Method Article
Cicatrización de heridas de abrasión epitelial corneal con rebabas Ocular como un modelo de córnea
En este artículo
Resumen
Este protocolo describe un método para causar una abrasión en la superficie ocular del ratón y seguir la herida en proceso de curación después de eso. El protocolo aprovecha de una ocular rebabas a eliminar parcialmente el epitelio de superficie del ojo en ratones anestesiados.
Resumen
La córnea murina ofrece un excelente modelo para estudiar la cicatrización de heridas. La córnea es la capa más externa del ojo y es la primera defensa a la lesión. De hecho, el tipo más común de lesión de ojo encontrado en clínica es una abrasión corneal. Aquí, utilizamos un ocular burr para inducir una abrasión, resultando en la eliminación del epitelio corneal en vivo sobre ratones anestesiados. Este método permite la interrupción epitelial específica y reproducible, dejando otras áreas intactas. Además, describimos la visualización del epitelio erosionada con tinción de fluoresceína y proporcionar consejos concretos sobre cómo visualizar la córnea erosionada. Luego, seguimos la línea de tiempo de cicatrización 0, 18 y 72 h después de la abrasión, hasta que la herida es re-epithelialized. El modelo de abrasión epitelial de la lesión corneal es ideal para los estudios sobre proliferación de células epiteliales, la migración y la reepitelización de las capas corneales. Sin embargo, este método no es óptimo para estudiar la activación estroma durante la cicatrización de heridas, porque las rebabas del ocular no penetran a las capas de células estromales. Este método también es adecuado para aplicaciones clínicas, por ejemplo, pre-clínica prueba de eficacia de la droga.
Introducción
Las capas epiteliales de numerosos órganos están expuestas a lesiones. Sin embargo, también contienen la capacidad de compensar la pérdida de tejido por medio de la cicatrización de heridas. La córnea ofrece un excelente modelo para estudiar la cicatrización de heridas. Forma la superficie externa del ojo y proporciona una capa protectora para la delicada maquinaria ocular. Así, la córnea funciona como una barrera física frente a patógenos y la pérdida de agua. Se compone de tres capas; epitelio, estroma y endotelio. El epitelio de la córnea es la capa más externa de la córnea. Las células epiteliales mantienen la función barrera de la córnea adhiriéndose estrictamente entre sí mediante uniones estrechas1,2,3. Membrana córnea acelular de la basal, la membrana de Bowman, separa el epitelio del estroma extensa, que contiene keratocytes refractaria. En el estroma, las células endoteliales canal de nutrientes, agua y oxígeno a la capa superior.
Abrasiones corneales son muy comunes en la clínica4. Lesiones en la córnea son diversas, pero en gran parte son causadas por pequeñas partículas como polvo o arena, arañazos u otros objetos extraños. El protocolo aquí había descrito pretende reproducir un tipo clínico de abrasión epitelial corneal. De esta manera, este protocolo proporciona un método controlable y seminal para los médicos y científicos corneales aplicar en sus estudios. Hemos realizado un ensayo de reparación en vivo lesiones en la córnea murina por causar lesiones en el tejido con una fresa rasgunõs ocular, el Algerbrush II. Aquí apuntamos la abrasión sólo al epitelio corneal central y dejar las otras partes del órgano sin daño. Así, el protocolo es ideal para el estudio de la célula epitelial corneal dinámica o la membrana basal durante re-epithelialization, célula de la migración, proliferación y diferenciación en vivo5. Recientemente, este modelo se utilizó para analizar la dinámica de la célula progenitora en la córnea murina, así como para conocer la capacidad de las células epiteliales corneales diferenciadas en el restablecimiento del nicho de células madre corneales después de lesión6,7. Después de la abrasión, la córnea vuelve a su normal transparencia y resistencia a la tracción. Curiosamente, un estudio en vitro indicó que re-epithelialization ocurre sin creciente de la célula proliferación8. Este protocolo describe la línea de tiempo de curación sin interrupciones en la córnea de ratón. Así, el método es aplicable para probar el efecto de las drogas en patrones y la velocidad de cicatrización.
La córnea se ha utilizado extensivamente para estudios de heridas. Sin embargo, muchos estudios han dependido de otros modelos de la lesión. Un modelo bien establecido de lesión corneal es la quemadura alcalina que se realiza mediante la aplicación de hidróxido de sodio (NaOH) con o sin papel de filtro sobre la superficie corneal9. Exposición alcalina produce una lesión grande y difusa que no sólo afecta el epitelio corneal, sino también la conjuntiva y el tejido conectador9,10. Soluciones alcalinas fuertes han demostrado inducir neovascularización9, opacificación y úlceras corneales. Las células inflamatorias invaden el estroma normalmente dentro de las 6 h y permanecen allí hasta las 24 h11. Por lo tanto, alcalino es un método recomendable en estudios relacionados con la activación stromal. Otro tipo de daño químico puede ser infligida por aplicar dimetilsulfóxido (DMSO) en la córnea9,10. Otros modelos de lesiones comúnmente usados incluyen heridas incisionales que penetran a través de las heridas de tejido conectador y keratectomy, que se limitan a la parte superior del tejido conectador14,15. Estos métodos también son útiles para responder a preguntas sobre cicatrización estromal. Lesiones diferentes modelos tienen sus ventajas y desventajas. Abrasión o desbridamiento, del epitelio corneal se desarrolló inicialmente utilizando bisturís rasgunõs o cuchillas en vivo ex córneas16. Este método ha sido más tarde usado en vivo en el ratón, rata y conejo17,18,19,20,21,22. Con las rebabas del ocular (figura 1), quitamos sólo una región seleccionada del epitelio, dejando el resto del epitelio afectado. Esta manera, es posible orientar precisamente la supresión epitelial a diferentes partes de la córnea. Además, el tamaño de la abrasión puede ser evaluado con la tinción de fluoresceína. Además, aquí seguimos cierre de abrasión durante el período de cicatrización.
Este método presenta varias ventajas, i) incluyendo la localización exacta del sitio de la abrasión, que no es posible con lesión química, ii) la abrasión es rápida de realizar, y iii) es no invasivo. Adjunto, describimos el método utilizando el ratón NMRI exogámica como modelo, sin embargo esto podría aplicarse a la amplia gama de modelos genéticos del ratón, así como a la rata y el conejo, que son modelos comunes utilizados para estudiar la interrupción córnea humana.
Protocolo
Todos los experimentos son aprobados por la Junta Nacional experimento animal.
1. preparaciones
- Preparar todas las soluciones y guardar en temperatura ambiente, salvo indicación en contrario. Siga las regulaciones de eliminación de residuos a disponer utilizada materiales y soluciones.
- Uso NMRI y ICR marginado las existencias, entre 4-12 semanas de edad y sexo. Si se utiliza la cepa C57BL/6, siga el método de preparación de ketamina-medetomidina en paso 1.3.2. Para otras medidas, siga las instrucciones descritas en 1.3.3.-1.3.5.
- Preparar la medicina veterinaria fresco y a tiempo antes de iniciar la operación. Carprofeno se utilizará más adelante, así no es necesario preparar en este momento.
- 0,375 mL de la mezcla para preparar una solución de medetomidina ketamina para la anestesia, (stock concentración 50 mg/mL) de ketamina (Ketaminol veterinario) con 0.25 mL (concentración de la madre 1 mg/mL) de medetomidina (Cepetor veterinario) y añadir 1,25 mL de estéril 0,9% NaCl. Administrar 0.15 mL/20 g de peso del ratón (7.5 mg/kg y 1 mg/kg, medetomidina y ketamina).
- 0,375 mL de la mezcla para preparar una solución más diluida de medetomidina ketamina para la anestesia en ratones C57BL/6, (stock concentración 50 mg/mL) de ketamina con 0.25 mL (concentración de la madre 1 mg/mL) de medetomidina y añadir 2,5 mL de estéril 0,9% NaCl. Administrar 0.15 mL/20 g de peso del ratón (3.75 mg/kg y 0,5 mg/kg de medetomidina y ketamina).
Nota: Este es un paso alternativo, sólo para adultos ratones C57BL/6. - Para preparar buprenorfin analgesia, Añadir 0,1 mL (concentración madre 0,3 mg/mL) de buprenorfin a 1,9 mL de estéril 0,9% NaCl. Administrar 0,2 mL/20 g de peso del ratón (0,15 mg/kg).
- Para preparar atipamezole para descontinuar la anestesia, Añadir 0,1 mL (archivo de concentración 5 mg/mL) de atipamezole a 4,9 mL de 0.9% NaCl. Administrar 0.15 mL/20 g de peso del ratón (0,75 mg/kg).
- Para la analgesia durante la postanestesia usar carprofeno. Añadir 0,1 mL (archivo de concentración 50 mg/mL) de carprofeno a 4,9 mL de 0.9% NaCl. Administrar 0.15 mL/20 g de peso del ratón (7.5 mg/kg).
- Preparar la solución de tinción fluorescente
- Para la visualización de la abrasión bajo la luz azul cobalto (figura 1), utilice una solución fluorescente. Preparar una solución de fluoresceína 0.1% primera medición 10 mg de sal de fluoresceína con una escala fina y luego agregar a 10 mL en solución salina tamponada con fosfato (PBS).
- Proteger la solución de fluoresceína de la luz y agitar durante 5 minutos en un agitador.
Nota: La solución de fluoresceína es sensible a la luz; mantener la solución de cubierta de la luz. Esta solución se puede conservar de + 4 ° C durante 2-3 días. Para el uso, es útil para la solución de fluoresceína en un gotero que se usa para las gotas. Utilice un filtro estéril al pasar la solución a la botella del cuentagotas.
- Limpie la punta de fresa ocular antes y después de su uso; primero con el PBS y luego con el 70% EtOH. Si hace una abrasión a varios ratones durante la misma operación, siga los pasos de limpieza entre cada ratón.
- Poner la placa calentada en el (+ 37 ° C) y coloque una toalla de papel en él.
2. corneal abrasión
PRECAUCIÓN: Use ropa protectora (bata, guantes) cuando manejo de ratones. Pesar el ratón para calcular el volumen del medicamento a administrar.
- Utilice el método de scruffing una mano para manejar el ratón23. Administrar la mezcla de ketamina-medetomidina por vía intraperitoneal (i.p.) a la izquierda parte inferior del abdomen. Coloque el ratón en una jaula individual y esperar a dormirse. Esto normalmente toma menos de 5 minutos. Entonces, administrar buprenorfin primero y luego atipamezole mediante inyecciones i.p.. Utilice la misma técnica de manipulación.
Nota: Una vez que se da la anestesia, el protocolo debe no ser pausado en cualquier momento. - Antes de continuar, compruebe que la placa caliente es caliente. Coloque el ratón anestesiado en la placa de calefacción. El nivel de la anestesia es buena si está ausente el reflejo de la cola, pero el reflejo del dedo del pie está presente. Comprobar estos reflejos pellizcando la cola y cualquier dedo del pie con los dedos o pinzas. No use fuerza excesiva. Anestesia será durante 20-25 minutos.
- Para crear una abrasión, use las rebabas ocular limpia. Gire la base de las rebabas para activar la vibración que es imprescindible hacer la abrasión. Sentir la vibración en la mano, cuando la fresa está funcionando correctamente.
- Abrir un ojo a la vez manteniendo los párpados por separado con los dedos. Entonces firmemente tocar las rebabas a la córnea y mover el instrumento hacia adelante y hacia atrás así como hacia los lados en la superficie ocular. La vibración de la fresa realiza el cero; no presione, agitar o rasgar la córnea. En la córnea central, 20 movimientos en la superficie de abrasión son suficientes para inducir la herida. No levante las rebabas y tratar de permanecer en la región de la córnea para ser desgastado. Adquirir una abrasión de tamaño estándar se requieren varias rondas de práctica.
Nota: Se logra antes de abrasión Corneal asepsia utilizando betadine solución oftálmica.
3. la proyección de imagen la abrasión
- Se ilumina la región erosionada utilizando fluoresceína solución y luz de pluma azul cobalto (figura 1). La superficie ocular aparece descolorida en la luz ambiental. Después de la aplicación de fluoresceína, la región erosionada aparece en verde cuando se ilumina el ojo con el lápiz de luz.
- Si es necesario, abra los ojos desgastados semejantemente como en 2.3 y administrar una gota de solución de fluoresceína desde el frasco cuentagotas. Lave el ojo una vez con PBS o 0.9% NaCl para reducir el fondo de la fluoresceína. Use un gotero o una pipeta para el lavado. Aspirar el líquido, con una toallita suave y limpia las pestañas, si es necesario. El exceso de líquido se recoge generalmente la frontera nasal del ojo, cerca de la abertura del canal lagrimal.
PRECAUCIÓN: Evite tocar la córnea al suplemento como abrasiones menores podrían ser inducidas.
- Si es necesario, abra los ojos desgastados semejantemente como en 2.3 y administrar una gota de solución de fluoresceína desde el frasco cuentagotas. Lave el ojo una vez con PBS o 0.9% NaCl para reducir el fondo de la fluoresceína. Use un gotero o una pipeta para el lavado. Aspirar el líquido, con una toallita suave y limpia las pestañas, si es necesario. El exceso de líquido se recoge generalmente la frontera nasal del ojo, cerca de la abertura del canal lagrimal.
- Tome fotos de la abrasión corneal.
- Para obtener imágenes similares durante cada sesión de imagen, herramientas accesorio constante para la luz de la pluma azul cobalto y la cámara (figura 2). Este protocolo proporciona una instalación fácil de repetir (figura 2).
- Para colocar la luz de la pluma y la cámara, utilice una lámpara de mesa con un brazo flexible y abrazadera y un brazo de cámara ajustable con una pinza, respectivamente. Atadura de cables el lápiz a la lámpara de mesa y la posición justo por encima de los ojos de ratón. Posicionamiento diferente la luz puede alterar la visualización de la abrasión. Una sugerencia para el posicionamiento de estas herramientas se describe en la figura 2.
- Utilice la cámara SLR para tomar fotografías del ojo. Coloque el animal en una distancia deseada y la posición y el enfoque la cámara (1:12) en la luz de la habitación. Después de eso, cerca de todas las luces excepto la luz de la pluma azul cobalto.
Nota: La manija ligera de pluma de la cinta hacia abajo o utilizar una banda elástica para mantener la luz en todo el tiempo durante la proyección de imagen. Esto podría ayudar si la imagen se vuelve borrosa. Es más fácil llevar a cabo la etapa de proyección de imagen con un colega.
- Para obtener imágenes similares durante cada sesión de imagen, herramientas accesorio constante para la luz de la pluma azul cobalto y la cámara (figura 2). Este protocolo proporciona una instalación fácil de repetir (figura 2).
4. despertar después de abrasión Corneal
- Administrar buprenorfin primero y luego atipamezole mediante inyecciones i.p.. Utilice la misma técnica de manipulación como en 2.1.
- Coloque una gota de ungüento de ojo ácido antibacteriano, fucidin (Isathal) a los ojos desgastados y no desgastado para hidratar y mantener la superficie ocular limpio de bacterias después de la anestesia.
- Como el ratón se despertará en 5-20 minutos en la placa de calefacción, observar el ratón durante el período de reactivación Post-anestésico. Cuando se convierte en móvil, coloque en una jaula individual.
Nota: Si despertar lleva más tiempo, coloque el ratón en la jaula con una almohadilla caliente o colocar la jaula entera en el plato caliente y supervisar regularmente el ratón. Mientras que la anestesia desaparece, el ratón típicamente sacude y llega hacia arriba con el cuerpo anterior. Este comportamiento debe volver a la normalidad en 3-4 horas y luego se puede colocar el ratón a una jaula compartida. - Administrar carprofen i.p. para el ungüento de analgesia y el ojo en dos días consecutivos después de la abrasión, semejantemente como en los pasos 2.2. y 4.2.
5. la proyección de imagen durante la cicatrización de heridas
- En este protocolo, tiempo de uso puntos 18 h y 72 h después de la abrasión para observar el cierre de la herida.
- Imagen consecutiva, anestesiar los ratones como explicado en 2.2.
- Tomar fotografías como se explica en 3.
- Despertar de los animales con atipamezole i.p. y supervisar del periodo como se explica en 4.3.
Nota: Si no continuar con el seguimiento, eutanasia el ratón después de 5.1.2. Eutanasia se describe en 6.1.
6. córnea colección e inclusión en parafina
- Después del último punto de tiempo, sacrificar el animal. Coloque el ratón en una cámara que puede estar llena de CO2. Llenan el aire de la cámara de CO2. Cuando el animal está inmóvil, dislocarse las vértebras cervicales tirando firmemente de la base de la cola y presionando la región del cuello al mismo tiempo.
PRECAUCIÓN: Siempre seguir las directrices del cuerpo de protección de los animales locales. - Recoger el globo ocular entero cortando una abertura en la piel al lado del ojo con las tijeras de disección. Colocar las tijeras en el globo ocular y cortar el nervio ocular para el globo ocular fuera de la órbita. Usar pinzas si el ojo no sale fácilmente.
- Hacer un agujero en la parte posterior del ojo, del lado de retina, con una aguja de 26G para permitir la libre penetración de soluciones dentro del ojo.
Nota: No deje que el ojo se convierten en seco, en cambio, colocar en PBS hasta continuar con el protocolo.
- Hacer un agujero en la parte posterior del ojo, del lado de retina, con una aguja de 26G para permitir la libre penetración de soluciones dentro del ojo.
- Recoger el globo ocular en un tubo de 2 mL con PBS. No hacer una pausa en el experimento en este momento.
- Quite la PBS y globos oculares en paraformaldehído al 4% (PFA) de + 4 ° C durante 4-5 horas.
- Mover el globo ocular fijo a una cinta de tejido para el proceso de tejido. Utilice un pañuelo de procesamiento de la máquina y el siguiente programa:
- Lavar con PBS.
- Incubar 2 x 45 min en etanol al 70% a temperatura ambiente.
- Incubar h 2 x 1 en 94% de etanol a temperatura ambiente.
- Incubar 3 x 45 min en etanol absoluto a temperatura ambiente.
- Incubar 3 x 1 h en xileno, a temperatura ambiente y xileno pasado a 37 ° C.
- Incubar 3 x 1 h en parafina a 60 ° C.
- Después de proceso de tejido, incorporar el globo ocular en parafina líquida (+ 60 ° C) usando un bloque de inclusión de tejidos. Colocar el ojo dentro del bloque de modo que mira hacia los lados y el borde periférico es hacia arriba. Que el bloque de solidificar en un plato fresco de 5 a 10 minutos.
7. parafina secciones de la córnea
- Preparar el microtomo para el seccionamiento según instrucciones de la institución o del fabricante.
PRECAUCIÓN: Tenga cuidado al manipular la cuchilla de micrótomo sharp. - Lugar un baño María con agua ultrapura a temperatura ambiente al lado del microtomo y otro con agua ultrapura calientan a 50 ° C.
- Hacer secciones de 5 μm espesor del globo ocular.
Nota: La lente se rompe fácilmente durante el seccionamiento. Para evitar esto, limpie la superficie con un paño húmedo cada vez que se inicia una nueva fila de secciones de corte. Utilizar agua para humedecer el tejido. - Ponga las secciones al lado de uno al otro en el baño de agua temperatura ambiente y luego moverlos a la bañera de agua caliente con la ayuda de un portaobjetos de vidrio. Se extienden las secciones en el baño de agua caliente hasta relajación todas las arrugas y el mate de las secciones se convierten.
- Secar los portaobjetos de vidrio con secciones durante la noche a + 37 ° C.
- Coloque las secciones de las diapositivas manteniendo el portaobjetos durante 1 minuto en un plato caliente en + 60 ° C. Después de esto, las secciones pueden ser directamente procesadas para la coloración de immunohistological métodos o almacenadas a + 4 ° C.
Resultados
Este protocolo describe un modelo para infligir una lesión de abrasión en la córnea de ratón y sugiere cómo seguir y visualizar el proceso de curación después de la abrasión. Recientemente, se empleó este método para estudiar el papel de células progenitoras epiteliales corneales durante6de cicatrización. El uso de herramientas establecidas es la clave para un experimento exitoso de la abrasión. Nosotros y otros, hemos utilizado las rebabas ocular Algerbrush II (figura 1) para realizar las abrasiones6,7,24. Esta herramienta tiene una punta rasgunõs rebabas de 0,5 mm de tamaño que cepillos en lugar de taladros o tijeras el epitelio corneal ausente. Así, esta herramienta es la opción recomendada para una lesión de abrasión en la córnea.
Una parte central de este modelo es que la región afectada puede visualizarse sin esfuerzo en los intervalos deseados. En la Figura 3A, se presenta el uso de fluoresceína tinción en combinación con una fuente de luz azul cobalto (figura 1) para visualizar el sitio de abrasión. En este experimento, se realizó una gran herida en la córnea central y dejó la córnea periférica intacta (Figura 3A). Además, había desgastado sólo el ojo izquierdo de cada ratón y mantienen el ojo derecho, bilateral como un control no desgastado. Las muestras oculares bilaterales seguían siendo negativas para señal de fluoresceína, que sugiere que no se someten a cualquier pérdida de la célula durante el experimento y así la función así como muestras de control. Sin embargo, la señal verde en los bordes del ojo muestra la solución de fluoresceína que acumuló en la ensambladura entre el ojo y el párpado. La abrasión es mayor a 0 h, inmediatamente después de la lesión (Figura 3A). Era notablemente más pequeño después de 18 h y, en este caso, se encuentra cerca de la frontera superior del ojo. Sin embargo, el epitelio cierra la región expuesta a una velocidad igual de todos lados de la abrasión. En particular, en 72 h, las heridas, no hay señal verde era visible. Esto indica que el epitelio corneal fue completamente re-epithelialized por 72 h después de la abrasión.
Con este método, nos encaminadas a centrarse la abrasión solamente en el epitelio corneal, por lo que las capas más profundas de la córnea intacta. La eliminación del epitelio corneal era evidente de secciones histológicas en la figura 3B. A las 0 h, el borde de la abrasión se muestra como una repisa estrecha, acelular que es continua de forma regular, epitelio corneal gruesas capas de la célula 4-5. Limbus, borde periférico del epitelio corneal, presenta una región de ejemplo que no fue afectada por la abrasión en la línea de tiempo experimental todo (72 h). Además, las secciones histológicas indican que las capas más profundas de la córnea, el estroma y el endotelio, no fueron perjudicados por las rebabas del ocular. Estos dos tejidos parecían similares en muestras de ojos desgastados y bilateral. En poste-lesión de 18 h, el proceso de curación es activo y re-epithelialization está llevando a cabo. Esto fue sugerido por la aparición de una vanguardia. La vanguardia contiene sólo 1-2 capas de células epiteliales y abarca la región expuesta antes de que la estratificación puede ocurrir25. En consonancia con los resultados en la Figura 3A, la superficie fue completamente re-epithelialized por 72 h, cuando los frentes migratorios habían cubierto la herida y una vez más estuvieron presentes todas las capas epiteliales. Las secciones histológicas del ojo bilateral confirman (Figura 3A) que los ojos de control permanecieron intactos durante el período de observación.
Por último, proporcionamos evidencia que el modelo de abrasión se limita al epitelio corneal y no invocar una respuesta estromal a lesiones, tales como neovascularization. La figura 4 muestra la córnea murina a las 18 h después de la abrasión. Basado en la visión macroscópica, este momento no se mostraban una respuesta estromal, lo que indica que nuestro protocolo no interrumpa las capas más profundas de la córneas. En comparación, una lesión alcalina con 0,75 mol/L NaOH inmediatamente inducida por neovascularización en el estroma. Dada la neovascularización rápida en lesiones alcalino, los puntos del tiempo en nuestro método de proporcionan pruebas para descartar la posibilidad de respuesta en el tejido conectador.

Figura 1: herramientas esenciales para abrasión epitelial corneal. La izquierda es una vibrante rebabas ocular. La luz de la pluma azul cobalto en la derecha se utiliza para la tinción con fluoresceína visible. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: imagen de la abrasión corneal. (A) herramientas para la proyección de imagen son un brazo de cámara ajustable con abrazadera (izquierda), la cámara SLR (centro) y una lámpara de mesa con brazo flexible y abrazadera (derecha). La luz de la pluma azul cobalto está ligada a la cúpula de la lámpara con dos bridas. (B) una visión general de la configuración de imagen; la distancia de cada herramienta de Unión está marcada en la imagen en cm. Dos pinzas son 6 cm de la placa de calor y el ratón se coloca 10 cm de distancia del borde de la placa de calor. (C) un vistazo a la imagen de abrasión con propuesta distancia y posición en el ojo de ratón en cm. haga clic aquí para ver una versión más grande de esta figura.

Figura 3: detección y localización de la abrasión corneal. Ojos de ratón (A) en 0, 18 y 72 h después de la abrasión. Señal de fluoresceína marca la región erosionada en verde brillante, mientras que todas las demás regiones en el epitelio permanecen oscuras. Ojos bilaterales sirven como controles. Línea punteada marca los bordes de la herida y la mancha blanca en cada ojo, es el reflejo de la cámara. (B) histológico seccionadas y hematoxilina y eosina tinción muestras de los ojos de ratón en 0, 18 y 72 h después de la abrasión. Limbo es la frontera que rodea el epitelio corneal por todos los lados. Astérix marca el borde de la abrasión. Barra de escala es 100 μm. haga clic aquí para ver una versión más grande de esta figura.
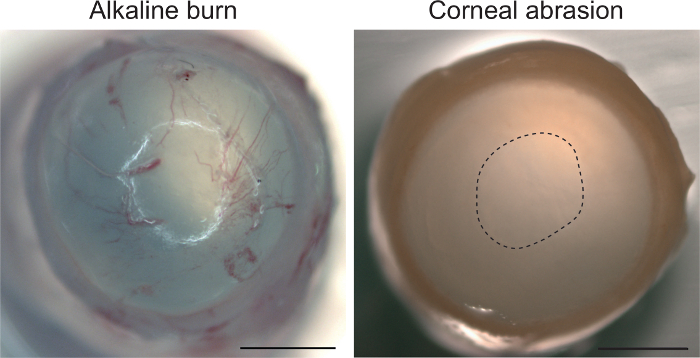
Figura 4: abrasión Corneal no activar una estroma respuesta. Exposición alcalina con 0,75 mol/L NaOH seguido de irrigación con 0.9% NaCl produce neovascularización de la córnea (ojo recogido inmediatamente después del tratamiento). Abrasión con las rebabas ocular no muestra neovascularización incluso después de 18 h. abrasión sitio es marcado con una línea discontinua. La escala de la barra 1 mm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hería los métodos son herramientas populares para estudiar diferentes aspectos de la homeostasis de la córnea y patologías. El modelo de abrasión ofrece un método bien-controlado para hacer frente a problemas relevantes en Oftalmología. Sin embargo, ciertos puntos críticos en el protocolo son destacar. En particular, los detalles descritos en relación con la medicina veterinaria, herida curativa línea de tiempo y resultado están optimizados para el uso con cepas NMRI y ICR exogámica, pero pueden variar entre cepas de ratones26. Con este protocolo, los animales experimentales permanece anestesiados durante aproximadamente 20 minutos. Esto da una ventana corta pero suficiente tiempo para llevar a cabo la abrasión. Sin embargo, al usar las rebabas del ocular, la abrasión del sí mismo es una operación muy rápida y debe ser posible realizar en este período de tiempo.
Fácil y accesible la visualización es una de las principales ventajas del modelo de abrasión. Combinado con métodos de biología molecular, esto abre posibilidades para el estudio de las células epiteliales con gran detalle. Córnea erosionada puede ser procesado histológico o inmunológicos tinción de y proteínas o ácidos nucleicos puede ser recogidos y examinados aún más. Pajoohesh-Ganji et al. demostró que el gen patrones de expresión en el cambio de células epiteliales corneales con insulto córnea con una cuchilla rasgunõs27. Para asegurar el muestreo controlado, le recomendamos que imágenes de las abrasiones se toman inmediatamente después de la operación y colecciones muestra siguen exactamente los plazos previstos.
Este protocolo tiene usos más allá de la examinación de epitelización corneal. Por ejemplo, la abrasión del limbus córneo, el nicho de células madre de la córnea, puede utilizarse para el estudio de la dinámica de la célula de vástago7. Demostró que la región no desgastado del epitelio seguían siendo normal durante el proceso de curación, sin embargo algunos autores afirman que la membrana del sótano y del subyacente keratocytes stromal se ven afectados por el ocular las rebabas24,28. La eliminación de la membrana basal se puede estimar con la tinción de la membrana basal específica. Además, repetidas abrasiones sobre una línea de tiempo más largo podrían revelar interesantes patrones curativos. En este protocolo, no observamos la arquitectura del epitelio sobre una persecución a largo plazo. Ambos desafilar bisturí y lesiones oculares burr han demostrado una mayor incidencia de erosiones corneales después de una a varias semanas después de lesión24,29,30. Esto debe tener en cuenta cuando se utiliza el modelo de abrasión para estudios a largo plazo. Sin embargo, estudios centrados en erosiones corneales pueden interesar este protocolo.
Otros modelos hiriente se describen largamente por Stepp et al. en revisión5. Juntos, este protocolo y los enfoques existentes ofrecen opciones versátiles para examinar tanto cuestiones biológicas fundamentales, así como problemas clínicos prácticos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Kaisa Ikkala por su invaluable asistencia técnica y ayuda perspicaz cuando actualizándose en este método, así como más tarde durante la aplicación a nuestras preguntas de investigación central. También queremos agradecer al centro de animales de laboratorio y Anna Meller por su ayuda con la planificación de las directrices de la labor veterinaria.
Materiales
| Name | Company | Catalog Number | Comments |
| NMRI mouse | Envigo | 275 | |
| 0.9% NaCl | use sterile | ||
| Medetomidine | Vetmedic | Vnr087896 | Market name: Cepetor Vet |
| Ketamine | Intervet | Vnr511485 | Market name: Ketaminol Vet |
| Buprenorfin | Invidior | 3015248 | Market name: Temgesic |
| Atipamezol | Orion Pharma | Vnr471953 | Market name: Antisedan Vet |
| Carprofen | Norbrook | Vnr027579 | Market name: Norocarp Vet |
| 1% fucidin acid eye ointment | Dechra | Vnr080899 | Market name: Isathal |
| Fluorescein salt | Sigma-Aldrich | F6377 | |
| Phosphate-buffered saline solution | PBS | ||
| Algerbrush ii ocular burr (0.5 mm tip) | Algerbrush | 6.39768E+11 | |
| Cobalt Blue pen light | SP Services | DE/003 | |
| Hot plate | Kunz Instruments | 2007-0217 | |
| Digital SLR camera | Nikon | D80 | |
| Adjustable camera arm and clamp | Neewer | 10086132 | Height 28 cm |
| Table lamp with a flexible arm and a clamp | Prisma | ||
| Soft wipe | KimtechScience | 7552 | |
| CO2 chamber | |||
| Dissection toolset | Fine Science Tools | ||
| Syringes | Beckton Dickinson | 303172 | |
| 26G needles | Beckton Dickinson | 303800 | |
| 2 mL Eppendorf tube | Sarstedt | 689 | |
| Tissue casette | Sakura Finetech | 4118F | |
| Tissue processing machine ASP200S | Leica | ||
| Xylene | VWR | UN1307 | |
| Paraffin wax | Millipore | K95523361 | |
| Tissue embedding mold 32 x 25 x 6 mm | Sakura Finetech | 4123 | |
| Microtome | Microm | HM355 | |
| Water bath for sectioning | Orthex | 60591 | |
| Water bath for sectioning | Leica | HI1210 | |
| Microtome blade | Feather | S35 | |
| Glass slide | Th.Geyer GmbH & Co. | 7,695,019 | |
| Ultrapure water | Millipore | MPGP04001 | MilliQ |
| Paraformaldehyde | Sigma-Aldrich | 158127 | PFA |
Referencias
- Yi, X., Wang, Y., Yu, F. S. Corneal epithelial tight junctions and their response to lipopolysaccharide challenge. Investigative Ophthalmology & Visual Science. 41 (13), 4093-4100 (2000).
- Wang, Y., Chen, M., Wolosin, J. M. ZO-1 In Corneal Epithelium; Stratal Distribution and Synthesis Induction by Outer Cell Removal. Experimental Eye Research. 57 (3), 283-292 (1993).
- Sugrue, S. P., Zieske, J. D. ZO1 in Corneal Epithelium: Association to the Zonula Occludens and Adherens Junctions. Experimental Eye Research. 64 (1), 11-20 (1997).
- Jackson, H. Effect of eye-pads on healing of simple corneal abrasions. British Medical Journal. 2 (5200), 713 (1960).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Kalha, S., Shrestha, B., Sanz Navarro, M., Jones, K. B., Klein, O. D., Michon, F. Bmi1+ Progenitor Cell Dynamics in Murine Cornea During Homeostasis and Wound Healing. Stem Cells. , (2018).
- Nasser, W., et al. Corneal-Committed Cells Restore the Stem Cell Pool and Tissue Boundary following Injury. Cell Reports. 22 (2), 323-331 (2018).
- Kaplan, N., Fatima, A., Peng, H., Bryar, P. J., Lavker, R. M., Getsios, S. EphA2/Ephrin-A1 Signaling Complexes Restrict Corneal Epithelial Cell Migration. Investigative Ophthalmology & Visual Science. 53 (2), 936 (2012).
- Bai, J. -. Q., Qin, H. -. F., Zhao, S. -. H. Research on mouse model of grade II corneal alkali burn. International Journal of Ophthalmology. 9 (4), 487-490 (2016).
- Chan, M. F., et al. Protective effects of matrix metalloproteinase-12 following corneal injury. Journal of Cell Science. 126, 3948-3960 (2013).
- Byeseda, S. E., Burns, A. R., Dieffenbaugher, S., Rumbaut, R. E., Smith, C. W., Li, Z. ICAM-1 is necessary for epithelial recruitment of gammadelta T cells and efficient corneal wound healing. American Journal of Pathology. 175 (2), 571-579 (2009).
- Amitai-Lange, A., et al. A Method for Lineage Tracing of Corneal Cells Using Multi-color Fluorescent Reporter Mice. Journal of Visualized Experiments. (106), e53370 (2015).
- Amitai-Lange, A., Altshuler, A., Bubley, J., Dbayat, N., Tiosano, B., Shalom-Feuerstein, R. Lineage Tracing of Stem and Progenitor Cells of the Murine Corneal Epithelium. Stem Cells. 33 (1), 230-239 (2015).
- Blanco-Mezquita, J. T., Hutcheon, A. E. K., Stepp, M. A., Zieske, J. D. αVβ6 Integrin Promotes Corneal Wound Healing. Investigative Ophthalmology & Visual Science. 52 (11), 8505 (2011).
- Blanco-Mezquita, J. T., Hutcheon, A. E. K., Zieske, J. D. Role of Thrombospondin-1 in Repair of Penetrating Corneal Wounds. Investigative Ophthalmology & Visual Science. 54 (9), 6262 (2013).
- Gipson, I. K., Kiorpes, T. C. Epithelial sheet movement: Protein and glycoprotein synthesis. Developmental Biology. 92 (1), 259-262 (1982).
- Danjo, Y., Gipson, I. K. Actin "purse string" filaments are anchored by E-cadherin-mediated adherens junctions at the leading edge of the epithelial wound, providing coordinated cell movement. Journal of Cell Science. 111, 3323-3332 (1998).
- Lyu, J., Joo, C. -. K. Wnt-7a up-regulates matrix metalloproteinase-12 expression and promotes cell proliferation in corneal epithelial cells during wound healing. Journal of Biological Chemistry. 280 (22), 21653-21660 (2005).
- Nagata, M., Nakamura, T., Hata, Y., Yamaguchi, S., Kaku, T., Kinoshita, S. JBP485 promotes corneal epithelial wound healing. Science Reports. 5, 14776 (2015).
- Stepp, M. A., Zhu, L., Cranfill, R. Changes in beta 4 integrin expression and localization in vivo in response to corneal epithelial injury. Investigative Ophthalmology & Visual Science. 37 (8), 1593-1601 (1996).
- Stepp, M. A., Zhu, L. Upregulation of alpha 9 integrin and tenascin during epithelial regeneration after debridement in the cornea. Journal of Histochemistry & Cytochemistry. 45 (2), 189-201 (1997).
- Pal-Ghosh, S., Tadvalkar, G., Jurjus, R. A., Zieske, J. D., Stepp, M. A. BALB/c and C57BL6 mouse strains vary in their ability to heal corneal epithelial debridement wounds. Experimental Eye Research. 87 (5), 478-486 (2008).
- . Lab Animal Research. Rodent Handling and Restraint Techniques Available from: https://www-jove-com.remotexs.ntu.edu.sg/science-education/10221/rodent-handling-and-restraint-techniques (2018)
- Pal-Ghosh, S., Pajoohesh-Ganji, A., Tadvalkar, G., Stepp, M. A. Removal of the basement membrane enhances corneal wound healing. Experimental Eye Research. 93 (6), 927-936 (2011).
- Suzuki, K. Cell-matrix and cell-cell interactions during corneal epithelial wound healing. Progress in Retinal and Eye Research. 22 (2), 113-133 (2003).
- Sato, Y., Seo, N., Kobayashi, E. Genetic background differences between FVB and C57BL/6 mice affect hypnotic susceptibility to pentobarbital, ketamine and nitrous oxide, but not isoflurane. Acta Anaesthesiologica Scandinavica. 50 (5), 553-556 (2006).
- Pajoohesh-Ganji, A., Pal-Ghosh, S., Tadvalkar, G., Stepp, M. A. K14 + Compound niches are present on the mouse cornea early after birth and expand after debridement wounds. Developmental Dynamics. 245 (2), 132-143 (2016).
- Boote, C., et al. Quantitative Assessment of Ultrastructure and Light Scatter in Mouse Corneal Debridement Wounds. Investigative Ophthalmology & Visual Science. 53 (6), 2786 (2012).
- Pal-Ghosh, S., et al. MMP9 cleavage of the β4 integrin ectodomain leads to recurrent epithelial erosions in mice. Journal of Cell Science. 124 (Pt 15), 2666-2675 (2011).
- Pal-Ghosh, S., Pajoohesh-Ganji, A., Brown, M., Stepp, M. A. A mouse model for the study of recurrent corneal epithelial erosions: alpha9beta1 integrin implicated in progression of the disease. Investigative Ophthalmology & Visual Science. 45 (6), 1775-1788 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados