Method Article
היישום של לייזר מיקרו-הקרנה בחינת יחיד ותיקון כפול Strand Break בתאים בתרבית
In This Article
Summary
קרינה פלואורסצנטית קונאפוקלית מיקרוסקופ לייזר מיקרו-הקרנה הצעה וכלים גרימת נזק לדנ א וניטור התגובה של חלבונים תיקון ה-DNA באזורים נבחרים גרעיני תת. טכניקה זו התקדמה באופן משמעותי את הידע שלנו של גילוי הנזק, איתות, גיוס. כתב יד זה מדגים הטכנולוגיות הללו לבחון סטרנד ליחיד מעבר לתיקון.
Abstract
מאוד מתואמת שמסלולי התיקון ה-DNA קיימים לזהות, בלו להחליף פגום DNA בסיסים ושל לתאם תיקון של מעברי גדיל ה-DNA. בעוד שיטות בביולוגיה מולקולרית הבהירו מבנה אנזימטי פונקציות, קינטיקה של תיקון חלבונים, יש עדיין צורך להבין כיצד תיקון הוא מתואם בתוך הגרעין. לייזר מיקרו-הקרנה מציע כלי רב עוצמה עבור גרימת נזק לדנ א וניטור הגיוס של תיקון חלבונים. אינדוקציה של ה-DNA נזק על ידי לייזר מיקרו-הקרנה יכולה להתרחש במגוון של אורכי גל, משתמשים יכול לגרום באופן אמין מעברי לחוט אחד, נגעים הבסיס כפול סטרנד מעברי עם מגוון של מנות. כאן, לייזר מיקרו-הקרנה משמש כדי לבדוק התיקון של יחיד, כפול סטרנד מעברי המושרה על ידי אורכי גל לייזר קונפוקלי נפוצים שני, 355 nm ו 405 ננומטר. אפיון נוסף, כמו שצריך המינון לייזר שימושית עבור גרימת נזק ספציפי תערובות מתואר, כך משתמשים יכולים לבצע reproducibly לייזר מיקרו-הקרנה והקפאה וניתוח.
Introduction
מיקרוסקופ פלואורסצנטי התפתחה טכניקה חזקה כדי להמחיש אדריכלות הסלולר, לבדוק חלבון לוקליזציה לפקח על אינטראקציות חלבון-חלבון, חלבון-DNA. באמצעות מיקרוסקופ פלואורסצנטי ללמוד DNA נזק תגובות לאחר היישום של DNA הכללית פגיעה סוכנים, כגון אור אולטרה סגול (UV), קרינה מייננת, חמצון כימי או סוכנים החומר, ו/או chemotherapeutics סיפקה תובנה חדשה החניכה, איתות, גיוס של ה-DNA לתקן חלבונים לאתרים של ה-DNA נזק1,2. עם זאת, אלה הכללית ואסינכרוניות פגיעה אירועים המגבילים, אם מפורט מידע על צו גיוס, קינטיקה של העמותה או דיסוציאציה, קשרי הגומלין בין חלבונים תיקון ה-DNA מפתח מתבקשות. למרבה המזל, החידושים סריקת מיקרוסקופ קונפוקלי לייזר, זמינות רחבה יותר של גרימת נזק אורכי גל לייזר, ושיפורים בחלבונים פלורסנט ב 25 השנים האחרונות סיפקו לחוקרים בכלים משופרים לבחינת אלה היבטים של ה-DNA תיקון, דרך אינדוקציה נזק ממוקד של DNA.
הקרנה של תאים עם לייזר microbeams ללימוד סלולרית ו- subcellular הוא כלי ומבוססת ביולוגיה של התא והקרנות -3. היישום של טכניקה זו לחקר DNA לתקן בקע כאשר קרמר ועמיתים אולטרה מאוד ממוקד (257 ננומטר) לייזר מערכת microbeam לגרום נזק לדנ א מעל במקום שחלה אוגר סיני (CHO) 0.5 מיקרומטר תאים4 והקימו את אינדוקציה של Photolesions ה-DNA על ידי זה מערכת5. בעוד מציע שיפורים משמעותיים על פני שיטות microbeam UV בזמנו, אימוץ זה גרימת נזק למערכת הייתה מוגבלת בשל הגדר המקצועית שלו, ואת יכולתו ליצור גדיל כפול מעברי (DSBs)6. בהמשך החקירה מגוון רחב של UV-B (290-320 ננומטר) ו UV-אורכי גל (320-400 ננומטר) על ידי מספר קבוצות חשף כי photoproducts UV, חמצוני לבסס נגעים, לחוט אחד שובר (SSBs), DSBs יכולים להיגרם תלויים אורך הגל של הלייזר ו כוח להחיל4,7,8,9,10 (נבדקה ב 3). יתר על כן, שילובים של אלה UV-B, אורכי גל של קרינת UV-A עם sensitizing סוכנים, כמו פסוראלן, bromodeoxyuridine (BrdU), צבעי Hoechst, נמצאו גם כדי לגרום נזק לדנ א תלויה באורך הגל, כוח ומשך החשיפה, למרות הכוח הדרוש כדי לגרום נזק לעיתים קרובות נפגמת בנוכחות סוכנים11,12,13,14,15. הפיתוחים האלה הרחיבה את השימוש מיקרו-הקרנה, למרות שלא היו מכשולים טכניים עדיין יש לטפל עבור אימוץ נרחב יותר של שיטות אלה.
קרמר ועמיתים לעבודה משמעותית מתקדמות בתחום מיקרו-הקרנה על ידי התמקדות בדיוק את microbeam UV כדי להחיל אנרגיה נזק משמעותי על פני שטח מאוד המותאמות לשפות אחרות בתא. כמו מיקרוסקופ קונפוקלי ומערכות microdissection לייזר מתקדם, אור ממוקד בחוזקה היה להפכה נגיש; עם זאת, צימוד מקורות UV כדי טווחי והתמודדות עם סטיות כרומטי שהם המושרה עדיין הציג אתגרים משמעותיים רוב המשתמשים3,6,16. כמו צבעי לכה UV גדל הפופולריות במהלך שנות ה-90, אופטיקה מסוגל להתמקד פלורסצנטיות UV-נלהב לכידת הפך זמין נרחב יותר16ואת שיפורים סריקת לייזר מוצעים למשתמשים היכולת ליצור מאוד ממוקד UV עירור כתמים בתוך תאים6,17. עם זאת, זה לא היה עד בתחילת שנות האלפיים כי ההשפעה האמיתית של שילוב זה של קורות ממוקד באופן הדוק עם לייזר בעוצמה גבוהה יותר הורגשה, כאשר דיווחים רבים יצאו להפגין מעברי גדיל DNA יכולים להיגרם עם ובלי לרגישות ב קרינת UV-A טווח6,10,18,19,20, 405 ננומטר21,22,23,24, 25,26, ו אפילו באורכי גל כבר גלוי כמו 488 ננומטר27. הפיתוחים האלה המותר עבור אימוץ נרחב יותר של טכניקת מיקרו-הקרנה על מספר מערכות מסחריות. במקביל, עם התפתחויות אלה, טכניקות שני הפוטונים גם בקע שמותר אינדוקציה מדויק של נזק לדנ א; למרות הפיתוחים האלה לא יידונו כאן, ישנם מספר מאמרים סקירה דנים אלה מתודולוגיות9,28,29,30.
עם הנגישות הנוכחי של מיקרוסקופ קונפוקלי מסוגל לספק אור UV מאוד ממוקד וזמינות פרושות לרווחה של חלבונים פלורסנט כדי לאפשר מעקב בזמן אמת אחר חלבונים תיקון ה-DNA, התפתחו טכניקות מיקרו-הקרנה כלים רבי-עוצמה לבחינת ה-DNA נזק התגובה ותיקון מסלולים. עם זאת, משתמשים צריכים להיות מודעים כי הדור של נזק לדנ א תלויה מאוד את אורך הגל של הלייזר ואת הכוח חלה על אזור תת גרעינית. השימוש UV-C (~ 260 ננומטר) אורכי הגל אפשר עירור DNA ישיר של סלקטיביות גבוהה עבור אינדוקציה של UV-photoproducts-7,-8. UV-B ו- UV-A אורכי גל לייצר תערובות של נזק לדנ א (בסיס הנגע, SSBs ו DSBs), התלוי על הכוח יישומית ואת הרקע הסלולר מנוצל7. Photosensitizers אנדוגני ורמות החמצון בתאים יישוב יכול להשפיע על תערובות נזק DNA המיוצר על ידי אורכי גל אלה. בנוסף, השימוש photosensitizers אקסוגני (BrdU, וכו ') עשוי לסייע בהורדת את האנרגיה הדרושה של אינדוקציה של נזק לדנ א. עם זאת, הסוכנים האלה יכול לגרום נזק לדנ א בכוחות עצמם, הם עשוי לשנות את מחזור התא ואת הכרומטין, אז השימוש שלהם עשויה לייצר תופעות לוואי צריך להיחשב על ידי המשתמש. לכן, לפני השימוש מיקרו-הקרנה ללמוד DNA נזק התגובה ותיקון, שיקול דעת זהיר של הנתיב תיקון ה-DNA של הריבית, זמינים לשימוש אורכי הגל התערובת נזק DNA נוצר נדרש.
כאן, לייזר מיקרו-הקרנה מבוצעת באורכי גל שני נפוץ, 355 nm ו 405 ננומטר, בלי לרגישות להפגין את תערובות של נזק לדנ א המושרה על ידי אורכי גל אלה ואת ההשפעות האלה תערובות נזק יש על בחינת התיקוןSSBs, DSBs. משתמשים צריכים להיות מודעים לכך אורכי גל אלה אינם יוצרים זן אחד של מעברי חוט או נגעים הבסיס. כדי להפלות בין ה-DNA שמסלולי התיקון, משתמשים חייבים לשלוט בכוח שהוחלו על אזור מסוים של הגרעין ובזהירות לאפיין את הנזק המושרה באמצעות מספר strand break סמני DNA הנגע נוגדנים. אם כראוי מוחל, מאופיין לייזר מיקרו-הקרנה יכול להעשיר מינים מסוימים של נזק לדנ א, מתן אפשרות למשתמשים להעריך את התיקון של נגעים הבסיס, SSBs או DSBs, עם קצת ירידה לפרטים. לכן, סיפקנו שיטה המאפשרת למשתמשים reproducibly לבצע מיקרו לייזר-הקרנה, לאפיין את תערובות DNA נזק הנגרם על ידי המינון לייזר יישומית, לבצע ניתוח נתונים.
Protocol
1. תרבית תאים ויצירת תאי יציב
- תאים לגדול צ'ו-K1 במדיום חיוני מינימלי, בתוספת 10% סרום שור בעובר. לשמור על תאים חממה humidified עם 5% CO 2-37 מעלות צלזיוס.
- Transfect צ'ו-K1 תאים עם µg 1 של ה-DNA פלסמיד המכיל XRCC1 האנושי עם C-מסוף ירוק תג חלבון פלואורסצנטי (GFP) באמצעות ריאגנט תקנים מסחרי בעקבות היצרן ' הוראות s.
- בחר צ'ו-K1 תאים stably לבטא את פיוז'ן XRCC1-GFP האנושי באמצעות 800 geneticin µg/mL, להעשיר את האוכלוסייה XRCC1-GFP לביטוי באמצעות קרינה פלואורסצנטית בסיוע מיון תא (FACS).
- צלחת התאים להיות מוקרן מיקרו בכלי תרבות עם תחתית coverglass, כך שהם מגיעים כ 75% או יותר confluency ביום שלמחרת. ישנם כמה מקומות בין תאים רצוי, במיוחד אם באמצעות רישום כדי לחזור באותו שדה תמונה (שמתואר בסעיף 3.2).
2. הגדרת מיקרוסקופ
- בחר סריקת לייזר מיקרוסקופ קונפוקלי מצויד מתאים, אופטיקה לייזרים תוכנת שליטה עבור מיקרו-הקרנה/photostimulation. הציג ניסויים שימוש בלייזר מיקרוסקופ קונפוקלי שהשתנה לכלול 355 ננומטר לייזר, מצמידים סיבים כדי miniscanner photoactivation גלוונומטר סורק ונשלט באמצעות היצרן ' s בקרה ותוכנה ניתוח. מערכת זו ניתן לבצע מיקרו-הקרנה באזור המיועד למשתמש עניין (ROI) באמצעות miniscanner את photoactivation (355 ננומטר לייזר) או גלוונומטר קונפוקלי הרגיל (405 ננומטר לייזר).
- בחר את אורך הגל שישמש עבור מיקרו-הקרנה, ולהבטיח כי כל הרכיבים אופטי ב- lightpath מיקרו-הקרנה מתאימים לכל אורך הגל שבחרת.
הערה: מערכת הציג משתמש מטרה טבילה שמן של C-עדשה אפוכרומטית (מפתח נומרי (NA) 1.2) 40 × יחד עם קוביה מסנן UV עבור מיקרו nm 355-הקרנה ויעד של 20 × C-עדשה אפוכרומטית (NA 0.75) יבש באמצעות את lightpath קונפוקלי הרגיל עבור מיקרו-הקרנה עם 405 ננומטר. המטרה × 20 המשמשים את ההתקנה אינה תואמת אורך הגל 355 ננומטר; ולכן השתמשנו את × 40 עבור 355 ננומטר בלבד. שימוש המטרה יבש פגיעה מאפשר immunofluorescence פרוטוקולים שתחול במורד הזרם ללא מנקה טבילה בשמן, ולכן אנו מנצלים את מטרה זו במידת האפשר. - להגדיר את המיקרוסקופ לניסוי. מיקרו-הקרנה. כדי לשמור על עקביות בין ניסויים, להגדיר תצורה סטנדרטית של הרכיבים מיקרוסקופ כדי לשמש עבור כל סוג של מיקרו-הקרנה. לשמור הגדרות אלה כקביעה בתוך המיקרוסקופ ' s הפעלת התוכנה, במידת האפשר.
הערה: במערכת שהוצגו, התאים הם מיקרו-מוקרן והגדר עם תמונה באמצעות סריקה חד כיווני, רזולוציית סריקה של 1024 x 1024 פיקסלים עם 1 x זום סריקה, בקצב מסגרת של 8 פריימים לשנייה (fps), ועם חריר כ 4 מאווררים יחידות (AU), כמו שנקבע 488 ננומטר לייזר (69 מיקרומטר). ההגדרה חריר פתוח נבחר על מנת למקסם את כמות האור בשבי לכל תמונה, ומאפשר שימוש הדמיה כוחות לייזר נמוך והפחתת photobleaching.
3. לייזר מיקרו-הקרנה
צלחת תרבות- מקום לכל צרה, המכיל תאים מעניינים, מיקרוסקופ הבמה ועל נעילת היטב למקומו.
- אם הוא זמין, למקם את השקופית תאיים חממה הבמה-העליון ולתחזק ב 37 ° C עם 5% CO 2 במהלך נזק אינדוקציה. שלב זה חשוב ביותר לחיות תאים timelapse הדמיה או זמן הדמיה הפעלות. אחרת במקום תאים במיקרוסקופ שלב ולבצע הקרנה בטמפרטורת החדר (~ הלעפה תרוטרפמט 25), ולאחר מכן להחזיר במהירות תאים כדי אינקובטור ב 37 ° C עם 5% CO 2.
- לרשום שדות תמונה כדי לאפשר החוקר לחזור לאותו מקום לאחר ביצוע קיבעון, מכתים או הליכים אחרים. לבצע רישום של שדות פגום באמצעות שלב מיקרוסקופ מקודד, אוטומטית או תא תרבות כלי coverglass עם רשת חרוט או תווית של מיקומים XY.
- , אם באמצעות רישום התוכנה תמונה, בחר תכונה לזיהוי של תרבות כלי השיט (קרי, הפינה של coverglass או מחסום בין וולס), לאסוף את התמונה ולהקליט את המיקום XY. זה יאפשר יישור והרשמה של המיקומים XY השדות הנבחרים, בעקבות הכנת הדוגמא.
- אם באמצעות רישום ידני, להקליט רשת או חרוט מיקומים עבור כל שדה באופן ידני, וישתדלו להקליט את הכיוון ואת המיקום של המנה על הבמה.
- אם אין תכונות זיהוי עבור כלי תרבות תא זמינות, לזהות שדות פגום על-ידי בדיקה ויזואלית של מורפולוגיה תאים וצפיפות. . שמור על עצמך כדי לבחור שדות עם תכונות שונות מספיק להיות ניתן לזיהוי במהלך הדימות מאוחר יותר.
הערה: זה יכול להיות זמן רב לבצע אלא אם כן הכיוון ואת אזור של כלי השיט תרבות היא מוגבלת בחוזקה.
- בחר שדה עבור מיקרו-הקרנה ולהתמקד המדגם. עבור תאים המבטאים חלבונים fluorescently שכותרתו, בחר את מטוס מוקד עם גרעיני חתך הרוחב המקסימלי בערוץ פלואורסצנט עניין. עבור תאים לא מבטא את תווית חלבונים, או עבור אלה ללא ברור גרעיני לוקליזציה, שלב חדות או התערבות דיפרנציאלית ניגודיות (DIC) הדמיה יכול לשמש כדי למצוא את המטוס מוקד הנכון.
הערה: תכונה שימושית של שלב ניגודיות והדמיה DIC היא העובדה כי המטוס מוקד עובר דרך הדגימה, התכונה זהה יכול להופיע בהיר או כהה בהתאם היחסי מטוס מוקד.- לבחור תכונה ברור בתוך הגרעין, כגון גרעינון, ולהעביר את מטוס מוקד למעלה ולמטה תוך התבוננות על השינוי במראה. המטוס האמיתי מוקד ישכב בתוך המעבר אור לחושך. כדי למקד את הדגימה, בחר את מטוס מוקד שבו התכונה שנבחרו יש הניגוד החד ביותר.
- לרשום את המיקום של השדה של ריבית. ליצור ריבוע 3 x 3 פיקסלים רועי בתוך התוכנה מיקרוסקופ, הצב הזה רועי על הגרעין של תא נזק והגדר את רועי להיות הנזק רועי.
- לאסוף תמונה נזק מראש, כולל המיקום של הנזק ROI.
- עבור ניסויים שאינם משתמשים חלבונים פלורסנט, לרכוש שלב-ניגודיות דיפרנציאלית הפרעות ניגודיות (DIC) brightfield תמונת או כדי לזהות ולהקליט גרעינים על הנזק.
- עבור לחיות תאים ניסויים באמצעות חלבונים פלורסנט, רוכשים תמונה המכילה brightfield וערוץ זריחה על החלבון עניין (קרי, לייזר קו 488 ננומטר על עירור של ה-GFP, ננומטר לייזר קו 561 עבור עירור של RFP). בניסויים באמצעות את צ'ו-K1 XRCC1-ה-GFP, זריחה נרגש על ידי 488 ננומטר לייזר קו נאסף בו זמנית בערוץ משודרים DIC brightfield.
- החניך לייזר נזק.
- במערכת שהוצגו, בילה פקד המינון לייזר על ידי הזמן הכולל סריקת הנזק ROI. כי גלוונומטר הלייזר nm 355 פועלת בקצב קבוע סריקה, לייזר מנה נשלטת על ידי הזמן המושקע שוב ושוב לסרוק את הנזק שנבחר רועי: הנתונים המובאים כאן, מיקרו-הקרנה-355 nm שבוצעו עבור 2 ו-10 שניות.
- , לעומת זאת, לשלוט 405 ננומטר לייזר המינון על-ידי להתכוונן את קצב הסריקה ולבצע סריקה אחת של הנזק שנבחר ROI. ב- p נתוניםכעס כאן, השתמש 8 ו 0.5 fps על מיקרו-הקרנה-405 ננומטר. קצב סריקה של 8 fps מספק במינון לייזר נמוך מ- 0.5 fps, כי הלייזר מבלה פחות זמן על כל פיקסל במהלך הסריקה. לייזרים הן מופעלות על 100% כוח. עיין בסעיף 3.7 לקבלת הוראות על מדידת עוצמת הלייזר ישירות.
הערה: כל מערכת מיקרוסקופ בודדים עשוי להשתנות כיצד עוצמת הלייזר מועבר של רועי המיועד, 355 הדומה איך nm ו 405 ננומטר שונים במערכת שהוצגו. משתמשים יצטרכו לקבוע הליך זה למערכת מיקרוסקופ שלהם ולדווח פרמטרים אלה בתוך המקטעים בשיטות שלהם. - עבור הדמיה תא חי, לבצע ייבוא תמונות timelapse של brightfield וערוצי זריחה. להתאים את המשך והתדירות של timelapse כדי למטב את איסוף הנתונים, באופן אידיאלי לכידת ההצטברות של החלבון הניאון בנזק רועי, דיסוציאציה שלה במרוצת הזמן של הניסוי. ניסויים באמצעות XRCC1-GFP אספו תמונות כל 30 שניות במשך 20 דקות.
הערה: התדירות של ההדמיה timelapse יכול להיות מוגבל על-ידי photobleaching של fluorophore, וכדי לסבך את הניתוח של הצטברות של דיסוציאציה. ניתן להעריך Photobleaching על-ידי התבוננות תאים ניזוק במהלך timelapse ושינוי תנאי רכישה כדי למזער את אובדן אות ניאון בתאים אלה ניזוק. כמה photobleaching עלול להיות בלתי נמנע, כך משתמשים עשוי לפצות על אובדן אות על ידי נרמול עוצמות פלואורסצנט תאים פגומים לאלה של תאים תקינים בכל מסגרת של timelapse.- לאחר השלמת מסלול הזמן, בחר שדה חדש של תאים עבור נזק או לתקן תאים פגומים עבור ניתוח נוסף, כמתואר בסעיף 4.
- המשך מיקרו-הקרנה והדמיה timelapse עד המספר הרצוי של תאים פגומים.
הערה: אנו ממליצים על פגיעה סך של 10-25 תאים לכל תנאי שנבחר כדי להעריך את הטרוגניות לתא בתגובה הנזק המושרה. למרות ביותר קונאפוקלית מערכות יאפשר למשתמשים נזק יותר מתא אחד במהלך כל מיקרו-הקרנה, זה מציג פעמים חניכה נזק מתנדנדת, אשר יכול לסבך את הניתוח של גיוס השיא על פני מספר רב של תאים או דיסוציאציה זמן לאירועים מהר. במערכות מסוימות, אינדוקציה נזק בו זמנית על מספר ROIs עשויה להפחית את המינון לייזר שהתקבלו על-ידי כל רועי עצמאית. לפיכך, אלא אם אלה בעיות תזמון/כוח מטופלות ישירות על-ידי המשתמש, מומלץ כי תאים ניזוק בנפרד.
- עבור ניתוח לפי immunofluorescence (אם), לבצע נזק גם מיד לתקן תאים, כמתואר בסעיף 4, או לאפשר לתאים תיקון עבור נבחרות בהפרשים של זמן (קרי, 1, 5, 10 או 20 דקות). אחרי הזמן המבוקש חולפת, לתקן, מכתים את התאים, כמפורט בסעיף 4.
- כדי להגדיל את מספר התא הכולל עבור ניתוח אם, נזק שדות נוספים בתוך הספינה תרבות כדי ליצור מסלול זמן מרובה שדות של התגובה שלאחר נזק. להקליט את המיקום XY של כל שדה ואת השעה שבהם אירע הנזק. לאחר הסיכום הרצויה לתקן זמן מסתיים, לתקן, מכתים את התאים כפי שיפורט להלן.
- לאחר התבוננות של הגיוס חלבון במינונים שנבחר, מדידה, דוח כוח לייזר רמות סיבים שלאחר ויעד שלאחר לאפיין במדויק ולדווח לייזר מינונים. אנו משתמשים מד כוח דיגיטלי קומפקטי שני ראשים חיישן פוטודיודה שונים; אחד מצמידים ישירות סיב לייזר למדידת סיבים שלאחר פלט, והניח השני על הבמה מיקרוסקופ כדי למדוד את פלט post-objective.
- כדי למדוד את עוצמת הלייזר, מיקום החיישן בתצורה הרצויה (סיבים שלאחר או post-objective) ולבצע מיקרו-הקרנה כמתואר לעיל, בעת הקלטת המדידות שנעשו על ידי מד הכוח. שים לב כי קצב הדגימה של מד צריכת החשמל עשוי לא להיות מהיר מספיק כדי ללכוד אירועים מיקרו-הקרנה מהירה מאוד, ולכן יהיה צורך להפעיל את חזרות מרובות של הניסוי כדי להבטיח כי מד צריכת החשמל מזהה במדויק את המינון יישומית-
הערה: הלייזר nm 355, מדדנו כוח שיא ממוצע של 5 סיבים שלאחר mW, כ 19 µW שלאחר המטרה. הלייזר 405 ננומטר, מיקרו-הקרנה בוצעה ב לולאות של 30 חזרות כדי להתגבר על קצב הדגימה המרבית של 0.01 s של מד הכוח, וכוחות שיא ממוצע של 1.5 מגה-וואט ו- 2.4 mW נמדדו באמצעות מהירות סריקה של 8 ו- 0.5 מסגרות לשנייה , בהתאמה. כל מטר כוח שונה. משתמשים יהיה צורך לקבוע את אורכי הגל מבצעית וקצבי דגימה עבור מד צריכת חשמל בודדות שלהם.
- כדי למדוד את עוצמת הלייזר, מיקום החיישן בתצורה הרצויה (סיבים שלאחר או post-objective) ולבצע מיקרו-הקרנה כמתואר לעיל, בעת הקלטת המדידות שנעשו על ידי מד הכוח. שים לב כי קצב הדגימה של מד צריכת החשמל עשוי לא להיות מהיר מספיק כדי ללכוד אירועים מיקרו-הקרנה מהירה מאוד, ולכן יהיה צורך להפעיל את חזרות מרובות של הניסוי כדי להבטיח כי מד צריכת החשמל מזהה במדויק את המינון יישומית-
4. Immunofluorescence מכתים הליכים
- נתח strand break אינדוקציה מאת אם מכתים.
- לתקן תאים עם 3.7% פורמלדהיד (זהירות) בפוספט buffered תמיסת מלח (PBS) במשך 10 דקות לשאוב פורמלדהיד פתרון ושטוף 3 פעמים עם PBS. ניתן לעצור את הפרוטוקול פה על-ידי הצבת PBS בחזרה על התאים, התאים שניתן לאחסן ב הלעפה תרוטרפמט 4 עד 1 לשבוע.
התראה: פורמלדהיד הוא רעילים ומסרטנים. ללבוש ציוד מגן אישי המתאים והשלך החומר הרעיל בתור הורה לו על ידי המוסדיים נהלים סביבתיים בטיחות וגהות. - Permeabilize תאים באמצעות 0.25% טריטון X-100 ב- PBS 10 דקות בטמפרטורת החדר (RT), ואז לשטוף 3 פעמים עם PBS.
- בלוק לכריכה שאינם ספציפיים נוגדנים על ידי המקננת למשך 30 דקות ב- PBS המכיל 1% שור אלבומין (BSA)-RT.
- Incubate עם monoclonal antibody העיקרי נגד γH2AX, ראשי polyclonal נוגדנים נגד 53BP-1 שניהם מדולל 1:750 ב- PBS המכיל 1% BSA עבור h 1-RT, ולאחר מכן לשטוף 3 פעמים עם PBS.
- תאים Incubate עם אלקסה 488 עז אנטי עכבר וארנבת אלקסה 546 עז אנטי-הן מדולל 1:2000 ב- PBS המכיל 1% BSA עבור h 1-RT, ולאחר מכן לשטוף 3 פעמים עם PBS.
- כתם DNA גרעיני עם פתרון 10 מ"ג/מ"ל של דאפי (4 ', 6-Diamidino-2-Phenylindole, זהירות) מדולל כדי 1:5000 ב- PBS במשך 5 דקות, או לצבוע גרעינית דומה לשימוש ולאחר מכן תשטוף 3 פעמים עם PBS.
התראה: דאפי הוא רעיל מוטגניות. ללבוש ציוד מגן אישי המתאים ולחסל את החומר הרעיל שהומלץ על ידי המוסדיים נהלים סביבתיים בטיחות וגהות.
אזיד הנתרן - המקום הציבורי או PBS + 0.1% (זהירות) חזרה אל התאים מוכתם. פרוטוקול ניתן לעצור כאן, תאים המאוחסנים הלעפה תרוטרפמט 4 במשך מספר ימים, או להמשיך ייבוא תמונות בסעיף 5.
התראה: אזיד הנתרן הוא רעיל. ללבוש ציוד מגן אישי המתאים ולחסל את חומרים רעילים שהומלץ על ידי המוסדיים נהלים סביבתיים בטיחות וגהות.
- לתקן תאים עם 3.7% פורמלדהיד (זהירות) בפוספט buffered תמיסת מלח (PBS) במשך 10 דקות לשאוב פורמלדהיד פתרון ושטוף 3 פעמים עם PBS. ניתן לעצור את הפרוטוקול פה על-ידי הצבת PBS בחזרה על התאים, התאים שניתן לאחסן ב הלעפה תרוטרפמט 4 עד 1 לשבוע.
- נתח אינדוקציה של נגעים הבסיס או דנ א adducts על ידי אם מכתים.
- תיקון ו permeabilize בתאים כקרח מתנול (זהירות) במשך 20 דקות ב-20 מעלות צלזיוס
התראה: מתנול הוא רעיל, דליק. ללבוש ציוד מגן אישי המתאים ולחסל את החומר הרעיל שהומלץ על ידי המוסדיים נהלים סביבתיים בטיחות וגהות. - וארוקן את ליthanol ולאפשר הדגימה להתייבש לחלוטין במשך 15 דקות פרוטוקול ניתן לעצור כאן ויבשה תאים המאוחסנים ב-20 הלעפה תרוטרפמט עד 3 ימים.
- נתרענן התאים ב- PBS במשך 15 דקות
- Denature DNA באמצעות N 2 HCl (זהירות) למשך 45 דקות ב RT ושטוף 3 פעמים עם PBS.
זהירות: HCl היא מאכל. ללבוש ציוד מגן אישי המתאים ולחסל את החומר קורוזיבית שהומלץ על ידי המוסדיים נהלים סביבתיים בטיחות וגהות. - נטרול ב 50 מ מ טריס-HCl pH 8.8 5 דקות ולאחריו 3 מנקי עם PBS.
- Incubate תאים במאגר חסימה עשה עם סרום עז רגילה 5% ו- 0.1% X-100 Triton ב- PBS עבור h 1-RT.
- Incubate עם נוגדנים העיקרי עבור 8-אוקסו-2´-deoxyguanosine (8-oxodG, 1:400) או cyclobutane פירימידין דיימר (שיקגו, 1:1, 000) במאגר עז סרום חסימה עבור h 1 RT ולאחר מכן לשטוף 3 פעמים עם PBS.
- דגירה תאים עם אלקסה 488 עז אנטי-העכבר יחס 1:2000 במאגר עז סרום חסימה עבור h 1-RT, ולשטוף 3 פעמים עם PBS.
- כתם DNA גרעיני באמצעות 1:5000 דאפי (10 מ"ג/מ"ל) ב- PBS במשך 5 דקות, לשטוף 3 פעמים עם PBS.
- אם באמצעות תאיים coverglass, המקום הציבורי או PBS + 0.1% אזיד הנתרן חזרה אל התאים מוכתם. פרוטוקול ניתן לעצור כאן, תאים המאוחסנים הלעפה תרוטרפמט 4 במשך מספר ימים, או להמשיך ייבוא תמונות בסעיף 5.
- הר. לחלופין, תאים במדיום הרכבה מועדף, אם coverglass נוספים ניתן להציב על גבי הספינה תרבות. ברגע נרפא, תאים נטען שניתן לאחסן ב 4 הלעפה תרוטרפמט במשך פרקי זמן ארוכים.
- תיקון ו permeabilize בתאים כקרח מתנול (זהירות) במשך 20 דקות ב-20 מעלות צלזיוס
5. תמונה רכישה לניסויים immunofluorescence
- נקי coverglass התחתון של הספינה תרבות עם אתנול ולמקם אותו בחזרה על הבמה מיקרוסקופ קונפוקלי. ודא הכיוון ואת המיקום של כלי השיט על הבמה מקביל הכיוון מיקום הקליט כאשר הנזק היה המושרה. לאבטח את כלי הקיבול של תרבות כדי להבטיח רישום אופטימלית והדמיה.
- אתר בעבר עם תמונה שדות באמצעות טכניקת רישום שנבחר (שמתואר 3.2).
- לרישום ידני באמצעות coverglass עם רשת חרוט, תביא את הרשת אל ומיקוד למצוא סימנים מזהים. ואז השתמש הקליט קואורדינטות XY כדי לאתר תאים פגומים.
- עבור הרשמה אוטומטית מבוססת תמונה, אתר התכונה מבניים המשמש כנקודת התייחסות בשלב 3.2.1 ולאחר מכן ליישר את התצוגה הנוכחית של מיקרוסקופ בשידור חי באופן מדויק על התמונה מוקלטות ככל האפשר. ברגע מיושר, למדוד את המיקום הנוכחי של הבמה מיקרוסקופ XY ולהשוות אותם למיקום XY של הייחוס. מרחק ליניארי בין שני המיקומים מגדיר את היסט X ו- Y. היסט זה חלות על כל מיקום XY מוקלטות כדי לזהות את שדות תמונה המכילה את התא לקרינה. פונקציה זו הסטה ייתכן האוטומטית בתוכנת בקרת מיקרוסקופ או לבצע באופן ידני.
- אם אין נקודות רישום מתאים יכול להיות מזוהה, באופן ידני לאתר תאים על ידי סריקה של השקופית ואיתור המאפיינים שזוהו בעבר תא.
- לרכוש תמונות באמצעות מיקרוסקופ המתאים הגדרות כדי לאסוף את מטרות כל המוכתמים, כולל תמונת brightfield (הגדרה בסעיף 2.3 והתמקדות בסעיף 3.3). בניסויים שהוצגו, תמונות רב-ערוצי נאספו באמצעות קווי לייזר עירור הבאים fluorophores: 405 ננומטר (דאפי), 488 ננומטר (488 אלקסה, brightfield DIC המשודרת), ו-561 nm (אלכסה 546). לייזרים כל עוברים דרך מסנן tunable אקוסטו אופטי יחיד שליטה השידור של אורך גל לייזר והן כוח.
6. חיים תא ניתוח תמונה של הגיוס של חלבונים פלורסנט לאתרים מוקרן מיקרו
- פתוח רכשה תמונות ביישום של ניתוח תמונה (קרי, אלמנטים ש ח או ImageJ). במידת הצורך, לשלב את התמונה הקרנה מראש עם תמונות timelapse כדי ליצור רצף תמונה בודדת של נזק טרום שלאחר אינדוקציה. משתמשים יכול להראות גיוס על ידי מדידת שינויים בעוצמת פלורסנט מעל האזור לקרינה היחסי עוצמת קרינה פלואורסצנטית הנמדד על פני כל גרעין (לראות תוצאות נציג איור 1 B. ).
- עבור כל תא ניתן למדוד, לראשונה ליצור הפניה רועי המייצג את הגרעין. להשתמש באלגוריתם סף על האות פלורסנט המכיל את הפיקסלים המרכיבים את הגרעין ולאחר מכן להמיר את האזור הזה רועי. במידת הצורך, רועי ניתן להסיק באופן ידני באמצעות brightfield את כנקודת התייחסות. להתאים את רועי במרוצת הזמן כדי להבטיח האזור הגרעיני במדויק מכוסה על ידי רועי, ולדווח עוצמת קרינה פלואורסצנטית אכזרי של האות פלורסנט בטווח הזה רועי לכל אחת מהמסגרות.
- עבור כל תא ניתן למדוד ליצור פיקסל 6 x 6 רועי ומניחים אותו על הנזק רועי לכל מסגרת של זמן הקורס. רועי גדול זה הוא כעת הנזק רועי לניתוח. הדו ח עוצמת קרינה פלואורסצנטית רועי אומר לכל אחת מהמסגרות.
הערה: תוכנה מסחרית ביותר של ניתוח תמונה כוללת מודולים עבור מעקב אחר אובייקט דו-ממדי, וישנם מספר מפותחות משתמש בפקודות מאקרו ImageJ או פיג'י המאפשרים זרימת עבודה מהירה יותר, תפוקה גבוהה יותר (ראה https://imagej.nih.gov/ij/plugins/). - לנרמל את עוצמת קרינה פלואורסצנטית רועי נזק מתכוון לזה של הפניה המתאימים רועי בכל מסגרת של timelapse. כאן, עוצמת קרינה פלואורסצנטית גרעיני רעים משמש כהפניה ROI (ראה תוצאות נציג איור 1). נורמליזציה יכול להתבצע על-ידי חיסור ההפניה כלומר עוצמת קרינה פלואורסצנטית רועי מהממוצע נזק עוצמת קרינה פלואורסצנטית רועי, או על-ידי חלוקת הממוצע נזק רועי עוצמת קרינה פלואורסצנטית מאת ההפניה כלומר עוצמת קרינה פלואורסצנטית רועי.
הערה: נורמליזציה האוגדה יכולות להניב תוצאות בלתי צפויות, אם נעשה שימוש במצבים עם ערכי העוצמה הפניה נמוך מאוד. - חזור על כל התאים הפגועים, כמו גם עבור פקד לפחות שני, תאים תקינים. שליטה תא תוצאות יכול לשמש עבור נוסף נורמליזציה, אם נדרש.
- גרף מנורמל ערכי העוצמה לאורך זמן כדי להציג את השינויים ב- dynamics גיוס כפונקציה של טיפול ניסיוני.
7. ניתוח של חלבון הגיוס שזיהה immunofluorescence תמונה
- פתוח קדם ונזק פוסט תמונות ביישום ניתוח של התמונה. תמונות נזק מראש להכיל את הנזק ROI(s) המשמש עבור מיקרו-הקרנה. העתק את ROI(s) והדבק התמונות נזק שלאחר לזהות תאים ממוקדות.
- ליצור פיקסל 6 x 6 רועי לניתוח של חלבון גיוס ולמקם את רועי במיקום של הנזק ROI. רועי גדול זה הוא כעת הנזק רועי לניתוח. דו ח הנזק כלומר עוצמת קרינה פלואורסצנטית רועי.
- לנרמל את עוצמת קרינה פלואורסצנטית רועי נזק מתכוון לזה של הפניה המתאימים רועי. . הנה, עוצמת קרינה פלואורסצנטית גרעיני רעים של התא הפגוע משמש כהפניה רועי (ראה תוצאות נציג איור 1). יצירת ההפניה רועי על-ידי שימוש באלגוריתם סף האות דאפי להגדרת הגרעין ולאחר מכן להמיר את האזור הזה רועי. דווח על ההפניה כלומר עוצמת קרינה פלואורסצנטית ROI. נורמליזציה יכול להתבצע על-ידי חיסור ההפניה כלומר עוצמת קרינה פלואורסצנטית רועי מן הפגיעה כלומר עוצמת קרינה פלואורסצנטית רועי, או על-ידי חלוקת הנזק כלומר עוצמת קרינה פלואורסצנטית רועי על ידי ההפניה כלומר עוצמת קרינה פלואורסצנטית רועי.
הערה: נורמליזציה האוגדה יכולות להניב תוצאות בלתי צפויות, אם נעשה שימוש במצבים עם ערכי העוצמה הפניה נמוך מאוד. - חזור עבור כל התאים הפגועים, לבצע את הניתוח באותו פקד לפחות שני תאים, כמתואר לעיל-
- גרף מנורמל ערכי העוצמה עבור כל אחד נמדדים מיקרו-הקרנה אירוע נגד הזמן כדי להציג את השינויים גיוס חלבון או סוג של נזק לדנ א כפונקציה של טיפול ניסיוני.
תוצאות
אפיון של נזק לדנ א המושרה
אינדוקציה של נגעים הבסיס ומעברי סטרנד תלויה המינון לייזר חלה על האזור שנבחר גרעיני ומשמשת microenvironment הסלולר של המודל תא7. חלבונים פלורסנט מאוחה לתקן חלבונים, כמו XRCC1, 53BP1, Ku70 או Rad51, לספק שימושי יחיד וכפול לנטישה של הפסקה סמנים עבור יצירת האנרגיה מינימלית הדרושה כדי לראות הצטברות של חלבון פלואורסצנטי בתוך נזק רועי לעיל רקע זריחה9,19,31. ברגע נמצאו תנאים לגרום לתגובה, חיוני כדי לאפיין את התערובת נזק הנגרם על ידי גל ספציפי והמנה הזאת. הנחתה של מינון, משך-אורך הגל המשמש יכול לאפשר למשתמש לצמצם את היווצרות נזק מורכבות תערובות. לייזר נמוך במינונים בטווח קרינת UV-A הוכחו לייצר בעיקר SSBs ואת כמות קטנה של נגעים הבסיס, המתאים ללמוד SSBR, בער מסלולים10,28. להגדיל את המינון יוצר נגעים הבסיס מורכבים יותר, חמצוני, UV המושרה ומשרה משמעותית יותר מספרים של7,DSBs10. בזמן אינדוקציה של זן אחד של נזק לדנ א רצוי בחינת שמסלולי התיקון ה-DNA ספציפיים, סביר יותר כי המשתמשים הם גרימת תערובת של נגעים דנ א, עם פצע מסוים כמו SSBs להיות הרבה יותר תכופים יותר נגעים הבסיס או DSBs. זה דומה ל- DNA תערובות נזק הנגרם על ידי חומרים כימיים כמו מי חמצן (H2O2) או מתיל methanesulfonate (MMS)32. המשתמשים צריכים להיות מודעים כאשר הם מדווחים תוצאות נזק תערובות יכול להתרחש, אפיון זהיר של מינון, נגעים באתר נזק מושרה נחוצים להבטיח את הפארמצבטית ואת comparability של התוצאות שלהם.
במחקרים מיקרו-הקרנה, XRCC1-GFP משמש לעתים קרובות סמן תנאי הגיוס של lesions הבסיס,9,SSBs28. XRCC1 הוא חלבון לגרדום אשר ממלא תפקיד חשוב חלטורה תיקון (SSBR), כריתה הבסיס לתקן (בער), משתתפת גם אחרים שמסלולי התיקון, כמו נוקלאוטיד כריתה תיקון (נר)33,34,35 . זה תפקיד חשוב תיאום תיקון ה-DNA, אינטראקציה עם מספר רב של חלבונים מפתח, כולל poly(ADP-ribose) פולימראז 1 (PARP-1), ה-DNA פולימראז β (Pol β), ו- DNA ליגאז השלישי. אנחנו מנוצל XRCC1-GFP stably הביע בתאים צ'ו-K1 כדי לקבוע במינונים לייזר הנדרש להפקת SSBs ו- DSBs. אנחנו זיהה לראשונה את המינון המינימלי הנדרש כדי לעודד גיוס הנצפה של XRCC1-GFP עבור כל אורך גל (איור 1). עבור הגל nm 355, זמן להתעכב s 2 על הנזק המוגדרים רועי נוצר אות ניאון מוגברת בתוך את רועי, המציין את אינדוקציה של נזק לדנ א שהיה לזיהוי ברקע (איור 1א'). עבור 405 ננומטר, שיעור סריקה 8 fps נחוץ כדי ליצור של גיוס הנצפה לנזק ROI (איור 1א'). ואז הוגדל המינון (10 s עבור 355 nm ו fps 0.5 על 405 ננומטר) כדי ליצור יותר אינטנסיבי נזק ROI (איור 1א').
גיוס ושימור של XRCC1-GFP באתר של נזק מושרה נוטרה ואז על ידי הדמיה timelapse. השמירה של החלבון באתר של נזק לדנ א עשוי להצביע על תיקון דנ א מתמשך, בעוד דיסוציאציה של החלבון מהאתר של נזק מושרה נחשב לעתים קרובות סמן השלמה של בער או SSBR. עם זאת, יש כבר אין ראיות ברורות המקשר את הדיסוציאציה של XRCC1 לייזר המושרה DNA נזק אתרי עם השלמת התיקון. גיוס של החלבון לאתר של נזק נמדד על ידי דיווח את עוצמת האות פלורסנט בתוך רועי פגומים אומר מעל האות פלורסנט רשע יימדדו הגרעין כולו (איור 1B). סוג זה של נורמליזציה מסייעת כתובת עוצמת תנודות האות גרעינית, למרות טכניקות נרמול אחרות יכול להיות מועסק בהתאם להתפלגות הסלולר של החלבון עניין. כאן, XRCC1 הוא מקומי בתא גרעיני, כך נורמליזציה לאזור גרעיני אמצעי הפצה מחדש של האות לנזק ROI. עוצמת פלורסנט אומר רועי ואז נרשם עבור כל תמונה ב- timelapse, כולל את תמונת נזק טרום ולאחר בגרף כפונקציה של הזמן (איור 1C).
אנחנו מכן נוסף מאופיין הנזק הנגרם על ידי שתי מנות שנבחרו לייזר כדי לבחון את היווצרות נגעים בסיס DNA. ראשית, היווצרות רופאות, פגיעה UV-induced מגושם, נבדקה על-ידי immunofluorescence כסמן לחבלות סוג נר (איור 2א). . אז, oxidatively המושרה הבסיס lesion8-oxodG נבדקה כסמן לחבלות סוג בער (איור 2B). אין עלייה משמעותית בנגעים רופאות נצפו על החשיפה במינון נמוך עבור שני אורכי הגל (2 s 355 nm ו 8 fps עבור 405 ננומטר), בזמן הגבוה במינון הטיפול באורכי גל שני (10 s עבור 355 nm ו fps 0.5 על 405 ננומטר) הראתה עלייה משמעותית בפלורסנט האות נצפתה בתוך הנזק ROI (איור 2א). מגרש פיזור של רועי רופאות מתכוון בעוצמה על כל הטרוגניות מראה תא פגום של היווצרות הנזק וזיהוי בכל אורכי הגל והן במינונים, המציין כי רמה נמוכה של רופאות נגעים עשוי להיות נוכח במינון נמוך, אבל העומס לא יכול להיות משמעותי זוהה עד מינון גבוה יותר מוחל. Scatterplot מציע גם את חוסר היעילות בזיהוי נוגדן עלולה להגביל כימות מדויק של תערובות נזק.
זה מודגשת עוד יותר זיהוי נגעים DNA oxidatively המושרה על-ידי סמן 8-oxodG. אין עלייה ברורה ניאון האות בתוך הנזק רועי נצפתה עבור 8-oxodG-אורך גל לייזר או מינון בשימוש (איור 2B). הנוגדן משמש לעבודה זו עולה בקנה אחד עם הקודם פרסומים9,10,36; עם זאת, יצוין כי יכול להיות מגבלות התבוננות היווצרות של 8-oxodG עם נוגדנים37,38. אישור היעדר נגעים oxidatively המושרה מומלץ גם על ידי סימון שני, כמו גיוס של 8-Oxoguanine דנ א Glycosylase (OGG1), האנזים האחראי על הסרה של 8-oxodG של ה-DNA10. לא נתבונן גיוס OGG1 לאתרים נזק שלנו דנ א '; עם זאת, היווצרות של רמות נמוכות של oxidatively המושרה נזק לדנ א שלא ניתן לשלול לחלוטין.
לבסוף, בדקנו את היווצרות DSBs בעזרת שני סמנים, γH2AX ו- 53BP-1, selecteלייזר-d במינון לפי immunofluorescence (איור 3 & 4). ΓH2AX משמשת כסמן strand break, אך ירידה שלו לפרטים על DSBs נחקר במספר דוחות39,40. בנוסף, זה אירוע זרחון מפיצה מאתר הפסקה סטרנד, כך לוקליזציה של אות הפסקה גדיל יכול להיות מוגבל בשל הפצת האות הזה. לפיכך, שילוב γH2AX עם 53BP-1 מאפשרת הערכה מדויקת יותר של DSB היווצרות בתוך הנזק ROI.
התגובה של γH2AX ו- 53BP-1 מיקרו-הקרנה הוא אורך הגל והן תלויות מינון. מינון נמוך (2 s) גירוי-355 nm מעורר אין תשובה במקום 5 ו- 20 דקות, והקרנה של תגובה חלשה ומשתנה 10 דקות פוסט (איור 3א) עבור שני הסמנים. המינון הגבוה (10 s) של 355 nm מיקרו-הקרנה המניע אות ניאון מוגברת בתוך הנזק רועי-5, 10 ו- 20 דקות הקרנה פוסט זה הוא מופחת ב 40 דקות (איור 3ב). תוצאות אלו מצביעות על זהירים טיטור של המינון nm 355 נדרש כדי למזער את הצלב-גירוי של שמסלולי התיקון, כפי שמתואר על ידי זיהוי מופחת γH2AX סמן לשבור גדיל כפול בנקודות זמן מוקדם (< 20 דקות) במינון נמוך מוחל.
ניסויים דומים בוצעו באמצעות נמוכה (8 fps) והן במינון גבוה (0.5 fps) 405 ננומטר לייזר גירוי (איור 4). ובאורך הגל הזה משמעותי להצטברות של פלורסנט בעוצמה בתוך הנזק רועי נצפתה 53BP-1 וגם γH2AX ללא קשר מינון יישומית, המציין כי אלה מנות לייצר תערובת מורכבת של מעברי חוט יחיד כמעט מיידית לאחר אינדוקציה של נזק לדנ א (איור 4). בנוסף, במינונים גבוהים של 405 ננומטר להראות עלייה γH2AX פאן-גרעיני מכתים בתוך 10 דקות האינדוקציה נזק (איור 4B, התחתון) זה מאפשר איתור של הנזק רועי קשה לדווח, תוך הצטברות 53BP-1 יותר כלולים הנזק ROI.
תוצאות אלו מדגימים בבירור כי 405 ננומטר מיקרו-הקרנה אינו מתאים עבור ניטור SSBR או בער, כי מספר סמני לדנ א adducts, לנטישה של מעברי צריך להיות מועסק לאפיין באופן מלא את נגעים המושרה ותשובות תיקון ה-DNA.
שינוי למינון גיוס ושימור של XRCC1-GFP
ברגע מלווה לנזק לדנ א המושרה, לייזר מיקרו-הקרנה ניתן לפלטפורמה אידיאלית ללמוד את הדינמיקה של חלבונים תיקון ה-DNA. קינטיקה שימור של דיסוציאציה של XRCC1-GFP מראה תלות במינון (איור 1), אשר אינה לא צפויה שנתן את אינדוקציה של תערובות נזק שונים לכל אורך הגל. מינון הקרנה הגבוהה ביותר (10 s ו 0.5 fps) מראים גיוס בעוצמה גבוהה יותר של XRCC1-GFP ביחס במינונים נמוכים יותר זמן השמירה של XRCC1-GFP באתר של נזק במרוצת הזמן 20 דקות (איור 1C). אפשרות זו מציינת כי הנזק DNA נוצר במינונים גבוהים עבור 355 והן 405 ננומטר הוא סביר לא נפתרה במהלך הניסוי, אשר תואם המראה ואת השמירה של DSB סמנים, γH2AX, 53BP-1 (3 דמויות & 4 ).
מעניין, מינונים נמוכים יותר נזק (2 s ו 8 fps) מראים גיוס מהירה של XRCC1-GFP לאתרים נזק דיסוציאציה של XRCC1-GFP במרוצת זמן הניסוי לרמות הקרנה מראש (איור 1C). ללא אפיון מלא התערובת נזק, זה עלול להוביל למסקנה כי SSBs נגעים בסיס לחלוטין נפתרות באמצעות תנאים אלה מזיק. עם זאת, הנוכחות של γH2AX ו- 53BP-1 ב 40 דקות בשביל 355 nm ו- 5 דקות על כביש 405 ננומטר עלול להוביל פרשנויות שונות. 355 nm 2 s. המינון, התערובת הנזק עשוי להיות בעיקר SSBs, אז הופעת סמני DSB ב 40 דקות עשוי לציין כי נגעים לא מתוקן עשוי להיות המוביל DSBs או DSBs שנוצר על ידי אנרגיה זו מתוקנים בקנה מידה זמן ארוך יותר. זמן בקנה מידה ההבדלים בין SSBR ותיקון DSB כבר שדווחה בעבר28,41,42. באופן דומה, הדיסוציאציה במינון נמוך (8 fps) 405 ננומטר מצביעים על רמה נמוכה של SSBs או קיבוץ באשכולות של SSBs זה מומרים במהירות DSBs, אשר נרשמה גבוה נזק DNA מיקרו-הקרנה, אחרים להזיק סוכנים בעבר43, 44 , 45.
יחד תוצאות אלה להדגיש את החשיבות של אפיון של תערובות נזק מושרה ניצול DNA מרובים לתקן חלבונים, סמנים עבור לפרש את גיוס ושימור של ה-DNA לתקן חלבונים באתרים של נזק מושרה.
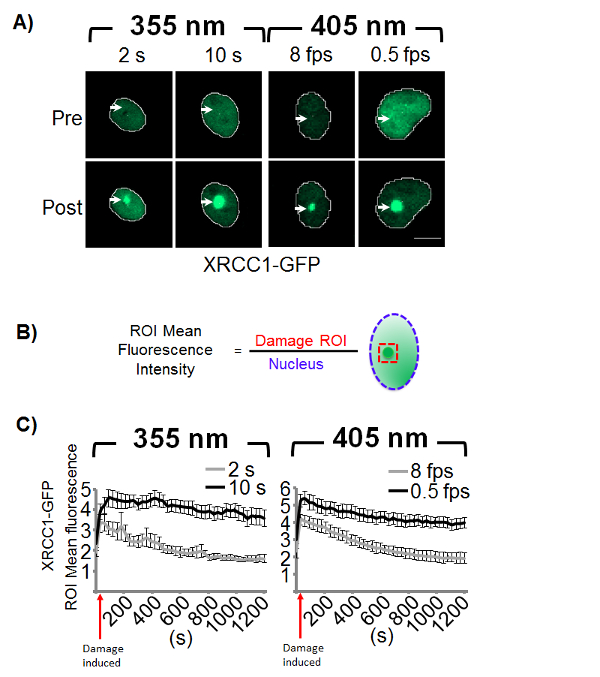
איור 1 . לייזר מיקרו-הקרנה גורם גיוס של XRCC1-GFP.
(א) צ'ו-K1 התאים stably לבטא XRCC1-GFP היו מוקרן, עם תמונה לפני ואחרי מיד נזק אינדוקציה. חיצים מציינים את המיקום של מיקרו-הקרנה במינון, סולם ובר הינו 10 מיקרומטר. (B) גיוס נמדד על ידי קביעת עוצמת פלורסנט רשע בתוך הנזק רועי, נורמליזציה ללחץ פלורסנט אכזרי של הגרעין כולו. (ג) דינמיקה של הגיוס ניתן למדוד עבור כל תמונה timelapse. גרפים הם נציגים של שני ניסויים עצמאית עם קווי שגיאה המייצג את תצורת ה-SEM (n = 24). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 . לייזר מיקרו-הקרנה גורם נזק נוקלאוטיד.
צ'ו-K1 התאים היו חשופים לייזר מיקרו-הקרנה, לתקן מיד לאחר נזק אינדוקציה. Immunofluorescence בוצע לזהות רופאות, 8-oxodG adducts. (א) העליון, פיזור חלקת רועי אומר קרינה פלואורסצנטית עוצמות שנצפתה נזק תאים לאחר צביעת רופאות. התחתון, להחליפן בתמונות של רופאות מכתים. חיצים מציינים מיקום של מיקרו-הקרנה, ובר סולם הינו 10 מיקרומטר (n = 12). (ב) תמונות נציג עבור 8-oxodG מכתים. חציםלהצביע על המיקום של מיקרו-הקרנה, ובר סולם הינו 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
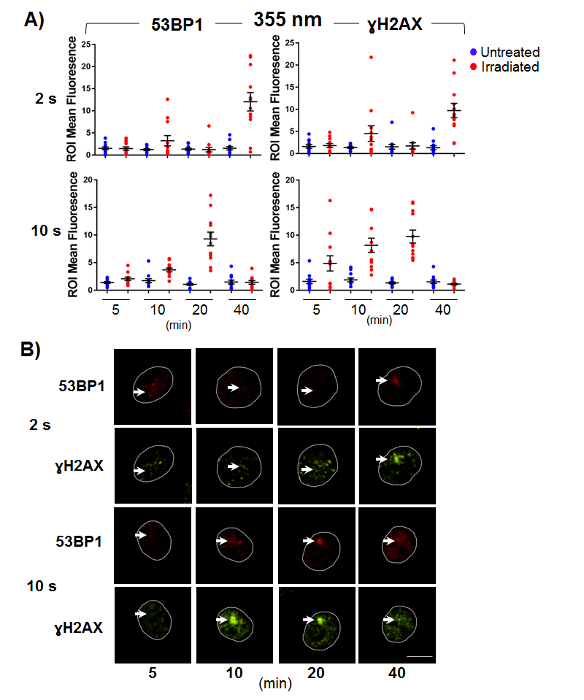
איור 3 . סימוני הדנ א גדיל כפול הפסקת להגיב 355 nm מיקרו-הקרנה באופן תלוי מינון.
צ'ו-K1 התאים היו נתון מיקרו-הקרנה, קבוע ב זמן נקודות המצוין פוסט-הגירוי. בוצעה immunofluorescence עבור DSB סמנים γH2AX ו- 53BP-1. (א) פיזור מגרש של נזק מנורמל רועי אומר עוצמות קרינה פלואורסצנטית נמדד עבור תאים תקינים, פגום. קווי שגיאה הם נציג של תצורת ה-SEM (n = 12). (ב) תמונות נציג עבור γH2AX ו- 53BP-1 מכתים. חיצים מציינים מיקום של מיקרו-הקרנה, ובר סולם הינו 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
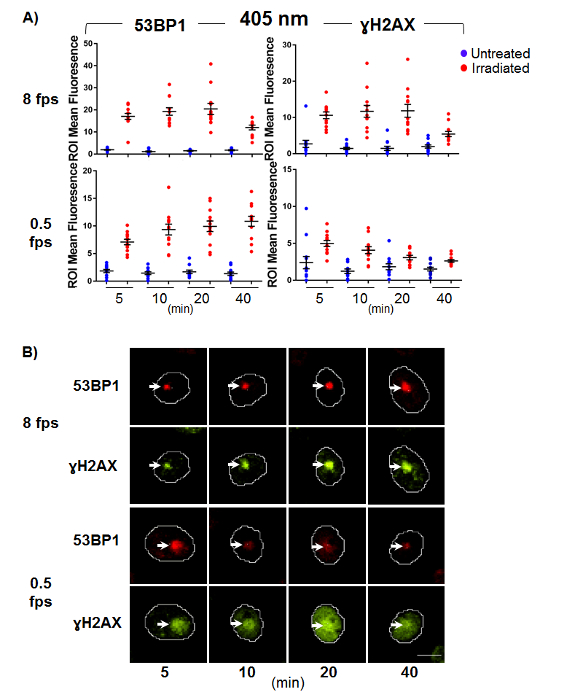
באיור 4. DNA גדיל כפול הפסקה סמנים robustly להגיב 405 ננומטר מיקרו-הקרנה.
צ'ו-K1 התאים היו נתון מיקרו-הקרנה, קבועות הגירוי הפוסט המצוין של נקודות זמן. Immunofluorescence עבור DSB סמנים γH2AX ו- 53BP-1. (א) פיזור מגרש של נזק מנורמל רועי אומר עוצמות קרינה פלואורסצנטית נמדד עבור תאים תקינים, פגום. קווי שגיאה הם נציג של תצורת ה-SEM (n = 12). (ב) תמונות נציג עבור γH2AX ו- 53BP-1 מכתים. חיצים מציינים מיקום של מיקרו-הקרנה, ובר סולם הינו 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
שימוש בתנאים המתוארים כאן, כל מיקרוסקופ קונפוקלי עם קרינת UV-A או 405 ננומטר לייזר, או משולב על ידי היצרן או נוספו על-ידי משתמש הקצה, באפשרותך לגרום נזק לדנ א בתוך גרעין התא ולאפשר הגיוס של חלבונים תיקון ה-DNA לאתר של המושרה נזק לדנ א כדי להיות במעקב. עם זאת, שכאמור פרוטוקול ותוצאות נציג, גל בחירה, חלה כוח, והיא נזק אפיון חשובים כל סוגיות שמחייבות תחילה על-ידי המשתמש כדי ללמוד על הדי. אן תיקון מסלול. בנוסף, ישנם שיקולים אחרים בהתווית גם להביא בחשבון על-ידי משתמשים.
כדי לעקוב אחר ההתנהגות של חלבון בפוסט תאים חיים מיקרו-הקרנה, חלבון fluorescently שכותרתו חייבים להיווצר. הזמינות של מגוון רחב של חלבונים פלורסנט כי ניתן להפריד spectrally מציע כלים ליצירת חלבון fusions יכול לשמש עבור אפיון הסלולר התגובות אינדוקציה של נזק לדנ א. תרביות תאים ארעית של חלבונים פלואורסצנט עניין מאפשר סינון מהיר של תנאים מזיק, מוטציות או אפילו מעכבי, תאים stably transfected מציעים יותר שליטה על רמות ביטוי ולאפשר אחרים הביוכימי אפיוני שיש לבצע, אימות מיקרו-הקרנה תוצאות. גם יכול להיות מנוצל חלבונים פלורסנט spectrally נפרדות באותו התא כדי לפקח על אינטראקציות בין חלבונים בתוך מסלול זהה או במשעולים שונים. חלבונים פלורסנט גם יבטל את הצורך של נוגדנים ספציפיים עבור כל חלבון עניין ומאפשרים לתא חי ניטור של חלבון התנהגות במשך פרקי זמן ארוכים לאחר תנאי הגיוס של נזק.
עם זאת, השימוש של חלבונים פלורסנט יש גם חסרונות. ללא רקע גנטי בנכונותם protein(s) של עניין, חלבונים אנדוגני יתחרו עם החלבונים fluorescently מתויגות. ההטיה של תג ניאון הסופית N או C של החלבון עשוי לשנות קיפול חלבונים, המעכבים אינטראקציות חלבון מפתח, או לחסום אותות רוברטסונית; שינוי פונקציה, שעלולים להשפיע על הדינמיקה גיוס. תופעות אלה הוכחו במספר דוחות איפה מכתים immunofluorescent הפגינו גיוס שונה באופן דרמטי ושעות השמירה חלבונים אנדוגני-אתר נזק28. השימוש של תרביות תאים ארעי או שיבוטים יציב יכול גם לשנות את התגובה שנצפו, בדרך כלל דרך בווריאציות רמות ביטוי החלבון. יתר על כן, השימוש של מספר חלבונים פלורסנט בניסוי יחיד יכול גם לשנות את הדינמיקה של גיוס, אם רמות החלבון לא equilibrated טוב או אם הגיוס של החלבון גדול מתויג fluorescently חוסם את הגיוס של חלבונים אחרים . בסופו של דבר, פלורסנט חלבונים יכולים לשמש סוכני רגישות עולה חלש, הגברת היווצרות של מינים חמצן תגובתי, פוטנציאל לשנות את ה-DNA נזק תערובות המושרה46,47. למרות חסרונות אלה חלבונים פלורסנט מציעים מספר יתרונות ברורים ב- DNA לומד לתקן עם מיקרו-הקרנה, אם משתמשים לשלב הפקדים המתאימים, כגון אפיון הנזק שתואר כאן, הם יכולים לספק תובנה חדשה לתוך נזק אינטראקציות חלבון-חלבון והיענות3.
אם התא חי הדמיה אינה נחוצה, immunofluorescence יכול לשמש כדי לנטר את התגובה המזורזת נזק. על ידי תיקון התאים במועדים ספציפיים פוסט נזק אינדוקציה והוא מכתים עם נוגדנים ספציפיים עבור חלבונים ונגעים של עניין, תמונות סטטיות של נזק אינדוקציה גיוס ושמירה של תיקון ניתן לבנות חלבונים. נוגדנים יכול לשמש כדי לפקח על הגיוס של חלבונים מרובים של ריבית ו/או שינויים post-translational המושרה על ידי התגובה נזק הדנ א. השימוש immunofluorescence מבטל את הצורך של חלבונים פלורסנט, ומאפשר חלבון אנדוגני התנהגות להיבדק. עם זאת, שיטה זו יש גם החסרונות. נוגדנים ספציפיים מאוד נחוצים, permeabilization ונהלים חסימה צריך להיות מותאם כדי לאפשר גילוי של גיוס עם עוצמת האות מספיקות. הליכי תיקון אינם נקודתית, ולא אילוץ פיזי זה מגביל את הרזולוציה הטמפורלי של גישה זו. מיפוי האתר של נזק אינדוקציה כך התאים שניתן למקם מחדש לאחר צביעת יכול להציג גם אתגרים משמעותיים. מיקרוסקופ קונפוקלי להשתמש בעבודה זו מאפשרת רישום מבוססת תמונה כפי שתוארה לעיל, אז יכול להיות ימוקמו מחדש תאים פגומים עם דיוק גבוהה. אם שלב רישום או חרוט coverglass אינה זמינה, הזמן ההשקעה מעורבים תאי המעבר ללא רישום הבמה, בשילוב עם עיכוב הטבועה בין נזק אינדוקציה ועל גיוס הדמיה, עלולה להפוך immunofluorescence אינה מושכת משתמשים מסוימים. עם זאת, הכי מדויקים ומלאים מיקרו-הקרנה ניסיוני העיצובים תשלב סוגים אלה של גישות במקביל עם השימוש של חלבונים פלורסנט, כמפורט בפרוטוקול שהוצגו.
כאן, הדמיה תא חי והן immunofluorescence משמש כדי להדגים את התועלת של לייזר מיקרו-הקרנה. צביעת immunofluorescent מאפשר לנו לבחון באופן מדויק את התערובת של נזק לדנ א נוצר ולפרש הגיוס של חלבונים המושרה על ידי כל כוח לייזר, אשר מאפשרים לנו טוב יותר השינויים שנצפו גיוס, השמירה של XRCC1-GFP. בהתבסס על תוצאות אלה, השימוש של 405 ננומטר לייזר צריכה להיות מוגבלת לבדיקה של חלבונים BER והן SSBR. עוד, הנבחנים אופטימלית כולל מדידות חשמל אחרי המטרה, אפיון תערובת נזק מלא עבור כל קו תא בשימוש וכן אימות של הגיוס ו שמירה שנצפתה fluorescently מתויג חלבונים עם immunofluorescence. ללא ספק, ציוד, זמן, שיקולי עלות עלולה להפוך אלה עיצובים מוטוריים אופטימלי אפשרי עבור משתמשים מסוימים. עם זאת, החשיבות של כל אחד מהרכיבים הללו הוכח כאן ולאחר משתמשים יש לזכור שיקולים אלו לאחר תחילת הניסויים מיקרו-הקרנה.
Disclosures
המחברים אין לחשוף.
Acknowledgements
המחברים רוצה להודות ד ר סמואל הנרי וילסון ב נבחרת המכון למדעי בריאות הסביבה עבור שורות תאים נעשה שימוש בעבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| Nikon A1rsi laser scanning confocal microscope | Nikon | ||
| NIS Elements software | Nikon | ||
| 355 nm laser | PicoQuant VisUV | Radiation source | |
| Galvanometer photoactivation miniscanner | Bruker | ||
| Microscope slide photodiode power sensor | THORLabs | S170C | |
| Fiber photodiode power sensor | THORLabs | S150C | |
| Digital handheld optical power and energy meter | THORLabs | PM100D | |
| CHO-K1 | From Dr. Samuel H. Wilson, NIEHS | ||
| Minimal essential media | Hyclone | SH3026501 | |
| Fetal bovine serum | Atlanta biologicals | S11550 | |
| XRCC1-GFP | Origene | RG204952 | |
| Jetprime | Polyplus transfection | 11407 | |
| Geneticin | ThermoFisher | 10131035 | |
| 4 chambered coverglass | ThermoFisher | 155382 | |
| 8 chambered coverglass | ThermoFisher | 155409 | |
| Anti 53BP-1 | Novus | NB100304 | |
| Anti-phospho-histone H2AX | Millipore | 05-636-I | |
| Anti cyclobutane pyrimidine dimer | Cosmo Bio clone | CAC-NM-DND-001 | |
| Anti 8-oxo-2´-deoxyguanosine | Trevigen | 4354-MC-050 | |
| Alexa 488 goat anti-mouse | ThermoFisher | A11029 | |
| Alexa 546 goat anti-rabbit | ThermoFisher | A11010 | |
| 4’,6-Diamidino-2-Phenylindole (DAPI) | ThermoFisher | R37606 | Caution toxic! |
| Phosphate buffered saline | ThermoFisher | 0780 | |
| Normal goat serum | ThermoFisher | 31873 | |
| Bovine serum albumin (BSA) | Jackson Immuno Research | 001-000-162 | |
| 37% Formaldehyde | ThermoFisher | 9311 | Caution toxic! |
| Ethanol | Decon Labs | 2716 | |
| Methanol | VWR | BDH1135 | Caution toxic! |
| HCl | Fisher | SA49 | |
| Sodium azide | Sigma-Aldrich | S2002 | Caution toxic! |
| Tris Hydrochloride | Amresco | O234 | |
| Triton X-100 | Sigma-Aldrich | T8787 |
References
- Luijsterburg, M. S., et al. Stochastic and reversible assembly of a multiprotein DNA repair complex ensures accurate target site recognition and efficient repair. J Cell Biol. 189 (3), 445-463 (2010).
- Vermeulen, W. Dynamics of mammalian NER proteins. DNA Repair (Amst). 10 (7), 760-771 (2011).
- Berns, M. W. A history of laser scissors (microbeams). Methods Cell Biol. 82, 1-58 (2007).
- Cremer, C., Cremer, T., Zorn, C., Schoeller, L. Effects of laser uv-microirradiation (lambda = 2573 A) on proliferation of Chinese hamster cells. Radiat Res. 66 (1), 106-121 (1976).
- Cremer, C., Cremer, T., Fukuda, M., Nakanishi, K. Detection of laser--UV microirradiation-induced DNA photolesions by immunofluorescent staining. Hum Genet. 54 (1), 107-110 (1980).
- Walter, J., Cremer, T., Miyagawa, K., Tashiro, S. A new system for laser-UVA-microirradiation of living cells. J Microsc. 209, (Pt 2) 71-75 (2003).
- Kielbassa, C., Roza, L., Epe, B. Wavelength dependence of oxidative DNA damage induced by UV and visible light. Carcinogenesis. 18 (4), 811-816 (1997).
- Kielbassa, C., Epe, B. DNA damage induced by ultraviolet and visible light and its wavelength dependence. Methods Enzymol. 319, 436-445 (2000).
- Kong, X., et al. Comparative analysis of different laser systems to study cellular responses to DNA damage in mammalian cells. Nucleic Acids Res. 37 (9), 68(2009).
- Lan, L., et al. In situ analysis of repair processes for oxidative DNA damage in mammalian cells. Proc Natl Acad Sci U S A. 101 (38), 13738-13743 (2004).
- Krasin, F., Hutchinson, F. Strand breaks and alkali-labile bonds induced by ultraviolet light in DNA with 5-bromouracil in vivo. Biophys J. 24 (3), 657-664 (1978).
- Krasin, F., Hutchinson, F. Double-strand breaks from single photochemical events in DNA containing 5-bromouracil. Biophys J. 24 (3), 645-656 (1978).
- Rosenstein, B. S., Setlow, R. B., Ahmed, F. E. Use of the dye Hoechst 33258 in a modification of the bromodeoxyuridine photolysis technique for the analysis of DNA repair. Photochem Photobiol. 31 (3), 215-222 (1980).
- Cremer, T., Peterson, S. P., Cremer, C., Berns, M. W. Laser microirradiation of Chinese hamster cells at wavelength 365 nm: effects of psoralen and caffeine. Radiat Res. 85 (3), 529-543 (1981).
- Limoli, C. L., Ward, J. F. A new method for introducing double-strand breaks into cellular DNA. Radiat Res. 134 (2), 160-169 (1993).
- Carlsson, K., Mossberg, K., Helm, P. J., Philip, J. Use of UV excitation in confocal laser scanning fluorescence microscopy. Micron and Microscopica Acta. 23 (4), 413-428 (1992).
- Stelzer, E. H. K., Haar, F. -M. Confocal Microscopy: Recent Developments. Advances in Imaging and Electron Physics. 106, 293-345 (1999).
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. J Cell Biol. 146 (5), 905-916 (1999).
- Tashiro, S., Walter, J., Shinohara, A., Kamada, N., Cremer, T. Rad51 accumulation at sites of DNA damage and in postreplicative chromatin. J Cell Biol. 150 (2), 283-291 (2000).
- Gassman, N. R., Stefanick, D. F., Kedar, P. S., Horton, J. K., Wilson, S. H. Hyperactivation of PARP triggers nonhomologous end-joining in repair-deficient mouse fibroblasts. PLoS One. 7 (11), 49301(2012).
- Bolin, C., et al. The impact of cyclin-dependent kinase 5 depletion on poly(ADP-ribose) polymerase activity and responses to radiation. Cell Mol Life Sci. 69 (6), 951-962 (2012).
- Godon, C., et al. PARP inhibition versus PARP-1 silencing: different outcomes in terms of single-strand break repair and radiation susceptibility. Nucleic Acids Res. 36 (13), 4454-4464 (2008).
- Hanssen-Bauer, A., et al. XRCC1 coordinates disparate responses and multiprotein repair complexes depending on the nature and context of the DNA damage. Environ Mol Mutagen. 52 (8), 623-635 (2011).
- Mortusewicz, O., Amé, J. C., Schreiber, V., Leonhardt, H. Feedback-regulated poly(ADP-ribosyl)ation by PARP-1 is required for rapid response to DNA damage in living cells. Nucleic Acids Res. 35 (22), 7665-7675 (2007).
- Mortusewicz, O., Leonhardt, H., Cardoso, M. C. Spatiotemporal dynamics of regulatory protein recruitment at DNA damage sites. J Cell Biochem. 104 (5), 1562-1569 (2008).
- Mortusewicz, O., Rothbauer, U., Cardoso, M. C., Leonhardt, H. Differential recruitment of DNA Ligase I and III to DNA repair sites. Nucleic Acids Res. 34 (12), 3523-3532 (2006).
- Solarczyk, K. J., Zarębski, M., Dobrucki, J. W. Inducing local DNA damage by visible light to study chromatin repair. DNA Repair (Amst). 11 (12), 996-1002 (2012).
- Gassman, N. R., Wilson, S. H. Micro-irradiation tools to visualize base excision repair and single-strand break repair. DNA Repair (Amst). 31, 52-63 (2015).
- Botchway, S. W., Reynolds, P., Parker, A. W., O'Neill, P. Use of near infrared femtosecond lasers as sub-micron radiation microbeam for cell DNA damage and repair studies. Mutat Res. 704 (1-3), 38-44 (2010).
- Ferrando-May, E., et al. Highlighting the DNA damage response with ultrashort laser pulses in the near infrared and kinetic modeling. Front Genet. 4, 135(2013).
- Lan, L., et al. Accumulation of Werner protein at DNA double-strand breaks in human cells. J Cell Sci. 118, Pt 18 4153-4162 (2005).
- Salmon, T. B., Evert, B. A., Song, B., Doetsch, P. W. Biological consequences of oxidative stress-induced DNA damage in Saccharomyces cerevisiae. Nucleic Acids Res. 32 (12), 3712-3723 (2004).
- Caldecott, K. W. DNA single-strand break repair. Exp Cell Res. 329 (1), 2-8 (2014).
- London, R. E. The structural basis of XRCC1-mediated DNA repair. DNA Repair (Amst). 30, 90-103 (2015).
- Moser, J., et al. Sealing of chromosomal DNA nicks during nucleotide excision repair requires XRCC1 and DNA ligase III alpha in a cell-cycle-specific manner. Mol Cell. 27 (2), 311-323 (2007).
- Campalans, A., et al. Distinct spatiotemporal patterns and PARP dependence of XRCC1 recruitment to single-strand break and base excision repair. Nucleic Acids Res. 41 (5), 3115-3129 (2013).
- Cooke, M. S., Lunec, J. Immunochemical detection of oxidative DNA damage. Vol. I. , World Scientific. 275-293 (2003).
- Rossner, P., Sram, R. J. Immunochemical detection of oxidatively damaged DNA. Free Radic Res. 46 (4), 492-522 (2012).
- Cleaver, J. E., Feeney, L., Revet, I. Phosphorylated H2Ax is not an unambiguous marker for DNA double-strand breaks. Cell Cycle. 10 (19), 3223-3224 (2011).
- Rybak, P., et al. Low level phosphorylation of histone H2AX on serine 139 (γH2AX) is not associated with DNA double-strand breaks. Oncotarget. 7 (31), 49574-49587 (2016).
- Haince, J. F., et al. PARP1-dependent kinetics of recruitment of MRE11 and NBS1 proteins to multiple DNA damage sites. J Biol Chem. 283 (2), 1197-1208 (2008).
- Caldecott, K. W. Single-strand break repair and genetic disease. Nat Rev Genet. 9 (8), 619-631 (2008).
- Lomax, M. E., Gulston, M. K., O'Neill, P. Chemical aspects of clustered DNA damage induction by ionising radiation. Radiat Prot Dosimetry. 99 (1-4), 63-68 (2002).
- Ma, W., Westmoreland, J. W., Gordenin, D. A., Resnick, M. A. Alkylation base damage is converted into repairable double-strand breaks and complex intermediates in G2 cells lacking AP endonuclease. PLoS Genet. 7 (4), 1002059(2011).
- Siddiqi, M. A., Bothe, E. Single- and double-strand break formation in DNA irradiated in aqueous solution: dependence on dose and OH radical scavenger concentration. Radiat Res. 112 (3), 449-463 (1987).
- Sano, Y., Watanabe, W., Matsunaga, S. Chromophore-assisted laser inactivation--towards a spatiotemporal-functional analysis of proteins, and the ablation of chromatin, organelle and cell function. J Cell Sci. 127, (Pt 8) 1621-1629 (2014).
- Wojtovich, A. P., Foster, T. H. Optogenetic control of ROS production. Redox Biol. 2, 368-376 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved