Method Article
חיזוי השתקת ג 'ין באמצעות שליטה Spatiotemporal של siRNA שחרור מ תגובה תגובה פולימרית פולימרית
In This Article
Summary
אנו מציגים שיטה חדשנית המשתמשת קופולימרים לחסום צילום תגובה עבור שליטה יעילה יותר spatiotemporal של השתקת הגן ללא תופעות לזיהוי מחוץ לגילוי. בנוסף, שינויים בביטוי גנים ניתן לחזות באמצעות מבחני שחרור siRNA פשוטים מודלים קינטיים פשוטים.
Abstract
חומרים חדשים ושיטות נדרשים כדי לשלוט טוב יותר מחייב לעומת שחרור של חומצות גרעין עבור מגוון רחב של יישומים הדורשים את הרגולציה המדויקת של פעילות הגן. במיוחד, חומרים חדשים עם תגובה לגירויים עם שליטה משופרת spatiotemporal על ביטוי גנים היה לפתוח פלטפורמות translatable של גילוי תרופות וטכנולוגיות רפואה משובי. יתר על כן, יכולת משופרת לשלוט על שחרור חומצות גרעין מחומרים תאפשר פיתוח של שיטות יעילות לחזות יעילות nanocarrier מראש , מה שמוביל לסקירה מואצת של כלי הלידה. להלן, אנו מציגים פרוטוקול לחיזוי יעילות השתקת גנים והשגת שליטה spatiotemporal על ביטוי גנים באמצעות מודולרי תגובה תגובה nanocarrier המערכת. RNA קטן המפריע (siRNA) הוא מורכב עם mPEG- b- פולי (5- (3 (אמינו) propoxy) -2-nitrobenzyl methacrylate) (mPEG- b -P (APNBMA)) פולימרים כדיRm יציב nanocarriers כי ניתן לשלוט עם אור כדי להקל על מתכוונן, on / off לשחרר siRNA. אנו מתאר שתי מבחני משלימים המעסיקים ספקטרוסקופיה מתאם פלואורסצנטי ג 'ל אלקטרופורזה עבור כימות מדויק של שחרור siRNA מ פתרונות חיקוי סביבות תאיים. מידע שנצבר מבחני אלה שולב לתוך הפרעה פשוטה RNAi (מודל RNAi) מודל קינטי לחזות את התגובות דינמי השתקה לתמונות שונות תמריצים התמונה. בתורו, אלה בתנאי הקרנה אופטימיזציה אפשרה חידוד של פרוטוקול חדש לשליטה spatiotemporally השתקת גנים. שיטה זו יכולה ליצור דפוסים סלולריים בביטוי גנים עם רזולוציה תאית לתא ולא תופעות לזיהוי היעד. יחדיו, הגישה שלנו מציעה שיטה קלה לשימוש לניבוי שינויים דינמיים בביטוי גנים ובדיוק שליטה על פעילות siRNA בחלל ובזמן. קבוצה זו של מבחני יכול להיות מותאם בקלות לבחון מגוון רחב של otשלה מגיבים מערכות הגירוי על מנת להתמודד עם אתגרים מרכזיים רלוונטי שפע של יישומים במחקר ביו רפואה ורפואה.
Introduction
קטן RNAs להפריע (siRNAs) לתווך שלאחר השתעת גן השתקה דרך מסלול RNAi קטליטי כי הוא ספציפי מאוד, חזק, ומותאם לכל גן יעד כמעט 1 . המאפיינים המבטיחים הללו אפשרו לתרופה siRNA להתקדם בניסויים קליניים בבני אדם לטיפול במחלות רבות, כולל מלנומה גרורתית ומופיליה 2 , 3 . עם זאת, בעיות משלוח משמעותיות נמשכות כי יש הפרעה תרגום 4 . בפרט, כלי אספקה צריך להישאר יציב ולהגן על siRNAs מ השפלה תאיים, אך גם לשחרר את המטען לתוך הציטופלסמה 5 . יתר על כן, יישומים רבים RNAi דורשים שיטות משופרות כדי להסדיר השתקת גנים בחלל ובזמן 6 , אשר תפחית תופעות לוואי בטיפול siRNA 7 ולאפשר טרנספורמטיביDvances ביישומים החל microarrays תא לגילוי סמים 8 אפנון של תגובות התא רגמות regenerative 9 . אתגרים אלה מדגישים את הצורך בחומרים ושיטות חדשים כדי לשלוט טוב יותר מחייב לעומת שחרור nanocarriers siRNA.
אחת האסטרטגיות המבטיחות ביותר לשליטה שחרור siRNA ושיפור הרגולציה spatiotemporal היא שימוש בחומרים מגיבים תגובה 10 . לדוגמה, מגוון רחב של biomaterials כבר מהונדסים עם שינוי זיקה חומצה גרעין לשינוי בתגובה לשינוי פוטנציאל החמצה או pH, או שדות מגנטיים מיושמים, אולטראסאונד, או אור 11 . למרות שרבות מהמערכות הללו מדגימות בקרה משופרת על פעילות חומצות גרעין, השימוש באור כגורם מפעיל הוא בעל יתרון מיוחד בשל תגובתו הזמנית המיידית, רזולוציה מרחבית מדויקת וקלות 12. יתר על כן, הפוטנציאל של טכנולוגיות רגישות לתמונות עבור ויסות ביטוי גנטי הוכיח על ידי המדינה- of-the-art מקדם מעורר ומערכות הרגולציה optogenetic; עם זאת, מערכות אלה סובלות מאתגרים רבים, כולל יכולות מוגבלות להסדרת גנים אנדוגניים, בעיות בטיחות כמו immunogenicity, וקשיים באספקה של הרכבות מרובות רכיבים 13 , 14 , 15 . צילום תגובה niocarriers siRNA הם אידיאליים כדי להתגבר על חסרונות אלה ולספק גישה פשוטה יותר חזקים spatiotemporally לווסת ביטוי גנים 16 , 17 , 18 . למרבה הצער, שיטות כדי לחזות במדויק את התגובה החלבון וכתוצאה מכך להישאר חמקמק.
האתגר העיקרי הוא כי הערכות כמותיות של שחרור siRNA הםנדיר 19 , 20 , ואפילו כאשר הערכות אלה מבוצעות, הם לא היו מצמידים לניתוחים של דינמיקה מחזור siRNA / חלבונים. הן כמות siRNA שפורסמו ההתמדה שלה / חיים הם הגורמים החשובים של הדינמיקה השתקת הגן שנוצר; לפיכך, חוסר מידע כזה הוא ניתוק מרכזי המונע חיזוי מדויק של מינון בתגובה RNAi 21 . התמודדות עם אתגר זה היה לזרז את ניסוח של מבנה המתאים תפקוד היחסים nanocarriers ולהודיע טוב יותר עיצובים ביולוגיים 22 . יתר על כן, גישות כאלה יאפשר פיתוח יעיל יותר פרוטוקולי מינון siRNA. בניסיון להבין את תגובת ההשתקה הדינמית, כמה קבוצות חקרו מודלים מתמטיים של RNAi 23 , 24 , 25 . מסגרות אלה היומוצלח במתן תובנות לשינויים בתיווך siRNA בביטוי גנטי וזיהוי צעדים להגבלת שיעור 26 . עם זאת, מודלים אלה יושמו רק על מערכות מסחריות של אספקת גנים ( למשל , Lipofectamine ו- polyethylenimine (PEI)) שאינם מסוגלים לשחרור siRNA מבוקר, והמורכבות של המודלים הגבילה מאוד את תועלתם 27 . חסרונות אלה מדגישים צורך בלתי מסופק עבור חומרים חדשים המסוגלים לשחרר siRNA מתכוונן בדיוק משולב עם מודלים קינטיים יעיל מנבא וקל לשימוש.
השיטה שלנו כתובות את כל האתגרים הללו באמצעות שילוב של פלטפורמה nanocarrier רגיש לאור עם שיטות מצמידים לכמת חינם siRNA מודל RNAi דינמיקה. בפרט, פלטפורמה SiRNA שלנו נשלט בדיוק של פלטפורמה 28 הוא פיקוח על ידי שתי שיטות משלימות לכימות מדוייק encapsulated לעומת unSiRNA כבול. הנתונים הניסוייים של מבחני אלה הם נכנסו מודל קינטי פשוט לחזות יעילות השתקת גנים מראש 29 . לבסוף, את on / off הטבע של nanocarriers הוא ניצל בקלות כדי ליצור דפוסי תאים ביטוי גנים עם שליטה מרחבית על אורך הסלולרי. לכן, שיטה זו מספקת שיטה להתאמה בקלות לשלוט ולחזות השתקת גנים במגוון של יישומים אשר ייהנו רגולציה spatiotemporal של התנהגות התא.
Protocol
1. ניסוח של niocarriers siRNA
- הכן פתרונות נפרדים של siRNA ו- mPEG- b- AP (APNBMA) עם כמויות שוות בדילול של 20 מ"מ -4 (2-hydroxyethyl) piperazine-1-ethanesulfonic חומצה (HEPES) חיץ ב pH 6.0.
- הוסף siRNA בריכוז של 32 מיקרוגרם / מ"ל ל 20 מ"מ פתרון HEPES.
הערה: ה- siRNA היה רצף בקרה שלילי לא ממוקד, אוניברסלי; עם זאת, siRNA יכול להיות מתוכנן להתמקד כל גן של עניין. - ממיסים mPEG- b- AP (APNBMA) פולימרים לתוך פתרון HEPES 20 מ"מ. הוסף כמות מתאימה של mPEG- b- AP (APNBMA) כדי ליצור פתרון של 220 מיקרוגרם / מ"ל כך שהיחס N / P (N, קבוצות amine ב- mPEG- b- AP (APNBMA), P, קבוצות פוספט ב- siRNA) הוא 4.
הערה: פרוטוקול סינתטי של פולימרים mPEG- b- AP (APNBMA) הוא דיווח במקום אחר 30 .
- הוסף siRNA בריכוז של 32 מיקרוגרם / מ"ל ל 20 מ"מ פתרון HEPES.
- הוסף את הפתרון mPEG- b- AP (APNBMA) ל- dropwise שווהE של הפתרון siRNA תוך ערבוב בעדינות על מכונת מערבולת. המשך מערבולת עבור 30 הבא פולימר נוסף. דגירה דגימות בחושך בטמפרטורת החדר למשך 30 דקות.
2. מדידת שחרור siRNA באמצעות ג'ל אלקטרופורזה
- ניסוח nanocarriers לפי הצעדים 1.1-1.2, ואת קנה המידה את הכרכים כדי להתאים את מספר דגימות הרצוי.
- מערבבים את ננוקרייר עם נתרן dodecyl סולפט (SDS).
- הכן פתרון 1 מ"ג / מ"ל של SDS במים. Aliquot את כמות הפתרון SDS הצורך לייצר פתרונות עם יחס S / P (S, קבוצות סולפט על SDS, P, קבוצות פוספט על siRNA) של 15.
הערה: אם הפתרון polyplex מכיל 1 מיקרוגרם של siRNA, 13 מיקרוגרם של SDS יש להוסיף כדי להשיג יחס S / P של 15. - הוסף את פתרון SDS לכל dropwise פתרון nanocarrier תוך בעדינות ערבוב על מכונת מערבולת. המשך למערבולת למשך 30 שניות לאחר הוספת SDS.
- צנטריפוגה דגימות ב XG 3000 במשך 5 s. דגירה דגימות בחושך בטמפרטורת החדר למשך 30 דקות.
- הכן פתרון 1 מ"ג / מ"ל של SDS במים. Aliquot את כמות הפתרון SDS הצורך לייצר פתרונות עם יחס S / P (S, קבוצות סולפט על SDS, P, קבוצות פוספט על siRNA) של 15.
- כייל ולהגדיר לייזר UV עם מסנן 365 ננומטר בעוצמה של 200 W / m. ודא כי עוצמת האור נמדדת מהמיקום שבו את החלק התחתון של הפתרון המדגם יהיה יושב.
- טען את הפתרון nanocarrier / SDS לתוך תא זכוכית המורכב זכוכית שקופיות מופרדים על ידי אטם גומי.
- טרום לשטוף שקופיות זכוכית פתרון 7: 3 (V / V) אתנול / מים במים ויבש לחלוטין. חותכים חור (~ 2 x 3 ס"מ מלבן) לתוך אטם גומי. מניחים את אטם גומי על שקופית זכוכית.
- פיפטה את nanocarrier / פתרון SDS על השקופית זכוכית בתוך החור של אטם גומי. טען עודף של פתרון (20 μL עודף) על גבי שקופית זכוכית תוך הימנעות ממגע עם אטם גומי.
הערה: נוזל כלשהו יאבדו במהלך השלבים הבאים. - מניחים את הכוס השנייההחלק העליון של השקופית אטם. כדי למנוע את הדור בועה אוויר, במקום אחד בקצה של השקופית למטה ולאחר מכן לאט לאט להוריד את הקצה השני.
- צרף קליפים בינדר לכל צד של החדר זכוכית להחזיק אותו סגור.
- מסננים את הדגימות עבור אורך הזמן הרצוי ( למשל , 0-60 דקות) באמצעות לייזר UV עם מסנן 365 ננומטר בעוצמה של 200 W / m. הסר את קליפים קליפ ולפתוח את החדר.
- פיפטה 25 μL של nanocarrier מוקרן / SDS דגימות לתוך צינור microcentrifuge. דגירה הפתרונות בחושך בטמפרטורת החדר למשך 30 דקות.
- הכן 2% ag% agarose ג'ל מוכתם מראש עם 0.5 מיקרומטר / מ"ל ethidium bromide ב Tris / Borate / EDTA (TBE) שנאגרו פתרון על פי פרוטוקולים סטנדרטיים 31 . הכן חיץ טוען המורכב של 3: 7 (V / V) גליצרול / מים.
- הוסף 5 μL של פתרון חיץ טעינה μL 25 של כל nanocarrier / SDS מדגם. דגירה דגימות בחושך בטמפרטורת החדר למשך 10 דקות.
- טען 30 μL של כל מדגם nanocarrier / SDS לתוך ג'ל agarose 2%. הפעל את הג'ל בחושך ב 100 V במשך 30 דקות. תמונה ג'ל באמצעות מערכת הדמיה ג'ל עם מסנני ethidium bromide. שמור את קבצי התמונה ג'ל והמשך לשלב 2.10 עבור כימות עוצמת הלהקה. ודא כי עוצמות הלהקה בהירות מספיק כדי להבהיר בבירור אבל לא בהיר מדי, כי האותות רוויים.
- לכמת את עוצמות הלהקה באמצעות הציבור זמין ImageJ תוכנה 32 .
- באמצעות כלי ההחזר על ההשקעה של ImageJ, לקבוע את עוצמת הקרינה של להקות siRNA חינם בכל נתיב על ידי ציור מלבן סביב כל הלהקה. מקמו את עקומות העוצמה של כל נתיב, ושילבו את השטח מתחת לעיקולים על ידי ציור קו אופקי על פני עקומות העוצמה ולחיצה על שרביט העקיבה בתוך האזורים הסגורים.
- לחשב את העוצמה היחסית של כל נתיב על ידי חלוקת השטח תחת cuRve של כל מדגם על ידי האזור מתחת לעיקול של שליטה חיובית siRNA (לא mPEG- b- AP (APNBMA) הוסיף ולא SDS הוסיף). דווח על אחוז siRNA שוחרר כמו עוצמת הלהקה מנורמל של כל מדגם.
3. מדידה siRNA שחרור באמצעות ספקטרוסקופיה קורלציה פלואורסצנטי (FCS)
- השג siRNA שכותרתו עם fluorophore אחת בקצה 5 'של גדיל את החושים.
הערה: את siRNA ניתן לרכוש מראש annealed עם תוויות מצומדות במיקום הרצוי. Fluorophore צריך להיות תמונה יציבה לקלוט / לפלוט בין 450 ל 750 ננומטר, כדי למנוע מרווה אור UV והעברת אנרגיה עם mPEG- b- AP (APNBMA). - ניסח את ננו על פי צעדים 1.1-1.2 באמצעות siRNA שכותרתו. קנה מידה את הכרכים כדי להתאים את מספר הדגימות הרצוי.
- דגירה של פתרונות SDS ו להקרין למשך הזמן הרצוי על פי הצעדים 2.2-2.6.
- הכנהAtion של חדר המדגם FCS.
- לשטוף שקופית זכוכית עם פתרון 7: 3 (V / V) אתנול / מים לחלוטין יבש את הזכוכית באמצעות לנגב זרם אוויר.
- הסר את פיסות הנייר מתוך spacer דבק דו צדדי לחשוף מרווח כפול דבק צדדית. צרף את spacer כדי coverslip זכוכית.
- פיפטה את nanocarrier / פתרון SDS על כיסוי להחליק באמצע החור מן spacer דבק.
- מניחים את שקופיות הזכוכית על גבי coverslip. לדחוף על שקופית הזכוכית כדי להבטיח כי שקופיות זכוכית coverslip מחוברים היטב טופס חותם.
- השתמש מיקרוסקופ confocal למדידות FCS 33 . השתמש 40X מים טבילה apochromat אובייקט עם הצמצם המספרי של 1.2. השתמש בערוץ לייזר עירור המתאים (488 ננומטר) לאסוף לפחות 30 מדידות של 10 שניות כל מדגם 34 . ודא כי עוצמת הלייזר יישור גלאי להישאראותו דבר עבור כל מדגם.
- בנוסף דגימות ניסיוני, למדוד שולטת כולל: מדגם ריק ללא תווית siRNA; ו מדגם siRNA חינם עם siRNA שכותרתו אבל לא mPEG- b- AP (APNBMA).
- ניתוח הנתונים באמצעות תוכנה ספציפית FCS. לזהות את שיעור לספור את הבסיס של כל מדגם על ידי קביעת שיעור ספירה יציבה במהלך זמן, כאשר nanocarriers לא עוברים דרך נפח confocal 29 .
- הפחת את שיעור הספירה של המדגם ריק מכל דגימה בסיסית ערך שיעור ספירה. לנרמל את הערכים שהתקבלו כדי לשלוט siRNA חינם כדי לחשב את אחוז siRNA חינם 35 .
4. מודלים קינטיים לחזות השתקת גנים
- יצירת סקריפטים בשפה תכנות מתמטית באמצעות קבוצה פשוטה של משוואות דיפרנציאלי רגילים לחזות השתקת גנים 29.
הערה: ניתן ליצור סקריפטים לפי בקשה.- כתוב את סט משוואות דיפרנציאליות רגילות כ:
 (1)
(1)  (2)
(2) 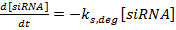 (3)
(3)
הערה: עבור משוואות 1-3, את תנאי k mRNA , k siRNA , ו K מגן הם קבועים קצב לייצור mRNA, siRNA, וחלבון, בהתאמה. המונחים k מ ', deg , k ים, deg , ו p p, deg הם קבועים קצב עבור השפלה של mRNA, siRNA, וחלבון, בהתאמה. דרגי דרגה מדורגים מחושבים על בסיס הרכיב חצי חיים, וקבועים קצב הייצור הם בכושר כדי להבטיח כי mRNA וחלבון מצב יציב ערכים מגיעים בהיעדר oF siRNA.- לקבוע את מחצית חייהם של ה- mRNA והחלבון עבור הגן (ים) של עניין, בין אם בניסוי המתואר בהתייחסות 36 ובין בספרות (ראה דיון ). כמו כן, לקבוע את זמן הכפלת הקו התא. הזן ערכים אלה לתוך הביטויים המתאימים של שיעור השפלה.
- כוונן את קצב ייצור הקצב כך רמות ביטוי גנים להישאר יציב על ערך מנורמל של 100 אם לא siRNA הוא הציג. באופן ספציפי, להגדיר [siRNA] לאפס ולגוון את הערכים של ה- mRNA k, k siRNA, ואת קבועי קצב הייצור k prot עד [mRNA] ו [חלבון] להישאר בתוך 1% משווי מנורמל הראשונית של 100% למשך את הסימולציה.
- באמצעות כמויות יחסית של siRNA שוחרר מן ג'ל אלקטרופורזה המתואר בעבר מבחני FCS כמו הערכות, להתאים את הריכוז היחסי ההתחלתי של siRNA בסקריפט. באופן ספציפי, לשנות [siRNA] להיות פרופורציונלי לסכום היחסי של siRNA שפורסמו, עם ערך של 100 המקביל לסכום המקסימלי 29 .
- כתוב את סט משוואות דיפרנציאליות רגילות כ:
5. תרבית תאים במשלוח siRNA Vitro
- תרבות NIH / 3T3 fibroblasts עובריים Murine על פי הפרוטוקולים של הספק.
- לגדל את התאים במדיום הצמיחה (Dulbecco השתנה הנשר בינוני (DMEM) בתוספת 10% חום- inactivated עוברית בסרום ו 1% פניצילין סטרפטומיצין). לשמור על התאים ב 37 מעלות צלזיוס בסביבה humidified עם 5% CO 2 .
- זרע את התאים 6-גם תרבות רקמות מטופלים צלחות.
- בצע את ההליך המומלץ תת-תרמי מהספק. ספירת התאים באמצעות hemocytometer. לדלל את התאים בתקשורת הצמיחה בתוספת לריכוז של 75,000 תאים / מ"ל.
- הוסף 2 מ"ל של ההשעיה התא (75,000 תאיםS / mL) היטב כל צלחת 6-היטב. בואו התאים לדבוק להתאושש במשך 24 שעות בחממה.
- הכן את התאים transfection ידי שטיפה עם פוספט שנאגרו מלוחים (PBS) והוספת 1.5 מ"ל של סרום ואנטיביוטיקה ללא transfection בינוני (ראה טבלה של חומרים ) על כל טוב.
- ניסח את nanocarriers siRNA לפי הצעדים 1.1-1.2. הוסף 25 μL של פתרון nanocarrier המכיל 30 pmol של siRNA לכל טוב. בעדינות פיפטה התקשורת למעלה ולמטה כדי לערבב. מניחים את התאים באינקובטור במשך 3 שעות.
- הסר את התקשורת transfection ולשטוף היטב עם PBS. הוסף 1 מ"ל של התקשורת הצמיחה בתוספת מקום התאים באינקובטור להתאושש במשך 30 דקות.
- כדי להכין את התאים לטיפול עם גירוי צילום, להסיר את התקשורת הצמיחה נוספה. הוסף 1 מ"ל של התקשורת transfection (ללא פנול אדום) לכל טוב.
הערה: ודא כי התקשורת transfection אינו מכיל פנול אדום. - כייל ולהגדיר לייזר UV עם מסנן 365 ננומטר בעוצמה של 200 W / m. ודא כי עוצמת האור נמדדת מהמיקום שבו את החלק התחתון של צלחת התא יהיה יושב.
- מניחים את התאים על צלחת חמה מוגדר 37 מעלות צלזיוס. הסר את מכסה הצלחת של התאים. מסננים את התאים מעל צלחת הזמן הרצוי (עד 20 דקות) באמצעות לייזר UV עם מסנן 365 ננומטר בעוצמה של 200 W מ -2 .
- הסר את התקשורת transfection ולהוסיף 2 מ"ל של התקשורת הצמיחה בתוספת. מקום באינקובטור עד ניתוח נוסף ( למשל , 24 שעות qPCR ו 48 שעות עבור סופג המערבי).
- למדוד שינויים ביטוי גנים באמצעות מגוון רחב של טכניקות כגון המערבי סופג 37 ו qPCR. 38 עבור גנים עם אותות גלויים, כגון GFP, השתמש מיקרוסקופ פלואורסצנטי 29 .
הערה: טכניקות אלו מוצעות בשל קלות השימוש והדיוק שלהןלכמת ביטוי גנטי
- למדוד שינויים ביטוי גנים באמצעות מגוון רחב של טכניקות כגון המערבי סופג 37 ו qPCR. 38 עבור גנים עם אותות גלויים, כגון GFP, השתמש מיקרוסקופ פלואורסצנטי 29 .
6. שליטה השתקה ג 'ין במנהג Spatiotemporal
- תרבות, זרע, transfect תאים לפי הצעדים 5.1-5.7.
- הכן photomask כי לחלוטין חוסם 365 ננומטר אור וממזער השתקפויות.
הערה: במקרה זה, 10 x 10 ס"מ חתיכות של נייר אלומיניום נייר בנייה שחור שימשו לחסום את האור כדי להפחית את השתקפויות, בהתאמה. נייר אלומיניום ונייר הבנייה היו מודבקים יחד כדי ליצור יחידה אחת.- גזור / אגרוף / מכונה את הצורה הרצויה לתוך photomask. לדוגמה, השתמש להב חד-פעמי וחריץ-חורים ליצירת תבנית קו ישר (~ 5 ס"מ אורך) ודפוס עגול (~ 7 מ"מ קוטר) של photomask, בהתאמה.
- דבק photomask לתחתית של צלחת 6-היטב עם דפוס מרוכז מתחת היטב המכיל את התאים עם הצד האנטי רעיוני ( למשל , שחור cנייר onstruction) מול הצלחת. ודא כי הדבק אינו ממוקם ליד הקצה (בתוך ~ 3 מ"מ) של התבנית.
- הגדר שתי הטבעות עומד כ 25 ס"מ זה מזה ולצרף פלטפורמה לכל טבעת לעמוד כך פלטפורמות הם בגובה שווה. להשעות את צלחת התא בין שני עומד על ידי הנחת צלחת על גבי פלטפורמות. ודא כי הצלחת היא ברמה.
- מסננים את התאים מתחת למדגם עבור הזמן הרצוי (עד 20 דקות) באמצעות לייזר UV עם מסנן 365 ננומטר בעוצמה של 200 W / m 2 .
- הסר את התקשורת transfection ולהוסיף 2 מ"ל של התקשורת הצמיחה בתוספת. מקום באינקובטור להתאושש לפחות 24 שעות. תמונה התאים באמצעות מיקרוסקופ פלואורסצנטי כמתואר 29 .
תוצאות
בעקבות ניסוח של nanocarriers, מבחני שחרור siRNA נערכו כדי ליידע את תנאי הקרנה לשמש transfections במבחנה . מינונים שונים של אור יושמו כדי לקבוע את אחוז siRNA אשר שוחרר. Assay הראשון המשמש ג'ל אלקטרופורזה להפריד את מולקולות siRNA חינם מן מולקולות siRNA עדיין מורכבים / הקשורים עם הפולימר. Nanocarriers שלא טופלו באור נשאר יציב ולא לשחרר כל siRNA. כמו משך הזמן הקרינה גדל, עוצמת הקרינה של להקות siRNA חינם גדל. כימות של עוצמות הלהקה באמצעות תוכנת ניתוח תמונה הראו כי ~ 15% של siRNA שוחרר לאחר 20 דקות של חשיפה לאור.
השני assi שחרור siRNA בשימוש FCS למדוד את אחוז המולקולות siRNA שהיו באופן חופשי diffusing ב סולהזהירות. שיעורי לספור את הבסיס של דגימות המכילות את ננוקריירים כי לא נחשפו לאור היו כמו שיעורי לספור את המדגם ריק מאגר חיץ, המציין כי לא siRNA חינם היה נוכח. שיעורי הספירה הבסיסית גדלו עם עליית זמן ההקרנה. אחוז siRNA חינם חושבה ונמצא להיות בהסכמה עם המדידות המתקבלות אלקטרופורזה ג'ל. בדרך כלל, האומדנים של שתי הטכניקות היו בתוך שגיאה של אחד את השני (p> 0.05 על ידי סטודנט של מבחן T) והראה כי אחוז siRNA שוחרר לא להגדיל באופן משמעותי עם יותר מ 20 דקות של הקרנה. חשוב לציין כי ג 'ל אלקטרופורזה ו FCS שימשו לכמת שחרור siRNA כי הם קלים לשימוש, מהר יחסית לנתח, ולספק תוצאות מדויקות.
כמויות יחסית של siRNA שפורסמו לאחר מינונים שונים של האור הוזנו כמו siRN הראשוניתריכוז במודל הקינטי. כפי שמוצג בתרשים 1A , המודל היה לרוץ כדי לחזות את הריכוזים של glyceraldehyde 3-פוספט dehydrogenase (GAPDH) mRNA, חלבון, ו siRNA כפונקציה של זמן תחת כל תנאי הקרנה. התחזיות המודל עבור רמות ביטוי חלבון GAPDH היו בהסכמה עם רמות ביטוי ניסויים שנקבעו שהושגו באמצעות סופג המערבי ( איור 1 ב ). בפרט, את רמת חלבון GAPDH לידי ביטוי ירד עם הזמן קרינה גדל. תאים אשר היו מוקרן במשך פרק הזמן הארוך ביותר (20 דקות) הציג את השינויים הגדולים ביותר ביטוי גנים כי כמויות גדולות יותר של siRNA שוחררו. חשוב לציין, תאים שלא נחשפו לאור לא הציגו שום נוקדון גנטי, מה שמראה כי nanocarriers שמר תרדמה ולא לשחרר כל siRNA אלא אם מופעלות על ידי גירוי תמונה. מבחני ציטוטוקסיות הראו כי NIH / 3T3 תאיםמתוחזק ≥ 90% כדאיות לאחר הטיפול nanocarriers ו 20 דקות של הקרנה 28 .
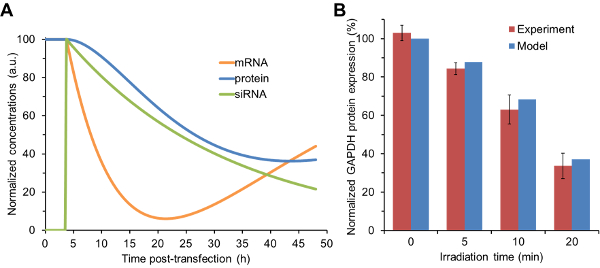
איור 1 : תחזיות מידול קינטי לעומת ניסויים שנקבעו באופן ניסיוני בביטוי חלבונים. ( א ) נתוני שחרור siRNA המתקבל ג'ל אלקטרופורזה שימשו לווסת את הריכוז הראשוני של siRNA במודל הקינטי. גרפים אלה מייצגים את פלט המודל עבור תאים המקבלים 20 דקות של הקרנה. ( ב ) כמויות יחסית של siRNA מכל מצב הקרנה הוכנסו המודל הקינטי לחזות שינויים בביטוי חלבון. תחזיות אלה הושוו רמות ביטוי חלבון GAPDH המתקבל מנתח סופג המערבי. התוצאות מוצגות כסטיית תקן ± dAta המתקבל משלושה דגימות עצמאיות. נתוני הניסוי הודפסו בחלקם באישור מסמ '29 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
כדי לשלוט על השתקת גנים באופן spatiotemporal, photomask שימש להגבלת אוכלוסיות הסלולר ספציפיים לגירוי תמונה. כפי שמוצג באיור 2 , הביטוי GFP בתאים נשלט באופן מרחבי בדפוס מעגלי. תאים שהיו מוגנים מפני האור הציג עוצמות הקרינה כי היו נבדלים מדגמים שליטה לא מטופלים עם siRNA ואור. עם זאת, כמעט כל התאים בתוך דפוס מעגלי הציג שום ביטוי GFP, המעיד על שחרור siRNA יעיל הגן מציאה. יתר על כן, השימוש באור כגורם מופעלת מאפשר ביטוי גנים להיות שליטההוביל על סולמות אורך הסלולר.

איור 2 : שליטה מרחבית על השתקת גנים. NIH / 3T3 תאים היו שיתוף transfected עם gFP pDNA המכילים lipoplexes ו- GFP מיקוד siRNA / mPEG- b- AP (APNBMA) nanocarriers. Photomask עגול הוחל לפני הקרנה עם אור 365 ננומטר במשך 20 דקות. התאים היו צילמו על מיקרוסקופ פלואורסצנטי 48 שעות שלאחר transfection. הקו האדום מקווקו מייצג את קצה photomask, ואת סרגל קנה מידה מייצג 1 מ"מ. מותאמת באישור מעיון 29 . אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Discussion
ישנם מספר צעדים בשיטה קריטיים במיוחד. כאשר ניסוח nanocarriers, את הסדר של תוספת רכיב מהירות ערבוב הם שני פרמטרים חשובים המשפיעים על יעילות 39 . פרוטוקול זה דורש כי רכיב cationic, mPEG- b- AP (APNBMA), נוסף מרכיב anionic, siRNA, בצורה dropwise בזמן vortexing. בהתאם נפח ניסוח הכולל, תהליך זה ערבוב לוקח 3-6 s. כדי לבדוק אם nanocarriers נוצרו כראוי, למדוד את התפלגות גודל באמצעות טכניקה כגון פיזור אור דינמי. MPEG- b- AP (APNBMA) / niocarriers siRNA עם יחס N / P של 4 יש קוטר ממוצע של 140 nm ~ ו polydispersity של ~ 0.2 28 . יתר על כן, יחס N / P יכול להיות מגוונות כדי להשיג polyplexes עם גדלים / יציבות שונים. יחס N / P של 4 נבחר במחקרים אלו משום שהוא היה היחס הנמוך ביותר שאיפשר השלמה מלאה ועלימכרה של מכתים ethidium bromide.
פרמטר נוסף קריטי בשיטה כרוכה תוספת של SDS לפתרונות nanocarrier של מבחני שחרור siRNA. SDS, פעילי שטח anionic, שימש כדי לדמות טוב יותר סביבות תאיים המכילים ריכוזים גבוהים של ממברנות שומנים polyanions 29 , 40 . יחס S / P חייב להיות גבוה מספיק כדי לחקות את השפע של ליפידים anionic נוכחים בתאים, אבל לא כל כך גדול כי ננוקרייר לפרק לפני גירוי תמונה ועוד ניתוחים. טווח של S / P ratios צריך להיבדק באמצעות ג'ל אלקטרופורזה כדי לזהות את הסכום המקסימלי של SDS שניתן להוסיף ללא שחרור siRNA. פרוטוקול זה נעשה שימוש גבוה יחסית יחס S / P של 15.
מגבלה פוטנציאלית של שיטה זו קשורה למודל הקינטי. המודל דורש את הקלט של mRNA וחלבון מחצית החיים של הגן של עניין. טרנובשיעורי גנים שנחקרו היטב נמצאים בספרות; עם זאת, מידע זה עשוי שלא להיות זמין עבור כל הגנים. כדי לעקוף את הנושא הזה, מחצית חייהם של גנים דומים ניתן למצוא בספרות כדי לספק הערכות. לחלופין, שיעורי מחזור עבור הגן הספציפי של עניין ניתן לקבוע באופן ניסיוני 36 . חשוב גם לציין כי מידע עבור אלפי גנים ניתן למצוא נתונים 41 הידור נתונים.
פרמטר מפתח נוסף בשיטה זו הוא סוג התא. NIH / 3T3 fibroblasts שימשו מחקרים אלה בתור קו תא מודל כי הם נחקרו בהרחבה, קל לעבוד עם, והם ישימים למספר יישומי רפואה רגנרטיבית. עם זאת, פרוטוקול ניתן להחיל על סוגי תאים אחרים של עניין. ניסוח nanocarrier ייתכן שיהיה צורך אופטימיזציה עבור סוג התא הספציפי.
לסיכום, שיטה זו enAbles הקביעה המהירה של תנאי הקרנה כדי spatiotemporally לשלוט siRNA לשחרר לחזות את השתקת הגן מראש . שיטה זו תהיה להתאמה בקלות אחרים תגובה תגובה חומצה גרעין מערכות. לדוגמה, הפולימרים mPEG- b- AP (APNBMA) עשויים להשתנות על-ידי כוונון אורכי החסימה ו / או תפקודים פונקציונליים כדי להתאים את ההתנהגות הרגישה לתמונה של הננו-אקרירים 42 . שימוש בפרוטוקול זה יעזור להבהיר את מבנה יחסי תפקוד השולטים יציבות nanocarrier ויעילות. תובנות מכניסטיות אלה עשויות לאפשר ליישומים ברפואה רגנרטיבית המחייבים שליטה מלאה על השתקת גנים. יתר על כן, בשל עומק החדירה הטבועה של 365 ננומטר אור ברקמות מימיות, ניסוחים אלה מתאימים היטב לטיפול במחלות לידי ביטוי על פני הגוף כגון סרטן העור ופצעים אקטואלי.
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
המחברים מודים למוסד הלאומי למדעי הרפואה הכללית של המכונים הלאומיים לבריאות (NIH) לתמיכה כספית באמצעות פרס פיתוח מוסדי (IDeA) תחת מספר מענק P20GM103541 וכן מענק מספר P20GM10344615. ההצהרות המובאות כאן אינן משקפות את עמדות ה - NIH. כמו כן, אנו מכירים את המכון הביוטכנולוגי של דלאוור (DBI) ואת משרד הפיתוח הכלכלי של דלאוור (DEDO) לתמיכה כספית באמצעות פרס המרכז למדעי החיים (Bioscience CAT) (12A00448).
Materials
| Name | Company | Catalog Number | Comments |
| siRNA | Sigma-Aldrich | SIC001 | non-targeted, universal negative control |
| mPEG-b-P(APNBMA) | synthesized in our lab | N/A | photo-responsive polymer |
| HEPES | Fisher Scientific | BP310-100 | |
| sodium dodecyl sulfate | Sigma-Aldrich | 436143 | |
| rubber gasket | McMaster-Carr | 3788T21 | 0.5 mL thick |
| UV laser | Excelitas Technologies | Omnicure S2000 | collimating lens and 365 nm filter used |
| agarose | Fisher Scientific | BP160-100 | |
| ethidium bromide | Fisher Scientific | BP1302-10 | |
| siRNA labelled with Dy547 | GE Healthcare Dharmacon, Inc. | custom order | fluorophore conjugated to 5’ end of sense strand |
| microscope slide | Fisher Scientific | 12-550-A3 | pre-cleaned glass |
| Secure-Seal Spacer | Life Technologies | S24735 | double-sided adhesive |
| LSM 780 | Carl Zeiss | N/A | confocal microscope |
| ZEN 2010 | Carl Zeiss | N/A | FCS analysis software |
| MATLAB | MathWorks | N/A | programming language |
| NIH/3T3 cells | ATCC | ATCC CRL-1658 | |
| DMEM | Mediatech | 10-013-CV | growth media |
| fetal bovine serum | Mediatech | 35-011-CV | heat-inactivated |
| penicillin-streptomycin | Mediatech | 30-002-CI | |
| 6-well plates | Fisher Scientific | 08-772-1B | |
| Opti-MEM | Life Technologies | 11058021 | transfection media |
References
- Forbes, D. C., Peppas, N. A. Oral delivery of small RNA and DNA. J Control Release. 162 (2), 438-445 (2012).
- Davis, M. E., et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature. 464 (7291), 1067-1070 (2010).
- Bouchie, A. Companies in footrace to deliver RNAi. Nat Biotechnol. 30 (12), 1154-1157 (2012).
- Burke, P. A., Pun, S. H., Reineke, T. M. Advancing Polymeric Delivery Systems Amidst a Nucleic Acid Therapy Renaissance. ACS Macro Lett. 2 (10), 928-934 (2013).
- Gooding, M., Browne, L. P., Quinteiro, F. M., Selwood, D. L. siRNA Delivery: From Lipids to Cell-penetrating Peptides and Their Mimics. Chem Biol Drug Des. 80 (6), 787-809 (2012).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nat Chem Biol. 10 (3), 196-202 (2014).
- Wang, X., Chen, X., Yang, Y. Spatiotemporal control of gene expression by a light-switchable transgene system. Nat Methods. 9 (3), 266-269 (2012).
- Ziauddin, J., Sabatini, D. M. Microarrays of cells expressing defined cDNAs. Nature. 411 (6833), 107-110 (2001).
- Saltzman, W. M., Olbricht, W. L. Building drug delivery into tissue engineering. Nat Rev Drug Discov. 1 (3), 177-186 (2002).
- Mura, S., Nicolas, J., Couvreur, P. Stimuli-responsive nanocarriers for drug delivery. Nat Mater. 12 (11), 991-1003 (2013).
- Shim, M. S., Kwon, Y. J. Stimuli-responsive polymers and nanomaterials for gene delivery and imaging applications. Adv Drug Delivery Rev. 64 (11), 1046-1058 (2012).
- Kelley, E. G., Albert, J. N. L., Sullivan, M. O., Epps, T. H. Stimuli-responsive copolymer solution and surface assemblies for biomedical applications. Chem Soc Rev. 42 (17), 7057-7071 (2013).
- Weber, W., Fussenegger, M. Emerging biomedical applications of synthetic biology. Nat Rev Genet. 13 (1), 21-35 (2012).
- Konermann, S., et al. Optical control of mammalian endogenous transcription and epigenetic states. Nature. 500 (7463), 472-476 (2013).
- Shimizu-Sato, S., Huq, E., Tepperman, J. M., Quail, P. H. A light-switchable gene promoter system. Nat Biotechnol. 20 (10), 1041-1044 (2002).
- Huschka, R., et al. Gene Silencing by Gold Nanoshell-Mediated Delivery and Laser-Triggered Release of Antisense Oligonucleotide and siRNA. ACS Nano. 6 (9), 7681-7691 (2012).
- Li, H. -J., Wang, H. -X., Sun, C. -Y., Du, J. -Z., Wang, J. Shell-detachable nanoparticles based on a light-responsive amphiphile for enhanced siRNA delivery. R Soc Chem Adv. 4 (4), 1961-1964 (2014).
- Braun, G. B., et al. Laser-Activated Gene Silencing via Gold Nanoshell-siRNA Conjugates. ACS Nano. 3 (7), 2007-2015 (2009).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nat Biotechnol. 31 (7), 638-646 (2013).
- Wittrup, A., et al. Visualizing lipid-formulated siRNA release from endosomes and target gene knockdown. Nat Biotechnol. 33 (8), 870-876 (2015).
- Roth, C. M. Quantitative measurements and rational materials design for intracellular delivery of oligonucleotides. Biotechnol Prog. 24 (1), 23-28 (2008).
- Mao, S., et al. Influence of polyethylene glycol chain length on the physicochemical and biological properties of poly(ethylene imine)-graft-poly(ethylene glycol) block copolymer/SiRNA polyplexes. Bioconjugate Chem. 17 (5), 1209-1218 (2006).
- Raab, R. M., Stephanopoulos, G. Dynamics of gene silencing by RNA interference. Biotechnol Bioeng. 88 (1), 121-132 (2004).
- Cuccato, G., et al. Modeling RNA interference in mammalian cells. BMC Systems Biology. 5, 1(2011).
- Varga, C. M., Hong, K., Lauffenburger, D. A. Quantitative analysis of synthetic gene delivery vector design properties. Mol Ther. 4 (5), 438-446 (2001).
- Chen, H. H., et al. Quantitative comparison of intracellular unpacking kinetics of polyplexes by a model constructed from quantum Dot-FRET. Mol Ther. 16 (2), 324-332 (2008).
- Bartlett, D. W., Davis, M. E. Insights into the kinetics of siRNA-mediated gene silencing from live-cell and live-animal bioluminescent imaging. Nucleic Acids Res. 34 (1), 322-333 (2006).
- Foster, A. A., Greco, C. T., Green, M. D., Epps, T. H., Sullivan, M. O. Light-Mediated Activation of siRNA Release in Diblock Copolymer Assemblies for Controlled Gene Silencing. Adv Healthc Mater. 4 (5), 760-770 (2015).
- Greco, C. T., Epps, T. H., Sullivan, M. O. Mechanistic Design of Polymer Nanocarriers to Spatiotemporally Control Gene Silencing. ACS Biomater Sci Eng. 2 (9), 1582-1594 (2016).
- Green, M. D., et al. Catch and release: photocleavable cationic diblock copolymers as a potential platform for nucleic acid delivery. Polym Chem. 5 (19), 5535-5541 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923(2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Marquer, C., Leveque-Fort, S., Potier, M. C. Determination of Lipid Raft Partitioning of Fluorescently-tagged Probes in Living Cells by Fluorescence Correlation Spectroscopy (FCS). J Vis Exp. (62), (2012).
- Staaf, E., Bagawath-Singh, S., Johansson, S. Molecular Diffusion in Plasma Membranes of Primary Lymphocytes Measured by Fluorescence Correlation Spectroscopy. J Vis Exp. (120), e54756(2017).
- Buyens, K., et al. Monitoring the disassembly of siRNA polyplexes in serum is crucial for predicting their biological efficacy. J Control Release. 141 (1), 38-41 (2010).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad. Sci U S A. 76 (9), 4350-4354 (1979).
- Wittwer, C. T., Herrmann, M. G., Moss, A. A., Rasmussen, R. P. Continuous Fluorescence Monitoring of Rapid Cycle DNA Amplification. Biotechniques. 54 (6), 314-320 (2013).
- Cho, S. K., Dang, C., Wang, X., Ragan, R., Kwon, Y. J. Mixing-sequence-dependent nucleic acid complexation and gene transfer efficiency by polyethylenimine. Biomater Sci. 3 (7), 1124-1133 (2015).
- Liu, Y. M., Reineke, T. M. Poly(glycoamidoamine)s for gene delivery: Stability of polyplexes and efficacy with cardiomyoblast cells. Bioconjugate Chem. 17 (1), 101-108 (2006).
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Greco, C. T., Muir, V. G., Epps, T. H., Sullivan, M. O. Efficient tuning of siRNA dose response by combining mixed polymer nanocarriers with simple kinetic modeling. Acta Biomater. 50, 407-416 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved