Method Article
Prévoir le silencieux des gènes grâce au contrôle spatiotemporel de la libération de siRNA de Nanocarriers polymériques adaptés à la photo
Dans cet article
Résumé
Nous présentons une nouvelle méthode qui utilise des copolymères à blocs photo-réactifs pour un contrôle spatiotemporel plus efficace de l'inhibition des gènes sans effets détectables hors cible. En outre, des changements dans l'expression des gènes peuvent être prédits en utilisant des essais de libération de siRNA simples et une modélisation cinétique simple.
Résumé
De nouveaux matériaux et méthodes sont nécessaires pour mieux contrôler la liaison et la libération d'acides nucléiques pour une large gamme d'applications nécessitant une régulation précise de l'activité des gènes. En particulier, les nouveaux matériaux réactifs aux stimuli avec un contrôle spatiotemporal amélioré de l'expression des gènes ouvraient des plateformes traduisibles dans les technologies de découverte de médicaments et de médecine régénératrice. En outre, une capacité améliorée à contrôler la libération d'acide nucléique à partir de matériaux permettrait le développement de méthodes simplifiées pour prédire l'efficacité des nanocarrières a priori , ce qui entraînerait un dépistage accéléré des véhicules de livraison. Dans ce document, nous présentons un protocole pour prédire l'efficacité du silence génétique et la réalisation d'un contrôle spatio-temporel sur l'expression des gènes grâce à un système nanocarrier modulaire photo-sensible. Le petit ARN interférant (siRNA) est complexé avec du mPEG- b- poly (méthacrylate de 5- (3- (amino) propoxy) -2-nitrobenzyle) (mPEG- b- P (APNBMA)) pourRm stable nanocarriers qui peuvent être contrôlés avec la lumière pour faciliter l'accordable, on / off siRNA version. Nous décrivons deux tests complémentaires utilisant la spectroscopie de corrélation de fluorescence et l'électrophorèse sur gel pour une quantification précise de la libération de siRNA à partir de solutions imitant les environnements intracellulaires. L'information obtenue à partir de ces dosages a été incorporée dans un modèle cinétique simple d'ARN (RNAi) pour prédire les réponses dynamiques au silence à diverses conditions de photo-stimulus. À leur tour, ces conditions d'irradiation optimisées ont permis de raffiner un nouveau protocole pour la régulation spatiotemporelle du silence des gènes. Cette méthode peut générer des modèles cellulaires dans l'expression des gènes avec une résolution cellule-à-cellule et aucun effet détectable hors cible. Ensemble, notre approche offre une méthode facile à utiliser pour prédire les changements dynamiques dans l'expression des gènes et contrôler avec précision l'activité des siARN dans l'espace et le temps. Cet ensemble de tests peut être facilement adapté pour tester une grande variété d'otSes systèmes stimuli-réactifs afin de relever les principaux défis pertinents à une multitude d'applications dans la recherche biomédicale et la médecine.
Introduction
Les petits ARN interférants (siRNAs) servent de médiateur au dépistage génétique post-transcriptionnel à travers une voie catalytique RNAi hautement spécifique, puissante et adaptable à pratiquement n'importe quel gène cible 1 . Ces caractéristiques prometteuses ont permis aux thérapeutiques de siRNA de progresser dans des essais cliniques humains pour le traitement de nombreuses maladies, dont le mélanome métastatique et l'hémophilie 2 , 3 . Cependant, des problèmes de livraison importants persistent qui ont entravé la traduction 4 . En particulier, les véhicules de livraison doivent rester stables et protéger les ARNs par dégradation extracellulaire, mais aussi libérer la charge utile dans le cytoplasme 5 . En outre, de nombreuses applications RNAi nécessitent des méthodes améliorées pour réguler le silence des gènes dans l'espace et le temps 6 , ce qui réduira les effets secondaires chez siRNA therapeutics 7 et permettra de transformer unDvances dans des applications allant des microarrays cellulaires pour la découverte de médicaments 8 à la modulation des réponses cellulaires dans les échafaudages régénératifs 9 . Ces défis mettent en évidence la nécessité de nouveaux matériaux et méthodes pour mieux contrôler la liaison et la libération dans les nanocarriers siRNA.
L'une des stratégies les plus prometteuses pour contrôler la libération de l'ARNi et l'amélioration de la régulation spatiotemporelle est l'utilisation de matériaux sensibles aux stimuli 10 . Par exemple, une grande variété de biomatériaux ont été conçus avec une affinité variable de liaison aux acides nucléiques en réponse à un potentiel ou pH rédox altéré, ou des champs magnétiques appliqués, des ultrasons ou de la lumière 11 . Bien que bon nombre de ces systèmes démontrent un contrôle amélioré de l'activité des acides nucléiques, l'utilisation de la lumière comme déclencheur est particulièrement avantageuse en raison de sa réponse temporelle instantanée, de sa résolution spatiale précise et de sa facilité d'accessibilité 12. En outre, le potentiel des technologies photo-sensibles pour la régulation de l'expression des gènes a été démontré par des systèmes inducteurs inducibles et des systèmes de régulation optogénétique à la fine pointe de la technologie; Cependant, ces systèmes souffrent de nombreux défis, y compris des capacités limitées pour réguler les gènes endogènes, des problèmes de sécurité tels que l'immunogénicité et les difficultés à fournir des assemblages multi-composants 13 , 14 , 15 . Les nanocarriers de siRNA sensibles à la photo sont idéalement adaptés pour surmonter ces inconvénients et fournir une approche plus simple et plus robuste de l'expression des gènes spatiotemportement modulables 16 , 17 , 18 . Malheureusement, les méthodes pour prédire avec précision la réponse de knockdown protéique résultante demeurent insaisissables.
Un défi majeur est que les évaluations quantitatives de la publication de siRNA sontRares 19 , 20 , et même lorsque ces évaluations sont effectuées, elles n'ont pas été couplées aux analyses de la dynamique du renouvellement des siRNA / protéines. La quantité de siRNA libérée et sa persistance / durée de vie sont des déterminants importants de la dynamique de suppression des gènes qui en résulte; Par conséquent, l'absence d'une telle information est une déconnexion majeure qui empêche une prédiction précise de la dose-réponse dans l'ARNm 21 . Répondre à ce défi permettrait d'accélérer la formulation des relations structure-fonction appropriées dans les nanocarriers et de mieux informer les modèles de biomatériau 22 . En outre, de telles approches permettraient le développement de protocoles de dosage de siRNA plus efficaces. Dans une tentative de comprendre la réponse au silence silencieux, plusieurs groupes ont étudié des modèles mathématiques de RNAi 23 , 24 , 25 . Ces cadres étaientA réussi à fournir des informations sur les changements de l'expression des gènes médiés par un siARN et l'identification des étapes de limitation du taux 26 . Cependant, ces modèles ont été appliqués uniquement aux systèmes commerciaux de distribution de gènes ( p . Ex. , La lipoprotéine et la polyéthylénimine (PEI)) qui ne sont pas capables de la libération si-ARN contrôlée et la complexité des modèles a considérablement limité leur utilité 27 . Ces lacunes mettent en évidence un besoin non satisfait de nouveaux matériaux capables d'obtenir une version de siRNA à réglage précis combinée à des modèles cinétiques prédictifs simplifiés et faciles à utiliser.
Notre méthode aborde tous ces défis grâce à l'intégration d'une plate-forme nanocarrier sensible à la lumière avec des méthodes couplées pour quantifier la dynamique de l'ARNi siRNA et du modèle. En particulier, la version de siRNA 28 contrôlée avec précision de notre plate-forme est surveillée par deux méthodes complémentaires pour quantifier avec précision encapsulated vs. unUn siRNA lié. Les données expérimentales de ces essais sont entrées dans un modèle cinétique simple pour prédire l'efficacité du silence génétique a priori 29 . Enfin, la nature marche / arrêt des nanocarriers est facilement exploitée pour générer des modèles cellulaires dans l'expression des gènes avec un contrôle spatial sur l'échelle de longueur cellulaire. Ainsi, cette méthode fournit une méthode facilement adaptable pour contrôler et prédire le silence des gènes dans une variété d'applications qui bénéficieraient de la régulation spatiotemporelle du comportement cellulaire.
Protocole
1. Formulation de siRNA Nanocarriers
- Préparer des solutions séparées d'ARNsi et de mPEG- b- P (APNBMA) avec des volumes égaux dilués dans du tampon 20 mM d'acide 4- (2-hydroxyéthyl) pipérazine-1-éthanesulfonique (HEPES) à pH 6,0.
- Ajouter un ARNsi à une concentration de 32 μg / ml à 20 mM de solution de HEPES.
NOTE: L'ARNsi était une séquence de contrôle négative universelle non ciblée; Cependant, le siRNA peut être conçu pour cibler tout gène d'intérêt. - Dissoudre les polymères mPEG- b- P (APNBMA) dans une solution 20 mM de HEPES. Ajouter une quantité appropriée de mPEG- b- P (APNBMA) pour obtenir une solution de 220 μg / mL de sorte que le rapport N / P (N, groupes amine sur mPEG- b- P (APNBMA); P, groupes phosphate sur siRNA) Est 4.
REMARQUE: Le protocole de synthèse pour les polymères mPEG- b- P (APNBMA) est rapporté ailleurs 30 .
- Ajouter un ARNsi à une concentration de 32 μg / ml à 20 mM de solution de HEPES.
- Ajouter la solution mPEG- b -P (APNBMA), goutte à goutte, à un débit égalE de la solution siRNA tout en mélangeant doucement sur une machine à vortex. Continuer à tourbillonner pendant 30 secondes après addition de polymère. Incuber les échantillons dans l'obscurité à température ambiante pendant 30 min.
2. Mesurer la libération d'ARNi à l'aide d'une électrophorèse sur gel
- Formuler les nanocarriers selon les étapes 1.1-1.2, et calculer les volumes pour tenir compte du nombre d'échantillons souhaités.
- Mélanger le nanocarrier avec du dodécylsulfate de sodium (SDS).
- Préparer une solution de SDS 1 mg / ml dans de l'eau. Aliquote la quantité de solution SDS nécessaire pour produire des solutions avec un rapport S / P (S, groupes sulfate sur SDS, P, groupes phosphate sur siRNA) de 15.
REMARQUE: si la solution polyplex contient 1 μg de siRNA, il faut ajouter 13 μg de SDS pour obtenir un rapport S / P de 15. - Ajouter la solution SDS à chaque solution de nanocarrier en goutte à goutte tout en mélangeant doucement sur une machine à vortex. Continuez à tourbillonner pendant 30 s après l'ajout de SDS.
- Centrifuger les échantillons à 3 000 xg pendant 5 s. Incuber les échantillons dans l'obscurité à température ambiante pendant 30 min.
- Préparer une solution de SDS 1 mg / ml dans de l'eau. Aliquote la quantité de solution SDS nécessaire pour produire des solutions avec un rapport S / P (S, groupes sulfate sur SDS, P, groupes phosphate sur siRNA) de 15.
- Calibrer et régler un laser UV avec un filtre de 365 nm à une intensité de 200 W / m. Assurez-vous que l'intensité de la lumière est mesurée à partir de l'endroit où le fond de la solution échantillon sera assis.
- Chargez la solution nanocarrier / SDS dans une chambre en verre composée de glissières en verre séparées par un joint en caoutchouc.
- Pré-laver les lames de verre dans une solution éthanol / eau 7: 3 (v / v) dans de l'eau et sécher complètement. Couper un trou (~ 2 x 3 cm rectangle) dans un joint en caoutchouc. Placez le joint en caoutchouc sur une glissière en verre.
- Pipettez la solution nanocarrier / SDS sur la glissière de verre à l'intérieur du trou du joint en caoutchouc. Chargez un excès de solution (20 μL excédentaire) sur la glissière en verre tout en évitant le contact avec le joint en caoutchouc.
REMARQUE: Certains liquides seront perdus lors des étapes suivantes. - Placez le deuxième verreGlisser sur le joint d'étanchéité. Pour éviter la génération de bulles d'air, placez d'abord une extrémité de la glissière et descendez lentement l'autre extrémité.
- Fixez les attaches du classeur de chaque côté de la chambre en verre pour le maintenir fermé.
- Irradiez les échantillons pendant la durée souhaitée ( p . Ex. , 0 à 60 minutes) en utilisant un laser UV avec un filtre de 365 nm à une intensité de 200 W / m. Retirer les agrafes et ouvrir la chambre.
- Pipettez 25 μL des échantillons de nanocarrier / SDS irradiés dans un tube de microcentrifugeuse. Incuber les solutions dans l'obscurité à température ambiante pendant 30 min.
- Préparer un gel d'agarose à 2% en poids pré-coloré avec 0,5 ug / ml de bromure d'éthidium dans une solution tampon Tris / Borate / EDTA (TBE) selon les protocoles standards 31 . Préparer un tampon de chargement composé de 3: 7 (v / v) de glycerol / eau.
- Ajouter 5 μL de la solution tampon de chargement à 25 μL de chaque échantillon nanocarrier / SDS. Incuber les échantillons dans l'obscurité àTempérature ambiante pendant 10 min.
- Chargez 30 μL de chaque échantillon de nanocarrier / SDS dans le gel d'agarose à 2%. Faire passer le gel dans l'obscurité à 100 V pendant 30 min. Image du gel en utilisant un système d'imagerie en gel avec des filtres au bromure d'éthidium. Enregistrez les fichiers d'image de gel et passez à l'étape 2.10 pour la quantification de l'intensité de bande. Assurez-vous que les intensités de la bande sont assez lumineuses pour visualiser clairement mais pas trop brillantes que les signaux sont saturés.
- Quantifier les intensités de bande à l'aide du logiciel ImageJ disponible publiquement 32 .
- En utilisant l'outil ROI de ImageJ, déterminez l'intensité de fluorescence des bandes d'ARNs libres dans chaque voie en dessinant un rectangle autour de chaque bande. Tracez les courbes d'intensité de chaque voie et intégrez la zone sous les courbes en traçant une ligne horizontale sur les courbes d'intensité et en cliquant sur la baguette de traçage dans les zones fermées.
- Calculez l'intensité relative de chaque voie en divisant la zone sous la cuChaque échantillon par la zone sous la courbe du contrôle positif de siRNA (aucun mPEG- b- P (APNBMA) ajouté et aucun SDS ajouté). Indiquez le pourcentage de siRNA libéré comme l'intensité de bande normalisée de chaque échantillon.
3. Mesurer la libération d'ARNi avec la spectroscopie de corrélation de fluorescence (FCS)
- Obtenez siRNA marqué avec un seul fluorophore à l'extrémité 5 'du brin de sens.
REMARQUE: L'ARNsi peut être acheté pré-recuit avec les étiquettes conjuguées dans l'emplacement souhaité. Le fluorophore devrait être stable à la photo et absorber / émettre entre 450 et 750 nm pour éviter la trempe de lumière UV et le transfert d'énergie avec mPEG- b- P (APNBMA). - Formuler les nanocarriers selon les étapes 1.1-1.2 en utilisant l'ARNi marqué. Échelle les volumes pour tenir compte du nombre d'échantillons souhaités.
- Incuber les solutions en SDS et irradier pendant la durée souhaitée selon les étapes 2.2-2.6.
- PréparationDe la chambre d'échantillonnage FCS.
- Laver une glissière en verre avec une solution éthanol / eau 7: 3 (v / v) et sécher complètement le verre à l'aide d'un chiffon et d'un courant d'air.
- Retirez les morceaux de papier d'une entretoise adhésive double face pour exposer l'entretoise adhésive double face. Fixez l'entretoise à une lamelle de verre.
- Pipettez la solution nanocarrier / SDS sur le cache de recouvrement au milieu du trou de l'entretoise adhésive.
- Placez la glissière en verre sur le dessus de la lamelle. Appuyez sur la glissière en verre pour vous assurer que la glissière et la lamelle de verre sont bien attachées et forment un joint d'étanchéité.
- Utilisez un microscope confocal pour les mesures FCS 33 . Utilisez un objectif d'apoussement d'immersion à l'eau 40X avec une ouverture numérique de 1,2. Utilisez le canal laser d'excitation approprié (488 nm) pour collecter au moins 30 mesures de 10 s chacune par échantillon 34 . Assurez-vous que l'intensité du laser et l'alignement des détecteurs restentLe même pour chaque échantillon.
- En plus des échantillons expérimentaux, mesurer les contrôles, y compris: un échantillon vide sans ARNs marqués; Et un échantillon de siRNA gratuit avec siRNA marqué mais pas de mPEG- b- P (APNBMA).
- Analyser les données en utilisant un logiciel spécifique au FCS. Identifiez le taux de comptage de base de chaque échantillon en déterminant le taux de comptage stable au cours d'un moment où aucun nanocarrier ne traverse le volume confocal 29 .
- Soustraire le taux de comptage de l'échantillon vierge de chaque valeur de taux de comptage de base de l'échantillon. Normaliser les valeurs résultantes à la commande libre de siRNA pour calculer le pourcentage de siRNA libre 35 .
4. Modélisation cinétique pour prédire le silence des gènes
- Créer des scripts dans un langage de programmation mathématique en utilisant l'ensemble simple d'équations différentielles ordinaires pour prédire le silence des gènes 29.
REMARQUE: les scripts peuvent être disponibles sur demande.- Écrivez l'ensemble des équations différentielles ordinaires comme suit:
 (1)
(1)  (2)
(2) 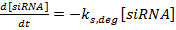 (3)
(3)
NOTE: Pour les équations 1-3, les termes k mRNA , k siRNA et k prot sont les constantes de vitesse pour la production d'ARNm, d'ARNsi et de protéines, respectivement. Les termes k m, deg , k s, deg et k p, deg sont les constantes de vitesse pour la dégradation de l'ARNm, de l'ARNsi et de la protéine, respectivement. Les constantes du taux de dégradation sont calculées sur la base des demi-vies composantes et les constantes de la vitesse de production sont adaptées pour s'assurer que les valeurs de l'ARNm et de l'état de la protéine sont atteintes en l'absence oF siRNA.- Déterminer les demi-vies de l'ARNm et de la protéine pour le (s) gène (s) d'intérêt, soit expérimentalement comme décrit dans la référence 36 ou dans la littérature (voir la discussion ). De plus, déterminez le temps de doublement pour la ligne cellulaire. Saisissez ces valeurs dans les expressions de taux de dégradation appropriées.
- Réglez les constantes de taux de production afin que les niveaux d'expression génique restent stables à une valeur normalisée de 100 si aucun siARN n'est introduit. Plus précisément, réglez [siRNA] à zéro et modifiez les valeurs des constantes de vitesse de production de k mRNA , k siRNA et k prot jusqu'à [ARNm] et [protéines] restent dans 1% de la valeur normalisée initiale de 100% pour la durée de La simulation.
- En utilisant les quantités relatives de siRNA libérées à partir de l'électrophorèse sur gel préalablement décrite et des tests FCS comme estimations, ajustez la concentration relative initiale de siRNA dans le script. Plus précisément, modifiez [siRNA] pour être proportionnel à la quantité relative de siRNA libéré, avec une valeur de 100 correspondant à la quantité maximale 29 .
- Écrivez l'ensemble des équations différentielles ordinaires comme suit:
5. Culture cellulaire et livraison in vitro de siRNA
- Culture NIH / 3T3 fibroblastes embryonnaires murins selon les protocoles du fournisseur.
- Augmenter les cellules en milieu de croissance (milieu de Eagle modifié modifié par Dulbecco (DMEM) additionné de 10% de sérum bovin fœtal inactivé par la chaleur et 1% de pénicilline-streptomycine). Maintenir les cellules à 37 ° C dans un environnement humidifié avec 5% de CO 2 .
- Graisser les cellules dans des plaques traitées à la culture tissulaire à 6 puits.
- Suivez la procédure de sous-culture recommandée auprès du fournisseur. Comptez les cellules en utilisant un hémocytomètre. Diluer les cellules dans des milieux de croissance additionnés à une concentration de 75 000 cellules / ml.
- Ajouter 2 mL de suspension cellulaire (75 000 cellulesS / mL) à chaque puits de la plaque à 6 puits. Laissez les cellules adhérer et récupérer pendant 24 h dans l'incubateur.
- Préparer les cellules pour la transfection par lavage avec une solution salée tamponnée au phosphate (PBS) et ajouter 1,5 ml de milieu de transfection sans sérum et sans antibiotiques (voir la Table des matières ) à chaque puits.
- Formuler les nanocarriers siRNA selon les étapes 1.1-1.2. Ajouter 25 μL de solution de nanocarrier contenant 30 pmol d'ARNsi à chaque puits. Pipettez doucement le support vers le haut et vers le bas pour mélanger. Placez les cellules dans l'incubateur pendant 3 h.
- Retirer les milieux de transfection et laver chaque puits avec du PBS. Ajouter 1 mL de milieux de croissance additionnés et placer les cellules dans l'incubateur pour récupérer pendant 30 minutes.
- Pour préparer les cellules pour un traitement avec une photo-stimulus, éliminer les milieux de croissance supplémentés. Ajouter 1 ml de milieu de transfection (sans phénol rouge) à chaque puits.
REMARQUE: Assurez-vous que les milieux de transfection ne contiennent pas de phénol rouge. - Calibrer et régler un laser UV avec un filtre de 365 nm à une intensité de 200 W / m. Assurez-vous que l'intensité de la lumière est mesurée à partir de l'endroit où le fond de la plaque de la cellule sera assis.
- Placez les cellules sur une plaque chauffante réglée à 37 ° C. Retirez le couvercle de la plaque des cellules. Irradiez les cellules au-dessus de la plaque pendant le temps désiré (jusqu'à 20 min) en utilisant le laser UV avec un filtre de 365 nm à une intensité de 200 W m -2 .
- Enlevez les milieux de transfection et ajoutez 2 ml de milieux de croissance additionnés. Placer dans l'incubateur jusqu'à une analyse plus approfondie ( p . Ex. , 24 h pour qPCR et 48 h pour Western blot).
- Mesurez les changements dans l'expression des gènes en utilisant diverses techniques telles que Western blot 37 et qPCR. 38 Pour les gènes avec des signaux visibles, tels que la GFP, utilisez une microscopie à fluorescence 29 .
NOTE: Ces techniques sont suggérées en raison de leur facilité d'utilisation et de leur précisionEn quantifiant l'expression des gènes
- Mesurez les changements dans l'expression des gènes en utilisant diverses techniques telles que Western blot 37 et qPCR. 38 Pour les gènes avec des signaux visibles, tels que la GFP, utilisez une microscopie à fluorescence 29 .
6. Contrôle du silence des gènes de manière spatio-temporelle
- Culture, semence et cellules transfectées selon les étapes 5.1-5.7.
- Préparez un photomasque qui bloque complètement la lumière 365 nm et minimise les réflexions.
REMARQUE: Dans ce cas, des morceaux de papier d'aluminium et de construction noir de 10 x 10 cm ont été utilisés pour bloquer la lumière et pour réduire les reflets, respectivement. La feuille d'aluminium et le papier de construction ont été collés ensemble pour former une seule unité.- Couper / poinçonner / emballer la forme désirée dans le photomasque. Par exemple, utilisez une lame à arêtes vives et un perforateur pour former un motif linéaire (~ 5 cm de long) et un motif circulaire (~ 7 mm de diamètre) dans le photomasque, respectivement.
- Collez le photomasque au fond de la plaque à 6 puits avec le motif centré sous le puit contenant les cellules avec le côté anti-réfléchissant ( p . Ex. , Noir cPapier d'étude) face à la plaque. Assurez-vous que la colle n'est pas placée près du bord (à environ 3 mm) du motif.
- Mettre en place deux anneaux à environ 25 cm de distance et attacher une plate-forme à chaque support de bague afin que les plates-formes soient égales. Suspendre la plaque de cellule entre les deux supports en appuyant sur la plaque sur le dessus des plates-formes. Assurez-vous que la plaque est au niveau.
- Irradiez les cellules de dessous de l'échantillon pendant le temps souhaité (jusqu'à 20 min) en utilisant le laser UV avec un filtre de 365 nm à une intensité de 200 W / m 2 .
- Enlevez les milieux de transfection et ajoutez 2 ml de milieux de croissance additionnés. Mettre en incubation pour récupérer pendant au moins 24 h. Image des cellules en utilisant la microscopie de fluorescence comme décrit 29 .
Résultats
Après la formulation des nanocarriers, les essais de libération de siRNA ont été effectués pour informer les conditions d'irradiation à utiliser dans les transfections in vitro . Diverses doses de lumière ont été appliquées pour déterminer le pourcentage de siRNA qui a été libéré. Le premier essai a utilisé une électrophorèse sur gel pour séparer les molécules d'ARNs libres des molécules d'ARNsi encore complexées / associées au polymère. Les nanotechoirs qui n'ont pas été traités avec la lumière sont restés stables et n'ont pas publié de siARN. Au fur et à mesure que la durée du temps d'irradiation augmentait, l'intensité de fluorescence des bandes de siRNA libres augmentait. La quantification des intensités de bande à l'aide d'un logiciel d'analyse d'image a démontré que ~ 15% de l'ARNsi a été libéré après 20 minutes d'exposition à la lumière.
Le deuxième essai de libération de siRNA a utilisé FCS pour mesurer le pourcentage de molécules d'ARNsi qui diffusaient librement dans le solUtion. Les taux de comptage de base des échantillons contenant les nanocarriers qui n'étaient pas exposés à la lumière étaient les mêmes que les taux de comptage de l'échantillon de contrôle du tampon vierge, ce qui indique qu'aucun siRNA gratuit n'était présent. Les taux de comptage de base ont augmenté à mesure que le temps d'irradiation augmentait. Le pourcentage de siRNA gratuit a été calculé et s'est avéré en accord avec les mesures obtenues à partir de l'électrophorèse sur gel. D'une manière générale, les estimations des deux techniques se sont trompées l'une de l'autre (p> 0,05 par test t de Student) et ont indiqué que le pourcentage de siRNA libéré n'a pas augmenté de manière significative avec plus de 20 minutes d'irradiation. Il est important de noter que l'électrophorèse sur gel et le FCS ont été utilisés pour quantifier la libération d'ARNi, car ils sont faciles à utiliser, relativement rapides à analyser et donnent des résultats précis.
Les quantités relatives de siRNA libérées suite à différentes doses de lumière ont été entrées comme étant les initiales du siRNUne concentration dans le modèle cinétique. Comme le montre la figure 1A , le modèle a été utilisé pour prédire les concentrations d'ARNm, de protéines et d'ARNs de la 3-phosphate déshydrogénase (GAPDH) de glycéraldéhyde en fonction du temps sous chaque état d'irradiation. Les prédictions du modèle pour les niveaux d'expression de la protéine GAPDH étaient en accord avec les niveaux d'expression expérimentaux déterminés obtenus par Western Blot ( figure 1B ). En particulier, le taux de protéine GAPDH exprimé diminue lorsque le temps d'irradiation augmente. Les cellules qui ont été irradiées pendant la plus longue période de temps (20 min) ont présenté les plus grands changements dans l'expression des gènes parce que de plus grandes quantités de siRNA ont été libérées. Fait important, les cellules qui n'étaient pas exposées à la lumière ne présentaient aucun effet génétique, indiquant que les nanocarriers maintenaient la dormance et ne libéraient aucun siARN, à moins d'être déclenchés par la photo-stimulus. Les tests de cytotoxicité ont démontré que les cellules NIH / 3T3Maintenu ≥ 90% de viabilité suite au traitement avec nanocarriers et 20 min d'irradiation 28 .
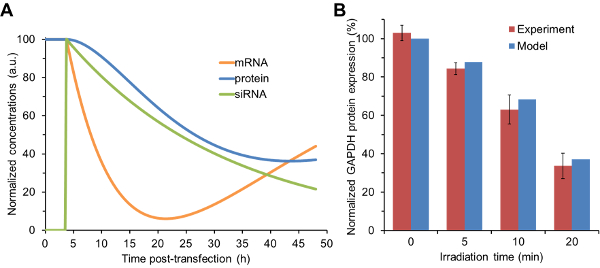
Figure 1 : prévisions de modélisation cinétique par rapport aux changements expérimentalement déterminés dans l'expression des protéines. ( A ) les données de sortie d'ARNi obtenues à partir d'une électrophorèse sur gel ont été utilisées pour moduler la concentration initiale de siRNA dans le modèle cinétique. Ces graphiques représentent la sortie du modèle pour les cellules recevant 20 minutes d'irradiation. ( B ) Les quantités relatives de siRNA provenant de chaque état d'irradiation ont été introduites dans le modèle cinétique pour prédire les changements dans l'expression des protéines. Ces prédictions ont été comparées aux niveaux d'expression de la protéine GAPDH obtenus à partir des analyses Western Blot. Les résultats sont indiqués comme la moyenne ± écart-type de dAta obtenu à partir de trois échantillons indépendants. Les données expérimentales ont été réimprimées en partie avec l'autorisation de la référence 29 . Cliquez ici pour voir une version plus grande de ce chiffre.
Pour contrôler le silence des gènes d'une manière spatiotemporelle, un photomasque a été utilisé pour limiter les populations cellulaires spécifiques à la photo-stimulus. Comme le montre la figure 2 , l'expression de GFP dans les cellules a été contrôlée spatialement dans un schéma circulaire. Les cellules qui étaient protégées de la lumière présentaient des intensités de fluorescence qui ne pouvaient être distinguées des échantillons de contrôle qui ne sont pas traités avec de l'ARNsi et de la lumière. Cependant, presque toutes les cellules dans le schéma circulaire ne présentaient aucune expression de GFP, ce qui indique une libération efficace d'ARNs et un knockdown de gène. En outre, l'utilisation de la lumière comme un déclencheur a permis l'expression du gène à contrôlerConduit sur des échelles de longueur cellulaire.

Figure 2 : Contrôle spatial sur le silence des gènes. Les cellules NIH / 3T3 ont été co-transfectées avec des lipoplexes contenant du pDNA de GFP et des nanocarriers de siRNA / mPEG- b- P (APNBMA) ciblant les GFP. Un photomasque circulaire a été appliqué avant irradiation avec une lumière de 365 nm pendant 20 min. Les cellules ont été imagées sur un microscope à fluorescence 48 h après la transfection. La ligne rouge pointillée représente le bord du photomasque, et la barre d'échelle représente 1 mm. Adapté avec l'autorisation de la référence 29 . Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Il y a quelques étapes dans la méthode qui sont particulièrement critiques. Lors de la formulation des nanocarriers, l'ordre de l'addition des composants et de la vitesse de mélange sont deux paramètres importants influençant l'efficacité 39 . Ce protocole nécessite que la composante cationique, mPEG- b -P (APNBMA), soit ajoutée à la composante anionique, siARN, de manière goutte à goutte lors du vortex. Selon le volume total de la formulation, ce processus de mélange dure de 3 à 6 s. Pour vérifier si les nanocarriers ont été formés correctement, mesurer la distribution de la taille en utilisant une technique telle que la diffusion dynamique de la lumière. Les nanocarriers mPEG- b -P (APNBMA) / siRNA avec un rapport N / P de 4 ont un diamètre moyen de ~ 140 nm et une polydispersité de ~ 0,2 28 . En outre, le rapport N / P peut varier pour obtenir des polyplexes de différentes tailles / stabilités. Un rapport N / P de 4 a été choisi dans ces études parce que c'était le ratio le plus bas qui a permis la séquestration complète et eliMination de la coloration au bromure d'éthidium.
Un autre paramètre critique dans la méthode implique l'ajout de SDS aux solutions nanocarrier dans les essais de libération de siRNA. Le SDS, un tensioactif anionique, a été utilisé pour mieux simuler des milieux intracellulaires contenant des concentrations élevées de membranes lipidiques et de polyanions 29 , 40 . Le rapport S / P doit être suffisamment élevé pour imiter l'abondance des lipides anioniques présents dans les cellules, mais pas si génial que les nanocarriers se désassemblent avant la photo-stimulus et d'autres analyses. Une gamme de rapports S / P devrait être testée à l'aide d'une électrophorèse sur gel pour identifier la quantité maximale de SDS pouvant être ajoutée sans libérer de siRNA. Ce protocole a utilisé un rapport S / P relativement élevé de 15.
Une limitation potentielle de cette méthode est liée à la modélisation cinétique. Le modèle nécessite l'entrée de demi-vies d'ARNm et de protéines du gène d'intérêt. TurnovLes taux d'erreur pour les gènes qui ont été bien étudiés peuvent être trouvés dans la littérature; Cependant, cette information peut ne pas être disponible pour tous les gènes. Pour contourner ce problème, les demi-vies de gènes similaires peuvent être trouvés dans la littérature pour fournir des estimations. En variante, les taux de renouvellement du gène spécifique d'intérêt peuvent être déterminés expérimentalement 36 . Il est également important de noter que des informations pour des milliers de gènes peuvent être trouvées dans les ensembles de données compilées 41 .
Un autre paramètre clé de cette méthode est le type de cellule. Les fibroblastes NIH / 3T3 ont été utilisés dans ces études comme une lignée cellulaire modèle parce qu'ils ont été étudiés de manière approfondie, sont faciles à utiliser et sont applicables à un certain nombre d'applications de médecine régénérative. Toutefois, le protocole peut être appliqué à d'autres types d'intérêt cellulaire. La formulation nanocarrier peut devoir être optimisée pour le type de cellule spécifique.
En résumé, cette méthode enPermet la détermination rapide des conditions d'irradiation à contrôler spatiotemporally la propagation de siRNA et prédire a priori le silence des gènes. Cette méthode serait facilement adaptable à d'autres systèmes d'administration d'acide nucléique sensible à la photo. Par exemple, les polymères mPEG- b- P (APNBMA) peuvent être modifiés en accordant les longueurs de blocs et / ou les fragments fonctionnels pour adapter le comportement photosensible des nanocarriers 42 . L'utilisation de ce protocole aiderait à élucider les relations structure-fonction qui régissent la stabilité et l'efficacité des nanocarrières. Ces connaissances mécanistiques peuvent permettre des applications en médecine régénératrice nécessitant un contrôle spatiotemporel sur le silence des gènes. De plus, en raison de la profondeur de pénétration inhérente de la lumière de 365 nm dans les tissus aqueux, ces formulations sont bien adaptées au traitement des maladies manifestées sur la surface du corps telles que le cancer de la peau et les plaies topiques.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont pas d'intérêts financiers concurrents.
Remerciements
Les auteurs remercient l'Institut national des sciences médicales générales des Instituts nationaux de santé (NIH) pour le soutien financier par le biais d'un Prix de développement institutionnel (IDeA) sous le numéro de délivrance P20GM103541 ainsi que le numéro de subvention P20GM10344615. Les énoncés présentés ne reflètent pas les points de vue du NIH. Nous reconnaissons également le Delaware Biotechnology Institute (DBI) et le Deloware Economic Development Office (DEDO) pour le soutien financier grâce au prix Bioscience Center for Advanced Technology (Bioscience CAT) (12A00448).
matériels
| Name | Company | Catalog Number | Comments |
| siRNA | Sigma-Aldrich | SIC001 | non-targeted, universal negative control |
| mPEG-b-P(APNBMA) | synthesized in our lab | N/A | photo-responsive polymer |
| HEPES | Fisher Scientific | BP310-100 | |
| sodium dodecyl sulfate | Sigma-Aldrich | 436143 | |
| rubber gasket | McMaster-Carr | 3788T21 | 0.5 mL thick |
| UV laser | Excelitas Technologies | Omnicure S2000 | collimating lens and 365 nm filter used |
| agarose | Fisher Scientific | BP160-100 | |
| ethidium bromide | Fisher Scientific | BP1302-10 | |
| siRNA labelled with Dy547 | GE Healthcare Dharmacon, Inc. | custom order | fluorophore conjugated to 5’ end of sense strand |
| microscope slide | Fisher Scientific | 12-550-A3 | pre-cleaned glass |
| Secure-Seal Spacer | Life Technologies | S24735 | double-sided adhesive |
| LSM 780 | Carl Zeiss | N/A | confocal microscope |
| ZEN 2010 | Carl Zeiss | N/A | FCS analysis software |
| MATLAB | MathWorks | N/A | programming language |
| NIH/3T3 cells | ATCC | ATCC CRL-1658 | |
| DMEM | Mediatech | 10-013-CV | growth media |
| fetal bovine serum | Mediatech | 35-011-CV | heat-inactivated |
| penicillin-streptomycin | Mediatech | 30-002-CI | |
| 6-well plates | Fisher Scientific | 08-772-1B | |
| Opti-MEM | Life Technologies | 11058021 | transfection media |
Références
- Forbes, D. C., Peppas, N. A. Oral delivery of small RNA and DNA. J Control Release. 162 (2), 438-445 (2012).
- Davis, M. E., et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature. 464 (7291), 1067-1070 (2010).
- Bouchie, A. Companies in footrace to deliver RNAi. Nat Biotechnol. 30 (12), 1154-1157 (2012).
- Burke, P. A., Pun, S. H., Reineke, T. M. Advancing Polymeric Delivery Systems Amidst a Nucleic Acid Therapy Renaissance. ACS Macro Lett. 2 (10), 928-934 (2013).
- Gooding, M., Browne, L. P., Quinteiro, F. M., Selwood, D. L. siRNA Delivery: From Lipids to Cell-penetrating Peptides and Their Mimics. Chem Biol Drug Des. 80 (6), 787-809 (2012).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nat Chem Biol. 10 (3), 196-202 (2014).
- Wang, X., Chen, X., Yang, Y. Spatiotemporal control of gene expression by a light-switchable transgene system. Nat Methods. 9 (3), 266-269 (2012).
- Ziauddin, J., Sabatini, D. M. Microarrays of cells expressing defined cDNAs. Nature. 411 (6833), 107-110 (2001).
- Saltzman, W. M., Olbricht, W. L. Building drug delivery into tissue engineering. Nat Rev Drug Discov. 1 (3), 177-186 (2002).
- Mura, S., Nicolas, J., Couvreur, P. Stimuli-responsive nanocarriers for drug delivery. Nat Mater. 12 (11), 991-1003 (2013).
- Shim, M. S., Kwon, Y. J. Stimuli-responsive polymers and nanomaterials for gene delivery and imaging applications. Adv Drug Delivery Rev. 64 (11), 1046-1058 (2012).
- Kelley, E. G., Albert, J. N. L., Sullivan, M. O., Epps, T. H. Stimuli-responsive copolymer solution and surface assemblies for biomedical applications. Chem Soc Rev. 42 (17), 7057-7071 (2013).
- Weber, W., Fussenegger, M. Emerging biomedical applications of synthetic biology. Nat Rev Genet. 13 (1), 21-35 (2012).
- Konermann, S., et al. Optical control of mammalian endogenous transcription and epigenetic states. Nature. 500 (7463), 472-476 (2013).
- Shimizu-Sato, S., Huq, E., Tepperman, J. M., Quail, P. H. A light-switchable gene promoter system. Nat Biotechnol. 20 (10), 1041-1044 (2002).
- Huschka, R., et al. Gene Silencing by Gold Nanoshell-Mediated Delivery and Laser-Triggered Release of Antisense Oligonucleotide and siRNA. ACS Nano. 6 (9), 7681-7691 (2012).
- Li, H. -. J., Wang, H. -. X., Sun, C. -. Y., Du, J. -. Z., Wang, J. Shell-detachable nanoparticles based on a light-responsive amphiphile for enhanced siRNA delivery. R Soc Chem Adv. 4 (4), 1961-1964 (2014).
- Braun, G. B., et al. Laser-Activated Gene Silencing via Gold Nanoshell-siRNA Conjugates. ACS Nano. 3 (7), 2007-2015 (2009).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nat Biotechnol. 31 (7), 638-646 (2013).
- Wittrup, A., et al. Visualizing lipid-formulated siRNA release from endosomes and target gene knockdown. Nat Biotechnol. 33 (8), 870-876 (2015).
- Roth, C. M. Quantitative measurements and rational materials design for intracellular delivery of oligonucleotides. Biotechnol Prog. 24 (1), 23-28 (2008).
- Mao, S., et al. Influence of polyethylene glycol chain length on the physicochemical and biological properties of poly(ethylene imine)-graft-poly(ethylene glycol) block copolymer/SiRNA polyplexes. Bioconjugate Chem. 17 (5), 1209-1218 (2006).
- Raab, R. M., Stephanopoulos, G. Dynamics of gene silencing by RNA interference. Biotechnol Bioeng. 88 (1), 121-132 (2004).
- Cuccato, G., et al. Modeling RNA interference in mammalian cells. BMC Systems Biology. 5, 1 (2011).
- Varga, C. M., Hong, K., Lauffenburger, D. A. Quantitative analysis of synthetic gene delivery vector design properties. Mol Ther. 4 (5), 438-446 (2001).
- Chen, H. H., et al. Quantitative comparison of intracellular unpacking kinetics of polyplexes by a model constructed from quantum Dot-FRET. Mol Ther. 16 (2), 324-332 (2008).
- Bartlett, D. W., Davis, M. E. Insights into the kinetics of siRNA-mediated gene silencing from live-cell and live-animal bioluminescent imaging. Nucleic Acids Res. 34 (1), 322-333 (2006).
- Foster, A. A., Greco, C. T., Green, M. D., Epps, T. H., Sullivan, M. O. Light-Mediated Activation of siRNA Release in Diblock Copolymer Assemblies for Controlled Gene Silencing. Adv Healthc Mater. 4 (5), 760-770 (2015).
- Greco, C. T., Epps, T. H., Sullivan, M. O. Mechanistic Design of Polymer Nanocarriers to Spatiotemporally Control Gene Silencing. ACS Biomater Sci Eng. 2 (9), 1582-1594 (2016).
- Green, M. D., et al. Catch and release: photocleavable cationic diblock copolymers as a potential platform for nucleic acid delivery. Polym Chem. 5 (19), 5535-5541 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Marquer, C., Leveque-Fort, S., Potier, M. C. Determination of Lipid Raft Partitioning of Fluorescently-tagged Probes in Living Cells by Fluorescence Correlation Spectroscopy (FCS). J Vis Exp. (62), (2012).
- Staaf, E., Bagawath-Singh, S., Johansson, S. Molecular Diffusion in Plasma Membranes of Primary Lymphocytes Measured by Fluorescence Correlation Spectroscopy. J Vis Exp. (120), e54756 (2017).
- Buyens, K., et al. Monitoring the disassembly of siRNA polyplexes in serum is crucial for predicting their biological efficacy. J Control Release. 141 (1), 38-41 (2010).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad. Sci U S A. 76 (9), 4350-4354 (1979).
- Wittwer, C. T., Herrmann, M. G., Moss, A. A., Rasmussen, R. P. Continuous Fluorescence Monitoring of Rapid Cycle DNA Amplification. Biotechniques. 54 (6), 314-320 (2013).
- Cho, S. K., Dang, C., Wang, X., Ragan, R., Kwon, Y. J. Mixing-sequence-dependent nucleic acid complexation and gene transfer efficiency by polyethylenimine. Biomater Sci. 3 (7), 1124-1133 (2015).
- Liu, Y. M., Reineke, T. M. Poly(glycoamidoamine)s for gene delivery: Stability of polyplexes and efficacy with cardiomyoblast cells. Bioconjugate Chem. 17 (1), 101-108 (2006).
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Greco, C. T., Muir, V. G., Epps, T. H., Sullivan, M. O. Efficient tuning of siRNA dose response by combining mixed polymer nanocarriers with simple kinetic modeling. Acta Biomater. 50, 407-416 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon