Method Article
ACT-Presto: סליקה רקמות ביולוגיות ושיטות immunolabeling הדמיה נפח
In This Article
Summary
ACT-פרסטו (הקשורים בלחץ טכניקת בהירות פעיל העברה יעילה ויציבה של מקרומולקולות לאיברים) מאפשרת סליקת רקמות מהירה, יעילה, אבל לא יקרה וחדירת נוגדן מהירה לרקמות מסומנות על ידי דיפוזיה פסיבית או מסירה סייע בלחץ. באמצעות שיטה זו, מגוון רחב של רקמות יכול להיות מסומן, immunolabeled ידי נוגדנים מרובים, ו-צלם נפח.
Abstract
זיהוי והחקירה של הארגון המפורט של איברים או של כל הגוף ברמה התאית הם אתגרי יסוד בביולוגיה. שיטות מעברות דורשות כמות משמעותית של זמן ומאמץ כדי לקבל תמונת 3D וכולל חתך ברקמה ללא פגע, immunolabeling, והדמית רקמות מחולקות סדרתי, אשר מייצרת הפסד של מידע בכל שלב של התהליך. בגישות שפותחו לאחרונה עבור הדמיה ברזולוציה גבוהה בתוך רקמה שלמה, אפיון מולקולרי הוגבל על התיוג של חלבונים. עם זאת, פרוטוקולים הקיימים כיום לסליקת איבר דורשים זמן תהליך ארוך באופן משמעותי, מה שהופך אותו קשה ליישם טכניקות סליקת רקמות במעבדה. הקמנו לאחרונה פרוטוקול מהיר הפערים לשחזור כינה ACT-פרסטו (א r ressure p echnique- t larity ג ctive במצב רוח מרומם fficient דואר ו- s השולחן t ransferשל מקרומולקולות לתוך rgans o), המאפשר פינוי רקמות בתוך מספר שעות. יתר על כן, ACT-PRESTO מאפשר immunolabeling המהירה עם שיטות קונבנציונליות ומאיץ חדירת נוגדן לתוך השכבה העמוקה של בנוי בצפיפות, דגימות עבות על ידי יישום זרימת לחץ או הסעה. אנו מתארים כיצד להכין רקמות, כיצד לנקות ע"י הסרת שומנים באמצעות אלקטרופורזה, וכיצד חיסוניים להכתים ידי משלוח לחץ בסיוע. המהירות והעקביות של פרוטוקול יזרז את ביצוע מחקר היסטולוגית 3D ואבחנות מבוססי נפח.
Introduction
אחד האתגרים במדעי המוח הוא להדמיה של חיווט מעגלים עצביים ועל תאים בודדים בתוך רקמת המוח ללא פגע. עד לאחרונה, הוכיח את הקשרים בין הנוירונים בדרך זו נדרש 1) חתך סדרה של רקמות; 2) תיוג מולקולרי של מטרות ספציפיות, כגון אקסונים או חלבונים; ו -3) להדמיה באמצעות שחזור 3D של המוח כולו באמצעות רישום או יישור חישובית של תמונות סדרתי 2D 1. צעדים אלה הם מייגעים, דורשים מידה רבה של זמן, והם עלולים לאבד מידע במהלך חתך וסימון, מה שהופך מיפוי רשת עצבי קשה ביותר. עם זאת, שיטות רבות המאפשרות הדמיה של רקמות שלמות בלי חתך פותחו. רקמות ביולוגיות יכולות להתבצע שקופות אופטי ידי טכניקות סליקת רקמה 2-10. אחת השיטות העיקריות הוא להפחית הבדלים מקדמים שבירים בין הרקמות השלמות פתרון הטבילה כדיכדי לצמצם פיזור אור בתוך הרקמה ללא פגע, ובכך הופך את הרקמה שקופה המאפשרת התצפית של מבנים עמוקים. סוגים מסוימים של פתרונות טבילה יש תכונות הידרופוביות, אשר תוצאה מרווה פלורסנט מהר במהלך הליך ההתייבשות. לכן, שיטות אלה אינן תואמות דימות פלואורסצנטי על פני תקופה ארוכה של זמן 11,12. במקום ריאגנטים הידרופובי, שיטות אחרות להשתמש ריאגנטים הידרופילי לניקוי רקמות, כגון SeeDB 4 ו Sca l e 6, המקיימים את המידע המבני הקרינה של 4,6,8 הרקמה הביולוגית. עם זאת, מקרומולקולות, כולל נוגדנים, לא יכול להגיע הליבה של רקמות ללא פגע על ידי דיפוזיה לבד. לפיכך, התיוג מראש של מולקולות מטרה באזורים עמוקים של רקמות בצפיפות וגדושות הוא מאתגר מהבחינה טכנית.
בשיטת רקמת סליקה לאחרונה מפותחת, CLARITY 3, אני רקמה ביולוגי-מוטבע הידרוג'לs נוצר עם acrylamide, ושומנים יוסרו על ידי אלקטרופורזה תחת סולפט dodecyl נתרן (SDS) פתרון המכילים. המדגם הוא שקוע אז בתמיסה עם אינדקס התאמה רעיוני להפחית אור פיזור 3. מערכת הסרת שומנים שונה מאוחר יותר בבהירות מתקדמת 13 ו PACT (טכניקת בהירות פסיבית) 10. לאחר פילמור, שרשראות acrylamide crosslink עם חלבונים, יוצרי רקמות הידרוג'ל. רכיבי שומנים לא יכול crosslink עם acrylamide; ובכך, ניתן לבטל שומנים ידי אלקטרופורזה תחת חיץ SDS המכיל. באמצעות החיסול הפעיל של שומנים, רקמות המוח עולות באופן ניכר בשקיפות 9. עם זאת, שיטות אלו אינן מטפלות האפשרות של תיוג עמוק על ידי דיפוזיה חופשית. כדי להתגבר על מגבלה זו, טכניקות להובלה הפעילה של ריאגנטים לחלקים העמוקים של רקמות עבות נדרשות.
למרות CLARITY מאפשר סליקת רקמות-רקמות עמוקותלהדמיה, זה לא הליך קל או מהיר. זה יכול לקחת כמה שבועות כדי לנקות 7,14 במוח העכבר כולו. התבהרות מהירה של רקמות חיונית עבור היישום של שיטות כאלה להגדרות מעבדה בסיסיות או קליניות למחקר מדעי חיים או אבחנת נפח. הפרוטוקול הנוכחי מספק תהליך פשוט לקבלת אישור רקמה ביולוגית וזיהוי חלבון לאחר מכן על ידי מכתים חיסוני משלוח בסיוע לחץ. היא מתאימה הדמיה נפח ברזולוציה גבוהה של מערכות עיבוד נתונים גדולות הגיש ו 3D באמצעות שילוב עם שיטות הדמיה.
Protocol
ניסויים בבעלי החיים חייבים לעמוד בכל התקנות הממשלתיות ומוסדיות הרלוונטיות.
1. הכנת ריאגנטים
- לקבלת הפתרון מונומר הידרוג'ל (A4P0): להוסיף 20 גרם של acrylamide 450 מ"ל של תמיסת מלח פוספט שנאגרו 0.1x (PBS) ולהתאים את עוצמת הקול עד 500 מ"ל עם 0.1x PBS.
זהירות: מונומרים Acrylamide רעילים. לבצע את כל ההליכים במנדף עם ציוד מגן אישי, כולל מגן פנים, מעיל מעבדה, כפפות, נעליים סגורות הבוהן.- מיד לפני השימוש, להוסיף 100 מ"ג של 2,2'-Azobis [2- (2-imidazolin-2-י.ל.) פרופאן] dihydrochloride 40 מ"ל של תמיסת מונומר הידרוג'ל (A4P0) בצינור חרוטי 50 מ"ל תחת במנדף .
- לסליקת רקמות electrophoretic (ETC) חיץ: הוסף 40 גרם של סולפט dodecyl נתרן (SDS) ו 12.37 גרם של חומצת בור ל -800 מ"ל של deionized H 2 O (O DH 2). התאם את ה- pH ל -8.5 עם NaOH ולהתאים את עוצמת הקול כדי1 ליטר עם 2 dH הנוסף O.
זהירות: SDS הוא כימיקל מזיק; ולכן, להתמודד עם זה בזהירות. - לקבלת הפתרון מעוקב-הר: להוסיף 250 גרם של סוכרוז, 125 גרם של אוריאה, ו 125 גרם של N, N, N ', N' -tetrakis (2-Hydroxypropyl) ethylenediamine 150 מ"ל של DH 2 O ולהביא את נפח 500 מ"ל עם dH 2 O.
2. הכנת דוגמאות & קיבוע
- המתת חסד של העכבר.
- הכן את alfaxalone (1 מ"ג / ק"ג) ו xylazine (0.5 מ"ג / ק"ג) באותו מזרק.
- Intraperitoneally להזריק את התערובת של alfaxalone ו xylazine ולאפשר 3 דקות העכבר כדי להפוך ללא הכרה.
- המתן עד העכבר מורדם כבר לא מגיב לגירויים מכאיבים, כגון צביטה זנב, לפני שתמשיך.
זהירות: פעל בהתאם להנחיות מוסדיות מתאימות לטיפול בבעלי חיים.
- Transcardially perfuse את העכבר עם 100 מ"ל של 0.9% NaCl (pH 7.4-7.5) פתרוןהמכילה הפרין (100 U / mL) כדי ולגרום לדימום מחודש, ואחריו 100 מ"ל של 4% paraformaldehyde (PFA) ב 1x PBS (pH 7.4) 14.
זהירות: פתרון PFA הוא רעיל. הכנת פתרון PFA וכל הטיפול העוקב חייבת להתנהל במנדף ועם ציוד מגן אישי. - חותך את ראש העכבר, לפתוח את העור, לשבור את הגולגולת בין העיניים בעזרת מספריים קטנים.
- הסר פיסות הגולגולת באמצעות מלקחיים קטנים, מעוגלים.
- להוציא את המוח או איברים רצויים.
- דגירת המוח ואיברים בתמיסת PFA פוסט לתקן 4% ב 4 מעלות צלזיוס למשך הלילה.
הערה: לניקוי רקמות ספציפי באזור, לנתח את האזור המסוים או לקצץ את הרקמה לאחר קיבוע רקמה.
זהירות: פתרון PFA הוא רעיל. זלוף transcardial וכל טיפול העכבר עוקב חייב להתנהל במנדף ועם ציוד מגן אישי.
3. עירוי מונומר הידרוג'ל ו Polymerization
- דגירת האיברים הקבועים בתמיסת מונומר הידרוג'ל A4P0 ב 4 מעלות צלזיוס במשך 12-24 שעות עם רעד עדין.
- הידרוג'ל מונומר חדור פילמור רקמות.
- מעבירים את המדגם כדי צינור 10 מ"ל מסביב לתחתית עם 5 מ"ל של תמיסת מונומר הידרוג'ל. עוטפים את החלק העליון של הצינור מסביב לתחתית עם Parafilm.
- הסר את החמצן מהצינור מסביב לתחתית המכיל מדגם במוח העכבר כולו רווי-הידרוג'ל ידי מבעבע חנקן דרך נוזל דקות 1. במהירות ובעוצמה לסגור את צינור המכיל מדגם.
- מעבירים את הצינור כדי אמבט מים (37 מעלות צלזיוס) במשך 2 שעות.
- לשטוף את המדגם polymerized בקצרה עם 0.1x PBS להסיר הידרוג'ל עודף.
זהירות: מונומרים הידרוג'ל רעילים. כדי למנוע מגע עם העור עם מונומר הידרוג'ל, לבצע את כל ההליכים במנדף ועם ציוד מגן אישי, כולל מגן פנים, מעיל מעבדה, וכפפות.
רקמות polymerized: הערהניתן לאחסן אזיד הנתרן המכיל 0.1x PBS במשך יותר מ 2 שבועות ב 4 ° C..
זהירות: יזיד הנתרן הוא מאוד בחריפות רעילה. לבצע את כל ההליכים במנדף ועם ציוד מגן אישי, כולל מגן פנים, מעיל מעבדה, וכפפות.
4. ניקוי רקמות Electrophoretic (ETC)
- מעבירים את המדגם מפולמר מיכל רקמות למקם את המיכל רקמות בתא ETC.
- ממלאים את החדר ETC עם חיץ ETC באמצעות משאבת peristatic.
- הגדר את תנאי ETC ולהפעיל את ETC. השתמש בהגדרות הבאות.
- לקבלת הגדרות וכו 'עבור איברים שלמים, להשתמש בהגדרות הבאות: (1.5 אמפר), טמפרטורה (37 מעלות צלזיוס), זמן הריצה (6.0 שעות), מהירות משאבה (30 סל"ד).
- לקבלת הגדרות וכו 'עבור פרוסות מוח עכבר עבות 1 עד 2 מ"מ, השתמש את ההגדרות הבאות: נוכחי (1.5 אמפר), טמפרטורה (37 מעלות צלזיוס), זמן ריצה (2.0 שעות), מהירות משאבה (30 סל"ד).
- מדבקהוא פינה מדגם צינור חרוטי 50 מ"ל עם 45 מ"ל של 0.1x PBS. לשטוף מספר פעמים מדגם פינה עם PBS 0.1x עד בועות לא נראים כאשר הצינור הוא מזועזע בקצרה (כדי לאשר את הסרה מלאה של SDS).
5. immunolabeling של רקמות ACT-מעובד
- עבור במוח העכבר כולו: דגירה המדגם בנפח 3 מ"ל של פתרון נוגדנים המכיל PBS 1x, 6% אלבומין בסרום שור (BSA), 0.1% Triton X-100, ו אזיד הנתרן 0.01% (פתרון דילול נוגדן) עם דילול גורם של 1/500 עבור hydroxylase טירוזין (TH) נוגדן במשך 4 ימים ב 37 מעלות צלזיוס עם רעד קל. החלף את פתרון הנוגדן בסוף היום 2.
- לשטוף את המדגם בתוך שפופרת חרוטי 50 מ"ל עם 45 מ"ל של 0.1x PBS עבור 3 - 5 שעות ולשנות את חיץ כל שעה.
- דגירה המדגם בנפח 3 מ"ל של תמיסת דילול נוגדן עם גורם לדילול של 1/500 עבור נוגדנים משני נגד ארנב החמור 488 במשך 4 ימים ב 37 מעלות צלזיוס עם רעד קל. Replאס פתרונות הנוגדן המדולל ביום 2.
- עבור 1 עד 2 מ"מ רקמת המוח פרוס עבה: דגירה המדגם לילה או עד 1 יום בנפח 0.5- עד 1 מ"ל של תמיסת דילול נוגדן עם גורם לדילול של 1/500 נוגדן מסוג IV קולגן ב 37 ° C עם רעד קל.
- לשטוף את המדגם בתוך שפופרת חרוטי 15 מ"ל עם נפח של 12 מ"ל של PBS 0.1x עבור 1-2 שעות. שינוי למאגר כל שעה.
- דגירה המדגם בנפח 0.5- עד 1 מ"ל של תמיסת דילול נוגדן עם גורם לדילול של 1/500 עבור נוגדנים משני נגד ארנב Cy3 מצומדות לילה או עד 1 יום ב 37 מעלות צלזיוס עם רעד קל.
- לשטוף את המדגם ב 0.1x PBS עבור 3 - 5 שעות; לשנות את החיץ בכל שעה.
- לפני ההדמיה, דגירת המדגם ב כמות מתאימה של פתרון מעוקב-mount עבור 1 שעות בטמפרטורת חדר עם רעד עדין. חלף עם פתרון מעוקב הר טרי דגירת h 1 נוסף.
הערה: 76 סוג של נוגדנים עבד היטב ברקמות ACT-מעובד עכבר, כולל 31 נוגדנים חד שבטיים 14. רקמה טרום שכותרתו ניתן בשילוב עם immunolabeling של שני fluorochromes יותר ברקמת מעובד ACT.
6. immunolabeling של רקמות דחוסות (פרסטו)
- ג-PRESTO
הערה: ג-PRESTO מתאים מדגמים קטנים בגודל, כגון אשך כולו, כולו כליות, או חלקים קטנים של איברים גדולים יותר.- מעבירים את המדגם לתוך צינור 1.5 מ"ל, ולהוסיף 500 μL של פתרון דילול נוגדן עם גורם לדילול של 1/500 עבור נוגדן מסוג IV קולגן, ו צנטריפוגות צינור לעבר גרם 600 × 2 h.
- לשטוף את המדגם מוכתם PBS 0.1x על ידי צנטריפוגה ב g 600 × למשך 30 דקות.
- הוספת 500 μL של פתרון דילול נוגדן עם גורם לדילול של 1/500 עבור נוגדנים משני Cy3 מצומדות נגד ארנב צנטריפוגות ב 600 × גרם במשך 2 שעות.
- לשטוף את המדגם מוכתם 0.1x PBS על ידי צנטריפוגה ב g 600 × למשך 30 דקות.
- s-PRESTO
הערה: s-PRESTO מתאים רקמות גדולות.- הכן מזרק (נפח של 30 מ"ל) ולחבר אותו (איור 1 א) 3 כיווני שסתום. מדביק את השסתום עם אקדח דבק על התנאים בלחץ גבוה (איור 1B).
- מעביר את המדגם לתוך מזרק 3 הכיוונים מחוברים שסתום במצב-שהסתום הסגור.
- להוסיף 5 - 7 מ"ל של תמיסת דילול נוגדן עם גורם לדילול של 1/500 עבור נוגדן מסוג IV קולגן. שחרר את פתרון הנוגדנים לתוך המדגם ידי פתיחת השסתום.
- הגדר את הבוכנה במזרק למצב 17 מ"ל לספק מספיק מקום לתנועה עירוי / נסיגה. ניתן לעשות זאת במצב-שסתום פתוח. סגור את שסתום 3 כיוונים לאחר הגדרת המזרק נגמרה.
- מכניסים את המזרק המכיל את המדגם על משאבת מזרק. הגדר את התנאים משאבת מזרק כדי נפח עירוי / נסיגה של 10 מ"ל / דקה 4-דקות להשהות זמן על מצב מחזור מתמשך (איור 1 ג).
הערה: המשאבה ממלאה עד שהוא מגיע בנפח היעד (10 מיליליטר), ולאחר מכן לכיוון שינויים בזרימה לאחר הפסקה קצרה (4 דקות). - הפעל את משאבת מזרק במשך 3 - 24 שעות בטמפרטורת החדר (איור 1F).
- פתח את שסתום 3 כיוונים ולהחליף פתרון עם PBS 0.1x.
- לשטוף את המדגם מוכתם פעמיים עם 0.1x PBS עבור h 1 בכל פעם באמצעות משאבת מזרק.
- שנה עם פתרון דילול נוגדן המכיל Cy3 מצומדות נגד ארנב נוגדנים משני (גורם לדילול של 1/500) ולהפעיל את משאבת מזרק במשך 3 - 24 שעות.
- פתח את שסתום 3 כיוונים ולהחליף פתרון עם PBS 0.1x.
- לפני הדמיה, דגירה מדגם מוכתם הכמות המתאימה של פתרון מעוקב-mount עבור 1 שעות בטמפרטורת החדר עם רעד עדין. חלף עם פתרון מעוקב הר טרי דגירת h 1 נוסף.
7. אניmaging
- הנח את הרקמה שכותרתו בצלחת confocal ולהוסיף פתרון מעוקב-mount עד הרקמה מכוסית. מניחים coverslip על הרקמה. שימוש במיקרוסקופ confocal לתדמית הרקמה 14 תחת המטרה 10X.
תוצאות
סליקת ACT-רקמה
אחד שיקולים חשובים המשפיעים סליקת רקמות הם קיבעון רקמות. קיבעון עירוי acrylamide PFA הם שלבים נפרדים בפרוטוקול זה. לאחר שלב פילמור הידרוג'ל-רקמה, פתרון A4P0 חינם אינו polymerized, למרות הידרוג חדורים רקמות הם צולבים עם מקרומולקולות אנדוגני. לפיכך, לא ג'ל צריך טופס מחוץ הרקמות (איור 2 א). תוצאות ההליך ACT בפחות cross-linking בין חלבונים acrylamide לעומת פרוטוקול CLARITY. בהתאם לכך, מדגם הידרוג'ל הרקמות הוא נקבובי יותר. תכונה זו מאפשרת מיצוי מהיר של ליפידים ואת דיפוזיה של מולקולות. קטעי עכבר המוח 1- עד 2 מ"מ עבה פונו מספקת בתוך 1 - 2 h (תרשים 2B), ו 5 - 6 שעות של ETC הספיקה גlearance של מוח עכבר השלם (איור 2 ג). סליקת רקמות בתיווך הידרוג'ל מושרה הרחבת הרקמות לאחר שלב ETC, אך הרקמה חזרה לגודלו המקורי בתמיסת מדד בהתאמה רעיונית. מדגם הידרוג'ל הרקמות נוצר בהליך ACT הוא נקבובי ביותר, וכך, תרכובות קטנות מקרומולקולות יכולים לחדור ביעילות לנטרל בקלות (איור 3). לאחר דגירה 2-h של פרוסות המוח 1 מ"מ עם hydroxylase טירוזין (TH) נוגדנים מסוג IV קולגן, דגירה 2-h לאחר מכן עם נוגדנים משני הספיק לתייג נוירונים דופאמינרגיים בעומק 500 מיקרומטר (איור 3) .
Presto-רקמות immunolabeling
יש איברים צפופים בדרך כלל בריכוזים גבוהים של סיבי ECM, אשר משפיע על החדירה של נוגדנים לתוך הרקמות. לפיכך, נוגדנים penetמדורג עד לעומק של רק 20-30 מיקרומטר ברקמות צפופות, כגון רקמת כליה, לאחר 12 שעות של דגירה. כדי להתגבר על מגבלה זו, עצבנו שיטות חדירות מקרומולקולה פעילות המאפשרות המשלוח של חומרים כימיים לתוך רקמות עמוקות, כלומר PRESTO (לחץ קשור העברה יעילה ויציבה של מקרומולקולות לתוך האיברים) (איור 4). לעומת הדגירה סטטי של רקמת כליה-מעובד ACT עם פתרונות נוגדנים, היישום של כוחות צנטריפוגליים (600 XG) עם צנטריפוגות בטבלה עליונה (פרסטו, ג-PRESTO צנטריפוגלי) משלוח הנוגדן השתפר מאוד לתוך רקמות עמוקות (איור 5). כאשר אנו להחיל את הליך ג-PRESTO לרקמות צפופות, 3 שעות של אינקובציה היו מספיק לתייג 250 עד 300 מיקרומטר מבנים עמוקים. כדי לשפר את עיוות רקמות ללא נזק לרקמות משמעותי, גם עיצבנו מכונת המספק תזרים הסעה עם משאבת מזרק (מזרק PRESTO, s-פרסטו). תהליך זה PE נוגדן השתפר באופן דומה netration לעומת דיפוזיה פסיבית (איור 5).
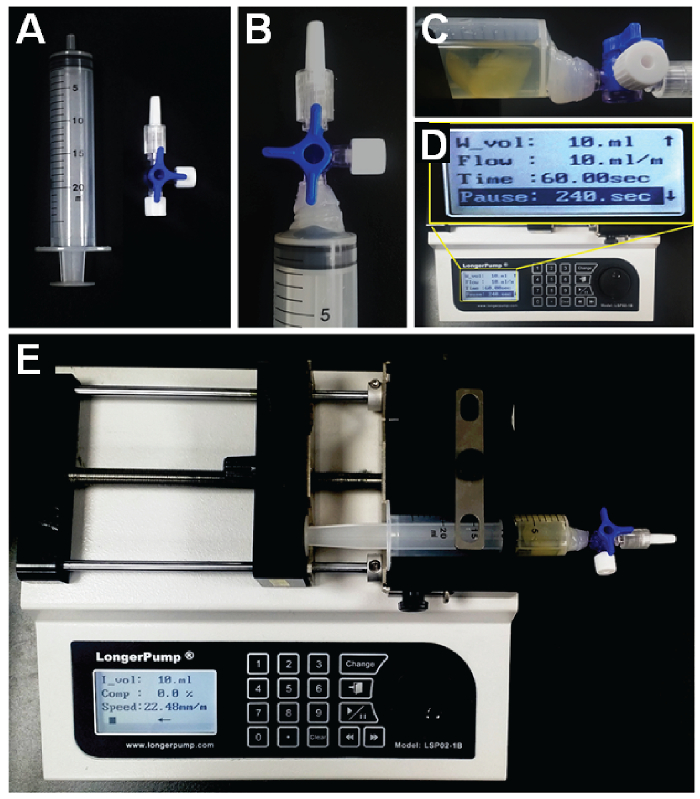
הכנה איור 1. של מנגנון s-פרסטו. א מזרק (30 מ"ל) ו שסתום משולשת. .ב שסתום המשולש מחובר ומודבק המזרק. ג מזרק המכיל את הפתרון מדגם נוגדנים, ואת מזרק דגש על משאבת מזרק. ד משאבת מזרק התקנת תנאי עבודה. .ה משאבת ממלאה תמיסה המכילה חומרים כימיים התיוג לתוך הדגימה. כאשר הנפח המיועד הוא הגיע, שינוי כיוון שאיבה ייסוג הפתרון לאחר פרק זמן מוגדר של זמן. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
EP-together.within-page = "1"> 
איור 2. סליקת רקמות ACT של מוח עכבר. א לאחר פילמור, פתרונות A4P0 חינמיים לא polymerized; הידרוג חדורים רקמות gelated ידי cross-linking עם מקרומולקולות אנדוגני. ב 1- פרוסות מוח עבות מ"מ 2 פוניו 1 - 2 שעות, ואת היקף ההרחבה והתאוששות גודל באינדקס רעיוני (RI) פתרון -matching נרשם. העובי ג במוח העכבר כולו הוא כ -0.8 ס"מ, ו 5 - 6 שעות של ETC היה מספיק כדי לנקות לחלוטין את המוח. אחרי 3 שעות של ETC, הייתה כמות משמעותית של רקמה שאינן נמחק. על ידי 6 שעות של ETC, לעומת זאת, סליקה של המוח כולו התרחשה. הצבע של רקמות לאחר ACT למאגר ETC הוא לבן או אטום. על ידי התאמת RI, הרקמות להיות שקופות. אנא לחץ אותהדואר כדי לצפות בגרסה גדולה יותר של דמות זו.
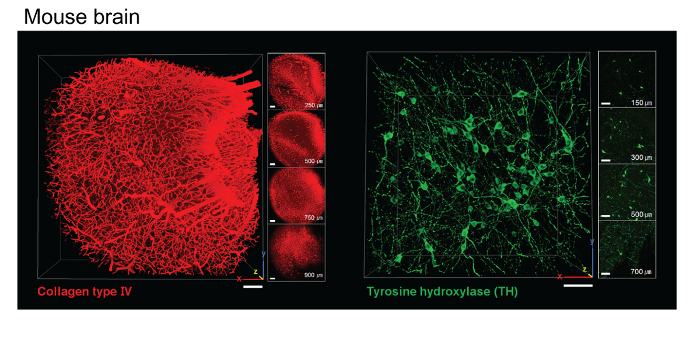
איור 3. immunolabeling עם רקמת מוח עכבר פינת ACT. תמונות של פרוסות מוח עכבר ACT-מעובד 1 מ"מ מראות קליפת עכבר מוח מוכתמת נוגדן מסוג IV קולגן חלק של המוח התיכון מוכתם נוגדן כדי טירוזין hydroxylase (TH). סרגל קנה מידה, 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
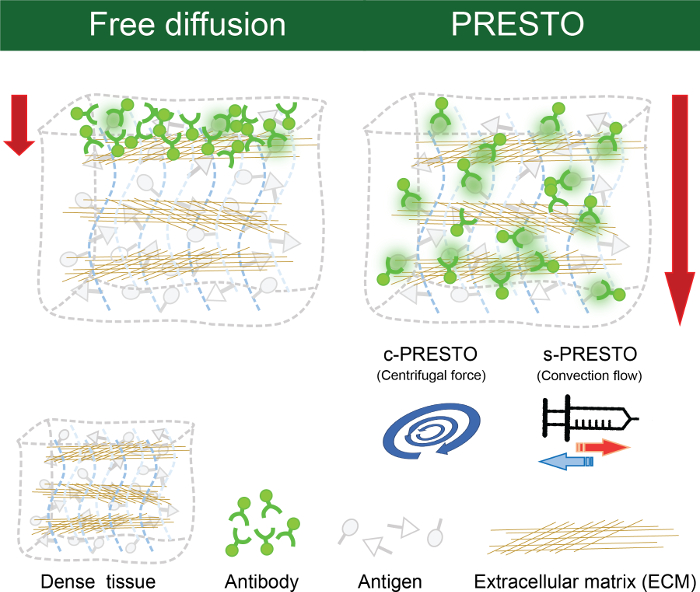
איור 4. PRESTO שיטות immunolabeling. נוגדנים אינם יכולים לחדור לרקמות צפופות על ידי דיפוזיה. שיטות immunolabeling PRESTO נועדו להחדיר מקרומולקולות לספק ריאגנטים אקטיבייםרקמות צפופות. היישום של כוחות צנטריפוגליים באמצעות צנטריפוגות בטבלה העליונה סטנדרטי (צנטריפוגלי PRESTO, ג-פרסטו) ניכרת הקל על משלוח של נוגדנים. Appling זרימת הסעה עם משאבת מזרק (מזרק PRESTO, s-פרסטו) השתפרה חדירת נוגדן. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
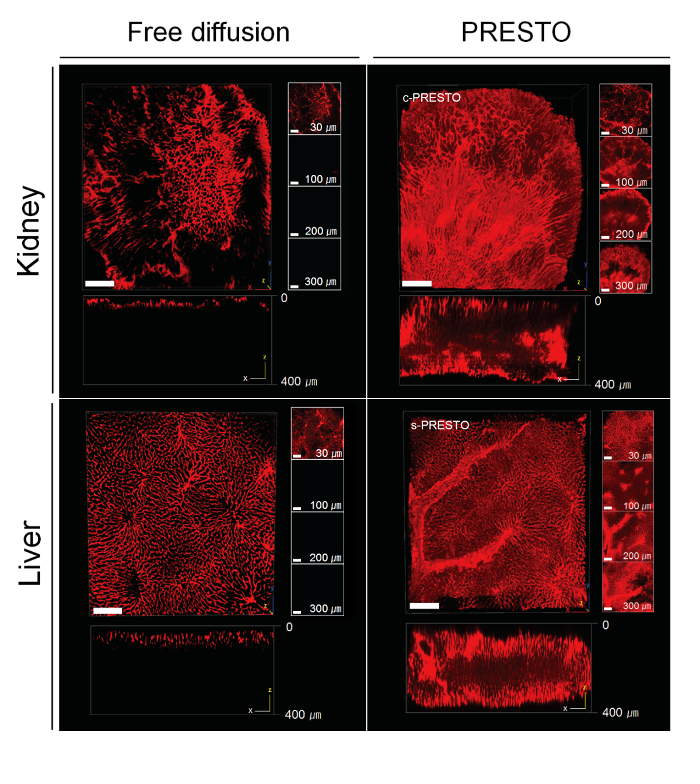
איור 5. PRESTO immunolabeling של רקמה צפופה פינת ACT. עבור C-פרסטו, רקמות היו centrifuged ב 600 XG למשך 3 שעות באמצעות צנטריפוגות בטבלה עליונה סטנדרטית כדי להאיץ את החדירה של נוגדנים ראשוניים ומשניים. עבור s-פרסטו, משאבת מזרק היה בשימוש בכדי לשלוח את הנוגדנים. איברי עכבר, כגון כליות והכבדות, תויגו עם IV סוג קולגן. בהשוואה לשיטות קונבנציונליות, 3 שעות שלC- או s-PRESTO משפר את עומק התיוג ניכר. בכליות ובכבד, עומק הציר-Z מגיע 300 - 350 מיקרומטר או עמוקים בדגימות PRESTO (מימין), בעוד דגימות בקרה מסומנות בעומק של רק 40 - 50 מיקרומטר (משמאל). תמונה משוחזרת 3D הושגה עם מיקרוסקופ confocal. סרגל קנה מידה, 100 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
קיבעון או טבילת הידרוג'ל מסכן לרקמות יכול לגרום לאובדן של חלבונים ואת העיוות של רקמות במהלך תהליך ניקוי רקמות. מוח עכבר הבוגר כולה צריך להיות וטופחיו paraformaldehyde 4% בין לילה, ואחריו טבילת נפח מינימאלי של 20 מיליליטר של תמיסת מונומר הידרוג'ל במשך 12 - 18 שעות עם רעד עדין. עבור רקמות גדולות, כולל רקמה אנושית כגון פרוסות המוח וחוט השדרה, הוארך השריה זמן בפתרון מונומר הידרוג'ל נדרש. פרוטוקול ACT ישימה בקלות פעולות הסליקה של רקמות קבועות משום ששלבי עירוי פולימר קיבעון רקמות מופרדים. לאחר ניקוי רקמות, רקמות אנושיות היו היטב מוכתם כמה נוגדנים. ראוי לציין, כי טכניקת סליקת ACT אינה תואמת fixatives אלכוהול, כגון אתנול, מתנול.
צעד פילמור הידרוג'ל הרקמות חיוני גם כדי לייצר רקמות באיכות טובה לאחר תהליך הסליקה. כיחמצן מעכב את פילמור של acrylamide, יש להסירו ידי degassing הפתרון המכילים הרקמה תחת מערכת עירוי גז חנקן. לחלופין, דה-חמצון ניתן לבצע באמצעות תא ואקום עם גוש חום במשך 23 שעות.
שיעור הסליקה תלוי בגורמים רבים, כולל גודל האיבר, את התוכן של שומנים או חלבונים סיביים ECM, התנאי של קיבעון, וכו רקמות עכבר רוב הבוגרים ניתן לסליקה על ידי ETC הלילה. עם זאת, קיים סיכון של מיותר על סליקה ונפיחות רקמות; וכך, ההבדלים בזמן סליקה של שיקול חשוב. תנאי רקמות סליקה יש לקבוע באופן אמפירי. חשוב לציין, את התוכן של ECM עשוי להשפיע על המראה של רקמת הפינה. הצבע של הרקמות נשאר לבן או אטום, גם לאחר ACT במאגר וכו ', כי אין דבר לנקות סיבי חלבון צפופים. עם זאת, כאשר גופים אלה היו שקועים פתרון התאמת RI, אתy הפך שקוף.
שיעור נפיחות רקמה שנראה תלוי תוכן ECM של הרקמות, ואיברים רכים, כמו המוח, להפגין יחס נפיחות גדול יותר איברים צפופים. בגלל רקמה עלתה נפיחות תעזור ההליך לסליקת רקמות, ACT שגרתי מנצל מזוקק חיץ על בסיס מים ברוב המקרים. במקרים מסוימים, כאשר נפיחות רקמות או עיוות חולפת אינן רצויות, כגון בעוברים, PBS 0.1x מאגר המכיל ניתן ליישם הדמיה ברזולוציה גבוהה. כמו כן יש לציין כי ריכוז מלח גבוה למאגר עלול לגרום ההתכווצות של רקמות.
שיטת ACT יכולה להבהיר איברים שלמים ואפילו כל הגוף של עכבר 14. עם זאת, הדמית רקמות עמוקות של רקמה שקופה דורשת מיקרוסקופים ויעדים מיוחדים. לכן, מוח רקמות 1 עד 2 מ"מ עבה הוא יעיל ביותר עבור הדמיה באמצעות מיקרוסקופ confocal קונבנציונלי. בידיים שלנו, הסרת תוויתנוגדני ed מרקמות מעובד ACT הוא נוגדן תלוי, ופגזים של תיוג נוגדן שונה אינם מומלצים. נוגדנים אחדים, כגון TH ו GFAP, עבדו טוב במיוחד עבור המוח כולו immunolabeling 14. מצד שני, כמה נוגדנים, כגון Tuj1 או MAP2, לעתים קרובות שכותרתו רק את פני השטח של הרקמות. זה עשוי להשתפר על ידי שיטות אחרות, כגון מתג 15. הגבלת פוטנציאל נוספת היא שזה עלול להיות קשה לשמר מבנים חלבוניים בסדר ברקמת ACT-מעובד בגלל רקמת נפיחות התכווצות במהלך שלב ניקוי הרקמות.
טכניקת PRESTO ישימה למגוון רחב של טכניקות תיוג רקמות. לדוגמא, בשיטות רקמה שקופה בעזרת רקמות מראש שכותרתו, כגון SeeDB 4 ו iDISCO 7, immunolabeling של רקמה צפופה דורש תקופות דגירה ארוכות יותר בכמה ימים עד שבועות. עם זאת, PRESTO יכול לקצר את זמן הדגירה לכמה שעות, דוארnabling השלמת התהליך כולו תוך יום עם רקמה צפופה בעובי 1 מ"מ. PRESTO יכול לשפר את היעילות של תיוג עמוק עבה, רקמות צפופות, או אפילו רקמות עבות un-פינה. בגלל PRESTO משתמשת צנטריפוגות בטבלה העליונה או משאבת מזרק ואינו דורש שום ציוד מיוחד, קל יחסית ליישום הטכניקה הזו לנהלים מעבדה שגרתיות.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
This research was supported by the Brain Research Program through the National Research Foundation (NRF) funded by the Korean Ministry of Science, ICT, and Future Planning (NRF-2015M3C7A1028790).
Materials
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | Lugen SCI | LGB-1175-4B | sample fixation |
| Acrylamide | Affymetrix | 75820 | Hydrogel monomer solution |
| 2,2’-Azobis[2-(2-imidazolin-2-yl) propane] dihydrochloride | Wako Pure Chemical Industries | VA-044 | Hydrogel monomer solution |
| Boric acid | Affymetrix | 76324 | ETC buffer |
| Sodium Dodecyl Sulfate (SDS) | Affymetrix | 18220 | ETC buffer |
| Sodium hydroxide pellets | Junsei chemical | 1310-73-2 | ETC buffer |
| Bovine Serum Albumin (BSA) | Santa Cruz Biotechnology | sc-2323A | Immunolabeling |
| Triton X-100 | Sigma-Aldrich | T8787 | Immunolabeling |
| Sodium azide | Sigma-Aldrich | S2002 | Immunolabeling |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | Antibody/immunolabeling |
| Alexa Fluor Cy3 Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-165-152 | Secondary antibody/ immunolabeling |
| Alexa Fluor 488 Donkey anti-Rabbit IgG (H+L) | Life Technologies - Molecular Probes | A21206 | Secondary antibody/ immunolabeling |
| Confocal dish | SPL lifesciences | 101350 | Imaging |
| Confocal microscope | Leica | SP8 | Imaging |
| Sucrose | Junsei chemical | 31365-0301 | CUBIC-mount solution |
| Urea | Affymetrix | 23036 | CUBIC-mount solution |
| N,N,N’,N’-tetrakis(2-hydroxypropyl)ethylenediamine | Sigma-Aldrich | 122262 | CUBIC-mount solution |
| ECT chamber | Logos Biosystems, Inc. | C10101 | ETC system |
| ECT chamber controller | Logos Biosystems, Inc. | C10201 | ETC system |
| Temperature probe | Logos Biosystems, Inc. | C12101 | ETC system |
| Peristatic pump | Baoding longer precision pump Co., Ltd | YZ1515X | ETC system |
| Buffer reservoir | Logos Biosystems, Inc. | C10401 | ETC system |
| Tissue container | Logos Biosystems, Inc. | C12001 | ETC system |
| Container holder for 1 tissue container | Logos Biosystems, Inc. | C12002 | ETC system |
| Mouse brain slice holder | Logos Biosystems, Inc. | C12004 | ETC system |
| Whole rat brain holder | Logos Biosystems, Inc. | C12007 | ETC system |
| Peristaltic pump tubing | Logos Biosystems, Inc. | C12104 | ETC system |
| Tabletop-centrifuge | Hanil science industrial Co., Ltd | MICRO 12 | c-PRESTO |
| Syringe pump | Baoding longer precision pump Co., Ltd | LSP02-1B | s-PRESTO |
| Syringe (30 mL) | Korea vaccine Co., Ltd. | KV-S30 | s-PRESTO |
| 3-way stopcock | Hyupsung medical Co.,Ltd. | HS-T-01N | s-PRESTO |
References
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Dodt, H. -. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat Methods. 4, 331-336 (2007).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. NATURE. 497, 332-337 (2013).
- Ke, M. -. T., Fujimoto, S., Imai, T. SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 16, 1154-1161 (2013).
- Ertürk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nat Protoc. 7, 1983-1995 (2012).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat Neurosci. 14, 1481-1488 (2011).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159, 896-910 (2014).
- Susaki, E. A., et al. Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis. Cell. 157, 726-739 (2014).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158, 945-958 (2014).
- Kim, S. -. Y., Chung, K., Deisseroth, K. Light microscopy mapping of connections in the intact brain. Trends Cogn Sci. 17, 596-599 (2013).
- Yushchenko, D. A., Schultz, C. Tissue clearing for optical anatomy. Angew Chem Int Edit. 52, 10949-10951 (2013).
- Tomer, R., Ye, L., Hsueh, B., Deisseroth, K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9, 1682-1697 (2014).
- Lee, E., et al. ACT-PRESTO: Rapid and consistent tissue clearing and labeling method for 3-dimensional (3D) imaging. Sci Rep. 6, 18631 (2016).
- Murray, E., et al. Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell. 163, 1500-1514 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved