Method Article
ACT-PRESTO: Aclaración del tejido biológico y métodos para immunolabeling Volume Imaging
En este artículo
Resumen
ACT-PRESTO (claridad técnica de presión activa derivada de la transmisión eficiente y estable de macromoléculas en órganos) permite el despeje rápido de los tejidos, eficiente, pero de bajo costo y la penetración rápida de anticuerpos en los tejidos aclarados por difusión pasiva o el parto asistido por presión. Usando este método, una amplia gama de tejidos se puede borrar, immunolabeled de múltiples anticuerpos, y la imagen de volumen.
Resumen
La identificación y la exploración de la organización detallada de los órganos o de todo el cuerpo a nivel celular son retos fundamentales de la biología. métodos transitorias requieren una cantidad sustancial de tiempo y esfuerzo para obtener una imagen en 3D y que incluye seccionar el tejido intacto, immunolabeling, y de formación de imágenes de tejido seccionada en serie, que produce una pérdida de información en cada paso del proceso. En los enfoques desarrollados recientemente para obtener imágenes de alta resolución dentro de tejido intacto, la caracterización molecular se ha restringido al etiquetado de proteínas. Sin embargo, los protocolos disponibles en la actualidad para la compensación de órganos requieren un tiempo considerablemente largo proceso, por lo que es difícil de poner en práctica las técnicas de limpieza y eliminación de tejido en el laboratorio. Recientemente hemos establecido un protocolo rápido y altamente reproducible denomina ACT-PRESTO (a ctivo c laridad t echnique- p resión r eufórico e ficiente y s tabla TRANSFERENCIAde macromoléculas en o rgans), que permite para el despacho de tejido dentro de varias horas. Por otra parte, ACT-PRESTO permite immunolabeling rápido con los métodos convencionales y acelera la penetración de anticuerpos en la capa profunda de formados densamente especímenes, de espesor mediante la aplicación de flujo de la presión o de convección. Se describe cómo preparar los tejidos, cómo borrar mediante la eliminación de lípidos mediante electroforesis, y la forma de inmuno-mancha por un parto asistido por presión. La rapidez y la consistencia del protocolo serán agilizar el curso de la investigación histológica 3D y diagnósticos basados en el volumen.
Introducción
Uno de los retos de la neurociencia es la visualización de cableado de circuitos neuronales y las células individuales dentro del tejido cerebral intacta. Hasta hace poco tiempo, lo que demuestra las conexiones entre las neuronas de esta manera la necesidad 1) cortes seriados de los tejidos; 2) el etiquetado molecular de objetivos específicos, como los axones o proteínas; y 3) la visualización de reconstrucción en 3D de todo el cerebro a través de registro o alineación de imágenes 2D en serie 1 computacional. Estos pasos son laboriosos, requieren una gran cantidad de tiempo, y son susceptibles de perder información durante el corte y el etiquetado, haciendo asignación de red neuronal extremadamente difícil. Sin embargo, se han desarrollado muchos métodos que permiten la visualización de tejido intacto sin seccionar. Los tejidos biológicos pueden hacerse ópticamente transparente mediante técnicas de limpieza de tejido 2-10. Uno de los principales métodos es reducir las diferencias de índice de refracción entre el tejido intacto y la solución de inmersión con el finpara reducir la dispersión de la luz en el tejido intacto, reduciendo así al tejido transparente y que permite la observación de estructuras profundas. Algunos tipos de soluciones de inmersión tienen propiedades hidrófobas, que dan como resultado la extinción fluorescente rápido durante el procedimiento de deshidratación. Por lo tanto, estos métodos no son compatibles con imágenes fluorescentes durante un largo período de tiempo 11,12. En lugar de reactivos hidrófobos, otros métodos utilizan reactivos hidrófilos para la compensación de tejido, tales como SeeDB 4 y Sca l e 6, que mantienen la información estructural y de fluorescencia de la 4,6,8 tejido biológico. Sin embargo, macromoléculas, incluyendo anticuerpos, pueden no alcanzar el núcleo de tejido intacto solamente por difusión. Por lo tanto, el pre-etiquetado de moléculas diana en las zonas profundas de los tejidos densamente empaquetadas-es técnicamente difícil.
En un método de limpieza de tejido desarrollado recientemente, CLARITY 3, un tejido biológico i hidrogel incrustados forman con acrilamida, y los lípidos se eliminan mediante electroforesis en dodecil sulfato de sodio solución -Con (SDS). La muestra se sumerge luego en una solución con un índice de reflexión a juego para reducir la luz de dispersión 3. El sistema de eliminación de lípidos se modificó posteriormente en CLARIDAD avanzada 13 y PACT (técnica claridad pasiva) 10. Después de la polimerización, las cadenas de acrilamida reticulan con proteínas, formador de hidrogel tejido. componentes lipídicos no se puede reticular con acrilamida; Por lo tanto, los lípidos pueden ser eliminados por electroforesis en el tampón que contiene SDS. A través de la eliminación activa de los lípidos, el tejido cerebral aumenta notablemente en la transparencia 9. Sin embargo, estos métodos no se ocupan de la imposibilidad de etiquetado de profundidad por difusión libre. Para superar esta limitación, se requieren técnicas para el transporte activo de los reactivos en las partes más profundas de los tejidos gruesos.
Aunque CLARIDAD permite limpieza de tejidos y de tejidos profundosvisualización, no es un procedimiento fácil o rápida. Puede tomar varias semanas para borrar todo un 7,14 cerebro de ratón. compensación rápida de los tejidos es esencial para la aplicación de tales métodos en los ajustes básicos o clínicos de laboratorio para la investigación de ciencias de la vida o el diagnóstico de volumen. El protocolo actual proporciona un proceso simplificado para la remoción de tejido biológico y la detección de proteínas posterior por asistida por presión y entrega inmuno-tinción. Es conveniente para la alta resolución de imagen de volumen de los sistemas de procesamiento de datos grandes y presentada en 3D a través de combinación con métodos de imagen.
Protocolo
Los experimentos con animales deben cumplir con todas las regulaciones gubernamentales e institucionales pertinentes.
1. Preparación de los reactivos
- Para la solución de monómero de hidrogel (A4P0): Añadir 20 g de acrilamida a 450 ml de 0,1x de buffer fosfato salino (PBS) y ajustar el volumen a 500 ml con 0,1 x PBS.
PRECAUCIÓN: monómeros de acrilamida son tóxicos. Realizar todos los procedimientos en una campana de humos con el equipo de protección personal, incluyendo un protector facial, una bata de laboratorio, guantes y zapatos cerrados.- Inmediatamente antes de usar, añadir 100 mg de 2,2'-azobis [2- (2-imidazolin-2-il) propano] dihidrocloruro a 40 ml de solución de monómero de hidrogel (A4P0) en un tubo cónico de 50 ml bajo una campana de humos .
- Para el claro tampón electroforético tejido (ETC): Añadir 40 g de dodecilsulfato de sodio (SDS) y 12,37 g de ácido bórico y 800 ml de H2O desionizada (dH2O). Ajustar el pH a 8,5 con NaOH y ajustar el volumen de1 litro con dH 2 O. adicional
PRECAUCIÓN: El SDS es un producto químico nocivo; Por lo tanto, manejar con cuidado. - Para la solución CUBIC de montaje: Añadir 250 g de sacarosa, 125 g de urea, y 125 g de N, N, N ', N' -tetrakis (2-hidroxipropil) etilendiamina a 150 ml de dH 2 O y llevar el volumen a 500 ml con dH2O
2. Preparación de muestras y Fijación
- La eutanasia del ratón.
- Preparar la alfaxalona (1 mg / kg) y xilazina (0,5 mg / kg) en la misma jeringa.
- Intraperitoneal inyectar la mezcla de alfaxalona y xilazina y permiten 3 minutos para el ratón a la pérdida del conocimiento.
- Espere hasta que el ratón anestesiado ya no responde a los estímulos dolorosos, como un pellizco de la cola, antes de continuar.
PRECAUCIÓN: Siga las directrices institucionales apropiadas para el manejo de los animales.
- Transcardially perfundir el ratón con 100 ml de 0,9% de NaCl (pH 7.4 hasta 7.5) soluciónque contiene heparina (100 U / ml) para Exsanguinate, seguido de 100 ml de 4% de paraformaldehído (PFA) en 1x PBS (pH 7,4) 14.
PRECAUCIÓN: La solución de PFA es tóxico. La preparación de la solución de PFA y todas las manipulaciones posteriores debe llevarse a cabo en una campana de humos y con equipo de protección personal. - Cortar la cabeza del ratón, abrir la piel, y romper el cráneo entre los ojos utilizando unas tijeras pequeñas.
- Retire las piezas del cráneo con unas pinzas pequeñas y curvadas.
- Sacar el cerebro u órganos deseados.
- Incubar el cerebro y los órganos en el post-fix solución PFA 4% a 4 ° C durante la noche.
NOTA: para la limpieza de tejidos específicos de cada región, diseccionar la región específica o recortar el tejido después de la fijación del tejido.
PRECAUCIÓN: La solución de PFA es tóxico. La perfusión transcardial y toda la manipulación posterior del ratón deben llevarse a cabo en una campana de humos y con equipo de protección personal.
3. Hidrogel monómero de infusión y Polymerization
- Incubar los órganos fijos en solución de monómero de hidrogel A4P0 a 4 ° C durante 12 a 24 h con agitación suave.
- Hidrogel monómero-infundido polimerización tejido.
- Transferir la muestra a un tubo de fondo redondo de 10 ml con 5 ml de solución de monómero de hidrogel. Envolver la parte superior del tubo de fondo redondo con Parafilm.
- Eliminar el oxígeno desde el tubo de fondo redondo que contiene la totalidad de ratón muestra cerebro de hidrogel infundido por burbujeo de nitrógeno a través del líquido durante 1 min. De forma rápida y cerrar herméticamente el tubo que contiene la muestra.
- Transferir el tubo a un baño de agua (37ºC) durante 2 h.
- Lavar la muestra polimerizado brevemente con 0,1x PBS para eliminar el exceso de hidrogel.
PRECAUCIÓN: monómeros de hidrogel son tóxicos. Para evitar el contacto de la piel con monómero de hidrogel, realizar todos los procedimientos en una campana de humos y con equipo de protección personal, incluyendo un protector facial, una bata de laboratorio y guantes.
NOTA: Polimerizado tejidosse pueden almacenar en 0,1x PBS que contiene azida de sodio durante más de 2 semanas a 4 ° C.
PRECAUCIÓN: La azida sódica es altamente tóxico y de forma aguda. Realizar todos los procedimientos en una campana de humos y con equipo de protección personal, incluyendo un protector facial, una bata de laboratorio y guantes.
4. electroforética Tejido de compensación (ETC)
- Transferir la muestra polimerizado a un recipiente de tejido y colocar el recipiente en la cámara de tejido ETC.
- Llenar la cámara ETC ETC con tampón utilizando una bomba peristáltica.
- Establecer las condiciones ETC y ejecutar el ETC. Utilice los siguientes ajustes.
- Para la configuración de ETC para órganos enteros, utilice los siguientes ajustes: (1.5 amperios), la temperatura (37 ° C), el tiempo (6.0 h), velocidad de la bomba (30 rpm) que se ejecuta.
- Para la configuración de ETC para gruesas rebanadas de cerebro de ratón de 1 a 2 mm, utilice la siguiente configuración: actual (1.5 amperios), la temperatura (37 ° C), el tiempo (2,0 h), velocidad de la bomba (30 rpm) que se ejecuta.
- transferencia tse aclaró la muestra a un tubo cónico de 50 ml con 45 ml de PBS 0,1x. Lavar la muestra varias veces compensados con 0,1x PBS hasta que no se ven burbujas cuando el tubo se agita brevemente (para confirmar la eliminación completa de SDS).
5. Immunolabeling de los tejidos de ACT-procesado
- Para el conjunto de cerebro de ratón: Se incuba la muestra en un volumen de 3 ml de solución de anticuerpo que contiene 1x PBS, 6% de albúmina de suero bovino (BSA), 0,1% de Triton X-100, y azida sódica al 0,01% (solución de dilución de anticuerpo) con una dilución factor 1/500 para tirosina hidroxilasa anticuerpo (TH) durante 4 días a 37 ° C con agitación suave. Vuelva a colocar la solución de anticuerpos al final del día 2.
- Lavar la muestra en un tubo cónico de 50 ml con 45 ml de 0,1 x PBS durante 3 - 5 h y cambiar el tampón cada hora.
- Incubar la muestra en un volumen de 3 ml de solución de dilución de anticuerpo con un factor de dilución de 1/500 de burro anti-conejo 488 anticuerpo secundario durante 4 días a 37 ° C con agitación suave. replas de las soluciones diluidas de anticuerpos en el día 2.
- Para 1- a grueso tejido cerebral en rodajas 2-mm: Incubar la muestra durante la noche o durante un máximo de 1 día en un volumen de 0,5 a 1 ml de la solución de dilución de anticuerpo con un factor de dilución de 1/500 para el anticuerpo de colágeno de tipo IV en 37 ° C con agitación suave.
- Lavar la muestra en un tubo cónico de 15 ml con un volumen de 12 ml de 0,1 x PBS durante 1-2 h. Cambiar el tampón cada hora.
- Incubar la muestra en un volumen de 0,5 a 1 ml de la solución de dilución de anticuerpo con un factor de dilución de 1/500 para Cy3 conjugado con anti-anticuerpo secundario de conejo durante la noche o durante un máximo de 1 día a 37 ° C con agitación suave.
- Lavar la muestra con 0,1 x PBS por 3 - 5 horas; cambiar el tampón cada hora.
- Antes de la proyección de imagen, se incuba la muestra en una cantidad apropiada de solución cúbicas de montaje para 1 h a temperatura ambiente con agitación suave. Reemplazar con solución cúbicas montaje fresco y se incuba durante 1 hora adicional.
NOTA: 76 Tipo de anticuerpos funcionó bien en el tejido ACT-procesado de ratón, incluyendo 31 14 anticuerpos monoclonales. tejido Pre-marcado se puede combinar con la inmunomarcación de dos fluorocromos más en el tejido procesado-ACT.
6. Immunolabeling de tejidos densos (PRESTO)
- c-PRESTO
NOTA: c-PRESTO es adecuado para muestras de pequeño tamaño, como los testículos conjunto, riñón entero, o pequeñas secciones de los órganos más grandes.- Transferir la muestra en un tubo de 1,5 ml, añadir 500 l de solución de dilución de anticuerpo con un factor de dilución de 1/500 de anticuerpo de colágeno de tipo IV, y se centrifuga el tubo a 600 xg durante 2 h.
- Lavar la muestra teñida con 0,1x PBS mediante centrifugación a 600 xg durante 30 min.
- Añadir 500 l de solución de dilución de anticuerpo con un factor de dilución de 1/500 para Cy3 conjugado con anti-anticuerpo secundario de conejo y se centrifuga a 600 xg durante 2 h.
- Lavar la muestra teñida con 0.1x PBS mediante centrifugación a 600 xg durante 30 min.
- s-PRESTO
NOTA: s-PRESTO es adecuado para tejidos más grandes.- Preparar una jeringa (volumen 30 ml) y conectarlo a una válvula de 3 vías (Figura 1A). Pegue la válvula con una pistola de pegamento para las condiciones de alta presión (Figura 1B).
- Transferir la muestra en la jeringa válvula de 3 vías conectadas en la posición cerrada de la válvula.
- Añadir 5 - 7 ml de diluyente de anticuerpo con un factor de dilución de 1/500 de anticuerpo de colágeno de tipo IV. Soltar la solución de anticuerpo en la muestra con la apertura de la válvula.
- Establecer el émbolo de la jeringa hasta la posición de 17 ml para proporcionar suficiente espacio para el movimiento de infusión / extracción. Esto se puede hacer en la posición de válvula abierta. Cierre la válvula de 3 vías después de que el ajuste de la jeringa está terminado.
- Ponga la jeringa que contiene la muestra en una bomba de jeringa. Establecer las condiciones de la bomba de jeringa a un volumen de infusión / retirada de 10 mL / min y un 4-min tiempo de pausa en el modo de ciclo continuo (Figura 1C).
Nota: La bomba infunde hasta que alcanza el volumen objetivo (10 ml), y entonces la dirección de los cambios de flujo después de una breve pausa (4 min). - Haga funcionar la bomba de jeringa durante 3 - 24 horas a temperatura ambiente (Figura 1F).
- Abrir la válvula de 3 vías y reemplazar la solución con 0,1 x PBS.
- Lavar la muestra teñida dos veces con 0,1x PBS durante 1 h cada vez usando la bomba de jeringa.
- Cambie con solución de dilución de anticuerpo que contiene conjugado con Cy3 anti-anticuerpo secundario de conejo (factor de dilución de 1/500) y ejecutar la bomba de jeringa por 3 - 24 h.
- Abrir la válvula de 3 vías y reemplazar la solución con 0,1 x PBS.
- Antes de la proyección de imagen, se incuba la muestra teñida en una cantidad apropiada de solución cúbicas de montaje para 1 h a temperatura ambiente con agitación suave. Reemplazar con solución cúbicas montaje fresco y se incuba durante 1 hora adicional.
7. Iforjamagia
- Coloque el tejido etiquetados en un plato confocal y añadir solución cúbicas de montaje hasta que se cubrió el tejido. Colocar un cubreobjetos sobre el tejido. Utilizar un microscopio confocal para la imagen del tejido 14 bajo el objetivo de 10X.
Resultados
Compensación ACT-tejido
Un factor importante que afecta el tejido de compensación es la fijación del tejido. la fijación de PFA y la infusión de acrilamida son pasos separados en este protocolo. Después de la etapa de polimerización de tejido de hidrogel, la solución A4P0 libre no se polimeriza, aunque hidrogeles infundido tejidos son reticulado con macromoléculas endógenas. Por lo tanto, no debe formar gel fuera de los tejidos (Figura 2A). Los resultados del procedimiento reaccionar en menos entrecruzamiento entre las proteínas y acrilamida en comparación con el protocolo de la claridad. De acuerdo con ello, la muestra de tejido de hidrogel es más poroso. Esta característica permite la extracción rápida de los lípidos y la difusión de macromoléculas. Las secciones de cerebro de ratón de 1 a 2 mm de espesor fueron aclarado suficientemente dentro de 1 - 2 h (Figura 2B), e 5 - 6 horas de ETC fue suficiente para clearance de cerebros de ratones enteros (Figura 2C). compensación de tejido de hidrogel mediada indujo la expansión del tejido después de la etapa ETC, pero el tejido vuelve a su tamaño original en solución índice de concordancia reflectante. La muestra de tejido de hidrogel formado en el procedimiento de ACT es altamente poroso, y por lo tanto, pequeños compuestos y macromoléculas podía penetrar de manera eficiente y difundirse fácilmente (Figura 3). Después de un 2-h de incubación de las secciones de cerebro de 1 mm con tirosina hidroxilasa (TH) y el anticuerpo de colágeno de tipo IV, un posterior 2 h de incubación con un anticuerpo secundario era suficiente para marcar las neuronas dopaminérgicas en una profundidad 500 mm (Figura 3) .
Immunolabeling PRESTO-tejido
órganos densos tienen generalmente altas concentraciones de fibras de ECM, que afecta a la penetración de los anticuerpos en los tejidos. Por lo tanto, los anticuerpos Penetclasificar a una profundidad de sólo 20 a 30 micras en los tejidos densos, como el tejido del riñón, después de 12 h de incubación. Para superar esta limitación, hemos diseñado métodos de penetración macromolécula activos que permiten la entrega de reactivos en los tejidos profundos, a saber PRESTO (presión relacionados con la transferencia eficiente y estable de macromoléculas en los órganos) (Figura 4). En comparación con la incubación estática de tejido renal ACT-procesado con soluciones de anticuerpos, la aplicación de fuerzas centrífugas (600 xg) con una centrífuga de sobremesa (PRESTO centrífuga, c-PRESTO) mejorado en gran medida la entrega de anticuerpos en el tejido profundo (Figura 5). Cuando se aplicó el procedimiento de c-PRESTO a los tejidos densos, 3 h de incubación fue suficiente para marcar de 250 a estructuras profundas de 300 micras. Para mejorar la distorsión del tejido sin daño tisular significativa, así como para diseñar una máquina que proporciona un flujo de convección con una bomba de jeringa (PRESTO jeringa, s-PRESTO). Este proceso mejorado de manera similar pe anticuerposnetration en comparación con la difusión pasiva (Figura 5).
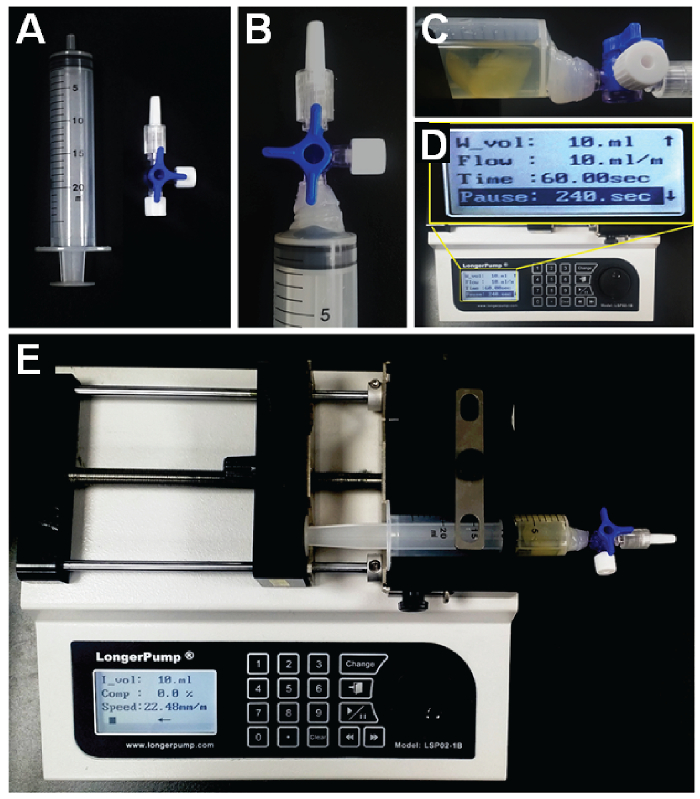
Figura 1. Preparación del aparato s-PRESTO. A. Una jeringa (30 ml) y llave de tres vías. B. La llave de tres vías conectada y pegado a la jeringa. C. La jeringa que contiene la solución de muestra y el anticuerpo, y la jeringa se coloca en la bomba de jeringa. D. La bomba de jeringa y la configuración de condiciones de trabajo. E. La bomba infunde una solución que contiene los reactivos de marcaje en la muestra. Cuando se alcanza el volumen designado, los cambios de dirección de bombeo y se retira la solución después de un período de tiempo determinado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. ACT compensación tejido de cerebro de ratón. A. Después de la polimerización, soluciones A4P0 libres no se polimerizan; hidrogeles infundido tejidos se gelifica por reticulación con macromoléculas endógenas. B. 1 a gruesas rodajas de cerebro de 2 mm se limpiaron durante 1 - 2 h, y el grado de expansión y la recuperación del tamaño de índice de refracción (RI) Solución De equiparación se registraron. C. El espesor de todo el cerebro del ratón es de aproximadamente 0,8 cm, e 5 - 6 horas de ETC fue suficiente para borrar por completo el cerebro. Después de 3 h de ETC, había una cantidad significativa de tejido no despejado. A los 6 h de ETC, sin embargo, se había producido la limpieza de todo el cerebro. El color de los tejidos después de ACT en el búfer de ETC es blanca u opaca. Mediante el ajuste RI, los tejidos se vuelven transparentes. Por favor, haga clic en ellae para ver una versión más grande de esta figura.
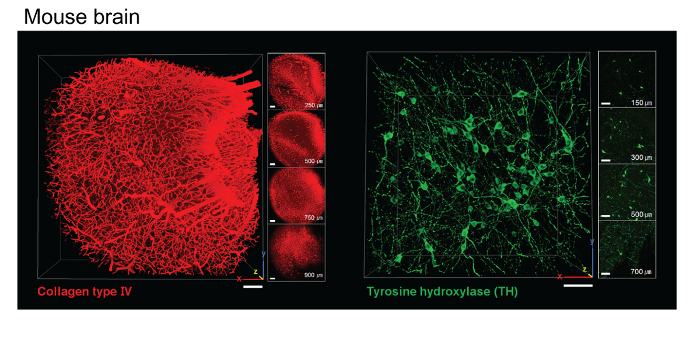
Figura 3. Immunolabeling con el tejido cerebral del ratón ACT-limpiado. Imágenes de cortes de cerebro de ratón 1 mm de ACT-procesado que muestran la corteza de cerebro de ratón teñidas con un anticuerpo para el colágeno de tipo IV y parte del cerebro medio se tiñeron con un anticuerpo para tirosina hidroxilasa (TH). Barra de escala, 100 micras. Haga clic aquí para ver una versión más grande de esta figura.
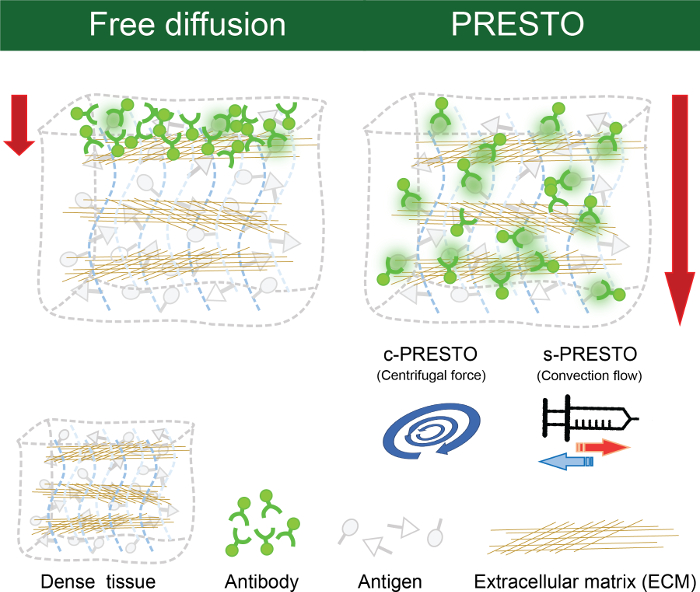
Figura 4. PRESTO métodos immunolabeling. Los anticuerpos no pueden penetrar en los tejidos densos por difusión. PRESTO métodos immunolabeling fueron diseñados para infundir activamente macromoléculas y para entregar los reactivos entejidos densos. La aplicación de las fuerzas centrífugas utilizando una centrífuga de sobremesa estándar (PRESTO centrífuga, c-PRESTO) marcadamente facilitó la entrega de anticuerpos. Appling flujo de convección con una bomba de jeringa (PRESTO jeringa, s-PRESTO) mejorar la penetración de anticuerpos. Haga clic aquí para ver una versión más grande de esta figura.
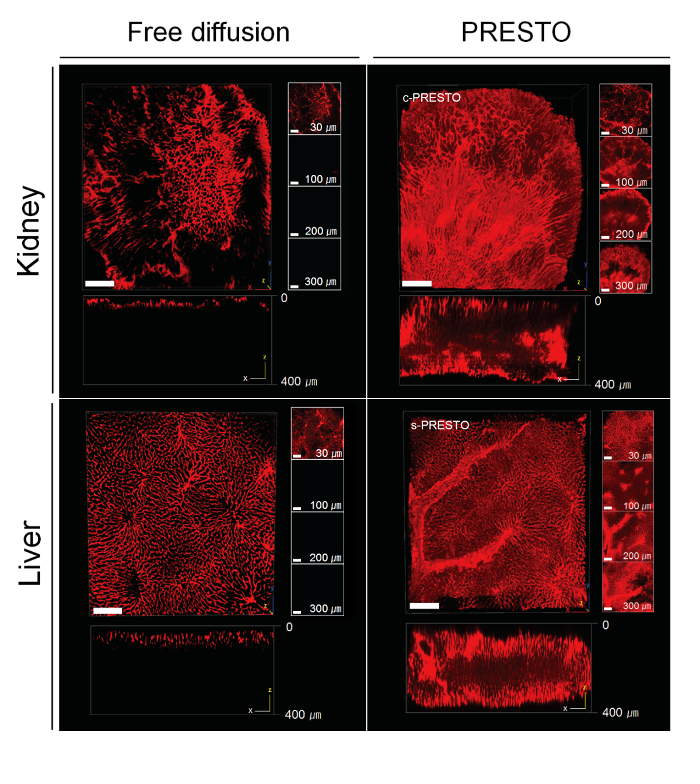
Figura 5. PRESTO immunolabeling de tejido denso ACT-limpiado. Para c-PRESTO, los tejidos se centrifugaron a 600 xg durante 3 h usando una centrífuga de mesa estándar con el fin de acelerar la penetración de los anticuerpos primario y secundario. Por s-PRESTO, una bomba de jeringa se utilizó para entregar los anticuerpos. órganos de ratón, tales como los riñones y el hígado, se marcaron con colágeno tipo IV. En comparación con los métodos convencionales, 3 h deC o s-PRESTO mejora notablemente la profundidad etiquetado. En el riñón y el hígado, la profundidad del eje Z alcanza 300-350 micras o más profundo en muestras PRESTO (derecha), mientras que las muestras de control se etiquetan a una profundidad de solamente 40 - 50 micras (izquierda). Una imagen reconstruida 3D se obtuvo con un microscopio confocal. Barra de escala, 100 micras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Poor fijación o la inmersión del hidrogel en los tejidos pueden causar la pérdida de proteínas y la distorsión de los tejidos durante el proceso de compensación de tejido. Todo el cerebro adulto de ratón debe ser incubado en 4% de paraformaldehído durante la noche, seguido de inmersión en un volumen mínimo de 20 ml de solución de monómero de hidrogel durante 12 - 18 h con agitación suave. Para grandes tejidos, incluyendo tejido humano, tales como cortes de cerebro y la médula espinal, extendida remojo vez en la solución de monómero de hidrogel se requiere. El protocolo de ACT es fácilmente aplicable a la limpieza de tejidos fijados porque los pasos de fijación del tejido y la infusión de polímero se separan. Después de borrar los tejidos, los tejidos humanos estaban bien teñidas con varios anticuerpos. Tenga en cuenta que la técnica de ACT de compensación no es compatible con los fijadores de alcohol, tales como etanol y metanol.
La etapa de polimerización tejido hidrogel también es fundamental para producir tejidos de buena calidad siguiendo el proceso de compensación. Porqueoxígeno inhibe la polimerización de la acrilamida, debe ser eliminado por la desgasificación de la solución que contiene el tejido bajo un sistema de infusión de gas nitrógeno. Alternativamente, desoxigenación se puede ejecutar utilizando una cámara de vacío con un bloque de calor durante 23 h.
La tasa de compensación depende de numerosos factores, incluyendo el tamaño de los órganos, el contenido de lípidos o proteínas fibrosas ECM, la condición de fijación, etc. La mayoría de los tejidos de ratón adulto se pueden borrar ETC durante la noche. Sin embargo, hay un riesgo de innecesaria sobre-compensación y la hinchazón del tejido; Por lo tanto, las diferencias en el tiempo de compensación son de consideración importante. las condiciones de limpieza de tejido deben ser determinadas empíricamente. Es importante destacar que, el contenido de la ECM pueden afectar la apariencia del tejido despejado. El color de los tejidos sigue siendo blanca u opaca, incluso después de la ACT en tampón ETC, porque ACT no borra las fibras de proteínas densos. Sin embargo, cuando estos órganos se sumergieron en solución de juego RI, lay se volvió transparente.
La velocidad de hinchazón del tejido parece ser dependiente de los contenidos de ECM de los tejidos y los órganos blandos, tales como el cerebro, exhiben una mayor relación de hinchamiento de órganos densos. Debido a que el aumento de la inflamación del tejido ayudará a que el procedimiento de limpieza de tejido, ACT utiliza rutinariamente destila tampón a base de agua en la mayoría de los casos. En algunos casos, cuando no es deseable, como en los embriones de la hinchazón del tejido o deformidad transitoria, tampón que contiene 0,1 x PBS se puede aplicar para obtener imágenes de alta resolución. Cabe también señalar que el aumento de las concentraciones de sal en el tampón podrían causar la contracción de los tejidos.
El método de ACT puede aclarar órganos enteros e incluso todo el cuerpo de un ratón 14. Sin embargo, las imágenes de tejidos profundos del tejido transparente requiere microscopios y objetivos especiales. Por lo tanto, de espesor de tejido cerebral de 1 a 2 mm es más eficaz para formación de imágenes con un microscopio confocal convencional. En nuestras manos, la eliminación de la etiquetaed anticuerpos a partir de tejidos de ACT-procesado es dependiente de anticuerpos, y no se recomiendan rondas de etiquetado anticuerpo diferente. Varios anticuerpos, tales como TH y GFAP, trabajaron especialmente bien para todo el cerebro immunolabeling 14. Por otro lado, algunos anticuerpos, tales como Tuj1 o Map2, a menudo etiquetados sólo la superficie de los tejidos. Esto podría ser mejorada por otros métodos, tal como el conmutador 15. Otra limitación potencial es que puede ser difícil de conservar las estructuras de proteínas finas en el tejido ACT-procesado debido a la inflamación del tejido y la contracción durante la etapa de limpieza de tejido.
La técnica PRESTO es aplicable a una amplia variedad de técnicas de etiquetado tejido. Por ejemplo, en métodos de tejido transparente utilizando tejido pre-marcado, como SeeDB 4 y iDISCO 7, immunolabeling de tejido denso requiere periodos de incubación de más de varios días a semanas. Sin embargo, PRESTO puede acortar el tiempo de incubación a varias horas, enabling la realización de todo el proceso dentro de un día con un grueso tejido denso 1-mm. PRESTO puede mejorar la eficacia de deep-etiquetado de espesor, tejidos densos o tejidos gruesos, incluso con despacho de la ONU. Debido PRESTO utiliza una centrífuga de sobremesa o bomba de jeringa y no requiere ningún equipo especial, es relativamente fácil de implementar esta técnica con los procedimientos de laboratorio de rutina.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
This research was supported by the Brain Research Program through the National Research Foundation (NRF) funded by the Korean Ministry of Science, ICT, and Future Planning (NRF-2015M3C7A1028790).
Materiales
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | Lugen SCI | LGB-1175-4B | sample fixation |
| Acrylamide | Affymetrix | 75820 | Hydrogel monomer solution |
| 2,2’-Azobis[2-(2-imidazolin-2-yl) propane] dihydrochloride | Wako Pure Chemical Industries | VA-044 | Hydrogel monomer solution |
| Boric acid | Affymetrix | 76324 | ETC buffer |
| Sodium Dodecyl Sulfate (SDS) | Affymetrix | 18220 | ETC buffer |
| Sodium hydroxide pellets | Junsei chemical | 1310-73-2 | ETC buffer |
| Bovine Serum Albumin (BSA) | Santa Cruz Biotechnology | sc-2323A | Immunolabeling |
| Triton X-100 | Sigma-Aldrich | T8787 | Immunolabeling |
| Sodium azide | Sigma-Aldrich | S2002 | Immunolabeling |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | Antibody/immunolabeling |
| Alexa Fluor Cy3 Donkey anti-Rabbit IgG (H+L) | Jackson ImmunoResearch | 711-165-152 | Secondary antibody/ immunolabeling |
| Alexa Fluor 488 Donkey anti-Rabbit IgG (H+L) | Life Technologies - Molecular Probes | A21206 | Secondary antibody/ immunolabeling |
| Confocal dish | SPL lifesciences | 101350 | Imaging |
| Confocal microscope | Leica | SP8 | Imaging |
| Sucrose | Junsei chemical | 31365-0301 | CUBIC-mount solution |
| Urea | Affymetrix | 23036 | CUBIC-mount solution |
| N,N,N’,N’-tetrakis(2-hydroxypropyl)ethylenediamine | Sigma-Aldrich | 122262 | CUBIC-mount solution |
| ECT chamber | Logos Biosystems, Inc. | C10101 | ETC system |
| ECT chamber controller | Logos Biosystems, Inc. | C10201 | ETC system |
| Temperature probe | Logos Biosystems, Inc. | C12101 | ETC system |
| Peristatic pump | Baoding longer precision pump Co., Ltd | YZ1515X | ETC system |
| Buffer reservoir | Logos Biosystems, Inc. | C10401 | ETC system |
| Tissue container | Logos Biosystems, Inc. | C12001 | ETC system |
| Container holder for 1 tissue container | Logos Biosystems, Inc. | C12002 | ETC system |
| Mouse brain slice holder | Logos Biosystems, Inc. | C12004 | ETC system |
| Whole rat brain holder | Logos Biosystems, Inc. | C12007 | ETC system |
| Peristaltic pump tubing | Logos Biosystems, Inc. | C12104 | ETC system |
| Tabletop-centrifuge | Hanil science industrial Co., Ltd | MICRO 12 | c-PRESTO |
| Syringe pump | Baoding longer precision pump Co., Ltd | LSP02-1B | s-PRESTO |
| Syringe (30 mL) | Korea vaccine Co., Ltd. | KV-S30 | s-PRESTO |
| 3-way stopcock | Hyupsung medical Co.,Ltd. | HS-T-01N | s-PRESTO |
Referencias
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55, 25-36 (2007).
- Dodt, H. -. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat Methods. 4, 331-336 (2007).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. NATURE. 497, 332-337 (2013).
- Ke, M. -. T., Fujimoto, S., Imai, T. SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat Neurosci. 16, 1154-1161 (2013).
- Ertürk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nat Protoc. 7, 1983-1995 (2012).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat Neurosci. 14, 1481-1488 (2011).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159, 896-910 (2014).
- Susaki, E. A., et al. Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis. Cell. 157, 726-739 (2014).
- Tainaka, K., et al. Whole-body imaging with single-cell resolution by tissue decolorization. Cell. 159, 911-924 (2014).
- Yang, B., et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell. 158, 945-958 (2014).
- Kim, S. -. Y., Chung, K., Deisseroth, K. Light microscopy mapping of connections in the intact brain. Trends Cogn Sci. 17, 596-599 (2013).
- Yushchenko, D. A., Schultz, C. Tissue clearing for optical anatomy. Angew Chem Int Edit. 52, 10949-10951 (2013).
- Tomer, R., Ye, L., Hsueh, B., Deisseroth, K. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nat Protoc. 9, 1682-1697 (2014).
- Lee, E., et al. ACT-PRESTO: Rapid and consistent tissue clearing and labeling method for 3-dimensional (3D) imaging. Sci Rep. 6, 18631 (2016).
- Murray, E., et al. Scalable Proteomic Imaging for High-Dimensional Profiling of Intact Systems. Cell. 163, 1500-1514 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados