Method Article
מתודולוגיות לימוד
In This Article
Summary
This study presents the development of reproducible methodologies to study biofilm inhibitors and their effects on Bacillus subtilis multicellularity.
Abstract
This work assesses different methodologies to study the impact of small molecule biofilm inhibitors, such as D-amino acids, on the development and resilience of Bacillus subtilis biofilms. First, methods are presented that select for small molecule inhibitors with biofilm-specific targets in order to separate the effect of the small molecule inhibitors on planktonic growth from their effect on biofilm formation. Next, we focus on how inoculation conditions affect the sensitivity of multicellular, floating B. subtilis cultures to small molecule inhibitors. The results suggest that discrepancies in the reported effects of such inhibitors such as D-amino acids are due to inconsistent pre-culture conditions. Furthermore, a recently developed protocol is described for evaluating the contribution of small molecule treatments towards biofilm resistance to antibacterial substances. Lastly, scanning electron microscopy (SEM) techniques are presented to analyze the three-dimensional spatial arrangement of cells and their surrounding extracellular matrix in a B. subtilis biofilm. SEM facilitates insight into the three-dimensional biofilm architecture and the matrix texture. A combination of the methods described here can greatly assist the study of biofilm development in the presence and absence of biofilm inhibitors, and shed light on the mechanism of action of these inhibitors.
Introduction
קהילות חיידקים רבות תאי לשחק תפקידים משמעותיים הסביבה טבעית אנתרופוגניים, והוא יכול להיות מועיל או מזיק ביותר. מושבות רבות התאיות אלה ידועים כמו biofilms, שבה התאים הבודדים המוטבעים מטריצת חומרים פולימריים תאיים בהפקה עצמית (EPS). EPS מאוד לדבוק התאים אל פני השטח הוא ליישב. הם לשמש כמגן נגד כוחות מכניים וכימיים וליצור קשר הדוק בין תאים שכנים, בהקלת התקשורת הסלולרית 1. Biofilm ניתן לצפות כקהילת בדיל, שבו משתמשי תאי פיקוח הדוק, מתוזמר תהליכים כדי לתאם את פעילותם בתוך הקהילה, כמו גם על פני מיני 2-5. המעבר ממצב planktonic ונטול חיים של צמיחה למצב ביופילם קשור לעתים קרובות עם תהליכים התפתחותיים. דוגמה טובה לכך היא subtilis Bacillus חיידק אדמה חיובי-גראם, ולפיכך undomeזן sticated משמש כאורגניזם מודל חזק כדי ללמוד את שלבי ההתפתחות מובילים להיווצרות ביופילם. חיידק זה, תאי ניע להתארגן מבנים רבים-תאיים בולטים מבצעות משימות מיוחדות 4. קבוצה אחת של תאים, המטריצה מפיק להפריש exopolysaccharides 6, חלבון עמילואיד טס 7,8, ואת חלבון הידרופוביות משטח BslA 9,10; שכולן להשתתף באסיפה של EPS 11-13.
בהתחשב השפע של biofilms בנישות טבעיות אנתרופוגניים והניזק הקטלני המשוערת הם יכולים לגרום, יש צורך דוחק למצוא דרכים למנוע היווצרותם. מעכבי מולקולה קטנים יכולים לסייע לגילוי מסלולי רגולטוריות חדשים, אנזימים וחלבונים מבניים המעורבים ביצירת ביופילם, ובכך לקדם תובנות התהליכים המורכבים של הרכבת קהילה רבה-תאית. כב ' subtilis הוא מודל למד היטב עבור ביוהיווצרות סרט 14,15, זה יכול לשמש כדי להעריך את ההשפעות של מעכבי ביופילם שונים. מחקר זה מתמודד עם ארבע שיטות יסוד שהן המפתח להערכת התגובה של biofilms למעכבי מולקולה קטנה. ראשית, על מנת להבטיח כי מעכבים אלה יש מטרת biofilm הספציפי, הפרדת ההשפעה על צמיחת planktonic מהשפעת על היווצרות ביופילם היא קריטית. רוב סוכני אנטיבקטריאלי למקד תאים בשלב הצמיחה planktonic שלהם, אבל מולקולות המשפיעות על אורח החיים ביופילם הם נדירים. בנוסף, כמו מולקולות שאינו משפיעות צמיחת planktonic אינן רעילות, הם יכולים להפחית את לחץ הסלקטיבי העדפת מוטציות אנטיביוטיות עמידות 16. לדוגמה, כאשר biofilms מטופלים עם חומצות אמינו D-או מולקולות מקיר מפריעים תאים אחרים מסוימים, הם גם מוטרדים או מפורקים, אבל מעכבי אלה רק במתינות להשפיע 12,17 צמיחה planktonic. לעומת זאת, אנטיביוטיקה רבה לפגוע בצמיחת planktonic דרמטית, עם little או אין השפעה על היווצרות ביופילם 17.
שנית, הקמת מסגרת ניסיונית עקבית ויציב כדי לחקור את ההשפעה של המולקולות הקטנות חיונית. צפינו כי טווח הריכוז הפעיל של מעכבי מולקולה קטנים היה רגיש לתנאים מראש התרבות להגדרות הניסוי נעשו שימוש כדי לחקור את ההשפעה של מעכבי מולקולה הקטנים אלה. דיווחים שונים, במיוחד הלומדים ב subtilis, חשף וריאציות בטווח הריכוז שבו D-אמינו חומצות לדכא את היווצרות pellicles - את biofilms חיידקי צף 12,17-19. התוצאות המוצגות כאן עולות כי הגורמים הבאים להסביר את ההבדלים בטווח הריכוז הפעיל: התנאים מראש התרבות (12,17 לוגריתמים לעומת שלב מאוחר-נייח 20 צמיחה), את מדיום הגידול בשימוש המצב טרום התרבות (עשירות, undefined [מרק לוריא, LB] לעומת מוגדר [מונוסודיום גלוטמט-glycerol, MSgg]), יחס החיסון ובמיוחד הסרת המדיום מראש התרבות לפני החיסון. הטמפרטורה של צמיחה קרומית סטטי הראה תפקיד חשוב פחות בטווח הפעילות של D-לאוצין מעכב מולקולה קטנה, חומצת אמינו D-נציג השתמשו במחקר זה.
לבסוף, לאחר biofilms מטופלים עם מעכבי biofilm ספציפיים, שיטות חזקות ואינפורמטיבי נדרשות לאפיין את ההשפעות של מעכבים אלה על כושר ביופילם. הנה, שתי שיטות כדי לאפיין את ההשפעה עצמאית של מעכבי מולקולה קטנים מתוארות בפירוט: (1) ההשפעה על תאים בודדים בתוך מושבה ביופילם ואת התנגדותם סוכני מיקרוביאלית. תאי biofilms הם בדרך כלל יותר עמיד לאנטיביוטיקה בהשוואת חיידקים חינם-חי 21-23. בעוד תופעה זו תלויה בכמה גורמים, היכולת של EPS כדי לצמצם את חדירת אנטיביוטיקה לעתים קרובות נחשב כהסבר מושך 24 . שיטה זו מעריכה את הישרדותם של תאי biofilm שנקבע מראש לאחר חשיפה לחומרים אנטי בקטריאליים. (2) ההשפעה על אדריכלות המושבה ביופילם, מן הגדולים אל בקנה מידה קטן. מושבות Biofilm מאופיינים המבנה התלת-ממדי שלהם ואת הנוכחות של EPS. ניצול במיקרוסקופ אלקטרונים סורק, שינויים במורפולוגיה התא, מבנה המושבה ביופילם והארכיטקטורה ושפע של EPS ניתן דמיינו מן גדול (מ"מ) אל בקנה מידה קטן (מיקרומטר).
Protocol
1. הערכת השפעת מולקולה קטנה מעכבי על קרומית היווצרות המושבה Biofilm
- כן פתרון 2x של מדיום MSgg וישכנע ביופילם מוגדר 25 ללא כלוריד סידן וברזל hexahydrate כלוריד (III). לאחר העיקור מסנן, מוסיפים את כלוריד סידן. המדיום הוא מוכן לשימוש ישירות או שזה יכול להיות מאוחסן על 4 ° C בחושך.
- הכן את דילול 1x MSgg ביום הניסוי.
- לדלל את המדיום 2x MSgg ל X 1 עם מים מזוקקים סטריליים (pellicles) או חם 3% סטרילי (80 ° C) אגר (biofilms) ולהוסיף ברזל (III) כלוריד hexahydrate לריכוז סופי של 50 מיקרומטר (pellicles) או 250 מיקרומטר ( biofilms). להוסיף אנטיביוטיקה או מעכבי מולקולה קטנה לריכוז הרצוי ומערבבים היטב. לדוגמה, כדי לקבל ריכוז סופי של 0.5 מ"מ D-לאוצין ב 30 מ"ל להקים pellicles או biofilms, להוסיף 196.6 μl של 76.3 מ"מ (10 מ"ג / מ"ל) פתרון המניות D-לאוצין.
לאTE:. הרכב 1x MSgg הסופי מתואר בטבלת 1 לעומת המתכון המקורי 25, המדיום הכיל 50 מיקרוגרם / מיליליטר תראונין ואת ריכוז הברזל לגדול מושבות ביופילם על מדיום MSgg מוצק הוגדלו 2.5x כדי לייעל את מורפולוגיה המושבה המקומטת .
- לדלל את המדיום 2x MSgg ל X 1 עם מים מזוקקים סטריליים (pellicles) או חם 3% סטרילי (80 ° C) אגר (biofilms) ולהוסיף ברזל (III) כלוריד hexahydrate לריכוז סופי של 50 מיקרומטר (pellicles) או 250 מיקרומטר ( biofilms). להוסיף אנטיביוטיקה או מעכבי מולקולה קטנה לריכוז הרצוי ומערבבים היטב. לדוגמה, כדי לקבל ריכוז סופי של 0.5 מ"מ D-לאוצין ב 30 מ"ל להקים pellicles או biofilms, להוסיף 196.6 μl של 76.3 מ"מ (10 מ"ג / מ"ל) פתרון המניות D-לאוצין.
- לאחר ההתמצקות של אגר, לייבש את צלחות MSgg המוצקות במנדף ביולוגי 30-45 דקות לפני החיסון.
- כדי לבחור מעכבים ספציפיים שמפריעים מנגנוני ההיווצרות קרומית (איור 1), פוסל כי ריכוזי בשימוש להשפיע planktonic וצמיחה סטטי.
- לקבוע צמיחת planktonic (גידול הצפיפות אופטית לאורך זמן בתרבות נוזלית) בתוך עקומת צמיחה פשוט על ידי מדידת הצפיפות האופטית ב 600 ננומטר כל שעה עד שלב הצמיחה הנייח.
- כדי לאשר כי עכירות תרבות נמדדת מייצג ספירת תא חי, לקבוע את מספרי יחידות המושבה להרכיב (CFU)של תאים בשלב הצמיחה planktonic מתרבות רועד לאחר מועדים לפי שעון מספר.
- כדי להעריך את ההשפעה של מעכבי מולקולה קטנה על צמיחה קרומית סטטי, תאים הקציר בסוף הדגירה 3 ימים ב 23 ° C מתרבות תא-24 גם כן, מחוסן באותם תנאים כמפורט בסעיפים 1.7-1.9 ולקבוע את CFU. עבור שליטה זו, להשתמש זן קרומי מחסרת כי חסר את operons קידוד עבור הרכיבים התאים מטריקס (כלומר, ב subtilis Δ epsH, Δ טסה).
הערה: זן זה הוא מסוגל לגדול בתנאים סטטיים, אך בניגוד סוג בר יוצרים קרומי, זה הוא חסר את היכולת לצוף לממשק הנוזל האוויר שצמח היא מועדף בשל רמות חמצן מוגברים 26. לפיכך, מטריצה תאית זו ומתח קרומי מחסרת הוא זן התייחסות מומלץ להעריך צמיחה בתנאים סטטיים.
הערה: לקבלת לשעבר המבוקשבשפע של D-לאוצין חומצת קאנונית אמינו-D כמתואר להלן, השפעה על planktonic וצמיחה סטטי בריכוזים שהפריעו היווצרות קרומית נפסלה 12,17. השיטות לקביעת planktonic וצמיחה סטטי מתוארות בפירוט 17.

באיור 1. סקירה מושגית לזיהוי של התקנה ניסיונית חזקה כדי להעריך את העיכוב הספציפי של היווצרות ביופילם. קריטריונים לבחירה עבור מעכבי מולקולה קטנים המציינים הפרעה ספציפית עם היווצרות ביופילם ללא השפעה מובהקת על צמיחת planktonic. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של נתון זה.
- Streak את B. subtilis ממלאי -80 מעלות צלזיוס (LB cultuמחדש של 10 9 תאים / מ"ל קפוא 20% גליצרול) לבודד מושבות אחת על צלחת אגר LB-1.5% במקל טיפ או המוליך סטרילית.
- לגדול בין לילה ב 30 מעלות צלזיוס.
- שלב קריטי: עבור עיכוב קרומי חזק ידי חומצות קאנונית D-אמינו כגון-לאוצין D, לגדל מושבה אחת הרים מצלחת LB-1.5% אגר ב 3 מיליליטר מרק LB ב 37 מעלות צלזיוס למשך 4 שעות בתוך רועד חממה (רועד סל"ד מהיר 200). החזר את מרק LB עם המדיום biofilm וישכנע MSgg לפני חיסון ידי צנטריפוגה 1.5 מ"ל תרבות המתנע עבור 4 דקות ב 6000 XG, בזהירות הסרת supernatant מחדש השעיית גלולה ב 1.5 מ"ל בינוני MSgg. שאר התרבות יכולה להיות מושלך.
חשוב: כדי להבטיח את איתנות המערכת, את הצפיפות האופטית ב 600 ננומטר (OD 600) של תרבות המתנע שטף צריכה להיות בין 0.6 ל -1. - במהלך הצמיחה של התרבות המתנע, להכין containin צלחת multidish 12 גם תא-תרבותמ"ל גרם 3 של המדיום MSgg בלי או עם טווח הריכוז של מעכבי מולקולה קטנה (למשל, 0.3, 0.5, 1 מ"מ D-לאוצין 17). כדי לשלול השפעות קצה, להפיץ את המיקום של הריכוזים השונים על פני צלחת multidish. לחלופין, השתמש 24 גם צלחות תרבית תאים multidish המכיל 1.5 מ"ל של מדיום MSgg.
- לחסן את בארות הצלחת 12 גם תא-תרבות multidish עם 3 μl של תרבות המתנע שטף (1: 1,000 דילול).
הערה: יחס דילול נמוך, כלומר, 1: 500 ניתן להשתמש. זה מקטין את זמן הפיתוח של pellicles. - לגדל את pellicles ב 23 ° C בתנאים סטטי במשך שלושה ימים. אל תזיז את pellicles במהלך הזמן הזה, כפי שהוא יכול להשפיע על מורפולוגיה השטח הסופית של קרומי.
- רוכש תמונות עם חשיפה משקפת הומוגנית של ברק. לחלופין, לצלם תמונה של pellicles עם מצלמה ברזולוציה גבוהה. כדי למנוע חפצים הנגרמים על ידי inconsisזוויות וצללי אוהל אור, לצלם מלמעלה למטה עם המצלמה הקבועה על חצובה ולהשתמש מקור אור רך גדול ב 45 מעלות משני הצדדים.
הערה: שיטה חלופית כדי ללמוד B. subtilis רב-תאיות הוא assay המושבה ביופילם על המדיום MSgg מוצק, וישכנע ביופילם. כמו pellicles, assay זה מאפשר לימוד של תהליכים spatiotemporal. ברגע בטווח הפעיל של מעכבי מולקולה קטנים נקבע, והשפיעו על היווצרות מושבת biofilm ניתן ללמוד. - לגדול מושבות ביופילם, לזהות באופן סימטרי 1.5 μl של תרבות מראש רחוץ (שלב 1.7) על צלחת אגר MSgg 1.5% יבשים בעזרת תבנית - 4 טיפות לכל צלחת פטרי בקוטר 8.5 ס"מ. תנו טיפות לספוג לצלחת לפני שעבר עליהם.
הערה: התבנית עוזרת לקבל חלוקה שווה של מושבות ביופילם בתוך האזור שבו התאים גדלים. כדי להכין את התבנית, לצייר את השטח הכולל של צמיחה בסקלות מקורית, לחלק אותו הכת שווהORS ולסמן במרכז. עבור צלחת פטרי עגול בקוטר 8.5 ס"מ, זה מקצה 14 ס"מ 2 למושבה ביופילם אחד. - דגירת הצלחות ב 30 מעלות צלזיוס למשך שלושה ימים. במהלך תקופה זו, מושבות ביופילם לפתח ליצור מבנה תלת-ממדי, מקומט.
- צלם תמונות כמו בשלב 1.11.
2. Assay ההתנגדות אתנול
- לגדול biofilms כמתואר בשלבים 1.1-1.7 ו 1.12-1.14.
- לאחר 68 שעות של צמיחה ב 30 ° C, לחתוך את המושבות ביופילם לשני חלקים שווים בעזרת סכין גילוח ואת התבנית.
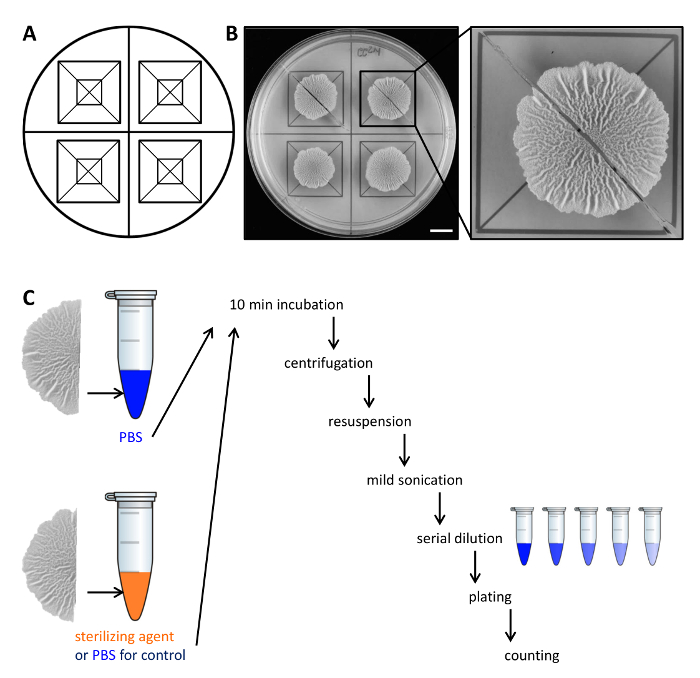
דוגמא איור 2. עיצוב ניסיוני כדי להעריך את ההתנגדות של תאי מושבה ביופילם לסוכני חיטוי. (א) תבנית המשמשת לחלוקה השוויונית של מושבות ביופילם על פני צלחת פטרי לחיתוך. (ב)תמונות מלמעלה למטה של ביופילם wild-type מטופל גדלו במשך 68 שעות על מדיום MSgg וישכנע ביופילם מוצק, מוגדר על 30 מעלות צלזיוס. ההגדלה מראה כיצד מושבה biofilm ניתן לחתוך לשני חצאים שווים. (ג) שני חצאים ביופילם שווה זוכים ליחס שווה (שליטה, PBS) או עם או PBS או עיקור סוכן ומעובד כמתואר. סרגל קנה מידה:. 1 ס"מ אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- הרם בזהירות כל מחצית של המושבה ביופילם מהצלחת אגר עם מרית קטנה ולהעביר אותו צינור 1.5 מ"ל microcentrifuge המכיל 500 μl של תמיסת מלח שנאגרו פוספט (PBS). במידת הצורך, לגרד את התאים הנותרים מהצלחת ולהעבירם צינור microcentrifuge כמו גם.
הערה: המחצית השנייה של המושבה ביופילם מטופל באופן דיפרנציאלי, תלוי אם זה הוא שליטה או כדי לבדוק את עמידות Steriסוכני lizing. - על הבקרה, דגירה במחצית השנייה של המושבה biofilm ב 500 μl PBS כמו בשלב 2.3. כדי להעריך התנגדות לסוכנים עיקור, להעביר את החצי השני של המושבה ביופילם 500 μl 50% (V / V) אתנול.
הערה: סוכני חיטוי אלטרנטיבי כגון חומצת נתרן יכולים לשמש. עבור כל הסוכנים לסטריליזציה בשימוש, לקבוע את זמן ריכוז דגירה הפעיל ניסוי ראשוני. - דגירה המושבות ביופילם במשך 10 דקות על העליונה הספסל בטמפרטורת החדר.
- צנטריפוגה מושבות ביופילם במשך 5 דקות ב 18,000 XG ובזהירות להסיר את supernatant עם טפטפת. הוספת 300 μl של PBS.
- Sonicate התאים מעט (sec 10%, דופק 5 משרעת) עם microtip של sonicator.
הערה: אנרגית sonication חייבת להיות מספיק כדי אגרגטים ביופילם נפרדים. עם זאת, sonication קשה מדי עלול lyse התאים. אשר מראש על ידי מיקרוסקופ אור שהאנרגיה sonicationבשימוש לא lyse התאים ושכל אגרגטים הם מומסים. - הוסף 700 μl של PBS לנפח סופי של 1 מ"ל. בצע דילול סדרתי (10 -7) ב PBS ולהתפשט 100 μl של 3 דילולים על צלחת אגר LB-1.5% באמצעות חרוזי זכוכית סטרילית.
הערה: הדילולים האופטימליים להיות מצופות צריכה להיקבע בניסוי ראשוני, כמו זה תלוי בכמות של תאים במושבה ביופילם הריבית לבין שיעור ההישרדות של התאים בתגובת סוכן החיטוי. - דגירה צלחות לילה ב 30 מעלות צלזיוס, לספור את CFU ולקבוע CFU / ml. מתוך CFU / ml הסופי של כל המושבות ביופילם וחצי, לחשב את אחוז הניצולים.
הערה: כאשר מבוצע ונותח כמתואר, שני חצי המושבה המלאה ביופילם ואת המטופל מול החצי שטופל אתנול של המושבה ביופילם המטופל אמור להניב הבדלים מתחת ל -10% בספירת תא קיימא, אימות הסימטריה או ההתנגדות של המושבה , respectively. לחלופין, התוצאות יכולות להיות מיוצגות הכולל CFU. ספירת התאים של מלאת המושבה ביופילם מטופל צריכה להישאר באותו סדר הגודל. לעומת זאת, ספירת תאי המחצית שטופל אתנול של מושבה ביופילם מולקולה שטופלה קטנה צפויות לרדת ידי מינימום של שני סדרי הגודל לתבוע רגישות מוגברת סוכן החיטוי.
3. הכנת דוגמאות מושבת Biofilm עבור במיקרוסקופ אלקטרונים סורק
- לגדול מושבות ביופילם כמתואר בשלבים 1.1-1.7 ו 1.12-1.14.
- הכן קבוצה חדשה של 2% (v / v) glutaraldehyde, 3% (v / v) פתרון paraformaldehyde ב cacodylate נתרן 100 מ"מ, 5 מ"מ חיץ סידן כלורי, pH 7.3. הכן 5 מ"ל של מקבע לכל צלחת פטרי בקוטר 8.5 ס"מ.
זהירות: Glutaraldehyde ו paraformaldehyde הם מסוכנים. לטפל בהם עם ציוד בטיחות בתוך במנדף כימי. מחק את הפתרונות ואת החומרים מזוהמים אל האזפסולת ardous. - בזהירות להוסיף מקבע למושבות ביופילם, ללא מחלק ישירות על גבי biofilms.
הערה: עקב האופי ההידרופובי של המושבה ביופילם, המושבות לאט להתנתק אגר ולהתחיל לצוף. - בזהירות לאטום את הצלחות עם פס של Parafilm. דגירה על שייקר רוטרי 2 שעות בטמפרטורת החדר ולאחר מכן להעביר את הצלחות עד 4 מעלות צלזיוס למשך לילה.
- למחרת, להסיר בזהירות את הנוזל עם טפטפת זכוכית פסטר מחובר משאבת ואקום.
- בזהירות להוסיף 10 מ"ל 100 מ"מ cacodylate נתרן, 5 מ"מ חיץ סידן כלורי לשטוף את ביופילם דגירה במשך 5 דקות. הוצא בעדינות את הנוזל עם טפטפת זכוכית פסטר מפינת הצלחת כדי למנוע נזק ביופילם ולהוסיף פתרון הכביסה טריים ידי pipetting עדין. חזור על פעולה זו פעם.
- עבור ההתייבשות של המושבות ביופילם, המשך בביצוע השלבים הבאים: 2x 5 דקות DDH 2 O; 2x 20 דקות 30% אתנול; 2x 20 דקות ב 50% אתנול; 2x 20 דקות ב 70% אתנול; 2x 20 דקות ב -96% אתנול; 2x 30 דקות ב 100% אתנול.
- הוסף 15 מ"ל של נוזל על כל צלחת פטרי בקוטר 8.5 ס"מ כל צעד ולהסיר את הנוזל בזהירות אחרי כל הדגירה.
- השתמש באחת משתי שיטות שונות לייבוש דגימות אתנול.
- עבור אוויר-ייבוש מן אתנול:
- חותכים נייר סינון תאית (בקוטר של 9 ס"מ) ברבעונים. בקצרה לצלול רבע ב 100% אתנול, ולאחר מכן בזהירות להעביר את אחד מושבה ביופילם צף על גבי זה. מכניס את נייר הסינון הרטוב בצלחת פטרי מרופדת נייר סינון. מכסים את צלחת פטרי ולתת מושבות ביופילם לילה יבש במנדף כימי.
- עבור נקודה קריטית (CP) -drying באמצעות פחמן דו-חמצני (CO 2) כמו נוזל המעבר:
- מלאו 75% של חדר מכונת ייבוש נקודה הקריטי עם אתנול 100%. העברת דגימות לתוך מחזיק, כל דגימה לתוך ג משלהhamber. במידת הצורך, לחתוך את biofilm עם מספריים לחתיכות קטנות. השאר את הדגימות שקועות אתנול במהלך כל הטיפול. ואז, להעביר את בעל ההחדרה ולסגור את החדר בחוזקה.
- מצננים את החדר כדי C 7 ° ולהתחיל ערבוב. ממלא את החדר לחלוטין עם נוזל CO 2. במהלך זמן דגירה 7 דקות, לתת לתערובת אתנול עם CO 2. ואז, פרוק 25% מהפתרון.
הערה: אין לרוקן את התא מתחת לרמה של המדגם. - חזור על שלב 3.8.2.2 ארבע פעמים.
- חזור על שלב 3.8.2.2 חמש פעמים עם זמן דגירה של 5 דקות בלבד. לבסוף, אתנול צריך להיות מוחלף לחלוטין על ידי ה- CO 2.
- בסבב האחרון, ריק רק 5% של החדר. כבה את הבחישה ואת הקירור. התחל חימום בתא עד 42 מעלות צלזיוס. בטמפרטורה של 31.1 מעלות צלזיוס, בלחץ של 73.9 בר, CO 2 הנוזלים מגיעים לנקודה הקריטית שלה, המדינה שבה ph הגזיםASE יש אותו הצפיפות כשלב הנוזלי של 27 הממס. ברגע שהטמפרטורה מגיעה 42 ° C, דגירה של 10 דקות. בגיל 42 ° C, CO 2 בתא קיים כגז סופר קריטי.
הערה: כל זמן לבדוק את הלחץ של החדר. הלחץ לא יעלה על 120 בר ב 42 מעלות צלזיוס. - התחל כדי לשחרר את הגז לאט עם חימום רציף. פעולה זו שומרת על דגימות בשלב CO 2 -gas ומונע את העיוות של מורפולוגיה המדגם דרך מתח פני הנוזל. הגדר את flowmeter עד 5 L / hr ידי כוונון עדין על שסתום ויסות שליטה על מד הזרימה. המתן עד כל הלחץ בתא הוא שוחרר. עכשיו לפתוח את התא ולהסיר את הדגימות בזהירות מבעל.
- עבור אוויר-ייבוש מן אתנול:
- מעיל בדל במיקרוסקופ אלקטרונים עם קלטת פחמן. בעזרת פינצטה, בזהירות להעביר את המושבות ביופילם על הבדל. חבר כל מושבה אל הבדל ידי הוספת גשר דק מן המכוניתbon קלטת, שהוא חיוני עבור חיסול תשלום תחת אלומת אלקטרונים. בשלב זה, להתמודד עם המושבות ביופילם בזהירות כפי שהם מאוד שבירים. אחסן את דגימות ייבוש לפחות 24 שעות או עד בדיקה.
- ביום הבדיקה עם מיקרוסקופ אלקטרונים סורק, גמגום מעיל המושבות ביופילם עבור 2 דקות בתוך זווית 60 ° בתוך coater-גמגום זהב-פלדיום. חזור על פעולה זו פעמיים וסובב את הדגימות על ידי 120 ° שביניהם. בסוף, גמגום מעיל דגימות פעם במשך 3 דקות מלמעלה. 20 ננומטר שכבה דקה של פלדיום זהב משפר את המוליכות ומשפר את הניגודיות של המדגם עבור הדמיה של SEM.
- אחסן את דגימות ייבוש להימנע ההתייבשות של המדגם 28 עד הדמיה באמצעות מיקרוסקופ אלקטרונים סורק 29,30.
תוצאות
את assay הקרומית היא אחת שיטות כדי לחקור את תהליכי פיקוח הדוק והדינמיים של B. subtilis רב-תאיות. מלבד זאת, assay הקרומית מתאימה לבדוק מגוון של תנאים או טרום פתיחה או ריכוזי מולקולה קטנים בצלחת multidish תא-תרבות אחת בניסוי אחד. עם זאת, ב ' ההיווצרות קרומית subtilis רגישה לתנאים מראש התרבות (למשל, מדיום גידול של התרבות טרום שלב הצמיחה שלה), יחס החיסון והסרת המדיום מראש התרבות. לפיכך, אנו הוקרן לראשונה עבור התקנה ניסיונית שאפשר לנו לשחזר עיכוב קרומית על ידי D-לאוצין. התוצאות שלנו מראות כי עיכוב קרומי לשחזור על ידי D-לאוצין ניתן להשיג אם התאים הם מראש בתרבית בינונית מוגדר, עשיר LB לשלב צמיחת לוגריתמים באמצע (מושבה אחת ב 3 מיליליטר LB ב 37 מעלות צלזיוס למשך 4 שעות עם רעד ), הסתחרר למטה מחדש מושעה במדיום MSgg כהגדרתו ערב של 1: inoculat 1,000יון (איור 3 א). כאשר התאים גדלו במדיום MSgg עד אמצע לוגריתמי שלב הצמיחה (מושבה אחת ב 1 מ"ל LB עבור שעה 2, מחדש מדולל 1: 100 עד 3 מ"ל MSgg, גדל במשך 5 שעות על 37 מעלות צלזיוס עם רועד ב 200 סל"ד), הסרת המדיום מראש התרבות לא הייתה השפעה על פעילות D-לאוצין. תאים שגודלו לשלב הצמיחה נייח (מושבה אחת ב 1 מ"ל LB עבור שעה 2, מחדש מדולל 1: 100 עד 3 מ"ל MSgg, גדל במשך עד 20 שעות ב מכבש בטמפרטורת החדר) ורחץ במדיום MSgg לפני החיסון היה פחות רגיש. עם זאת, העלייה זו התנגדות כלפי אפקט העיכוב הקרומי של לאוצין D יכולה להיות בגלל צפיפות התא הגבוהה מבינה התרבות מראש, הגדלת יחס החיסון. יחס החיסון של התרבות טרום לצמיחה סטטי במדיום MSgg, כלומר, 1: 500 או 1: 1,000, משפיע על מגוון הפעילות של D-לאוצין ואת הזמן של פיתוח קרומי (איור 3 ב). עיכוב קרומי על ידי D-לאוצין התרחשבטמפרטורות גידול שונות (23 ° C ו- 30 ° C, איור 3 ג). חשוב לציין, תוך רגישות התאים D-לאוצין תלויה בתנאים מראש התרבות, השחזור של התופעות בטמפרטורות שונות מוכיח כי עיכוב קרומי-ידי מולקולת D-לאוצין הקטן יש תכונות חזקות.

. תוצאות איור 3. דוגמא המראות את ההשפעות של תנאים מראש תרבות שונות על עיכוב קרומי על ידי D-לאוצין פרמטרים אחדים תוערכנה לקבל התקנה ניסיונית חזקה, כולל: (א) הסרת מזהמים מהגידול-התרבות מראש בינוני (לא שטף מול שטף), מדיום גידול של התרבות מראש (עשיר, מדיום LB מוגדר או מוגדר biofilm וישכנע בינוני MSgg), ומדינת צמיחה של התרבות מראש (לוגריתמים לעומת שלב צמיחה נייח), (B) יחס חיסון (1: 1,000 לעומת 1: 500) של התרבות מראש לתוך מדיום הגידול קרומי הסופי, ו- (ג) טמפרטורת צמיחה (23 מעלות צלזיוס לעומת 30 ° C) ב. subtilis NCIB 3610 התאים גדלו במדיום המצוין (LB או MSgg) עבור 4 שעות ב 37 ° C או בטמפרטורת החדר במשך הלילה (o / n) עם רעד, ובינוניים מראש תרבות הוחלף MSgg אם המצוין (שטף או לא שטוף). לבסוף, תרבות המתנע היה מחוסן 1: 1,000 אם לא צוין אחרת ו pellicles גדלו בתנאים סטטיים ב 23 מעלות צלזיוס למשך שלושה ימים. תמונות מלמעלה למטה נרכשו עם מצלמה. ובכן הקוטר הוא 22 מ"מ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לאחר זיהוי מראש בתנאי תרבות התקנה ניסיונית שאפשרה מגוון פעילות לשחזור של D-leucine על היווצרות קרומית (מבוגר התרבות טרום ב LB כדי לשלב צמיחת לוגריתמים באמצע, לרחוץ MSgg, מדולל 1: 1,000 ו גדלתי ב 23 מעלות צלזיוס למשך שלושה ימים), ההשפעה נבדקה עבור החוסן שלה. לשם כך, הפעילות של לאוצין D על היווצרות קרומית הוערכה במדיה MSgg השונים שונים (איור 4). טווח הפעילות של D-לאוצין לעיכוב קרומי היה עקבי בחמש התקשורת נבדקה, ומראה כי ההשפעה של D-לאוצין על היווצרות קרומית היא איתנה. מגמה דומה נצפתה עם D-טירוזין, שבו עיכוב קרומי בריכוז בטווח של עד 2 מיקרומטר היה עקבי בכמה תקשורת MSgg השונה (ריכוז ברזל נמוך והחלפת מקור החנקן עם אמוניום כלוריד או כמקור פחמן עם גלוקוז, נתונים לא מוצג).

רגישות איור 4. אל D-לאוצין מתרחשתתקשורת צמיחה שונה. המוצגים הן תמונות מלמעלה למטה של B. subtilis NCIB 3610 pellicles, גדל בתנאים סטטיים ב 23 מעלות צלזיוס מוגדרת, ותשכנע ביופילם MSgg הבינוני או במדיה MSgg השונים שונים (מקור פחמן 0.5% גלוקוז; מקור חנקן 0.5% (NH 4) 2 SO 4; ברזל גבוה 250 מיקרומטר FeCl 3; גליצרול נמוך 0.125% גליצרול) במשך שלושה ימים, למעט מדיום מקור חנקן החלופי (שבו pellicles גדל במשך חמישה ימים) או בלי או עם-לאוצין D בריכוזים מצוינים. ה Starter Culture גדלו במשך 4 שעות ב 37 מעלות צלזיוס עם רעד נכנס שלא הוגדרו, מדיום LB עשיר. לפני החיסון, תאים נשטפו על ידי צנטריפוגה ו resuspended במדיום הגידול קרומי המקביל. תרבות המתנע היה מדולל 1: 1,000, הקוטר גם הוא 22 מ"מ. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
שיטה חלופית ללמוד B. subtilis רב-תאיות הוא assay המושבה ביופילם על המדיום MSgg מוצק. כמו pellicles, assay זה מאפשר לימוד של תהליכים spatiotemporal. ברגע בטווח הפעיל של מעכבי מולקולה קטנים נקבע במערכת הקרומית, והשפיעו על היווצרות מושבת biofilm ניתן ללמוד. במחקר זה, מושבות ביופילם שמשו להעריך את השפעת D-לאוצין על ההתנגדות של מושבות ביופילם לסוכני עיקור, כי מושבות ביופילם הן פחות שבירות ועל הרקע המוצק, הם יותר קלים לתמרן. כאשר מושבות ביופילם שטופלו D-לאוצין נחשפים 50% אתנול למשך 10 דקות, אחוז התאים ששרדו טיפות לעומת דרמטי לשבר שלא טופלו (איור 5). שיטה זו יכולה להיות פיתוח נוספת כדי להעריך את ההשפעות של מעכבי מולקולה קטנה אחרים והשפיעו על ההתנגדות לסוכני bactericidal (sterilסוכנים או אנטיביוטיקה izing).

איור 5. תוצאות דוגמה של התנגדות המושבה ביופילם מטופל או מטופלת נגד סוכן חיטוי. מושבות Biofilm של B. subtilis NCIB 3610 גדלו על המדיום מוצק, מוגדר עבור 68 שעות ב 30 מעלות צלזיוס, עם או בלי 0.5 מ"מ D-לאוצין. לאחר חיתוך המושבות בשני חצאים שווים, מחצית טופלה עם PBS (הבקרה הפנימית) ואת החצי השני עם אתנול 50% או PBS (שליטה). לאחר sonication קלה, דילול סדרתי, ציפוי ועוד היד נטויה של יחידות המושבה להרכיב, אחוז הניצולים לעומת הבקרה הפנימית חושבה. מוצגים הם התוצאות של שלושה ניסויים בלתי תלויים עם הממוצעים של שני (א) או שלוש (B, C) משכפל וסטיות התקן שלהם. אנא לחצו כאן to לצפות בגרסה גדולה יותר של דמות זו.
במיקרוסקופ אלקטרונים סורק (SEM) הוא כלי רב עוצמה שיכול לשמש כדי להתמקד אדריכלות המרחבי של קמטים המושבה ביופילם, שפע ולוקליזציה של EPS ומורפולוגיה תא בודד 31. הדמית SEM דורשת דגימות כי ניתן הדמיה תחת ואקום גבוה. כדי לחקור דגימות בתנאי ואקום גבוהים, כל מולקולות מים בכמות הגדולות יש להסירו, ולכן, הדמית SEM מחייבת ההתייבשות של המדגם לפני ההדמיה. לחלופין, ניתן הדמיה דגימות בתנאים ואקום נמוך במצב רטוב על ידי מיקרוסקופ אלקטרונים סורק סביבתיים (ESEM), שבו המדגם hydrated הוא מיובש בעדינות בתא מיקרוסקופ. כדי להעריך את ההשפעות של מעכבי מולקולה קטנים על ארכיטקטורת מושבה ביופילם, מורפולוגיה הארגון ותא EPS, שלושה סוגים שונים של התייבשות מדגם הושוו: ייבוש במיקרוסקופ תחת מו רטובתנאי דה (ESEM), האוויר היבש מנקודת ממס או קריטית (CP) -dried באמצעות פחמן דו חמצני כמו נוזל המעבר. שלא טופלו ו D-לאוצין שטופל ב מושבות ביופילם subtilis בשלבי הידרציה שונים בהתאם לשיטה המקובלת יכולות להיבחן. הדמיה בתנאי ואקום נמוכים במצב הרטוב על ידי ESEM שמרה על המצב טבעי מאוד של המושבה ביופילם. עם זאת, מידע על מורפולוגיה תא בודד למניה שפע ואדריכלות היה מועט, כמו EPS היו עדיין מלא hydrated והתאים ננעצו EPS (מידע לא מוצג). במונחים של התייבשות, CP-ייבוש היה הנוהל המחמיר ביותר. היא הסירה ביותר מבחינה מבנית כבול וחסר בתפזורת מולקולות מים מן הרקמה, והיוותה פסד בהיקף 30-70%, תלוי הרקמות 32. לעומת זאת, אוויר-ייבוש שמר על מולקולות מים המאוגדות. רקמה עוברית למשל איבד 18% מנפחו לאחר ייבוש באוויר מן אתנול ממס נדיף ו -59% לאחר CP-ייבוש 32 . ככל EPS לאגד מים והם מאוד hydrated, אנו ממליצים בהתחשב לאובדן המוחלט של מים בשיטה יבש-CP. כאשר דגימות של מחקר זה היו מיובש באתנול ואוויר מיובש, את המבנה התלת-ממדי של המושבה ביופילם השתמר, תאים בודדים הופיעו, ואת EPS היו משוטחים, אבל הם עדיין על קשר מכוסה תאים בודדים (איור 6 א) . מושבות Biofilm שהיו מיובש עם אתנול CP-יבשים גם נשמר המבנה התלת-ממדי שלהם, ואת EPS הופיע כמו קורי עכביש (איור 6 ג). בדגימות האוויר יבש ו-מיובש CP, את ההשפעות של D-לאוצין מעכב מולקולה הקטן על ארכיטקטורת המושבה ביופילם, מבנה מורפולוגיה EPS תא הבודד ניכרו (איור 6 ו- D). המושבות ביופילם גדלו בנוכחות-לאוצין D היו קטנות יותר והקמטים היו פחות בולטים. התאים D-לאוצין שטופלו היו מוארכים, פנוטיפ כי הוא observed בתאים שטופלו מולקולות מקיר מיקוד תא 33. בנוסף, התאים היו מכוסים פחות בבירור עם EPS ולא קשורים באופן הדוק לתאים השכנים שלהם באמצעות EPS כפי שניתן לראות מושבות ביופילם מטופל. התוצאות המוצגות מראים כי שתי השיטות של התייבשות המושבה ביופילם, אוויר יבש מן אתנול או CP-מיובשים באמצעות פחמן דו חמצני כמו נוזל המעבר לתת תובנות רבות ערך על ההשפעה של מולקולות קטנות על מורפולוגיה תא בודד, כמו גם על שפע EPS ואדריכלות.

מולקולות איור 6. קטנות יכולות לשנות את סדר הגודל הגדול וקטן של אדריכלות המושבה ביופילם. מושבות Biofilm של B. subtilis NCIB 3610 בוגרים (A ו- D) בהעדרו או (B ו- D) בנוכחות של 0.5 מ"מ D-לאוצין במשך 72 שעות ב 30 ° Cעל מדיום MSgg המוצק היו מקובעים כמתואר בפרוטוקול מיובש מן אתנול כדלקמן: (A ו- B) אוויר יבש ו (C ו- D) באמצעות CP-יבשי פחמן דו חמצני כמו נוזל המעבר. מוצגים הם מלמעלה למטה תמונות משקפות של המושבות ביופילם (שמאל, לוחות עליונים), מלמעלה למטה תמונות של מושבות ביופילם המיובשות רכוב על ספחים במיקרוסקופ אלקטרונים לפני ציפוי זהב-פלדיום (שמאל, לוחות נמוכים), נמוך ו-גדלה גבוהה תמונות שנרכשו על ידי SEM להראות ארכיטקטורת 3D של קמטי המושבה ביופילם או ארגון תא המורפולוגיה / EPS היחיד. ברי סולם משמאל לימין:. 5 מ"מ, 100 מיקרומטר, 2 מיקרומטר אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| 1.925 מ"מ | סירmonobasic פוספט assium |
| 3.075 מ"מ | dibasic פוספט אשלגן |
| 100 מ"מ | 3- (-morpholino N) חומצה propanesulfonic, pH 7.1 |
| 2 מ"מ | מגנזיום כלוריד hexahydrate |
| 700 מיקרומטר | נטול מי סידן כלורי |
| 50 מיקרומטר | ברזל (III) כלוריד hexahydrate |
| 125 מיקרומטר ב | |
| 1 מיקרומטר | נטול מי כלוריד אבץ |
| 2 מיקרומטר | hydrochloride תיאמין |
| 50 מיקרוגרם / מ"ל | טריפטופן |
| 50 מיקרוגרם / מ"ל | פנילאלנין |
| 50 מיקרוגרם / מ"ל | תראונין |
| 0.5% (v / v) | נטול מים גליצרול |
| 0.5% (w / v) | מימה מלחי חומצת גלוטמט L-גלוטמית |
| a עבור assay קרומית; b עבור assay biofilm | |
טבלה 1. סופי הרכב 1x MSgg השתמשו במחקר זה.
Discussion
Subtilis Bacillus צורות חזקה מובנה מאוד biofilms הוא נוזל (pellicles) ועל בינוני מוצק (מושבות). לפיכך, היא משמשת אורגניזם מודל אידיאלי לאפיין את מצב הפעולה של מעכבי biofilm ספציפיים. על תקשורת מוצקה, תאי טופס מבנים רבים-תאי עם מאפייני בולטים שאינם ניכרים pellicles, כמו קמטים הקורנים מהמרכז לקצה. לפיכך, pellicles ומושבות הן מערכות משלימות ללמוד B. subtilis רב-תאיות.
מטרת מחקר זה היא לפתח ב מערכת מודל subtilis עבור ביופילם (pellicles ומושבות) עיכוב. מספר צעדים חיוניים עבור השחזור של מסת ההפרעה ביופילם. שלב קריטי ראשון הוא לאשר כי ההשפעה על היווצרות ביופילם אינה בשל רעילות כללית חיידקים הגדלים אורח חי planktonic. זה יכול להיחשב על ידי השוואת ההשפעה של ריכוז נתון כמומעכב מולקולת קניון על העיכוב ביופילם ביחס להשפעה של מולקולה זו על צמיחת planktonic. אפקט דרמטי חזק על פיתוח biofilm יכול להבטיח זיהוי של מנגנוני היעד שחשובים במיוחד לפיתוח biofilms. יתר על כן, המחקר בזאת תיאר מדגים את החשיבות של תנאים מוקדמים תרבות להתפתחות pellicles ואת רגישותם מולקולות קטנות. לפני אפיון השפעת מולקולות קטנות, לשחזור ויציב תנאי הניסוי (למשל, טמפרטורה הצמיחה קרומית וחוסר רגישות להרכב התקשורת) על מנת לבחון את השפעתם צריך להיות מוגדר. כדי למצוא בתנאים כאלה, התקשורת של המצב טרום התרבות, שלב צמיחה של הסרת תקשורת מראש תרבות, מראש תרבות, צמיחת תקשורת הטמפרטורה וצמיחה צריכה להיחשב.
אחד אתגרים גדולים, פעם מעכבת ספציפית ליצירת biofilm נמצא, הוא למצוא כמוניושיטות איכותיות המאפיינות את ההשפעות של מעכבי מולקולה קטנים אלה על התפתחות ביופילם והתנגדות. הנה, שתי מתודולוגיות חשובה מתוארת בפירוט, שניתן להשתמש בם כדי להעריך את ההשפעות של מעכבים כזה. ראשית, אנחנו מציגים שיטה כמותית פשוטה שיכולה לחקור את ההתנגדות של מטופלים reproducibly לעומת biofilms המושבה מטופל כדי bactericides, כגון אתנול. תוצאות נציגים מוצגות על הרגישות של מושבות ביופילם D שטופל-לאוצין אתנול 50%. עם זאת, המאמר הזה יכול בקלות להיות שונה באמצעות סוכני חיטוי שונים או אנטיביוטיקה. שנית, שיטת SEM מתוארת בפירוט המאפשר בדיקה ברזולוציה גבוהה של השינויים במושבה ביופילם הנגרמת על ידי מעכב המולקולה הקטן בכמה רמות משלימות: המבנה הכללי, ארגון ושפע של מטריקס EPS ומרכיביו, ואת מורפולוגיה תא בודד ברחבי ביופילם. נציין כי שתי שיטות dehydratiעל (ייבוש האוויר מכלי אתנול 100% או ייבוש CP באמצעות פחמן דו חמצני כמו נוזל המעבר) יכול לשמש באותה מידה במהלך הכנת המדגם SEM של מושבה ביופילם. חשוב לציין הקיבעון המוצלח של המדגם ביופילם מסתמך במידה רבה על הידרופוביות של המושבה ביופילם. הידרופוביות זהו מאפיין של B. subtilis biofilms בשל שכבת פני השטח הידרופובי 10,34.
מספר גישות שימשו בעבר ללמוד הרכבה biofilm ופיתוח עם B. subtilis כאורגניזם מודל 35. מספר מחקרים עצמאיים הראו את ההשפעות של רכב תקשורת על התפתחות biofilm 36-38. עד כה עם זאת, הערכה שיטתית של ההשפעות של רכב תקשורת על עיכוב ביופילם הייתה, למיטב ידיעתנו, חסרה. מחקר זה מוכיח כי בעוד עיכוב קרומי של B. subtilis על ידי מולקולות קטנות רגיש מראש תרבות תנאים, זה unaffected ידי השפעת רכב טמפרטורת תקשורת, ובכך שימושית עבור מסך שיטתי של מעכבי מולקולה קטנים. כמו כן, הקמנו שיטה פשוטה, לשחזור כמותי להערכת ההתנגדות של מושבות ביופילם שטופלו במעכבי מולקולה מטופל או קטן לסוכנים אנטיבקטריאלי, כרגע חסר ב אורגניזם מודל ביופילם subtilis.
ב subtilis biofilms בשילוב עם כתבי ניאון ניתן לקחת עוד לחפש מעכבי מולקולה קטנים למקד צעד התפתחותי מסוים של היווצרות ביופילם או תת-אוכלוסייה שונה של תאים בתוך biofilm. השיטות שתוארו לעיל אינם מספקים ברזולוציה תא בודד במונחים של ביטוי גנים בתוך ביופילם. שיטות ניתוח ביטוי גנים מטריקס EPS בתוך B. biofilms subtilis ברמת התא הבודדה הוקם בהצלחה 39.
biofilms חיידקים הם של cruciaמשמעות l במסגרות חקלאית, תעשייתית וקלינית. בהקשר חקלאי, את היכולת ליצור biofilms מגדילה את הקולוניזציה מארח צמח צמח רב פתוגנים 40, ו בהקשר קליני, biofilms הוא עמיד מטבעם לסוכנים מיקרוביאלית 21 והם בליבה של זיהומים חיידקיים רבים מתמשכים וכרוניים. בנוסף, עכשיו זה הודה כי יש biofilms שלכות עלות ענקיות לתעשייה כפי שהם קשים מאוד להסיר ולשלוט 41. לפיכך, פיתוח מסגרת ניסיונית לחקר מעכבי ביופילם מיקרוביאלי יספק 42,43 חקלאיים נרחבת, קלינית 21,44, וטכנולוגית 45-47 התקדמות.
השיטות הקיימות מוגבלות ב subtilis. אנו מעודדים בעקבות מושגים כמותיים ואיכותיים תיאר ללמוד מעכבי מולקולה קטנה ספציפי ביופילם במינים אחרים גם כן. בנוסף מחקר זה מתייחס דוגמא ספציפית עבור עיכוב ביופילם על ידי-לאוצין D, מתוך מעכבים כמה biofilm הספציפי פורסם בתאריך 17 בעבר. חשוב לציין, D-לאוצין כבר התאפיינה מולקולה אנטי biofilm ב הפתוגן צמח Xanthomonas citri 48, הצגת דמיון אפשרי בין קולוניזציה צמחים והיווצרות biofilm. היווצרות ביופילם (קרומית היווצרות המושבה rugose) מקובלת גם פתוגנים אנושיים (למשל, Pseudomonas aeruginosa 49-51 ו coli Escherichia uropathogenic 52,53). השיטות שתוארו ניתן לפתחו הלאה לחפש תרופות ספציפיות מעכבות היווצרות ביופילם ולהפחית התנגדות ביופילם בתיווך לסוכנים מיקרוביאלית במחקר קליני. בסך הכל, השיטות שתוארו כאן יכולות לשמש בסיס לפיתוח מושגים כמותיים ואיכותיים ללמוד מעכבי מולקולה קטנה ספציפי ביופילם במינים אחרים גם כן.
NT "> לסיכום, אנו מספקים תיבת כלי פשוט ושימושי זה מדגים את נקודות החוזק ואת החסרונות פוטנציאליים באמצעות 'subtilis ללמוד מעכבי ביופילם.Disclosures
The authors have nothing to disclose.
Acknowledgements
Electron microscope imaging was conducted at the Electron Microscopy Unit of the Weizmann Institute of Science, supported in part by the Irving and Cherna Moskowitz Center for Nano and Bio-Nano Imaging. This research was also supported by the ISF I-CORE grant 152/1, Mr. and Mrs. Dan Kane, Ms. Lois Rosen, by a Yeda-Sela research grant, by the Larson Charitable Foundation, by Ruth and Herman Albert Scholars Program for New Scientists, by the Ilse Katz Institute for Materials Sciences and Magnetic Resonance Research grant, by the Ministry of Health grant for alternative research methods, and by the France-Israel Cooperation - Maimonide-Israel Research Program. IKG is a recipient of the Rowland and Sylvia Career Development Chair.
Materials
| Name | Company | Catalog Number | Comments |
| Luria Broth, Lennox | Difco | 240230 | |
| Bacto Agar | Difco | 214010 | |
| potassium phosphate monobasic | Sigma, 136.09 g/mol | P0662-500G | |
| potassium phosphate dibasic | Fisher Scientific, 174.18 g/mol | BP363-1 | |
| 3-(N-morpholino)propanesulfonic acid | Fisher Scientific, 209.27 g/mol | BP308-500 | |
| magnesium chloride hexahydrate | Merck, 203.30 g/mol | 1.05833.0250 | |
| calcium chloride anhydrous | J.T. Baker, 110.98 g/mol | 1311-01 | |
| manganese(II) chloride tetrahydrate | Sigma, 197.91 g/mol | 31422-250G-R | |
| iron(III) chloride hexahydrate | Sigma, 270.30 g/mo) | F2877-500G | |
| zinc chloride anhydrous | Acros Organics, 136.29 g/mol | 424592500 | |
| thiamine hydrochloride | Sigma, 337.27 g/mol | T1270-100G | |
| L-tryptophan | Fisher Scientific, 204.1 g/mol | BP395-100 | |
| L-phenylalanine | Sigma, 165.19 g/mol | P5482-100G | |
| L-threonine | Sigma, 119.12 g/mol | T8625-100G | |
| glycerol anhydrous | Bio-Lab Itd | 712022300 | |
| L-glutamic acid monosodium salts hydrate | Sigma, 169.11 g/mol | G1626-1KG | |
| D-leucine | Sigma, 169.11 g/mol | 855448-10G | |
| ethanol anhydrous | Gadot | 830000054 | |
| razor blade | Eddison | NA | |
| circular cellulose filter papers | Whatman, 90 mm | 1001-090 | |
| glutaraldehyde | EMS (Electron Micoscopy Science), 25% in water | 16220 | |
| paraformaldehyde | EMS, 16% in water | 15710 | |
| sodium cacodylate | Merck, 214.05 g/mol | 8.2067 | |
| calcium chloride 2-hydrate | Merck, 147.02 g/mol | 1172113 | |
| stub-aluminium mount | EMS, sloted head | 75230 | |
| carbon adhesive tape | EMS | 77825-12 | |
| Shaker 37 °C | New Brunswick Scientific Innowa42 | NA | |
| Centrifuge | Eppendorf table top centrifuge 5424 | NA | |
| Digital Sonifier, Model 250, used with Double Step Microtip | Branson | NA | |
| Incubator 30 °C | Binder | NA | |
| Incubator 23 °C | Binder | NA | |
| Filter System, 500 ml, polystyrene | Cornig Incorporated | NA | |
| Rotary Shaker - Orbitron Rotatory II | Boekel | NA | |
| S150 Sputter Coater | Edwards | NA | |
| CPD 030 Critical Point Dryer | BAL-TEC | NA | |
| Environmental Scanning Electron Microscope | XL30 ESEM FEG Philips (FEI) | NA |
References
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Stoodley, P., Sauer, K., Davies, D. G., Costerton, J. W. Biofilms as complex differentiated communities. Annu Rev Microbiol. 56, 187-209 (2002).
- Miller, M. B., Bassler, B. L. Quorum sensing in bacteria. Annu Rev Microbiol. 55, 165-199 (2001).
- Aguilar, C., Vlamakis, H., Losick, R., Kolter, R. Thinking about Bacillus subtilis as a multicellular organism. Curr Opin Microbiol. 10, 638-643 (2007).
- Kolter, R., Greenberg, E. P. Microbial sciences: the superficial life of microbes. Nature. 441, 300-302 (2006).
- Kearns, D. B., Chu, F., Branda, S. S., Kolter, R., Losick, R. A master regulator for biofilm formation by Bacillus subtilis. Mol Microbiol. 55, 739-749 (2005).
- Branda, S. S., Chu, F., Kearns, D. B., Losick, R., Kolter, R. A major protein component of the Bacillus subtilis biofilm matrix. Mol Microbiol. 59, 1229-1238 (2006).
- Romero, D., Aguilar, C., Losick, R., Kolter, R. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms. Proc Natl Acad Sci USA. 107, 2230-2234 (2010).
- Kobayashi, K., Iwano, M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms. Mol Microbiol. 85, 51-66 (2012).
- Hobley, L., et al. BslA is a self-assembling bacterial hydrophobin that coats the Bacillus subtilis biofilm. Proc Natl Acad Sci USA. 110, 13600-13605 (2013).
- Romero, D., Vlamakis, H., Losick, R., Kolter, R. An accessory protein required for anchoring and assembly of amyloid fibres in B. subtilis biofilms. Mol Microbiol. 80, 1155-1168 (2011).
- Kolodkin-Gal, I., et al. D-amino acids trigger biofilm disassembly. Science. 328, 627-629 (2010).
- Chan, Y. G., Kim, H. K., Schneewind, O., Missiakas, D. The capsular polysaccharide of Staphylococcus aureus is attached to peptidoglycan by the LytR-CpsA-Psr (LCP) family of enzymes. J Biol Chem. 289, 15680-15690 (2014).
- Mielich-Suss, B., Lopez, D. Molecular mechanisms involved in Bacillus subtilis biofilm formation. Environ Microbiol. 17, 555-565 (2014).
- Cairns, L. S., Hobley, L., Stanley-Wall, N. R. Biofilm formation by Bacillus subtilis: new insights into regulatory strategies and assembly mechanisms. Mol Microbiol. 93, 587-598 (2014).
- Chen, M., Yu, Q., Sun, H. Novel strategies for the prevention and treatment of biofilm related infections. Int J Mol Sci. 14, 18488-18501 (2013).
- Bucher, T., Oppenheimer-Shaanan, Y., Savidor, A., Bloom-Ackermann, Z., Kolodkin-Gal, I. Disturbance of the bacterial cell wall specifically interferes with biofilm formation. Environ Microbiol Rep. 7, 990-1004 (2015).
- Sarkar, S., Pires, M. M. D-Amino acids do not inhibit biofilm formation in Staphylococcus aureus. PLoS One. 10, e0117613(2015).
- Wei, W., Bing, W., Ren, J., Qu, X. Near infrared-caged D-amino acids multifunctional assembly for simultaneously eradicating biofilms and bacteria. Chem Commun (Camb). 51, 12677-12679 (2015).
- Leiman, S. A., et al. D-amino acids indirectly inhibit biofilm formation in Bacillus subtilis by interfering with protein synthesis. J Bacteriol. 195, 5391-5395 (2013).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Davies, D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov. 2, 114-122 (2003).
- Olsen, I. Biofilm-specific antibiotic tolerance and resistance. Eur J Clin Microbiol Infect Dis. 34, 877-886 (2015).
- Tseng, B. S., et al. The extracellular matrix protects Pseudomonas aeruginosa biofilms by limiting the penetration of tobramycin. Environ Microbiol. 15, 2865-2878 (2013).
- Branda, S. S., Gonzalez-Pastor, J. E., Ben-Yehuda, S., Losick, R., Kolter, R. Fruiting body formation by Bacillus subtilis. Proc Natl Acad Sci USA. 98, 11621-11626 (2001).
- Holscher, T., et al. Motility, Chemotaxis and Aerotaxis Contribute to Competitiveness during Bacterial Pellicle Biofilm Development. J Mol Biol. 427, 3695-3708 (2015).
- Bray, D. Methods in Biotechnology. 13, Humana Press Inc. 235-243 (2000).
- Ensikat, H. J., Ditsche-Kuru, P., Barthlott, W. Scanning electron microscopy of plant surfaces: simple but sophisticated methods for preparation and examination. 1, Formatex Research Center. 248-255 (2010).
- Hayat, M. A. Principles and techniques of scanning electron microscopy: Biological applications. 2, Van Nostrand Reinhold Company. (1976).
- Schatten, H. Scanning Electron Microscopy for the Life Sciences. , Cambridge University Press. (2013).
- Bridier, A., Meylheuc, T., Briandet, R. Realistic representation of Bacillus subtilis biofilms architecture using combined microscopy (CLSM, ESEM and FESEM). Micron. 48, 65-69 (2013).
- Boyde, A., MacOnnachie, E. Volume changes during preparation of mouse embryonic tissue for scanning electron microscopy. SCANNING. 2, 149-163 (1979).
- Yao, Z., Kahne, D., Kishony, R. Distinct single-cell morphological dynamics under beta-lactam antibiotics. Mol Cell. 48, 705-712 (2012).
- Epstein, A. K., Pokroy, B., Seminara, A., Aizenberg, J. Bacterial biofilm shows persistent resistance to liquid wetting and gas penetration. Proc Natl Acad Sci USA. 108, 995-1000 (2011).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11, 157-168 (2013).
- Shemesh, M., Chai, Y. A combination of glycerol and manganese promotes biofilm formation in Bacillus subtilis via histidine kinase KinD signaling. J Bacteriol. 195, 2747-2754 (2013).
- Kolodkin-Gal, I., et al. Respiration control of multicellularity in Bacillus subtilis by a complex of the cytochrome chain with a membrane-embedded histidine kinase. Genes Dev. 27, 887-899 (2013).
- Oppenheimer-Shaanan, Y., et al. Spatio-temporal assembly of functional mineral scaffolds within microbial biofilms. npj Biofilms and Microbiomes. 2, 15031(2016).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. , e3796(2012).
- Bogino, P. C., Oliva Mde, L., Sorroche, F. G., Giordano, W. The role of bacterial biofilms and surface components in plant-bacterial associations. Int J Mol Sci. 14, 15838-15859 (2013).
- Fratamico, P. M., Annous, B. A., Guenther, N. W. Biofilms in the Food and Beverage Industires. 1, Woodhead Publishing. (2009).
- Gao, G., et al. Effect of biocontrol agent Pseudomonas fluorescens 2P24 on soil fungal community in cucumber rhizosphere using T-RFLP and DGGE. PLoS One. 7, e31806(2012).
- Chen, Y., et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation. Environ Microbiol. 15, 848-864 (2013).
- Bryers, J. D. Medical biofilms. Biotechnol Bioeng. 100, 1-18 (2008).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7, 375-381 (2009).
- Nevin, K. P., Woodard, T. L., Franks, A. E., Summers, Z. M., Lovley, D. R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds. MBio. 1, (2010).
- Torres, C. I., et al. A kinetic perspective on extracellular electron transfer by anode-respiring bacteria. FEMS Microbiol Rev. 34, 3-17 (2010).
- Li, J., Wang, N. Foliar application of biofilm formation-inhibiting compounds enhances control of citrus canker caused by Xanthomonas citri subsp. citri. Phytopathology. 104, 134-142 (2014).
- Okegbe, C., Price-Whelan, A., Dietrich, L. E. Redox-driven regulation of microbial community morphogenesis. Curr Opin Microbiol. 18, 39-45 (2014).
- Mann, E. E., Wozniak, D. J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 36, 893-916 (2012).
- Bouffartigues, E., et al. Sucrose favors Pseudomonas aeruginosa pellicle production through the extracytoplasmic function sigma factor SigX. FEMS Microbiol Lett. 356, 193-200 (2014).
- Wu, C., Lim, J. Y., Fuller, G. G., Cegelski, L. Quantitative analysis of amyloid-integrated biofilms formed by uropathogenic Escherichia coli at the air-liquid interface. Biophys J. 103, 464-471 (2012).
- Serra, D. O., Richter, A. M., Hengge, R. Cellulose as an Architectural Element in Spatially Structured Escherichia coli Biofilms. J Bacteriol. 195, 5540-5554 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved