Method Article
שיטה של בידוד תא ממוקד באמצעות Functionalization משטח הזכוכית
In This Article
Summary
This protocol describes customizable surface functionalization of the desthiobiotin, streptavidin, and APTES system in order to isolate specific cell types of interest. In addition, this manuscript covers the applications, optimization, and verification of this process.
Abstract
One of the limiting factors to the adoption and advancement of personalized medicine is the inability to develop diagnostic tools to probe individual nuances in expression from patient to patient. Current methodologies that try to separate cells to fill this niche result in disruption of physiological expression, making the separation technique useless as a diagnostic tool. In this protocol, we describe the functionalization and optimization of a surface for the cellular capture and release. This functionalized surface integrates biotinylated antibodies with a glass surface functionalized with an aminosilane (APTES), desthiobiotin and streptavidin. Cell release is facilitated through the introduction of biotin, allowing the recollection and purification of cells captured by the surface. This release is done through the targeting of the secondary moiety desthiobiotin, which results in a much more gentle release paradigm. This reduction in harsh reagents and shear forces reduces changes in cellular expression. The functionalized surface captures up to 80% of cells in a single cell mixture and has demonstrated 50% capture in a dual-cell mixture. Applications of this technology to xenografts and cancer separation studies are investigated. Quantification techniques for surface verification such as plate reader and ImageJ analyses are described as well.
Introduction
גישות הפרדת תא ספסל העליונות נוכחיות (למשל, תא מופעל קרינת מיון 1, דיסקציה מייקרו הלכידה ליזר 2, הפרדה חרוזה-מגנטי חיסוני 1) יכולה לקחת כמה שעות של הכנה ומיון. סולמות זמן גדולים אלה עלולים להשפיע על מידת תגובה שלהם והביטוי פיסיולוגי, וכתוצאה מכך ניתוחים שאינם נציג התגובה הפיזיולוגית 3. מערכות נדרשות שיכולה במהירות וביעילות לבודדת סוגי תאים מסוימים מבלי לשבש פני קרום תא-רמות הקולטן על מנת לשפר בידוד תא והעשרה עבור יישומים ביו. לכן, רציונל הגישה שלנו הוא לפתח גישה עדינה בידוד תא.
את "מעבדה על שבב" המושג מציע את ההבטחה של סדרי גודל יותר מהר (שעות ל-דקות) בידוד תא, ורוב לעתים קרובות כרוך לכידת תאים על גבי משטח ושחרור תאים או קונטה תאייםnts דרך 4,5 פיזי או בשיטות כימיות 6. למרות שגישות אלו מציעים כמה יתרונות כמו זיהוי ביטוי 7,8 חלבון, זיהוי ביטוי RNA 9-11, או אפילו מתן תאים במבחנה תרבות 12,13, רבים של טכניקות אלה לא יכול להיות מתורגם אבחון כגון אפיון קולטן התא עקב לסביבות הלא הפיזיולוגית שלהם. סוכני הרמת אנזימתי כגון collagenases יכול להשפיע גם על כמויות קולטן אלה 14,15, כלומר טכניקות כימות תא קולטן המשתמשות סוכני הרמה אלה לא יפיקו נתונים פיסיולוגיים מדויקים. תמוגה סלולרית מונעת בידול בין הקולטנים הילידים, ואלו הופנמו בעבר 16. פרוטוקול זה מתאר גישה מהירה ועדינה בידוד תא.
Protocol
ריאגנטים 1. ניקוי משטח הזכוכית ואת ההכנה
- מניחים משטח זכוכית מכונת פלזמה חמצן למשך 5 דקות בהספק 50% כדי לנקות אותו.
- הכן 2.5 מ"ל 2% מחדש (3-aminopropyl) triethoxysilane (APTES) פתרון, על ידי הוספת 50 μl של APTES ו 2.45 מ"ל של אתנול צינור חרוטי.
2. APTES ו DSB Functionalization
- הוסף פתרון APTES אל המשטחים. פיפטה 150 μl לכל טוב עבור 8 צלחות היטב. פיפטה 100 μl לכל טוב עבור 24 צלחות היטב. פיפטה 1.1 מ"ל במשך 60 x 15 מ"מ מנות זכוכית. מכסה את המשטחים כדי למנוע התאדות חלוקה לא שווה של פתרון APTES. מניח את המשטחים על שייקר פלטפורמה למשך 50 דקות בטמפרטורת חדר, אשר יוצרת חלוקה שווה של שכבת APTES.
הערה: APTES הוא aminosilane המהווה את השכבה הראשונה של פני השטח. אם אתם משתמשים שונים על פני שטח, heuristically לקבוע את עוצמת הקול של הפתרון הנדרש כדי לכסות את פני השטח. - בחר את הטמפרטורה בתנור, ואילו המשטחים על שייקר: חום עד 55 מעלות צלזיוס למשך 2 שעות במשך 8 צלחות היטב 24 צלחות היטב. זכוכית חומה רק מנות עד 90 מעלות צלזיוס במשך שעה 1.
- יש לשטוף את המשטחים עם אתנול.
- נהל את כמות האתנול נדרשה על ידי הפניה מבוססת על המשטח המשמש. להוסיף 150 אתנול μl היטב כל עבור 8 צלחות היטב. להוסיף 125 אתנול μl היטב כל 24 צלחות היטב. להוסיף 1.1 מ"ל אתנול עבור כלים מזכוכית.
- יש לשטוף את המשטח על ידי הזרמה וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח. לשטוף פעמיים נוספות אתנול משתמש.
הערה: אם כל אחד הצלחות גם תחתיות הזכוכית שום פלסטיק בם, לא לחמם אותם מעל 65 מעלות צלזיוס, כמו הפלסטיק יתחיל להמס עיוות.
- יבש עם 100% חנקן גז לוותר מטנק. מניח את המשטחים ב oVen.
- הכן 2.5 מ"ל של ד-desthiobiotin (DSB) פתרון על ידי שילוב של 1.5 מ"ג / מ"ל DSB ב 37.5 μl של sulfoxide דימתיל (DMSO), ו -5 מ"ג / מ"ל 1-אתיל-3- (3-dimethylaminopropyl) carbodiimide (EDC) ב 2462.5 μl של M 4-morpholinoethanesulfonic 0.1 מימה חומצה (MES) (pH 6) חיץ. ואז לשלב שני הפתרונות.
- הוסף 1 μl של mercaptoethanol 2-β, לאחר 15 דק ', אל הפתרון להרוות את התגובה בין DSB ו EDC. הסר APTES החם פונקציונלי משטחי זכוכית מהתנור. מתן 5-10 דקות עבור משטחי הזכוכית להתקרר.
- להוסיף MES חיץ פני השטח לשטוף, באמצעות כמויות מבוססות על פני השטח. להוסיף 150 MES μl חיץ היטב כל עבור 8 צלחות היטב. להוסיף 125 MES μl חיץ היטב כל 24 צלחות היטב. הוסף חוצץ 1.1 מ"ל MES עבור כלים מזכוכית.
- יש לשטוף לפני השטח על ידי הזרמת וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירותאל פני השטח. לשטוף פעמיים נוספות עם חיץ MES.
- החל פתרון DSB על המשטחים לאפשר להם לדגור. להוסיף 150 פתרון DSB μl לכל טוב עבור 8 צלחות היטב. הוספת 100 פתרון DSB μl לכל טוב עבור 24 צלחות היטב. להוסיף 1.1 מ"ל עבור פתרון DSB כלים מזכוכית.
- מניחים את משטחי זכוכית מכוסה DSB על מגבת נייר לחה בתוך צלחת פטרי. מכסים דגירה מקרר 4 ° C. עבור 18-24 שעות.
3. streptavidin Functionalization
- שטפו כל משטח זכוכית שלוש פעמים עם 1 מ"ל של 1.0x בופר פוספט (PBS). יש לשטוף לפני השטח על ידי הזרמת וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח. לדלל את streptavidin (SAV) הפתרון המניות 0.4 מ"ג / מ"ל (מומלץ).
הערה: PBS הוא שוה, כך שהוא יכול לשמש כמדיום דילול ושטיפה. PBS משמש כממיס עבור SAv, ולכן, לא ישפיע על היכולת של SAV להיקשר אל פני השטח. - החל 0.4 מ"ג / מ"ל של תמיסת SAV שווה על משטחים כך שכבה דקה של צורות בתחתית הכוס, לבחור את כמות פתרון המבוסס על פני השטח. במשך 8 צלחות היטב, להוסיף 150 μl 0.4 מ"ג / מ"ל פתרון SAV לכל טוב. במשך 24 צלחות היטב, להוסיף 100 μl 0.4 מ"ג / מ"ל פתרון SAV לכל טוב. לקבלת כלים מזכוכית, להוסיף 1.1 מ"ל 0.4 מ"ג / מ"ל פתרון SAV.
- מכסים להזיז את הצלחות כדי בצלחת 14 ס"מ פטרי כדי לשמור על הלחות. דגירת צלחת פטרי במקרר למשך 18-24 שעות.
הערה: זה חיוני כדי לנצל כרכים עקביים של APTES, DSB, ו SAV על כל משטח. - שטפו כל משטח זכוכית שלוש פעמים עם 150 μl של PBS להסיר SAV. יש לשטוף לפני השטח על ידי הזרמת וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח.
- להרטיב מגבת נייר wה- i לא מיונן מים ומניחים את מגבת נייר שטוח 14 ס"מ צלחת פטרי סביב צלחות כדי לשמור על לחות במי הקידוחים. מכסים את צלחת פטרי המכילה את הבארות. דגירת צלחת פטרי במקרר 4 ° C בטיחות ביולוגי ברמת 1 (BSL-1) עד צורך.
לכיד ולשחרר Cell 4.
- התחל עם בקבוק T175 (ים) של תאים המיועדים הניסוי. לשאוב את התקשורת מן הבקבוק (ים). יש לשטוף היטב את התקשורת הנותרים עם 5 מ"ל של PBS בטמפרטורת החדר. לשאוב PBS מהבקבוק (ים).
- הוסף 10 מ"ל של סוכן הרמת אנזימטית, כגון פתרון התא דיסוציאציה, אל הבקבוק של תאי T-175. שים את הבקבוק בחממה במשך 6 דקות, כדי לאפשר הסרת התאים מהבקבוק.
- לאחר 6 דקות, להוסיף 10 מיליליטר של תמיסת המלח המאוזנת של קר האנק (HBSS; ראה רשימת חומרים) כדי להשבית את סוכן ההרמה. להוציא 20 μl של תאים לספור מספר התאים בתמיסה באמצעות hemacytometer.
הערה: בהתאם funcהולאם משטחים השתמשו בניסוי ללכוד, את מספר תאי דרוש משתנה. לקבלה פונקציונלית 8 צלחות היטב, השתמש 300,000 תאים לכל טוב. עבור מנות כוס פונקציונליות, להשתמש 1.1 מיליון תאים. במשך 24 צלחות גם פונקציונליים, 125,000 תאים מומלצים. מידע נוסף על ספירת תאים נמצא במוסף. - חזור על שלבים 4.1- 4.3 עבור בקבוק אחר של תאים, אם פחות תאים נוכחים מהדרוש לצורך הניסוי. שלב השעיות תא ותאי ספירה חוזר לקבל מספר כולל של תאים בתמיסה.
- ספין למטה השעית תא בצנטריפוגה ב XG 500 עבור 5 דקות ב 4 ° C כדי לקבל גלולה של תאים מרוכזים. מצא את הכמות המתאימה של HBSS להוסיף את ההשעיה התא כדי לקבל ריכוז של 1 x 10 6 תאים לכל מ"ל, ואז לשאוב supernatant מתאי הסתחרר למטה, ולהוסיף נפח מחושב. נפח זה יכול להיות מחושב באמצעות משוואות במוסף.
- עד פיפטה ומטה (triturate) כדי resuspend התאי דואר בתמיסה ולהפחית clumping הסלולר בתמיסה שעשויה להפחית מחייב נוגדנים. פיצול הפתרון הסלולרי לתוך שליטה נפרדת ופתרונות ניסיוניים. צפייה בקבצים משלימים עבור רכיבים וחישובים.
- מוסיף את נוגדני biotinylated לפתרונות תאי בהתאמה כמתואר קובץ המשלימה. דגירה במשך 30 דקות ב 4 ° C על מערבל הקצה על הקצה.
הערה: עבור תאים MCF7GFP, 0.5 מ"ג / מ"ל hIgG או 0.5 מ"ג / מ"ל נוגדנים HLA-ABC המומלצים. עבור מקרופאגים RAW, 1 מ"ג / מ"ל mCD11b המומלצים במחצית נפח כדי להסביר את ההבדלים דילול. עבור לתאי אנדותל האדם טבורי וריד (HUVECs), 0.5 מ"ג / מ"ל hCD31 מומלץ. - שטוף את משטח הזכוכית הפונקציונלית עם HBSS. לצורך ניסוי זה, צלחת היטב 8 מומלצת.
- להוסיף 150 μl HBSS היטב כל עבור 8 צלחות היטב. לשטוף פעמיים נוספות באמצעות HBSS. יש לשטוף לפני השטח על ידי הזרמת וציור הנוזל מנקודה קבועה כגון בפינת הבאר.החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח. שמור על קור על 4 מעלות צלזיוס.
- להוסיף פתרונות תא אל הבארות ולהמתין 45 דקות עבור התאים כדי לדגור על קרח על שייקר. הפוך את הפתרון של ביוטין ב סטרילי HBSS באמצעות כרכים מחושב כמתואר במוסף.
- הסר את פתרון התא מבאר הזכוכית באמצעות HBSS.
- בעדינות פיפטה 150 μl HBSS לבאר כל אחד. ואז פיפטה את HBSS. יש לשטוף לפני השטח על ידי הזרמת וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח.
- חזור על עוד פעמיים. לאחר כביסה, להוסיף HBSS על הבארות כדי לשמור על התא רטוב.
- להוסיף 150 μl של פתרון ביוטין 20 מ"מ לכל מהדורה בהתאמה היטב, ולאחר מכן לחכות 20 דקות, כדי לאפשר תגובה.
- לזכור תאים שאינם דווקא כבולהים על ידי שטיפה עם HBSS כאמור לעיל, ולאחר מכן, אם באמצעות תאים שכותרתו fluorescently, להמשיך קרינת תמונת התאים. כמו כן תמונה חיה תאים בבקבוק (כביקורת, להשוות עם התאים היטב). אם באמצעות חלבון פלואורסצנטי ירוקים (GFP) תאים transfected, העירור יהיה 470 ננומטר, ואת הפליטה תהיה 515 ננומטר.
5. אופטימיזציה נוגדן: טיטרציה נוגדן
- בגין על ידי הרמת תאים מהבקבוק T75 או T175 כמוסבר בשלב 4.1- 4.3.
הערה: כרכים אלה מכוילים עבור 24 צלחות היטב, אך ניתן לשנות כדי להתאים לכל משטחים פונקציונלי זכוכית באמצעות בדיקות האוריסטי. טיטרציה נוגדן נציג מוצגת באיור 1. - ספירת תאים באמצעות hemacytometer, ולאחר מכן לסובב את פתרון תא צינור חרוטי ב XG 500 עבור 5 דקות ב 4 ° C. מחדש תאים 1 מיליון תאים לכל מ"ל, באמצעות חישובים המתוארים במוסף.
- פיצול 1 מ 'תאי illion לכל פתרון מיליליטר לשישה פתרונות שונים של 500 μl צינורות צנטריפוגות שונים עבור הנוגדן (AB) פתרונות.
- לדלל את הפתרון המניות נוגדן עד 10 מיקרוגרם / מ"ל, 1 מיקרוגרם / מ"ל, 100 ng / ml, 10 ng / ml, 1 ng / ml. צור בקרות באמצעות 100 μl של Stain הצפה (PBS + 1% נתרן יזיד + 1% BSA), ו -500 μl של תאים על הבקרה ללא Ab בו. על הבקרה הריקה (אין Ab ולא תאים), להשתמש בפתרון של 300 μl PBS.
הערה: זהירות: אזיד הנתרן הוא רעיל מאוד, נפץ, בזהירות רבה יש לנקוט בעת השימוש בו. יש להתייעץ עם גיליון נתוני בטיחות חומרים (MSDS) והשתמש בציוד הבטיחות המתאים.
- לדלל את הפתרון המניות נוגדן עד 10 מיקרוגרם / מ"ל, 1 מיקרוגרם / מ"ל, 100 ng / ml, 10 ng / ml, 1 ng / ml. צור בקרות באמצעות 100 μl של Stain הצפה (PBS + 1% נתרן יזיד + 1% BSA), ו -500 μl של תאים על הבקרה ללא Ab בו. על הבקרה הריקה (אין Ab ולא תאים), להשתמש בפתרון של 300 μl PBS.
- שלב ו דגירה הפתרונות Ab עם פתרונות סלולריים במיקסר הקצה על הקצה על 4 מעלות צלזיוס למשך 30 דקות. יש לשטוף את הצלחות גם 24 הפונקציונליות עם שלוש פעמים HBSS. יש לשטוף את המשטח על ידי הזרמה וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את pipette בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח.
- μl Aliquot 125 של כל פתרון מדגם לתוך APTES המתאים, DSB, ו SAV פונקציונליות היטב. דגירה על 4 מעלות צלזיוס או על קרח למשך 45 דקות על משטח הזכוכית. יש לשטוף את המשטח עם HBSS שלוש פעמים כדי להסיר תאים מצורפים שאינו במיוחד. יש לשטוף לפני השטח על ידי הזרמת וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח. אין לשטוף בשורה התחתונה, כמו אלה הם בקרות.
- להוסיף 150 μl של HBSS לכל נשטף היטב, לשים 24 הצלחות היטב על קרח, ולאחר מכן להשתמש בקורא צלחת למדוד קרינה של תאי GFP (עירור 485 ננומטר / פליטה 528 ננומטר).
6. אופטימיזציה נייד: טיטרציה נייד
- הרם את התאים כאמור צעדים 4.1 -4.3.
- ספירת תאים באמצעות hemacytometer. ספין למטה תאים כךlution בצינור חרוטים ב XG 500 עבור 5 דקות ב 4 ° C. מחדש תאים 1 מיליון תאים לכל מ"ל.
הערה: מידע נוסף על שימוש hemacytometer ניתן למצוא במוסף. - פיפטה 1.6 מ"ל מפתרון התא עבור המניה 1.6 מיליון תאים ומכניסים צינור חרוטי. פיפטה 800 μl של תאים מפתרון התא עבור מניות 800,000 תאים ומכניס צינור חרוטים. פיפטה 80 μl ממלאי התא עבור מניות 80,000 תאים ומכניסים צינור חרוטים. פיפטה 8 μl ממלאי התא עבור מניות 8,000 תאים ומכניסים צינור חרוטים.
הערה: ריכוזים ניתנים לכל 8 מדידות הצלחת היטב, לשכפל לפי הצורך. דוגמה של פלט צלחת מוצג באיור 2. - קח את ארבעת פתרונות מניות ספין בצנטריפוגה ב XG 500 במשך 5 דקות ב 4 ° C.. Re- להשעות את כל פתרונות מניות ב 400 μl של HBSS.
- להוסיף 1.6 μl של 100 נוגדן ng / ml למלאי 1.6 מיליון תאים, 0.8 μl למלאי 800,000 תאים, ו -0.5 μl לכל מניות אחרות. דגירה נוגדנים במשך 30 דקות במיקסר הקצה על הקצה למשך 30 דקות ב 4 ° C.. שטוף את משטח זכוכית הפונקציונלית עם שלוש פעמים HBSS.
הערה: הצלחת גם פונקציונלי 8 מומלצת כימות מיקרוסקופיה, בעוד 24 את הצלחת היטב הפונקציונלית מומלצת כימות קורא צלחת. ריכוז נוגדן עבור 8,000 תא מניות היה לא מצטמצם כדי לאפשר את הגורם המגביל של המשטח הלכיד לא להיות חוסר הנוגדנים בתמיסה, אלא את המאפיינים הלכידים של פני השטח. - החל 150 μl של פתרונות מדגם היטב כל אחד. החל את המניה 1.6 מיליון התא בעמודה הראשונה של בארות משמאל. החל את המניות 800,000 התא בעמודה השנייה משמאל. החל את המניות 80,000 התא בעמודה השלישית משמאל. לבסוף להחיל את מניית 8,000 התא בעמודה האחרונה. דגירה במשך 45 דקות ב 4 ° C על שייקר.
הערה: 1.6 מיליוןמניית התא ממשמשת את הריכוז הגבוה ביותר להיבדק, והוא הכמות כפולה של תאים המשמשת בדרך כלל בניסויי הפרדת תא (600,000 תאים לכל היטב) מניית תא 800,000 משמשת הבקרה של הניסוי כפי שהוא ריכוז הסלולר הטיפוסי המשמש בניסויי הפרדת תא (3,000,000 תאים לכל היטב). מניית התא 80,000 משמשת דילול פי עשרה כדי לבדוק ריכוזים נמוכים עבור לכידת הסלולר (30,000 תאים לכל היטב). מניית התא 8,000 משמשת דילול פי מאה להשתמש כבדיקה על מנת לבדוק את הגבול התחתון של פרדה הסלולר (3,000 תאים לכל טוב). - לשטוף עם שלוש פעמים HBSS. יש לשטוף לפני השטח על ידי הזרמת וציור הנוזל מנקודה קבועה כגון בפינת הבאר. החזק את פיפטה בזווית של כ- 70 מעלות כך הקצה אינו מכוון ישירות אל פני השטח. לאסוף את כל השטיפות.
- תמונה התאים על מיקרוסקופ פלואורסצנטי, אם באמצעות 8 צלחות היטב, לקחת תמונות של כל surהפנים, ולהחיל 150 μl ביוטין לכל משטח עבור שעה אחת ב 4 ° C על שייקר. לאחר שעה, לשטוף בארות שחרור ביוטין עם 3 פעמים HBSS כמו קודם. לאסוף את כל השטיפות מבארות לספירה עם hemocytometer ותמונת בארות השחרור.
- החל 150 μl של 20 מ"מ פתרון ביוטין עודף לנכס בארות שחרור ביוטין עבור שעה 1, אם באמצעות 24 צלחות היטב, ולאחר מכן לשטוף אותם בארות 3 פעמים עם HBSS. לכמת 24 צלחות היטב באמצעות קורא צלחת. השתמש hemacytometer לספור תאים מכל שוטף גם אסף.
ניתוח תמונה 7.
הערה: חבילת תוכנת פיג'י (http://fiji.sc/Fiji) מומלצת לניתוח תמונה. בתחילה, התמונות הוסבו תמונה בגוונים אפורה, ולאחר מכן את הבהירות / ניגודיות שונו כדי להוציא מהם את התאים.
- לטעון את התמונה, ולהמיר לגווני אפור ידי לחיצה על כרטיסיית התמונה מכן גלילה למטה כדי "סוג" ולאחר מכן לחיצה על4; 8 ביט ".
- הגדל את הניגודיות של התמונה על ידי לחיצה על כרטיסיית תמונה ולאחר מכן גלילה כדי "להתאים". לחץ על "בהירות והניגודיות", ולאחר מכן להשתמש בפסי הגלילה על מנת להפוך את התאים להתבלט. אם באמצעות תמונות קרינה, להפוך את התמונות כדי להפוך את התאים מוגדרים יותר.
- טען תוסף על ImageJ בשם ITCN (http://rsb.info.nih.gov/ij/plugins/itcn.html) כדי לנתח את התמונות.
- להרחיב ITCN. כאשר תיבת דו-שיח, המנחה את המשתמש עם מספר פרמטרים כדי להעריך את גודל התא, להגדיר את רוחב מינימלי של התא של הריבית הראשונה. לחץ על האפשרות "זיהוי פיקס האפל" אם התמונה ניאון התאים חשוכים.
- הגדר את ערך הסף 2 בתחילה, ולאחר מכן ללחוץ על כפתור "רוזן". גרסה נספרת חדש של התמונה תופיע עם נקודות אדומות המגדירה שבו תאים נספרו.
- התאם את פרמטר הסף ורוחב כדי לקבל נתונים סלולריים מדויקים יותר על ידי defining בגודל של "תא". הערה: מספר תאים נספר יהיה בתיבת דו-שיח בצד ימין. פרמטרי שינוי ינתנו מספר שונה של תאים נספרו.
- המשך איטרציות הפרמטרים סף ורוחב עד אומדן טוב הוא הגיע למספר תאים.
תוצאות
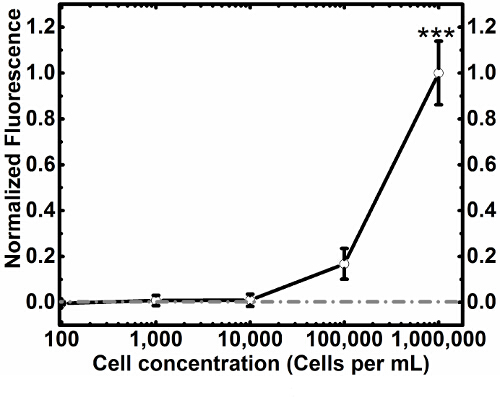
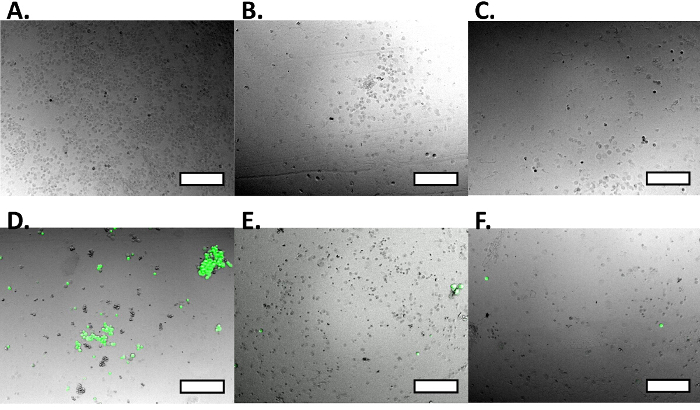
שימוש בפרוטוקול זה אנו מראים ללכוד תאים (איור 3 א) ושחרור תא (איור 3 ג) של תאי MCF7GFP וכן בקרות תא חיות (איור 4). אנחנו כמתנו את ללכוד תאים כמו 60% ו -80% שוחררו (איור 3 ג). כאשר הרחבנו את הגישה הזאת כדי תערובת של מקרופאגים RAW 264.7 ותאי MCF7GFP, 50% של מקרופאגים RAW נתפסו (איור. 3D) ו -80% של מקרופאגים RAW היו שחרור עם 20 ביוטין מ"מ (איור 3 ב). מאז נוגדנים עודפים יכולים להקטין ללכוד תאים, אנו אופטימיזציה באמצעות titrating 0-10,000 ננומטר של נוגדן HLA, ולבחון כי ריכוז הנוגדן האידיאלי הוא בין 100-1,000 נוגדן מ"מ (איור. 1). בדומה לכך, אנו קובעים כי ריכוז אידיאלי של תאים שיכולים ליפול בפח הוא 1 x 10 5 ו 1 x 10 6, מאז להלן מספר לזו של תאים, ערכים נמוכים יותר מהרקע 17(איור 2). נתוני הקרינה מכל טוב מעובד כמתואר להלן.
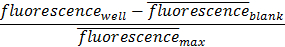
הנה, לממוצע של 3 משכפל נלקח דגימה ללא נוגדנים (ריק) והוא מפחית את קרינת מתקבל מדגם זה. ערך זה הוא אז מנורמל הקרינה מקסימלית הממוצעת. עיבוד זה מאפשר לחוקר לבחון את הגבול הנמוך בבירור של זיהוי הסלולר.

איור 1. מנורמל blanked נוגדן טיטרציה. האדם HLA-ABC הוא טיטרציה על פני כמות קבועה של תאי MCF7GFP (125,000 תאים לכל היטב) ואת הקרינה של תאים שנתפסו היו לכמת באמצעות קורא צלחת. קוֹדֵםחשיפה פני השטח הפונקציונלי, התאים והנוגדנים היו centrifuged להסיר את קובץ מצורף נוגדן הלא ספציפי. ללא צנטריפוגה זה, נוגדן עודף יהיה להרוות שטח ולמנוע נפתח תא, כפי שמוצג עם ריכוזים של 10,000 ng / ml שבו צנטריפוגה לא היה די כדי למנוע oversaturation נוגדן של פני השטח, וכתוצאה מכך התאים פחות מחייבים אל פני השטח. קו אפור מייצג את הביקורת. ברי שגיאה מייצגים סטיית התקן של הממוצע. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
איור 2. טיטרציה Cell מנורמל blanked. ריכוז נוגדן מותאם שימוש מן טיטרציה נוגדנים, תאים MCF7GFP היו טיטרציה למצוא ריכוז ללכוד מותאם בעוד keeping משטח פונקציונלי וריכוז נוגדן מתמיד. זה יכול לשמש כדי לכייל תא ללכוד עבור יישומים שונים. עמודות בנתון זה הם משכפל, בעוד שורות לשנות את הריכוז של תאים כדי למצוא את מגוון הרעיון עבור לכידת הסלולר. קו אפור מייצג שליטה, ברי שגיאה מייצגים סטיית התקן של הממוצע. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לכידת דיאגרמה 3. שחררו ניסויים. תערובת תא בודדת נחשפה המשטח הפונקציונלי (א), לכידת תאי MCF7GFP באמצעות נוגדן HLA-ABC. כאשר הוא נשטף עם HBSS (B), תאים נשאר בשבי, אבל כאשר הם נחשפים פתרון של 20 מ"מ ביוטין (C), תאים היו released. תערובת הסלולר של תאי MCF7GFP ו- RAW 264.7 מקרופאגים נחשפה משטח פונקציונלי ו נתפסה באמצעות נוגדן mCD11b (D). שאינו ספציפי בתא MCF7GFP מסומן בירוק. עוצמת הקרינה של תאים MCF7GFP ירד כאשר הם נחשפים לשטוף נייטרלי (E), מה שמרמז כי השטח לא למקד אותם, ושהם מחוברים שאינם במיוחד. כאשר נחשף לשטוף ביוטין (F), מקרופאגים RAW הממוקדים שוחררו מפני השטח. ברי סולם הם 250 מיקרומטר. לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
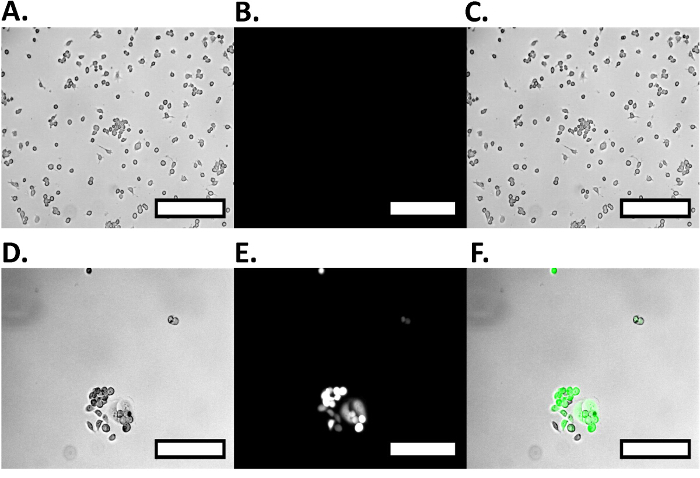
איור 4. בקרת Cell חיובית ושלילית בידוד תא כפול. הביקורת החיובית המקרופאגים RAW הם צלמו oנה קרינת מיקרוסקופ, לא נרשמה כל פעילות ניאון כמו גם האומדת היחסית של תאים. מקרופאגים Brightfield RAW להראות אומדת התא (א), ואילו תחת עירור GFP, אין פלואורסצנטי (ב '), אשר מוצג בתמונה הממוזגת (C). תאי MCF7GFP הבקרה השליליים הם צלמו על מיקרוסקופ פלואורסצנטי מראה פעילות ניאון גדולה, כמו גם את הגודל היחסי של MCF7GFP התאים. תאים הם צלמו על brightfield (D), מראים אומד, ובעוד תחת עירור GFP (E) להראות קרינה גדולה, אשר ניתן לראות בבירור את התמונה הממוזגת (F). ברי סולם הם 250 מיקרומטר. לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
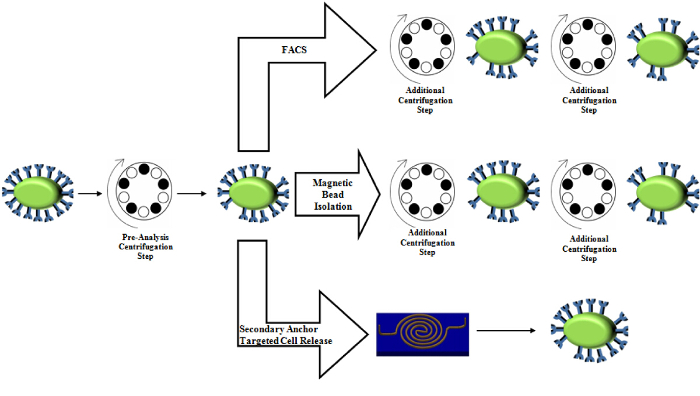
Figure 5. השוואה בין השימוש צנטריפוגות בטכניקות טיהור רגילות. צעד צנטריפוגה טרום הניתוח נשמר ב הכנת מדגם. בידוד חרוז מגנטי וכן FACS כרוך בכמה צעדים צנטריפוגה נוספים, אשר מציג לחץ על לתאים ועלולים לשנות את רמות ביטוי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
קובץ קוד משלימה. חישובים. אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
שיפורים בטכניקות בידוד תא מקדמים מחקרים מדעיים ביחסי מבנה-תפקוד במדעי המוח 18, גזע תכנות תא בביולוגיה רגנרטיבית, ואיתות angiogenic בביולוגיה וסקולרית 19. ואכן, 20 תרבית תאים ראשונית (למשל, HUVECs) בביולוגית וסקולרית נעשה בעיקר באמצעות השימוש בטכניקות בידוד תא. גם בידוד תא שימש לאחרונה עבור זרימת כמותית (qFlow) cytometry ניתוח של קולטני קרום הפלזמה 3,14,15,19,21. עם זאת, מתודולוגיות בידוד תא קיימים להשפיע על רמות הקולטן על פני קרום התא והם יקרים בשני אנשי ריאגנטים. אנו קדמנו שיטה חדשה ב functionalization משטח 17, אשר מאפשר יצירה של מערכת עדינה של לכידה לשחזור של סוג תא בודד מתערובת של סוגי תאים לפגוש הליקויים הללו. טכניקה זו יכולה להיות משולבת מערכת איטרטיבי, הותרת האפשרות גapturing סוגי תאים שונים בשלבים באמצעות נוגדנים ספציפיים. כדי להבהיר את ההליך, מספר השאלות לפתרון בעיות ותשובות מוצעים להלן:
אופטימיזציה Functionalization: תהליכי functionalization עבר אופטימיזציה עבור אחידות משופרת לנתץ של תאים MCF7gfp. פרוטוקול זה יכול לחלופין להיות מותאם אישית לכל סוג תא ותצורת נוגדן. זו יכולה להיות מושגת באמצעות שינוי הריכוזים של מרכיבי הבסיס על פני השטח שבי או על ידי שינוי הסוג או ריכוזים של הנוגדנים. רוב סוגי הנוגדנים ניתן biotinylated באמצעות פרוטוקול לעיל. לאחר biotinylated, אז הם יכולים להיות טיטרציה (איור 1) למצוא ריכוז אידיאלי לנתץ. ריכוז התא ניתן טיטרציה (איור 2) כדי למצוא את הריכוז האידיאלי של תאים כדי ללכוד. שימוש זה, את הכדאיות של לכידה לסוג תא מסוים עם הכובעניתן לקביעת משטח ture. לדוגמא, אם סוג של עניין תא הוא בסדר הגודל של 100 תאים לכל מיליון תאים, לכידה ריכוז תאים בטווח זה באמצעות המשטח הפונקציונלי יהיה אידיאלי. אם במהלך טיטרציה, פני השטח לא יכול ללכוד תאים של קטן ריכוז, ואז אופטימיזציה של פני השטח או הנוגדן היא הכרחית כדי להיות מסוגל לסנן תאים בתוך כי טווח ריכוז.
איזה סוגי תאים משמשים בפרוטוקול זה? איך מישהו יכול לשנות בפרוטוקול זה כדי להשתמש בסוג תאים שונה?
נכון לעכשיו, פרוטוקול זה משתמש תאים MCF7-GFP, מקרופאגים 264.7 RAW הם לעתים קרובות כללו להראות יכולת לשלוף סוג תא אחד בתערובת כפול תאים. תאים אלה נבחרו כפי שהיו שני סוגי התאים הרלוונטיים ביותר מודל xenograft העכבר (גידולים בבני אדם בתוך סביבה בעכברים). על מנת לכייל את התהליך עבור מגוון רחב של תאים אחרים, sp נוגדןecificity הוא בעל חשיבות עליונה. ישנם מספר מקורות מקוונים הזמינות לבחירת נוגדנים 22.
מהן היתרונות של שיטה זו?
גישה עדינה: המחסור בכח עושה גישה זו עדינה. ואכן, כוח גזירה מחושב שלנו הוא מקסימאלי, 24 x 10 -6 pN 17, אשר לא צריך לגרום להפרעה משמעותית סמנים ביולוגיים, מאז מדגיש הידרודינמית של 2.09 Pa (656 pN בהנחה 314 PM 2 שטח פני התא) לגרום נמק בעוד ערכים של מתח מתחת 0.59 Pa (185 pN בהנחה 314 PM 2 תא שטח הפנים) לא 23. גישה עדינה זו אפוא יתרון על פני כמה אפשרויות זמינות מסחרי כגון מבוססת צנטריפוגה מתקרבת 24, אשר מפעיל עד 0.78 Pa 25 של מאמץ גזירת שיא עקב האצה הפתאומית בערכים כ -600 G, אשר עשוי לשנות את דפוסי ביטוי חלבון מורפולוגיה 25 , 26 ואף לגרום תא נימק 23. לכן תהליך שיכול להפחית את כמות שימושים צנטריפוגות יפחית את כמות מדגיש שתאי היה לחוות דרך טיהור, ובסופו של דבר להבטיח נתונים פיזיולוגיים יותר. הפרוטוקול הנוכחי שלנו משתמש צנטריפוגות לטהר ולגבש מחדש את ריכוז התא לפני ללכוד, אולם, תהליך הכנה זה הנו סטנדרטי טכניקות טיהור רבות כגון בידוד חרוז מגנטי 27,28, cytometry זרימה 29, ו FACS 30 (איור 5). הגישה שלנו מפחית כל התהליכים צנטריפוגה במורד הזרם כי טכניקות אחרות להשתמש בנוסף לשלב ההכנה.
ביוטין-avidin גישה: היישום של חומרים ביולוגיים נפוצים (DSB-SAV ו ביוטין-SAV) גם הופך את הגישה הזו 31,32 יתרון. חלבונים המשפחה avidin להיקשר מאוד סלקטיבי את החלבונים המשפחה ביוטין ומשמשים למגוון scientific ויישומים רפואיים כולל: fluorophore-נוגדן מצורף 33, מצורף חרוז Qdot מוקצפים כמותי 34, ויצירת הידרוג המגיבים לגירויים בסביבה כדי לשחרר תרופות במארז 32. בנוסף, הקלות היחסית של רכישת נוגדני biotinylated עושה גישה זו נגישה לציבור רחב וניתן להתאמה אישית.
הגישה Desthiobiotin בלי חרוזים: המשטח ללכוד הוא מסוגל ליישם את השימוש desthiobiotin ללא שימוש של חומרים כימיים כוחות קשים כדי לשחרר את התאים. DSB שימש במשך מצורף תא הפיך ושחרור על ידי מערכות אחרות בשילוב עם DSB-נוגדנים חרוזים מגנטיים 35. עם זאת, ההשפעות הקשות של טכניקת ההפרדה וכן אובדן הסלולר הגדול הקשורות בהכנת הדגימות 27,28 תוצאת קולטן דיפרנציאלי chemokine ביטוי 28,36. גישה זו שואפת להקטיןו להתגבר על המגבלות האלה על ידי ביטול השימוש של שני מגנט וחרוזים ליצור מתודולוגיה לשטוף ושחרור עדין הרבה יותר.
מה הם השלבים הקריטיים בפרוטוקול זה? מה יכול לגרום השתנות? איך יכול השתנות כי להיות נשלט?
יש תהליך זה ארבעה שלבים קריטיים שיכולים לגרום יעילות ירד של משטח הלכידה. השלב הקריטי הראשון הוא מניעת מים אל פני שטח APTES במהלך שלבי functionalization APTES, אשר יביאו חורבן המשטח העצמי התאסף. זה לתקנה באמצעות אתנול כממס ו אפיית APTES בתנור להפחית הידרוליזה מפתרונות מימיים מאוחר יותר. השלב הקריטי השני הוא הצעדים התגובה EDC שבו EDC מזרז את התגובה של DSB עם APTES: המאפשר cross-linking של שתי השכבות. אם EDC נשלל או לא הוסיף מספיק, DSB לא תוכל לצרף את הרצפה, whic h תפגע מנגנון השחרור. השלב הקריטי השלישי הוא במהלך functionalization SAV, כמו שמירה על שכבת SAV היא קריטית. אחידות ללא תוצאות שכבת streptavidin ב הפחתת יעילות הלכידה. השלב הקריטי הרביעי נמצא biotinylation של הנוגדן, כמו המחייב של הנוגדן על פני השטח ללכוד הוא קל באמצעות אינטראקצית streptavidin-ביוטין של משטח לכידת נוגדן. אם הנוגדן הוא הלא-biotinylated, ואחר כך שכבת streptavidin לא תוכל ללכוד אותו ולמשוך אותו, מה שהופך את המשטח הלכיד חסר תועלת. השתנות וחוסר עקביות בלכידת השטח ניתן לייחס-סדירות הלא ריכוז וכן stochasticity התקשרות שכבה. וריאציה זו ניתן לשלוט באמצעות ריכוזים מדויקים של רכיבי שכבה מכוילים אל פני השטח ואת המטרות המיועדות ללכוד. בתכנון זה, ריכוזי מכוילים במיוחד כדי ללכוד תאים MCF7-GFP.
e_content "> מהן החסרונות של שיטה זו?נכון לעכשיו, functionalization APTES נעשה באמצעות טבילת שלב נוזלית של פני השטח במשך 55 דקות ואחריו צעד אפייה עד 2 שעות. אמנם זה מאפשר שכבה שלמה של silane APTES להיקשר אל פני השטח, תהליך אחיד יותר יהיה השלב אדי silanization 37. זה מקטין זמן מגע APTES, ובכך לחסוך את הזמן החוקר, כמו גם הגדלת אחידות. בנוסף, נפתח משופר נצפה 17 כאשר הדגיר הלילה של SAV משמשת, וכיום, את functionalization השטח דורש שנייה, incubations לילה, מה שהופך את התהליך הכולל לקחת שלושה ימים. אז, אופטימיזציה של הכימיה תציע-חיסכון משמעותי בזמן עבור החוקר.
מהן אזהרות או אמצעי זהירות שעשויה להועיל?
כאשר functionalizing משטחים, זה imperative כי טיפול נאות הוא נלקח את הסיכון לנזק בדרכי הנשימה. APTES ו mercaptoethanol שניהם יכולים להיות מסוכנים מאוד אל הריאות ואיברים כלולות, ולכן יש צורך לעשות את התהליך functionalization במנדף כימי כדי להפחית אינטראקציה עם אדים כימיים. Mercaptoethanol הוא תיאול שהוא בעיקר חריף ריח. בעת שימוש mercaptoethanol, לאפשר לפסולת מזוהמת לשבת למכסת מנוע עבור יום או ימים לפני הסילוק.
מהן המטרות יישומים העתידיות של המשטח הזה?
מטרות העתיד שלנו לערב התאמה אישית משטח זה לעבוד עם מגוון רחב של סוגי תאים רלוונטיים למחלות הקשורות angiogenic. במיוחד, אנו מתכוונים להתמקד אדם טבורי הווריד לתאי אנדותל כדי לדבר על עניינו באמצעות דגימות דם הפרדת תאים בעלי עניין משם. בנוסף, אנו מתכננים לשלב שיטות פרדה כגון aptamers לתוך העיצוב של surfac הפונקציונליתדואר כדי להגביר עוד יותר את אחוזי ללכוד שחרורנו.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to thank the American Cancer Society, Illinois Division (282802) and the National Science Foundation CBET (1512598) for funding support. We also would like to thank Dr. Dianwen Zhang from the University of Illinois Beckman Institute for microscopy training. Finally, we would like to thank Jared Weddell, Stacie Chen, and Spencer Mamer for insightful discussions.
Materials
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl) triethoxysilane (APTES) | Acros Organics | 919-30-2 | Used to make 2% APTES solution |
| Plasma Cleaner Pico | Diener | Model 1 | Cleans surfaces and allows for bonding of PDMS to glass |
| d-Desthiobiotin (DSB) | Sigma | D20655 | Used as the releasing mechanism in the cellular capture surface. |
| dimethyl sulfoxide (DMSO) | British Drug Houses (BDH) | BDH1115-1LP | Dissolves the DSB into solution |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC) | Thermo-Scientific | 5g: 22980 25g: 22981 | Activates carboxylic acids and allows binding of proteins to glass surface. |
| uncoated 8-well culture slide | BD Falcon | Case of 24: 354118 Case of 96: 354108 | Used in cellular experiments involving Zeiss fluorescence microscope such as initial capture and release quantification experiments |
| Glass bottom 24-well plates | MatTek | P24G-0-13-F | Used in cellular experiments involving the plate reader such as antibody and cellular titration experiments |
| Mercaptoethanol | Science Lab | 60-24-2 | Used to quench reaction between EDC and DSB |
| 4-Morpholinoethanesulfonic acid hydrate (MES Hydrate 99%) | Fisher Scientific | AC172590250 | Used to make 0.1 M MES Buffer for use in EDC reaction |
| Precision Oven | Thermo Scientific | 11-475-153 | Used in curing of PDMS and APTES layer. |
| Titramax 1000 Shaker | Heidolph | 13-889-420 | Used to ensure even distribution of APTES on surfaces. |
| 1x Streptavidin 5 mg [e7105-5mg] | Proteo Chem | 9013-20-1 | Biotin-binding protein. May cause irritation. |
| 5 cm Glass Dish | Fisher Scientific | 08748A | Used in HUVEC studies as well as future profiling studies. |
| 14 cm Petri Dish with Cover | Sigma-Aldrich | Z717231 | Used to hold samples being functionalized and transport them. |
| MCF7-GFP cells | Cell Biolabs | AKR211 | Stored in liquid nitrogen |
| RAW264.7 mouse macrophages | ATCC | TIB-71 | Gifted to us from Smith lab at the University of Illinois. Stored in liquid nitrogen. |
| TrypLE | Life Technologies | 12605036 | Stored in 100 ml at room temperature |
| Dulbecco’s modified Eagle medium | Cell Media Facility at School of Chemical Sciences at UIUC | 50003PC | Supplier: Corning |
| Nonessential amino acids | Cell Media Facility at School of Chemical Sciences at UIUC | 25-025-CI | Already added into DMEM by facility. Supplier: Corning. |
| Cell scraper | Fisher Scientific | 12-565-58 | Small 23 cm 50 pack |
| Cell Dissociation Solution | Corning | MT-25-056CI | Used to lift cells non-enzymatically for the use in cell experiments |
| Hemacytometer | Hausser | 02-671-54 | Used to count cells for quantification of cell solutions and capture and release effectivity. |
| Biotin | Amresco | 58-85-5 | Used to release cells from surface. |
| HBSS | Created from Recipe | N/A | Used to keep cells alive in suspension as well as wash surfaces of non-specific binding. Adapted from Cold Spring Harbor Protocols: In 500 ml, use 4 g NaCl, 0.2 g KCl, 0.0402 g Na2PO4•7H2O, 0.03 g KH2PO4 and 0.5 g glucose. Add DI water to get to 500 ml, filter, and then refrigerate. |
| HLA-ABC Antibody | BioLegend | 311402 | Antibody used to capture MCF7gfp cells |
| hIgG Antibody | BioLegend | HP6017 | Antibody used to capture MCF7gfp cells |
| MCF7 GFP cells | Cell Biolabs | AKR-211 | Luminal Breast Cancer line that has been transfected with green fluorescent protein. |
| Assorted Conicals | Thermo-Scientific | 15mL: 12-565-268 | 50/15 ml plastic conicals for storing solutions and aliquots. |
| Mini-Tube Rotators (End over End Mixer) | Fisher Scientific | 05-450-127 | Used to incubate antibody and mix other cellular solutions in order to mix |
| Axiovert 200M (Fluorescence Microscope) | Zeiss | N/A | Zeiss Axiovert 200 M inverted florescence microscope. |
| Zeba Desalting columns | Thermo-Scientific | PI-87770 | Used to purify newly biotinylated antibodies after the use of the Biotinylation Kit. Instructions provided at: http://www.funakoshi.co.jp/data/datasheet/PCC/89894.pdf |
| EZ Link Sulfo NHS Low Weight Biotinylation Kit | Thermo- Scientific | Used to biotinylate antibodies to allow them to integrate with the capture surface | |
| Plate Reader | BioTek | Synergy HTX Multimode Reader | Used to quantitatively measure fluorescent intensity in the titration experiments. |
References
- Erdbruegger, U., Haubitz, M., Woywodt, A. Circulating endothelial cells: a novel marker of endothelial damage. Clin. Chim. Acta. 373 (1-2), 17-26 (2006).
- De Spiegelaere, W., Cornillie, P., Van Poucke, M., Peelman, L., Burvenich, C., Van den Broeck, W. Quantitative mRNA expression analysis in kidney glomeruli using microdissection techniques. Histol. Histopathol. 26 (2), 267-275 (2011).
- Chen, S., Guo, X., Imarenezor, O., Imoukhuede, P. I. Quantification of VEGFRs, NRP1, and PDGFRs on Endothelial Cells and Fibroblasts Reveals Serum, Intra-Family Ligand, and Cross-Family Ligand Regulation. Cell. Mol. Bioeng. 8 (3), 383-403 (2015).
- Cheung, L. S. L., et al. Detachment of captured cancer cells under flow acceleration in a bio-functionalized microchannel. Lab Chip. 9 (12), 1721-1731 (2009).
- Privorotskaya, N., et al. Rapid thermal lysis of cells using silicon-diamond microcantilever heaters. Lab Chip. 10 (9), 1135-1141 (2010).
- Park, K., Akin, D., Bashir, R. Electrical capture and lysis of vaccinia virus particles using silicon nano-scale probe array. Biomed. Microdevices. 9 (6), 877-883 (2007).
- Galletti, G., Sung, M., Vahdat, L. Isolation of breast cancer and gastric cancer circulating tumor cells by use of an anti HER2-based microfluidic device. Lab Chip. 14 (1), 147-156 (2014).
- Schudel, B. R., Choi, C. J., Cunningham, B. T., Kenis, P. J. A. Microfluidic chip for combinatorial mixing and screening of assays. Lab Chip. 9 (12), 1676-1680 (2009).
- Lien, K. Y., Chuang, Y. H., et al. Rapid isolation and detection of cancer cells by utilizing integrated microfluidic systems. Lab Chip. 10 (21), 2875-2886 (2010).
- Stott, S. L., et al. Isolation of circulating tumor cells using a. PNAS. 107 (35), 18392-18397 (2010).
- Yu, M., Ting, D., Stott, S., Wittner, B., Ozsolak, F. RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis. Nature. 487 (7408), 510-513 (2012).
- Sheng, W., Ogunwobi, O., Chen, T., Zhang, J. >Capture, release and culture of circulating tumor cells from pancreatic cancer patients using an enhanced mixing chip. Lab Chip. 14 (1), 89-98 (2014).
- Zheng, X., Cheung, L. S. L., Schroeder, J. A., Jiang, L., Zohar, Y. A high-performance microsystem for isolating circulating tumor cells. Lab Chip. 11 (19), 3269-3276 (2011).
- Imoukhuede, P. I., Popel, A. S. Quantification and cell-to-cell variation of vascular endothelial growth factor receptors. Exp. Cell Res. 317 (7), 955-965 (2011).
- Imoukhuede, P. I., Popel, A. S. Expression of VEGF receptors on endothelial cells in mouse skeletal muscle. PLoS One. 7 (9), e44791(2012).
- Ludwig, A., Kretzmer, G., Schügerl, K. Determination of a "critical shear stress level" applied to adherent mammalian cells. Enzyme Microb. Technol. 14 (3), 209-213 (1992).
- Ansari, A., Lee-Montiel, F. T., Amos, J., Imoukhuede, P. I. Secondary anchor targeted cell release. Biotechnol. Bioeng. 112 (11), 2214-2227 (2015).
- Drenan, R. M., Nashmi, R., Imoukhuede, P., Just, H., McKinney, S., Lester, H. A. Subcellular trafficking, pentameric assembly, and subunit stoichiometry of neuronal nicotinic acetylcholine receptors containing fluorescently labeled alpha6 and beta3 subunits. Mol. Pharmacol. 73 (1), 27-41 (2008).
- Imoukhuede, P. I., Dokun, A. O., Annex, B. H., Popel, A. S. Endothelial cell-by-cell profiling reveals temporal dynamics of VEGFR1 and VEGFR2 membrane-localization following murine hindlimb ischemia. Am J Physiol Hear. Circ Physiol. 4 (8), H1085-H1093 (2013).
- van Beijnum, J. R., Rousch, M., Castermans, K., van der Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3 (6), 1085-1091 (2008).
- Imoukhuede, P. I., Popel, A. S. Quantitative fluorescent profiling of VEGFRs reveals tumor cell and endothelial cell heterogeneity in breast cancer xenografts. Cancer Med. 3 (2), 225-244 (2014).
- BD Biosciences. CD Marker Handbook: Human and Mouse. , at: https://www.bdbiosciences.com/documents/cd_marker_handbook.pdf (2010).
- Tanzeglock, T., Soos, M., Stephanopoulos, G., Morbidelli, M. Induction of mammalian cell death by simple shear and extensional flows. Biotechnol. Bioeng. 104 (2), 360-370 (2009).
- Processing Blood. , at: https://www.google.com/patents/US20140030238 (2014).
- Fukuda, S., Schmid-Schönbein, G. W. Centrifugation attenuates the fluid shear response of circulating leukocytes. J. Leukoc. Biol. 72 (July), 133-139 (2002).
- dela Paz, N. G., Walshe, T. E., Leach, L. L., Saint-Geniez, M., D'Amore, P. A. Role of shear-stress-induced VEGF expression in endothelial cell survival. J. Cell Sci. 125 (Pt 4), 831-843 (2012).
- Allard, W. J., et al. Tumor Cells Circulate in the Peripheral Blood of All Major Carcinomas but not in Healthy Subjects or Patients With Nonmalignant Diseases Tumor Cells Circulate in the Peripheral Blood of All Major Carcinomas but not in Healthy Subjects or Patients With Nonmalignant diseases.". Clinical Cancer Research. 10, 6897-6904 (2005).
- Nagrath, S., et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature. 450 (7173), 1235-1239 (2007).
- Chen, S., Weddel, J., Gupta, P., Conard, G., Parkin, J., Imoukhuede, P. I. QFlow Cytometer-Based Receptoromic Screening: A High-throughput Quantification Approach Informing Biomarker Selection and Nanosensor. Submiss. , (2016).
- Vasa, M., et al. Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease. Circ. Res. 89 (1), E1-E7 (2001).
- Hirsch, J. D., Eslamizar, L., et al. Easily reversible desthiobiotin binding to streptavidin, avidin, and other biotin-binding proteins: uses for protein labeling, detection, and isolation. Anal. Biochem. 308 (2), 343-357 (2002).
- Wilchek, M., Bayer, E. A. Applications of Avidin-Biotin Technology: Literature Survey. Methods Enzymol. 152 (1), 183-189 (1987).
- Wu, X., et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots. Nat. Biotechnol. 21 (1), 41-46 (2002).
- Lee-Montiel, F. T., Imoukhuede, P. I. Engineering quantum dot calibration standards for quantitative fluorescent profiling. J. Mater. Chem. B. 1, 6434(2013).
- Oligonucleotide-linked magnetic particles and uses thereof. , Available from: http://www.google.com/patents/US5512439 (1996).
- Naranbhai, V., et al. Impact of blood processing variations on natural killer cell frequency, activation, chemokine receptor expression and function. J. Immunol. Methods. 366 (1-2), 28-35 (2011).
- Yadav, A. R., Sriram, R., Carter, J. A., Miller, B. L. Comparative study of solution-phase and vapor-phase deposition of aminosilanes on silicon dioxide surfaces. Mater. Sci. Eng. C. 35 (1), 283-290 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved