Method Article
Un método de aislamiento de células reconocidas a través del vidrio funcionalización de la superficie
En este artículo
Resumen
This protocol describes customizable surface functionalization of the desthiobiotin, streptavidin, and APTES system in order to isolate specific cell types of interest. In addition, this manuscript covers the applications, optimization, and verification of this process.
Resumen
One of the limiting factors to the adoption and advancement of personalized medicine is the inability to develop diagnostic tools to probe individual nuances in expression from patient to patient. Current methodologies that try to separate cells to fill this niche result in disruption of physiological expression, making the separation technique useless as a diagnostic tool. In this protocol, we describe the functionalization and optimization of a surface for the cellular capture and release. This functionalized surface integrates biotinylated antibodies with a glass surface functionalized with an aminosilane (APTES), desthiobiotin and streptavidin. Cell release is facilitated through the introduction of biotin, allowing the recollection and purification of cells captured by the surface. This release is done through the targeting of the secondary moiety desthiobiotin, which results in a much more gentle release paradigm. This reduction in harsh reagents and shear forces reduces changes in cellular expression. The functionalized surface captures up to 80% of cells in a single cell mixture and has demonstrated 50% capture in a dual-cell mixture. Applications of this technology to xenografts and cancer separation studies are investigated. Quantification techniques for surface verification such as plate reader and ImageJ analyses are described as well.
Introducción
De sobremesa enfoques actuales de separación de células (por ejemplo, de células activada por fluorescencia 1, captura por láser micro-disección 2, inmuno-magnética separación del grano 1) puede tomar varias horas de preparación y de clasificación. Estas grandes escalas de tiempo pueden afectar los niveles de respuesta y fisiológicos de expresión, lo que resulta en análisis que no son representativos de la respuesta fisiológica 3. Sistemas que se necesitan rápida y eficiente puede aislar determinados tipos de células sin interrumpir los receptores de los niveles de la superficie celular con el fin de mejorar el aislamiento de células y el enriquecimiento para aplicaciones biomédicas. Por lo tanto, la razón de nuestro enfoque es el desarrollo de un enfoque suave para el aislamiento de células.
El "laboratorio en un chip" concepto ofrece la promesa de órdenes de magnitud más rápido aislamiento de células (horas-minutos-a), y con mayor frecuencia implica la captura de células sobre una superficie y células o conte intracelular liberaciónn id a través física 4,5 o 6 métodos químicos. Aunque estos enfoques ofrecen algunas ventajas tales como la identificación de la expresión de proteína 7,8, la identificación de la expresión del ARN 9-11, o incluso proporcionar células para el cultivo in vitro 12,13, muchas de estas técnicas no pueden ser traducidos a los diagnósticos, tales como perfiles de receptor de la célula debido a sus entornos no fisiológicas. Agentes de elevación enzimáticos tales como colagenasas también pueden afectar a los receptores de estas cantidades, es decir, 14,15 técnicas de cuantificación del receptor de células que usan estos agentes de elevación no generará datos fisiológicos precisos. Lisis celular previene la diferenciación entre los receptores de la superficie nativas, y las que se internaliza previamente 16. Este protocolo describe un enfoque rápido y suave para el aislamiento de células.
Protocolo
1. Limpieza de la superficie del vidrio y Preparación de Reactivos
- Colocar una superficie de vidrio en una máquina de plasma de oxígeno durante 5 minutos a 50% de potencia para limpiarlo.
- Preparar 2,5 ml 2% reconstituido (3-aminopropil) trietoxisilano (APTES) solución, mediante la adición de 50 l de APTES y 2,45 ml de etanol en un tubo cónico.
2. APTES y funcionalización OSD
- Añadir solución APTES a las superficies. Pipetear 150 l por pocillo para placas de 8 pocillos. Pipeta 100 l por pocillo de placas de 24 pocillos. Pipetear 1,1 ml de platos de cristal de 60 x 15 mm. Cubrir las superficies para evitar la evaporación y la distribución desigual de la solución APTES. Colocar las superficies en un agitador de plataforma durante 50 min a temperatura ambiente, lo que crea una distribución uniforme de la capa de APTES.
NOTA: APTES es un aminosilano que forma la primera capa de la superficie. Si se utiliza una superficie diferente, heurísticamente determinar el volumen de solución necesario para cubrir la superficie. - Seleccione la temperatura para el horno, mientras que las superficies están en el agitador: Calentar a 55 ° C durante 2 h para las placas 8 pocillos y placas de 24 pocillos. vidrio de calor sólo platos a 90 ° C durante 1 hora.
- Enjuague las superficies con etanol.
- Administrar la cantidad de etanol requerida haciendo referencia basado en la superficie utilizada. Añadir 150 l de etanol a cada pocillo para placas de 8 pocillos. Añadir 125 l de etanol a cada pocillo para placas de 24 pocillos. Añadir 1,1 ml de etanol para los platos de vidrio.
- Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie. Enjuague dos veces más el uso de etanol.
NOTA: Si cualquiera de los pocillos con fondo de cristal tienen cualquier plástico en ellos, no calentarlos por encima de 65 ° C, ya que el plástico que comenzará a derretirse y la deformación.
- Secar con gas 100% de nitrógeno dispensado desde un tanque. Coloque las superficies de la juntaVen.
- Preparar 2,5 ml de la solución de d-destiobiotina (DSB) mediante la combinación de 1,5 mg / ml OSD en 37,5 l de sulfóxido de dimetilo (DMSO), y 5 mg / ml de 1-etil-3- (3-dimetilaminopropil) carbodiimida (EDC) en 2462.5 l de la (6 pH) tampón de hidrato de ácido 4-morfolinoetanosulfónico M 0,1 (MES). A continuación, combinar ambas soluciones.
- Añadir 1 l de mercaptoetanol 2-β, después de 15 min, en la solución para detener la reacción entre DSB y EDC. Retire APTES calientes funcionalizados superficies de vidrio del horno. Espere 5-10 minutos para las superficies de vidrio se enfríe.
- Añadir tampón MES la superficie para enjuagar, el uso de cantidades en base a la superficie. Añadir 150 ml de tampón MES a cada pocillo para placas de 8 pocillos. Añadir 125 l de tampón MES a cada pocillo para placas de 24 pocillos. Añadir 1,1 ml de tampón MES para los platos de cristal.
- Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamenteen la superficie. Enjuague dos veces más con tampón MES.
- Aplicar la solución OSD a las superficies para que puedan incubar. Añadir 150 solución OSD l por pocillo para placas de 8 pocillos. Añadir una solución de 100 OSD l por pocillo de placas de 24 pocillos. Añadir 1,1 ml de solución de vidrio platos OSD.
- Coloque las superficies de vidrio OSD cubiertos sobre una toalla de papel húmeda en el interior de una caja de Petri. Cubrir e incubar en una nevera C 4 ° durante 18-24 horas.
3. La funcionalización estreptavidina
- Enjuague cada superficie de vidrio tres veces con 1 ml de 1,0x salina tamponada con fosfato (PBS). Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie. Diluir la solución de estreptavidina (SAV) stock a 0,4 mg / ml (recomendado).
NOTA: PBS es isotónica para que pueda ser utilizado como un medio para la dilución y lavado. PBS se usa como un disolvente para el SAv, y por lo tanto, no afectará a la capacidad de la SAV a unirse a la superficie. - Aplicar 0,4 mg / ml de solución de SAv de manera uniforme a las superficies de manera que una capa delgada de formas en la parte inferior de la copa, seleccionar la cantidad de solución basada en la superficie. Para placas de 8 pocillos, añadir solución SAv 150 l 0,4 mg / ml por pocillo. Para placas de 24 pocillos, añadir solución SAv 100 l 0,4 mg / ml por pocillo. Para los platos de vidrio, añadir solución Sav / ml 1,1 ml 0,4 mg.
- Tapar y mover las placas a una placa de Petri de 14 cm para retener la humedad. Incubar la placa de Petri en el refrigerador durante 18-24 horas.
NOTA: Es esencial utilizar volúmenes consistentes de APTES, OSD, y sav en cada superficie. - Enjuague cada superficie de vidrio tres veces con 150 ml de PBS para eliminar SAv. Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie.
- Moje una toalla de papel wITH agua desionizada y coloque la toalla de papel plana en 14 cm placa de Petri que rodea las placas para retener la humedad en los pocillos. Cubrir la placa de Petri que contiene los pozos. Incubar la placa de Petri en el nivel 1 (BSL-1) refrigerador 4 ° C hasta que se necesite Bioseguridad.
4. Captura y liberación de la célula
- Comience con el frasco (s) T175 de células destinados para el experimento. Aspirar los medios de comunicación del frasco (s). Lave el resto del soporte con 5 ml de PBS temperatura ambiente. Aspirar PBS del matraz (s).
- Añadir 10 ml de agente de elevación no enzimática, tales como la célula de disociación de soluciones, en el matraz T-175 de las células. Poner el matraz en la incubadora durante 6 minutos para permitir la elevación de las células del matraz.
- Después de 6 minutos, añadir 10 ml de solución salina equilibrada de Hank fría (HBSS; Ver Lista de Materiales) para inactivar el agente de elevación. Sacar 20 l de células para contar el número de células en solución utilizando un hemacitómetro.
NOTA: Dependiendo de la funcsuperficies utilizadas en el experimento de captura de titucionalizado, el número de células necesario varía. Para funcionalizados 8 placas de pocillos, utilice 300.000 células por pocillo. Para los platos de vidrio funcionalizadas, utilizar 1,1 millones de células. Para funcionalizados placas de 24 pocillos, se recomienda a 125.000 células. Más información sobre el recuento de células se encuentra en el Suplemento. - Repetir los pasos 4.1- 4.3 para otro matraz de células, si un menor número de células están presentes de lo necesario para el experimento. Combinar las suspensiones de células y células de recuento para obtener el número total de células en solución.
- Centrifugar la suspensión de células en una centrífuga a 500 xg durante 5 min a 4 ° C para obtener un pellet de las células concentradas. Encontrar la cantidad apropiada de HBSS para añadir a la suspensión celular para obtener una concentración de 1 x 10 6 células por ml, a continuación, aspirar el sobrenadante de las células se centrifugaron, y añadir el volumen calculado. Este volumen se puede calcular utilizando las ecuaciones presentadas en el suplemento.
- Pipeta hacia arriba y abajo (triturado) para volver a suspender THcélulas correos en solución y esto reduce la agregación celular en una solución que puede reducir la unión del anticuerpo. Dividir la solución celular en el control separado y soluciones experimentales. Ver el fichero suplementario para componentes y cálculos.
- Añadir los anticuerpos con biotina a las respectivas soluciones celulares como se describe en el archivo suplementario. Incubar durante 30 minutos a 4 ° C en un mezclador extremo sobre-fin.
NOTA: Para las células MCF7GFP, 0,5 mg / ml o anticuerpos hIgG / ml HLA-ABC 0,5 mg se recomiendan. Para los macrófagos RAW, se recomienda 1 mg / ml mCD11b a la mitad del volumen para dar cuenta de las diferencias de dilución. Para las células endoteliales de vena umbilical humana (HUVEC), 0,5 mg / ml se recomienda hCD31. - Lavar la superficie de vidrio funcionalizada con HBSS. Para este experimento, se aconseja una placa 8 también.
- Añadir 150 l HBSS a cada pocillo para placas de 8 pocillos. Enjuague dos veces más con HBSS. Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo.Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie. Mantener frío a 4 ° C.
- Añadir las soluciones de células a los pocillos y esperar 45 minutos para que las células se incuban en hielo en el agitador. Hacer que la solución de biotina en HBSS estéril mediante el uso de volúmenes calculados como se describe en el Suplemento.
- Retire la solución de células de los pozos de vidrio mediante el uso de HBSS.
- pipetear suavemente 150 l HBSS en cada pocillo. A continuación pipetear el HBSS. Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie.
- Repetir dos veces más. Después del lavado, añadir HBSS a los pocillos para mantener las células en húmedo.
- Añadir 150 ml de solución de biotina 20 mM a cada versión respectiva bien, y luego esperar 20 minutos para permitir la reacción.
- Se acuerden de células no específicamente unidos de un lavado con HBSS como se ha dicho, y luego, si el uso de células marcadas con fluorescencia, proceder a la fluorescencia de imagen de las células. También las células vivas de la imagen en un frasco (como control, para comparar con las células en el pozo). Si el uso de células transfectadas proteína fluorescente verde (GFP), la excitación será 470 nm, y la emisión será 515 nm.
5. Anticuerpo Optimización: Titulación de anticuerpos
- Empezar por el levantamiento de las células de la T75 o T175 matraz como se explica en el paso 4.1- 4.3.
NOTA: Estos volúmenes están calibrados para placas de 24 pocillos, pero se pueden cambiar para adaptarse a cualquier superficie de vidrio funcionalizada a través de pruebas heurístico. Una valoración de anticuerpos representativo se muestra en la Figura 1. - Recuento de células utilizando el hemocitómetro, y luego girar hacia abajo la solución de células en un tubo cónico a 500 xg durante 5 min a 4 ° C. Reconstituir las células de 1 millón de células por ml, usando los cálculos descritos en el Suplemento.
- Dividir el 1 mcélulas illones por ml de solución en seis soluciones diferentes de 500 l en diferentes tubos de centrífuga para el anticuerpo (Ab) soluciones.
- Diluir la solución de anticuerpo de stock a 10 mg / ml, 1 g / ml, 100 ng / ml, 10 ng / ml, 1 ng / ml. Crear los controles mediante el uso de 100 l de la mancha de Buffer (PBS + 1% de azida de sodio + 1% de BSA), y 500 l de células para el control sin Ab en ella. Para el blanco de control (n Ab y sin células), utilizan una solución de 300 l de PBS.
NOTA: ATENCIÓN: La azida sódica es extremadamente tóxico, explosivo, y un cuidado extremo se debe tomar cuando se la usa. Por favor consulte la hoja de datos de seguridad del material (MSDS) y utilizar el equipo de seguridad apropiado.
- Diluir la solución de anticuerpo de stock a 10 mg / ml, 1 g / ml, 100 ng / ml, 10 ng / ml, 1 ng / ml. Crear los controles mediante el uso de 100 l de la mancha de Buffer (PBS + 1% de azida de sodio + 1% de BSA), y 500 l de células para el control sin Ab en ella. Para el blanco de control (n Ab y sin células), utilizan una solución de 300 l de PBS.
- Combinar e incubar las soluciones Ab con las soluciones de células en el mezclador de extremo sobre extremo a 4 ° C durante 30 min. Enjuagar las placas de 24 pocillos funcionalizados con HBSS tres veces. Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantenga la pipette en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie.
- Alícuotas de 125 l de cada solución de muestra en las APTES apropiadas, OSD, y Sav funcionalizados también. Se incuba a 4 ° C o en hielo durante 45 min sobre la superficie de vidrio. Enjuague la superficie con HBSS tres veces para eliminar las células unidas no específicamente. Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie. No se enjuague la fila inferior, ya que esos son los controles.
- Añadir 150 ml de HBSS a cada lavó bien, poner las placas de 24 pocillos en hielo, y luego usar un lector de placas para medir la fluorescencia de las células GFP (excitación 485 nm / emisión 528 nm).
6. Optimización de la célula: Titulación Celular
- Levante las células como se ha mencionado en los pasos 4.1 -4.3.
- Recuento de células utilizando un hemocitómetro. Centrifugar las células de modolución en tubo cónico a 500 xg durante 5 min a 4 ° C. Reconstituir las células a 1 millón de células por ml.
NOTA: Más información sobre el uso de la hemocitómetro se puede encontrar en el suplemento. - Pipetear 1,6 ml de la solución de células para la población de 1,6 millones de células y colocar en un tubo cónico. Pipetear 800 l de células a partir de la solución de células para la población de 800.000 células y colocar en un tubo cónico. Pipeta de 80 l de la población de células de la población de 80.000 células y colocar en un tubo cónico. Pipeta de 8 l de la población celular de 8.000 células de valores y colocar en un tubo cónico.
NOTA: Las concentraciones se dan por 8 mediciones de placa así, repetir según sea necesario. Un ejemplo de salida de la placa se muestra en la Figura 2. - Tome las cuatro soluciones madre y girar en una centrífuga a 500 g durante 5 min a 4 ° C. Vuelva a suspender todas las soluciones madre en 400 l de HBSS.
- Añadir 1,6 l de 100 ng de anticuerpo / ml al stock 1.600.000 celular, 0,8 μl al stock de 800.000 células, y 0,5 l a todas las demás poblaciones. Incubar el anticuerpo durante 30 minutos en el mezclador de extremo sobre extremo durante 30 minutos a 4 ° C. Lavar la superficie de vidrio funcionalizada con HBSS tres veces.
NOTA: Se recomienda que la placa de 8 funcionalizado para la cuantificación de microscopía, mientras que se recomienda la placa así funcionalizado 24 para lector de placas de cuantificación. La concentración de anticuerpo de 8.000 celular stock no se redujo para permitir que el factor limitante de la superficie de captura a no ser la falta de anticuerpos en solución, sino más bien las propiedades de captura de la superficie. - Aplicar 150 l de las soluciones de muestra a cada pocillo. Aplicar la población de 1,6 millones de células a la primera columna de pocillos de la izquierda. Aplicar la población de 800.000 celda a la segunda columna de la izquierda. Aplicar la población de 80.000 células a la tercera columna desde la izquierda. Finalmente aplicar la acción de 8.000 celda a la última columna. Incubar durante 45 minutos a 4 ° C en el agitador.
NOTA: El 1,6 millonescelular stock sirve como la mayor concentración a ensayar, y es el doble de la cantidad de células que se utiliza típicamente en los experimentos de separación celular (600.000 células por pocillo) El stock de 800.000 células sirve como control para el experimento, ya que es la concentración celular típica que se utiliza en los experimentos de separación celular (3.000.000 de células por pocillo). El stock de 80.000 células sirve como una dilución de diez veces para la prueba de concentraciones más bajas para la captura celular (30.000 células por pocillo). El stock de 8.000 celular sirve como una dilución centenar de veces que se utiliza como una prueba para comprobar el límite inferior de la separación celular (3.000 células por pocillo). - Enjuague con HBSS tres veces. Enjuague la superficie mediante la descarga y el dibujo del líquido desde un punto fijo, como la esquina del pozo. Mantener la pipeta en un ángulo de 70 ° para que la punta no está orientado directamente en la superficie. Recoger todos los lavados.
- Imagen de las células en un microscopio de fluorescencia, si se utilizan placas 8, así, tomar fotos de cada uno surcara, y se aplica biotina 150 l a cada superficie durante una hora a 4 ° C en el agitador. Después de una hora, enjuague pozos de liberación de biotina con HBSS 3 veces como antes. Recoger todos los lavados de los pozos para contar con el hemocitómetro y la imagen de los pozos de liberación.
- Aplicar 150 l de solución de biotina exceso de 20 mM a los pocillos apropiados de liberación de biotina durante 1 hora, si el uso de placas de 24 pocillos, y luego enjuague aquellos pocillos 3 veces con HBSS. Cuantificar placas de 24 pocillos utilizando un lector de placas. Utilice un hemacitómetro para contar las células de todos los lavados así recogidos.
Análisis 7. Imagen
Nota: Se recomienda el paquete de software de Fiji (http://fiji.sc/Fiji) para el análisis de imágenes. Inicialmente, las imágenes se convirtieron en la imagen en escala de grises, y luego el brillo / contraste se modificó para permitir llevar a cabo las células.
- Cargar la imagen, y convertir a escala de grises haciendo clic en la pestaña de la imagen a continuación, desplazarse hacia abajo para "Tipo" y luego haciendo clic4; 8 bit ".
- Aumentar el contraste de la imagen haciendo clic en la pestaña de imagen y luego desplazarse a "Ajuste". Haga clic en "Brillo y contraste", y luego usar las barras de desplazamiento para hacer que las células se destacan. Si el uso de imágenes de fluorescencia, invertir las imágenes para que las células sean más definidos.
- Cargar un plugin en ImageJ llama ITCN (http://rsb.info.nih.gov/ij/plugins/itcn.html) para analizar las imágenes.
- Abrir ITCN. Cuando aparezca un cuadro de diálogo que pide al usuario con varios parámetros para estimar el tamaño de la celda, establecer el ancho mínimo de la primera célula de interés. Haga clic en la opción "Detectar picos oscuros" si la imagen es fluorescente y se oscurecen las células.
- Establecer el valor umbral en el 2 al principio, y luego pulsa el botón "Count". Una versión recién contado de la imagen aparecerá con puntos rojos que delimitan donde se han contado las células.
- Ajustar el parámetro de umbral y el ancho para obtener datos más precisos celulares por defining del tamaño de una "célula". Nota: El número de células contadas estará en un cuadro de diálogo de la derecha. Modificación de los parámetros darán diferente número de células contadas.
- Continuar para recorrer los parámetros de umbral y de anchura hasta que se alcanza una buena estimación para el número de células.
Resultados
El uso de este protocolo se muestra la captura de células (Figura 3A) y la liberación de células (Figura 3C) de células MCF7GFP, así como controles de células vivas (Figura 4). Se cuantificó la captura de células en un 60% y el 80% fueron puestos en libertad (Figura 3C). Cuando nos extendió este enfoque a una mezcla de RAW 264.7 macrófagos y células MCF7GFP, 50% de los macrófagos RAW fueron capturados (Fig. 3D) y 80% de macrófagos RAW eran liberación con biotina 20 mM (Figura 3B). Desde el exceso de anticuerpo puede disminuir la captura de células, hemos optimizado a través de la titulación 0-10.000 nM de anticuerpo HLA, y observamos que la concentración de anticuerpo ideal es entre el anticuerpo 100-1.000 mM (Fig. 1). Del mismo modo, se determina que la concentración ideal de células que puede ser capturado es 1 x 10 5 y 1 x 10 6, ya que por debajo de ese número de células, los valores son más bajos que el fondo 17(Figura 2). Los datos de fluorescencia de cada pocillo se procesa como se describe a continuación.
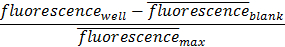
Aquí, la media de 3 repeticiones se toma de una muestra sin anticuerpo (en blanco) y se resta de la fluorescencia obtenida a partir de cada muestra. Este valor es entonces normalizada a la fluorescencia máxima promedio. Este proceso permite al investigador observar claramente el bajo límite de detección celular.

Figura 1. Normalized En blanco Anticuerpo titulación. Humano HLA-ABC se valora a través de una cantidad constante de células MCF7GFP (125.000 células por pocillo) y la fluorescencia de células capturadas se cuantificaron usando un lector de placas. Anteriorcon la exposición a la superficie funcionalizada, se centrifugaron las células y los anticuerpos para eliminar unión de anticuerpos no específica. Sin esta centrifugación, el exceso de anticuerpo se saturará superficie y prevenir pulldown celular, como se muestra con concentraciones de 10.000 ng / ml, donde la centrifugación no era suficiente para evitar la sobresaturación de anticuerpo de la superficie, lo que resulta en menos células que se unen a la superficie. línea gris representa el control. Las barras de error representan el error estándar de la media. Por favor, haga clic aquí para ver una versión más grande de esta figura.
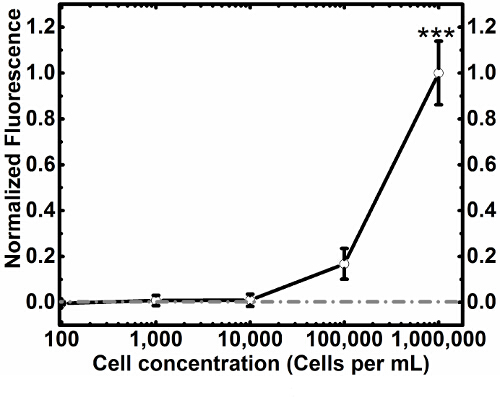
Figura 2. Normalizado En blanco Titulación de la célula. El uso de la concentración de anticuerpos optimizado de la valoración de anticuerpos, las células fueron titulados MCF7GFP para encontrar la concentración de captura optimizada mientras keEping superficie funcionalizada y concentraciones de anticuerpo constante. Esto puede ser usado para calibrar la captura de células para diferentes aplicaciones. Las columnas de esta figura son repeticiones, mientras que las filas cambian la concentración de las células para encontrar el rango idea para la captura celular. Línea gris representa el control, y las barras de error representan el error estándar de la media. Por favor, haga clic aquí para ver una versión más grande de esta figura.
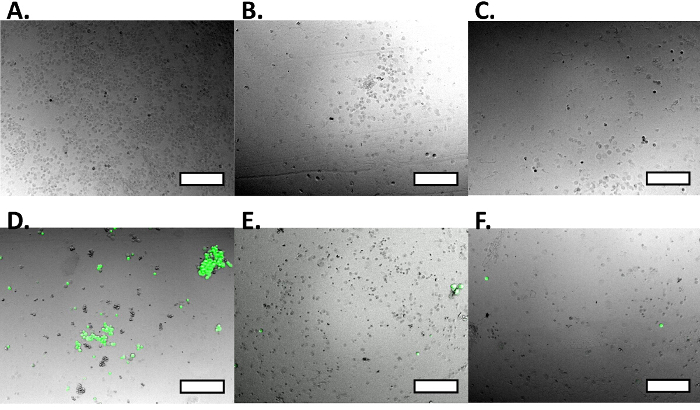
Figura 3. Captura y liberación Los experimentos. Una mezcla única célula se expone a la superficie funcionalizado (A), la captura de células MCF7GFP utilizando anticuerpos HLA-ABC. Cuando se lavó con HBSS (B), las células permanecieron capturados, pero cuando se expone a una solución de biotina 20 mM (C), las células fueron releobre la base. Una mezcla celular de las células MCF7GFP y macrófagos RAW 264.7 fueron expuestos a una superficie funcionalizado y fueron capturados utilizando anticuerpo mCD11b (D). MCF7GFP células no específicas se marcan en verde. La intensidad de fluorescencia de las células MCF7GFP disminuyó cuando se expone a un lavado neutro (E), lo que implica que la superficie no los de destino, y que se une de forma no específica. Cuando se expone a un lavado de biotina (F), los macrófagos RAW dirigidos fueron liberados de la superficie. Las barras de escala son de 250 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Figura 4. Control de la célula positivo y negativo para el aislamiento celular dual. El control positivo RAW Los macrófagos se le toman radiografías ona microscopio de fluorescencia, que no muestran actividad fluorescente, así como el tamaño relativo de las células. Macrófagos RAW Brightfield muestran el tamaño de células (A), mientras que bajo excitación GFP, no hay fluorescencia (B), que se muestra en la imagen resultante de la concentración (C). Las células de control MCF7GFP negativos son imágenes en un microscopio de fluorescencia que muestra gran actividad fluorescente, así como el tamaño relativo de las células MCF7GFP '. Las células se captación de imagen sobre campo claro (D), que muestra el tamaño, y mientras bajo excitación GFP (E) muestran gran fluorescencia, que puede ser claramente se muestra en la imagen resultante de la fusión (F). Las barras de escala son de 250 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
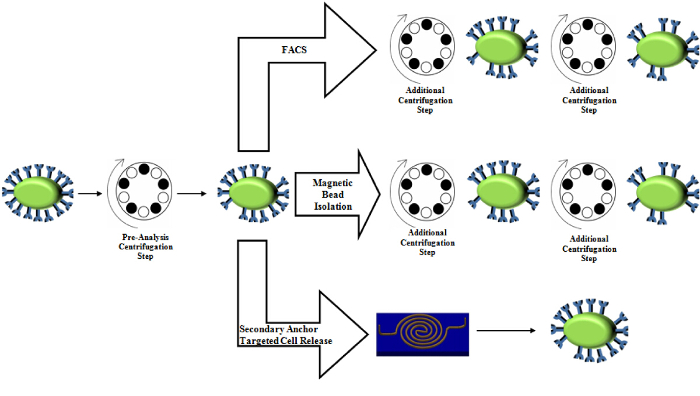
Figura 5. Comparación del uso de centrífuga en técnicas de purificación estándar. La etapa de centrifugación pre-análisis se conserva en la preparación de muestras. Aislamiento de perlas magnéticas, así como FACS implica varias etapas de centrifugación adicionales, que introduce el estrés en las células y puede alterar los niveles de expresión. Haga clic aquí para ver una versión más grande de esta figura.
Archivo de código suplementario. Cálculos. Por favor, haga clic aquí para descargar este archivo.
Discusión
Las mejoras en las técnicas de aislamiento de células promueve estudios científicos en las relaciones estructura-función en la neurociencia 18, la programación celular en biología regenerativa, y la señalización angiogénica en la biología vascular 19 de vástago. De hecho, cultivo celular primario 20 (por ejemplo, HUVECs) en biología vascular se realiza principalmente a través del uso de técnicas de aislamiento de células. Aislamiento de células también fue utilizado recientemente para el flujo cuantitativa (QFlow) análisis de citometría de receptores de membrana plasmática 3,14,15,19,21. Sin embargo, las metodologías de aislamiento de células existentes afectan a los niveles de los receptores de la superficie celular y son costosos tanto en personal y reactivos. Hemos avanzado un nuevo método en funcionalización de la superficie 17, que permite la creación de un sistema de captura suave reproducible de un solo tipo de células a partir de una mezcla de tipos de células para satisfacer estas deficiencias. Esta técnica se puede integrar en un sistema iterativo, lo que permite la posibilidad de capturing diferentes tipos de células en etapas usando anticuerpos específicos. Para aclarar aún más el procedimiento, una serie de preguntas y respuestas de solución de problemas se ofrecen a continuación:
Funcionalización Optimización: Los procesos de funcionalización se ha optimizado para mejorar la uniformidad y tire hacia abajo de las células MCF7gfp. Este protocolo, alternativamente, se puede optimizar y personalizar para cualquier tipo de célula y la configuración del anticuerpo. Esto puede lograrse mediante la alteración de las concentraciones de los componentes de la base en la superficie de captura, o cambiando el tipo o la concentración de los anticuerpos. La mayoría de los tipos de anticuerpos se pueden biotinilados utilizando el protocolo anterior. Una vez biotina, pueden entonces ser titulados (Figura 1) para encontrar la concentración ideal para tirar hacia abajo. La concentración de células puede ser titulada (Figura 2) para encontrar la concentración ideal de las células a capturar. El uso de este, la viabilidad de la captura de un determinado tipo de célula con la tapatura de superficie puede ser comprobada. Por ejemplo, si un tipo de célula de interés está en la escala de 100 células por millón de células, la captura de las concentraciones de células en ese rango de uso de la superficie funcionalizada sería ideal. Si durante la valoración, la superficie no puede capturar células de ese pequeño una concentración, a continuación, la optimización de la superficie o el anticuerpo es necesario con el fin de ser capaz de filtrar las células dentro de ese intervalo de concentración.
¿Qué tipos de células se utilizan en este protocolo? ¿Cómo es posible que alguien modificar este protocolo para utilizar un tipo de célula diferente?
En la actualidad, este protocolo utiliza células MCF7-GFP, y los macrófagos RAW 264.7 a menudo se incluye para demostrar su capacidad para sacar un tipo de célula en una mezcla de celda dual. Se seleccionaron estas células como lo fueron dos de los tipos de células más relevantes a modelo de xenoinjerto de ratón (tumor humano en el entorno murino). Con el fin de calibrar el procedimiento para una variedad de otras células, sp anticuerpoecificity es de suma importancia. Hay varios recursos en línea disponibles para la selección de anticuerpos 22.
¿Cuáles son algunas de las ventajas de este método?
Enfoque suave: La falta de fuerza hace que este enfoque suave. De hecho, nuestra fuerza de corte calculada es como máximo, de 24 x 10 -6 PN 17, que no debe causar perturbaciones significativas a los biomarcadores, ya que las tensiones hidrodinámicas de 2,09 Pa (656 pN asumiendo área de 314 pM 2 de superficie celular) inducir la necrosis mientras que los valores de tensión por debajo 0,59 Pa (185 pN asumiendo superficie celular 314 pM 2) no 23. Este enfoque suave es, pues, ventajoso sobre algunas opciones disponibles comercialmente, tales como basadas en la centrifugación se aproxima a 24, que ejercen hasta 0,78 Pa 25 de tensión de corte pico debido a la aceleración súbita a valores de alrededor de 600 G, que puede cambiar de proteínas patrones de expresión y morfologías 25 , 26 e incluso inducir la necrosis celular 23. Así, un proceso que podría reducir la cantidad de usos de centrífuga reduciría la cantidad de tensiones que las células experimentarían través de la purificación y en última instancia, asegurar que los datos más fisiológicas. Nuestro protocolo actual utiliza centrifugadoras para purificar y reconstituir la concentración celular antes de la captura, sin embargo, este proceso de preparación es estándar en muchas técnicas de purificación tales como el aislamiento de perlas magnéticas 27,28, citometría de flujo 29, y FACS 30 (Figura 5). Nuestro enfoque reduce todos los procesos de centrifugación aguas abajo que las otras técnicas utilizan, además de la etapa de preparación.
Enfoque de biotina-avidina: La aplicación de biomateriales de uso común (DSB-SAV y biotina-SAV) también hace que este enfoque ventajosa 31,32. proteínas de la familia de avidina se unen muy selectivamente a las proteínas de la familia biotina y se utilizan para una gama de scientIFIC y aplicaciones médicas, incluyendo: unión de anticuerpos fluoróforo 33, cuantitativa Qdot-poliestireno de reborde de unión 34, y la creación de hidrogeles que responden a los estímulos en el ambiente para liberar fármacos encapsulados 32. Además, la relativa facilidad de la adquisición de anticuerpos biotinilados hace que este enfoque ampliamente accesible y personalizable.
Enfoque destiobiotina sin granos: La superficie de captura es capaz de implementar el uso de destiobiotina sin el uso de reactivos y las fuerzas duras para liberar las células. OSD se ha utilizado para la fijación celular reversible y la liberación por otros sistemas en conjunción con OSD-anticuerpos y perlas magnéticas 35. Sin embargo, los duros efectos de la técnica de separación, así como la gran pérdida celulares asociados con la preparación de las muestras 27,28 resultado en el receptor diferencial y la expresión de quimioquinas 28,36. Este enfoque tiene como objetivo mitigary superar estas limitaciones mediante la eliminación del uso tanto de imán y perlas para crear una metodología de lavado y de liberación mucho más suave.
¿Cuáles son los pasos críticos en este protocolo? ¿Qué puede causar variabilidad? ¿Cómo se puede controlar que la variabilidad?
Este proceso tiene cuatro pasos críticos que pueden resultar en la disminución de la eficiencia de la superficie de captura. El primer paso crítico es la prevención de agua a la superficie APTES durante las etapas de funcionalización APTES, que daría lugar a la destrucción de la superficie de auto-ensamblado. Esto se remedia mediante el uso de etanol como disolvente y la cocción de los APTES en el horno para reducir la hidrólisis a partir de soluciones acuosas posteriores. El segundo paso crítico es las etapas de reacción en la que la EDC EDC cataliza la reacción de la OSD con las APTES: que permiten la reticulación de las dos capas. Si la EDC se excluye o no añade suficiente, el OSD no será capaz de unir el piso, whic h pondrá en peligro el mecanismo de liberación. El tercer paso es crítico durante la funcionalización SAv, como el mantenimiento de la capa de SAv es crítica. La falta de uniformidad de los resultados de la capa de estreptavidina en la reducción de la eficiencia de la captura. El cuarto paso crítico está en la biotinilación del anticuerpo, ya que la unión del anticuerpo a la superficie de captura se facilita a través de la interacción biotina-estreptavidina de la superficie de captura y el anticuerpo. Si el anticuerpo es no biotinilado, a continuación, la capa de estreptavidina no será capaz de capturar y tire de ella hacia abajo, haciendo que la superficie de captura inútil. Variabilidad y la inconsistencia en la captura de superficie se pueden atribuir a la concentración no regularidad, así como la estocasticidad de unión de capa. Esta variación puede ser controlada mediante el uso de concentraciones precisas de componentes de la capa calibrados a la superficie y los objetivos previstos de captura. En este diseño, las concentraciones están calibrados específicamente a la captura de células MCF7-GFP.
e_content "> ¿Cuáles son algunas desventajas de este método?Actualmente, la funcionalización APTES se realiza mediante el uso de una inmersión en fase líquida de la superficie durante 55 minutos seguido de una etapa de cocción para un máximo de 2 horas. Aunque esto permite para una capa completa de APTES silano a unirse a la superficie, un proceso más uniforme sería la silanización en fase de vapor 37. Esto disminuye el tiempo de contacto APTES, ahorrando así el tiempo de investigador, así como el aumento de la uniformidad. Además, la mejora desplegable se ha observado 17 cuando se utiliza incubación durante la noche de SAv, y en la actualidad, la funcionalización de la superficie requiere dos incubaciones, durante la noche, haciendo que el proceso general de toma tres días. Por lo tanto, la optimización de la química ofrecería importantes ahorros de tiempo para el investigador.
¿Cuáles son algunas advertencias o precauciones que pueden ser útiles?
Cuando la funcionalización de superficies, es imperative que se cuida bien al riesgo de daño respiratorio. Ambos APTES y mercaptoetanol pueden ser extremadamente peligroso para los pulmones y los órganos asociados, por lo que es necesario para hacer el proceso de funcionalización en una campana química para reducir la interacción con los vapores químicos. Mercaptoetanol es un tiol que es especialmente penetrante en el olor. Al usar mercaptoetanol, permitir residuos contaminados para sentarse en el capó de un día o dos antes de su eliminación.
¿Cuáles son los futuros objetivos y aplicaciones de esta superficie?
Nuestros futuros objetivos implican la personalización de esta superficie a trabajar con una variedad de tipos de células relevantes para las enfermedades relacionadas angiogénicos. En particular, tenemos la intención de centrarse en las células endoteliales de vena umbilical humana con el fin de ramificarse a partir de muestras de sangre y separación de células de interés a partir de ahí. Además, tenemos la intención de integrar las modalidades de separación tales como aptámeros en el diseño de la superfi funcionalizadoe para aumentar aún más nuestros porcentajes de captura y liberación.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We would like to thank the American Cancer Society, Illinois Division (282802) and the National Science Foundation CBET (1512598) for funding support. We also would like to thank Dr. Dianwen Zhang from the University of Illinois Beckman Institute for microscopy training. Finally, we would like to thank Jared Weddell, Stacie Chen, and Spencer Mamer for insightful discussions.
Materiales
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl) triethoxysilane (APTES) | Acros Organics | 919-30-2 | Used to make 2% APTES solution |
| Plasma Cleaner Pico | Diener | Model 1 | Cleans surfaces and allows for bonding of PDMS to glass |
| d-Desthiobiotin (DSB) | Sigma | D20655 | Used as the releasing mechanism in the cellular capture surface. |
| dimethyl sulfoxide (DMSO) | British Drug Houses (BDH) | BDH1115-1LP | Dissolves the DSB into solution |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC) | Thermo-Scientific | 5g: 22980 25g: 22981 | Activates carboxylic acids and allows binding of proteins to glass surface. |
| uncoated 8-well culture slide | BD Falcon | Case of 24: 354118 Case of 96: 354108 | Used in cellular experiments involving Zeiss fluorescence microscope such as initial capture and release quantification experiments |
| Glass bottom 24-well plates | MatTek | P24G-0-13-F | Used in cellular experiments involving the plate reader such as antibody and cellular titration experiments |
| Mercaptoethanol | Science Lab | 60-24-2 | Used to quench reaction between EDC and DSB |
| 4-Morpholinoethanesulfonic acid hydrate (MES Hydrate 99%) | Fisher Scientific | AC172590250 | Used to make 0.1 M MES Buffer for use in EDC reaction |
| Precision Oven | Thermo Scientific | 11-475-153 | Used in curing of PDMS and APTES layer. |
| Titramax 1000 Shaker | Heidolph | 13-889-420 | Used to ensure even distribution of APTES on surfaces. |
| 1x Streptavidin 5 mg [e7105-5mg] | Proteo Chem | 9013-20-1 | Biotin-binding protein. May cause irritation. |
| 5 cm Glass Dish | Fisher Scientific | 08748A | Used in HUVEC studies as well as future profiling studies. |
| 14 cm Petri Dish with Cover | Sigma-Aldrich | Z717231 | Used to hold samples being functionalized and transport them. |
| MCF7-GFP cells | Cell Biolabs | AKR211 | Stored in liquid nitrogen |
| RAW264.7 mouse macrophages | ATCC | TIB-71 | Gifted to us from Smith lab at the University of Illinois. Stored in liquid nitrogen. |
| TrypLE | Life Technologies | 12605036 | Stored in 100 ml at room temperature |
| Dulbecco’s modified Eagle medium | Cell Media Facility at School of Chemical Sciences at UIUC | 50003PC | Supplier: Corning |
| Nonessential amino acids | Cell Media Facility at School of Chemical Sciences at UIUC | 25-025-CI | Already added into DMEM by facility. Supplier: Corning. |
| Cell scraper | Fisher Scientific | 12-565-58 | Small 23 cm 50 pack |
| Cell Dissociation Solution | Corning | MT-25-056CI | Used to lift cells non-enzymatically for the use in cell experiments |
| Hemacytometer | Hausser | 02-671-54 | Used to count cells for quantification of cell solutions and capture and release effectivity. |
| Biotin | Amresco | 58-85-5 | Used to release cells from surface. |
| HBSS | Created from Recipe | N/A | Used to keep cells alive in suspension as well as wash surfaces of non-specific binding. Adapted from Cold Spring Harbor Protocols: In 500 ml, use 4 g NaCl, 0.2 g KCl, 0.0402 g Na2PO4•7H2O, 0.03 g KH2PO4 and 0.5 g glucose. Add DI water to get to 500 ml, filter, and then refrigerate. |
| HLA-ABC Antibody | BioLegend | 311402 | Antibody used to capture MCF7gfp cells |
| hIgG Antibody | BioLegend | HP6017 | Antibody used to capture MCF7gfp cells |
| MCF7 GFP cells | Cell Biolabs | AKR-211 | Luminal Breast Cancer line that has been transfected with green fluorescent protein. |
| Assorted Conicals | Thermo-Scientific | 15mL: 12-565-268 | 50/15 ml plastic conicals for storing solutions and aliquots. |
| Mini-Tube Rotators (End over End Mixer) | Fisher Scientific | 05-450-127 | Used to incubate antibody and mix other cellular solutions in order to mix |
| Axiovert 200M (Fluorescence Microscope) | Zeiss | N/A | Zeiss Axiovert 200 M inverted florescence microscope. |
| Zeba Desalting columns | Thermo-Scientific | PI-87770 | Used to purify newly biotinylated antibodies after the use of the Biotinylation Kit. Instructions provided at: http://www.funakoshi.co.jp/data/datasheet/PCC/89894.pdf |
| EZ Link Sulfo NHS Low Weight Biotinylation Kit | Thermo- Scientific | Used to biotinylate antibodies to allow them to integrate with the capture surface | |
| Plate Reader | BioTek | Synergy HTX Multimode Reader | Used to quantitatively measure fluorescent intensity in the titration experiments. |
Referencias
- Erdbruegger, U., Haubitz, M., Woywodt, A. Circulating endothelial cells: a novel marker of endothelial damage. Clin. Chim. Acta. 373 (1-2), 17-26 (2006).
- De Spiegelaere, W., Cornillie, P., Van Poucke, M., Peelman, L., Burvenich, C., Van den Broeck, W. Quantitative mRNA expression analysis in kidney glomeruli using microdissection techniques. Histol. Histopathol. 26 (2), 267-275 (2011).
- Chen, S., Guo, X., Imarenezor, O., Imoukhuede, P. I. Quantification of VEGFRs, NRP1, and PDGFRs on Endothelial Cells and Fibroblasts Reveals Serum, Intra-Family Ligand, and Cross-Family Ligand Regulation. Cell. Mol. Bioeng. 8 (3), 383-403 (2015).
- Cheung, L. S. L., et al. Detachment of captured cancer cells under flow acceleration in a bio-functionalized microchannel. Lab Chip. 9 (12), 1721-1731 (2009).
- Privorotskaya, N., et al. Rapid thermal lysis of cells using silicon-diamond microcantilever heaters. Lab Chip. 10 (9), 1135-1141 (2010).
- Park, K., Akin, D., Bashir, R. Electrical capture and lysis of vaccinia virus particles using silicon nano-scale probe array. Biomed. Microdevices. 9 (6), 877-883 (2007).
- Galletti, G., Sung, M., Vahdat, L. Isolation of breast cancer and gastric cancer circulating tumor cells by use of an anti HER2-based microfluidic device. Lab Chip. 14 (1), 147-156 (2014).
- Schudel, B. R., Choi, C. J., Cunningham, B. T., Kenis, P. J. A. Microfluidic chip for combinatorial mixing and screening of assays. Lab Chip. 9 (12), 1676-1680 (2009).
- Lien, K. Y., Chuang, Y. H., et al. Rapid isolation and detection of cancer cells by utilizing integrated microfluidic systems. Lab Chip. 10 (21), 2875-2886 (2010).
- Stott, S. L., et al. Isolation of circulating tumor cells using a. PNAS. 107 (35), 18392-18397 (2010).
- Yu, M., Ting, D., Stott, S., Wittner, B., Ozsolak, F. RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis. Nature. 487 (7408), 510-513 (2012).
- Sheng, W., Ogunwobi, O., Chen, T., Zhang, J. >Capture, release and culture of circulating tumor cells from pancreatic cancer patients using an enhanced mixing chip. Lab Chip. 14 (1), 89-98 (2014).
- Zheng, X., Cheung, L. S. L., Schroeder, J. A., Jiang, L., Zohar, Y. A high-performance microsystem for isolating circulating tumor cells. Lab Chip. 11 (19), 3269-3276 (2011).
- Imoukhuede, P. I., Popel, A. S. Quantification and cell-to-cell variation of vascular endothelial growth factor receptors. Exp. Cell Res. 317 (7), 955-965 (2011).
- Imoukhuede, P. I., Popel, A. S. Expression of VEGF receptors on endothelial cells in mouse skeletal muscle. PLoS One. 7 (9), e44791 (2012).
- Ludwig, A., Kretzmer, G., Schügerl, K. Determination of a "critical shear stress level" applied to adherent mammalian cells. Enzyme Microb. Technol. 14 (3), 209-213 (1992).
- Ansari, A., Lee-Montiel, F. T., Amos, J., Imoukhuede, P. I. Secondary anchor targeted cell release. Biotechnol. Bioeng. 112 (11), 2214-2227 (2015).
- Drenan, R. M., Nashmi, R., Imoukhuede, P., Just, H., McKinney, S., Lester, H. A. Subcellular trafficking, pentameric assembly, and subunit stoichiometry of neuronal nicotinic acetylcholine receptors containing fluorescently labeled alpha6 and beta3 subunits. Mol. Pharmacol. 73 (1), 27-41 (2008).
- Imoukhuede, P. I., Dokun, A. O., Annex, B. H., Popel, A. S. Endothelial cell-by-cell profiling reveals temporal dynamics of VEGFR1 and VEGFR2 membrane-localization following murine hindlimb ischemia. Am J Physiol Hear. Circ Physiol. 4 (8), H1085-H1093 (2013).
- van Beijnum, J. R., Rousch, M., Castermans, K., van der Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3 (6), 1085-1091 (2008).
- Imoukhuede, P. I., Popel, A. S. Quantitative fluorescent profiling of VEGFRs reveals tumor cell and endothelial cell heterogeneity in breast cancer xenografts. Cancer Med. 3 (2), 225-244 (2014).
- BD Biosciences. . CD Marker Handbook: Human and Mouse. , (2010).
- Tanzeglock, T., Soos, M., Stephanopoulos, G., Morbidelli, M. Induction of mammalian cell death by simple shear and extensional flows. Biotechnol. Bioeng. 104 (2), 360-370 (2009).
- Perritt, D., Wong, P., Macpherson, J. L., Henrichsen, K., Symonds, G., Pond, S. . Processing Blood. , (2014).
- Fukuda, S., Schmid-Schönbein, G. W. Centrifugation attenuates the fluid shear response of circulating leukocytes. J. Leukoc. Biol. 72 (July), 133-139 (2002).
- dela Paz, N. G., Walshe, T. E., Leach, L. L., Saint-Geniez, M., D'Amore, P. A. Role of shear-stress-induced VEGF expression in endothelial cell survival. J. Cell Sci. 125 (Pt 4), 831-843 (2012).
- Allard, W. J., et al. Tumor Cells Circulate in the Peripheral Blood of All Major Carcinomas but not in Healthy Subjects or Patients With Nonmalignant Diseases Tumor Cells Circulate in the Peripheral Blood of All Major Carcinomas but not in Healthy Subjects or Patients With Nonmalignant diseases.". Clinical Cancer Research. 10, 6897-6904 (2005).
- Nagrath, S., et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature. 450 (7173), 1235-1239 (2007).
- Chen, S., Weddel, J., Gupta, P., Conard, G., Parkin, J., Imoukhuede, P. I. QFlow Cytometer-Based Receptoromic Screening: A High-throughput Quantification Approach Informing Biomarker Selection and Nanosensor. Submiss. , (2016).
- Vasa, M., et al. Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease. Circ. Res. 89 (1), E1-E7 (2001).
- Hirsch, J. D., Eslamizar, L., et al. Easily reversible desthiobiotin binding to streptavidin, avidin, and other biotin-binding proteins: uses for protein labeling, detection, and isolation. Anal. Biochem. 308 (2), 343-357 (2002).
- Wilchek, M., Bayer, E. A. Applications of Avidin-Biotin Technology: Literature Survey. Methods Enzymol. 152 (1), 183-189 (1987).
- Wu, X., et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots. Nat. Biotechnol. 21 (1), 41-46 (2002).
- Lee-Montiel, F. T., Imoukhuede, P. I. Engineering quantum dot calibration standards for quantitative fluorescent profiling. J. Mater. Chem. B. 1, 6434 (2013).
- Hornes, E., Korsnes, L. . Oligonucleotide-linked magnetic particles and uses thereof. , (1996).
- Naranbhai, V., et al. Impact of blood processing variations on natural killer cell frequency, activation, chemokine receptor expression and function. J. Immunol. Methods. 366 (1-2), 28-35 (2011).
- Yadav, A. R., Sriram, R., Carter, J. A., Miller, B. L. Comparative study of solution-phase and vapor-phase deposition of aminosilanes on silicon dioxide surfaces. Mater. Sci. Eng. C. 35 (1), 283-290 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados