Method Article
Ein Verfahren zur gezielten Zellisolierung über Glas Oberflächenfunktionalisierung
In diesem Artikel
Zusammenfassung
This protocol describes customizable surface functionalization of the desthiobiotin, streptavidin, and APTES system in order to isolate specific cell types of interest. In addition, this manuscript covers the applications, optimization, and verification of this process.
Zusammenfassung
One of the limiting factors to the adoption and advancement of personalized medicine is the inability to develop diagnostic tools to probe individual nuances in expression from patient to patient. Current methodologies that try to separate cells to fill this niche result in disruption of physiological expression, making the separation technique useless as a diagnostic tool. In this protocol, we describe the functionalization and optimization of a surface for the cellular capture and release. This functionalized surface integrates biotinylated antibodies with a glass surface functionalized with an aminosilane (APTES), desthiobiotin and streptavidin. Cell release is facilitated through the introduction of biotin, allowing the recollection and purification of cells captured by the surface. This release is done through the targeting of the secondary moiety desthiobiotin, which results in a much more gentle release paradigm. This reduction in harsh reagents and shear forces reduces changes in cellular expression. The functionalized surface captures up to 80% of cells in a single cell mixture and has demonstrated 50% capture in a dual-cell mixture. Applications of this technology to xenografts and cancer separation studies are investigated. Quantification techniques for surface verification such as plate reader and ImageJ analyses are described as well.
Einleitung
Strom bench-top Zelltrennungsansätze (zB Fluoreszenz - aktivierte Zellsortierung 1, Laser Capture Mikrodissektion 2, immuno-magnetische bead Trennung 1) kann mehrere Stunden dauern Vorbereitung und Sortierung. Diese großen Zeitskalen können physiologische Reaktion und Expressionsspiegel beeinflussen, in Analysen führt , die nicht repräsentativ für die physiologische Reaktion 3 sind. Die Systeme werden benötigt, die schnell und effizient spezifische Zelltypen Zelloberflächenrezeptor-Ebenen, um Zellisolierung und Bereicherung für biomedizinische Anwendungen ohne Unterbrechung zu verbessern isolieren kann. Daher ist der Grund für unser Ansatz einen sanften Ansatz zur Zellisolierung zu entwickeln.
Das "Lab on a Chip" -Konzept bietet das Versprechen um Größenordnungen schneller (Stunden zu Minuten) Zellisolierung und am häufigsten werden Zellen auf einer Oberfläche und die Freigabe Zellen oder intrazelluläre conte Erfassungnts durch physikalische 4,5 oder chemische Verfahren 6. Obwohl diese Ansätze einige Vorteile, wie die Identifizierung Protein 7,8 Expression bieten, Identifizieren RNA - Expression 9-11, oder sogar Zellen für die in vitro Kultur 12,13, sind viele dieser Techniken Bereitstellung kann aufgrund Diagnostik wie Zellrezeptor Profilierungs übersetzt zu ihren nicht-physiologischen Umgebungen. Die enzymatische Hebemittel wie Kollagenasen können auch diese Rezeptor Mengen 14,15, was bedeutet , Zell - Rezeptor Quantifizierung Techniken beeinflussen , dass diese Hebemittel verwenden, nicht genaue physiologische Daten erzeugen. Zelluläre Lyse verhindert Differenzierung zwischen den nativen Oberflächenrezeptoren, und solche , die 16 zuvor verinnerlicht wurden. Dieses Protokoll beschreibt einen schnellen und schonenden Ansatz zur Zellisolierung.
Protokoll
1. Reinigung der Glasoberfläche und Vorbereitung Reagenzien
- Legen Sie eine Glasoberfläche in einem Sauerstoffplasma Maschine für 5 Minuten bei 50% Leistung zu reinigen.
- Bereiten 2,5 ml 2% rekonstituiert (3-Aminopropyl) triethoxysilan (APTES) Lösung, durch Zugabe von 50 & mgr; l APTES und 2,45 ml Ethanol in einem konischen Röhrchen.
2. APTES und DSB Funktionalisierung
- Hinzufügen APTES Lösung auf die Oberflächen. Je 150 & mgr; l pro Vertiefung für 8-Well-Platten. Je 100 & mgr; l pro Vertiefung für 24-Well-Platten. Pipette 1,1 ml für 60 x 15 mm Glasschalen. Decken Sie die Oberflächen Verdunstung und ungleichmäßige Verteilung der APTES Lösung zu verhindern. Platzieren Sie die Oberflächen auf einem Plattformschüttler 50 Minuten lang bei Raumtemperatur, die eine gleichmäßige Verteilung der APTES Schicht erzeugt.
HINWEIS: APTES ein Aminosilan, das die erste Schicht der Oberfläche bildet. Wenn eine andere Oberfläche unter Verwendung heuristisch das Volumen der Lösung bestimmen, erforderlich, um die Oberfläche zu bedecken. - Wählen Sie die Temperatur für den Ofen, während die Oberflächen auf dem Schüttler sind: Erwärme auf 55 ° C für 2 Stunden für die 8-Well-Platten und Platten mit 24 Vertiefungen. Wärme Glas nur Geschirr bis 90 ° C für 1 Stunde.
- Spülen Sie die Oberflächen mit Ethanol.
- Verwalten die Menge an Ethanol erforderlich Referenzierung basierend auf der Oberfläche verwendet. In 150 ul Ethanol in jede Vertiefung für 8-Well-Platten. In 125 ul Ethanol zu jeder Vertiefung für 24-Well-Platten. In 1,1 ml Ethanol für Glasschalen.
- Spülen der Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten der Pipette bei ungefähr 70 ° Winkel, so wird die Spitze nicht direkt in die Oberfläche gerichtet. Spülen Sie zweimal unter Verwendung von Ethanol.
HINWEIS: Wenn eine der Glasboden-Well-Platten in ihnen jede Kunststoff haben, sie nicht über 65 ° C erhitzen, da der Kunststoff zu schmelzen und verformen beginnt.
- Trocknen Sie mit 100% Stickstoffgas aus einem Tank abgegeben. Legen Sie die Oberflächen in der oven.
- Bereiten 2,5 ml D-Desthiobiotin (DSB) Lösung durch Vereinigen von 1,5 mg / ml DSB in 37,5 & mgr; l Dimethylsulfoxid (DMSO) und 5 mg / ml 1-Ethyl-3- (3-dimethylaminopropyl) carbodiimid (EDC) in 2462,5 & mgr; l der 0,1 M 4-Morpholinethansulfonsäure-Hydrat (MES) (pH 6) Puffer. Kombinieren Sie dann beide Lösungen.
- 1 ul 2-Mercaptoethanol β, nach 15 min in die Lösung, um die Reaktion zwischen DSB und EDC zu quenchen. Entfernen Sie heißen APTES funktionalisierte Glasoberflächen aus dem Ofen. Warten Sie 5-10 min für die Glasflächen zu kühlen.
- In MES die Oberfläche Puffer zu spülen, mit Mengen auf der Oberfläche basiert. In 150 ul MES in jede Vertiefung für 8-Well-Platten puffern. In 125 ul MES in jede Vertiefung für 24-Well-Platten puffern. In 1,1 ml MES-Puffer für Glasschalen.
- Spülen Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten Sie die Pipette auf etwa ein Winkel von 70 °, so wird die Spitze nicht direkt daraufin die Oberfläche. Spülen Sie zweimal mit MES-Puffer.
- Tragen Sie die DSB-Lösung auf die Oberflächen zu ermöglichen, sie zu brüten. In 150 ul DSB-Lösung pro Vertiefung für 8-Well-Platten. 100 l DSB-Lösung pro Well für 24-Well-Platten. In 1,1 ml für Glasschalen DSB Lösung.
- Legen Sie die DSB bedeckt Glasflächen auf einem feuchten Papiertuch in einer Petrischale. Zudecken und in einem 4 ° C Kühlschrank für 18-24 Stunden inkubiert.
3. Streptavidin-Funktionalisierung
- Spülen jeder Glasoberfläche dreimal mit 1 ml 1,0x Phosphate Buffered Saline (PBS). Spülen Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten der Pipette bei ungefähr 70 ° Winkel, so wird die Spitze nicht direkt in die Oberfläche gerichtet. Man verdünnt das Streptavidin (Streptavidin) Stammlösung auf 0,4 mg / ml (empfohlen).
HINWEIS: PBS isotonisch ist, so dass es als ein Medium zur Verdünnung und Spülen verwendet werden kann. PBS wird als Lösungsmittel für die SA verwendetv, und daher wird keine Auswirkung auf die Fähigkeit des SAv an die Oberfläche zu binden. - Gelten 0,4 mg / ml Streptavidin-Lösung gleichmäßig auf den Oberflächen, so dass eine dünne Schicht bildet sich an der Unterseite des Glases, die Menge der Lösung wählen basierend auf Oberfläche. Für 8-Well-Platten mit 150 & mgr; l 0,4 mg / ml Streptavidin-Lösung pro Vertiefung. Für 24-Well-Platten mit 100 & mgr; l 0,4 mg / ml Streptavidin-Lösung pro Vertiefung. Für Glasschalen, fügen Sie 1,1 ml 0,4 mg / ml Streptavidin-Lösung.
- Decken und die Platten zu einer 14 cm Petrischale bewegen, Feuchtigkeit zu speichern. Inkubieren Sie die Petrischale im Kühlschrank für 18-24 Std.
HINWEIS: Es ist wichtig, konsistente Mengen von APTES, DSB und SAv auf jeder Oberfläche zu verwenden. - Spülen jeder Glasoberfläche dreimal mit 150 ul PBS SAv zu entfernen. Spülen Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten der Pipette bei ungefähr 70 ° Winkel, so wird die Spitze nicht direkt in die Oberfläche gerichtet.
- Befeuchten Sie ein Papiertuch with de-ionisiertes Wasser und legen Sie das Papiertuch in 14 cm Petrischale flach, die Platten umgebenden Feuchtigkeit in den Vertiefungen zu halten. Decken Sie die Petrischale mit den Brunnen. Inkubieren Sie die Petrischale in einem 4 ° C Biosafety Level 1 (BSL-1) Kühlschrank, bis sie benötigt.
4. Zelleinfang und Freigabe
- Beginnen mit T175-Kolben (n) von Zellen für das Experiment bestimmt. Absaugen Medien von Kolben (s). Waschen Sie die restlichen Medien mit 5 ml Raumtemperatur PBS. Aspirat PBS aus dem Kolben (s).
- 10 ml nichtenzymatische Hebemittel, wie Zelldissoziationslösung, auf die T-175-Kolben von Zellen. Setzen Sie den Kolben in den Inkubator für 6 min zum Anheben der Zellen aus dem Kolben zu ermöglichen.
- Nach 6 min, 10 ml kalter Hanks Balanced Salt Solution (HBSS; Siehe Liste der Materialien), um das Hebemittel zu inaktivieren. Nehmen Sie 20 ul Zellen Anzahl von Zellen in Lösung zu zählen ein Hemacytometer verwenden.
HINWEIS: Je nach functionalisierten Oberflächen im capture Experiment verwendet, variiert die Anzahl der Zellen benötigt. Für funktionalisierte 8-Well-Platten, verwenden 300.000 Zellen pro Vertiefung. Für funktionalisierte Glasschalen, verwenden Sie 1,1 Millionen Zellen. Für funktionalisierte 24-Well-Platten, werden 125.000 Zellen empfohlen. Mehr Informationen über Zellzählung wird im Supplement gefunden. - Wiederholen Sie die Schritte 4.1- 4.3 für einen anderen Kolben von Zellen, wenn weniger Zellen vorhanden sind, als für das Experiment benötigt. Kombinieren Zellsuspensionen und Nachzählung Zellen zur Gesamtzahl der Zellen in Lösung erhalten.
- Spin-Down-Zellsuspension in einer Zentrifuge bei 500 × g für 5 min bei 4 ° C, um ein Pellet von konzentrierten Zellen zu erhalten. Finden Sie die entsprechende Menge an HBSS zur Zellsuspension hinzufügen , um eine Konzentration von 1 x 10 6 Zellen pro ml zu erhalten, aspirieren dann den Überstand von den Zellen abzentrifugiert, und fügen Sie das berechnete Volumen. Dieses Volumen kann unter Verwendung der Gleichungen im Supplement berechnet werden.
- Pipette nach oben und unten (triturate) zu suspendieren the Zellen in Lösung und zelluläre Verklumpung in Lösung reduzieren, die Antikörperbindung reduzieren kann. Teilen Sie die zelluläre Lösung in getrennte Kontroll- und experimentellen Lösungen. Sehen Sie einen Brief Datei für Komponenten und Berechnungen.
- Fügen Sie die biotinylierte Antikörper an die jeweiligen Zelllösungen, wie in der Supplemental Datei beschrieben. Inkubieren für 30 min bei 4 ° C auf einem End-Over-End-Mixer.
HINWEIS: Bei MCF7GFP Zellen wurden 0,5 mg / ml hIgG oder 0,5 mg / ml HLA-ABC-Antikörper werden empfohlen. Bei RAW-Makrophagen, 1 mg / ml mCD11b werden auf die Hälfte des Volumens für die Bilanzierung der Verdünnung Unterschiede empfohlen. Für menschlichen Nabelschnurvenen-Endothelzellen (HUVECs), 0,5 mg / ml hCD31 wird empfohlen. - Waschen Sie die funktionalisierte Glasoberfläche mit HBSS. Für dieses Experiment ist ein 8-Well-Platte beraten.
- In 150 ul HBSS in jede Vertiefung für 8-Well-Platten. Spülen Sie zweimal HBSS verwenden. Spülen Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen.Halten der Pipette bei ungefähr 70 ° Winkel, so wird die Spitze nicht direkt in die Oberfläche gerichtet. Halten Sie kalt bei 4 ° C.
- In Zelllösungen in die Vertiefungen und 45 Minuten warten, bis die Zellen auf Eis auf dem Schüttler inkubiert. Sprechen Sie die Lösung von Biotin in steriler HBSS von berechneten Volumina unter Verwendung der in der Ergänzung beschrieben.
- Entfernen Sie die Zell-Lösung aus den Glasbrunnen durch HBSS mit.
- Gently Pipette in jede Vertiefung 150 ul HBSS. Dann die HBSS Pipette aus. Spülen Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten der Pipette bei ungefähr 70 ° Winkel, so wird die Spitze nicht direkt in die Oberfläche gerichtet.
- Wiederholen Sie zwei weitere Male. Nach dem Waschen hinzufügen HBSS in die Vertiefungen, die Zellen feucht zu halten.
- In 150 ul 20 mM Biotin-Lösung auf die jeweilige Veröffentlichung gut, und warten Sie 20 Minuten für die Reaktion zu ermöglichen.
- Erinnere nicht spezifisch gebundene Zelles durch Waschen mit HBSS, wie oben angegeben, und dann fluoreszierend markierten Zellen bei Verwendung, gehen Bild zur Fluoreszenz der Zellen. Auch Bild lebenden Zellen in einem Kolben (als Kontrolle, wobei die Zellen in der Vertiefung zu vergleichen). Wenn das grün fluoreszierende Protein (GFP) transfizierte Zellen verwenden, wird die Anregung 470 nm, und die Emission wird 515 nm sein.
5. Antikörperoptimierung: Antikörper-Titration
- Beginnen Sie, indem die Zellen aus dem T75 oder T175-Kolben heben, wie in Schritt 4.1- 4.3 erläutert.
HINWEIS: Diese Volumina sind für 24-Well-Platten kalibriert, kann aber keine Glas funktionalisierten Oberflächen durch heuristische Tests zu entsprechen geändert werden. Eine repräsentative Antikörpertitration ist in Abbildung 1 dargestellt. - Zählen von Zellen unter Verwendung des Hämazytometers und dann drehen, um die Zell-Lösung in einem konischen Röhrchen bei 500 xg für 5 min bei 4 ° C. Rekonstitution Zellen zu 1 Million Zellen pro ml, unter Verwendung der in der Ergänzung beschriebenen Berechnungen.
- Teilen Sie die 1 million Zellen pro ml Lösung in sechs verschiedenen Lösungen von 500 & mgr; l in verschiedene Zentrifugenröhrchen für den Antikörper (Ab) Lösungen.
- Verdünne die Antikörper-Stammlösung zu 10 & mgr; g / ml, 1 ug / ml, 100 ng / ml, 10 ng / ml, 1 ng / ml. Erzeugen die Steuerungen unter Verwendung von 100 & mgr; l Stain-Puffer (PBS + 1% Natriumazid + 1% BSA) und 500 & mgr; l Zellen für die Kontrolle ohne Ab darin. Für die Blindkontrolle (No Ab und keine Zellen), eine Lösung von 300 & mgr; l PBS verwenden.
HINWEIS: ACHTUNG: Natriumazid ist extrem giftig, explosiv, und extreme Vorsicht ist geboten, wenn es zu benutzen. Bitte beachten Sie die Sicherheitsdatenblatt (SDB) und die entsprechende Sicherheitsausrüstung verwenden.
- Verdünne die Antikörper-Stammlösung zu 10 & mgr; g / ml, 1 ug / ml, 100 ng / ml, 10 ng / ml, 1 ng / ml. Erzeugen die Steuerungen unter Verwendung von 100 & mgr; l Stain-Puffer (PBS + 1% Natriumazid + 1% BSA) und 500 & mgr; l Zellen für die Kontrolle ohne Ab darin. Für die Blindkontrolle (No Ab und keine Zellen), eine Lösung von 300 & mgr; l PBS verwenden.
- Kombinieren und inkubieren Sie die Ab-Lösungen mit den Zell Lösungen im End-Over-End-Mixer bei 4 ° C für 30 min. Spülen Sie die funktionalisierten 24-Well-Platten mit HBSS dreimal. Spülen der Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten Sie die piPette ungefähr in einem 70 ° Winkel, so dass die Spitze nicht direkt in die Oberfläche gerichtet wird.
- Aliquot 125 ul jeder Probenlösung in die entsprechenden APTES, DSB und SAv gut funktionalisiert. Inkubieren bei 4 ° C oder auf Eis für 45 min auf der Glasoberfläche. Spülen der Oberfläche mit HBSS dreimal unspezifisch gebundenen Zellen zu entfernen. Spülen Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten der Pipette bei ungefähr 70 ° Winkel, so wird die Spitze nicht direkt in die Oberfläche gerichtet. Sie NICHT die untere Reihe spülen, wie die Kontrollen sind.
- In 150 ul HBSS zu jeder gut gewaschen, legte die 24-Well-Platten auf Eis, und dann einen Plattenleser verwenden Fluoreszenz von GFP Zellen zu messen (Anregung 485 nm / Emission 528 nm).
6. Zell Optimierung: Titrierzelle
- Heben Sie die Zellen wie in den Schritten 4.1 -4.3 erwähnt.
- Zählen von Zellen unter Verwendung eines Hämacytometers. Spin down Zelle sosung in konischen Röhrchen bei 500 xg für 5 min bei 4 ° C. Rekonstituieren Zellen zu 1 Million Zellen pro ml.
HINWEIS: Weitere Informationen über die Verwendung des Hämazytometers kann im Supplement finden. - Pipette 1,6 ml der Zelllösung für die 1,6 Millionen Zellen Lager und in einem konischen Rohr. Pipette 800 ul Zellen aus der Zelllösung für die 800.000 Zellen Lager und in einem konischen Rohr. Pipette 80 ul aus der Zelle Lager für die 80.000 Zellen Lager und in einem konischen Rohr. Pipette 8 ul aus der Zelle Lager für 8000 Zellen Lager und in einem konischen Rohr.
HINWEIS: Die Konzentrationen werden pro 8-Well-Platte Messungen gegeben, replizieren nach Bedarf. Ein Beispiel der Plattenausgabe wird in Abbildung 2 dargestellt. - Nehmen Sie die vier Stammlösungen und Spin in einer Zentrifuge bei 500 xg für 5 min bei 4 ° C. Re-suspend alle Stammlösungen in 400 ul HBSS.
- In 1,6 ul 100 ng / ml Antikörper an die 1,6 Millionen Zelle Lager, 0,8 μl auf die 800.000 Zelle Lager, und 0,5 ul auf alle anderen Aktien. Inkubieren des Antikörpers für 30 min in die End-over-End-Mixer für 30 min bei 4 ° C. Waschen Sie die funktionalisierte Glasoberfläche mit HBSS dreimal.
HINWEIS: Die funktionalisierte 8-Well-Platte ist für die Mikroskopie Quantifizierung empfohlen, während das funktionalisierte 24-Well-Platte für Platte Leser Quantifizierung empfohlen. Antikörperkonzentration für 8000 Zellstoff wurde nicht der begrenzende Faktor der Erfassungsfläche zu ermöglichen, reduziert nicht der Mangel an Antikörper in Lösung zu sein, sondern die Erfassung von Eigenschaften der Oberfläche. - Anwenden 150 ul der Probenlösungen in jede Kammer. Tragen Sie die 1,6 Millionen Zelle Lager auf der ersten Spalte der Brunnen auf der linken Seite. Tragen Sie die 800.000 Zelle Lager auf der zweiten Spalte von links. Tragen Sie die 80000 Zelle Lager auf der dritten Spalte von links. Schließlich gelten die 8000 Zelle Aktie der letzten Spalte. für 45 min inkubieren, auf dem Schüttler bei 4 ° C.
HINWEIS: Die 1,6 MillionenZelle Lager dient als höchste Konzentration getestet werden, und ist die doppelte Menge an Zellen, die normalerweise in der Zelltrennung Experimente verwendet (600.000 Zellen pro Vertiefung) Die 800.000 Zelle Lager dient als Kontrolle für das Experiment, wie es die typische Zellkonzentration ist dass in Zelltrennungsversuche (3.000.000 Zellen pro Vertiefung) verwendet. Die 80.000 Zelle Lager dient als zehnfache Verdünnung für niedrigere Konzentrationen für die zelluläre Erfassung (30.000 Zellen pro Vertiefung) zu testen. Die 8000 Zelle Lager dient als hundert fache Verdünnung als Test verwenden, um die untere Grenze der Zelltrennung (3.000 Zellen pro Vertiefung) zu überprüfen. - Spülen Sie mit HBSS dreimal. Spülen Oberfläche durch Entladen und die Flüssigkeit von einem festen Punkt, wie beispielsweise die Ecke des Bohrloches zu ziehen. Halten der Pipette bei ungefähr 70 ° Winkel, so wird die Spitze nicht direkt in die Oberfläche gerichtet. Sammeln Sie alle Wäschen.
- Bild die Zellen auf einem Fluoreszenzmikroskop, bei Verwendung von 8-Well-Platten, machen Sie Fotos von jedem surGesicht und auf jede Oberfläche bei 4 ° C auf dem Schüttler eine Stunde Biotin 150 & mgr; l an. Biotin Release Brunnen mit HBSS 3 mal Nach einer Stunde gründlich wie zuvor. Sammeln Sie alle Waschungen aus Brunnen zum Zählen mit dem Hämozytometer und Bild die Freigabe Brunnen.
- Bewerben 150 ul 20 mM überschüssige Biotinlösung an Biotin Freisetzung Vertiefungen für 1 Stunde veranschlagen, wenn 24-Well-Platten verwenden, und dann spülen den Vertiefungen 3 mal mit HBSS. Quantifizieren 24-Well-Platten mit einem Plattenleser. Verwenden Sie eine Hemacytometer Zellen aus allen gesammelten gut Waschungen zu zählen.
7. Bildanalyse
Hinweis: Die FIJI-Software-Paket (http://fiji.sc/Fiji) wird für die Bildanalyse empfohlen. Zunächst wurden die Bilder in Graustufenbild umgewandelt, und dann wird die Helligkeit / Kontrast verändert wurde, um die Zellen zu bringen.
- Laden Sie das Bild nach oben, und konvertieren, indem Sie auf das Bild und dann auf das Scrollen nach unten zu "Typ" in Graustufen und dann auf4; 8-Bit ".
- Erhöhen Sie den Kontrast des Bildes durch das Bild Registerkarte klicken und dann scrollen auf "Anpassen". Klicken Sie auf "Helligkeit und Kontrast", und dann die Bildlaufleisten verwenden, um die Zellen abheben. Wenn Fluoreszenzbilder verwenden, invertieren die Bilder um die Zellen zu machen mehr definiert.
- Laden Sie ein Plugin auf ImageJ ITCN genannt (http://rsb.info.nih.gov/ij/plugins/itcn.html), um die Bilder zu analysieren.
- Öffnen Sie ITCN. Wenn ein Dialogfeld angezeigt, das den Benutzer mit verschiedenen Parametern aufgefordert, die Größe der Zelle zu schätzen, die minimalen Breite der Zelle zunächst von Interesse. Klicken Sie auf die "Detect Dunkle Peaks" Option, wenn das Bild fluoresziert und die Zellen werden abgedunkelt.
- Stellen Sie den Grenzwert bei 2 zunächst, und dann drücken Sie die "Count" -Taste. Eine neu gezählt Version des Bildes erscheint mit roten Punkten abgrenzen, wo Zellen gezählt wurden.
- Stellen Sie die Schwelle und Breitenparameter genauer Handy-Daten von defini zu erhaltenng die Größe einer "Zelle". Hinweis: Die Anzahl der gezählten Zellen in einem Dialogfeld auf der rechten Seite sein wird. Ändern von Parametern unterschiedliche Anzahl von Zellen gezählt geben.
- Weiterhin durch die Schwelle und Breitenparameter zu iterieren, bis eine gute Abschätzung für die Anzahl von Zellen erreicht ist.
Ergebnisse
Mit diesem Protokoll wir Zelleinfang zeigen (3A) und Zellfreisetzung (3C) von MCF7GFP Zellen sowie Live - Zellkontrollen (Abbildung 4). Wir quantifizierten die Zelle capture als 60% und 80% freigesetzt wurden (Abbildung 3C). Wenn wir diesen Ansatz zu einer Mischung aus RAW 264.7 Makrophagen und MCF7GFP Zellen verlängert, 50% der RAW - Makrophagen wurden gefangen genommen (Abb. 3D) und 80% der RAW - Makrophagen waren Freisetzung mit 20 mM Biotin (3B). Da überschüssiger Antikörper Zelleinfang verringern kann, wir über Titrieren 0-10,000 nM von HLA - Antikörpers optimiert, und zu beobachten , dass die ideale Antikörperkonzentration zwischen 100-1000 mM Antikörper (Fig. 1). Ebenso wir feststellen , dass die ideale Konzentration der Zellen , die 1 erfasst werden kann x 10 5 und 1 x 10 6, da unterhalb dieser Zahl von Zellen, sind Werte , die niedriger als der Hintergrund 17(Abbildung 2). Die Fluoreszenzdaten aus jeder Vertiefung wird verarbeitet, wie unten beschrieben.
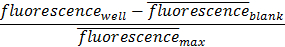
Hier wird der Durchschnitt von 3 Wiederholungen von einer Probe ohne Antikörper (blank) entnommen und von der Fluoreszenz von jeder Probe erhalten subtrahiert. Dieser Wert wird dann normiert auf die mittlere maximale Fluoreszenz. Diese Verarbeitung ermöglicht es dem Forscher klar die untere Grenze der zellulären Erkennung beobachten.

Abbildung 1. Normalized Blanked Antikörper Titration. Menschliches HLA-ABC wird in einer konstanten Menge an MCF7GFP Zellen (125.000 Zellen pro Vertiefung) und die Fluoreszenz von gefangenen Zellen titriert wurden unter Verwendung eines Plattenlesegerät quantifiziert. Vordie Exposition gegenüber der funktionalisierten Oberfläche wurden die Zellen zentrifugiert und Antikörper nicht-spezifische Antikörperbefestigungs zu entfernen. Ohne diese Zentrifugation wird überschüssiger Antikörper Oberfläche sättigen und Zell pulldown verhindern, wie mit Konzentrationen von 10.000 ng / ml gezeigt, wo der Zentrifugation nicht ausreichend war, Antikörper-Übersättigung der Oberfläche zu verhindern, was zu weniger Zellen an die Oberfläche zu binden. Graue Linie stellt die Steuerung. Die Fehlerbalken stellen die Standardfehler des Mittelwerts. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
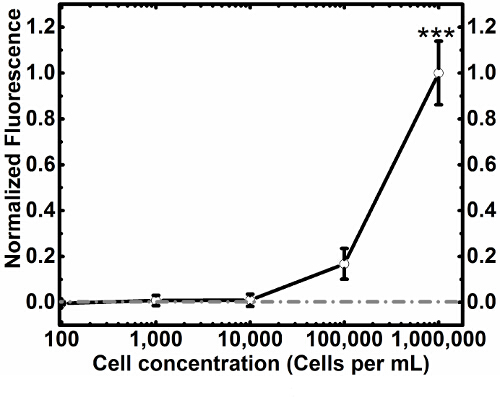
Abbildung 2. Normierte Tastet Titrierzelle. Mit optimierten Antikörperkonzentration aus der Antikörper - Titration wurden MCF7GFP Zellen titriert optimierte Erfassung Konzentration zu finden , während keEping funktionalisierten Oberfläche und konstante Antikörperkonzentrationen. Dies kann verwendet werden, um Zellerfassung für verschiedene Anwendungen zu kalibrieren. Die Spalten in dieser Figur sind Replikate, während Reihen die Konzentration der Zellen verändern die Idee Bereich für die zelluläre Aufnahme zu finden. Graue Linie repräsentiert Kontrolle und Fehlerbalken stellen die Standardfehler des Mittelwerts. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
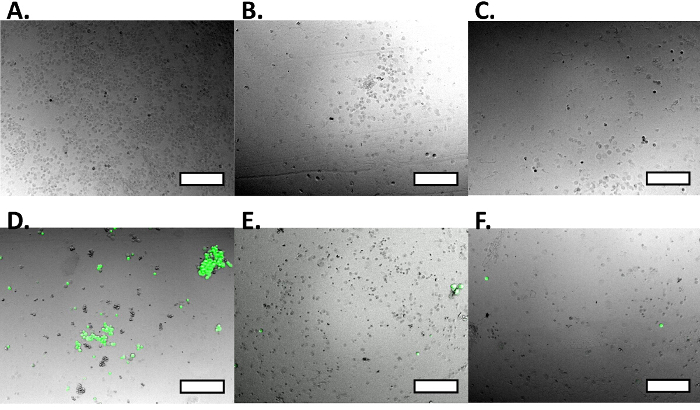
Abbildung 3. Erfassung und Freisetzungsversuche. Eine einzelne Zellgemisch auf der funktionalisierten Oberfläche ausgesetzt wurde (A), die Erfassung MCF7GFP Zellen unter Verwendung von HLA-ABC - Antikörper. Wenn sie mit HBSS (B) gewaschen, blieben Zellen eingefangen, aber wenn zu einer Lösung von 20 mM Biotin (C) ausgesetzt ist , Zellen wurden releasierend. Zellulares Mischung aus MCF7GFP Zellen und Makrophagen RAW 264.7 wurden einer funktionalisierten Oberfläche belichtet und wurden unter Verwendung mCD11b Antikörpers (D) erfasst. Unspezifische MCF7GFP Zellen sind grün markiert. Fluoreszenzintensität der MCF7GFP Zellen verringert wird, wenn auf eine Neutralwäsche (E) ausgesetzt ist , was bedeutet , dass die Oberfläche sie nicht gerichtet sind , und daß sie gebunden unspezifisch. Bei Anschluss an einen Biotin Wäsche (F) ausgesetzt wurden die gezielte RAW Makrophagen von der Oberfläche freigesetzt. Maßstabsbalken sind 250 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
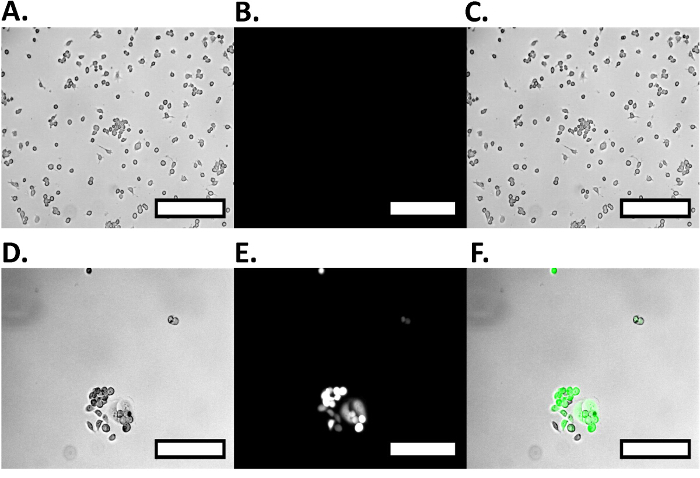
Abbildung 4. Positive und negative Zellkontrolle für Dual - Zellisolierung. Die positive Kontrolle RAW Makrophagen abgebildet werden ona Fluoreszenzmikroskop, keine Fluoreszenzaktivität sowie die relative Größe der Zellen zeigt. Hell RAW Makrophagen zeigen Zelle Sizing (A), während unter GFP Anregung, gibt es keine Fluoreszenz (B), die in dem fusionierten Bild (C) dargestellt ist. Die Negativkontrolle MCF7GFP Zellen werden auf einem Fluoreszenzmikroskop zeigt große Fluoreszenzaktivität, sowie der relativen Größe der MCF7GFP Zellen abgebildet. Die Zellen werden auf Hell- (D) abgebildet wird , Dimensionierung zeigt, und während sie unter GFP Anregung (E) zeigen große Fluoreszenz, die eindeutig im fusionierten Bild gezeigt werden kann (F). Maßstabsbalken sind 250 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
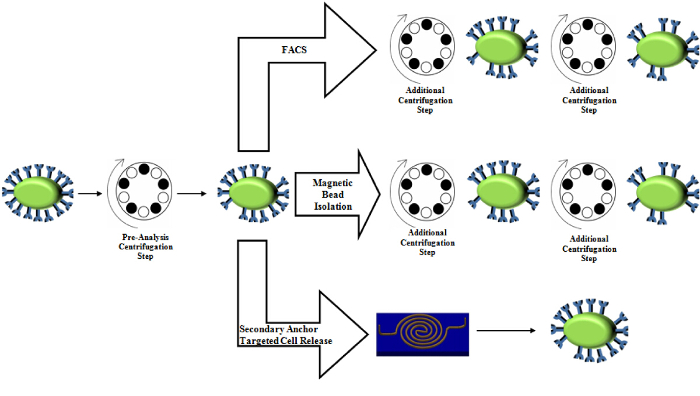
Fild 5. Vergleich von Zentrifugen Verwendung in Standard - Reinigungstechniken. Der Zentrifugationsschritt Voranalyse wird in der Probenvorbereitung konserviert. Magnetic - Bead - Isolierung sowie FACS mehrere zusätzliche Zentrifugationsschritte beinhaltet, die Belastung auf Zellen führt und die Expressionsniveaus verändern können. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Ergänzenden Code - Datei. Berechnungen. Bitte hier klicken , um diese Datei herunterzuladen.
Diskussion
Verbesserungen in der Zellisolationstechniken fördert wissenschaftliche Untersuchungen in der Struktur-Funktions - Beziehungen in den Neurowissenschaften 18, Zell - Programmierung in der regenerativen Biologie stammen, und angiogenen Signalgebung in der Gefäßbiologie 19. Tatsächlich primäre Zellkultur 20 (zB HUVECs) in vaskulären biology wird in erster Linie durch die Verwendung von Zellisolierungstechniken durchgeführt. Zellisolierung wurde auch für die quantitative Flow (QFlow) Zytometrie Analyse von Plasmamembranrezeptoren 3,14,15,19,21 vor kurzem verwendet. Allerdings beeinflussen bestehende Zellisolierung Methoden Zelloberflächenrezeptor Ebenen und sind sowohl teuer als in Personal und Reagenzien. Wir haben ein neues Verfahren in Oberflächenfunktionalisierung 17 vorgeschoben , die für die Schaffung eines sanften System reproduzierbarer Einfang eines einzelnen Zelltyps aus einem Gemisch von Zelltypen erlaubt , diese Mängel zu erfüllen. Diese Technik kann in eine iterative System integriert werden, so dass die Möglichkeit, capturing verschiedene Zelltypen in Stufen unter Verwendung spezifischer Antikörper. Um das Verfahren zu klären, eine Reihe von Fragen zur Fehlerbehebung und Antworten werden angeboten unter:
Funktionalisierung Optimierung: Die Funktionalisierung Prozesse ist für eine verbesserte Gleichmäßigkeit optimiert und Pull - Down von MCF7gfp Zellen. Dieses Protokoll kann alternativ optimiert und für jeden Zelltyp und Antikörper-Konfiguration angepasst werden. Dies kann durch Veränderung der Konzentrationen der Grundkomponenten in der Erfassungsfläche erreicht werden, oder durch den Typ oder die Konzentrationen der Antikörper zu verändern. Die meisten Antikörper Typen können mit dem obigen Protokoll biotinyliert werden. Sobald biotinyliert, können sie dann titriert werden (Abbildung 1) ideale Konzentration zu finden nach unten ziehen. Die Zellkonzentration kann (Abbildung 2) titriert werden , um die optimale Konzentration der Zellen zu finden , zu erfassen. Mit Hilfe dieser, die Durchführbarkeit eines bestimmten Zelltyps mit der Kappe Einfangenture Oberfläche ermittelt werden. Zum Beispiel ist, wenn ein Zelltyp von Interesse auf der Skala von 100 Zellen pro Million Zellen Konzentrationen von Zellen in diesem Bereich unter Verwendung der funktionalisierten Oberfläche ideal wäre einzufangen. Wenn während der Titration kann die Oberfläche nicht Zellen dieser geringen Konzentration aufnehmen und dann eine Optimierung der Oberfläche oder des Antikörpers notwendig ist, um in der Lage zu sein, Zellen innerhalb dieser Konzentrationsbereich auszufiltern.
Welche Zelltypen werden in diesem Protokoll verwendet? Wie könnte jemand dieses Protokoll ändern , um einen anderen Zelltyp zu benutzen?
Derzeit nutzt dieses Protokoll MCF7-GFP-Zellen und RAW 264.7 Makrophagen sind oft die Fähigkeit zu zeigen, ziehen Sie einen Zelltyp in einer Dual-Zellgemisch enthalten. Diese Zellen wurden ausgewählt, da sie zwei der relevanten Zelltypen zu Maus-Xenograft-Modell (human Tumor innerhalb murine Umgebung). Um das Verfahren für eine Vielzahl von anderen Zellen, Antikörper sp kalibrierenecificity ist von größter Bedeutung. Es gibt mehrere Online - Ressourcen für die Antikörper 22 ausgewählt wird .
Was sind einige der Vorteile dieser Methode?
Sanfte Ansatz: Der Mangel an Kraft macht diesen Ansatz sanft. Tatsächlich ist unsere berechnete Scherkraft maximal, 24 x 10 -6 17 pN, die keine signifikante Störung bis hin zu Biomarkern verursachen sollte, da hydrodynamischen Belastungen von 2,09 Pa (656 pN 314 pM 2 Zelloberfläche unter der Annahme) induzieren Nekrose , während Werte von Stress unter 0,59 Pa (185 pN unter der Annahme , 314 pM 2 Zelloberfläche) nicht 23. Diese schonende Methode ist somit vorteilhaft gegenüber einigen kommerziell verfügbaren Optionen wie Zentrifugation basierte Ansätze 24, die Pa Belastung 25 der Spitzenscher bis 0,78 ausüben up aufgrund der plötzlichen Beschleunigung bei Werten um 600 G, die Muster - Protein - Expression kann sich ändern und Morphologien 25 , 26 und sogar Zellnekrosen 23 induzieren. Somit wird ein Prozess, der die Menge der Zentrifugen Verwendungen reduzieren könnte, würde die Menge von Spannungen zu reduzieren, dass die Zellen durch Reinigung und schließlich sicherzustellen mehr physiologischen Daten erfahren würde. Unsere aktuellen Protokoll Zentrifugen verwendet die Zellkonzentration vor der Aufnahme, jedoch zu reinigen und zu rekonstituieren Dieses Herstellungsverfahren ist in vielen Standardreinigungstechniken , wie beispielsweise Magnetkügelchen Isolations 27,28, Durchflusszytometrie 29 und FACS 30 (Abbildung 5). Unser Ansatz reduziert alle nachgelagerten Zentrifugation Prozesse, die die anderen Techniken zusätzlich verwenden, um den Vorbereitungsschritt.
Biotin-Avidin - Ansatz: Die Anwendung von häufig verwendeten Biomaterialien (DSB-Streptavidin und Biotin-Streptavidin) macht diesen Ansatz auch vorteilhaft 31,32. Avidin- Familie Proteine binden extrem selektiv an die Biotin-Familie Proteine und sind für eine Reihe von scient verwendetific und medizinische Anwendungen , einschließlich: Antikörper-Fluorophor Befestigung 33, quantitative Qdot-Polystyrol - Kügelchen Befestigung 34, und die Schaffung von Hydrogelen , die in der Umwelt auf Reize reagieren verkapselte Wirkstoffe freizusetzen 32. Darüber hinaus macht die relative Leichtigkeit, biotinylierten Antikörper des Erwerbs dieser Ansatz allgemein zugänglich und anpassbar.
Desthiobiotin Ansatz ohne Perlen: Die Erfassungsfläche in der Lage , die Verwendung von Desthiobiotin ohne die Verwendung von ätzenden Reagenzien und Kräfte zu implementieren , um die Zellen zu lösen. DSB ist für reversible Zellhaftung und die Freisetzung von anderen Systemen in Verbindung mit DSB-Antikörper und magnetischen Kügelchen 35 verwendet. Die harten Auswirkungen der Trenntechnik sowie die große Zellverlust verbunden jedoch mit den Proben 27,28 Ergebnis in Differential Rezeptor und Chemokinexpression 28,36 vorbereitet. Dieser Ansatz zielt darauf ab, zu mildernund überwinden diese Einschränkungen durch die Verwendung sowohl von Magneten zu beseitigen und Perlen eine viel sanftere Wasch und Release-Methodik zu erstellen.
Was sind die kritischen Schritte in diesem Protokoll? Was kann Variabilität verursachen? Wie kann das Variabilität gesteuert werden?
Dieser Prozess hat vier wichtige Schritte, die in der verringerten Effizienz der Erfassungsfläche zur Folge haben kann. Der erste wichtige Schritt ist die Vermeidung von Wasser auf die Oberfläche während der APTES APTES Funktionalisierung Schritte, die in der Zerstörung des selbstorganisierenden Oberfläche führen würde. Dies wird durch die Verwendung von Ethanol als Lösungsmittel und Backen der APTES im Ofen behoben zu verringern Hydrolyse von späteren wässrigen Lösungen. Der zweite entscheidende Schritt ist die EDC Reaktionsschritte, bei denen EDC die Reaktion des DSB mit den APTES katalysiert: ermöglicht die Vernetzung der beiden Schichten. Wenn die EDC ausgeschlossen oder nicht in ausreichendem Maße gegeben, wird der DSB nicht in der Lage sein, den Boden zu befestigen, whic h wird der Auslösemechanismus beeinträchtigen. Der dritte kritische Schritt ist während der SAv Funktionalisierung, wie die Aufrechterhaltung der SAv Schicht kritisch ist. Die Uneinheitlichkeit der Streptavidin-Schicht führt zur Verringerung der Fangeffizienz. Der vierte Schritt ist kritisch in der Biotinylierung des Antikörpers, da die Bindung des Antikörpers an die Erfassungsfläche wird über die Biotin-Streptavidin-Wechselwirkung der Erfassungsfläche und der Antikörper erleichtert. Wenn der Antikörper nicht biotinyliert, dann wird die Streptavidin-Schicht nicht in der Lage sein, es zu erfassen und ziehen Sie sie nach unten, so dass die Erfassungsfläche nutzlos. Veränderlichkeit und Widersprüchlichkeit in der Oberflächenerfassung kann auf die Konzentration nicht Regelmäßigkeit zurückgeführt werden sowie stochasticity der Schicht Befestigung. Diese Variation kann auf die Oberfläche, und die beabsichtigten Ziele capture kalibriert unter Verwendung von präzisen Konzentrationen von Schichtkomponenten gesteuert werden. Bei dieser Konstruktion werden Konzentrationen speziell auf die Erfassung von MCF7-GFP-Zellen kalibriert.
e_content "> Was sind einige Nachteile dieser Methode?Derzeit ist die APTES Funktionalisierung durch Verwendung einer flüssigen Phase Eintauchen der Oberfläche durch ein Wärmebehandlungsschritt folgt für 55 Minuten durchgeführt für bis zu 2 Stunden. Obwohl dies für eine vollständige Schicht von APTES Silans an die Oberfläche zu binden , ermöglicht, wäre eine einheitlichere Verfahren die Dampfphase Silanisierung 37 sein. Dies verringert APTES Kontaktzeit, damit die Forscher Zeitersparnis sowie zunehmende Gleichförmigkeit. Zusätzlich verbessert pull-down wurde 17 beobachtet werden, wenn die Inkubation über Nacht von SAv verwendet wird, und zur Zeit erfordert die Oberflächenfunktionalisierung zwei, über Nacht Inkubationen, so dass der Gesamtprozess drei Tagen. So würde bieten die Chemie Optimierung erhebliche Zeitersparnis für den Forscher.
Was sind einige Warnungen oder Vorsichtsmaßnahmen , die hilfreich sein können?
Wenn Oberflächen zu funktionalisieren, ist es imperative, dass die richtige Pflege auf das Risiko von Atemwegs Schaden genommen wird. Beide APTES und Mercaptoethanol können in die Lunge und damit verbundenen Organe extrem gefährlich sein, so ist es notwendig, die Funktionalisierung in einer chemischen Haube zu tun Wechselwirkung mit den chemischen Dämpfen zu reduzieren. Mercaptoethanol ist ein Thiol, die in Geruch besonders scharf ist. Wenn Mercaptoethanol verwendet, erlauben für kontaminierte Abfälle für einen oder zwei Tage vor der Entsorgung in der Haube sitzen.
Was sind die zukünftigen Ziele und Anwendungen dieser Oberfläche?
beinhalten Unsere Zukunft Ziele dieser Oberfläche Customizing mit einer Vielzahl von relevanten Zelltypen für angiogene verwandten Erkrankungen zu arbeiten. Insbesondere wollen wir Menschen Endothelzellen aus der Nabelvene, um unter Verwendung von Blutproben zu segue zu konzentrieren und von dort aus Zellen von Interesse abscheidet. Darüber hinaus planen wir, Trennung Modalitäten wie Aptamere in das Design des funktionalisierten surfac zu integrierene, um unsere Erfassung und Freigabe Prozentsätze erhöhen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We would like to thank the American Cancer Society, Illinois Division (282802) and the National Science Foundation CBET (1512598) for funding support. We also would like to thank Dr. Dianwen Zhang from the University of Illinois Beckman Institute for microscopy training. Finally, we would like to thank Jared Weddell, Stacie Chen, and Spencer Mamer for insightful discussions.
Materialien
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl) triethoxysilane (APTES) | Acros Organics | 919-30-2 | Used to make 2% APTES solution |
| Plasma Cleaner Pico | Diener | Model 1 | Cleans surfaces and allows for bonding of PDMS to glass |
| d-Desthiobiotin (DSB) | Sigma | D20655 | Used as the releasing mechanism in the cellular capture surface. |
| dimethyl sulfoxide (DMSO) | British Drug Houses (BDH) | BDH1115-1LP | Dissolves the DSB into solution |
| 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDC) | Thermo-Scientific | 5g: 22980 25g: 22981 | Activates carboxylic acids and allows binding of proteins to glass surface. |
| uncoated 8-well culture slide | BD Falcon | Case of 24: 354118 Case of 96: 354108 | Used in cellular experiments involving Zeiss fluorescence microscope such as initial capture and release quantification experiments |
| Glass bottom 24-well plates | MatTek | P24G-0-13-F | Used in cellular experiments involving the plate reader such as antibody and cellular titration experiments |
| Mercaptoethanol | Science Lab | 60-24-2 | Used to quench reaction between EDC and DSB |
| 4-Morpholinoethanesulfonic acid hydrate (MES Hydrate 99%) | Fisher Scientific | AC172590250 | Used to make 0.1 M MES Buffer for use in EDC reaction |
| Precision Oven | Thermo Scientific | 11-475-153 | Used in curing of PDMS and APTES layer. |
| Titramax 1000 Shaker | Heidolph | 13-889-420 | Used to ensure even distribution of APTES on surfaces. |
| 1x Streptavidin 5 mg [e7105-5mg] | Proteo Chem | 9013-20-1 | Biotin-binding protein. May cause irritation. |
| 5 cm Glass Dish | Fisher Scientific | 08748A | Used in HUVEC studies as well as future profiling studies. |
| 14 cm Petri Dish with Cover | Sigma-Aldrich | Z717231 | Used to hold samples being functionalized and transport them. |
| MCF7-GFP cells | Cell Biolabs | AKR211 | Stored in liquid nitrogen |
| RAW264.7 mouse macrophages | ATCC | TIB-71 | Gifted to us from Smith lab at the University of Illinois. Stored in liquid nitrogen. |
| TrypLE | Life Technologies | 12605036 | Stored in 100 ml at room temperature |
| Dulbecco’s modified Eagle medium | Cell Media Facility at School of Chemical Sciences at UIUC | 50003PC | Supplier: Corning |
| Nonessential amino acids | Cell Media Facility at School of Chemical Sciences at UIUC | 25-025-CI | Already added into DMEM by facility. Supplier: Corning. |
| Cell scraper | Fisher Scientific | 12-565-58 | Small 23 cm 50 pack |
| Cell Dissociation Solution | Corning | MT-25-056CI | Used to lift cells non-enzymatically for the use in cell experiments |
| Hemacytometer | Hausser | 02-671-54 | Used to count cells for quantification of cell solutions and capture and release effectivity. |
| Biotin | Amresco | 58-85-5 | Used to release cells from surface. |
| HBSS | Created from Recipe | N/A | Used to keep cells alive in suspension as well as wash surfaces of non-specific binding. Adapted from Cold Spring Harbor Protocols: In 500 ml, use 4 g NaCl, 0.2 g KCl, 0.0402 g Na2PO4•7H2O, 0.03 g KH2PO4 and 0.5 g glucose. Add DI water to get to 500 ml, filter, and then refrigerate. |
| HLA-ABC Antibody | BioLegend | 311402 | Antibody used to capture MCF7gfp cells |
| hIgG Antibody | BioLegend | HP6017 | Antibody used to capture MCF7gfp cells |
| MCF7 GFP cells | Cell Biolabs | AKR-211 | Luminal Breast Cancer line that has been transfected with green fluorescent protein. |
| Assorted Conicals | Thermo-Scientific | 15mL: 12-565-268 | 50/15 ml plastic conicals for storing solutions and aliquots. |
| Mini-Tube Rotators (End over End Mixer) | Fisher Scientific | 05-450-127 | Used to incubate antibody and mix other cellular solutions in order to mix |
| Axiovert 200M (Fluorescence Microscope) | Zeiss | N/A | Zeiss Axiovert 200 M inverted florescence microscope. |
| Zeba Desalting columns | Thermo-Scientific | PI-87770 | Used to purify newly biotinylated antibodies after the use of the Biotinylation Kit. Instructions provided at: http://www.funakoshi.co.jp/data/datasheet/PCC/89894.pdf |
| EZ Link Sulfo NHS Low Weight Biotinylation Kit | Thermo- Scientific | Used to biotinylate antibodies to allow them to integrate with the capture surface | |
| Plate Reader | BioTek | Synergy HTX Multimode Reader | Used to quantitatively measure fluorescent intensity in the titration experiments. |
Referenzen
- Erdbruegger, U., Haubitz, M., Woywodt, A. Circulating endothelial cells: a novel marker of endothelial damage. Clin. Chim. Acta. 373 (1-2), 17-26 (2006).
- De Spiegelaere, W., Cornillie, P., Van Poucke, M., Peelman, L., Burvenich, C., Van den Broeck, W. Quantitative mRNA expression analysis in kidney glomeruli using microdissection techniques. Histol. Histopathol. 26 (2), 267-275 (2011).
- Chen, S., Guo, X., Imarenezor, O., Imoukhuede, P. I. Quantification of VEGFRs, NRP1, and PDGFRs on Endothelial Cells and Fibroblasts Reveals Serum, Intra-Family Ligand, and Cross-Family Ligand Regulation. Cell. Mol. Bioeng. 8 (3), 383-403 (2015).
- Cheung, L. S. L., et al. Detachment of captured cancer cells under flow acceleration in a bio-functionalized microchannel. Lab Chip. 9 (12), 1721-1731 (2009).
- Privorotskaya, N., et al. Rapid thermal lysis of cells using silicon-diamond microcantilever heaters. Lab Chip. 10 (9), 1135-1141 (2010).
- Park, K., Akin, D., Bashir, R. Electrical capture and lysis of vaccinia virus particles using silicon nano-scale probe array. Biomed. Microdevices. 9 (6), 877-883 (2007).
- Galletti, G., Sung, M., Vahdat, L. Isolation of breast cancer and gastric cancer circulating tumor cells by use of an anti HER2-based microfluidic device. Lab Chip. 14 (1), 147-156 (2014).
- Schudel, B. R., Choi, C. J., Cunningham, B. T., Kenis, P. J. A. Microfluidic chip for combinatorial mixing and screening of assays. Lab Chip. 9 (12), 1676-1680 (2009).
- Lien, K. Y., Chuang, Y. H., et al. Rapid isolation and detection of cancer cells by utilizing integrated microfluidic systems. Lab Chip. 10 (21), 2875-2886 (2010).
- Stott, S. L., et al. Isolation of circulating tumor cells using a. PNAS. 107 (35), 18392-18397 (2010).
- Yu, M., Ting, D., Stott, S., Wittner, B., Ozsolak, F. RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis. Nature. 487 (7408), 510-513 (2012).
- Sheng, W., Ogunwobi, O., Chen, T., Zhang, J. >Capture, release and culture of circulating tumor cells from pancreatic cancer patients using an enhanced mixing chip. Lab Chip. 14 (1), 89-98 (2014).
- Zheng, X., Cheung, L. S. L., Schroeder, J. A., Jiang, L., Zohar, Y. A high-performance microsystem for isolating circulating tumor cells. Lab Chip. 11 (19), 3269-3276 (2011).
- Imoukhuede, P. I., Popel, A. S. Quantification and cell-to-cell variation of vascular endothelial growth factor receptors. Exp. Cell Res. 317 (7), 955-965 (2011).
- Imoukhuede, P. I., Popel, A. S. Expression of VEGF receptors on endothelial cells in mouse skeletal muscle. PLoS One. 7 (9), e44791(2012).
- Ludwig, A., Kretzmer, G., Schügerl, K. Determination of a "critical shear stress level" applied to adherent mammalian cells. Enzyme Microb. Technol. 14 (3), 209-213 (1992).
- Ansari, A., Lee-Montiel, F. T., Amos, J., Imoukhuede, P. I. Secondary anchor targeted cell release. Biotechnol. Bioeng. 112 (11), 2214-2227 (2015).
- Drenan, R. M., Nashmi, R., Imoukhuede, P., Just, H., McKinney, S., Lester, H. A. Subcellular trafficking, pentameric assembly, and subunit stoichiometry of neuronal nicotinic acetylcholine receptors containing fluorescently labeled alpha6 and beta3 subunits. Mol. Pharmacol. 73 (1), 27-41 (2008).
- Imoukhuede, P. I., Dokun, A. O., Annex, B. H., Popel, A. S. Endothelial cell-by-cell profiling reveals temporal dynamics of VEGFR1 and VEGFR2 membrane-localization following murine hindlimb ischemia. Am J Physiol Hear. Circ Physiol. 4 (8), H1085-H1093 (2013).
- van Beijnum, J. R., Rousch, M., Castermans, K., van der Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3 (6), 1085-1091 (2008).
- Imoukhuede, P. I., Popel, A. S. Quantitative fluorescent profiling of VEGFRs reveals tumor cell and endothelial cell heterogeneity in breast cancer xenografts. Cancer Med. 3 (2), 225-244 (2014).
- BD Biosciences. CD Marker Handbook: Human and Mouse. , at: https://www.bdbiosciences.com/documents/cd_marker_handbook.pdf (2010).
- Tanzeglock, T., Soos, M., Stephanopoulos, G., Morbidelli, M. Induction of mammalian cell death by simple shear and extensional flows. Biotechnol. Bioeng. 104 (2), 360-370 (2009).
- Processing Blood. , at: https://www.google.com/patents/US20140030238 (2014).
- Fukuda, S., Schmid-Schönbein, G. W. Centrifugation attenuates the fluid shear response of circulating leukocytes. J. Leukoc. Biol. 72 (July), 133-139 (2002).
- dela Paz, N. G., Walshe, T. E., Leach, L. L., Saint-Geniez, M., D'Amore, P. A. Role of shear-stress-induced VEGF expression in endothelial cell survival. J. Cell Sci. 125 (Pt 4), 831-843 (2012).
- Allard, W. J., et al. Tumor Cells Circulate in the Peripheral Blood of All Major Carcinomas but not in Healthy Subjects or Patients With Nonmalignant Diseases Tumor Cells Circulate in the Peripheral Blood of All Major Carcinomas but not in Healthy Subjects or Patients With Nonmalignant diseases.". Clinical Cancer Research. 10, 6897-6904 (2005).
- Nagrath, S., et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology. Nature. 450 (7173), 1235-1239 (2007).
- Chen, S., Weddel, J., Gupta, P., Conard, G., Parkin, J., Imoukhuede, P. I. QFlow Cytometer-Based Receptoromic Screening: A High-throughput Quantification Approach Informing Biomarker Selection and Nanosensor. Submiss. , (2016).
- Vasa, M., et al. Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease. Circ. Res. 89 (1), E1-E7 (2001).
- Hirsch, J. D., Eslamizar, L., et al. Easily reversible desthiobiotin binding to streptavidin, avidin, and other biotin-binding proteins: uses for protein labeling, detection, and isolation. Anal. Biochem. 308 (2), 343-357 (2002).
- Wilchek, M., Bayer, E. A. Applications of Avidin-Biotin Technology: Literature Survey. Methods Enzymol. 152 (1), 183-189 (1987).
- Wu, X., et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots. Nat. Biotechnol. 21 (1), 41-46 (2002).
- Lee-Montiel, F. T., Imoukhuede, P. I. Engineering quantum dot calibration standards for quantitative fluorescent profiling. J. Mater. Chem. B. 1, 6434(2013).
- Oligonucleotide-linked magnetic particles and uses thereof. , Available from: http://www.google.com/patents/US5512439 (1996).
- Naranbhai, V., et al. Impact of blood processing variations on natural killer cell frequency, activation, chemokine receptor expression and function. J. Immunol. Methods. 366 (1-2), 28-35 (2011).
- Yadav, A. R., Sriram, R., Carter, J. A., Miller, B. L. Comparative study of solution-phase and vapor-phase deposition of aminosilanes on silicon dioxide surfaces. Mater. Sci. Eng. C. 35 (1), 283-290 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten