Method Article
VacuSIP, שיטת INEX משופרת
In This Article
Summary
We introduce the VacuSIP, a simple, non-intrusive, and reliable method for clean and accurate point sampling of water. The system was developed and evaluated for the simultaneous collection of the water inhaled and exhaled by benthic suspension feeders in situ, to cleanly measure removal and excretion of particulate and dissolved compounds.
Abstract
Benthic suspension feeders play essential roles in the functioning of marine ecosystems. By filtering large volumes of water, removing plankton and detritus, and excreting particulate and dissolved compounds, they serve as important agents for benthic-pelagic coupling. Accurately measuring the compounds removed and excreted by suspension feeders (such as sponges, ascidians, polychaetes, bivalves) is crucial for the study of their physiology, metabolism, and feeding ecology, and is fundamental to determine the ecological relevance of the nutrient fluxes mediated by these organisms. However, the assessment of the rate by which suspension feeders process particulate and dissolved compounds in nature is restricted by the limitations of the currently available methodologies. Our goal was to develop a simple, reliable, and non-intrusive method that would allow clean and controlled water sampling from a specific point, such as the excurrent aperture of benthic suspension feeders, in situ. Our method allows simultaneous sampling of inhaled and exhaled water of the studied organism by using minute tubes installed on a custom-built manipulator device and carefully positioned inside the exhalant orifice of the sampled organism. Piercing a septum on the collecting vessel with a syringe needle attached to the distal end of each tube allows the external pressure to slowly force the sampled water into the vessel through the sampling tube. The slow and controlled sampling rate allows integrating the inherent patchiness in the water while ensuring contamination free sampling. We provide recommendations for the most suitable filtering devices, collection vessel, and storing procedures for the analyses of different particulate and dissolved compounds. The VacuSIP system offers a reliable method for the quantification of undisturbed suspension feeder metabolism in natural conditions that is cheap and easy to learn and apply to assess the physiology and functional role of filter feeders in different ecosystems.
Introduction
ניזונים ההשעיה benthic לשחק תפקידים חיוניים לתפקוד של מערכות אקולוגיות ימיות 1. על ידי סינון כמויות גדולות של מים 2,3, מסלקים ומפרישות חלקיקים (פלנקטון שאריות) ופזרו תרכובות 1 (והפניות בו) והם סוכן חשוב של צימוד benthic-פלגי 4,5 ו מזין אופניים 6,7. מדויק למדידת החלקיקים ותרכובות מומסות מוסר מופרש על ידי האכלת השעית benthic (כגון ספוגים, ascidians, ורב-שעירים, ו צדפות) היא יסוד להבין אקולוגית הפיסיולוגיה, מטבוליזם, ההאכלה שלהם. יחד עם שאיבת מדידות קצב, הוא גם מאפשר כימות של והנתיבים המזינים בתיווך אורגניזמים אלה ההשפעה האקולוגית שלהם על איכות מים וכן על תהליכים בקנה מידה אקולוגית.
בחירת השיטה המתאימה של מדידת שיעורי הסרה וייצור של חלקיקי com מומספאונד על ידי ניזונים מסנן השעיה הוא חיוני להשגת נתונים אמינים בנוגע לפעילות ההאכלה שלהם 8. כפי שצוין על ידי Riisgård ואחרים, תוצאות הטית מתודולוגיות הולמות, לעוות תנאי ניסוי, לייצר הערכות שגויות של בליעה והפרשה של חומרים מסוימים, ויכול להוביל כימות המוטעית של והנתיבים המזינים מעובד על ידי אורגניזמים אלה.
שתי השיטות הנפוצות ביותר למדוד חלקיקים ונתיבים מזינים מומסים ניזונים מסננים לכלול הן דגירה (טכניקות עקיפות) או אוסף סימולטני של סביבה ומי נשף (טכניקות ישירות). טכניקות דגירה מבוססות על מדידת קצב השינוי בריכוז החלקיקים וחומרים המזינים המומסים במים וטופחו, והערכת קצב ההפקה או הסרה בהשוואה לקבוצת ביקורת נאותה 8. עם זאת, מצרף אורגניזם בתא דגירה יכול לשנות feedin שלהg ושאיבת התנהגות עקב שינויים במשטר הזרימה הטבעי, בשל ירידת חמצן ו / או בריכוז מזון, או בשל הצטברות של תרכובות הפרשה ב 7,9 מי דגירה (והפניות בו). בנוסף להשפעות של כליאה ואספקת מים שונה, הטיה גדולה של טכניקות דגירה נובעת תופעות מחדש סינון (ראה למשל 10). למרות שחלק בעיות מתודולוגיות אלה הוכרעו באמצעות הנפח והצורה התקין של כלי הדגירה 11 או עם כניסתה של מערכת פעמון-צנצנת הסירקולציה המחודשת באתרו 12, טכניקה זו לעתים קרובות ממעיטה בערך שיעורי הסרה והפקה. כימות מטבוליזם של תרכובות מומסות כגון חנקן אורגני מומס (דון) ופחמן (DOC) או חומרים מזינים אורגניים, הוכיח להיות מועדים במיוחד להטיות נגרמות על ידי טכניקות דגירת 13.
בשנות ה -60 המאוחרות וה -70 המוקדמות, הנרי Reiswig9,14,15 חלוץ ביישום של טכניקות ישירות לכמת הסרת חלקיק ידי ספוגי הקאריביים ענקים, על ידי בנפרד דגימת המים השואפים ונושפת ידי האורגניזמים באתרו. בשל הקושי ליישם את הטכניקה של Reiswig על ניזונים השעיה קטנים בתנאים תת מאתגרים יותר, את חלק הארי של מחקר בתחום זה הוגבל במעבדה (in vitro) שימוש בטכניקות דגירה עקיפות בעיקר 16. יהל ועמיתיו שהותאמו Reiswig של ישיר בטכניקה באתרו לעבוד בתנאים בקנה מידה קטן יותר. שיטתם, כינת INEX 16, מבוסס על דגימה מתחת למים סימולטני של המים בשאיפה (ב) ונשף (Ex) על ידי אורגניזמים באין מפריע. ריכוז שונה של חומר (למשל, חיידקים) בין זוג דגימות (INEX) מספק מדד של שימור (או ייצור) של החומר הזה על ידי החיה. טכניקת INEX מעסיקה צינורות פתוחיםמסתמך על סילון excurrent המיוצר על ידי פעילות השאיבה של האורגניזם למד כדי להחליף את מי הסביבה פסיבית בצינור האיסוף. בעוד יהל ועמיתיו בהצלחה יישמו טכניקה זו במחקר של מעל 15 השעיה שונה וקינון מינים (למשל, 17), השיטה מוגבלת על ידי הרמה הגבוהה של עשייה וניסיון הנדרשת, לפי הגודל הזעיר של כמה פתחי excurrent, ועל ידי תנאי ים.
כדי להתגבר על המכשולים הללו, פיתחנו טכניקה חלופית המבוססת על שאיבה מבוקרת של מים שנדגמו דרך צינורות דקות (קוטר חיצוני <1.6 מ"מ). מטרתנו הייתה ליצור מכשיר פשוט, אמין, ולא יקר שיאפשר נקי ומבוקר דגימת מים באתרו מנקודת מבט ספציפי מאוד, כגון נקב excurrent של מתקני האכלת השעית benthic. כדי להיות יעיל, השיטה צריכה להיות בלתי פולשניות כדי לא להשפיע על משטר זרימת הסביבה או לשנות את behavior של היצורים שנחקרו. המכשיר המוצג כאן נקרא VacuSIP. זהו פישוט של מערכת SIP שפותח על ידי יהל et al. (2007) 18 לדגימה נקודה מבוססת ROV במעמקי הים. VacuSIP הוא הרבה יותר זול מאשר SIP המקורי וזה הותאם לעבודה מבוססת SCUBA. המערכת תוכננה על פי העקרונות המוצגים ונבדקו על ידי רייט סטיבנס (1978) 19 ו Møhlenberg ו Riisgård (1978) 20 עבור הגדרות במעבדה.
למרות שמערכת VacuSIP תוכנן עבור במחקרים באתרו של חילוף החומרים של מתקני האכלה ההשעיה benthic, זה יכול לשמש גם עבור במחקרי מעבדה ובכל מקום מבוקר ונקי, דגימת מים-מקור הצבע נדרש. המערכת שימושית במיוחד כאשר שילוב לאורך תקופות ממושכות (דקות שעות) או filtrations באתרו נדרש. VacuSIP שימש בהצלחה במעבדה יהל מאז 2011, ויש לו גםהועסק בשני מחקרים אחרונים של ונתיבים מזינים בתיווך מינים ספוגים הקאריביים והים תיכוניים 21 (Morganti et al.) שנמסר.
שימוש דוגמים ספציפיים, משך הדגימה הממושך, ותנאי השטח, שבו VacuSIP מוחל, כרוך סטיות כמה מן הפרוטוקולים האוקיינוגרפי תקן לאיסוף, סינון, ואחסון דגימות עבור analytes הרגיש. כדי להפחית את הסיכון של זיהום על ידי מערכת VacuSIP או את הסיכון של שינוי של מים שנדגמו על ידי פעילות חיידקית לאחר איסוף, בדקנו שונים הליכי סינון ואחסון באתרו. התקני סינון שונים, כלי איסוף, ונהלים לאחסון נבחנו על מנת להשיג את הטכניקה המתאימה ביותר לניתוח אורגני המומס (PO 4 3, NO x -, NH 4 +, SiO 4) ואורגני (DOC + DON) תרכובות, ואת-פלנקטון אולטרה (<1081; מ ') ו- (POC האורגני חלקיקים + דגימת PON). כדי לצמצם עוד יותר את הסיכון של זיהום, במיוחד בתנאי שדה, את מספר צעדי טיפול צומצם למינימום ההכרחי. הפורמט החזותי, שבו שיטת המוצג מכוון להקל שחזור כדי לצמצם את הזמן הדרוש כדי ליישם את הטכניקה בצורה יעילה.
סקירת מערכת
כדי לדגום במים הנשאבים באתרו מן ניזונים השעיה עם נקבי exhalant קטנים כמו 2 מ"מ, פעילות השאיבה כל דגימה היא מדמיינת ראשונה על ידי שחרור מסונן צבוע והעמסה מי ים ליד פתח נשימתית (הים) והתבוננות זרימתו מ פתח excurrent 16 (ראה גם איור 2b ב 18). המים שהיא שואפת ונושפים על ידי דגימת המחקר (incurrent ו excurrent) אז הם שנדגמו בד בבד עם השימוש של זוג צינורות דקות מותקנים על מניפולטור שהותקן או על שתיים "The ARms "של חצובה ניידת גמישה הפוכה (איור 1 משלים וידאו 1). המים שאנו נושמים האורגניזם המחקר נאספו על ידי מיצוב הקצה הפרוקסימלי בקפידה של צינור אחד בתוך או ליד הצמצם נשימתית של האורגניזם המחקר. זהה צינור ממוקם אז בתוך פתח excurrent. פעולה זו דורשת טיפול טוב כדי להימנע ממגע או הפרעה של החיה, למשל, על ידי resuspension משקעים. כדי להתחיל את הדגימה, צוללן מפלח מחצה בתוך כלי איסוף עם מחט מזרק מצורף קצה הדיסטלי של צינור אחד, המאפשרים לחץ החיצוני של המים כדי להוציא את המים שנדגמו לתוך הכלי דרך צינור הדגימה. היניקה היא שיזמה את הריק שנוצר בעבר הצלוחיות ידי פרש לחצים בין המים החיצוניים ואת מכל המדגם פונה .
כדי להבטיח אוסף נקי של מי נשף וכדי למנוע שאיבה בשוגג של Ambiמים אף אוזן גרון 16, קצב הדגימה מים צריך להיות כל הזמן בקצב נמוך משמעותית (<10%) משיעור זרימת excurrent. שיעור היניקה נשלט על ידי האורך של הצינור וקוטרו הפנימי שלה (ID). הקוטר הפנימי הקטן גם מבטיח נפח מת זניח (<200 μl למטר של צינורות). דגימה לאורך תקופות ממושכות (דקות עד שעות) עושה את זה אפשרי לשלב את מעשה הטלאים הטבועים של רוב החומרים של עניין. כדי להבטיח כי דגימות נשמרות כראוי בפגישות דגימה מתחת למים ממושכות וכן לתחבורה למעבדה, גידול סינון באתרו מומלץ עבור analytes הרגיש. הבחירה של כלי דגימה, הרכבת סינון, צינורות מוכתבים על ידי אורגניזמים מחקר ושאל המחקר הספציפי. הפרוטוקול המתואר להלן מניח כי הפרופיל המטבולי מלא הוא בעל עניין (עבור סקירה ראה איור 2). עם זאת, האופי מודולרי של הפרוטוקול מאפשר fאו שינוי קל להכיל פשוטות או אפילו מאוד תוכניות דגימה שונות. במשך פרופיל המטבולי מלא, פרוטוקול הדגימה צריך לכלול את הצעדים הבאים: (1) הצגת נתוני זרימה; (2) הזנה אולטרה-פלנקטון דגימה (פלנקטון <10 מיקרומטר); (3) דגימה ספיגת חומרים מזינים אורגניים הפרשה (באמצעות מסננים אונליין); (4) דגימה מומסת ספיג והפרשה אורגניות (באמצעות מסננים אונליין); (5) חלקיקי האכלה והפרשה (באמצעות מסננים אונליין); (6) חזור על שלב 2 (האכלה אולטרה-פלנקטון כמו בדיקת איכות); (7) זרימה ויזואליזציה.
כאשר מבחינה לוגיסטית ריאלי, מומלץ כי מדידות הפרופיל המטבולי משולבות עם שאיבת שיעור (למשל, שיטת המהירות מול לצבוע, ב 16) וכן עם מדידות נשימה. מדידות אלה נלקחות טובים ביותר בתחילה בסוף פגישת הדגימה. למדידת נשימה, optodes מתחת למים או-אלקטרודות מיקרו עדיפים.
Protocol
1. נהלי צעדים וניקיון המכינה
- תְמִיסָה לנִיקוּי
- ללבוש ציוד מגן, חלוק מעבדה וכפפות בכל עת. לבצע צעדי ההכנה האלה בחלל נקי ללא אבק ועשן.
- הכין חומצה הידרוכלורית 5-10% פתרון (HCl) עם איכות טריה, גבוהה, מים מזוקקים פעמים.
- כן% 5 לתמהיל בסיסי מסיס מאוד של פתרון פעיל שטח anionic והלא-היוני (ראה רשימת חומרים) עם איכות טריה, גבוהה, מים מזוקקים פעמים.
- אחסן את כל הפתרונים נקיים, חומצת שטף מכולות.
- פעולות הכנה ונהלי ניקוי (במעבדה)
הערה: אם תרכובות זרחן אינן עניין, בכביסת HCl יכולה להיות מוחלפת על ידי חומצה זרחתית באיכות גבוהה (H 3 PO 4) לשטוף (8% H 3 PO 4 ריכוז סופי).- ללבוש ציוד מגן, חלוק מעבדה וכפפות בכל עת.
- לִשְׁטוֹףמנגנון הדגימה (למעט בעל מסנן נירוסטה ב-קו פלדת Swinney) עם כמות גדולה של מים טוהרים גבוהים. השאר את מנגנון שריית פתרון 5-10% HCl הלילה. יש לשטוף את המנגנון שוב עם כמות גדולה של מים מזוקקים פעמיים באיכות גבוהה.
- שטוף את מסנן חלד ב-קו Swinney פלדת המחזיקים עם כמות גדולה של מים טוהרים גבוהים. השאירו את בעלי מסנן שריה 5% מסיס מאוד לתמהיל הבסיסי של פתרון anionic פעילי שטח nonionic לילה. לשטוף אותם שוב עם מים מזוקקים פעמיים באיכות גבוהה מספיק.
- לייבש את כל מנגנון הדגימה, לעטוף אותם בנייר אלומיניום ולשמור בקופסא נקיה עד שימוש.
- שליטה בקצב היניקה
- לשלוט על קצב הדגימה על ידי התאמת האורך והקוטר פנימי של צינור הצריכות לפי עומק העבודה המתוכננת ואת טמפרטורת מים. השתמש המשוואה הבאה (נגזרת ממשוואת האגן-Poiseuille המשמש devel מלאזרימה בצנרת למינרית OpEd) כמדריך:
 כאשר F = קצב הזרימה (ס"מ 3 דקות -1), ΔP = לחץ דיפרנציאלי (בר), r = כניסת צינורות רדיוס פנימי (ס"מ), K = 2.417 x 10 -9 (sec -2), L = אורך הצינור (ס"מ ), V = צמיגות המים (ס"מ g -1 שניות -1). ראה טבלה 1 לפרטים נוספים.
כאשר F = קצב הזרימה (ס"מ 3 דקות -1), ΔP = לחץ דיפרנציאלי (בר), r = כניסת צינורות רדיוס פנימי (ס"מ), K = 2.417 x 10 -9 (sec -2), L = אורך הצינור (ס"מ ), V = צמיגות המים (ס"מ g -1 שניות -1). ראה טבלה 1 לפרטים נוספים. - לשמור על קצב דגימה מתחת ל -1% של קצב השאיבה של החיה למדה.
הערה: שימוש מכולות פונו, לפעמים עם ואקום ידוע מציבה סיבוכים נוספים. לכן, מבחן שדה מומלץ מאוד. ב -10 מ 'עומק ~ 22 ° C מי ים (40 PSU), בצינור כניסת 50 ס"מ עם קוטר פנימי של 254 מיקרומטר מספק שיעור יניקה הממוצע של ~ 26 μl שניות -1 (1.56 מ"ל דקות -1).
- לשלוט על קצב הדגימה על ידי התאמת האורך והקוטר פנימי של צינור הצריכות לפי עומק העבודה המתוכננת ואת טמפרטורת מים. השתמש המשוואה הבאה (נגזרת ממשוואת האגן-Poiseuille המשמש devel מלאזרימה בצנרת למינרית OpEd) כמדריך:
- כלי דגימה
- לקבלת דוגמיות נפח קטן (3-20 מ"ל, למשל,-פלנקטון אולטרה לספיקה CYTometry) להשתמש צינורות פלסטיק סטרילי מראש שאב.
הערה: צינורות פלסטיק סטרילי-שאב קדם מועסקים באופן שגרתי בדיקות דם שגרתיות אצל בני אדם; הקפד להשתמש צינורות סטרילית ללא תוספים. צינורות פלסטיק סטרילי שאב אלה נדגמים באופן מיטבי את השימוש בעל צינור סטרילי, לשימוש חד-פעמי עם מחוץ למרכז Luer. אמנם זהו מנגנון הדגימה הבטוח והיעיל ביותר, יש לו נפח מת מעט גדול לעומת מחט פשוטה. - לקבלת דוגמיות מים גדולים כגון חומרי מזון אורגניים מומסים, להשתמש 40 או 60 מ"ל צלוחיות זכוכית העונים על הסוכנות להגנת הסביבה (EPA) קריטריונים עבור ניתוחים אורגניות נדיפות. בקבוקונים אלה כוללים כובע פוליפרופילן עם מחצה סיליקון פן PTFE.
- כי גם כמויות גדולות יותר, להשתמש בבקבוקי פניצילין עם פקקי גומי או צלוחיות ואקום.
- השתמש בקבוקונים עשויים פוליאתילן בצפיפות גבוהה (HDPE בקבוקונים) עבור דגימות סיליקה.
- כדי להגדיל נפח דגימה וכדי להפחית את הסיכון של פירוק הפקקבמהלך העלייה, לפנות (ואקום) פריטים 1.4.2-1.4.4 לפני הצלילה עם משאבת ואקום. אבק ידני באמצעות משאבת ואקום יד או אפילו על ידי מציצה באוויר עם מזרק. עם זאת, לקבלת התוצאות הטובות ביותר, משאבת ואקום טובה מומלצת. lyophilizers התקן קובע ואקום גבוה.
הערה: שים לב מיוחד בעת שימוש צלוחיות שאב גדולות כדי להבטיח שמירה על קצב השאיבה הראשוני מהר לא לזהם את דגימות מי נשף.
- לקבלת דוגמיות נפח קטן (3-20 מ"ל, למשל,-פלנקטון אולטרה לספיקה CYTometry) להשתמש צינורות פלסטיק סטרילי מראש שאב.
- הליכי ניקוי כלי
- לקבלת חומרים אורגניים מומסים NH 4 + ניתוח, השתמש בקבוקונים EPA מראש לנקות חדש.
- שוטף את הבקבוקונים (זכוכית HDPE) לניתוח של חומרים מזינים אחרים, כדלקמן:
- שוטפים את בקבוקונים (זכוכית HDPE) ואת מכסי פוליפרופילן עם מים מזוקקים פעמיים באיכות גבוהה. התקן מחצה סיליקון חדש.
- משרים את בקבוקונים (זכוכית HDPE) ב 10% של HCl במשך 3 ימים לפחות ולשטוף עם מים מזוקקים פעמיים באיכות גבוהה מספיק.
- להתלקחות צלוחיות זכוכית ב -450 מעלות צלזיוס למשך 4 שעות להתקרר בכבשן. התקן את המכסה, ועוטפים בנייר אלומיניום עד השימוש.
- מסנן
- השתמש במסננים סיבי זכוכית קלסר ללא סינון של כל הדגימות אורגני מומס (למשל, DOC, DON) ו לאיסוף חומרים אורגניים חלקיקי (למשל, POC, PON). לארוז כל מסנן זכוכית במעטפת רדיד אלומיניום נפרדת. להתלקחות ב 400 מעלות צלזיוס למשך 2 שעות כדי לנדוף שאריות וחנות אורגניות בתוך כלי נקי ויבש עד שימוש.
- השתמש באחת מסננים סיבי זכוכית קלסר ללא כנ"ל, או ממברנות פוליקרבונט 0.2 מיקרומטר עבור הדגימה מזינים אורגניים (למשל, PO 4 3, NO x -, NH 4 +). נקה את האחרון פעם מותקן בעל מסנן כמוסבר להלן (1.7.3).
- השתמש 0.2 מיקרומטר מסנן ממברנות פוליקרבונט לדגימת סיליקה. נקו אותם פעם installeד ב בעל מסנן כמוסבר להלן (1.7.3).
- הכנת הרכבת סינון
- סנן את התערובת בסיסית מסיסה מאוד של anionic פתרון פעיל שטח בלתי יוני במים המזוקקים פעמים באיכות גבוהה דרך פילטר 0.2 מיקרומטר לפני השימוש בם כדי לנקות את מכלול הסינון.
- סינון הרכבה עבור חומרים מזינים מומסים אורגניים מלבד סיליקה:
- מניחים מסננים סיבי זכוכית קלסר ללא combusted בתוך בעל מסנן Swinney נירוסטה אונליין לנקות.
- השתמש מזרק חומצה לניקוי לרוץ 100 מיליליטר של 5% לתמהיל בסיסי מסיס מאוד של anionic פתרון פעיל שטח בלתי יוני ולאחר מכן 100 מ"ל מים מזוקקים פעמים באיכות גבוהה באמצעות ההרכבה כולה.
- סינון הרכבה עבור SiO 4:
- מניחים את המסנן פוליקרבונט בתוך בעל מסנן פוליקרבונט ניקה (בעל מסנן PC).
- השתמש מזרק חומצה לניקוי לימיןun 30 מ"ל של 5% HCl ו -30 מ"ל מים מזוקקים פעמיים באיכות גבוהה באמצעות ההרכבה כולה.
- הרכבת מערכת
- הרכב את המערכה לעבודה מתחת למים באמצעות צצה (polyether Ether קיטון) צינורות עם קוטר חיצוני (OD) של 1.6 מ"מ ו קוטר פנימי (ID) של 254 מיקרומטר או 177 מיקרומטר.
- השתמש חותך בסכין או הצצה חדה לחתוך את צינורות באורך הנדרש.
- בקצה הדיסטלי שלה (צד מיכל מדגם), להתאים צינור אחד עם מחבר זכר Luer מצורף מחט המזרק. הקפד לבצע את ההפעלה של היצרן וליישר את הצד השטוח של טבעת חזוק flangeless הכחול עם קצה הצינורית לפני הידוק האגוז הירוק.
- צרף הצינורות הצצים לחצובה "נשק" או מניפולטור שהותקן באמצעות סרט בידוד.
- צרף מחט מזרק חד פעמי למחבר Luer זכר. שמור את המחט עם מכסה המגן שלה כדי למנוע פציעות.
- ברור לתייג את הקוד הילוך וצבע הדגימה כל הרכיבים שהיא שואפת ונושפת (למשל, ירוק = ב, אדום = Ex).
- באופן דומה צבע קוד כלי הדגימה עם סטים של כלי דגימה לזווג ממוספרים ברצף.
2. השקעה מתחת למים
- הכין אתר עבודה
- סקר ראשוני וגיוס כוח הדגימות
הערה: בשל אופייה המורכב של פרוטוקול הדגימה מתחת למים, להקדיש את הזמן הדרוש להכנה יבטיח צלילת דגימה יעילה.- סקר באתר העבודה ולעשות הכנות דרושות לפני הזמן.
- בחר וסמן אורגניזמים היעד מתאים שניתן לגשת בקלות יחסית. מכיוון שלא כל האורגניזמים בהכרח להיות פעילים בזמן צלילת הדגימה, להכין יותר תחנות עבודה ממה שאתה מצפה לטעום.
- התקנת משענות בסיס
- when עובד על מצע מפולס:
- הר קליפ השחרור המהיר המקורי של החצובה הגמישה על משקולות צלילת 1 קילו ופשוט למקם אותו ליד חית היעד.
- כשעובדים על קירות אנכיים:
- בסיס תמיכת הר צלחות למערכת VacuSIP, ווי הילוך אבזר, קולבים עבור כלי איסוף נושאת מגש בשלב הכנת עבודה באתר (2.1.1).
- כאשר חצובות נייד וגמיש משמשים, השתמש ברגים או שרף אפוקסי דו-רכיבי לתקן צלחות PVC 10x10 ס"מ ליד כל חיה היעד. כל צלחת צריכה להיות חור לצרף קליפים השחרור המהירים של החצובה הניידת הגמישה.
- לאחר השרף רפא וצלחות הבסיס מחוברות באופן יציב אל הקיר, לדפוק את קטעי שחרור המהירים, משמש נקודת חיבור איתן החצובה הניידת הגמישה למערכת VacuSIP.
- when עובד על מצע מפולס:
- סקר ראשוני וגיוס כוח הדגימות
- התקנת VacuSIP
- בדוק אם הדגימה היא שאיבה ידי שחרור צבע פלואורסצנטי מסוננים שליד פתח נשימתית ולאשר כי צבען הוא המתעוררים דרך פתח exhalent כמתואר יהל et al. (2005) 16.
- התקן את התקן VacuSIP ומקום נשימתית (IN) צינור הדגימה בתוך פתח נשימתית או ממש ליד זה (בתוך ~ 5 מ"מ). ודא כי הצינור נשימתית אינו הקרבה של אחר פתח exhalant.
- בזהירות לכוון את צינור דגימה exhalant (EX) לעבר סיפון osculum / exhalant ובעדינות רבה ולהכניס אותו, עד כי היא ממוצבת 1-5 מ"מ בתוך סיפון osculum / exhalant (ראה איור 1 משלים וידאו 1). להקדיש תשומת לב רבה לא ליצור קשר עם או אחרת להפריע האורגניזם שנדגמו.
- לפני ובמהלך דגימה ולבדוק את המיקום של שני הצינורות.
- לאחר בדיקת הדגימה אם הדגימה עדיין שאיבה כמו described לעיל (2.2.1).
הערה: מכיוון התנועה של זרוע אחת של החצובה כאשר מניפולציה של אחרים, עלול להתעורר, הקפד ראשית במקום צינור הדגימה נשימתית ושנית הצינור exhalant, מחייב מניפולציה מדויקת יותר. בעקבות צו זה, גם אם המניפולציה של צינור דגימת exhalant עלולה לגרום לתנועה של הצינור נשימתית, זה לא ישפיע על הדגימה.
- שיטת הדגימה מתחת למים מודולרי
הערה: ממתינה על שאלת המחקר, כל אחד מן השלבים הניסיוניים להלן ניתן לבצע כניסוי עצמאי. פרוטוקול הדגימה פרופיל מלא מטבולית המתואר להלן הוא תהליך ממושך, המחייב עד 8 שעות הדגימה (עבור סקירה ראה איור 2 ו טבלה 2). כפי תנאים והתקנות צלילה שונים בין אתרי דגימה, אזורים, ומוסדות, תוכניות צלילה אינן נכללות בפרוטוקול זה. אף על פי כן, להקדיש כללי זהירות ושמורות METIתכנון culous לתוכנית צלילה. שים טיפול מיוחד כדי למנוע רוויה ופרופילי צלילת yoyo. במידת האפשר, רצוי לבצע ניסויים אלה בעומק רדוד (<10 מ '). rebreathers במעגל סגור יכול להיות מאוד שימושי עבור תוכניות הדגימה כה ממושכת.- לפני הדגימה בפועל מתחילה, לוודא שאין עקבות גלויות של שאריות והעמסה להישאר וכי משקעים מושעים הוסדרו או נישאים משם.
- Ultra-פלנקטון, (ללא מסנן מותקן בשלב זה!)
- השתמש מחט לנקב את IN (בשאיפה) ו EX (ננשף) שאב septa צינורות פלסטיק סטרילית. אמת המים, כי הוא מטפטפים בשיעור המתוכנן ולאסוף 2-6 דגימות מי מיליליטר.
- ביום אחזור, לשמור דגימות בקופסא קרה על קרח. במעבדה, לשמר עם 1% paraformaldehyde + 0.05% glutaraldehyde כיתת EM (ריכוז סופי), או 0.2% glutaraldehyde כיתת EM. להקפיא cryovials בחנקן נוזלי חנות ב -80 &# 176; C עד הניתוח.
- דגימת סיליקט ואחסון
- התקן את מראש לנקות ב-קו בעל מסנן PC חלד המכיל קרום פוליקרבונט 0.2 מיקרומטר בין מחטי מחבר זכר Luer בקצה הדיסטלי של הצינור.
- פירס את כובע מחצה של הבקבוקונים פוליאתילן בצפיפות גבוהה מראש לנקות (בקבוקוני HDPE) להתחיל דגימה. ודא ששני הדוגמים נוטפים ולאסוף 15 מיליליטר של מים בכל בקבוקון.
- שמור את הדגימות בקירור (4 מעלות צלזיוס) עד ניתוח. אם הניתוח לא יכול להתחיל בתוך שבועיים, ולאחסן ב -20 מעלות צלזיוס. לניתוח, לוודא כי הדגימות מופשרות ב 50 מעלות צלזיוס למשך 50 דקות לפחות לפזר ג'ל סיליקה.
הערה: קרום ניתן לשמר עבור במיקרוסקופ או ניתוח דנ"א לפי הצורך.
- Inorganics מומס (PO 4 3, NO x -, NH 4 +)
- חלף tהוא הרכבת מסנן PC עם בעל מסנן נירוסטה מראש לנקות ב-קו המכיל מסנן זכוכית טרום combusted.
- לפני הדגימה, להבטיח כי לפחות 20 מיליליטר של דגימות מי ים הועבר דרך מערכת הסינון באמצעות EPA, בקבוקוני HDPE או כלי ואקום אחר כדי להפעיל את היניקה. מדוד את נפח המים שנאספו לפני שהן מושלכות.
- פירס את כובע מחצה של צלוחיות זכוכית EPA הראויות להתחיל דגימה, ודא הדוגמים הם נוטפים, ולאסוף 25-30 מיליליטר עבור חנקת וניתוח פוספט.
- Switch to צלוחיות זכוכית EPA חדשות לניתוח אמוניה, ודאו הדוגמים הם נוטפים, ולאסוף 20 מיליליטר בכל בקבוקון.
- שמור את הדגימות בקופסא קרה על קרח ולאחסן ב -20 ° C עד הניתוח.
הערה: אם רק התסנין הוא עניין, מסנני מזרק חד פעמיים יכולים לשמש צעדי 2.3.3 ו 2.3.4.
- חומרים אורגניים מומסים (DOC + DON) דגימה stאורינג
הערה: שמור את הדגימות זקופות ככל האפשר ברחבי טיפול כך המים מדגמים לא באים במגע עם septa סיליקון.- המשך באמצעות הרכבת מסנן הנירוסטה לאסוף 20 מיליליטר של דגימות מי ים לתוך צלוחיות זכוכית EPA חדשות, כמתואר לעיל.
- עם שליפה, לשמור על הדגימות בקופסא קרה על קרח. במעבדה, להשתמש פיפטה פסטר זכוכית טרום combusted לתקן את הדגימות עם חומצה זרחתית (להוסיף 5-6 טיפות של חומצת כיתת מתכת עקבות 25% לתוך מדגם 20 מיליליטר, ריכוז סופי של 0.04%) או חומצה הידרוכלורית (להוסיף 2 טיפות עקבות של מתכת כיתה מרוכזת חומצה לתוך מדגם 20 מיליליטר, ריכוז סופי 0.1%) ולשמור בקירור.
- שמור את הדגימות בקירור (4 מעלות צלזיוס) עד ניתוח. אם דגימות אינן מנותחות בתוך שבוע של אוסף, ולאחסן ב -20 ° C עד הניתוח.
- החומר החלקיקי אורגני (POC, PON, POP)
- המשך באמצעות stainless הרכבה מסנן פלדה מסנן לפחות 500 מ"ל של מי ים לתוך תרמוס פונו 250 מ"ל. החלף צלוחיות במידת הצורך.
- ביום אחזור, להשתמש במזרק אוויר המלא לפנות את כל מי ים הנותר מבעל המסנן, לעטוף אותו בנייר אלומיניום, ולאחסן בקופסא קרה על קרח. במעבדה, הסר את המסננים ממחזיקי המסנן ולאחסן ב -20 ° C עד הניתוח.
- לפני הדגימה בפועל מתחילה, לוודא שאין עקבות גלויות של שאריות והעמסה להישאר וכי משקעים מושעים הוסדרו או נישאים משם.

איור 1. דוגמא של מתקנים הנכונים של VacuSIP: (א) דגימת mytiligera ascidian Polycarpa (מפרץ עקבה, ים אדום) באמצעות מניפולטור מובנה מותאם אישית עם קוד הצבע המשמש ירוק בשאיפה וצהובה עבור דגימות מים ננשפות (צילום על ידי טום Shelizenger ויובל יעקובי); (ב) דגימה של oroides ספוג Agelas (NW התיכוןים) עם רוחב osculum של 3 מ"מ, באמצעות מכשיר VacuSIP. קוד הצבע המשמש הוא צהוב בשאיפה ואדומה עבור דגימות מים ננשפות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. סקירה כללית של טכניקת VacuSIP כמתואר בסעיף בפרוטוקול. העבודה במעבדה מיוצגת קופסות צהובות, עבודת השדה בקופסות כחולות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
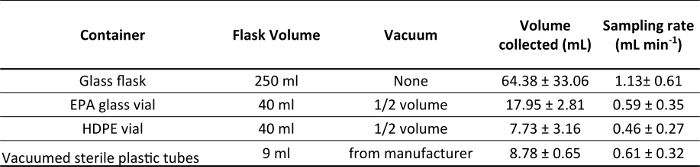
טבלת 1. שיעורי הדגימה הממוצעים הכולל (מיליליטר דקות -1) שהושגו עם מיכלים שוניםהמשמש אוספים מים ורמות ואקום שונים: צלוחיות לא שאב (ללא); צלוחיות זכוכית EPA ו- בקבוקוני HDPE היו שאב חצי מנפחם (½ נפח); צינורות פלסטיק סטרילי כבר שאבו ידי היצרן. עבודה בעומק 5-8 מ ', טמפרטורת מים של 18-22 מעלות צלזיוס, באמצעות צינורות הצצה באורך 79 סנטימטר של 25 מיקרומטר קוטר פנימי.
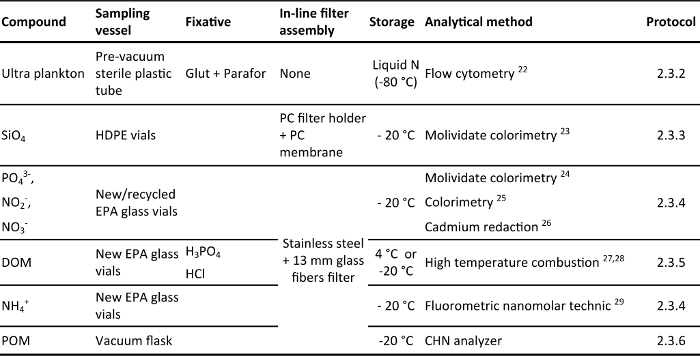
סקירה טבלה 2. של כלי הדגימה, מקבע, ב-קו מסנן הרכבה, אחסון ושיטות אנליטיות כמתואר בסעיף בפרוטוקול. תרכובות ניתח הם: שפע אולטרה-פלנקטון (פלנקטון <10 מיקרומטר), סיליקט (SiO 4), פוספט (PO 4 3-), ניטריט + ניטראט (2 NO - + NO 3 -), מומס חומר אורגני (DOM), אמוניום (NH 4 +) ו חומר אורגני חלקיקי(POM). כל כלי הדגימה שיש כובע סיליקון מחץ והם שאבו לפני הדגימה. Fixatives הם: paraformaldehyde + glutaraldehyde (שפע + Parafor), חומצה זרחתית (H 3 PO 4) וחומצה הידרוכלורית (HCl). מכלולים המסנן אונליין בהם נעשה שימוש הם: בעלי מסנן פוליקרבונט קרום פוליקרבונט 0.2 מיקרומטר מסננים (בעל מסנן PC + קרום PC) ומחזיקי מסנן נירוסטה סיבי זכוכית נטולת קלסר מסנני GFF.
תוצאות
אופטימיזציה של שיטות איסוף מי ים
מבחר צלוחיות אספן הליך הניקוי
VacuSIP תואמים כלי איסוף צריכים מחצה המאפשר דגימה שאותה יוזמת פירסינג עם מחט מזרק. הם צריכים לעמוד בלחץ מתחת למים הגבוהים (2-3 ברי צלילה טיפוסית עובדת במעמקים), וצריכים להחזיק ואקום. רב (אך לא כל המותגים) של בקבוקונים אושרו על ידי ה- EPA לניתוח חומרים אורגניים נדיפים עומדים בקריטריונים אלה. בקבוקונים מראש לנקות מאושר DOC וניתוח DON זמינים גם. כדי לבדוק את התאמתו של בקבוקונים אלה לאיסוף וניתוח של חומרים מזינים כדי לייעל תהליכי ניקוי, מים מזוקקים פעמיים באיכות גבוהה נאסף צינורות פוליפרופילן חומצה לניקוי (צינורות PP), רכשה לאחרונה, בתוך cid לניקוי בקבוקונים עשויים פוליאתילן בצפיפות גבוהה (HDPE בקבוקונים), ואת צלוחיות זכוכית EPA, כולם מצוידים עם כובע מחצה polytetrafluoroethylene (PFTE). צלוחיות HDPE וצינורות פוליפרופילן נוקו כמפורט בסעיף 1.5.2 לעיל, ואת צלוחיות זכוכית EPA נוקו על ידי היצרן.
כמות NH 4 + נמצא צלוחיות זכוכית EPA הייתה מזערית יחסית (≤ 0.1 μmol ל -1) ו תלויה באיכות תקן מים מזוקקים פעמיים באיכות גבוהה. לעומת זאת, NH 4 + ריכוזים גדלו באופן משמעותי (עד פי 3 ו -7, בהתאמה) והציגו השתנות גבוהה צינורות פוליפרופילן חומצה-ניקו צלוחיות פוליאתילן בצפיפות גבוהה (ANOVA F (5,53) = 7.183, p < 0.001, איור 3). לא היתה השפעה של מגע מים מזוקקים פעמיים באיכות גבוהה עם מחצה סיליקון על ניתוח אמוניום.
o: keep-together.within-page = "1"> השוואה בין צלוחיות זכוכית חדשות מול צלוחיות זכוכית לנקות / ממוחזר
כדי לבדוק אם צלוחיות זכוכית EPA יכולות להיות מנוצלות עבור ניתוח מזין יותר מפעם אחת, NO x -, PO 4 3, ו NH 4 + ריכוזים בדגימות מי ים שנאספו צלוחיות זכוכית חדשות EPA הושוו לאלה שנאספו צלוחיות זכוכית EPA משומשות. צלוחיות הזכוכית החדשות EPA היו מראש לנקות על ידי היצרן, בעוד צלוחיות זכוכית הממוחזרות נוקו כפי שתוארו לעיל (1.5.2). בקבוקונים ממוחזרים היו ריכוז גבוה + NH 4 משמעותי, עד 1.5 לקפל את הרמה נמצאת צלוחיות זכוכית חדשות (מבחן t, p <0.001, n = 5). לא נמצאו הבדלים משמעותיים ב NO x - ו PO 4 3 תוכן בין הדגימות שנאספו בקבוקונים ממוחזרים הדגימות שנאספו זכוכית חדשהבקבוקונים (איור 4).
אוסף סיליקט ונהלים לאחסון
כדי לקבוע את כלי הדגימה הטוב ביותר לניתוח סיליקט, מים מזוקקים פעמים באיכות גבוהה נאספו הלא ניקה צינורות פוליפרופילן חומצה לניקוי (צינורות PP), צלוחיות פוליאתילן חומצה לניקוי בצפיפות גבוהה (בקבוקוני HDPE), ו צלוחיות זכוכית EPA. ריכוז סיליקט הצפוי היה קרוב לאפס, כך ערכים שחרגו מהריכוז הצפוי נחשבו מזוהם. ריכוז סיליקט שונה משמעותית בין דגימות שנאספו בקבוקונים שונים (ANOVA, F (3,19) = 210.047, p <0.001), מראה את ריכוז SiO 4 הנמוך ביותר צלוחיות HDPE לניקוי חומצה. צלוחיות זכוכית בורוסיליקט מזוהמות הדגימות, עם ריכוז SiO 4 הסופי הגדלה בשיעור של עד 7 μmolל -1 (איור 5).
מבחר מנגנון סינון עבור חומר אורגני מומס (DOM) וניתוח מזין
כדי לקבוע אילו מכשירי סינון מייצרת את ריק הנמוך ביותר בניתוח מומס אורגני (DOC ודון) וחומרים מזינים אורגניים (NO x -, NH 4 +, PO 4 3), בעלי מסנן נירוסטה הושוו פוליקרבונט אונליין Swinney בעלי מסנן. עם כל סוג בעל מסנן שבדקנו הוא קרום פוליקרבונט ולסנן סיבי זכוכית טרום combusted. השילוב של בעל מסנן נירוסטה מסננת סיב זכוכית combusted ספק את החסר הנמוך ביותר, ואילו בעל מסנן פוליקרבונט Swinney מצויד קרום פוליקרבונט מזוהם בבירור הדגימות של עד 9 לקפל. הגדלת כרכים לשטוף עשה לא לפתור בעיה זו (איור 6).

איור 3. ריכוז אמוניום (μmol ל -1, SD ± הממוצע) שנאספו עם בקבוקונים שונים: (1) בקבוקון uncleaned HDPE; (2) נוקה בקבוקון HDPE; (3) נוקה HDPE בקבוקון + Parafilm; (4) בקבוקון זכוכית EPA; (5) בקבוקון זכוכית EPA + Parafilm; (6) נוקה צינור PP. את parafilm הוצב כדי לבדוק אם מחץ סיליקון עלול לזהם את דגימות מים. עבור כל טיפול 9 דגימות של מים מזוקקים פעמיים באיכות גבוהה נותחו. הדגימות נותחו טריות. נמצאו הבדלים משמעותיים בין ארבעה כלי הדגימה (ANOVA, F (5,53) = 7.183, p <0.001, מבחן כוח = 0.992). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
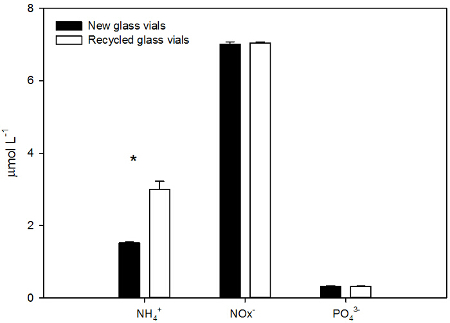
איור 4. אמוניום (NH 4 +), ניטריט + ניטראט (NOx -), והפוספט (PO 4 3) ריכוזים (μmol ל -1, SD ± הממוצע) של דגימות מי ים שנאספו (כהה) חדש וממוחזרים / ניקה (לבן) צלוחיות זכוכית EPA. מי ים נאסף על אזור ניסיוני Aquaria של לשכת המדע ימית סונן עם בעל מסנן נירוסטה פילטר זכוכית. דגימות המים נותחו טריות. הכוכבית (*) מציינת כי ההבדל הוא משמעותי (מבחן t, p <0.001, n = 5, מבחן כוח = 1). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
.jpg "/>
איור 5. ריכוז סיליקט (μmol ל -1, SD ± הממוצע) באיכות גבוהה שנאספו מים כפולים מזוקקים בתוך מבחנות שונות: צינורות PP-ניקה חומצה, צינורות PP, בקבוקוני HDPE לניקוי חומצה, צלוחיות זכוכית EPA חדשות. נמצאו הבדלים משמעותיים בין ארבעת החומרים סמפלר (ANOVA, F (3,19) = 210.047, p <0.001, מבחן כוח = 1). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 6. בחינת ההשפעה של מכלולי סינון שונים ולשטוף כרכים על ניטריט + ניטראט (NO x - μmol ל -1). דוגמאות עבור NO x - התקבלו על ידי סינון דגימות מי ים עם נירוסטה (SS fבעל ilter) או פוליקרבונט אונליין בעלי מסנן Swinney (בעל מסנן PC) מצויד גם קרום פוליקרבונט (מסנן PC) או מסננים סיבי זכוכית טרום combusted. עבור מסנני PC, כרכים שונים (10, 30, 60, 90 ו -120 מיליליטר) של 5% HCl ואיכות גבוהה מים כפולים מזוקקים שמשו לרחיצת ההרכבה המסננת, היקף הכביסה ניתן בסוגר אגדת הדמות. ערכים באים לידי ביטוי כמו ממוצע ± סטיית תקן (n = 5). מי ים נאסף על אזור ניסיוני Aquaria של הלשכה למדעי ים ואת הדגימות נותחו טריות לאחר הסינון. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
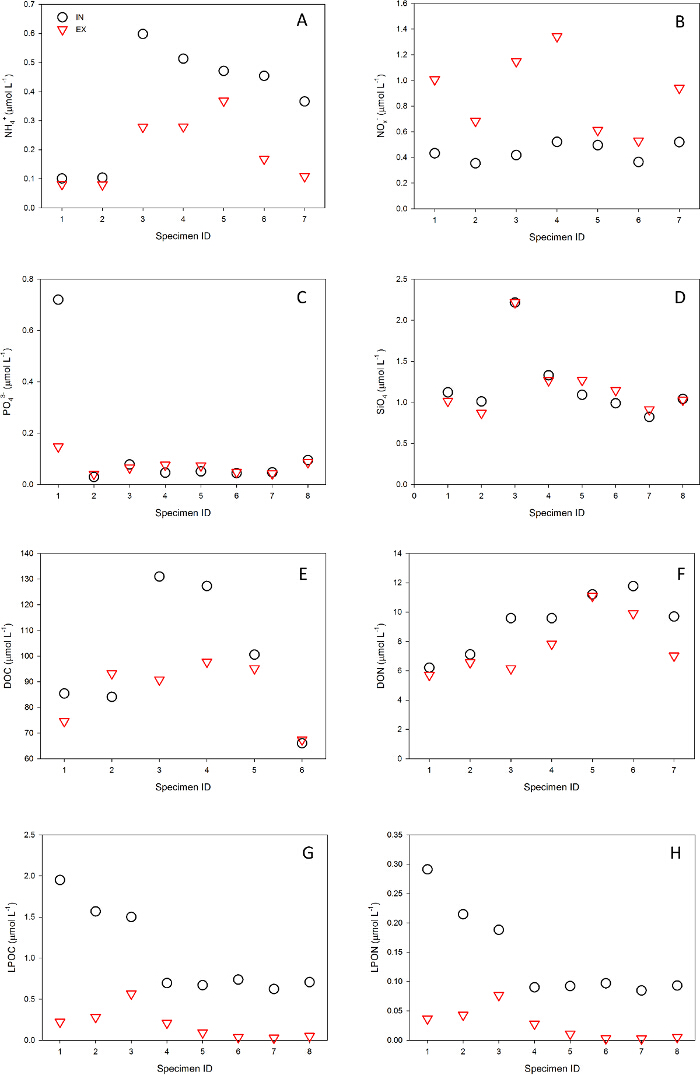
איור 7. דוגמה של תוצאות הניסוי: בשאיפה (IN, שחורמעגל) ונשף (EX, משולש אדום) לזווג ריכוזי דגימת מים (-1 L μmol) של חומרים שונים מעובדים על ידי הספוג Chondrosia reniformis בים התיכון: (א) אמוניום (NH 4 +); (ב) ניטריט + ניטראט (NOx -); (C) פוספט (PO 4 3); (ד) סיליקט (SiO 4); (E) מומס פחמן אורגני (DOC); (F) מומס חנקן אורגני (דון); (G) פחמן אורגני planktonic (LPOC); (H) חנקן אורגני planktonic (LPON). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 8. דוגמא זרימת cytomניתוח לאופטומטריסטים של דגימות מים לזווג שנשאבו המים בשאיפה (A, C, E, G) ונשף (B, D, F, H) על ידי הספוג Chondrosia reniformis: (A, B, C, D) אוכלוסיות הפיטופלנקטון; (E, F, G, H) חיידקים heterotrophic. ב AB ו EF הדגימה הייתה נקייה ומדויקת (כל הקבוצות planktonic נשמרו בצורה יעילה). CD ו- GH הם דוגמאות של זיהום מים ננשף, מראות הסרה נמוכה של כל קבוצות planktonic. Syn:. Synechococcus sp, pico: picoeukariotes אוטוטרופי, ננו: nanoeukaryotes אוטוטרופי, גבוה: חיידקים heterotrophic עם תוכן DNA גבוה, נמוך:. חיידקים heterotrophic עם תוכן DNA נמוכה אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Figur משלימהיעילות השמירה דואר 1. תא טרף planktonic שונים על ידי Pacifica צדפה חמא: sp פרוכלורוקוקוס. (פרו), sp Synechococcus. (Syn), פיקו-אאוקריוטים (פיקו Euk), ננו-אאוקריוטים (Nano Euk). ברי שגיאה = 95% CI. אנא לחץ כאן כדי להוריד את הקובץ.
וידאו משלים 1. דגימת mytiligera ascidian Polycarpa באמצעות מניפולטור שהותקן עם קוד הצבע המשמש ירוק בשאיפה וצהובה עבור דגימות מים ננשפות. צינורות דגימה (פיק, מזהה 54 מיקרומטר, 75 סנטימטרים) ממוקמים בזהירות סיפוני exhalant ו נשימתית של ascidian. המים מאשר להיגרר צינורות פונו בשיעור של ~ 1 מ"ל דקות -1. בהפגנה זו צבע פלואורסצנטי משמש כדי להמחיש את סילון exhalant. ראוי לציין, כי צינור הדגימה exhalant מושם wi היטבדקת סילון exhalant. אנא לחץ כאן כדי להוריד את הקובץ.
Discussion
פעולות הכנה
אספן בקבוקונים עבור DOM וניתוח מזין
מאז כלי אספן עשוי אינטראקציה עם המרכיבים מיקרו מומס והקירות סמפלר עשוי להיות מצע לחיידקים צמיחה 30-34, בקבוקונים שונים עבור DOM ואיסוף מזין נבדקו. בורוסיליקט אינה מומלצת כימות סיליקה 33,35, מאז בקבוקי זכוכית יכול להגדיל את הריכוז הראשוני של סיליקה ידי עד שני לקפל אם הדגימות לא מוקפאים במהירות 30. תוצאות המחקר מראות כי באמצעות מבחנות מראש לנקות EPA תוצאה חסר ריכוז נמוך עבור DOC, DON, וחומרים מזינים אורגני, בעיקר עבור אמוניום.
סינון ואחסון DOC
סינון הוא נדרש, ובמקרים רבים, הוא הצעד הראשון אנליטי בכימיה ימיתמִיקרוֹבִּיוֹלוֹגִיָה. למרות זאת, ניתן לסנן את הדגימות לאחר איסוף במעבדה, הליך זה אינו מומלץ לעבודה באתרו, שבו דגימות נאספות מתחת למים, בדרך כלל במקומות נידחים, שעות או ימים הרחק מתקני מעבדה נכונים. השימוש ב-קו, סינון באתרו ממזער טיפול מדגם ובכך מקטין את הסיכון לזיהום. בשנת הסינון באתרו גם מסיר את רוב החיידקים מפחית את הסיכון כי הרכב המדגם יהיה שונה על ידי מטבוליזם בקטריאלי במהלך הדגימה והתחבורה הממושכות זְמַן. עצרת הסינון מגדילה את הנפח המת של מנגנון הדגימה יכולה להיות גם מקור הזיהום. מבחר של בעלי המסנן הקטנים ביותר האפשרי (למשל, ב-קו Swinney מסנן בעל 13 מ"מ) צינורות צצים דקות (למשל, 254 מיקרומטר ID) מקטין את הנפח מת ואת הסיכון של זיהום על ידי מי סביבה.
אם המסנן הנכון הוא לאבשימוש או אם הוא לא שטף בזהירות, חפצים וזיהום של דגימות המים צפויים להופיע 32,36-39. מחקרים של ניתוח DOC הראו כי מסננים ומחזיקי מסנן עשויים תרכובות אורגניות (פוליקרבונט PFA-PTFE) עלולים לגרום לזיהום חמור DOC 32,37, במיוחד כאשר לא סמוקים היטב במים מזוקקים פעמים באיכות גבוהה 38. הפרוטוקול הנוכחי והתוצאות בהתאם להנחיות אלה גם עולה כי בעלי מסנן פוליקרבונט יש להימנע.
בעבודה באתרו interoperation
מערכת VacuSIP היא טכניקת דגימה ישירה המאפשרת לחקר מטבוליזם של מתקני האכלת השעיה ללא הפרעה לסביבה הטבעית שלהם ואת כימות של התפקיד האקולוגי שלהם במערכת. לצוללים מנוסים ומצוידים, היישום של השיטה VacuSIP הוא פשוט דורש TR קצר בלבדaining. ניסויי INEX VacuSIP מיועדים ניתוח סטטיסטי 'within'-עיצוב (כלומר, ניתוח מדד זיווג או חוזר ונשנה), ובאופן זה לשלוט עבור רוב החפצים אנליטי כולל חסר גבוה. שימוש יניקה מבוקרת מבטיח שיעורי דגימה איטיים מתכווננת, ובכך למנוע זיהום בשוגג של מי נשף במי סביבה. במידת ההאפשר, את הבחירה של אתרי עבודה עם עכירות נוכחית נמוכה נמוכה מומלצת ותבטיח נקיות ומדויקות יותר תוצאות. שעת הדגימה הממושכת (דקות עד שעות) מאפשרת שילוב של מעשה טלאים הגבוהים מאפיינת שכבת גבול benthic. כל התכונות הללו להבטיח שכאשר כראוי להחיל את שיטת VacuSIP היא חזקה מאוד, מתן תוצאות אמינות שאפשר לשכפל גם כאשר עובד עם מספר קטן של חזרות. דוגמא לתוצאות טיפוסיות המתקבל ספוג תיכון ומיני צדפת Indo-Pacific מוצגת באיור 7 ו Supplementary איור 1.
כמו עם כל טכניקה, VacuSIP אינה חפה בעיות פוטנציאליות. הבעיה הנפוצה ביותר היא זיהום של דגימת המים ננשפה במי סביבה. סיבות חפצות אלו כוללות קצב שאיבה גבוהה, dislodgments צינור, והתנהגות בעלי חיים. בחירה נכונה של קצב הדגימה הנכון היא תלוי אומדנים קודמים של קצב זרימת excurrent. הערכות אלו ניתן להשיג על ידי שימוש בשיטת המהירות מול לצבוע 16. באופן אידיאלי, שיעור היניקה צריך להישמר מתחת 1% של קצב השאיבה (למשל, 1 מיליליטר דקות -1 שעה L 6 -1 שאיבת שיעור). כדי למנוע זיהום במי סביבה, קצב דגימה לא צריך להיות גדול מ -10% של קצב השאיבה.
כדי לשלוט על קצב הדגימה, האורך והקוטר הפנימי של צינור הצריכה צריך להיות מותאם לפי עומק העבודה המתוכננת ואת טמפרטורת מים. משוואת האגן-Poiseuille (ראה סעיף 1.3.1 לעיל) עשויים לשמש כמדריך. עם זאת, המשוואה הזאת צריכה להיחשב קירוב מסדר ראשון מאז ΔP וירידת דגימת שיעור עם זמן דגימת אונליין סינון מוסיף ודאות. השימוש במיכלים פונו, לפעמים עם לחצי ואקום ידועים, מציג סיבוכים נוספים. דוגמה לאופן שבו שיעורי דגימה משתנה כפונקציה של מכולות פונו שונים עם ואקום שונים, מוצג בטבלה 1.
הקטנת שיעור דגימת המושגת בקלות על ידי התאמת אורך הצינור זהה, ללא מגבלות טכניות להנחה זו (שיעורי דגימה של כמה מיקרוליטר לשעה הם ריאליים). אף על פי כן, הנסיינים צריכים להיות מודעים את קצב הדגימה האיטי שהכתיב מגבלה זו לבעלי חיים עם קצב שאיבה איטי עבור אורגניזמים קטנים או דגימות. המשמעות המיידית של קצב דגימה האיטי היא הכמות המוגבלת של מים שניתן לגבות במהלך sessi דגימה אחתעַל. נפח נמוך זה יגביל את מספר הניתוחים משכפל כי ניתן להפיק דגימות אלה, ויהיה ובכך להגביל את המידע שניתן להשיג מאוכלוסיות אלה.
שליפה Tube ניתן הבחין בקלות הדגימה ניתן להפסיק או להפעיל מחדש, ובלבד צולל משגיחה מתמיד. לעומת זאת, הפסקת השאיבה במהלך הדגימה היא לא תמיד קל לזהות. הדבר נכון לא רק עבור ספוגים, אלא גם עבור tunicates, צדפות, ורב-שעירים. למעשה, ובניגוד לדעה הרווחת, אירועים שבו ascidian או צדפה הפסיקו שאיבה תועדו ללא שינוי נראה לעין בגיאומטריה סיפון (יהל, נתונים שלא פורסמו). יתר על כן, במקרים מסוימים, tunicates יכול לשמור שאיבה פעילה ללא הפרשת רשת (כלומר, ללא סינון מתקיים).
שליטה על קצב הדגימה היא קריטית. מבחינה זו VacuSIP הוא טוב יותר מאשר שיטות אחרות, במיוחד כאשר חי המחקר הן relativאיליי קטנים או כשהם לשאוב לאט. מזרקים במיוחד קשה לשלוט 2. למשל, Perea-Blazquéz ועמיתיו (2012a) 40 בשימוש מזרק כדי לטעום את המים נשף ידי כמה מינים ספוג ממוזג ובאופן מפתיע לא מצאתי תבנית כללית של בליעה / הפרשת חומרים מזינים בפרט (NO 2 -, NO 3 -, NH 4 +, PO 4 3, SiO 4). היעדר דפוס ברור הוא כנראה תוצאה של זיהום של הדגימות ננשפו במי סביבה עקב שימוש במזרק. זיהום ניכר מן יעילות השמירה נמוכות מאוד של פלנקטון פיקו שדווח על ידי Perea-Blázquez ועמיתיו (2012b) 41 עבור ספוגים שלהם: 40 ± 14% של חיידקים heterotrophic ו -54 ± 18% של Synechococcus sp. לשם השוואה, באמצעות VacuSIP, מולר et al. (2014) 21 דיווחו על יעילות הסרת חיידקי heterotrophic של72 ± 15% ב sp Siphonodictyon. ו -87 ± 10% ב Cliona delitrix.
כדי לוודא איכות מדגם ולהבטיח שאף זיהום של מי הסביבה מתרחש, אנו ממליצים בחום קודם לנתח דגימות פיקו ננו פלנקטון באמצעות cytometry זרימה. ניתוח מהיר, אמין, וזול זה יספק מידע מיידי של איכות המדגם. זה נפוץ מאוד עבור כמה מיני טרף כגון Synechococcus sp. להסירו על קרוב ל 90% יעילים 14,42 ידי ספוגי ascidian. סטיות משמעותיות בין אמת המידה הזו מראות כי זיהום שאולי התרחש (איור 8).
עבור דגימה אמינה ונקיה, לוודא ממלא עיצוב הניסוי שבעה כללים פשוטים: (1) לבצע סקר מקדים (כולל שאיבת הערכות שיעור) ולהכין את worksite היטב; (2) לדעת החיות למדו; (3) לוודא כי הדגימה למדה יש צוהר excurrent מוגדר היטבnd במיקום נגיש; (4) לוודא את הדגימה למדה שאיבה לפני ואחרי כל אוסף מדגם; (5) במקום הצינור לאיסוף המים ננשפים מעט בתוך צמצם excurrent (איור 1); (6) להשתמש קצב דגימה <10% של קצב זרימת excurrent, 1% מומלץ מאוד; (7) להגדיר קריטריון איכות להשמיט זוגות INEX חשד.
בעקבות כללים פשוטים אלה, מערכת VacuSIP מציעה שיטה מעשית ואמינה למדידה איך חלקיקי תהליך ניזונים השעיה פעילים ותרכובות מומסות בתנאים טבעיים, המאפשרים אומדנים מדויקים דומים היכול לשמש כדי להעריך את התפקיד הפונקציונלי של ניזונים מסננים במערכות אקולוגיות שונה ברחבי העולם.
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים Manel בוליבר עזרתו עבודת השדה. אנו מודים "מונטרי דל טבעי Parc, les Illes ומדי i el Baix Ter" על תמיכתם הרשאות מחקר ודגימה שלנו. המניפולטור מתחת למים תוכנן על ידי איילת דדון-פילוסוף מפוברק על ידי מר פילוסוף. עבודה זו נתמכה על ידי פרוייקט ממשלת ספרד CSI-אלמוג [מספר מענק CGL2013-43106-R כדי RC ומר] ועל ידי המילגה FPU מ "Ministerio דה Educacion, קולטורה y Deporte (MECD)" כדי TM. זוהי תרומה מן Biogeochemistry הימי וקבוצת מחקר גלובל שינוי הממומנת על ידי ממשלת קטלאנית [מספר מענק 2014SGR1029] ומענק ISF 1280-1213 מענק ו BSF 2,012,089 ל G. יהל.
Materials
| Name | Company | Catalog Number | Comments |
| GorillaPod, Original | Joby | GP000001 | flexible portable tripod |
| Flangeless Ferrule | IDEX Health & Science | P-200X | 1/16" in Blue/pk |
| Male Nut | IDEX Health & Science | P-205X | 1/16" in Green/10 pk |
| Female to Female Luer | IDEX Health & Science | P-658 | |
| Female-Male Luer | IDEX Health & Science | P-655 | |
| Peek Tubing (254 µm ID) | IDEX Health & Science | 1531 | 1/16" OD x 0.01 in ID x 5 ft length. Alternative ID can be used. |
| Two component resin epoxy | IVEGOR | 9257 | Mix well the two component resin before use |
| (TOC) EPA Vials | Cole -Parmer | 03756-20 | 40 ml glass vials. Manufactured also by Thomas Scientific (ref. number 9711F09). |
| HDPE Vials | Wheaton | 986701 (E78620) | 20 ml high-density polyethylene vials |
| Vacuette Z no additive | Greiner bio-one | 455001 | pre-vacuum by the manufacturer |
| Septum Sample Bottles | Thomas Scientific | 1755C01 | 250 ml glass bottles |
| Septum Cap 1 | Wheaton | W240844SP (E7865R) | 22-400 for HDPE vials |
| Septum Cap 2 | Wheaton | W240846 (1078-5553) | 24-400 for glass vials and bottles. Also manufactured by Thermo Scientific National (ref. 03-377-42). |
| In-line stainless steel Swinney Filter holders | Pall | 516-9067 | 13 mm of diameter |
| PTFE Seal Washer | Pall | 516-8064 | ring for stainless steel filter holders |
| TCLP Glass Filters | Pall | 516-9126 | binder-free glass fiber filters, 13 mm of diameter, pore size 0.7 µm |
| Polycarbonate Filter Holders | Cole -Parmer | 17295 | 13 mm of diameter |
| Isopore Membrane Filters | Millipore | GTTP01300 | 13 mm of diameter, pore size 0.2 µm |
| Contrad 70 Solution | Decon Labs | 1002 | highly soluble basic mix of anionic and non-ionic surfactant solution |
| Sterile Syringe Filters | VWR International Eurolab S.L. | 514-0061P | 25 mm of diameter , pore size 0.2 µm |
| Fluorescein | Sigma-Aldrich | (old ref.28802) 46955-100G | 100 g |
| Holdex, disposable,sterile | Greiner bio-one | 450263 | sterile, single-use tube holder with off-center luer for Vacuette |
| Sterile Needles | IcoGammaPlus | 5160 | 0.7 mm x 30 mm |
| Cryovials Nalgene | Nalgene | V5007(Cat. No.5000-0020) | 2 ml |
| Cryobox carton | Rubilabor | M-600 | 145x145x55 mm p/microtube 1.5 ml |
| Orthophosphoric Acid | Sigma | 79617 or Alternatively use Ultra-Pure Hydrochloric acid, final concertation 0.1% | |
| Paraformaldehyde | Sigma | P6148 | 500 g |
| Glutaraldehyde | Merck | 8,206,031,000 | 25%, 1 L |
| Hand Vacuum Pump | Bürkle | 5620-2181 or Alternatively use standard laboratory vacuum pump |
References
- Gili, J. M., Coma, R. Benthic suspension feeders: their paramount role in littoral marine food webs. Trends. Ecol. Evol. 13 (8), 316-321 (1998).
- Reiswig, H. In situ pumping activities of tropical Demospongiae. Mar. Bio. 9, 38-50 (1971).
- McMurray, S., Pawlik, J., Finelli, C. Trait-mediated ecosystem impacts: how morphology and size affect pumping rates of the Caribbean giant barrel sponge. Aquat. Bio. 23 (1), 1-13 (2014).
- Pile, A. J., Young, C. M. The natural diet of a hexactinellid sponge: benthic-pelagic coupling in a deep-sea microbial food web. Deep-Sea Res. Pt. I. 53 (7), 1148-1156 (2006).
- Nielsen, T., Maar, M. Effects of a blue mussel Mytilus edulis bed on vertical distribution and composition of the pelagic food web. Mar. Ecol. Prog. Ser. 339, 185-198 (2007).
- De Goeij, J. M., et al. Surviving in a marine desert: the sponge loop retains resources within coral reefs. Science. 342, 108-110 (2013).
- Maldonado, M., Ribes, M., van Duyl, F. C. Nutrient Fluxes Through Sponges. Biology, Budgets, and Ecological Implications. Advances in Marine Biology. 62, (2012).
- Riisgård, H. U. On measurement of filtration rates in bivalves - the stony road to reliable data: review and interpretation. Mar. Ecol. Prog. Ser. 211, 275-291 (2001).
- Reiswig, H. M. Water transport, respiration and energetics of three tropical marine sponges. J. Exp. Mar. Biol. Ecol. 14, 231-249 (1974).
- Jiménez, E., Ribes, M. Sponges as a source of dissolved inorganic nitrogen: nitrification mediated by temperate sponges. Limnol. Oceanogr. 52 (3), 948-958 (2007).
- Diaz, M. C., Ward, B. Sponge-mediated nitrification in tropical benthic communities. Mar. Ecol. Prog. Ser. 156, 97-107 (1997).
- Ribes, M., Coma, R., Gili, J. Natural diet and grazing rate of the temperate sponge Dysidea avara (Demospongiae, Dendroceratida) throughout an annual cycle. Mar. Ecol. Prog. Ser. 176, 179-190 (1999).
- Jiménez, E. Nutrient fluxes in marine sponges: methodology, geographical variability and the role of associated microorganisms. , Universitat Politècnica de Catalunya. Barcelona. PhD thesis (2011).
- Reiswig, H. M. Particle feeding in natural populations of three marine demosponges. Biol. Bull. 141 (3), 568-591 (1971).
- Reiswig, H. M. In situ pumping activities of tropical Demospongiae. Mar. Biol. 9 (1), 38-50 (1971).
- Yahel, G., Marie, D., Genin, A. InEx - a direct in situ method to measure filtration rates, nutrition, and metabolism of active suspension feeders. Limnol. Oceanogr-meth. 3, 46-58 (2005).
- Genin, A., Monismith, S. S. G., Reidenbach, M. A., Yahel, G., Koseff, J. R. Intense benthic grazing of phytoplankton in a coral reef. Limnol. Oceanogr. 54 (2), 938-951 (2009).
- Yahel, G., Whitney, F., Reiswig, H. M., Leys, S. P. In situ feeding and metabolism of glass sponges (Hexactinellida , Porifera) studied in a deep temperate fjord with a remotely operated submersible. Limnol. Oceanogr. 52 (1), 428-440 (2007).
- Wright, S. H., Stephens, G. C. Removal of amino acid during a single passage of water across the gill of marine mussels. J. Exp. Zool. 205, 337-352 (1978).
- Møhlenberg, F., Riisgård, H. U. Efficiency of particle retention in 13 species of suspension feeding bivalves. Ophelia. 17 (2), 239-246 (1978).
- Mueller, B., et al. Natural diet of coral-excavating sponges consists mainly of dissolved organic carbon (DOC). PLoS ONE. 9 (2), e90152(2014).
- Gasol, J. M., Moran, X. A. G. Effects of filtration on bacterial activity and picoplankton community structure as assessed by flow cytometry. Aquat. Microb. Ecol. 16 (3), 251-264 (1999).
- Koroleff, F. Determination of reactive silicate. New Baltic Manual, Cooperative Research Report Series A. 29, 87-90 (1972).
- Murphy, J., Riley, J. P. A. Modified single solution method for the determination of phosphate in in natural waters. Anal. Chim. Acta. 27, 31-36 (1962).
- Shin, M. B. Colorimetric method for determination of nitrite. Ind.Eng.Chem. 13 (1), 33-35 (1941).
- Wood, E. D., Armstrong, F. A. J., Richards, F. A. Determination of nitrate in sea water by cadmium-copper reduction to nitrite. J. Mar. Biol. Assoc. U. K. 47 (1), 23-31 (1967).
- Sharp, J. H., et al. A preliminary methods comparison for measurement of dissolved organic nitrogen in seawater. Mar. Chem. 78 (4), 171-184 (2002).
- Sharp, J. H. Marine dissolved organic carbon: Are the older values correct. Mar. Chem. 56 (3-4), 265-277 (1997).
- Holmes, R. M., Aminot, A., Kerouel, R., Hooker, B. A., Peterson, B. J. A simple and precise method for measuring ammonium in marine and freshwater ecosystems. Can. J. Fish. Aquat. Sci. 56 (10), 1801-1808 (1999).
- Degobbis, D. On the storage of seawater samples for ammonia determination. Limnol. Oceanogr. 18 (1), 146-150 (1973).
- Tupas, L. M., Popp, B. N., Karl, D. M. Dissolved organic carbon in oligotrophic waters: experiments on sample preservation, storage and analysis. Mar. Chem. 45, 207-216 (1994).
- Yoro, S. C., Panagiotopoulos, C., Sempéré, R. Dissolved organic carbon contamination induced by filters and storage bottles. Water Res. 33 (8), 1956-1959 (1999).
- Zhang, J. Z., Fischer, C. J., Ortner, P. B. Laboratory glassware as a contaminant in silicate analysis of natural water samples. Water Res. 33 (12), 2879-2883 (1999).
- Yoshimura, T. Appropriate bottles for storing seawater samples for dissolved organic phosphorus (DOP) analysis: a step toward the development of DOP reference materials. Limnol. Oceanogr-meth. 11 (4), 239-246 (2013).
- Strickland, J. D. H., Parsons, T. R. A practical handbook of seawater analysis. , Fisheries Research Board of Canada. Ottawa. (1968).
- Eaton, A. D., Grant, V. Freshwater sorption of ammonium by glass frits and filters: implications for analyses of brackish and freshwater. Limnol. Oceanogr. 24 (2), 397-399 (1979).
- Norrman, B. Filtration of water samples for DOC studies. Mar. Chem. 41 (1-3), 239-242 (1993).
- Carlson, C. A., Ducklow, H. W. Growth of bacterioplankton and consumption of dissolved organic carbon in the Sargasso Sea. Aquat. Microb. Ecol. 10 (1), 69-85 (1996).
- Grasshoff, K., Ehrhardt, M., Kremling, K. Methods of Seawater Analysis. Second, Revised and Extended Edition. , (1999).
- Perea-Blázquez, A., Davy, S. K., Bell, J. J. Nutrient utilisation by shallow water temperate sponges in New Zealand. Hydrobiologia. 687 (1), 237-250 (2012).
- Perea-Blázquez, A., Davy, S. K., Bell, J. J. Estimates of particulate organic carbon flowing from the pelagic environment to the benthos through sponge assemblages. PLoS ONE. 7 (1), e29569(2012).
- Pile, A. J., Patterson, M. R., Witman, J. D. In situ grazing on plankton <10 µm by the boreal sponge Mycale lingua. Mar. Ecol. Prog. Ser. 141, 95-102 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved