Method Article
מדידת נזק לדנ"א ותיקון בSplenocytes העכבר לאחר כרוני
In This Article
Summary
A protocol to evaluate changes in DNA damage levels and DNA repair capacity that may be induced by chronic in vivo low dose irradiation in mouse spleen lymphocytes, by measuring phosphorylated histone H2AX, a marker of DNA double-strand breaks, using flow cytometry is presented.
Abstract
חשיפה לקרינה במינון נמוכה עלולה לייצר מגוון רחב של השפעות ביולוגיות שהם שונים בכמות ובאיכות מתופעות המיוצרות על ידי מינוני קרינה גבוהים. התמודדות עם שאלות הקשורות לבטיחות בריאות סביבתית, תעסוקתית וציבורית באופן ראוי ומוצדק מבחינה מדעית מסתמכת במידה רבה על היכולת למדוד במדויק את ההשפעות הביולוגיות של מזהמים במינון נמוכים, כגון חומרים מייננת קרינה וכימיקלים. נזק לדנ"א ותיקון הם הסימנים המוקדמים החשובים ביותר של סיכונים בריאותיים בשל השלכותיהם הפוטנציאליות לטווח ארוך, כגון סרטן. כאן אנו מתארים פרוטוקול ללמוד את ההשפעה של חשיפה כרונית בvivo למינונים נמוכים של קרינת β γ- ועל נזק לדנ"א ותיקון בתאי טחול עכבר. באמצעות סמן מקובל של DNA הפסקות גדיל פעמיים, H2AX היסטון phosphorylated נקרא γH2AX, אנו מדגימים כיצד ניתן להשתמש בו כדי להעריך לא רק את הרמות של נזק לדנ"א, אלא גם משניםביכולת תיקון DNA שהופק על ידי פוטנציאל מינון נמוך בחשיפות vivo. Cytometry זרימה מאפשרת מדידה מהירה, מדויקת ואמינה של γH2AX כותרת immunofluorescently במספר גדול של דגימות. תיקון הפסקה כפול גדיל DNA יכול להיות מוערך על ידי חשיפת splenocytes חילוץ למנה מאתגרת של 2 Gy לייצר כמות מספקת של DNA פורץ להפעלת תיקון ועל ידי המדידה המושרית (לאחר ההקרנה 1 שעה) ונזק לדנ"א שייר (24 שעות לאחר הקרנה). הנזק לדנ"א שיורי יהיה מעיד על תיקון חלקי והסיכון של חוסר יציבות גנומית לטווח ארוך וסרטן. בשילוב עם מבחני אחרים ונקודתי קצה שיכול בקלות להיות נמדדים בכך במחקרי vivo (למשל, סטיות כרומוזומליות, תדרי גרעינונים בreticulocytes מח עצם, ביטוי גנים, וכו '), גישה זו מאפשרת הערכה מדויקת וקונטקסטואלית של ההשפעות הביולוגיות לחצים רמה הנמוכה של.
Introduction
מחלוקת מהותית על ההשפעות המזיקות האפשריות של שני מינונים נמוכים או נמוכים מאוד של קרינה מייננת ופחד של הציבור של קרינה, מונע על ידי תמונות של ההפצצות האטומיות על הירושימה ונגסקי ותאונות כור גרעיני נדירות (שהוחמרה על ידי תקשורת המונים), הובילה למאוד רגולציה קפדנית הגנה מפני קרינה ותקנים שהם בעלות פוטנציאל לא מדעי מוצדקים. בשלושת העשורים האחרונים, דיווחים רבים תעדו שני חוסר מזיק ואת הנוכחות של השפעות ביולוגיות פוטנציאלי הנגרמות על ידי קרינה מועילות במינון נמוך 1-4. גורם הסיכון בריאותי קרינה העיקרי הוא ההסתברות של סרטן, המוערכת בהתבסס על מחקרים אפידמיולוגיים של ניצולי פצצה אטומיים שקיבלו מינון גבוה או בינוני של קרינה. אקסטרפולציה ליניארית של נתונים אלה (מה שנקרא ליניארי-אין-סף או מודל LNT) משמשת להערכת סיכונים של סרטן במינונים נמוכים. עם זאת, גישה זו לא קיבלה קבלה מדעית ברחבי העולםוהוא דנו בכבדות 5.
ניכר כי מחקרים נוספים נדרשים כדי להבהיר סוגיה זו ואולי לשפר את הסטנדרטים להגנה מפני קרינה. מחקרים כאלה צריכים לערב טיפולים כרוניים (הקירוב הטוב ביותר של חשיפות סביבתיות ותעסוקתיות), במודלים של בעלי החיים vivo (הטובים ביותר עבור אקסטרפולציה אפקטים לאדם) ונקודתי קצה כגון שיעורי נזק לדנ"א, תיקון DNA וmutagenesis. זה ידוע שה- DNA הוא היעד העיקרי לפגיעת השפעות קרינה ולא שלמים או אי-תיקון עלול להוביל להתפתחות הסרטן וmutagenesis 6.
הפסקות DNA פעמיים גדיל (DSB) הן אחד מהסוגים מזיקים ביותר של נגעי DNA ועלולות להוביל למוות של תאים ויצירת הגידולים 7. זהו, אם כן, חשוב להיות מסוגל אמין ומדויק למדידת הרמה של DSB לאחר חשיפה לקרינה במינון נמוכה ו / או גורמי לחץ אחרים, כגון מזהמים כימיים. אחד מהסמנים הרגישים והספציפיים ביותרשל DNA DSB הוא H2AX היסטון פוספורילציה, נקרא γH2AX 8, עדיין סמנים ושיטות אחרים כבר הציעו 9,10. ההערכה היא כי אלפי מולקולות H2AX, בקרבת DSB מושרה, מעורבים בהיווצרות γH2AX מאפשרת זיהוי של DSB הבודד על ידי תיוג immunofluorescent עם הנוגדן ומיקרוסקופ פלואורסצנטי אנטי γH2AX 11. התגובה היא מהירה מאוד, והגיע המקסימלית שלה בין 30 ל -60 דקות. ראיות לכך שγH2AX מאפשר תיקון של דנ"א DSB ידי משיכת גורמי תיקון אחרים לאתרים של הפסקות ועל ידי שינוי מבנה הכרומטין לעגן קצות DNA השבורים ולספק גישה לחלבונים אחרים תיקון (ביקורת ב -12). עם השלמת התיקון של דנ"א DSB, γH2AX מקבל דה-פוספורילציה ו / או עובר השפלה, ומולקולות H2AX מסונתזים חדש להחליף γH2AX באזורים שנפגעו מהכרומטין 10. ניטור היווצרות ואובדן γH2AX יכול,לכן, לספק הערכה מדויקת של קינטיקה תיקון DNA DSB. גישה זו נעשתה שימוש כדי ללמוד תיקון DSB בשורות תאי גידול שונים אנושיות מוקרנים עם מינונים גבוהים של קרינה ושיעורה ורמות DSB שייר הוכח לתאם עם radiosensitivity 13-15.
אנחנו שונה הגישה הניסויית הזה וליישם אותו למחקר עכבר in vivo לבחון את ההשפעות של מינונים נמוכים של γ- הכרוני וβ-קרינה ברמות ה- DNA DSB ותיקון (איור 1). ראשית, אנחנו מדגימים שיטה לביצוע חשיפה כרונית ארוך טווח של עכברים לβ-קרינה הנפלטת באמצעות טריטיום (מימן-3) בצורה של המים tritiated (HTO) או כטריטיום מחויב אורגני (OBT) מומס במי שתייה . שתי הצורות צפויות לצבור ו / או להפיץ בצורה שונה בגוף ולכן, לייצר השפעות ביולוגיות שונות. שני צורות הן סכנות פוטנציאליות בתעשיית גרעין. טיפול זההקביל לחשיפה כרונית לקרינת γ-בשיעור מינון שווה ערך כדי לאפשר השוואה נכונה של שני סוגי הקרינה, שהוא חיוני להערכת היעילות הביולוגית היחסית שלהם. Beta-קרינה מורכבת מאלקטרונים, מה שהופך את שונה מאוד מγ-הקרינה, הפוטונים באנרגיה גבוהים. בשל הבדל זה, Β-קרינה מייצגת סכנה בריאותית בעיקר פנימית ועלולה לייצר השפעות ביולוגיות שונות בהשוואה לγ-קרינה. סיבוך זה הביא מחלוקות משמעותיות על פני הרגולציה של חשיפה לβ-קרינה הנפלטת על ידי HTO. לפיכך, רמות רגולציה של HTO במי שתייה לציבור משתנות מקרל 100 / L באירופה 75,000 בקרל / L באוסטרליה. זהו, אם כן, חשוב להשוות השפעות ביולוגיות של HTO למינונים מקבילים של γ-קרינה. שנית, שיעור ה- DNA DSB נמדד בsplenocytes המבודד עם השלמת חשיפות כרוניות באמצעות כותרת immunofluorescently γH2AX לזהותאד על ידי cytometry זרימה. זה מאפשר ההערכה של מידת נזק שנגרם על ידי ה- DNA in vivo החשיפות. עם זאת, זה הגיוני לצפות שחשיפות כגון רמה נמוכה לא יכולות לייצר כל שיעורי זיהוי של ה- DNA DSB; במקום זאת, כמה שינויים נסתרים / ניתן לצפות תגובות שמשפיעות על היכולת של התאים כדי לתקן נזק ל- DNA. שינויים אלה, אם מצאו, יכולים להיות גם גירוי (ייצור אפקט מועיל) או מעכב (ייצור אפקט מזיק). הפרוטוקול המוצע מאפשר חושף שינויים כאלה על ידי מאתגרים splenocytes חילוץ עם מינון גבוה של קרינה שמייצר כמות משמעותית של נזק (למשל, 2 Gy ייצור כ -50 DNA DSB לכל תא או 3 -. עלייה של 5 לקפל בסך הכל רמת γH2AX) . בהמשך לכך, ההיווצרות ואובדן γH2AX, המשקף את הייזום והשלמת תיקון DSB, מנוטרת על ידי cytometry זרימה. בדרך זו, לא רק בסיס ורמות מושרה טיפול של ה- DNA DSB ניתן למדוד, אבלגם השפעתה הפוטנציאלית על היכולת של התאים להגיב ונזק לדנ"א תיקון הנגרם על ידי רמות לחץ גבוהות בהרבה.
Protocol
כל נהלי הטיפול וטיפול העכבר צריכים לדבוק בכללים שנקבעו על ידי מחוקק התוכניות ו / או טיפול בבעלי חיים ואושרו על ידי ועדת טיפול בבעלי החיים מקומית. כל השיטות שתוארו בפרוטוקול זה בוצעו בהתאם להנחיות המועצה הקנדית על טיפול בבעלי חיים באישור ועדת טיפול בבעלי החיים המקומית.
זהירות: כל העבודה עם רדיואקטיביות (כולל, אך לא מוגבלת לטיפול בטריטיום, γ-קרינה חיצונית, טיפול ברקמות בעלי החיים רדיואקטיבי, פסולת מצעים) צריך לדבוק בכללים שנקבעו על ידי הרשויות המחוקקת ו / או הגנה מפני קרינה ותבוצע על ידי מורשה כוח אדם במעבדה ו / או מתקן מוסמכים.
1. בעלי החיים עבודה
- בעלי החיים קיבוץ
- אם עכברים מגיעים מארגון חיצוני, להתאקלם חיות לפחות 10 ימים במתקן בעלי החיים. אם המחקר כולל קבוצות טיפול מרובות, להבטיח כי ספק בעלי החיים ניתן לשלוח אלבעלי החיים l כיצווה אחת.
- באופן אקראי להקצות עכברים לקבוצות טיפול של 10 עכברים לכל קבוצה. אם משתמש בעכברי זכרים של זן C57BL / 6, יש לי ספק החיה מראש לארגן אקראי של C57BL זכרים / 6 צעירים מאוד במתקן שלהם כדי למתן בעיות תוקפנות.
- חשיפה כרונית של עכברים β-קרינה פנימית ל
- הכן ריכוזי עבודה של טריטיום (10 kBq / L וMBq 1 / L) במי שתיית עכבר על ידי דילול המניות המקוריות של HTO וOBT (תערובת של פרולין tritiated, אלאנין וחומצות אמינו גליצין) פתרונות.
- לאמת את הריכוזים הסופיים של טריטיום במי השתייה על ידי מדידת רדיואקטיביות באמצעות מונה נצנץ נוזלי. התאם ריכוזים, במידת צורך.
- לטפל בבעלי חיים לחודש אחד על ידי מתן כרצונך גישה למים טריטיום. אם מים טיפול מקבלים נמוכים בתקופה של השבועיים, להוסיף עוד מים. אחרת, לשנות בקבוקים בשבועות.
- דמה-מוקרנת התייחס שליטהעכברים זהים. שמור אותם בחדר "נקי" נפרד או על מדף נפרד "נקי" תחת לחץ אוויר חיובי כדי למנוע טריטיום זיהום צולב מהאוויר.
- חשיפה כרונית של עכברים γ-קרינה חיצונית ל
הערה: γ-קרינת מתקן / ציוד ישתנה בהתאם למיקום. - שימוש בשיטות זמינות של dosimetry, לקבוע את המרחקים ממקור γ-קרינה שיש לי שדות קרינת הפקת שיעורי מינון הרצויים. ודא ההומוגניות של שדות קרינה באזורי כיסוי כלובי חיות.
הערה: 1.7 μGy / h הוא שווה ערך לשיעור מינון המיוצר על ידי 1 MBq / טריטיום L בגוף. - לחשוף עכברים על ידי הצבת כלובי עכבר במרחקים שנקבעו בשלב 1.3.1 לחודש אחד. למזער הפרעה יומית של γ-קרינה 30 דקות. השתמש מד מינון thermoluminescence למדוד מינונים נקלטו כולל.
2. קורבנות ודגימה
- הכן מכשירי ניתוח סטרילי, צלחות פטרי 60 מ"מ עם מסננות הוכנסו 70 מיקרון תא, 15 מיליליטר וצינורות 1.5 מיליליטר, תקשורת RPMI בתוספת סרום 5% שור עוברי (FBS) ומקום כל בתוך ארון בטיחות ביולוגי. הבטחת סטריליות של העבודה היא קריטית.
- לוותר 5 מיליליטר של תקשורת RPMI לכל צלחת פטרי 60 מ"מ.
- להקריב עכברים באמצעות שיטה שאושרה על ידי ועדת טיפול בבעלי החיים המקומית. נקע בצוואר הרחם הוא בחירה טובה עבור עבודת splenocyte המתוארת בפרוטוקול זה. עם זאת, אם דגימות דם למבחנים אחרים (לדוגמא, לmFISH, הגרעינון בלוק cytochalasin או מבחני genetoxicity הנפוץ אחרים) נדרשות, להשתמש לנקב פנים-לב לאחר הרדמה עם isoflurane.
- מניחים את החיה שכיבתה על גב, עם הראש והצביע ממך. לרסס את העכבר למטה עם 70% אתנול. בעזרת מלקחיים, לתפוס את עור anteriorly לפתיחת השופכה ולעשות חתך קטן עם מספריים באזור החיץ הנקבי.
- מחתך זה, לחתוך לאורך קו האמצע הגחון לחלל החזה, להיות זהיר, כדי לחתוך רק את העור ולא קיר השריר מתחת. לנתח את העור מקו האמצע.
- לתפוס את דופן הבטן עם מלקחיים ולחתוך לאורך הציר החציוני של קיר השרירים לפתוח את חלל הבטן.
- בלו הטחול על ידי בקלילות תופס אותו עם מלקחיים סטריליות ומשייכתו בעדינות על זה תוך צמצום מרחק בו זמנית רקמת חיבור במספריים.
- חותכי חתיכה קטנה של הטחול (כ 1/10 של הטחול) והמקום בצינור 1.5 מיליליטר. Snap להקפיא בחנקן נוזלי לאחסון שלאחר מכן ב -80 ° C למבחנים משלימים.
- מניחים את שארית הטחול לתוך מסננת תא בתוך צלחת פטרי 60 מ"מ עם 5 מיליליטר של תקשורת RPMI-לוותר מראש.
- המשך לעכבר הבא.
יכולים להיות כל הזמן טחולים חולץ ב -60 מנות מ"מ עם תקשורת (עד 2 שעות) בעוד שאר העכברים להקריב את: הערהאד. בהתאם למספר האנשים שהשתתפו, בין 5 ל 15 עכברים יכולים להיות מעובד ביום אחד.
3. הכנת תרבויות Splenocyte
- Homogenize הטחול על ידי מיותר בתוך מסננת תא עם מלקחיים סטרילי עם קצה מעוגל.
- הסר את מסננת התא ולאסוף את ההשעיה התא המסוננת מצלחת 60 מ"מ לתוך צינור 15 מיליליטר.
- יש לשטוף את מסננת התא עם 5 מיליליטר של תקשורת כדי לאסוף את שארית התאים.
- צינורות צנטריפוגה XG ב 300 במשך 5 דקות על RT.
- supernatant ולמזוג מחדש להשעות גלולה ב 10 מיליליטר של RPMI.
- צינורות צנטריפוגה XG ב 300 במשך 5 דקות על RT.
- supernatant ולמזוג מחדש להשעות גלולה ב 5 מיליליטר של RPMI.
- העברה 4 מיליליטר של השעיה תא לתוך בקבוק 25 מיליליטר תרבות רקמות ולהסיר לחממת CO 2 (37 מעלות צלזיוס, 5% CO 2, 80% לחות)
4. מאתגרי הקרנה ותיקון
- העבר אתנותר 1 מיליליטר של השעיה תא מהצעד 3.8 לתוך צינור 1.5 מיליליטר על קרח וצנטריפוגות ב XG 300 במשך 5 דקות על 4 מעלות צלזיוס. הנזק לדנ"א שנמדד במדגם זה מייצג שני נזק הנגרם הטיפול וt = 0 נתוני נקודה לבניית עקומת תיקון DNA.
- בזהירות לשאוב supernatant באמצעות משאבת ואקום. בעדינות מחדש להשעות גלולה ב 1 מיליליטר של חיץ TBS (20 מ"מ טריס pH 7.4, 150 מ"מ NaCl, 2.7 מ"מ KCl).
- צינורות צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. בזהירות לשאוב supernatant באמצעות משאבת ואקום. בעדינות מחדש להשעות גלולה ב 300 μl של TBS.
- תוך ערבוב במערבולת במהירות נמוכה, להוסיף 700 μl של -20 אתנול 100% מעלות צלזיוס. סגור את המכסה ולהפוך כמה פעמים כדי לערבב.
- אחסן את הדגימות ב -20 ° C. Splenocytes הקבוע באתנול ניתן לאחסן ב -20 ° C לפחות 12 חודשים ללא כל אובדן מורגש באות γH2AX.
- מכשיר את תרבויות splenocyte מצעד 3.8 עם γ-רד מאתגר מינון iation של 2 Gy ב≥ שיעור מינון 200 mGy / דקות באמצעות מכשיר הקרנה זמין.
הערה: המטרה של קרינה זו היא לגרום לDNA DSB לאתגר את מכונות התיקון. גם צילומי רנטגן יכול לשמש למטרה זו. - מייד להחזיר את התרבויות לחממת CO 2.
- שעה 1 לאחר הקרנת Gy 2 המאתגרת, להסיר את התרבויות מן החממה לארון בטיחות ביולוגית. לאסוף aliquot מדגם מייצג, בעדינות מחדש להשעות תאים באמצעות pipettor והעברה 1 מיליליטר של ההשעיה תא צינור 1.5 מיליליטר על קרח. להחזיר את תרביות תאים לחממת CO 2.
- צינורות צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. בזהירות לשאוב supernatant באמצעות משאבת ואקום. בעדינות מחדש להשעות גלולה ב 1 מיליליטר של TBS.
- חזור על שלבים 4.3-4.5.
- 24 שעות לאחר 2 γ-הקרנת Gy, הקציר המאתגר ולתקן ב= מדגם 24 שעות כמתואר בשלב 4.8-4.10.
הערה: בדרך כלל, 15-30 דגימות ליום יכולות להיות מתויגות immunofluorescently וassayed ידי cytometry זרימה בטווח אחת. כדי להבטיח השוואה מדויקת בין קבוצות טיפול, כולל מדגם (ים) מכל קבוצה. ראית גם התייחסות 16 לפרטים נוספים.
- הכן ערכת שכותרת של צינורות למספר הדגימות להיות מעובד ומניחים על קרח. השתמש 12 x 75 מ"מ צינורות זכוכית הסירו את מכסה. עקרות אינה נדרשות לעבודה זו. כולל דגימה אחת נוספת היסטורית שליטה לתיוג עם נוגדנים משני בלבד ("2 Ab רק"). השתמש מדגם שליטה היסטורי זה בכל cytometry זרימה לרוץ בתוך מחקר.
- הוסף 0.5 מיליליטר של TBS קר כקרח על צינור אחד.
- הסר splenocytes קבוע מ-20 ° C, מערבולת במשך 5 שניות ולהעביר aliquot 0.5 מיליליטר לצינורות מוכנים עם כפות. מניחים את שארית דגימות בחזרה לאחסון -20 ° C ולשמור כמדגם גיבוי.
- splenocytes צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. למזוג supernatant בעדינות מחדש להשעות גלולה ב 1 מיליליטר של קר כקרח TBS המכיל 1% FBS
- תאי צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. למזוג supernatant בעדינות מחדש להשעות גלולה ב 1 מיליליטר של חיץ TST (0.05% X-100, 2% FBS טריטון ב TBS). דגירה של 20 דקות על קרח.
- תאי צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. למזוג supernatant בעדינות מחדש להשעות גלולה ב 200 μl של נוגדן אנטי γH2AX העיקרי בדילול 1: 150 במאגר TST. השתמש 200 μl של TST ל" 2 Ab רק "מדגם השליטה.
- צינורות עמדה על שייקר מסתובב בזווית של 45 - 60 מעלות ולנער תמורת 1.5 שעות ב 300 XG ב RT.
- בעוד צינורות דוגרים, להכין נפח מספיק (200 μl / מדגם) של הנוגדנים משני אנטי העכבר העז מצומדות עם Alexa-488 בדילול 1: 200 במאגר TST.
הערה: כל העבודה שיש בי Alexa-488נוגדן מצומדת (שלבים 5.10-5.16 להלן) צריך להיעשות בתנאי אור עמומים וצריכה להיות מוגן דגימות שכותרתו מאור על ידי עטיפת צינורות בנייר אלומיניום. - ברגע שהדגירה 1.5 שעות הושלמה, להוסיף 1 מיליליטר של TBS קר כקרח המכיל 2% FBS על צינור אחד וצנטריפוגות ב XG 300 במשך 5 דקות ב 4 מעלות צלזיוס. למזוג supernatant בעדינות מחדש להשעות גלולה ב 1 מיליליטר של TBS המכיל 2% FBS.
- צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. למזוג supernatant בעדינות מחדש להשעות גלולה ב 200 μl של פתרון נוגדנים משני מהשלב 5.8.
- דגירה הדגימות על פלטפורמה רועדת עבור שעה 1 כמו בשלב 5.7.
- הוסף 1 מיליליטר של TBS קר כקרח המכיל 1% FBS.
- צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. למזוג supernatant בעדינות מחדש להשעות גלולה ב 1 מיליליטר של TBS קר כקרח.
- צנטריפוגה XG ב 300 במשך 5 דקות ב 4 מעלות צלזיוס. למזוג supernatant בעדינות מחדש להשעות גלולה ב 0.5 מיליליטר של TBS המכיל 50 מיקרוגרם / מיליליטריודיד propidium.
- דגירה של 5 דקות על RT המוגנים מפני אור.
- ניתוח דגימות על cytometer זרימה באמצעות פרוטוקולי מכשיר ספציפי 16. קראו לפחות 10,000 תאים לדגימה.
תוצאות
איור 2 מציג דוגמאות של cytometry זרימת הגרפים הצפויים לsplenocytes מוכנים תוך שימוש בשיטה שתוארה כאן. תאים מגודר ראשון המבוסס על <נפח בצד הפיזור אלקטרוני> עלילת פיזור (איור 2 א ו 2 ד; נפח אלקטרוני הוא שווה ערך לפיזור קדימה). היסטוגרמות יוד FL3 / propidium (איור 2 ו2E) לאשר חלוקת מחזור התא נורמלית. אומר אות γH2AX מחושבת באמצעות ערוץ FL1 מאשר גידול> פי 2 בדנ"א DSB ב2-Gy מוקרן תאים (איור 2F) בהשוואה לקבוצת הביקורת (איור 2 ג). בשלב הבא, בחנו את הרגישות של השיטה המתוארת מדידת שכותרת immunofluorescently γH2AX ידי cytometry זרימה בsplenocytes עכבר. איור 3 א מציג רמות γH2AX, מעיד על DNA DSB, בsplenocytes עכבר שעה 1 לאחר vivo לשעבר החשיפה לאו נמוך (0.1GY) או (2 Gy) מינונים גבוהים של קרינת γ-ביחס לקבוצת הביקורת. ניתן לראות כי 0.1 Gy מושרה עלייה קלה ברמת DSB והעלייה שהייתה משמעותית מבחינה סטטיסטית. האינדוקציה של פי 3 החזקה הייתה צפויה ואותרה לאחר חשיפת Gy 2. כדי לאמת את הספציפיות של תיוג immunofluorescent γH2AX כמתואר בפרוטוקול, תאים שכותרתו נבדקו עם מיקרוסקופ פלואורסצנטי. הדפוס כמו המוקדים-המסומן נצפה מצביע על כך שאות הקרינה שמקורה DNA DSB הבודד בתוך הכרומטין (איור 3).
נציגי תוצאות של ההערכה של שיעור DNA DSB ותיקונם בsplenocytes של עכברים שנחשף לחודש אחד לריכוזים נמוכים מאוד של מים tritiated (10 kBq / L) מוצגות באיור 4. ניתן לראות (איור 4 א) שלמרות ש טיפול הביא לעלייה של 10% מרמת בסיס γH2AX, השינוי לא היהt (N = 5, אחד מדגם מבחן t של סטודנט) משמעותי מבחינה סטטיסטית. יתר על כן, ההיווצרות המדודה ואובדן γH2AX לאחר הקרנת Gy 2 המאתגרת, המייצג את קינטיקה של תיקון DNA DSB, לא היה שונה בין התאים מהשליטה והעכברים שטופלו HTO (איור 4).
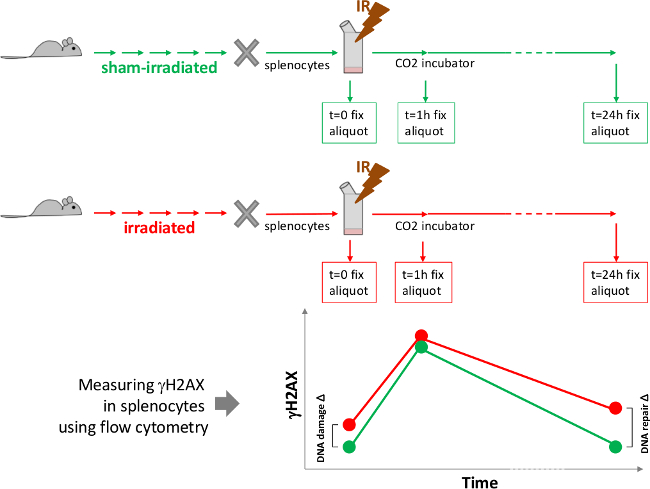
איור 1. תרשים ניסיון להעריך את ההשפעה של קרינה כרונית in vivo על נזק לדנ"א ותיקון DNA. לאחר in vivo טיפול בעכברים עם הקרנה כרונית לתקופה רצויה של זמן, עכברים הקריבו ותרבויות splenocyte הוקמו ונחשפו למאתגר הקרנה. aliquots Splenocyte נאספים וקבוע בזמנים שונים לאחר המנה המאתגרת. רמות של γH2AX לאחר מכן נמדדו באמצעות immunofluorescent להbeling וזיהוי על ידי cytometry זרימה. העלילה בחלק התחתון של איור היא סכמטי של נתונים צפויים. רמה-H2AX גמא באופן דרסטי מגבירה מוקדם לאחר ההקרנה המאתגרת ואחריו ירידה חזרה לערך השליטה, אם תיקון DNA הוא מלא. הנזק לדנ"א Δ מייצג את הנזק שהופק כתוצאה מהטיפול הניסיוני של עכברים וΔ תיקון DNA מייצג את ההשפעה של הטיפול בעכברים ביכולת תיקון DNA DSB. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
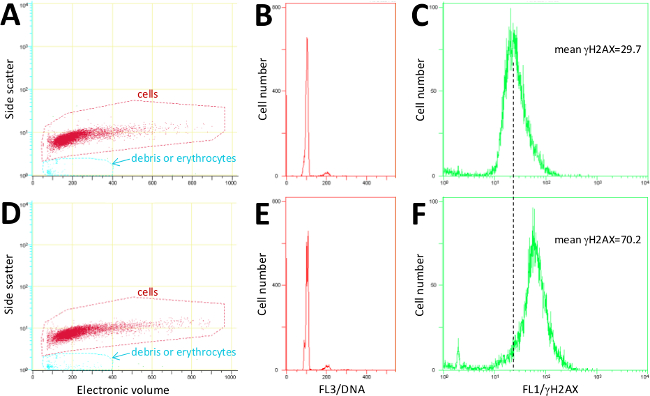
נציג 2. איור cytometry זרימת הנתונים גולמיים. (A, D) מגרשי פיזור ואזורי gating לsplenocytes ופסולת תא ואריתרוציטים. (B, E) היסטוגרמות DNA המייצגת הפצות מחזור התא. (C, F) היסטוגרמה γ-H2AX הקרינה ואומר ערכי הקרינה. הנתונים בסטים (AC) התקבלו מתאי טחול נציג מטופל שליטה, ואילו הנתונים בסטים (D- F) התקבלו מהתאים מוקרנים עם 2 γ-קרינת Gy ונקטפו שעה 1 לאחר ההקרנה. אנא לחץ כאן לצפייה גרסה גדולה יותר של דמות זו.

איור 3. איתור של H2AX γ על ידי cytometry זרימה הוא רגיש וספציפי. () Splenocytes מבודד טרי מעכברי CBA הגבריים היו מוקרן גם עם 0.1 או 2 Gy של γ-קרינה, או ואיפשר לפתח תגובת γH2AX עבור שעה 1 טופל דמה. תאים אז היו קבועים, immunofluorescentlyשכותרתו עם נוגדן אנטי γH2AX ונותח על ידי cytometry זרימה. ערכים ממוצעים מנורמלים ± SD מוצגים (N = 12). * ו*** מסמן הבדל סטטיסטי עם p <0.05 וp <0.001, בכבוד (אחד-מדגם -test t של סטודנט). (ב) microphotographs נציג של קבוצת ביקורת (UT) או 2 Gy מוקרן splenocytes כותרת immunofluorescently עם אנטי γH2AX נוגדן. הדפוס כמו המוקדים-הקרינה ירוקה מאשר את הספציפיות של תיוג immunofluorescent לγH2AX. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4. נציגי תוצאות מראים את חוסר ההשפעה מיוצר על ידי חשיפת 1 חודשים של עכברים לwate tritiatedr (HTO) ברמת ה- DNA DSB ותיקון. Splenocytes () היו מבודד מעכברים שטופלו עם 10 kBq / L של HTO בשתיית מים ובעלי חיים שליטה. רמת γH2AX נמדדה באמצעות תיוג immunofluorescent וcytometry זרימה כמתואר בפרוטוקול. אומר רמות הקרינה γH2AX ביחס לאלו של שליטת ± SD מוצגות (N = 5). נתונים אלה נוצרו מt = 0 הנקודה הזמן שהיה בשימוש באיור 3 להערכת תיקון DNA DSB. splenocytes (ב) מבודד נחשף למינון Gy 2 מאתגר של γ-קרינה וaliquots של תאים היו קבוע ב לא פעמים = 0, 1 ו -24 שעות לאחר ההקרנה המאתגרת. אומר הקרינה של γH2AX ביחס לt = 0 השליטה שלה מוצג ± SD (N = 5). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
הפרוטוקול שהוצג במאמר זה הוא שימושי לניהול עכבר בקנה מידה גדול במחקרי vivo בוחנים את השפעות genotoxic של רמות נמוכות של חומרים כימיים ופיסיים שונים, כוללים קרינה מייננת. המתקן שלנו ייחודי ספציפי הפתוגן ללא בעלי החיים מצויד בirradiator GammaBeam 150 ואולם הקרנה ארוכה 30 מטר מאפשר ביצוע המחקרים ארוכים-חיים כרוכים בirradiations שיעור מינון נמוך או נמוך מאוד על מאות או אפילו אלפים של עכברים. ניתן להגדיר מתקני קרינה קטנים יותר לקרינה במינון נמוכה כרונית באוניברסיטה או בסביבת בית חולים שבו לימודים מתקיימים באופן שגרתי רדיוביולוגיה והנחיות הגנה מפני קרינה / תקנות מיושמות. עם זאת, תקנות מחמירות בדרך כלל חלה על מתקנים המיועדים להקרנת חיה הפנימית שבו הטיפול בradionuclides, כגון טריטיום, מתבצעת. אמנם נדיר, מעבדות מוסמכים ללימודי חשיפה לקרינה פנימיים כאלה מחדש שוניםמוסדות חיפוש עולמי והיכולות הייחודיות שלהם יכולים לשמש למחקרים שתוארו בפרוטוקול זה.
בתוך הפרוטוקול, אנו משתמשים בתיוג immunofluorescent של γH2AX להעריך במדויק שיעורי DNA DSB מיוצרים על ידי חשיפות ניסיוניות. רמה יותר חשוב מכך, את ההקדמה של הקרנה מאתגרת נמסרה vivo לשעבר לsplenocytes חילוץ מאפשר להעריך את תקינות תגובת DNA DSB (רמת γH2AX בשעה 1 לאחר האתגר) ושל תיקון DSB DNA (γH2AX 24 שעות בהשוואה ל 0 שעות). יש לציין כי כימות של מוקדי γH2AX לכל תא על ידי מיקרוסקופ פלואורסצנטי עשוי לספק רגישות גבוהה יותר בהשוואה לcytometry זרימה. לדוגמא, מינון נמוך כמו 0.001 Gy דווח לייצר עליות משמעותיות במספר מוקדי γH2AX לכל תא. עם זאת, השימוש בגילוי של γH2AX מבוסס cytometry הזרימה מספק יתרונות על פני beca ניתוח מיקרוסקופ פלואורסצנטילהשתמש בו דורש פחות זמן למדידות, היא אינה דורשת כוח אדם מאוד מיוחד / מאומן וזה ימנע סובייקטיבי קשור לγH2AX קבלת החלטות מוקדי הכרה וספירה. יתרונות אלה הם קריטיים למחקרים בבעלי חיים בקנה מידה גדולה. ניסויים בבעלי חיים אופייניים עם 10 קבוצות טיפול ועכברים 10 לכל קבוצה יביאו 100 דגימות x 3 = 300 טחול, אם השיטה הציעה (איור 1) ואחריו. כדי להפיק נתונים ממספר זה של דגימות, כ 100 שעות תידרש באמצעות cytometry זרימה. לחלופין, אם נעשה על ידי ניתוח מיקרוסקופי ידני, את אותה המשימה תיקח לפחות 300 שעות, באמצעות הערכה שמרנית של 40 דקות של זמן מיקרוסקופ התובעני ביותר לדגימה. למרות ניסיונות להפוך ניתוח וניקוד של מוקדי γH2AX נעשו 17-19, לכולם יש מספר המגבלות. בפרט, הצורה העגולה וגודל קטן של splenocytes עכבר והופכים אותו לימפוציטים מעשיים לפתור את כל תחרות אישיתidual γH2AX מוקדים מיקרוסקופי. בעוד תאים חסיד כבר כבש בהצלחה על ידי מערכות מיקרוסקופיה אוטומטיות למוקדי γH2AX, ללא הצלחה הודגמה גם עבור splenocytes עכבר או לימפוציטים.
הדרך הטובה ביותר למנוע השתנות היום-היום בערכים שנמדדו של γH2AX אות על ידי cytometry זרימה היא לכלול דגימות קבוצה ושליטה ניסיוניות באותו הטווח ולחשב ביחס שינויי γH2AX בתוך כל ריצה. המלצות נוספות כוללות: א) שליטה היסטורית בהיקף של מטופל ו -2 Gy מוקרן מדגם משמש בכל ריצה; ב) אדם אחד מבצע את כל הליכי תיוג נוגדן; ג) מניות יחידה של מאגרים ותצוו אחת של נוגדן, שני עיקריים ומשניים, משמשת לכל הקבוצה של דגימות בתוך ניסוי אחד. זה גם חיוני לבצע cytometer זרימת מבחן בקרת איכות המומלצת על ידי יצרן המכשיר באופן שיגרתי ולפני כל ריצה של דגימות. זה required לאמת מערכת היישור וfluidics האופטית של המכשיר וגם עוזר וריאציה היום-יום מזעור הקרינה γH2AX נמדדה בין דגימות כדי להשוות או נקווה בקבוצה אחת.
יש לציין כי השימוש במספר גדול יותר של נקודות זמן (לדוגמא, 1, 2, 4, 6 שעות) הקרנת הודעה מאתגרת עשויות לעזור לנתח ולמדוד קינטיקה תיקון DNA DSB לטווח קצר בפירוט רב יותר 16. עם זאת, פוטנציאל תיקון כללי והסבירות של השפעות בריאותיות מתעכבות יהיו מיוצג על ידי נזק שיורי נמדד רק ב 24 שעות והשוואה לזה שנצפה בנקודת הזמן הראשונית (t = 0) 13-15 (איור 4).
מאז רמות γH2AX בסיסיות ידועות כדי להגביר בבעלי חיים ישנים או תאים מזדקנים 20, לפרשנות מדויקת יותר של התוצאות שהתקבלו במחקרים ארוך טווח עכבר חשיפה (> 6 חודשים) בשיטה המתוארת, השימוש בדואר של קבוצה שלא טופלה צעירה, בנוסף לשליטה באותו גיל, יהיה רצוי. למרות כמה דיווחים מצביעים על כך שγH2AX עשוי להגדיל בתאים מתרבים, אשר לא היה קשור ל- DNA DSB, זה יכול בקלות להיות נשלט על ידי מדידת S-שלב וG2 / M-שלב שברי תא באמצעות היסטוגרמות DNA (איור 2 א, ד). אם תנאי ניסוי מסוימים עדיין למנוע חוקר משימוש γH2AX כסמן של נזק לדנ"א (בשל הסיבות שתוארו לעיל או השילוב שלהם), אחר מוקדי נזק ל- DNA חלבון יוצר, כגון 53BP1, יכול לשמש 21.
למרות שיש לנו לא ניסינו בשיטה זו לרקמות שאינן הלימפה, כגון שרירים, לב, מוח ואחרים, זה היה נראה קשה לעבד אותם לcytometry זרימה. סעיפי רקמות ומיקרוסקופיה לספירת מוקדי γH2AX יהיו השיטה של בחירה, אם נדרש ניתוח של רקמות כגון. עם זאת, תאי הלימפה אחרים, כגון l דם ההיקפיymphocytes, ימפוציטים מח עצם או thymocytes, יכול לשמש למדידת רמות γH2AX בשיטה שתוארה. היתרון של שימוש לימפוציטים טחול הוא הפשטות היחסית של הכנת ההשעיה תא והמספר הגדול של תאים שיכולים להיות מבודד מטחול. זה הופך להיות אפילו יותר מועיל אם נקודות קצה נוספות שנכללו במחקר. מניסיוננו, תשואה אופיינית לsplenocytes לכל עכבר מאפשרת האיסוף של לפחות 10 aliquots, מתאימה לכל אחד מהמבחנים הבאים: cytometry זרימה, RT-qPCR לגן או ביטוי מירנה, כתם מערבי, הדנ"א הגנומי למתילציה CPG assay. לפיכך, aliquots splenocyte נוסף שנאסף במקביל לאלו של נקודת סיום γH2AX ניתן להשתמש כדי למדוד את הביטוי של גנים מעורבים בתגובות איתות ותיקון נזק לדנ"א. גנים כגון GADD45A וCDKN1A, כי הם בדרך כלל תעתיק מוסדר עד-בתגובה לטיפולים ציטוטוקסיות 22, עשויים לספק רמז כדי לגרותתאיה מגיבים כראוי להשפעת המתח המאתגרת. כמו כן, רמות חלבון ולאחר translational שינויים מעורבים בתגובות דחק ניתן להעריך. לבסוף, הוא לא ציפה שכל אחד מהשלבים של הליך החילוץ, אם בוצע כפי שתואר כאן, יכול לגרום לγH2AX בsplenocytes.
זה יהיה מועיל ומומלץ מאוד לטעום איברים ורקמות נוספים בקורבנות כדי להשלים נתונים נזק ותיקון DNA שהתקבלו לsplenocytes לפי פרוטוקול מוצג עם נקודות קצה אחרות. לדוגמא, אנו אוספים באופן שיגרתי בתאי מח עצם עבור assay הגרעינון מח עצם in vivo, רקמות שונות הקשורים להזדקנות β-galactosidase ומדידות ביטוי גני תיקון DNA. היכולת לאסוף רקמות אחרות יהיה תלויה בתמיכה הטכנית הזמינות בקורבנות; עם זאת, זה יכול לעזור באופן משמעותי בפרשנות הנכונה של תוצאות והבנייה של muפרק יותר מבחינה ביולוגית תמונה מערכתית רלוונטית של התגובה לטיפול ברמה הנמוך נחקרת.
Disclosures
The authors declare that there are no known competing financial interests.
Acknowledgements
The authors would like to acknowledge the contribution of our colleagues Sandrine Roch-Lefevre and Eric Gregoire of the Institute of Radioprotection and Nuclear Safety (Paris, France). This work was supported by the Government of Canada Science and Technology program at Canadian Nuclear Laboratories (Chalk River, Ontario, Canada), the CANDU Owners Group (Toronto, Ontario, Canada), the Canadian Nuclear Safety Commission and by the Institute of Radioprotection and Nuclear Safety (Paris, France).
Materials
| Name | Company | Catalog Number | Comments |
| HTO: tritiated water, [3H] | locally obtained from a nuclear reactor | stock activity 3.7 GBq/mL; can be substituted with HTO from Perkin Elmer | |
| OBT: Alanine, L-[3-3H]: organically bound tritium (OBT) | Perkin Elmer | NET348005MC | 1 mCi/ml (185 MBq) |
| OBT: Glycine, [2-3H]: organically bound tritium | Perkin Elmer | NET004005MC | 1 mCi/ml (185 MBq) |
| OBT: Proline, L-[2,3-3H]: organically bound tritium (OBT) | Perkin Elmer | NET323005MC | 1 mCi/ml (185 MBq) |
| tritiated water, [3H] (HTO) | Perkin Elmer | NET001B005MC | substitute for HTO of local origin |
| GammaBeam 150 irradiator | Atomic Energy of Canada Limited | locally manufactured | can be substituted with another g-radiation source of sufficiently low activity |
| Tween-20 | Sigma Aldrich | P1379-500ML | |
| RPMI | Fisher Scientific | SH3025501 | Hyclone RPMI 1640 with L-Glutamine and HEPES 500mL |
| fetal bovine serum | Sigma Aldrich | F1051-100ML | |
| anti-gH2AX antibody, clone JBW301 | Millipore | 05-636 | |
| Alexa fluor-488 goat anti-mouse antibody | Life Technologies (formerly Invitrogen) | A21121 | |
| propidium iodine | Sigma Aldrich | P4864-10ML | 1 mg/ml |
| ethanol | Commercial Alcohols | P006-EAAN | 500 ml bottles Absolute Ethanol |
| 1.5 ml tubes | Fisher Scientific | 2682550 | microcentrifuge tubes |
| 15 ml tubes | Fisher Scientific | 05-539-5 | sterile polypropylene centrifuge tubes |
| liquid nitrogen | Linde | P110403 | |
| 12 x 75 mm uncapped glass tubes | Fisher Scientific | K60B1496126 | disposable borosilicate glass tubes with plain end |
| T25 flasks | VWR | CA15708-120 | nunc tisue culture 25ml flask (supplier no. 156340) |
| scissors | Fine Science Tools | 14068-12 | Wagner scissors 12 cm sharp/sharp |
| forceps, straight | Fine Science Tools | 11008-13 | Semken forceps 13 cm, straight |
| forceps, curved | Fine Science Tools | 11003-12 | Narrow Pattern forceps 12 cm, curved |
| 60 mm petri dishes | VWR | CA25382-100 | BD Falcon tissue culture dish 60 x 15 mm |
| cell strainers, 70 mm | Fisher Scientific | 08-771-2 | Falcon cell strainers 50/case |
| PBS recipe: 1 tablet dissolved in 200 ml of deionized water, adjust pH to 7.4 if needed. | Sigma Aldrich | P4417-100TAB | Phosphate Buffered Saline Tablets |
| TBS recipe: to make 10x stock | |||
| 30 g TRIS HCl | Sigma Aldrich | T3253-1KG | Trizma hydrochloride |
| 88 g NaCl | Fisher Scientific | S271-500 | Sodium Chloride |
| 2 g KCl | Fisher Scientific | P217-500 | Potassium Chloride |
| Dissolve in 1 L of deionized water, adjust pH to 7.4 |
References
- Mitchel, R. E., Jackson, J. S., McCann, R. A., Boreham, D. R. The adaptive response modifies latency for radiation-induced myeloid leukemia in CBA/H mice. Radiat Res. 152 (3), 273-279 (1999).
- Shadley, J. D. Chromosomal adaptive response in human lymphocytes. Radiat Res. 138 (Suppl 1), S9-12 (1994).
- Wiencke, J. K., Afzal, V., Olivieri, G., Wolff, S. Evidence that the [3H]thymidine-induced adaptive response of human lymphocytes to subsequent doses of X-rays involves the induction of a chromosomal repair mechanism). Mutagenesis. 1 (5), 375-380 (1986).
- Mitchel, R. E. The dose window for radiation-induced protective adaptive responses. Dose-Response. 8 (2), 192-208 (2010).
- Tubiana, M., Feinendegen, L. E., Yang, C., Kaminski, J. M. The linear no-threshold relationship is inconsistent with radiation biologic and experimental data. Radiology. 251 (1), 13-22 (2009).
- Gent, D. C., Hoeijmakers, J. H., Kanaar, R. Chromosomal stability and the DNA double-stranded break connection. Nat Rev Genet. 2 (3), 196-206 (2001).
- Jackson, S. P. Sensing and repairing DNA double-strand breaks. Carcinogenesis. 23 (5), 687-696 (2002).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Schultz, L. B., Chehab, N. H., Malikzay, A., Halazonetis, T. D. p53 binding protein 1 (53BP1) is an early participant in the cellular response to DNA double-strand breaks. J Cell Biol. 151 (7), 1381-1390 (2000).
- Kinner, A., Wu, W., Staudt, C., Iliakis, G. Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Res. 36 (17), 5678-5694 (2008).
- Sedelnikova, O. A., Rogakou, E. P., Panyutin, I. G., Bonner, W. M. Quantitative detection of (125)IdU-induced DNA double-strand breaks with gamma-H2AX antibody. Radiat Res. 158 (4), 486-492 (2002).
- Yuan, J., Adamski, R., Chen, J. Focus on histone variant H2AX: to be or not to be. FEBS Lett. 584 (17), 3717-3724 (2010).
- Taneja, N., et al. Histone H2AX phosphorylation as a predictor of radiosensitivity and target for radiotherapy. J Biol Chem. 279 (3), 2273-2280 (2004).
- Olive, P. L., Banath, J. P., Sinnott, L. T. Phosphorylated histone H2AX in spheroids, tumors, and tissues of mice exposed to etoposide and 3-amino-1,2,4-benzotriazine-1,3-dioxide. Cancer Res. 64 (15), 5363-5369 (2004).
- Banath, J. P., Klokov, D., MacPhail, S. H., Banuelos, C. A., Olive, P. L. Residual gammaH2AX foci as an indication of lethal DNA lesions. BMC Cancer. 10, 4(2010).
- Blimkie, M. S., Fung, L. C., Petoukhov, E. S., Girard, C., Klokov, D. Repair of DNA double-strand breaks is not modulated by low-dose gamma radiation in C57BL/6J mice. Radiat Res. 1815 (5), 548-559 (2014).
- Runge, R., et al. Fully automated interpretation of ionizing radiation-induced gammaH2AX foci by the novel pattern recognition system AKLIDES(R). Int J Radiat Biol. 88 (5), 439-447 (2012).
- Jucha, A., et al. FociCounter: A freely available PC programme for quantitative and qualitative analysis of gamma-H2AX foci. Mutat Res. 696 (1), 16-20 (2010).
- Garty, G., et al. The RABIT: a rapid automated biodosimetry tool for radiological triage. Health Phys. 98 (2), 209-217 (2010).
- Kovalchuk, I. P., et al. Age-dependent changes in DNA repair in radiation-exposed mice. Radiat Res. 182 (6), 683-694 (2014).
- Rube, C. E., et al. DNA repair in the context of chromatin: new molecular insights by the nanoscale detection of DNA repair complexes using transmission electron microscopy. DNA Repair. 10 (4), 427-437 (2011).
- Amundson, S. A., Do, K. T., Fornace, A. J. Induction of stress genes by low doses of gamma rays. Radiat Res. 152 (3), 225-231 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved