Method Article
Mesure de dommages et réparation de l'ADN dans les splénocytes de souris Après chronique
Dans cet article
Résumé
A protocol to evaluate changes in DNA damage levels and DNA repair capacity that may be induced by chronic in vivo low dose irradiation in mouse spleen lymphocytes, by measuring phosphorylated histone H2AX, a marker of DNA double-strand breaks, using flow cytometry is presented.
Résumé
L'exposition aux rayonnements à faible dose peut produire une variété d'effets biologiques qui sont différentes en quantité et de la qualité des effets produits par de fortes doses de rayonnement. Aborder les questions relatives à la sécurité de la santé environnementale, professionnelle et publique d'une manière appropriée et justifiée scientifiquement repose largement sur la capacité de mesurer avec précision les effets biologiques des polluants à faible dose, tels que des substances chimiques et des rayonnements ionisants. dommages à l'ADN et la réparation sont les plus importants indicateurs précoces de risques pour la santé en raison de leurs conséquences à long terme potentiels, tels que le cancer. Ici, nous décrivons un protocole pour étudier l'effet de l'exposition in vivo chronique à de faibles doses de γ- et β-rayonnement sur les dommages de l'ADN et la réparation dans les cellules de rate de souris. En utilisant un marqueur couramment acceptée de cassures de l'ADN double-brin, phosphorylée H2AX histone appelé γH2AX, nous démontrons comment il peut être utilisé pour évaluer non seulement les niveaux de dommages à l'ADN, mais change ausside la capacité de réparation de l'ADN potentiellement produite par une faible dose de l'exposition in vivo. La cytométrie en flux permet une mesure rapide, précise et fiable des immunofluorescence marqué γH2AX dans un grand nombre d'échantillons. ADN double-brin de réparation des cassures peut être évaluée en exposant splénocytes extraites à une dose stimulante de 2 Gy pour produire un nombre suffisant de cassures de l'ADN pour déclencher la réparation et en mesurant l'induit (1 h post-irradiation) et les dommages de l'ADN résiduel (24 heures post-irradiation). Lésions de l'ADN résiduel serait indicative de réparation incomplète et le risque d'instabilité génomique à long terme et le cancer. Combiné avec d'autres analyses et points d'extrémité qui peuvent être facilement mesurés dans cette étude in vivo (par exemple, des aberrations chromosomiques, des fréquences de micronoyaux dans les réticulocytes de la moelle osseuse, l'expression des gènes, etc.), cette approche permet une évaluation précise et contextuelle des effets biologiques de facteurs de stress de bas niveau.
Introduction
Une importante controverse sur les effets nocifs potentiels de doses soit faibles ou très faibles de rayonnement et de la peur de publique de rayonnement, tirée par les images des bombardements atomiques d'Hiroshima et de Nagasaki et de rares accidents de centrales nucléaires ionisants (exacerbée par les médias de masse), a conduit à de très la réglementation et les normes qui sont potentiellement pas scientifiquement justifiée radioprotection stricte. Au cours des trois dernières décennies, de nombreux rapports ont documenté à la fois l'absence de nuisibles et la présence d'effets biologiques potentiellement bénéfiques induits par une faible dose rayonnement 1-4. Le principal facteur de risque pour la santé de rayonnement est la probabilité de cancer, estimé sur la base des études épidémiologiques des survivants de la bombe atomique recevant des doses élevées ou moyennes de rayonnement. Extrapolation linéaire de ces données (dites linéaire sans seuil ou modèle LNT) est utilisé pour estimer les risques de cancer à faibles doses. Cependant, cette approche n'a pas reçu l'acceptation scientifique mondialet est fortement débattue 5.
Il est évident que d'autres études sont nécessaires pour clarifier cette question et peut-être améliorer les normes de radioprotection. Ces études devraient impliquer des traitements chroniques (meilleur rapprochement des expositions environnementales et professionnelles), dans des modèles animaux in vivo (meilleure pour les effets pour la santé humaine) et en extrapolant ces points extrêmes que les taux de lésions de l'ADN, réparation de l'ADN et la mutagénèse. Il est connu que l'ADN est la cible principale pour endommager les effets des rayonnements et incomplètes ou mal-réparation peut conduire à la mutagenèse et le développement du cancer 6.
Cassures double-brin d'ADN (ORD) sont l'un des types les plus délétères de lésions de l'ADN et peuvent conduire à la mort cellulaire et la tumorigenèse 7. Il est donc important de pouvoir mesurer de manière fiable et précise le niveau de l'ORD après l'exposition au rayonnement à faible dose et / ou d'autres facteurs de stress, tels que les polluants chimiques. L'un des marqueurs les plus sensibles et spécifiquesde l'ADN DSB histone H2AX phosphorylée est appelé γH2AX 8, mais d'autres marqueurs et procédés ont été suggérés 9,10. On estime que des milliers de molécules d'H2AX, dans le voisinage d'un ORD induite, sont impliqués dans la formation de γH2AX permettant la détection de l'individu ORD par marquage immunofluorescent avec un anticorps et la microscopie à fluorescence anti-γH2AX 11. La réaction est très rapide, atteignant son maximum entre 30 et 60 min. Il existe des preuves que γH2AX facilite la réparation de l'ADN de l'ORD en attirant d'autres facteurs de réparation des sites de pauses et en modifiant la structure de la chromatine pour ancrer extrémités d'ADN cassées et fournir un accès à d'autres protéines de réparation (12) examinés dans. À la fin de la réparation de l'ADN de l'ORD, γH2AX se dé-phosphorylée et / ou subit une dégradation, et des molécules d'H2AX nouvellement synthétisées remplacer γH2AX dans les zones touchées de la chromatine 10. La formation et la perte de γH2AX surveillance peut,par conséquent, fournir une estimation précise de l'ADN de l'ORD cinétique de réparation. Cette approche a été utilisée pour étudier la réparation de l'ORD dans diverses lignées cellulaires tumorales humaines irradiées avec des doses élevées de niveaux résiduels ORD rayonnement et son taux et ont été corrélée à la radiosensibilité 13-15.
Nous avons modifié cette approche expérimentale et appliquée à une étude in vivo de la souris pour examiner les effets des faibles doses de γ- chronique et β-irradiation sur les niveaux d'ADN de l'ORD et la réparation (Figure 1). Tout d'abord, nous démontrons une méthode pour effectuer une exposition chronique à long terme des souris à β-rayonnement soit émis par le tritium (hydrogène 3) sous la forme d'eau tritiée (HTO) ou que le tritium lié organiquement (OBT) dissous dans l'eau potable . Les deux formes sont attendus pour accumuler et / ou distribuer différemment dans le corps et, par conséquent, de produire différents effets biologiques. Les deux formes sont les dangers potentiels dans l'industrie nucléaire. Ce traitementva de pair avec une exposition chronique à γ-rayonnement à un débit de dose équivalente pour permettre une comparaison correcte des deux types de rayonnement, qui est crucial pour l'évaluation de leur efficacité biologique relative. Le bêta-rayonnement est constitué d'électrons, ce qui rend très différente de la γ-rayonnement, les photons de haute énergie. En raison de cette différence, Β-rayonnement représente danger pour la santé essentiellement interne et peut produire des effets biologiques différents par rapport à γ-rayonnement. Cette complication a donné lieu à des controverses importantes sur la réglementation de l'exposition à la β-rayonnement émis par HTO. Ainsi, les niveaux réglementaires de HTO dans l'eau potable pour le public varient de 100 Bq / L en Europe à 75.000 Bq / L en Australie. Il est donc important de comparer les effets biologiques de HTO à des doses équivalentes de γ-irradiation. Deuxièmement, le taux de l'ADN de l'ORD est mesurée dans les splénocytes isolés lors de l'achèvement des expositions chroniques à l'aide immunofluorescence marqué γH2AX détectered par cytométrie de flux. Ceci permet l'évaluation de l'importance des dégâts infligés par les ADN exposition in vivo. Cependant, il est raisonnable de s'attendre à ce que de telles expositions de bas niveau ne peuvent pas produire des taux détectables d'ADN ORD; à la place, quelques changements cachés / réponses peuvent être attendus qui pourraient affecter la capacité des cellules à réparer les dommages de l'ADN. Ces changements, si trouvé, peuvent être soit de stimulation (produisant un effet bénéfique) ou inhibiteur (produisant un effet délétère). Le protocole proposé permet de révéler de tels changements en contestant les splénocytes extraites avec une forte dose de rayonnement qui produit une quantité importante de dommages (par exemple, 2 Gy produisant environ 50 ADN ORD par cellule ou d'un 3 -. Augmentation de 5 fois dans le niveau de γH2AX totale) . Par la suite, la formation et la perte de γH2AX, reflétant l'initiation et l'achèvement de la réparation DSB, est surveillée par cytométrie de flux. De cette façon, non seulement de base et des niveaux d'ADN ORD induites par le traitement peuvent être mesurés, maisaussi son effet potentiel sur la capacité des cellules à répondre et les dommages de réparation de l'ADN induite par des taux de stress beaucoup plus élevés.
Protocole
Toutes les procédures de manutention et de traitement souris doivent se conformer aux règles édictées par les programmes de l'Assemblée législative et / ou soins des animaux et approuvées par un comité de protection des animaux. Toutes les méthodes décrites dans le présent protocole ont été effectuées en conformité avec les lignes directrices du Conseil canadien de protection des animaux, avec l'approbation du comité de protection des animaux.
ATTENTION: Tous les travaux avec la radioactivité (y compris, mais non limité à la manipulation de tritium, γ-irradiation externe, la manipulation des tissus animaux radioactifs, déchets de litière) devrait adhérer aux règles énoncées par les autorités de l'Assemblée législative et / ou de radioprotection et être effectuée par des personnes autorisées le personnel dans un laboratoire et / ou des installations certifiées.
1. animale Travail
- Groupement animal
- Si les souris arrivent d'une organisation externe, acclimater les animaux pendant au moins 10 jours dans l'animalerie. Si l'étude comprend plusieurs groupes de traitement, veiller à ce que le fournisseur des animaux peut envoyer all les animaux comme un seul lot.
- Allouer au hasard les souris à des groupes de 10 souris par groupe de traitement. Si vous utilisez des souris mâles de la souche C57BL / 6, ont le fournisseur des animaux pré-organiser la randomisation de très jeunes C57BL / 6 mâles dans leur établissement pour atténuer les problèmes d'agressivité.
- Exposition chronique de souris à β-Internal Radiation
- Préparer des concentrations de travail de tritium (10 kBq / L et 1 MBq / L) dans l'eau potable de la souris en diluant le stock initial de HTO et OBT (un mélange de proline tritiée, l'alanine et la glycine acides aminés) des solutions.
- Validate les concentrations finales de tritium dans l'eau de boisson par mesure de la radioactivité en utilisant un compteur à scintillation liquide. Ajuster la concentration, si nécessaire.
- Traiter les animaux pendant un mois en fournissant un accès ad libitum à l'eau de tritium. Si l'eau de traitement est faible au cours de la période de deux semaines, ajouter plus d'eau. Sinon, changer bouteilles à deux semaines.
- Traiter imposture irradié commandesouris identique. Gardez-les dans une pièce séparée «propre» ou sur une grille séparée "propre" sous pression d'air positive pour éviter la contamination croisée tritium dans l'air.
- Exposition chronique de souris externe à γ-radiations
Remarque: γ-irradiation installation / équipement varie en fonction de l'emplacement. - En utilisant des méthodes de dosimétrie disponibles, déterminer les distances à partir d'une source de rayonnement γ qui ont des champs de rayonnement produisant les doses désirées. Assurer l'homogénéité de champs de rayonnement dans les zones couvrant les cages pour animaux.
Remarque: 1,7 Gy / h est équivalente à un taux de dose produite par une MBq / L de tritium dans le corps. - Exposer les souris en plaçant les cages de souris à des distances déterminées à l'étape 1.3.1 pour un mois. Réduire interruption quotidienne de γ-irradiation à 30 min. Utilisez dosimètres à thermoluminescence pour mesurer des doses totales absorbées.
2. sacrifices et d'échantillonnage
- Élaborer des instruments chirurgicaux stériles, 60 mm boîtes de Pétri avec insérées crépines cellulaires 70 microns, 15 ml et tubes de 1,5 ml, milieu RPMI supplémenté avec 5% de sérum fœtal bovin (FBS) et le lieu tout dans une enceinte de sécurité biologique. Assurer la stérilité du travail est cruciale.
- Distribuer 5 ml de milieu RPMI dans chaque boîte de Pétri de 60 mm.
- Sacrifiez souris en utilisant une méthode approuvée par le comité de protection des animaux. La dislocation cervicale est un bon choix pour le travail de splénocyte décrites dans ce protocole. Toutefois, si des échantillons de sang pour les autres essais (par exemple, pour le mFISH, le micronoyau de bloc de cytochalasine ou d'autres dosages de genetoxicity commune) sont nécessaires, utiliser ponction intra-cardiaque après l'anesthésie à l'isoflurane.
- Placez l'animal en décubitus dorsal, la tête vers le loin de vous. Vaporiser la souris vers le bas avec 70% d'éthanol. En utilisant des pinces, saisir la peau antérieurement à l'ouverture de l'urètre et de faire une petite incision avec des ciseaux dans la région périnéale.
- De cette incision, couper le long de la ligne médiane ventrale de la cavité de la poitrine, en faisant attention à ne couper la peau et non la paroi musculaire dessous. Disséquer la peau loin de la ligne médiane.
- Saisir la paroi abdominale avec une pince et couper le long de l'axe médian de la paroi musculaire à ouvrir la cavité abdominale.
- Exciser la rate par une légère saisissant avec des pinces stériles et en tirant doucement sur elle, tout en réduisant simultanément loin le tissu conjonctif avec des ciseaux.
- Coupez un petit morceau de la rate (environ 1/10 de la rate) et placer dans un tube de 1,5 ml. Aligner congeler dans de l'azote liquide pour un stockage ultérieur à -80 ° C pour des analyses supplémentaires.
- Passer le reste de la rate dans un tamis cellulaire à l'intérieur d'une boîte de Petri de 60 mm avec 5 ml de milieu RPMI pré-distribué.
- Passez à la prochaine souris.
Remarque: Extrait rates peuvent être conservés dans des boîtes de 60 mm avec les médias (pour un maximum de 2 heures), tandis que le reste des souris sont sacrificéd. En fonction du nombre de participants, entre 5 et 15 souris peuvent être traitées en une seule journée.
3. Préparation de cultures splénocytes
- Homogénéiser la rate en hachant l'intérieur d'un tamis cellulaire avec des pinces stériles avec une extrémité recourbée.
- Retirer le filtre de la cellule et de recueillir la suspension de cellules filtré à partir de la boîte de 60 mm dans un tube de 15 ml.
- Rincer la crépine de cellules avec 5 ml de milieu pour collecter le reste des cellules.
- Tubes à centrifuger à 300 g pendant 5 min à température ambiante.
- Décanter le surnageant et remettre en suspension le culot dans 10 ml de RPMI.
- Tubes à centrifuger à 300 g pendant 5 min à température ambiante.
- Décanter le surnageant et remettre en suspension le culot dans 5 ml de RPMI.
- Transfert 4 ml de suspension de cellules dans un ballon de culture de 25 ml de tissu et la déplacer dans un incubateur à CO2 (37 ° C, 5% de CO2, 80% d'humidité)
4. Remettre en question l'irradiation et de fixation
- Transférer lereste 1 ml de suspension cellulaire de l'étape 3.8 dans un tube de 1,5 ml sur la glace et centrifuger à 300 g pendant 5 min à 4 ° C. dommages à l'ADN mesurée dans cet échantillon représentera les dommages induite par le traitement et t = 0 point de données pour la construction d'une courbe de réparation d'ADN.
- Aspirer soigneusement le surnageant en utilisant une pompe à vide. Doucement remettre en suspension le culot dans 1 ml de tampon TBS (Tris 20 mM pH 7,4, NaCl 150 mM, KCl 2,7 mM).
- Tubes à centrifuger à 300 g pendant 5 min à 4 ° C. Aspirer soigneusement le surnageant en utilisant une pompe à vide. Doucement remettre en suspension le culot dans 300 pi de TBS.
- Tout en mélangeant au vortex à faible vitesse, ajouter 700 ul de -20 ° C 100% d'éthanol. Fermer le couvercle et retourner plusieurs fois pour mélanger.
- Conserver les échantillons à -20 ° C. Splénocytes fixes dans l'éthanol peuvent être conservés à -20 ° C pendant au moins 12 mois sans perte notable dans le signal γH2AX.
- Irradier les cultures de splénocytes de l'étape 3.8 avec un γ-rad difficile dose de iation de 2 Gy à un débit de dose ≥ 200 mGy / min à l'aide disponible dispositif d'irradiation.
Remarque: Le but de cette irradiation est d'induire l'ADN ORD pour contester la machinerie de réparation. Les rayons X peuvent également être utilisés à cette fin. - Remettre immédiatement les cultures à un incubateur à CO2.
- 1 heure après la difficile irradiation 2 Gy, retirez les cultures de l'incubateur à une enceinte de sécurité biologique. Pour prélever un échantillon aliquote représentant, doucement remettre en suspension les cellules à l'aide d'une pipette et le transfert de 1 ml de la suspension cellulaire à un tube de 1,5 ml sur de la glace. Remettre les cultures de cellules à un incubateur à CO 2.
- Tubes à centrifuger à 300 g pendant 5 min à 4 ° C. Aspirer soigneusement le surnageant en utilisant une pompe à vide. Doucement remettre en suspension le culot dans 1 ml de TBS.
- Répétez les étapes 4.3 à 4.5.
- 24 heures après la 2 Gy γ-irradiation difficile, la récolte et la fixer à 24 heures = échantillon tel que décrit à l'étape 4/8 à 4/10.
Remarque: En règle générale, 15 - 30 échantillons par jour peuvent être immunofluorescence étiquetés et analysés par cytométrie de flux en un seul passage. Pour assurer une comparaison exacte entre les groupes de traitement, y compris l'échantillon (s) de chaque groupe. Voir aussi la référence 16 pour plus de détails.
- Préparer un ensemble marqué de tubes pour le nombre d'échantillons à traiter et les placer sur la glace. Utilisez 12 x 75 mm tubes en verre non plafonnés. La stérilité est pas nécessaire pour ce travail. Inclure un échantillon de contrôle historiques supplémentaires pour le marquage avec l'anticorps secondaire seulement ("Ab 2e seulement"). Utilisez cet exemple de commande historique dans tous les cytométrie de flux de fonctionner au sein d'une étude.
- Ajouter 0,5 ml de glace-froid SCT à chaque tube.
- Retirer splénocytes fixes de -20 ° C, vortex pendant 5 secondes et de transférer une aliquote de 0,5 ml à tubes préparés avec le SCT. Placez le reste des échantillons de nouveau dans -20 ° C stockage etgarder comme un échantillon de sauvegarde.
- splénocytes de centrifuger à 300 g pendant 5 min à 4 ° C. Décanter le surnageant et remettre en suspension doucement le culot dans 1 ml de glace-froid du TBS contenant 1% de FBS
- Centrifuger les cellules à 300 g pendant 5 min à 4 ° C. Décanter le surnageant et remettre en suspension doucement le culot dans 1 ml de tampon TST (0,05% de Triton X-100, 2% de FBS dans du TBS). Incuber pendant 20 min sur de la glace.
- Centrifuger les cellules à 300 g pendant 5 min à 4 ° C. Décanter le surnageant et remettre en suspension doucement le culot dans 200 pl d'anticorps anti-γH2AX primaire dilué 1: 150 dans du tampon TST. Utilisez 200 pi de TST pour le "2e Ab seulement" échantillon de contrôle.
- tubes de position sur un agitateur rotatif à un angle de 45 - 60 ° et agiter pendant 1,5 h à 300 g à RT.
- Bien que les tubes sont en incubation, préparer un volume suffisant (200 ul / échantillon) de l'anticorps secondaire anti-souris de chèvre conjugué à Alexa-488 à une dilution de 1: 200 dans du tampon TST.
Remarque: Tous les travaux impliquant Alexa-488anticorps conjugué (étapes 5.10 à 5.16 ci-dessous) doit être effectuée dans des conditions de faible luminosité et des échantillons étiquetés doit être protégé de la lumière en enveloppant les tubes dans une feuille d'aluminium. - Une fois que le 1,5 heures d'incubation est terminée, ajouter 1 ml de TBS glacée contenant 2% de FBS à chaque tube et centrifuger à 300 g pendant 5 min à 4 ° C. Décanter le surnageant et remettre en suspension doucement le culot dans 1 ml de TBS contenant 2% de FBS.
- Centrifugeuse à 300 g pendant 5 min à 4 ° C. Décanter le surnageant et remettre en suspension doucement le culot dans 200 pl de la solution d'anticorps secondaire de l'étape 5.8.
- Incuber les échantillons sur une plate-forme agitation pendant 1 h comme dans l'étape 5.7.
- Ajouter 1 ml de glace-froid du TBS contenant 1% de FBS.
- Centrifugeuse à 300 g pendant 5 min à 4 ° C. Décanter le surnageant et remettre en suspension doucement culot dans 1 ml de glace-froid SCT.
- Centrifugeuse à 300 g pendant 5 min à 4 ° C. Décanter le surnageant et remettre en suspension doucement le culot dans 0,5 ml de TBS contenant 50 ug / mliodure de propidium.
- Incuber pendant 5 min à température ambiante à l'abri de la lumière.
- Analyser les échantillons sur un cytomètre de flux en utilisant des protocoles spécifiques à l'instrument 16. Lisez au moins 10 000 cellules par échantillon.
Résultats
La figure 2 montre des exemples de cytométrie de flux graphiques attendues pour splénocytes préparés en utilisant le procédé décrit ici. Les cellules sont d'abord déclenchés sur la base du <électronique scatter volume côté> nuage de points (figure 2A et 2D; volume électronique est équivalente à diffusion vers l'avant). FL3 / propidium histogrammes iode (Figure 2B et 2E) confirment la distribution du cycle cellulaire normal. Signal de γH2AX calculé en utilisant le canal FL1 moyenne confirme une augmentation> 2 fois dans l'ADN ORD à 2 Gy-cellules (Figure 2F) irradié par rapport au témoin non traité (figure 2C). Ensuite, nous avons examiné la sensibilité de la méthode de mesure marqué γH2AX immunofluorescence par cytométrie en flux dans des splénocytes de souris décrit. La figure 3A montre les niveaux γH2AX, indicatif d'ADN DSB, dans les splénocytes de souris 1 heure après l'exposition ex vivo soit faible (0,1Gy) ou deux doses de Gy) γ-irradiation par rapport au témoin non traité (haute. On constate que 0,1 Gy a induit une légère augmentation du niveau ORD et cette augmentation était statistiquement significative. Le 3 fois forte induction a été prévu et détecté après l'exposition 2 Gy. Pour valider la spécificité de γH2AX marquage immunofluorescent de la manière décrite dans le protocole, les cellules marquées ont été examinées avec un microscope à fluorescence. Le motif de foyers analogue marqué observé indique que le signal de fluorescence provient de l'individu à l'intérieur de l'ADN DSB la chromatine (figure 3B).
Les résultats représentatifs de l'évaluation du taux d'ADN ORD et leur réparation dans les splénocytes de souris exposées pendant un mois à de très faibles concentrations d'eau tritiée (10 kBq / L) sont présentés à la figure 4. On peut voir (figure 4A) que bien que le traitement a entraîné une augmentation du niveau basal de γH2AX 10%, le changement avait pas det statistiquement significative (N = 5, un échantillon test t de Student). En outre, la formation mesurée et la perte de γH2AX après la difficile irradiation 2 Gy, représentant la cinétique de l'ADN ORD réparation, n'a pas été différent entre les cellules de la souris contrôles et HTO-traitées (figure 4B).
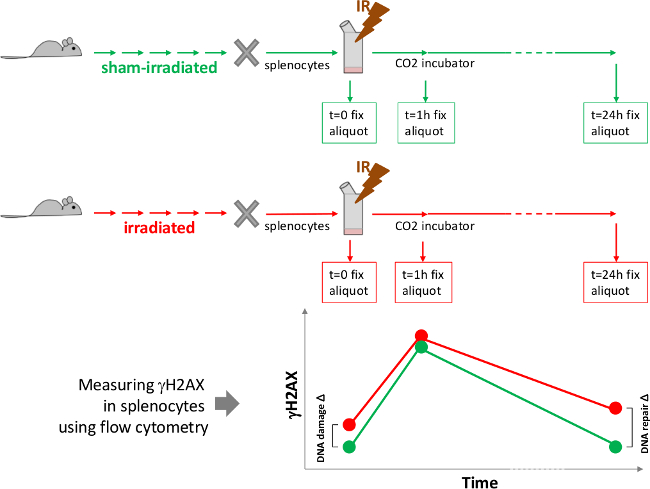
Figure 1. Schéma expérimental pour évaluer l'effet de l'irradiation chronique in vivo sur des lésions de l'ADN et de réparation de l'ADN. Après le traitement in vivo de souris avec irradiation chronique pendant une période de temps désirée, les souris sont sacrifiées et les cultures de splénocytes sont fixées et exposées à un défi irradiation. Aliquotes splénocytes sont collectés et fixés à différents moments après la dose difficile. Niveaux de γH2AX sont ensuite mesurées en utilisant la immunofluorescencebeling et détection par cytométrie de flux. La courbe en bas de la figure est un schéma de données attendues. Gamma-H2AX niveau augmente considérablement tôt après l'irradiation difficile suivie d'une baisse à la valeur de contrôle, si l'ADN réparation est terminée. dommages à l'ADN Δ représente les dégâts produits en raison du traitement expérimental de souris et de réparation de l'ADN Δ représente l'effet du traitement de la souris sur la capacité de réparation de l'ADN de l'ORD. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
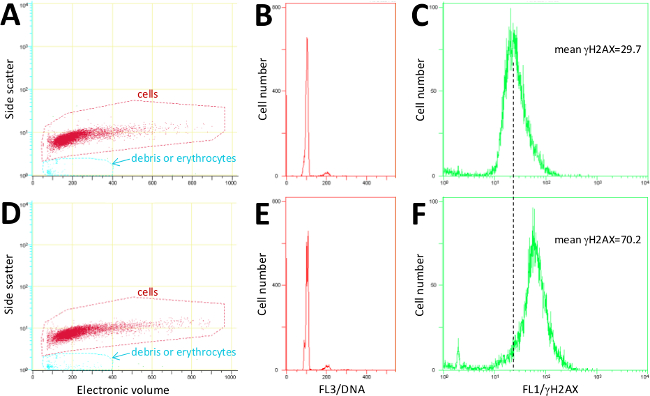
Figure 2. Représentant cytométrie de flux de données brutes. (A, D) Les diagrammes de dispersion et les régions de déclenchement pour splénocytes et les débris cellulaires et les érythrocytes. (B, E) histogrammes d'ADN représentant les distributions du cycle cellulaire. (C, F) γ-H2AX fluorescence histogramme et les valeurs moyennes de fluorescence. Données en ensembles (AC) ont été obtenus auprès d'un représentant des cellules de rate de témoins non traités, alors que les données dans des ensembles (D- F) ont été obtenues à partir de cellules irradiées avec 2 Gy γ-rayonnement et récoltées 1 h après l'irradiation. S'il vous plaît cliquer ici pour voir une plus grande version de ce chiffre.

Figure 3. Détection de γ H2AX par cytométrie de flux est sensible et spécifique. (A) Des splénocytes fraîchement isolés à partir de souris mâles CBA ont été irradiés avec 0,1 ou 2 Gy de rayonnement γ-ou sham-traitée et on a laissé se développer réponse γH2AX pendant 1 heure. Les cellules ont ensuite été fixées, par immunofluorescencemarqué avec un anticorps anti-γH2AX et analysées par cytométrie en flux. Des valeurs moyennes normalisées ± SD sont présentés (N = 12). * Et *** signifient différence statistique avec p <0,05 et p <0,001, respectueusement (t sur un échantillon -test de l'étudiant). (B) microphotographies représentatifs de témoin non traité (UT) ou 2 Gy irradié splénocytes immunofluorescence marquées avec anti-γH2AX anticorps. Le motif de foyers comme de la fluorescence verte confirme la spécificité du marquage d'immunofluorescence pour γH2AX. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 4. Les résultats représentatifs montrant l'absence d'effet produit par une exposition de 1 mois de souris à Wate tritiéer (HTO) au niveau de l'ADN et la réparation ORD. (A) splénocytes ont été isolés à partir de souris traitées avec 10 kBq / L de HTO dans l'eau potable des animaux et de contrôle. Le niveau de γH2AX été mesurée en utilisant l'étiquetage par immunofluorescence et cytométrie de flux comme décrit dans le protocole. Moyenne γH2AX niveaux par rapport à ceux du contrôle ± SD de fluorescence sont présentés (N = 5). Ces données ont été générées à partir du temps t = 0 point qui a été utilisé sur la figure 3B pour l'évaluation de l'ADN DSB réparation. (B) Des splénocytes isolés ont été exposés à une dose de 2 Gy difficile γ-irradiation et des aliquotes de cellules ont été fixées à temps t = 0, 1 et 24 heures après l'irradiation difficile. Fluorescence de γH2AX par rapport à son propre t = 0 commande moyenne est affichée ± SD (n = 5). S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
Discussion
Le protocole présenté dans ce document est utile pour la réalisation à grande échelle de la souris dans les études in vivo portant sur les effets génotoxiques des faibles niveaux de divers agents chimiques et physiques, y compris les rayonnements ionisants. Notre installation unique et spécifique des animaux exempts de pathogènes équipé d'un irradiateur GammaBeam 150 et une salle d'irradiation longue de 30 mètres permet la réalisation d'études long de la vie impliquant des irradiations faibles ou très faibles débits de dose sur des centaines voire des milliers de souris. Les petites installations d'irradiation pour l'irradiation chronique à faible dose peuvent être mis en place dans une université ou un milieu hospitalier où les études sont menées régulièrement radiobiologie et les directives de radioprotection / règlements sont appliqués. Cependant, les réglementations plus strictes sont normalement à des installations conçues pour l'irradiation interne des animaux où la manipulation des radionucléides, comme le tritium, est effectuée. Bien que rare, des laboratoires certifiés pour de telles études d'exposition aux radiations internes existent dans divers rerecherche institutions mondiales et leurs capacités uniques peuvent être utilisés pour les études décrites dans le présent protocole.
Dans le protocole, nous utilisons le marquage immunofluorescent de γH2AX d'évaluer avec précision les taux d'ADN produites par l'ORD expositions expérimentales. Niveau plus important encore, l'introduction d'une irradiation difficile livré ex vivo pour splénocytes extraits permet d'évaluer l'intégrité de la réponse de l'ADN de l'ORD (niveau γH2AX à 1 h après la provocation) et de l'ADN ORD réparation (γH2AX à 24 h par rapport à 0 h). Il convient de noter que la quantification de foyers γH2AX par cellule par microscopie de fluorescence peut fournir une plus grande sensibilité par rapport à la cytométrie en flux. Par exemple, des doses aussi faibles que 0,001 Gy ont été signalés pour produire une augmentation significative du nombre de foyers γH2AX par cellule. Cependant, l'utilisation de la détection de γH2AX à base de cytométrie de flux fournit des avantages par rapport à l'analyse de fluorescence microscopie becautiliser nécessite moins de temps pour la mesure, il ne nécessite pas un personnel hautement spécialisé / formés et il évite γH2AX lié à la prise de décision subjective foci reconnaissance et le comptage. Ces avantages sont essentielles pour les études animales à grande échelle. Une expérience typique des animaux avec 10 groupes de traitement et les 10 souris par groupe se traduira par des échantillons x 3 100 = 300 spléniques, si le procédé proposé (Figure 1) est suivie. Pour générer des données à partir de ce nombre d'échantillons, environ 100 heures seront nécessaires en utilisant la cytométrie de flux. Alternativement, si elle est faite par des analyses microscopiques manuelles, la même tâche faudrait au moins 300 heures, en utilisant une estimation prudente de 40 min de temps de microscope très exigeant par échantillon. Bien que des tentatives pour automatiser l'analyse et la notation des foyers γH2AX ont été faites 17-19, ils ont tous un certain nombre de limitations. En particulier, la forme ronde et la petite taille de splénocytes de souris et lymphocytes, il est impossible de résoudre tous les individual γH2AX foci au microscope. Alors que les cellules adhérentes ont été reçu avec succès par les systèmes de microscopie automatisée pour γH2AX foyers, aucun succès n'a été mise en évidence soit de splénocytes ou des lymphocytes de souris.
La meilleure façon d'éliminer la variabilité au jour le jour dans les valeurs mesurées de signaux γH2AX par cytométrie de flux est d'inclure les échantillons expérimentaux du groupe et de contrôle dans la même série et de calculer les changements de γH2AX relatives dans chaque course. Recommandations supplémentaires incluent: a) un contrôle historique constitué de non traitée et 2 Gy irradié échantillon est utilisé dans chaque course; b) une personne exécute toutes les procédures d'étiquetage des anticorps; c) un stock unique de tampons et un seul lot d'anticorps, à la fois primaires et secondaires, est utilisé pour l'ensemble des échantillons dans une expérience. Il est également essentiel d'effectuer un cytomètre de flux test de contrôle de la qualité recommandée par le fabricant de l'appareil régulièrement et avant chaque série d 'échantillons. Ceci est required pour vérifier l'alignement du système optique et fluidique de l'instrument et contribue également à réduire au minimum la variation de jour en jour dans fluorescence mesurée γH2AX entre les échantillons à comparer mis en commun ou dans un groupe.
Il convient de souligner que l'utilisation d'un plus grand nombre de points dans le temps (par exemple, 1, 2, 4, 6 heures) après l'irradiation difficile peut aider à analyser et mesurer à court terme cinétique ADN ORD de réparation plus en détail 16. Cependant, le potentiel de réparation générale et de la probabilité d'effets retardés sur la santé seraient représentés par le dommage résiduel mesuré seulement à 24 heures et par rapport à celui observé au point de temps initial (t = 0) 13-15 (Figure 4).
Depuis niveaux γH2AX basales sont connus pour augmenter chez les animaux âgés ou les cellules sénescentes 20, pour une interprétation plus précise des résultats obtenus dans les études de la souris de l'exposition à long terme (> 6 mois) en utilisant la méthode décrite, el'utilisation de e d'un jeune groupe non traité, en plus d'un contrôle de l'âge appariés, serait souhaitable. Bien que certains rapports indiquent que γH2AX peut augmenter dans les cellules proliférantes, qui ne seraient pas liées à l'ADN de l'ORD, ce qui peut facilement être contrôlé par la mesure de la phase S et G2 / M-phase des fractions de cellules en utilisant des histogrammes d'ADN (figure 2A, D). Si certaines conditions expérimentales empêchent encore un chercheur de l'aide γH2AX comme un marqueur de dommages à l'ADN (pour les raisons décrites ci-dessus ou de leur combinaison), une autre protéine formant dommages à l'ADN des foyers, comme 53BP1, peut être utilisé 21.
Bien que nous ayons pas tenté d'utiliser cette méthode pour les tissus non lymphoïdes, tels que les muscles, le cœur, le cerveau et d'autres, il semble difficile de les traiter pour la cytométrie de flux. Les coupes de tissus et de la microscopie pour γH2AX foyers comptage serait la méthode de choix, si l'analyse de ces tissus est nécessaire. Cependant, d'autres cellules lymphoïdes, telles que le sang périphérique lymphocytes, des lymphocytes de moelle osseuse ou des thymocytes, peuvent être utilisés pour mesurer les niveaux γH2AX par le procédé décrit. L'avantage d'utiliser des lymphocytes de la rate est la simplicité relative de la préparation de la suspension cellulaire et le grand nombre de cellules qui peuvent être isolées à partir d'une rate. Cela devient encore plus avantageux que les points terminaux supplémentaires sont inclus dans l'étude. Dans notre expérience, un rendement typique de splénocytes par souris permet la collecte d'au moins 10 aliquotes, chacun adapté à un quelconque des dosages suivants: cytométrie en flux, RT-qPCR pour le gène ou l'expression des miARN, western blot, l'ADN génomique pour la méthylation CpG dosage. Ainsi, des aliquotes de splénocytes supplémentaires collectées en parallèle à celles pour le point final γH2AX peuvent être utilisés pour mesurer l'expression de gènes impliqués dans la signalisation des dommages de l'ADN et de réparation réponses. Ces gènes que Gadd45a et CDKN1A, qui sont normalement transcriptionnellement régulé à la hausse en réponse à des traitements cytotoxiques 22, peuvent fournir un indice quant à aiguiserses cellules sont correctement réagissent à l'influence du stress difficile. De même, les taux de protéine et les modifications post-traductionnelles intervenant dans les réponses au stress peuvent être évalués. Enfin, il est peu probable que l'une des étapes de la procédure d'extraction, si elle est effectuée de la manière décrite ici, peut induire γH2AX dans les splénocytes.
Il serait bénéfique et fortement recommandé de goûter organes et de tissus supplémentaires au cours de sacrifices pour compléter lésion de l'ADN et de réparation données obtenues pour splénocytes que selon le protocole présenté avec d'autres points d'extrémité. Par exemple, nous recueillons régulièrement les cellules de moelle osseuse pour le test in vivo du micronoyau de la moelle osseuse, tissus différents pour β-galactosidase de la sénescence associée et réparation de l'ADN des mesures d'expression des gènes. La capacité de recueillir d'autres tissus dépendrait de l'appui technique disponible pendant sacrifices; Toutefois, il peut aider de manière significative dans l'interprétation correcte des résultats et la construction d'un much biologiquement plus systémique image pertinente de la réponse au traitement de bas niveau à l'étude.
Déclarations de divulgation
The authors declare that there are no known competing financial interests.
Remerciements
The authors would like to acknowledge the contribution of our colleagues Sandrine Roch-Lefevre and Eric Gregoire of the Institute of Radioprotection and Nuclear Safety (Paris, France). This work was supported by the Government of Canada Science and Technology program at Canadian Nuclear Laboratories (Chalk River, Ontario, Canada), the CANDU Owners Group (Toronto, Ontario, Canada), the Canadian Nuclear Safety Commission and by the Institute of Radioprotection and Nuclear Safety (Paris, France).
matériels
| Name | Company | Catalog Number | Comments |
| HTO: tritiated water, [3H] | locally obtained from a nuclear reactor | stock activity 3.7 GBq/mL; can be substituted with HTO from Perkin Elmer | |
| OBT: Alanine, L-[3-3H]: organically bound tritium (OBT) | Perkin Elmer | NET348005MC | 1 mCi/ml (185 MBq) |
| OBT: Glycine, [2-3H]: organically bound tritium | Perkin Elmer | NET004005MC | 1 mCi/ml (185 MBq) |
| OBT: Proline, L-[2,3-3H]: organically bound tritium (OBT) | Perkin Elmer | NET323005MC | 1 mCi/ml (185 MBq) |
| tritiated water, [3H] (HTO) | Perkin Elmer | NET001B005MC | substitute for HTO of local origin |
| GammaBeam 150 irradiator | Atomic Energy of Canada Limited | locally manufactured | can be substituted with another g-radiation source of sufficiently low activity |
| Tween-20 | Sigma Aldrich | P1379-500ML | |
| RPMI | Fisher Scientific | SH3025501 | Hyclone RPMI 1640 with L-Glutamine and HEPES 500mL |
| fetal bovine serum | Sigma Aldrich | F1051-100ML | |
| anti-gH2AX antibody, clone JBW301 | Millipore | 05-636 | |
| Alexa fluor-488 goat anti-mouse antibody | Life Technologies (formerly Invitrogen) | A21121 | |
| propidium iodine | Sigma Aldrich | P4864-10ML | 1 mg/ml |
| ethanol | Commercial Alcohols | P006-EAAN | 500 ml bottles Absolute Ethanol |
| 1.5 ml tubes | Fisher Scientific | 2682550 | microcentrifuge tubes |
| 15 ml tubes | Fisher Scientific | 05-539-5 | sterile polypropylene centrifuge tubes |
| liquid nitrogen | Linde | P110403 | |
| 12 x 75 mm uncapped glass tubes | Fisher Scientific | K60B1496126 | disposable borosilicate glass tubes with plain end |
| T25 flasks | VWR | CA15708-120 | nunc tisue culture 25ml flask (supplier no. 156340) |
| scissors | Fine Science Tools | 14068-12 | Wagner scissors 12 cm sharp/sharp |
| forceps, straight | Fine Science Tools | 11008-13 | Semken forceps 13 cm, straight |
| forceps, curved | Fine Science Tools | 11003-12 | Narrow Pattern forceps 12 cm, curved |
| 60 mm petri dishes | VWR | CA25382-100 | BD Falcon tissue culture dish 60 x 15 mm |
| cell strainers, 70 mm | Fisher Scientific | 08-771-2 | Falcon cell strainers 50/case |
| PBS recipe: 1 tablet dissolved in 200 ml of deionized water, adjust pH to 7.4 if needed. | Sigma Aldrich | P4417-100TAB | Phosphate Buffered Saline Tablets |
| TBS recipe: to make 10x stock | |||
| 30 g TRIS HCl | Sigma Aldrich | T3253-1KG | Trizma hydrochloride |
| 88 g NaCl | Fisher Scientific | S271-500 | Sodium Chloride |
| 2 g KCl | Fisher Scientific | P217-500 | Potassium Chloride |
| Dissolve in 1 L of deionized water, adjust pH to 7.4 |
Références
- Mitchel, R. E., Jackson, J. S., McCann, R. A., Boreham, D. R. The adaptive response modifies latency for radiation-induced myeloid leukemia in CBA/H mice. Radiat Res. 152 (3), 273-279 (1999).
- Shadley, J. D. Chromosomal adaptive response in human lymphocytes. Radiat Res. 138 (Suppl 1), S9-12 (1994).
- Wiencke, J. K., Afzal, V., Olivieri, G., Wolff, S. Evidence that the [3H]thymidine-induced adaptive response of human lymphocytes to subsequent doses of X-rays involves the induction of a chromosomal repair mechanism). Mutagenesis. 1 (5), 375-380 (1986).
- Mitchel, R. E. The dose window for radiation-induced protective adaptive responses. Dose-Response. 8 (2), 192-208 (2010).
- Tubiana, M., Feinendegen, L. E., Yang, C., Kaminski, J. M. The linear no-threshold relationship is inconsistent with radiation biologic and experimental data. Radiology. 251 (1), 13-22 (2009).
- Gent, D. C., Hoeijmakers, J. H., Kanaar, R. Chromosomal stability and the DNA double-stranded break connection. Nat Rev Genet. 2 (3), 196-206 (2001).
- Jackson, S. P. Sensing and repairing DNA double-strand breaks. Carcinogenesis. 23 (5), 687-696 (2002).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem. 273 (10), 5858-5868 (1998).
- Schultz, L. B., Chehab, N. H., Malikzay, A., Halazonetis, T. D. p53 binding protein 1 (53BP1) is an early participant in the cellular response to DNA double-strand breaks. J Cell Biol. 151 (7), 1381-1390 (2000).
- Kinner, A., Wu, W., Staudt, C., Iliakis, G. Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Res. 36 (17), 5678-5694 (2008).
- Sedelnikova, O. A., Rogakou, E. P., Panyutin, I. G., Bonner, W. M. Quantitative detection of (125)IdU-induced DNA double-strand breaks with gamma-H2AX antibody. Radiat Res. 158 (4), 486-492 (2002).
- Yuan, J., Adamski, R., Chen, J. Focus on histone variant H2AX: to be or not to be. FEBS Lett. 584 (17), 3717-3724 (2010).
- Taneja, N., et al. Histone H2AX phosphorylation as a predictor of radiosensitivity and target for radiotherapy. J Biol Chem. 279 (3), 2273-2280 (2004).
- Olive, P. L., Banath, J. P., Sinnott, L. T. Phosphorylated histone H2AX in spheroids, tumors, and tissues of mice exposed to etoposide and 3-amino-1,2,4-benzotriazine-1,3-dioxide. Cancer Res. 64 (15), 5363-5369 (2004).
- Banath, J. P., Klokov, D., MacPhail, S. H., Banuelos, C. A., Olive, P. L. Residual gammaH2AX foci as an indication of lethal DNA lesions. BMC Cancer. 10, 4(2010).
- Blimkie, M. S., Fung, L. C., Petoukhov, E. S., Girard, C., Klokov, D. Repair of DNA double-strand breaks is not modulated by low-dose gamma radiation in C57BL/6J mice. Radiat Res. 1815 (5), 548-559 (2014).
- Runge, R., et al. Fully automated interpretation of ionizing radiation-induced gammaH2AX foci by the novel pattern recognition system AKLIDES(R). Int J Radiat Biol. 88 (5), 439-447 (2012).
- Jucha, A., et al. FociCounter: A freely available PC programme for quantitative and qualitative analysis of gamma-H2AX foci. Mutat Res. 696 (1), 16-20 (2010).
- Garty, G., et al. The RABIT: a rapid automated biodosimetry tool for radiological triage. Health Phys. 98 (2), 209-217 (2010).
- Kovalchuk, I. P., et al. Age-dependent changes in DNA repair in radiation-exposed mice. Radiat Res. 182 (6), 683-694 (2014).
- Rube, C. E., et al. DNA repair in the context of chromatin: new molecular insights by the nanoscale detection of DNA repair complexes using transmission electron microscopy. DNA Repair. 10 (4), 427-437 (2011).
- Amundson, S. A., Do, K. T., Fornace, A. J. Induction of stress genes by low doses of gamma rays. Radiat Res. 152 (3), 225-231 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon