Method Article
Etablissement et validation d’un modèle chez le rat d’hypertension artérielle pulmonaire associée à une fibrose pulmonaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, la méthode d’induction de l’hypertension artérielle pulmonaire associée à la fibrose pulmonaire (PF-PH) modèle de rat par injection de bléomycine dans les voies respiratoires est introduite. Nous proposons également une approche étape par étape pour valider ce modèle animal.
Résumé
Les patients atteints de fibrose pulmonaire courent un risque plus élevé de développer une hypertension pulmonaire, une complication de mauvais pronostic. À l’heure actuelle, le mécanisme de ce lien est encore mal compris. L’un des principaux obstacles aux progrès dans ce domaine est l’absence d’un modèle animal fiable pour reproduire la PF-PH. Cette étude visait à établir un modèle stable de rat PF-PH. Les rats ont été à jeun pendant la nuit avant l’intervention. Sous anesthésie au pentobarbital sodique (45 mg/kg), la trachée a été intubée à l’aide d’un tube PE50 inséré à une profondeur de 3 cm (la distance entre la glotte et le tube). La bléomycine (BLM) a été administrée par voie intratrachéale en une seule dose (5 mg/kg, dissoute dans 0,2 mL de NaCl à 0,9 %). Après l’injection, les rats ont immédiatement été tournés pour assurer une distribution uniforme du BLM. À 35 jours après l’injection de BLM, les rats présentaient une altération progressive de la fonction pulmonaire et une augmentation de la pression systolique ventriculaire droite et de l’hypertrophie ventriculaire droite, révélant les caractéristiques pathologiques de l’hypertension pulmonaire. Nous fournissons une méthode générale et fiable pour établir un modèle de PF-PH chez le rat.
Introduction
L’hypertension pulmonaire (HTP) due à une pneumopathie interstitielle (MPI) est fréquente cliniquement, avec une prévalence estimée de 10 % à 80 % chez les patients atteints de fibrose pulmonaire idiopathique (FPI), et elle est également fréquemment observée dans d’autres MPI fibrotiques 1,2. De nombreuses études ont montré que le développement de l’HTP est lié à une morbidité importante et à une survie réduite 3,4,5. Par rapport à l’hypertension artérielle pulmonaire (HTAP) du groupe 1, la pathogenèse de l’hypertension artérielle pulmonaire associée à la fibrose pulmonaire (PF-PH) reste mal comprise6. L’objectif de l’établissement d’un modèle animal de PF-PH chez le rat est de fournir un cadre fiable pour la recherche scientifique sur la fibrose pulmonaire associée à l’hypertension pulmonaire et d’explorer des pistes potentielles pour des applications thérapeutiques cliniques.
La bléomycine est un inducteur classique de la fibrose pulmonaire largement utilisé dans les modèles animaux7. D’autres recherches menées par Blackburn et coll.8 et notre laboratoire9 ont révélé que la bléomycine peut également déclencher des caractéristiques pathologiques typiques de l’hypertension pulmonaire, telles que l’augmentation de la pression systolique ventriculaire droite (RVSP) et l’hypertrophie ventriculaire droite. D’un point de vue mécanistique, la bléomycine induit une fibrose parenchymateuse pulmonaire, une vasoconstriction hypoxique et une réduction de la densité du lit vasculaire pulmonaire, conduisant ainsi au développement d’une hypertension pulmonaire6. De plus, nous avons observé une perte significative de cellules endothéliales vasculaires pulmonaires à partir du 7e jour du traitement par la bléomycine, cette perte s’aggravant progressivement au cours de l’expérience9. Ce phénomène suggère que le dysfonctionnement endothélial vasculaire pulmonaire induit par la bléomycine peut jouer un rôle potentiel dans l’initiation et la progression de l’hypertension pulmonaire.
En raison de la fibrose interstitielle pulmonaire, les patients atteints de FPI sont dans un état d’hypoxie pendant une longue période et des changements compensatoires se produisent dans les vaisseaux cardio-pulmonaires, ce qui conduit à l’hypertension pulmonaire6. L’utilisation de modèles animaux peut nous aider à mieux comprendre les mécanismes sous-jacents de la fibrose pulmonaire idiopathique humaine associée à l’hypertension pulmonaire. Bien que ce modèle ne puisse pas simuler entièrement les caractéristiques pathologiques des maladies humaines, il peut tout de même fournir des informations précieuses. Il existe de nombreux modèles expérimentaux simulant la fibrose pulmonaire, tels que la perfusion à dose unique de bléomycine dans les voies respiratoires, l’administration de facteurs de croissance transformants par vecteur viral et l’exposition à la silice 8,10. À l’heure actuelle, le modèle BLM est le modèle le plus largement utilisé et caractérisé car il peut être facilement induit en peu de temps et a une reproductibilité élevée. De plus, des changements temporels dans la fibrose pulmonaire ont été évalués dans un modèle murin de bléomycine, où une expression accrue des marqueurs de fibrose et des gènes associés à la pathologie de la maladie, tels que Col1A1 et Col1A2, a été observée du 15e au 21e jour8. Des changements cardiovasculaires, tels qu’une hypertrophie ventriculaire droite et une augmentation significative de la RVSP, ont été détectés au jour 3311 ou après. Dans le même temps, notre laboratoire a déjà évalué les modifications des paramètres PH et PF de modèles de rats induites par la bléomycine9. Nous avons constaté qu’en plus des caractéristiques de la fibrose pulmonaire (FP) telles que l’altération progressive de la fonction pulmonaire et le dépôt de collagène chez le rat, les caractéristiques typiques de l’hypertension pulmonaire (HTP) sont progressivement apparues dans les 7 à 35 jours suivant une instillation unique de bléomycine dans les voies respiratoires. RVSP et l’indice Fulton ont montré une augmentation de la dépendance au temps. Actuellement, divers animaux atteints de fibrose pulmonaire ont été rapportés dans la littérature. Certains experts ont suggéré que les modèles de rats présentaient une réponse fibrotique plus prononcée que les modèles murins12. Par conséquent, afin de mieux étudier la progression de la fibrose pulmonaire combinée à l’hypertension pulmonaire, un modèle de rat induit par la bléomycine est la clé.
Protocole
Les expériences sur les animaux décrites dans cette étude ont été approuvées par le Comité de soin et d’utilisation des animaux du premier hôpital affilié de l’Université de médecine de Guangzhou (numéro d’approbation éthique : 2018-456).
1. Acquisition de rats expérimentaux
- Divisez les rats en deux groupes : le groupe témoin normal et le groupe modèle, avec 7 rats dans chaque groupe. Utiliser des rats Sprague-Dawley (SD) mâles de 10 semaines pesant 200 ± 20 g pour l’étude
2. Induction du modèle de rat PF-PH
- Afin d’éviter la régurgitation des aspirations pendant la procédure, faites jeûner les rats pendant la nuit avant le modélisme.
- Anesthésier les rats par injection intrapéritonéale de pentobarbital sodique (45 mg/kg) pour assurer l’exactitude et la sécurité de l’intervention et minimiser la douleur et le stress chez les animaux. Confirmer les niveaux d’anesthésie chirurgicale par une absence de réponse au pincement des orteils. Dans le même temps, appliquez une pommade sur les yeux des rats pour éviter la sécheresse.
- Intubez la trachée du rat à l’aide d’un tube PE50 inséré à une profondeur de 3 cm (la distance entre la glotte et le tube).
- À l’aide d’une seringue de 1 mL (26 G), prélever 0,2 mL de bléomycine (5 mg/kg, dissous dans 0,2 mL de NaCl à 0,9 %). Injecter la seringue contenant le BLM dans les voies respiratoires à travers une canule en une seule dose. Pour les rats du groupe témoin, effectuer l’administration intratrachéale d’une solution saline normale stérile (0,2 mL). Au cours de ce processus, les rats n’ont pas besoin de soulager la douleur.
- Pour assurer une distribution uniforme de la bléomycine, placez le rat en position couchée, tenez-le doucement et tournez-le lentement. L’angle de rotation recommandé est de 30°-45°, en alternance entre les côtés. Chaque rotation doit être maintenue pendant 10 à 15 s, répétée 3 à 4 fois.
- Placez les rats sur des coussins chauffants pour aider à maintenir la température corporelle et surveillez de près leur état. Observez quand les rats commencent à se déplacer par eux-mêmes et transférez les animaux du coussin chauffant dans une cage séparée pour la récupération.
- Après 5 semaines d’injection de BLM, évaluez les rats pour déterminer si le modèle PF-PH a pu être établi avec succès en utilisant des méthodes telles que la surveillance échocardiographique, les mesures hémodynamiques et l’analyse histologique.
3. Suivi échocardiographique
- Anesthésier les rats à l’aide d’isoflurane à 4 %. Retirez la fourrure du rat avec une crème dépilatoire et appliquez du gel à ultrasons sur sa poitrine.
- Évaluer les paramètres fonctionnels et structurels du cœur droit chez le rat à l’aide d’une sonde à ultrasons de 250 MHz. Pour obtenir la meilleure vue longitudinale du ventricule, placez la sonde sur le côté gauche de la ligne médiane de la poitrine de l’animal.
- Selon l’anatomie individuelle, tournez la sonde de 15° dans le sens inverse des aiguilles d’une montre par rapport à la ligne parasternale gauche, avec l’incisive pointant vers son épaule droite, et ajustez les axes x et y en mode B de sorte que tout le cœur soit au centre du champ visuel.
- Sélectionnez Couleur pour afficher la couleur du flux sanguin afin de distinguer l’artère pulmonaire (le signal de débit sanguin de l’artère pulmonaire dans cette position est bleu).
- Sélectionnez le mode PW (PW Doppler), placez la ligne d’échantillonnage sous la valve pulmonaire et tournez le bouton d’angle PW pour ajuster la direction de la ligne d’échantillonnage de sorte que la direction de l’échantillonnage soit parallèle à la direction du flux sanguin de l’artère pulmonaire (environ 25°). Appuyez à nouveau sur la touche PW et obtenez le temps d’accélération/temps d’éjection du flux sanguin de l’artère pulmonaire (PAT/PET). Mesurez au moins cinq cycles cardiaques et faites la moyenne. Utilisez Cine pour enregistrer l’image.
- Ajustez l’animal à une tête basse et à un pied haut, placez la sonde à ultrasons au sommet du cœur de l’animal et dirigez les ultrasons le long du sommet du cœur pour obtenir la surface incisive à quatre chambres. Ajustez les axes x et y en mode B pour vous assurer que les quatre cavités cardiaques sont visibles.
- Affichez la ligne de mesure 2x en maintenant le mode M enfoncé et placez-la à la jonction de l’anneau valvulaire tricuspide et de la paroi libre ventriculaire droite. Mesurer la distance de déplacement de la valve tricuspide (TAPSE) au cours d’au moins trois cycles cardiaques et la conserver dans Cine.
- Placez la sonde sur la ligne médiane de la clavicule droite de la poitrine de l’animal et ajustez l’angle entre la sonde et l’encoche de la poitrine de l’animal à environ 45°. Ajustez l’image en mode B pour que le ventricule ventriculaire droit et le septum interventriculaire soient visibles.
- Sélectionnez le mode M pour afficher la ligne de mesure 2x et placez la ligne de mesure au milieu du septum interventriculaire. La ligne d’échantillonnage était perpendiculaire à la paroi libre du ventricule droit. Enregistrez l’image pour obtenir l’épaisseur de la paroi libre ventriculaire droite.
4. Estimation de la fonction pulmonaire
- Ouvrez le logiciel PFT et vérifiez que l’appareil est reconnu. Calibrer selon les instructions de l’équipement pour assurer la précision des capteurs de débit et des capteurs de pression. Définissez les paramètres de test dans le logiciel PFT, tels que la fréquence respiratoire, le volume courant, la durée du test, etc.
- Le mode de détection des animaux est le mode d’étude des rats. Allumez l’interrupteur de l’instrument de commande principal et assurez-vous que l’interrupteur de chaque amplificateur de signal est en position d’arrêt.
- Réglez le débit d’air en fonction du poids corporel de l’animal. Allumez l’écrou de régulation du débit d’air d’aspiration et réglez l’inspiration sur 5. Allumez l’écrou de régulation du débit d’air expiratoire et réglez l’expiration lente à -4. Réglez la valeur de pression sur 60 cm H2O, puis étalonnez l’instrument selon l’ordre du débit FRC, du débit, du débit élevé et de la pression pulmonaire avec une erreur inférieure à 0,5 %.
- Anesthésier les rats par injection intrapéritonéale de pentobarbital sodique (45 mg/kg) comme à l’étape 2.2. Coupez la peau le long du centre du cou et retirez le muscle couche par couche.
- Au niveau de la partie supérieure exposée de la trachée cervicale, faites une incision horizontale entre les anneaux cartilagineux trachéaux. Insérez rapidement la canule métallique dans l’incision trachéale, en vous assurant que la canule est correctement positionnée et sécurisée. Utilisez des sutures en fil de soie 4-0 pour fixer la canule à la trachée, l’empêchant de glisser ou de se déloger. Placez le rat dans le compartiment animal PFT et connectez la canule trachéale à l’interface du canal de circulation d’air à l’extérieur de l’instrument.
- Cliquez sur le bouton Démarrer et examinez la capacité vitale forcée (CVF) et la compliance pulmonaire dynamique. Pour assurer la cohérence des données, enregistrez chaque indicateur au moins 3 fois.
- Une fois le test terminé, les données sont enregistrées et exportées vers le logiciel d’analyse. Utilisez un logiciel statistique pour analyser les données et comparer les paramètres de la fonction pulmonaire de différents groupes.
5. Mesures hémodynamiques et histologiques
- Détection de la pression systolique ventriculaire droite (RVSP)
- Anesthésier les rats par injection intrapéritonéale de pentobarbital sodique (45 mg/kg) comme à l’étape 2.2. Confirmez que le rat a été correctement anesthésié en pinçant l’orteil pour vous assurer que le rat ne répond pas. Fixez l’abdomen du rat vers le haut sur le banc d’expérimentation et appliquez de la crème pour les yeux sur les yeux du rat pour éviter la sécheresse.
- Faites une incision (environ 4 cm) sur le côté droit du cou à l’aide de ciseaux chirurgicaux et séparez la veine jugulaire externe à l’aide d’une pince microchirurgicale. Séparez doucement les veines d’une longueur d’environ 1 cm à l’aide d’une micro-pince et insérez deux lignes chirurgicales aux extrémités distale et proximale.
- Avant l’intubation, trempez la sonde PE50 dans une solution saline normale contenant 1 % d’héparine sodique ou d’EDTA pendant au moins 30 minutes. Ajustez l’enregistreur physiologique pour ramener la pression à la ligne 0 et ajustez la plage de pression à 0-150 mmHg.
- Lissez l’extrémité distale de la veine jugulaire externe avec du fil de soie 4-0, soulevez doucement la ligne chirurgicale proximale et placez-la sur la paroi de la veine distale. Utilisez de petits ciseaux pour faire une petite incision (environ 0,3 mm). Après avoir inséré le tube PE50 dans la veine jugulaire externe, utilisez du fil de soie 4-0 pour ligaturer le cathéter avec la veine jugulaire externe afin d’éviter les fuites de sang.
- Observez la forme d’onde de la pression veineuse sur l’enregistreur. Poussez lentement le cathéter dans l’oreillette droite, et la forme d’onde de l’oreillette droite est visible, avec une amplitude d’environ 0-5 mmHg. Une fois que le cathéter continue de progresser de l’oreillette droite au ventricule droit, la forme d’onde de pression du ventricule droit peut être observée. Lorsque la pression est stable, enregistrez la RVP pendant 5 minutes et les données sont sauvegardées et analysées avec un logiciel d’analyse.
- Détection de l’indice de Fulton
- Après la détection de RVSP, après une anesthésie à l’isoflurane (5 %, 2 L/min O2), euthanasier les rats par exsanguination.
- Après la thoracotomie, retirez le cœur intact du rat à l’aide d’une pince à épiler. Coupez le pavillon de l’oreille et le tissu conjonctif près du cœur avec des ciseaux.
- Coupez la paroi libre du ventricule droit le long de l’artère pulmonaire. Ce tissu est le ventricule droit (RV). Les tissus restants sont le ventricule gauche et le septum interventriculaire (LV+S). Après la séparation, drainez la surface du ventricule droit (RV) et du ventricule gauche ainsi que du septum interventriculaire (LV+S) avec du papier filtre et pesez séparément à l’aide d’une balance analytique. Après avoir enregistré le poids du ventricule droit (RV) et du ventricule gauche plus le septum ventriculaire (LV+S), calculez le rapport de poids du ventricule droit par rapport au ventricule gauche plus septum ventriculaire (RV/(LV+S)).
- Coloration histologique
- Après avoir ouvert la cavité thoracique, prélevez 3 mL de solution saline à l’aide d’une seringue de 10 ml. Insérez la seringue dans l’artère pulmonaire et injectez lentement la solution saline pour rincer les poumons, en éliminant le sang et les autres résidus.
- À l’aide de ciseaux, disséquez le lobe accessoire droit et le lobe antérieur droit du poumon. Placez ces deux lobes pulmonaires dans du formol à 4 % pour les fixer afin de préserver la morphologie et la structure des tissus. Placez rapidement les trois lobes restants du poumon (tels que le poumon gauche, le lobe moyen droit et le lobe postérieur droit) dans de l’azote liquide pour le stockage congelé, prêt pour les expériences ultérieures.
- Retirez l’excès de graisse et de tissu conjonctif de la surface du tissu pulmonaire pour vous assurer que les blocs de tissu sont propres et nets. Coupez les lobes pulmonaires en petits blocs de 5 mm x 5 mm x 3 mm. Placez les blocs de tissu coupés dans le déshydrateur et déshydratez-les progressivement à l’aide d’une série de gradients d’alcool (60 %, 70 %, 80 %, 90 %, 100 %).
- Immergez le tissu pulmonaire dans du xylène pendant 2 h pour obtenir une transparence. Après l’enlèvement, faites-le tremper dans de la paraffine fondue à 56-58 °C pendant 2 h pour assurer une infiltration complète. Ensuite, placez le tissu dans un moule, en le positionnant avec la surface de coupe vers le bas pour une section ultérieure.
- Coupez le bloc de cire sur le microtome d’une épaisseur de 4 à 8 μm13 et conservez-le à température ambiante pour une coloration pathologique.
- Effectuer la coloration à l’éosine et au trichrome de Masson14.
6. Détection de l’hydroxyproline (HYP)
- Peser 30 à 100 mg de tissu pulmonaire dans un tube de verre. Ajouter 2 mL de solution d’acide chlorhydrique (6 mol/L) et digérer à 110 °C dans un four pendant 2 à 6 h jusqu’à ce qu’il n’y ait plus de gros grumeaux.
- Après refroidissement, ajustez la valeur du pH à la plage de 6 à 8 en utilisant 1 mL de solution de NaOH (10 mol/L), puis condensez l’eau distillée en solution de 4 mL. Enfin, centrifuger à 28 620 x g à 25 °C pendant 20 min et prélever le surnageant à être.
- Préchauffez le lecteur de microplaques pendant 30 min, ajustez la longueur d’onde à 560 nm et mettez l’instrument à zéro à l’aide d’eau distillée.
- Diluer la solution étalon avec de l’eau distillée pour préparer des solutions étalons aux concentrations de 30, 15, 7,5, 3,75, 1,875, 0,938, 0,469 et 0,234 μg/mL.
- Prélever 60 μL de surnageant de l’échantillon et les mélanger avec 60 μL de réactif A, puis laisser reposer à température ambiante pendant 20 min.
- Ajouter 60 μL de réactif B et 120 μL d’eau distillée. Placez la solution mélangée dans un bain-marie à 60 °C pendant 20 min. Suivez les mêmes étapes pour chaque concentration des solutions étalons (par exemple, 30, 15, 7,5, 3,75, 1,875, 0,938, 0,469, 0,234 μg/mL) et effectuez les opérations en conséquence.
- Après être resté à température ambiante pendant 15 min, prélever 200 μL de la solution dans la plaque à 96 puits pour détecter la valeur d’absorption de la lumière à 560 nm. Tracez la courbe standard avec la concentration des solutions étalons sur l’axe des x et les valeurs mesurées sur l’axe des y, en obtenant l’équation y=kx+b. Substituez la valeur mesurée de l’échantillon dans l’équation pour déterminer la concentration de l’échantillon.
Résultats
Fibrose pulmonaire induite par la bléomycine chez le rat
La bléomycine a été signalée comme un inducteur classique de la fibrose pulmonaire dans des modèles animaux7. Ici, les indices de fibrose pulmonaire ont été évalués après stimulation BLM. Tout d’abord, après 35 jours de traitement par BLM, nous avons effectué des tests de la fonction pulmonaire et avons constaté que la CVF (Figure 1E) et la compliance pulmonaire dynamique (Figure 1F) dans le groupe modèle étaient significativement réduites. Ces résultats indiquent clairement que la fonction pulmonaire était nettement altérée. Deuxièmement, pour évaluer le dépôt de collagène dans le tissu pulmonaire, l’étude a utilisé la coloration trichrome de Masson et le dosage HYP. La coloration trichrome de Masson a révélé une augmentation significative des zones colorées en bleu autour des artères pulmonaires dans le groupe modèle, suggérant une accumulation prononcée de collagène (Figure 1D). Pendant ce temps, les résultats du test HYP ont démontré que les niveaux de HYP dans le groupe modèle étaient significativement plus élevés que ceux du groupe témoin (Figure 2E), confirmant ainsi l’augmentation des dépôts de collagène. De plus, nous avons évalué les poids du foie (figure 3A) et des reins (figure 3B) à l’aide d’une méthode de pesée et n’avons trouvé aucune différence significative entre les deux groupes.
Progression de l’hypertension pulmonaire stimulée par le BLM
Ensuite, les changements hémodynamiques caractéristiques de l’hypertension pulmonaire ont été mesurés. Après 35 jours de traitement par BLM, la pression systolique ventriculaire droite (RVSP) a été évaluée à l’aide d’un cathétérisme cardiaque droit. Les résultats ont montré que la RVSP (Figure 1A,C) dans le groupe modèle était significativement plus élevée que celle dans le groupe témoin. Pendant ce temps, en calculant l’indice de Fulton des cœurs de rats, il a été constaté que le rapport entre le ventricule droit et le ventricule gauche, plus le poids du septum (RV/(LV+S) ; Graphique 1B) a considérablement augmenté après 35 jours de traitement BLM. L’élévation de la RVSP (figures 1A, C) et l’augmentation de la RV/(LV+S) (figure 1B) ont collectivement indiqué l’établissement réussi de la fibrose pulmonaire combinée au modèle de l’hypertension pulmonaire (PF-PH). De plus, l’analyse histologique a révélé des changements histopathologiques typiques liés au remodelage vasculaire pulmonaire dans le groupe modèle (Figure 1D). Pour évaluer davantage la fonction cardiaque, nous avons effectué une échocardiographie, qui a montré que le groupe modèle présentait des rapports PAT/PET significativement réduits (Figure 2A), TAPSE (Figure 2B), RVFAC (Figure 2C) et CO (Figure 2D). En résumé, ces résultats démontrent que le BLM est un inducteur efficace pour construire avec succès le modèle PF-PH chez le rat.

Figure 1 : Le rat traité par BLM a présenté une augmentation des indices hémodynamiques, un remodelage vasculaire et un dysfonctionnement de la fonction pulmonaire. (A) RVSP, (B) RV/LV+S, et (C) des traces représentatives montrent des indices hémodynamiques pour les groupes témoin et modèle. (D) Éosine et coloration trichrome de Masson, montrant les changements histologiques dans les artères pulmonaires à l’intérieur des sections pulmonaires de chaque groupe. (E) Les graphiques à barres montrent la CVF (F) et la compliance pulmonaire dynamique. Les résultats sont exprimés en moyenne ± MEB, et la signification a été évaluée par le test t de Student. n = 8 dans chaque groupe (A, B) ; n = 6 dans chaque groupe (E, F). *p < 0,05, indiquant une différence significative. Veuillez cliquer ici pour voir une version agrandie de cette figure.
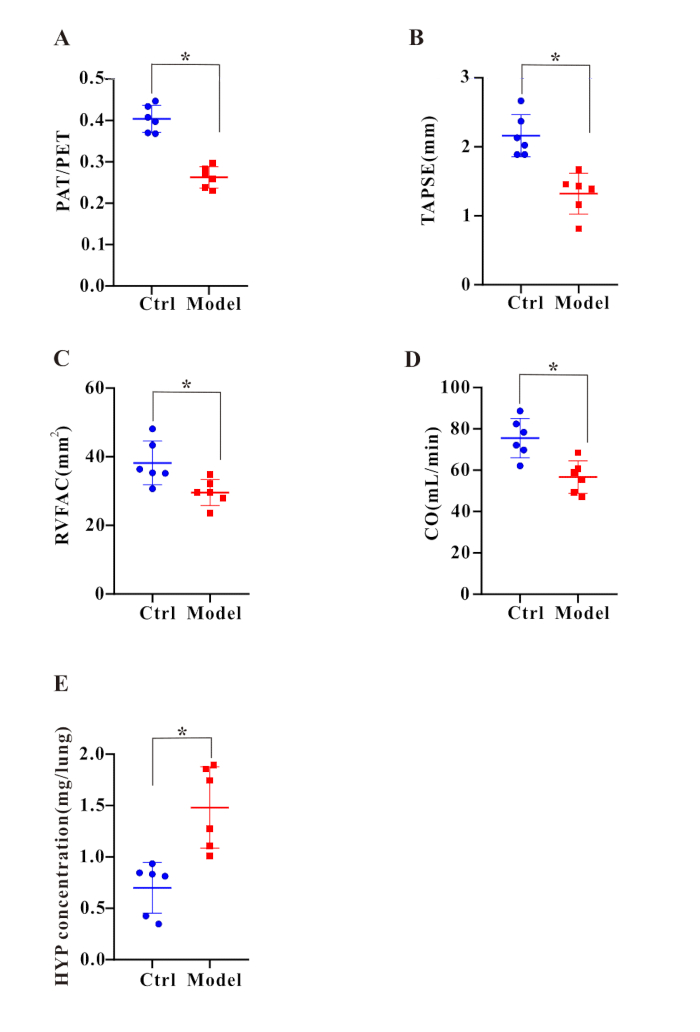
Figure 2 : Un dysfonctionnement cardiaque droit et un dépôt de collagène ont été détectés après le traitement BLM. Les graphiques à barres affichent le rapport (A) PAT/PET, (B) TAPSE, (C) RVFAC, (D) CO et (E) concentration HYP. Les résultats sont exprimés en moyenne ± MEB, et la signification a été évaluée par le test t de Student. n = 6 dans chaque groupe. *p < 0,05, indiquant une différence significative. Veuillez cliquer ici pour voir une version agrandie de cette figure.
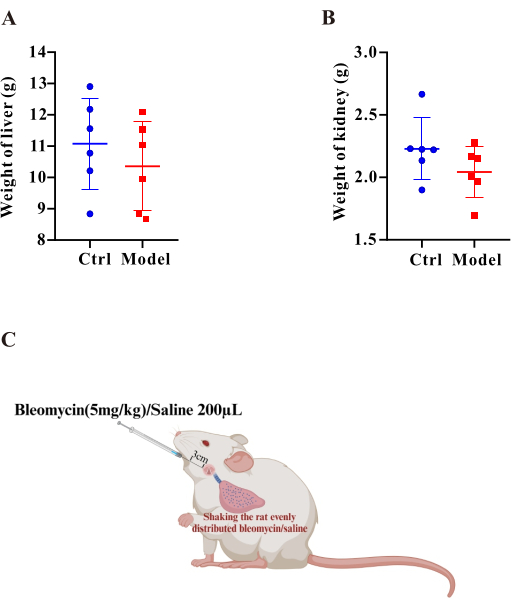
Figure 3 : Les poids du foie et des reins étaient comparables entre le modèle et le groupe témoin. Les graphiques à barres affichent les poids du foie (A) et du rein (B). Les résultats sont exprimés en moyenne ± MEB, et la signification a été évaluée par le test t de Student. *p < 0,05, indiquant une différence significative. (C) Schéma du protocole pour l’établissement du modèle PF-PH chez le rat. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La fibrose pulmonaire idiopathique est une maladie progressive et mortelle avec une survie médiane de 2 à 3 ans à compter du diagnostic, ce qui suggère un pronostic sombre9. L’hypertension pulmonaire est une comorbidité fréquente de la FPI, qui détériore rapidement la FPI avec un pronostic aggravé15. De plus, les options thérapeutiques pour l’IPF-PH7 étaient limitées. Il est donc essentiel d’acquérir une compréhension plus approfondie des mécanismes moléculaires sous-jacents de la PF-PH, ce qui pourrait fournir une approche thérapeutique potentielle pour la maladie.
Le protocole proposé décrit une méthode bien établie et stable pour générer un modèle de rat PF-PH. Le modèle est essentiel pour étudier les mécanismes physiopathologiques des maladies et joue un rôle crucial dans la vérification de nouvelles approches thérapeutiques. Les modèles animaux de PF peuvent être établis par diverses méthodes, notamment l’administration de médicaments, l’irradiation, l’exposition à la silice, les vecteurs viraux, les transgéniques et le transfert de fibroblastes humains16. Chaque méthode de modélisation a ses forces et ses faiblesses. Par exemple, l’irradiation est coûteuse et prend du temps (plus de 30 semaines) ; le traitement à la silice est plus susceptible de provoquer une pneumoconiose que la FP ; les procédures pour les vecteurs viraux et les modèles animaux transgéniques sont relativement compliquées et nécessitent des compétences avancées ; Et le transfert de fibroblastes humains entraîne une faible reproductibilité et des coûts élevés16. En revanche, les modèles de PF induits par les médicaments, tels que ceux utilisant la bléomycine, l’amiodarone, le méthotrexate et la moutarde à l’azote, sont faciles à mettre en œuvre, efficaces et reproductibles7.
Le modèle comporte trois étapes clés, notamment la dose et le mode d’administration, la sélection du sexe et le temps nécessaire à la réalisation du modèle. Bien qu’une dose unique de BLM (0,1-6 mg/kg), administrée par voie intratrachéale ou oropharyngée, soit une approche couramment utilisée pour la modélisation de la PF17. Nous avons apporté quelques améliorations. Dans la présente étude, la dose optimale et le mode d’administration du BLM ont été explorés, et une dose de 5 mg/kg administrée par voie intratrachéale a été sélectionnée. Parce que les rats femelles Sprague-Dawley présentaient une hypertension pulmonaire (HTP) moins sévère que les rats mâles18 et que les rats mâles sont plus sensibles au remodelage de l’artériole pulmonaire ; Nous avons utilisé des rats mâles dans cette étude. Selon des études antérieures que nous avons menées, les indices RVSP et Fulton dans le groupe Bléomycine ont augmenté progressivement dans les 7 à 35 jours suivant le traitement à la bléomycine, ce qui est significativement plus élevé que dans le groupe témoin. Par conséquent, il est recommandé que le temps de modélisation du modèle soit d’environ 35 jours.
Nos études précédentes ont permis d’établir des modèles d’hypertension pulmonaire chez le rat à l’aide de diverses méthodes, notamment l’hypoxie19, l’hypoxie Sugen20, la monocrotaline19, la ligature de l’artère pulmonaire21 et la néphrectomie15. Les changements caractéristiques observés dans ces modèles animaux d’hypertension pulmonaire comprennent une augmentation de la RVSP, des rapports RV/(LV+S) élevés, un remodelage vasculaire pulmonaire et un dysfonctionnement cardiaque droit, conformément aux résultats de la présente étude
Malgré l’accès facile à BLM, ce modèle animal présente plusieurs limitations. Tout d’abord, les perfusions des voies respiratoires de BLM provoquent une distribution inégale des concentrations de médicaments, entraînant une fibrose locale des poumons. Deuxièmement, le BLM est un agent de chimiothérapie qui présente des risques pour la santé des chercheurs. Troisièmement, la recherche indique que le processus fibrotique induit par la MLB peut être auto-résolutif16.
En conclusion, nous avons réussi à établir un modèle de rat PH associé à PF à l’aide de BLM. Ce modèle animal présentait des caractéristiques typiques de la FP, notamment une altération de la fonction pulmonaire et un dépôt élevé de collagène. De plus, nous avons observé des changements hémodynamiques représentatifs, tels que l’augmentation des rapports RVSP et RV/(LV+S), ainsi qu’un remodelage vasculaire et un dysfonctionnement du cœur droit dans ce modèle de rat induit par BLM. Il est important de noter que l’établissement d’un modèle de rat PF-PH est précieux pour comprendre les mécanismes sous-jacents à la PF-PH et fournir de nouvelles orientations thérapeutiques.
Déclarations de divulgation
Les auteurs n’ont pas de divulgations financières pertinentes.
Remerciements
Ce travail a été soutenu en partie par les subventions de la Fondation nationale des sciences naturelles de Chine (82370063, 82170069, 82120108001, 82241012), du programme de R&D du laboratoire national de Guangzhou (GZNl2023A02013), du programme national de R&D clé de la Chine (2022YFE0131500), du département des sciences et de la technologie du Guangdong (2024A1515011208, 2022A1515012052, 2024A1515013104, 202102020019, 202201020538, 202201010069, 2023A03J0334), le projet indépendant du laboratoire clé d’État des maladies respiratoires (SKlRD-Z-202513), la Fondation de recherche médicale du Guangdong (A2023379) de l’Université médicale de Guangzhou et le plan d’amélioration de la recherche scientifique dans le GMU et les fonds de recherche ouverts du sixième hôpital affilié de l’Université de médecine de Guangzhou (Hôpital populaire de Qingyuan) (202201-101).
matériels
| Name | Company | Catalog Number | Comments |
| Bleomycin | MedChemExpress | HY-17565A | |
| Coupling agent | HYNAUT | BX-CSRH | |
| Formalin fixative | Biosharp) | BL401B | |
| Hair removal cream | LUSEN | LS-B-TMG-50 | |
| Hematoxylin eosin (HE) staining kit | Beyotime | C0189S | |
| Isoflurane | RWD Life Science(China) | R510-22-10 | |
| Masson Tri-color dyeing kit | Beyotime | C0189S | |
| Normal saline | KERONG | SLYS-001 | |
| syringe | Beyotime | FS701-50pcs |
Références
- Sm, N., et al. Clinical significance of pulmonary hypertension in interstitial lung disease: A consensus statement from the Pulmonary Vascular Research Institute's innovative drug development initiative-Group 3 pulmonary hypertension. Pulm Circ. 12 (3), e12127(2022).
- Nathan, S. D., et al. Pulmonary hypertension in chronic lung disease and hypoxia. Eur Resp J. 53 (1), 1801914(2019).
- King, C. S., Shlobin, O. A. The Trouble With Group 3 Pulmonary Hypertension in Interstitial Lung Disease. Chest. 158 (4), 1651-1664 (2020).
- Meyer, K. C. Pulmonary fibrosis, part I: epidemiology, pathogenesis, and diagnosis. Expert Rev Respir Med. 11 (5), 343-359 (2017).
- Raghu, G., et al. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Critic Care Med. 205 (9), e18-e47 (2022).
- Ruffenach, G., Hong, J., Vaillancourt, M., Medzikovic, L., Eghbali, M. Pulmonary hypertension secondary to pulmonary fibrosis: clinical data, histopathology and molecular insights. Respir Res. 21 (1), 303(2020).
- Li, S., Shi, J., Tang, H. Animal models of drug-induced pulmonary fibrosis: an overview of molecular mechanisms and characteristics. Cell Biol Toxicol. 38 (5), 699-723 (2022).
- Karmouty-Quintana, H., et al. Deletion of ADORA2B from myeloid cells dampens lung fibrosis and pulmonary hypertension. FASEB J. 29 (1), 50-60 (2015).
- Jiang, Q., et al. Dysregulation of BMP9/BMPR2/SMAD signalling pathway contributes to pulmonary fibrosis and pulmonary hypertension induced by bleomycin in rats. Br J Pharmacol. 178 (1), 203-216 (2021).
- Degryse, A. L., Lawson, W. E. Progress toward improving animal models for idiopathic pulmonary fibrosis. Am J Med Sci. 341 (6), 444-449 (2011).
- Collum, S. D., et al. Inhibition of hyaluronan synthesis attenuates pulmonary hypertension associated with lung fibrosis. Br J Pharmacol. 174 (19), 3284-3301 (2017).
- Ye, X., et al. Animal models of acute exacerbation of pulmonary fibrosis. Respir Res. 24 (1), 296(2023).
- León-Mancilla, B., et al. Three-Dimensional Collagen Matrix Scaffold Implantation as a Liver Regeneration Strategy. J Vis Exp. (172), e62697(2021).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a Survivable Liver Biopsy Procedure in Mice to Assess Non-alcoholic Steatohepatitis (NASH) Resolution. J Vis Exp. (146), e59130(2019).
- Jiang, Q., et al. Nephrectomy and high-salt diet inducing pulmonary hypertension and kidney damage by increasing Ang II concentration in rats. Respir Res. 25 (1), 288(2024).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Jenkins, R. G., et al. An Official American Thoracic Society Workshop Report: Use of Animal Models for the Preclinical Assessment of Potential Therapies for Pulmonary Fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Lahm, T., et al. The effects of estrogen on pulmonary artery vasoreactivity and hypoxic pulmonary vasoconstriction: Potential new clinical implications for an old hormone. Crit Care Med. 36 (7), 2174-2183 (2008).
- Chen, Y., et al. Tetramethylpyrazine: A promising drug for the treatment of pulmonary hypertension. Br J Pharmacol. 177 (12), 2743-2764 (2020).
- Zheng, Q., et al. Established pulmonary hypertension in rats was reversed by a combination of a HIF-2α antagonist and a p53 agonist. Br J Pharmacol. 179 (5), 1065-1081 (2022).
- Chen, J., et al. Upregulation of mechanosensitive channel Piezo1 involved in high shear stress-induced pulmonary hypertension. Thrombo Res. 218, 52-63 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon