Method Article
Establecimiento y validación de un modelo rata de hipertensión arterial pulmonar asociada a fibrosis pulmonar
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, se presenta el método de inducción de hipertensión arterial pulmonar asociada con fibrosis pulmonar (PF-PH) modelo de rata mediante la inyección de bleomicina en la vía aérea. También proporcionamos un enfoque paso a paso para validar este modelo animal.
Resumen
Los pacientes con fibrosis pulmonar tienen un mayor riesgo de desarrollar hipertensión pulmonar, una complicación de mal pronóstico. En la actualidad, el mecanismo de este vínculo sigue siendo poco conocido. Un obstáculo importante para el progreso en esta área es la falta de un modelo animal confiable para replicar el PF-PH. Este estudio tuvo como objetivo establecer un modelo estable de rata PF-PH. Las ratas fueron ayunadas durante la noche antes de la intervención. Bajo anestesia con pentobarbital sódico (45 mg/kg), la tráquea se intubó con un tubo de PE50 insertado a una profundidad de 3 cm (la distancia entre la glotis y el tubo). La bleomicina (BLM) se administró por vía intratraqueal en dosis única (5 mg/kg, disuelto en 0,2 mL de NaCl al 0,9%). Después de la inyección, las ratas se rotaron inmediatamente para garantizar una distribución uniforme de la BLM. A los 35 días después de la inyección de BLM, las ratas mostraron un deterioro progresivo de la función pulmonar y un aumento de la presión sistólica del ventrículo derecho y de la hipertrofia ventricular derecha, revelando las características patológicas de la hipertensión pulmonar. Proporcionamos un método general y confiable para establecer un modelo de PF-PH en ratas.
Introducción
La hipertensión pulmonar (HP) por enfermedad pulmonar intersticial (EPI) es frecuente clínicamente, con una prevalencia estimada del 10% al 80% en pacientes con fibrosis pulmonar idiopática (FPI), y también se observa con frecuencia en otras EPI fibróticas 1,2. Numerosos estudios han demostrado que el desarrollo de HP está relacionado con una morbilidad sustancial y una menor supervivencia 3,4,5. En comparación con la hipertensión arterial pulmonar (HAP) del grupo 1, la patogenia de la hipertensión arterial pulmonar asociada a la fibrosis pulmonar (PF-HP) sigue siendo poco conocida6. El propósito de establecer un modelo animal de PF-PH en ratas es proporcionar un marco confiable para la investigación científica sobre la fibrosis pulmonar asociada con la hipertensión pulmonar y explorar posibles vías para aplicaciones terapéuticas clínicas.
La bleomicina es un inductor clásico de la fibrosis pulmonar ampliamente utilizado en modelos animales7. Investigaciones posteriores de Blackburn et al.8 y nuestro laboratorio9 han revelado que la bleomicina también puede desencadenar características patológicas típicas de la hipertensión pulmonar, como el aumento de la presión sistólica del ventrículo derecho (RVSP) y la hipertrofia del ventrículo derecho. Mecánicamente, la bleomicina induce fibrosis del parénquima pulmonar, vasoconstricción hipóxica y una reducción de la densidad del lecho vascular pulmonar, lo que conduce al desarrollo de hipertensión pulmonar6. Además, observamos una pérdida significativa de células endoteliales vasculares pulmonares a partir del día 7 de tratamiento con bleomicina, y esta pérdida empeora progresivamente a lo largo del experimento9. Este fenómeno sugiere que la disfunción endotelial vascular pulmonar inducida por bleomicina puede desempeñar un papel potencial en el inicio y la progresión de la hipertensión pulmonar.
Debido a la fibrosis intersticial pulmonar, los pacientes con FPI se encuentran en un estado de hipoxia durante mucho tiempo y se producen cambios compensatorios en los vasos cardiopulmonares, lo que conduce a la hipertensión pulmonar6. El uso de modelos animales puede ayudarnos a comprender mejor los mecanismos subyacentes de la fibrosis pulmonar idiopática humana asociada con la hipertensión pulmonar. Aunque este modelo no puede simular completamente las características patológicas de las enfermedades humanas, aún puede proporcionar información valiosa. Existen muchos modelos experimentales que simulan la fibrosis pulmonar, como la infusión de bleomicina en las vías respiratorias en una sola dosis, la administración de factores de crecimiento transformantes por vectores virales y la exposición a sílice 8,10. En la actualidad, el modelo BLM es el más utilizado y caracterizado porque se puede inducir fácilmente en poco tiempo y tiene una alta reproducibilidad. Además, se han evaluado los cambios temporales en la fibrosis pulmonar en un modelo de ratón con bleomicina, donde se observó un aumento de la expresión de marcadores de fibrosis y genes asociados con la patología de la enfermedad, como Col1A1 y Col1A2, desde los días 15-218. Se detectaron alteraciones cardiovasculares, como hipertrofia ventricular derecha y aumento significativo de la RVSP, a partir del día 3311. Al mismo tiempo, nuestro laboratorio ha evaluado previamente los cambios en los parámetros de PH y PF de modelos de rata inducidos por bleomicina9. Encontramos que además de las características de la fibrosis pulmonar (PF), como el deterioro progresivo de la función pulmonar y la deposición de colágeno en ratas, las características típicas de la hipertensión pulmonar (HP) emergieron gradualmente dentro de los 7 a 35 días después de una sola instilación de bleomicina en las vías respiratorias. El RVSP y el índice de Fulton mostraron un aumento en la dependencia del tiempo. Actualmente, se han reportado varios animales con fibrosis pulmonar en la literatura. Algunos expertos han sugerido que los modelos de rata exhibieron una respuesta fibrótica más pronunciada que los modelos de ratón12. Por lo tanto, para estudiar mejor la progresión de la fibrosis pulmonar combinada con la hipertensión pulmonar, la clave es un modelo de rata inducido por bleomicina.
Protocolo
Los experimentos con animales descritos en este estudio fueron aprobados por el Comité de Cuidado y Uso de Animales del Primer Hospital Afiliado de la Universidad Médica de Guangzhou (número de aprobación ética: 2018-456).
1. Adquisición de ratas experimentales
- Divida las ratas en dos grupos: el grupo de control normal y el grupo modelo, con 7 ratas en cada grupo. Para el estudio, se utilizaron ratas macho Sprague-Dawley (SD) de 10 semanas de edad con un peso de 200 ± 20 g
2. Inducción del modelo de rata PF-PH
- Con el fin de prevenir aspiraciones regurgitantes durante el procedimiento, ayune a las ratas durante la noche antes de modelar.
- Anestesiar ratas mediante inyección intraperitoneal de pentobarbital sódico (45 mg/kg) para garantizar la precisión y seguridad del procedimiento y minimizar el dolor y el estrés de los animales. Confirmar los niveles de anestesia quirúrgica por la falta de respuesta al pellizco de los dedos de los pies. Al mismo tiempo, aplica un ungüento en los ojos de las ratas para evitar la sequedad.
- Intuble la tráquea de la rata con un tubo de PE50 insertado a una profundidad de 3 cm (la distancia entre la glotis y el tubo).
- Con una jeringa de 1 mL (26 G), extraiga 0,2 mL de bleomicina (5 mg/kg, disuelto en 0,2 mL de NaCl al 0,9%). Inyecte la jeringa que contiene BLM en las vías respiratorias a través de una cánula como una dosis única. En el caso de las ratas del grupo de control, realizar la administración intratraqueal de solución salina normal estéril (0,2 ml). Durante este proceso, las ratas no necesitan alivio del dolor.
- Para asegurar una distribución uniforme de la bleomicina, coloque a la rata en posición supina, sujétela suavemente y gírela lentamente. El ángulo de rotación recomendado es de 30°-45°, alternando entre lados. Cada rotación debe mantenerse durante 10-15 s, repetida 3x-4x.
- Coloque a las ratas sobre almohadillas térmicas para ayudar a mantener la temperatura corporal y controle de cerca su estado. Observe cuándo las ratas comienzan a moverse por sí solas y transfiera a los animales de la almohadilla térmica a una jaula separada para su recuperación.
- Después de 5 semanas de inyección de BLM, evalúe las ratas para determinar si el modelo PF-PH pudo establecerse con éxito utilizando métodos como el monitoreo ecocardiográfico, las mediciones hemodinámicas y el análisis histológico.
3. Monitorización ecocardiográfica
- Anestesiar ratas con isoflurano al 4%. Retira el pelo de la rata con una crema depilatoria y aplica gel ultrasónico en su pecho.
- Evaluar los parámetros funcionales y estructurales del corazón derecho en ratas con una sonda ultrasónica de 250 MHz. Para obtener la mejor vista del ventrículo en el eje largo, coloque la sonda en el lado izquierdo de la línea mediana del tórax del animal.
- De acuerdo con la anatomía individual, gire la sonda 15° en sentido contrario a las agujas del reloj en relación con la línea paraesternal izquierda, con el incisivo apuntando hacia su hombro derecho, y ajuste los ejes x e y en modo B para que todo el corazón esté en el centro del campo visual.
- Seleccione Color para mostrar el color del flujo sanguíneo para distinguir la arteria pulmonar (la señal de flujo sanguíneo de la arteria pulmonar en esta posición es azul).
- Seleccione el modo PW (PW Doppler), coloque la línea de muestreo debajo de la válvula pulmonar y gire la perilla de ángulo PW para ajustar la dirección de la línea de muestreo de modo que la dirección del muestreo sea paralela a la dirección del flujo sanguíneo de la arteria pulmonar (aproximadamente 25 °). Presione la tecla PW nuevamente y obtenga el tiempo de aceleración del flujo sanguíneo de la arteria pulmonar / tiempo de eyección (PAT / PET). Mida al menos cinco ciclos cardíacos y un promedio. Utilice Cine para guardar la imagen.
- Ajuste el animal a una cabeza baja y un pie alto, coloque la sonda ultrasónica en el ápice del corazón del animal y conduzca el ultrasonido a lo largo del ápice del corazón para obtener la superficie incisal de cuatro cámaras. Ajuste los ejes x e y en el modo B para asegurarse de que las cuatro cámaras cardíacas sean visibles.
- Visualice la línea de medición 2x manteniendo pulsado el modo M y colóquela en la unión del anillo de la válvula tricúspide y la pared libre del ventrículo derecho. Mida la distancia de desplazamiento de la válvula tricúspide (TAPSE) dentro de al menos tres ciclos cardíacos y preservándola en Cine.
- Coloque la sonda en la línea media de la clavícula derecha del tórax del animal y ajuste el ángulo entre la sonda y la muesca del tórax del animal a unos 45°. Ajuste la imagen en modo B para que el ventrículo ventricular derecho y el tabique interventricular sean visibles.
- Seleccione el modo M para mostrar la línea de medición 2x y coloque la línea de medición en el centro del tabique interventricular. La línea de muestreo fue perpendicular a la pared libre del ventrículo derecho. Guarde la imagen para obtener el grosor de la pared libre del ventrículo derecho.
4. Estimación de la función pulmonar
- Abra el software PFT y compruebe que se reconoce el dispositivo. Calibre de acuerdo con las instrucciones del equipo para garantizar la precisión de los sensores de flujo y los sensores de presión. Establezca los parámetros de prueba en el software PFT, como la frecuencia respiratoria, el volumen corriente, la duración de la prueba, etc.
- El modo de detección de animales es el modo para estudios con ratas. Encienda el interruptor del instrumento de control principal y asegúrese de que el interruptor de cada amplificador de señal esté en la posición de apagado.
- Ajuste el flujo de aire de acuerdo con el peso corporal del animal. Encienda la tuerca reguladora del flujo de aire de succión y ajuste la inspiración a 5. Encienda la tuerca reguladora del flujo de aire espiratorio y ajuste la expiración lenta a -4. Ajuste el valor de presión a 60 cm H2O y luego calibre el instrumento de acuerdo con el orden de flujo FRC, flujo, flujo alto y presión pulmonar con un error de menos del 0,5%.
- Anestesiar ratas mediante inyección intraperitoneal con pentobarbital sódico (45 mg/kg) como en el paso 2.2. Corta la piel a lo largo del centro del cuello y retira el músculo capa por capa.
- En la porción superior expuesta de la tráquea cervical, haga una incisión horizontal entre los anillos del cartílago traqueal. Inserte rápidamente la cánula metálica en la incisión traqueal, asegurándose de que la cánula esté correctamente colocada y segura. Utilice suturas de hilo de seda 4-0 para fijar la cánula a la tráquea, evitando que se deslice o se desprenda. Coloque la rata en el compartimento del animal PFT y conecte la cánula traqueal a la interfaz del canal de flujo de aire fuera del instrumento.
- Haga clic en el botón Inicio y examine la capacidad vital forzada (FVC) y la distensibilidad pulmonar dinámica. Para garantizar la coherencia de los datos, registre cada indicador al menos 3 veces.
- Una vez completada la prueba, los datos se guardan y se exportan al software de análisis. Utilice software estadístico para analizar los datos y comparar los parámetros de la función pulmonar de diferentes grupos.
5. Mediciones hemodinámicas e histológicas
- Detección de presión sistólica del ventrículo derecho (RVSP)
- Anestesiar ratas mediante inyección intraperitoneal con pentobarbital sódico (45 mg/kg) como en el paso 2.2. Confirme que la rata ha sido anestesiada correctamente pellizcando el dedo del pie para asegurarse de que la rata no responda. Fije el abdomen de la rata hacia arriba en el banco experimental y aplique crema para los ojos de la rata para evitar la sequedad.
- Hacer una incisión (unos 4 cm) en el lado derecho del cuello a través de unas tijeras quirúrgicas y separar la vena yugular externa mediante pinzas microquirúrgicas. Separe suavemente las venas con una longitud de aproximadamente 1 cm con micropinzas e inserte dos líneas quirúrgicas en los extremos distal y proximal.
- Antes de la intubación, sumerja el tubo de PE50 en solución salina normal que contenga heparina sódica al 1% o EDTA durante al menos 30 minutos. Ajuste el registrador fisiológico para devolver la presión a la línea 0 y ajuste el rango de presión a 0-150 mmHg.
- Limine el extremo distal de la vena yugular externa con hilo de seda 4-0, levante suavemente la línea quirúrgica proximal y colóquela en la pared de la vena distal. Use unas tijeras pequeñas para hacer una pequeña incisión (aproximadamente 0,3 mm). Después de insertar el tubo de PE50 en la vena yugular externa, use hilo de seda 4-0 para ligar el catéter junto con la vena yugular externa para evitar fugas de sangre.
- Observe la forma de onda de la presión venosa en la grabadora. Empuje el catéter lentamente hacia la aurícula derecha, y la forma de onda de la aurícula derecha será visible, con una amplitud de aproximadamente 0-5 mmHg. Después de que el catéter continúa avanzando desde la aurícula derecha hasta el ventrículo derecho, se puede ver la forma de onda de presión del ventrículo derecho. Cuando la presión es estable, registre RVP durante 5 minutos y los datos se guardan y analizan con un software de análisis.
- Detección del índice de Fulton
- Después de la detección de RVSP, después de la anestesia con isoflurano (5%, 2 L/min O2), se sacrificó a las ratas mediante exanguinación.
- Después de la toracotomía, extraiga el corazón intacto de la rata con unas pinzas. Cortar la aurícula y el tejido conectivo cerca del corazón con unas tijeras.
- Cortar la pared libre del ventrículo derecho a lo largo de la arteria pulmonar. Este tejido es el ventrículo derecho. El resto de los tejidos son el ventrículo izquierdo más el tabique interventricular (VI+S). Después de la separación, drene la superficie del ventrículo derecho (VD) y del ventrículo izquierdo más el tabique interventricular (VI+S) con papel de filtro y pese por separado con una balanza analítica. Después de registrar el peso del ventrículo derecho (VD) y del ventrículo izquierdo más el tabique ventricular (VI+S), calcule la relación entre el peso del ventrículo derecho y el ventrículo izquierdo más el tabique ventricular (VD/(VI+S)).
- Tinción histológica
- Después de abrir la cavidad torácica, use una jeringa de 10 mL para extraer 3 mL de solución salina. Inserte la jeringa en la arteria pulmonar e inyecte lentamente la solución salina para enjuagar los pulmones, eliminando la sangre y otros residuos.
- Use tijeras para diseccionar el lóbulo accesorio derecho y el lóbulo anterior derecho del pulmón. Coloque estos dos lóbulos pulmonares en formol al 4% para su fijación y preservar la morfología y estructura del tejido. Coloque rápidamente los tres lóbulos restantes del pulmón (como el pulmón izquierdo, el lóbulo medio derecho y el lóbulo posterior derecho) en nitrógeno líquido para su almacenamiento congelado, listo para experimentos posteriores.
- Elimine el exceso de grasa y tejido conectivo de la superficie del tejido pulmonar para asegurarse de que los bloques de tejido estén limpios y ordenados. Recorta los lóbulos pulmonares en bloques pequeños de 5 mm x 5 mm x 3 mm. Coloque los bloques de tejido recortados en el deshidratador y deshidrételos gradualmente con una serie de gradientes de alcohol (60%, 70%, 80%, 90%, 100%).
- Sumerja el tejido pulmonar en xileno durante 2 h para lograr la transparencia. Después de la extracción, sumérjalo en parafina derretida a 56-58 °C durante 2 h para asegurar una infiltración completa. A continuación, coloque el tejido en un molde, colocándolo con la superficie de corte hacia abajo para su posterior seccionamiento.
- Cortar el bloque de cera en el micrótomo con un grosor de 4-8 μm13 y almacenarlo a temperatura ambiente para tinciones patológicas.
- Realizar la tinción tricrómica de Eosin y Masson14.
6. Detección de hidroxiprolina (HYP)
- Pesar 30-100 mg de tejido pulmonar en un tubo de vidrio. Añadir 2 mL de solución de ácido clorhídrico (6 mol/L) y digerir a 110 °C en horno durante 2-6 h hasta que no queden grumos grandes a la vista.
- Después de enfriar, ajuste el valor de pH al rango de 6-8 usando 1 mL de solución de NaOH (10 mol/L), luego condense el agua destilada a 4 mL de solución. Por último, centrifugar a 28.620 x g a 25 °C durante 20 min y tomar el sobrenadante.
- Precaliente el lector de microplacas durante 30 minutos, ajuste la longitud de onda a 560 nm y ponga a cero el instrumento con agua destilada.
- Diluir la solución patrón con agua destilada para preparar soluciones estándar con concentraciones de 30, 15, 7,5, 3,75, 1,875, 0,938, 0,469 y 0,234 μg/mL.
- Tome 60 μL del sobrenadante de la muestra y mézclelo con 60 μL del reactivo A, luego déjelo reposar a temperatura ambiente durante 20 min.
- Añadir 60 μL de reactivo B y 120 μL de agua destilada. Colocar la solución mezclada en un baño de agua a 60 °C durante 20 min. Siga los mismos pasos para cada concentración de las soluciones patrón (por ejemplo, 30, 15, 7,5, 3,75, 1,875, 0,938, 0,469, 0,234 μg/mL) y realice las operaciones en consecuencia.
- Después de permanecer a temperatura ambiente durante 15 minutos, tome 200 μL de la solución en la placa de 96 pocillos para detectar el valor de absorción de luz a 560 nm. Trace la curva estándar con la concentración de las soluciones estándar como el eje x y los valores medidos como el eje y, obteniendo la ecuación y=kx+b. Sustituya el valor medido de la muestra en la ecuación para determinar la concentración de la muestra.
Resultados
Fibrosis pulmonar inducida por bleomicina en ratas
La bleomicina ha sido reportada como un inductor clásico de fibrosis pulmonar en modelos animales7. En este caso, se evaluaron los índices de fibrosis pulmonar tras la estimulación con BLM. En primer lugar, después de 35 días de tratamiento con BLM, realizamos pruebas de función pulmonar y descubrimos que tanto la FVC (Figura 1E) como la distensibilidad pulmonar dinámica (Figura 1F) en el grupo modelo se redujeron significativamente. Estos resultados indican claramente que la función pulmonar estaba marcadamente deteriorada. En segundo lugar, para evaluar la deposición de colágeno en el tejido pulmonar, el estudio empleó la tinción tricrómica de Masson y el ensayo HYP. La tinción tricrómica de Masson reveló un aumento significativo en las áreas teñidas de azul alrededor de las arterias pulmonares en el grupo modelo, lo que sugiere una acumulación pronunciada de colágeno (Figura 1D). Mientras tanto, los resultados del ensayo HYP demostraron que los niveles de HYP en el grupo modelo fueron significativamente más altos que los del grupo de control (Figura 2E), lo que confirma aún más el aumento de la deposición de colágeno. Además, evaluamos los pesos del hígado (Figura 3A) y de los riñones (Figura 3B) utilizando un método de pesaje y no encontramos diferencias significativas entre los dos grupos.
Progresión de la hipertensión pulmonar estimulada por BLM
A continuación, se midieron los cambios hemodinámicos característicos de la hipertensión pulmonar. Después de 35 días de tratamiento con BLM, se evaluó la presión sistólica del ventrículo derecho (RVSP) mediante cateterismo cardíaco derecho. Los resultados mostraron que la RVSP (Figura 1A,C) en el grupo modelo fue significativamente mayor que en el grupo control. Por su parte, al calcular el índice de Fulton de corazones de rata, se encontró que la relación entre el ventrículo derecho y el ventrículo izquierdo más el peso del tabique (RV/(LV+S); Figura 1B) aumentó significativamente después de 35 días de tratamiento con BLM. La elevación de la RVSP (Figura 1A,C) y el aumento del VD/(LV+S) (Figura 1B) indicaron colectivamente el establecimiento exitoso de la fibrosis pulmonar combinada con el modelo de hipertensión pulmonar (PF-PH). Además, el análisis histológico reveló cambios histopatológicos típicos relacionados con el remodelado vascular pulmonar en el grupo modelo (Figura 1D). Para evaluar más a fondo la función cardíaca, realizamos una ecocardiografía, que mostró que el grupo modelo exhibió proporciones significativamente reducidas de PAT/PET (Figura 2A), TAPSE (Figura 2B), RVFAC (Figura 2C) y CO (Figura 2D). En resumen, estos resultados demuestran que BLM es un inductor eficaz para construir con éxito el modelo de rata PF-PH.

Figura 1: La rata tratada con BLM mostró un aumento de los índices hemodinámicos, remodelación vascular y disfunción de la función pulmonar. (A) Las trazas representativas de RVSP, (B) RV/LV+S y (C) muestran índices hemodinámicos para los grupos de control y modelo. (D) Tinción de eosina y tricrómico de Masson, que exhibe los cambios histológicos en las arterias pulmonares dentro de las secciones pulmonares de cada grupo. (E) Los gráficos de barras muestran la FVC (F) y la distensibilidad pulmonar dinámica. Los resultados se expresan como media ± SEM, y la significancia se evaluó mediante la prueba t de Student. n = 8 en cada grupo (A, B); n = 6 en cada grupo (E, F). *p < 0,05, lo que indica una diferencia significativa. Haga clic aquí para ver una versión más grande de esta figura.
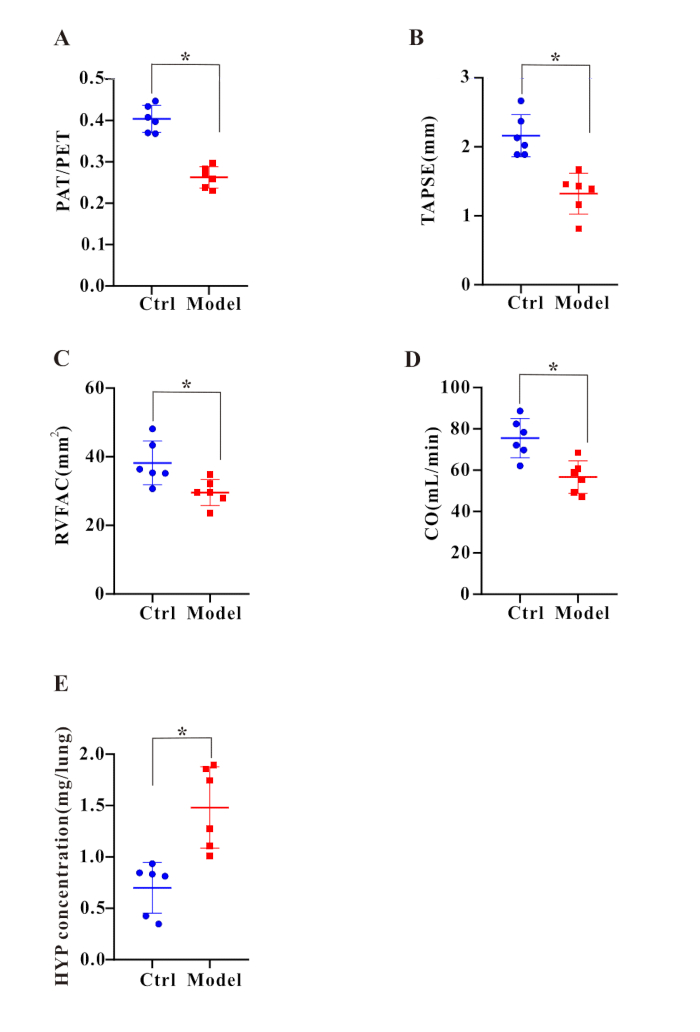
Figura 2: Se detectó disfunción cardíaca derecha y depósito de colágeno después del tratamiento con BLM. Los gráficos de barras muestran la relación entre (A) PAT/PET, (B) TAPSE, (C) RVFAC, (D) CO y (E) concentración de HYP. Los resultados se expresan como media ± SEM, y la significancia se evaluó mediante la prueba t de Student. n = 6 en cada grupo. *p < 0,05, lo que indica una diferencia significativa. Haga clic aquí para ver una versión más grande de esta figura.
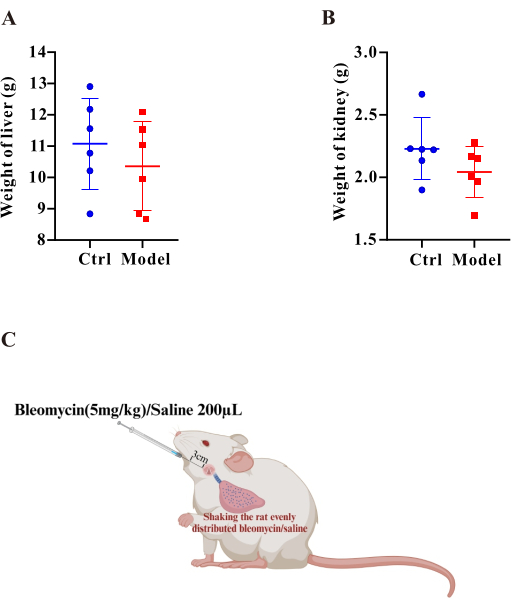
Figura 3: Los pesos del hígado y del riñón fueron comparables entre el modelo y el grupo control. Los gráficos de barras muestran los pesos del hígado (A) y del riñón (B). Los resultados se expresan como media ± SEM, y la significancia se evaluó mediante la prueba t de Student. *p < 0,05, lo que indica una diferencia significativa. (C) Esquema del protocolo para el establecimiento del modelo de rata PF-PH. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La fibrosis pulmonar idiopática es una enfermedad progresiva y mortal con una mediana de supervivencia de 2-3 años desde el diagnóstico, lo que sugiere un pronóstico sombrío9. La hipertensión pulmonar es una comorbilidad frecuente de la FPI, que se deteriora rápidamente con un pronóstico peor15. Además, las opciones terapéuticas para la FPI-PH7 eran limitadas. Por lo tanto, es esencial obtener una comprensión más profunda de los mecanismos moleculares subyacentes de la PF-PH, lo que puede proporcionar un enfoque terapéutico potencial para la enfermedad.
El protocolo propuesto describe un método bien establecido y estable para generar un modelo de rata PF-PH. El modelo es esencial para estudiar los mecanismos fisiopatológicos de las enfermedades y desempeña un papel crucial en la verificación de nuevos enfoques terapéuticos. Los modelos animales de PF pueden establecerse a través de varios métodos, incluyendo la administración de fármacos, la irradiación, la exposición a sílice, vectores virales, transgénicos y la transferencia de fibroblastos humanos16. Cada método de modelado tiene sus fortalezas y debilidades. Por ejemplo, la irradiación es costosa y requiere mucho tiempo (tarda más de 30 semanas); Es más probable que el tratamiento con sílice cause neumoconiosis que PF; Los procedimientos para los vectores virales y los modelos animales transgénicos son relativamente complicados y requieren conocimientos avanzados; y la transferencia de fibroblastos humanos resulta en baja reproducibilidad y altos costos16. Por el contrario, los modelos de PF inducidos por fármacos, como los que utilizan bleomicina, amiodarona, metotrexato y mostaza nitrogenada, son fáciles de implementar, eficaces y reproducibles7.
El modelo tiene tres pasos clave, que incluyen la dosis y el modo de administración, la selección del sexo y el tiempo para hacer el modelo. Aunque una dosis única de BLM (0,1-6 mg/kg), administrada por vía intratraqueal u orofaríngea, es un enfoque comúnmente utilizado para el modelado de la PF17. Hemos hecho algunas mejoras. En el presente estudio, se exploraron la dosis óptima y el modo de administración de BLM, y se seleccionó una dosis de 5 mg/kg administrada por vía intratraqueal. Debido a que las ratas hembras de Sprague-Dawley exhibieron hipertensión pulmonar (HP) menos severa que las ratas macho18 y las ratas macho son más sensibles a la remodelación de la arteriola pulmonar; En este estudio se utilizaron ratas macho. Según estudios previos realizados, el RVSP y el índice de Fulton en el grupo de bleomicina aumentaron gradualmente dentro de los 7-35 días posteriores al tratamiento con bleomicina, significativamente más alto que en el grupo de control. Por lo tanto, se recomienda que el tiempo de modelado del modelo sea de unos 35 días.
Nuestros estudios previos establecieron con éxito modelos de ratas con hipertensión pulmonar utilizando varios métodos, incluyendo hipoxia19, Sugen-hipoxia20, monocrotalina19, ligadura de la arteria pulmonar21 y nefrectomía15. Los cambios característicos observados en estos modelos animales de hipertensión pulmonar incluyen aumento de RVSP, relaciones RV/(VI+S) elevadas, remodelación vascular pulmonar y disfunción cardíaca derecha, en línea con los hallazgos del presente estudio
A pesar del fácil acceso a BLM, este modelo animal tiene varias limitaciones. En primer lugar, las infusiones de BLM en las vías respiratorias provocan una distribución desigual de las concentraciones del fármaco, lo que conduce a la fibrosis local de los pulmones. En segundo lugar, BLM es un agente quimioterapéutico que presenta riesgos para la salud de los investigadores. En tercer lugar, las investigaciones indican que el proceso fibrótico inducido por BLM puede ser autolimitado16.
En conclusión, establecimos con éxito un modelo de rata PH asociado a PF utilizando BLM. Este modelo animal exhibía características típicas de PF, incluyendo deterioro de la función pulmonar y elevación de la deposición de colágeno. Además, observamos cambios hemodinámicos representativos, como el aumento de las proporciones RVSP y RV/(LV+S), junto con la remodelación vascular y la disfunción cardíaca derecha en este modelo de rata inducido por BLM. Es importante destacar que el establecimiento de un modelo de rata PF-PH es valioso para comprender los mecanismos subyacentes a PF-PH y proporcionar nuevas direcciones terapéuticas.
Divulgaciones
Los autores no tienen información financiera relevante.
Agradecimientos
Este trabajo fue respaldado en parte por las subvenciones de la Fundación Nacional de Ciencias Naturales de China (82370063, 82170069, 82120108001, 82241012), el Programa de Investigación y Desarrollo del Laboratorio Nacional de Guangzhou (GZNl2023A02013), el Programa Nacional Clave de Investigación y Desarrollo de China (2022YFE0131500), el Departamento de Ciencia y Tecnología de Guangdong (2024A1515011208, 2022A1515012052, 2024A1515013104, 202102020019, 202201020538, 202201010069, 2023A03J0334), el Proyecto Independiente del Laboratorio Estatal Clave de Enfermedades Respiratorias (SKlRD-Z-202513), la Fundación de Investigación Médica de Guangdong (A2023379), la Universidad Médica de Guangzhou y el Plan para mejorar la investigación científica en GMU y los Fondos de Investigación Abierta del Sexto Hospital Afiliado de la Universidad Médica de Guangzhou (Hospital Popular de Qingyuan) (202201-101).
Materiales
| Name | Company | Catalog Number | Comments |
| Bleomycin | MedChemExpress | HY-17565A | |
| Coupling agent | HYNAUT | BX-CSRH | |
| Formalin fixative | Biosharp) | BL401B | |
| Hair removal cream | LUSEN | LS-B-TMG-50 | |
| Hematoxylin eosin (HE) staining kit | Beyotime | C0189S | |
| Isoflurane | RWD Life Science(China) | R510-22-10 | |
| Masson Tri-color dyeing kit | Beyotime | C0189S | |
| Normal saline | KERONG | SLYS-001 | |
| syringe | Beyotime | FS701-50pcs |
Referencias
- Sm, N., et al. Clinical significance of pulmonary hypertension in interstitial lung disease: A consensus statement from the Pulmonary Vascular Research Institute's innovative drug development initiative-Group 3 pulmonary hypertension. Pulm Circ. 12 (3), e12127(2022).
- Nathan, S. D., et al. Pulmonary hypertension in chronic lung disease and hypoxia. Eur Resp J. 53 (1), 1801914(2019).
- King, C. S., Shlobin, O. A. The Trouble With Group 3 Pulmonary Hypertension in Interstitial Lung Disease. Chest. 158 (4), 1651-1664 (2020).
- Meyer, K. C. Pulmonary fibrosis, part I: epidemiology, pathogenesis, and diagnosis. Expert Rev Respir Med. 11 (5), 343-359 (2017).
- Raghu, G., et al. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Critic Care Med. 205 (9), e18-e47 (2022).
- Ruffenach, G., Hong, J., Vaillancourt, M., Medzikovic, L., Eghbali, M. Pulmonary hypertension secondary to pulmonary fibrosis: clinical data, histopathology and molecular insights. Respir Res. 21 (1), 303(2020).
- Li, S., Shi, J., Tang, H. Animal models of drug-induced pulmonary fibrosis: an overview of molecular mechanisms and characteristics. Cell Biol Toxicol. 38 (5), 699-723 (2022).
- Karmouty-Quintana, H., et al. Deletion of ADORA2B from myeloid cells dampens lung fibrosis and pulmonary hypertension. FASEB J. 29 (1), 50-60 (2015).
- Jiang, Q., et al. Dysregulation of BMP9/BMPR2/SMAD signalling pathway contributes to pulmonary fibrosis and pulmonary hypertension induced by bleomycin in rats. Br J Pharmacol. 178 (1), 203-216 (2021).
- Degryse, A. L., Lawson, W. E. Progress toward improving animal models for idiopathic pulmonary fibrosis. Am J Med Sci. 341 (6), 444-449 (2011).
- Collum, S. D., et al. Inhibition of hyaluronan synthesis attenuates pulmonary hypertension associated with lung fibrosis. Br J Pharmacol. 174 (19), 3284-3301 (2017).
- Ye, X., et al. Animal models of acute exacerbation of pulmonary fibrosis. Respir Res. 24 (1), 296(2023).
- León-Mancilla, B., et al. Three-Dimensional Collagen Matrix Scaffold Implantation as a Liver Regeneration Strategy. J Vis Exp. (172), e62697(2021).
- Oldham, S., Rivera, C., Boland, M. L., Trevaskis, J. L. Incorporation of a Survivable Liver Biopsy Procedure in Mice to Assess Non-alcoholic Steatohepatitis (NASH) Resolution. J Vis Exp. (146), e59130(2019).
- Jiang, Q., et al. Nephrectomy and high-salt diet inducing pulmonary hypertension and kidney damage by increasing Ang II concentration in rats. Respir Res. 25 (1), 288(2024).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Jenkins, R. G., et al. An Official American Thoracic Society Workshop Report: Use of Animal Models for the Preclinical Assessment of Potential Therapies for Pulmonary Fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Lahm, T., et al. The effects of estrogen on pulmonary artery vasoreactivity and hypoxic pulmonary vasoconstriction: Potential new clinical implications for an old hormone. Crit Care Med. 36 (7), 2174-2183 (2008).
- Chen, Y., et al. Tetramethylpyrazine: A promising drug for the treatment of pulmonary hypertension. Br J Pharmacol. 177 (12), 2743-2764 (2020).
- Zheng, Q., et al. Established pulmonary hypertension in rats was reversed by a combination of a HIF-2α antagonist and a p53 agonist. Br J Pharmacol. 179 (5), 1065-1081 (2022).
- Chen, J., et al. Upregulation of mechanosensitive channel Piezo1 involved in high shear stress-induced pulmonary hypertension. Thrombo Res. 218, 52-63 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados