Method Article
Hyperbalayage EEG à domicile pour les interactions sociales entre le nourrisson et le soignant
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit comment l’électroencéphalographie, l’électrocardiographie et les enregistrements comportementaux synchronisés ont été capturés à partir de dyades de nourrissons-soignants à domicile.
Résumé
Les études antérieures par hyperbalayage qui enregistrent les activités cérébrales des soignants et des enfants en même temps ont été principalement menées dans les limites du laboratoire, limitant ainsi la généralisabilité des résultats à des contextes réels. Ici, un protocole complet pour capturer l’électroencéphalographie synchronisée (EEG), l’électrocardiographie (ECG) et les enregistrements comportementaux des dyades nourrissons-soignants pendant diverses tâches interactives à la maison est proposé. Ce protocole montre comment synchroniser les différents flux de données et rapporter les taux de rétention des données EEG et les contrôles de qualité. De plus, les problèmes critiques et les solutions possibles en ce qui concerne la configuration expérimentale, les tâches et la collecte de données à domicile sont discutés. Le protocole n’est pas limité aux dyades nourrissons-soignants, mais peut être appliqué à diverses constellations dyadiques. Dans l’ensemble, nous démontrons la flexibilité des configurations d’hyperbalayage EEG, qui permettent de mener des expériences en dehors du laboratoire pour capturer les activités cérébrales des participants dans des environnements plus écologiquement valides. Pourtant, le mouvement et d’autres types d’artefacts limitent encore les tâches expérimentales qui peuvent être effectuées à la maison.
Introduction
Avec l’enregistrement simultané des activités cérébrales de deux ou plusieurs sujets en interaction, également connu sous le nom d’hyperscanning, il est devenu possible d’élucider la base neuronale des interactions sociales dans leur dynamique complexe, bidirectionnelle et rapide1. Cette technique a déplacé l’attention de l’étude des individus dans des environnements isolés et étroitement contrôlés vers l’examen d’interactions plus naturalistes, telles que les interactions parent-enfant pendant le jeu libre 2,3, la résolution d’énigmes 4 et les jeux informatiques coopératifs 5,6. Ces études démontrent que les activités cérébrales se synchronisent pendant les interactions sociales, c’est-à-dire qu’elles présentent des similitudes temporelles, un phénomène appelé synchronie neuronale interpersonnelle (SNI). Cependant, la grande majorité des études d’hyperbalayage ont été confinées à des laboratoires. Bien que cela permette un meilleur contrôle expérimental, cela peut se faire au prix d’une perte de validité écologique. Les comportements observés en laboratoire peuvent ne pas être représentatifs des comportements interactifs quotidiens typiques des participants en raison du cadre inconnu et artificiel et de la nature des tâches imposées7.
Les progrès récents des appareils mobiles de neuroimagerie, tels que l’électroencéphalographie (EEG) ou la spectroscopie fonctionnelle dans le proche infrarouge (fNIRS), atténuent ces problèmes en supprimant la nécessité pour les participants de rester physiquement connectés à l’ordinateur d’enregistrement. Ainsi, ils nous permettent de mesurer les activités cérébrales des participants lorsqu’ils interagissent librement en classe ou à leur domicile 8,9. L’avantage de l’EEG par rapport à d’autres techniques de neuroimagerie, telles que la fNIRS, est qu’il a une excellente résolution temporelle, ce qui le rend particulièrement adapté à l’étude de dynamiques sociales rapides10. Pourtant, il s’accompagne d’une mise en garde selon laquelle le signal EEG est très vulnérable au mouvement et à d’autres artefacts physiologiques et non physiologiques11.
Malgré cela, les premières études ont réussi à mettre en œuvre des configurations d’hyperbalayage EEG dans des environnements et des conditions réalistes. Par exemple, Dikker et al.12 ont mesuré le signal EEG d’un groupe d’étudiants alors qu’ils participaient à diverses activités en classe, notamment en assistant à des cours, en regardant des vidéos et en participant à des discussions de groupe. Cette étude, ainsi que d’autres études 8,9, a principalement utilisé des électrodes EEG sèches pour faciliter le processus de réalisation de mesures dans des environnements non laboratoires. Par rapport aux électrodes humides, qui nécessitent l’application d’un gel ou d’une pâte conductrice, les électrodes sèches offrent des avantages notables en termes de facilité d’utilisation. Il a été démontré qu’elles présentent des performances comparables à celles des électrodes humides dans des populations adultes et des conditions stationnaires ; Cependant, leurs performances peuvent diminuer dans les scénarios liés au mouvement en raison de l’augmentation des niveaux d’impédance13.
Ici, nous présentons un protocole de travail pour capturer des enregistrements synchronisés à partir d’un système EEG à gel liquide à sept canaux à faible densité avec une électrocardiographie (ECG) à une seule sonde connectée au même amplificateur sans fil (fréquence d’échantillonnage : 500 Hz) des dyades nourrissons-soignants dans un cadre domestique. Alors que les électrodes actives étaient utilisées pour les adultes, les électrodes passives étaient plutôt utilisées pour les nourrissons, car ces dernières se présentent généralement sous la forme d’électrodes annulaires, facilitant ainsi le processus d’application du gel. De plus, les enregistrements EEG-ECG ont été synchronisés avec trois caméras et microphones pour capturer les comportements des participants sous différents angles. Dans l’étude, des nourrissons de 8 à 12 mois et leurs soignants se sont livrés à une tâche de lecture et de jeu pendant que leur EEG, leur ECG et leurs comportements étaient enregistrés. Pour minimiser l’impact d’un mouvement excessif sur la qualité du signal EEG, les tâches ont été effectuées sur une table (par exemple, en utilisant la table de la cuisine et une chaise haute pour bébé), obligeant les participants à rester assis tout au long de la tâche d’interaction. Les soignants ont reçu trois livres adaptés à leur âge et des jouets de table (équipés de ventouses pour les empêcher de tomber). On leur a demandé de lire à leur enfant pendant environ 5 minutes, suivie d’une séance de jeu de 10 minutes avec les jouets.
Ce protocole détaille les méthodes de collecte synchronisées de données EEG-ECG, vidéo et audio pendant les tâches de lecture et de lecture. Cependant, la procédure globale n’est pas spécifique à ce modèle de recherche, mais convient à différentes populations (p. ex., dyades parent-enfant, dyades d’amis) et à différentes tâches expérimentales. La méthode de synchronisation des différents flux de données sera présentée. De plus, un pipeline de prétraitement EEG de base basé sur Dikker et al.12 sera décrit, et les taux de rétention des données EEG et les mesures de contrôle de la qualité seront rapportés. Étant donné que les choix analytiques spécifiques dépendent de divers facteurs (tels que la conception des tâches, les questions de recherche, le montage EEG), l’analyse EEG hyperscanning ne sera pas plus détaillée, mais le lecteur sera plutôt renvoyé aux lignes directrices et aux boîtes à outils existantes (par exemple, 14 pour les lignes directrices ;15,16 pour les boîtes à outils d’analyse d’hyperbalayage). Enfin, le protocole aborde les défis et les solutions potentielles pour l’hyperbalayage EEG-ECG à domicile et dans d’autres contextes réels.
Protocole
Le protocole décrit a été approuvé par l’Institutional Review Board (IRB) de l’Université technologique de Nanyang, à Singapour. Le consentement éclairé a été obtenu de tous les participants adultes et des parents au nom de leurs nourrissons.
1. Considérations relatives à l’équipement et à l’espace lors des séances à domicile
- Préparez-vous à des conditions d’humidité et de température différentes selon le pays et la saison. Pour les environnements avec des niveaux de température et d’humidité élevés, assurez-vous qu’il y a une circulation d’air adéquate et allumez l’unité de climatisation à la maison si possible.
- Maintenez une distance avec les émetteurs WiFi, les équipements Bluetooth (par exemple, les téléphones portables, le clavier, la souris, etc.) et les fours à micro-ondes, car les machines à proximité fonctionnant dans la même bande de fréquence peuvent provoquer des interférences. De plus, essayez de garder la configuration expérimentale à l’écart des appareils de charge dans la maison, car cela pourrait provoquer un bruit de ligne électrique important dans les données. Notez que des ventilateurs sur pied ou des ventilateurs de plafond à grande vitesse à proximité peuvent faire osciller les câbles EEG et contribuer à des artefacts mécaniques.
- Préparez un espace propice pour la réalisation de l’expérience au domicile du participant. Assurez-vous que la zone d’essai dispose d’un espace dégagé suffisant pour accueillir une personne qui s’occupe d’un enfant dans une chaise haute assise autour d’une table, ainsi que trois caméras sur des trépieds. Débarrassez tous les articles de la table, si possible, pour réduire les distractions potentielles.
- Assurez-vous qu’il y a une luminosité adéquate dans la zone de test pour que les caméscopes puissent capturer les expressions du participant. Si les tables sont proches des fenêtres, ne placez pas les caméscopes face à la fenêtre pour éviter l’éblouissement de l’objectif.
2. Préparatifs avant la session
- Informer les participants que pour la mesure de l’EEG, les adultes sont tenus de se laver les cheveux la veille de la séance sans appliquer de produits capillaires. Demandez-leur s’ils peuvent s’abstenir de se maquiller le jour de la séance d’EEG.
- Assurez-vous que tout le matériel d’enregistrement (microphones et caméscopes), les ordinateurs portables, les amplificateurs et la banque d’alimentation utilisée par le boîtier de déclenchement sont chargés la veille de la séance. Vérifiez que tout l’équipement est complètement chargé quelques heures avant la séance. Emportez des chargeurs ou de préférence des banques d’alimentation portables en cas de cas inattendus de faibles niveaux de batterie dans l’équipement.
- Emportez tous les formulaires et le matériel d’enregistrement nécessaires pour la séance.
3. Préparation de l’expérience au domicile du participant
- Préparation de gélification EEG
- Mettez une paire de gants lorsque vous manipulez le gel. Remplissez quatre seringues de gel, deux seringues avec l’embout émoussé pour les électrodes passives et deux seringues avec l’embout le plus fin pour les électrodes actives.
- Préparez deux morceaux carrés de ruban adhésif pour les électrodes ECG du nourrisson et de l’adulte.
- Préparation de l’appareil d’enregistrement
- Retirez les gants lors de la manipulation d’équipements électroniques.
- Allumez tous les ordinateurs portables et fixez les dongles EEG aux ordinateurs portables respectifs. Assurez-vous que le logiciel d’enregistrement EEG est en cours d’exécution.
- Connectez les amplificateurs pour adultes et nourrissons au logiciel d’enregistrement EEG sur les ordinateurs portables respectifs via une connexion sans fil.
- Vérifiez et assurez-vous que les deux amplificateurs (adulte et bébé) ont les mêmes paramètres de port de déclenchement, c’est-à-dire si le marqueur de déclenchement est produit sur le front ascendant (actif élevé) ou descendant (actif faible) de l’impulsion d’entrée.
- Montez les trois caméscopes sur chaque trépied. Assurez-vous que chaque caméscope capture respectivement la personne qui s’occupe de l’enfant, le nourrisson et la personne qui s’occupe de l’enfant (vue combinée) (voir Figure 1). Avant de commencer la séance, assurez-vous que les angles du caméscope permettent de capturer de manière cohérente les visages des participants, compte tenu du fait que la personne qui s’occupe de l’enfant se déplace souvent vers l’œil du nourrisson pendant les interactions.
- Placez la chaise haute du nourrisson et la chaise de la personne qui s’occupe de l’enfant au bord de leur table de manière à ce qu’elles se fassent face à un angle permettant aux caméscopes de capter leurs expressions faciales (voir la figure 1). S’il n’y a pas assez d’espace sur la table, placez la chaise haute du bébé et la chaise de la personne qui s’occupe de l’enfant l’une à côté de l’autre à angle droit.
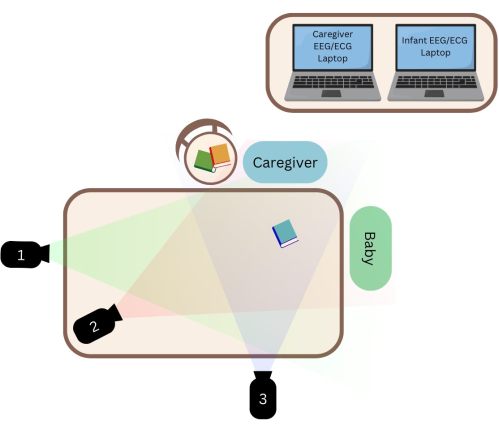
Figure 1 : Vue de haut en bas de l’installation. (1) Caméscope orienté vers les nourrissons. (2) Caméscope à vue combinée. (3) Caméscope destiné aux soignants. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Application de capteurs EEG et ECG pour le soignant
- Fixation sécurisée de l’amplificateur au capuchon EEG
- Pour le soignant, utilisez la poche arrière du capuchon EEG pour ranger l’amplificateur afin de réduire le mouvement du câble et le bruit EEG. Avant d’appliquer le capuchon au participant, assurez-vous que l’amplificateur a été bien rangé et fixé au connecteur.
- Assurez-vous qu’il n’y a pas de contact avec l’eau lors de la manipulation de l’amplificateur (c’est-à-dire retirez les gants s’ils sont trempés dans du gel).
- Demandez à l’aidant d’enlever ses lunettes, son masque ou ses boucles d’oreilles. Si leurs cheveux sont attachés, demandez-leur d’enlever le bandeau pour qu’ils aient les cheveux détachés.
- En portant des gants et avec l’autorisation de la personne soignante, nettoyez le front à l’aide d’imbibés d’alcool (alcool isopropylique à 70 %) (IPA)).
- Des deux côtés de la tête de l’aidant, séparez les cheveux au point le plus haut de l’oreille pour vous assurer que l’oreille est bien visible, en suivant les lignes naturelles de séparation des cheveux.
- Mesurez le tour de la tête de l’aidant en plaçant le ruban à mesurer autour de quatre points de référence sur la tête : la nasion (au niveau des sourcils), sur la crête de l’inion (le point le plus élevé à l’arrière de la tête) et entre le tragus gauche et droit (le bout des oreilles).
- Étirez le capuchon EEG de l’intérieur avec un geste de la main en forme de couronne et commencez à placer le capuchon du front de l’aidant vers l’arrière de sa tête. Sans lâcher le capuchon, glissez les mains vers le bas pour tenir les sangles, tirez-les vers le bas vers leur menton et fixez les extrémités auto-agrippantes. Ajustez les sangles en fonction du confort du participant.
- Assurez-vous que toute frange ou mèche de cheveux sur le visage du participant est retirée du visage pour éviter toute gêne ou obstruction de la vision.
- Lissez doucement le capuchon pour vous assurer que les électrodes sont en contact étroit avec le cuir chevelu. Assurez-vous qu’il n’y a pas de plis sur le bouchon.
- Placez le ruban à mesurer sur les électrodes sur la ligne médiane et mesurez la distance entre la nasion et l’ion. Assurez-vous que l’électrode Cz du système international 10-20 se trouve au milieu de la mesure. Utilisez la méthode de froissage et de relâchement pour déplacer les positions du capuchon d’avant en arrière si nécessaire.
- Mesurez la distance entre le tragus gauche et droit pour vous assurer que l’électrode Cz correspond au point médian de la mesure et ajustez si nécessaire.
- Application de gel EEG et ECG
- Commencez par appliquer du gel sur les électrodes de référence et de terre. Procédez à la gélification des électrodes restantes. Commencez par les électrodes à l’arrière, car il peut s’écouler plus de temps avant que l’impédance ne se réduise à une plage acceptable (généralement < 25 kΩ), car les adultes ont généralement plus de poils à l’arrière.
- Lors de l’application du gel sur le soignant, utilisez une seringue avec un embout plus long et plus fin. Insérez l’embout de la seringue dans l’ouverture de l’électrode et séparez les cheveux à l’aide de la courbe inférieure de la seringue. Versez de petites quantités de gel au fur et à mesure que la seringue est retirée. S’il y a un grand espace entre le cuir chevelu et l’électrode, appuyez fermement sur l’électrode pour assurer le contact.
- Utilisez la lumière comme guide de référence d’impédance si la configuration de l’électrode active donnée le permet. Vous pouvez également vous référer aux lectures d’impédance sur le logiciel d’enregistrement EEG pour identifier les électrodes nécessitant une amélioration du contact.
REMARQUE : Les électrodes à faible impédance et de bonne qualité de signal (assurée par la vérification des artefacts avant de commencer la session) seront colorées en vert sur le capuchon et/ou sur le montage EEG. Si l’impédance d’une électrode est élevée, répétez l’effort pour séparer les cheveux et bien déplacer le gel dans l’électrode jusqu’au point de contact clair avec le cuir chevelu. - Notez que le capuchon ne s’adapte généralement pas parfaitement à chaque tête, et les zones concaves de la tête peuvent provoquer un espace naturel entre l’électrode et le cuir chevelu. Si l’impédance reste élevée, appliquez un petit monticule de gel pour assurer un pont de gel entre l’électrode et le cuir chevelu. Veillez à ne pas déplacer le gel sur le côté après cela pour éviter de faire le pont avec les électrodes voisines sous le capuchon.
- Veillez à ne pas trop remplir les puits de gel pour éviter de jeter des ponts entre les électrodes adjacentes sur le bouchon.
- Une fois que toutes les électrodes EEG ont une faible impédance, nettoyez la zone molle sous la clavicule gauche du participant à l’aide de lingettes imbibées d’alcool et commencez à fixer l’électrode ECG.
- Fixez un ruban circulaire au bas de l’électrode ECG et appliquez suffisamment de gel pour couvrir le puits de l’électrode.
- Fixez l’électrode sur la zone molle sous la clavicule gauche. Appliquez du ruban adhésif blanc sur le dessus du capteur.
5. Application de capteurs EEG et ECG pour le nourrisson
- Demandez à la personne qui s’occupe de l’enfant d’aider l’enfant à porter un gilet, qui est fourni par les expérimentateurs, avec une poche arrière, qui stockera plus tard l’amplificateur.
- Avec la permission de l’aidant, nettoyez le front à l’aide de lingettes imbibées d’alcool. Mesurez le tour de tête du nourrisson en plaçant le ruban à mesurer autour des quatre points de référence.
- Si le nourrisson est apparemment de bonne humeur et qu’il joue joyeusement seul ou avec une personne qui s’occupe d’elle, mettez le capuchon EEG. Consultez la personne qui s’occupe de l’enfant au sujet de l’humeur du nourrisson et de sa prédisposition au port d’un couvre-chef. Préparez de la nourriture sèche ou des jouets pour occuper les mains du nourrisson avant de le coiffer, si cela convient au parent. De plus, placez le nourrisson sur les genoux de la personne qui s’occupe de lui afin qu’il se sente réconforté pendant le processus de gélification.
- Placez le capuchon sur la tête du nourrisson avec le même mouvement d’étirement en forme de couronne et fixez les extrémités auto-agrippantes sous le menton. Demandez à la deuxième personne qui s’occupe de l’enfant d’inciter l’enfant à lever les yeux, à l’aide d’un hochet, afin qu’il soit plus facile d’attacher les extrémités auto-agrippantes.
- Assurez-vous que toute frange ou tout poil égaré sur le visage du nourrisson est soigneusement rangé sous le capuchon pour éviter toute gêne ou obstruction de la vision.
- Lissez doucement le capuchon pour vous assurer que les électrodes sont en contact étroit avec le cuir chevelu. Assurez-vous qu’il n’y a pas de plis sur le bouchon.
- Utilisez le ruban à mesurer pour vous assurer que le capuchon est correctement positionné, avec l’électrode Cz au milieu ou au sommet de la tête et utilisez la méthode de froissage et de relâchement pour ajuster si nécessaire (voir étape 4.7).
- Fixez solidement l’amplificateur au capuchon. Une fois connecté, affichez les lectures d’impédance.
- Placez l’amplificateur connecté dans la poche à l’arrière du gilet pour bébé.
- Application de gel EEG et ECG
- Commencez par appliquer du gel sur les électrodes de référence et de terre. Procédez à la gélification des électrodes restantes en commençant par l’arrière.
REMARQUE : Les nourrissons peuvent être un peu difficiles avec les expérimentateurs qui touchent leur tête ou à cause de la sensation de refroidissement du gel. Si c’est le cas, laissez un peu de temps à la personne qui s’occupe de l’enfant pour apaiser le nourrisson avant de continuer. Le deuxième expérimentateur peut distraire l’enfant (par exemple, en soufflant des bulles, en utilisant des jouets ou en lui donnant de la nourriture). - Remplissez toutes les ouvertures des électrodes avec du gel, puis utilisez les cotons-tiges pour séparer les cheveux dans un léger mouvement de gauche à droite si vous utilisez des électrodes passives (comme ici) ; reportez-vous au montage sur le logiciel d’enregistrement EEG pour vérifier l’impédance pendant la gélification.
- Assurez-vous que toutes les électrodes présentent une faible impédance sur le logiciel d’enregistrement EEG, généralement < 50 kΩ, car les nourrissons sont moins tolérants au processus de gélification que les adultes.
- Nettoyez la zone molle sous la clavicule gauche du nourrisson avec des lingettes pour bébé et fixez l’ECG sous la clavicule gauche du nourrisson en suivant la même procédure que l’ECG adulte.
- Commencez par appliquer du gel sur les électrodes de référence et de terre. Procédez à la gélification des électrodes restantes en commençant par l’arrière.
6. Création d’une boîte de déclenchement pour la synchronisation multimodale des données
REMARQUE : Étant donné que différents flux de données de capteur (c’est-à-dire EEG, ECG, vidéo et audio) commenceront à enregistrer à différents moments de la session, ils doivent être synchronisés manuellement pour créer une chronologie unique des événements. Ainsi, il est nécessaire de capturer un événement commun qui peut être capturé à la fois par le caméscope (c’est-à-dire la lumière LED) et l’amplificateur (c’est-à-dire le signal numérique ou analogique). Pour ce faire, une boîte de déclenchement de synchronisation interne est utilisée, qui peut être construite à l’aide d’un simple programme d’unité de microcontrôleur, comme détaillé ci-dessous.
- Pour construire le boîtier de déclenchement, utilisez une carte de développement de microcontrôleur, une LED, un connecteur BNC, une banque d’alimentation, un périphérique d’entrée numérique (c’est-à-dire un bouton-poussoir) et une sortie d’impulsion/signal électrique (c’est-à-dire des fils de déclenchement) qui se connectent au port de déclenchement de l’amplificateur (voir Figure 2B).
- Connectez le connecteur BNC femelle au bouton-poussoir, qui sert d’entrée (par exemple, broche d’entrée : 8), et le voyant LED et le signal d’impulsion électrique agissent comme sortie (par exemple, broche de sortie : 12 ; voir Figure 2A).
- Connectez le connecteur BNC aux deux amplificateurs via les câbles électriques de 2,5 mm, produisant des déclencheurs à un bit marquant les échantillons dans l’enregistrement EEG-ECG lorsqu’il lit le signal TTL numérique à partir du bouton-poussoir (voir Figure 2C).
- Configurez les paramètres du port de déclenchement des amplificateurs adultes et nourrissons de la même manière pour assurer une synchronisation EEG-EEG précise et précise.
- Concevez le système de déclenchement de telle sorte que les marqueurs de déclenchement soient produits dans les deux enregistrements de l’amplificateur lorsque le bouton-poussoir de déclenchement est relâché (après avoir été enfoncé) plutôt que lorsqu’il est enfoncé.
- Identifiez l’état actuel du port de déclenchement dans les amplificateurs. S’il s’agit initialement de 0 ou LOW, réglez le port sur low-active pour produire un marqueur lorsque le bouton-poussoir est relâché. Sinon, si l’état initial du port est 1 ou HIGH, réglez le port sur high-active pour produire un marqueur lorsque le bouton-poussoir est relâché (voir Figure 3).

Figure 2 : Construction de la boîte de déclenchement. (A) Schéma de circuit du microcontrôleur pour la boîte de déclenchement ; (B) Intérieur de la boîte de déclenchement construite ; (C) Boîtier de déclenchement connecté aux amplificateurs EEG-ECG pour adultes et nourrissons, au bouton-poussoir de déclenchement et à la banque d’alimentation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
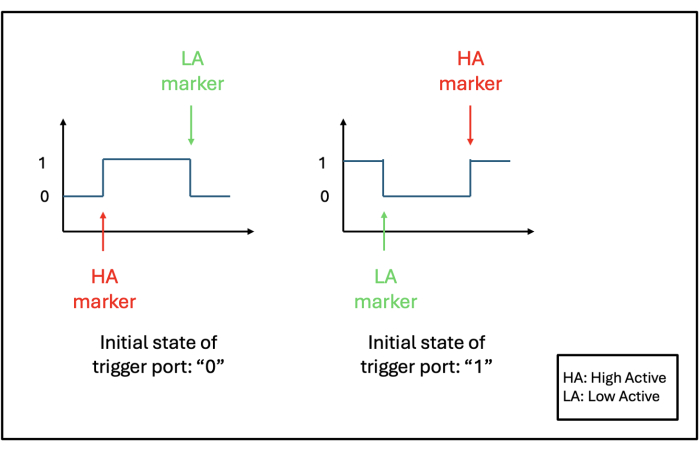
Figure 3 : paramètres du port de déclenchement actif élevé et actif faible. En fonction de l’état initial de la goupille de déclenchement (0 ou 1), le réglage du port de déclenchement (High Active, HA ou Low Active, LA) est choisi de manière à ce que le marqueur soit produit à la fin de l’impulsion (lorsque le bouton-poussoir de déclenchement est relâché). Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Synchronisation des flux de capteurs
- Pour faciliter la synchronisation, fixez le récepteur du microphone à son caméscope respectif, synchronisant ainsi automatiquement la vidéo (caméscope) avec l’audio (microphone).
REMARQUE : Étant donné que les microphones sont connectés aux caméscopes et que les électrodes EEG et ECG proviennent du jeu de branches d’électrodes EEG connecté au même amplificateur, ces flux de données sont automatiquement pré-synchronisés. - Fixez l’émetteur de microphone correspondant au col du haut de la personne qui s’occupe de l’enfant et au gilet du bébé.
- Démarrez l’enregistrement des caméscopes pour les trois caméscopes après vous être assuré que leur positionnement peut capturer le signal lumineux LED du boîtier de déclenchement dans la pièce.
- Démarrez l’enregistrement EEG sur l’ordinateur portable et l’amplificateur (version carte SD) pour le nourrisson et la personne qui s’occupe de lui. Pour faciliter la synchronisation post-session, démarrez d’abord les caméras, puis les capteurs EEG dans l’ordre adulte-nourrisson, car l’EEG du nourrisson est le capteur maître avec lequel tous les autres capteurs sont synchronisés (pour éviter les décalages négatifs vidéo-EEG).
- Fixez fermement les deux amplificateurs à la configuration du boîtier de déclenchement à l’aide de la prise jack 2,5 mm pour éviter les marqueurs parasites (Figure 2C).
REMARQUE : Un marqueur de déclenchement doit être visible sur le flux continu EEG lorsque la prise est fixée à l’amplificateur. - Synchronisez les flux de données à l’aide de la boîte de déclenchement.
- Effectuez de longues pressions sur les boutons-poussoirs, car la différence d’apparence des marqueurs entre les deux configurations (début ou fin de l’appui sur le bouton) n’est perceptible que lorsque les pressions sont considérablement longues (au moins 1 à 2 s).
- Effectuez plusieurs appuis longs pour produire plusieurs déclencheurs afin d’augmenter la précision et la fiabilité des décalages estimés entre les capteurs et de faciliter la synchronisation post-hoc dans les situations où certains déclencheurs ne sont pas enregistrés par certains capteurs.
- Vérifiez toutes les caméras pour vérifier si le signal LED de la boîte de déclenchement est visible dans les enregistrements et vérifiez s’il y a des marqueurs simultanés affichés dans les enregistrements EEG en cours sur l’ordinateur portable.
- Retirez les amplificateurs de la configuration de la boîte de déclenchement et assurez-vous qu’ils sont solidement fixés aux capuchons EEG respectifs.
- Effectuez cette procédure de synchronisation au début et à la fin de la session expérimentale, en particulier si des caméras Web sont utilisées pour surveiller les images vidéo perdues, ce qui entraîne une dérive de la synchronisation.
8. Expérience d’interaction parent-enfant
- Avant de commencer la tâche d’interaction parent-enfant, retirez tout l’équipement de la table pour éliminer les distractions potentielles pour les expériences d’interaction parent-enfant.
- Effectuer les tâches expérimentales.
REMARQUE : Les tâches ont été choisies pour mettre l’accent sur les interactions naturalistes entre la dyade avec un minimum d’instructions ou d’implication de l’expérimentateur (par exemple, lisez avec votre bébé pendant 5 minutes comme vous le feriez généralement à la maison). La durée de la tâche dépend du confort des participants et des limites de l’équipement, par exemple la durée de vie de la batterie de l’amplificateur. - Si possible, assurez-vous que tous les expérimentateurs sont cachés à la vue du nourrisson tout au long de l’expérience pour éviter les distractions. L’un des expérimentateurs doit rester à proximité des ordinateurs portables d’enregistrement pour pouvoir intervenir en cas de problème de diffusion du capteur. Assurez-vous que les ordinateurs portables d’enregistrement sont à proximité des amplificateurs (< 10 m) pour éviter les pertes d’échantillons dues à la dégradation sans fil (Wi-Fi, Bluetooth).
9. Nettoyage à la fin de l’expérience
- Arrêtez les enregistrements sur les caméscopes et le logiciel d’enregistrement EEG sur l’ordinateur portable et l’amplificateur. Éteignez l’amplificateur et détachez-le du capuchon.
- Retrait des capuchons EEG
- Retirez délicatement les bandes et les électrodes ECG en commençant par la personne qui s’occupe de l’enfant ou demandez à celle-ci de retirer l’ECG du nourrisson si nécessaire. Comme la peau du nourrisson est sensible, utilisez des lingettes pour bébé ou de l’eau tiède pour mouiller le ruban afin de le retirer plus facilement.
- Commencez par retirer les extrémités auto-agrippantes du capuchon, puis décollez le capuchon vers l’arrière et retournez-le. Utilisez des lingettes pour bébé pour nettoyer les résidus de gel de la tête du nourrisson et retirez le capuchon de la personne qui s’occupe de lui.
- Informez le soignant que l’excès de gel s’enlève facilement sous la douche.
- Préparatifs pour le transport
- Placez le capuchon EEG avec les électrodes EEG et ECG dans un sac en plastique. Assurez-vous que le gel sur le capuchon n’entre pas en contact avec la boîte de séparation du bouchon. Conservez les fils et la boîte répartitrice dans une boîte structurée pendant le transport.
- Pour éviter les dommages mécaniques pendant le transport, emballez l’amplificateur dans une boîte rembourrée pour minimiser les vibrations.
- Nettoyage post-bouchage en laboratoire
- Commencez à nettoyer les capuchons EEG dès que possible.
- Mettez les capuchons EEG dans une cuve de nettoyage et prenez les fils en sandwich avec des chiffons secs loin de la source d’eau. Assurez-vous que le boîtier de séparation n’entre pas en contact avec de l’eau.
- Versez environ 1 L d’eau dans la baignoire et ajoutez 10 ml de désinfectants à base d’aldéhyde. Laisser le capuchon reposer dans la solution pendant 10 min. Ne gardez pas le capuchon dans la solution trop longtemps et ne mettez pas trop de désinfectant, car cela accélérerait la détérioration des bouchons au fil du temps.
- Après 10 min, utilisez une brosse à dents pour nettoyer les résidus de gel des électrodes sous l’eau courante. Soyez particulièrement prudent lors du nettoyage des électrodes actives, car elles ont de petits circuits électroniques intégrés dans chaque électrode.
- Rincez abondamment le capuchon à l’eau pour éliminer la solution désinfectante.
- À l’aide d’un chiffon sec, séchez le capuchon et insérez un chiffon sec à l’intérieur du capuchon pour absorber l’humidité restante. Fermez les extrémités du crochet et de la boucle pour maintenir le chiffon sec à l’intérieur du capuchon.
- Suspendez le capuchon pour qu’il sèche et assurez-vous que les extrémités humides du capuchon ne rencontrent pas les connecteurs. Pour ce faire, placez le capuchon à une position plus basse que le boîtier de séparation et les connecteurs pendant la suspension.
- Sauvegarde des données
- Assurez-vous que les données des cartes SD des caméscopes, des amplificateurs et des enregistrements de l’ordinateur portable sont exportées et sauvegardées sur le site de stockage des données.
10. Assurance de la qualité des données
- Données vidéo-audio
- Vérifiez que le son est activé, qu’aucune vue n’a été obstruée pendant les tâches et que les marqueurs sont capturés.
- Données EEG-ECG
- Assurez-vous que l’enregistrement de la carte SD est présent et qu’il n’est pas corrompu. Vérifiez si les marqueurs sont capturés sur les deux enregistrements EEG.
- Vérifiez les défauts techniques, c’est-à-dire la déconnexion de l’amplificateur et les interférences électriques ou mécaniques dans le signal EEG / ECG.
11. Traitement des données
- Synchronisation des enregistrements multi-capteurs
- Importez les vidéos du caméscope pour les soignants, les nourrissons et les caméras combinées dans le logiciel de montage vidéo.
- Parcourez la vidéo pour marquer les images spécifiques dans lesquelles chaque voyant de déclenchement LED apparaît pour la première fois. Continuez à parcourir la vidéo et ajoutez un autre marqueur au niveau de l’image spécifique dans lequel la lumière LED disparaît complètement à chaque déclencheur.
- Procédez comme suit pour les trois vidéos. Une fois terminé, notez les numéros d’image des marqueurs de toutes les vidéos dans une feuille de calcul.
- Ouvrez les fichiers des marqueurs EEG de la carte SD de l’amplificateur pour le nourrisson et l’adulte. Notez les informations de l’échantillon de marqueur dans une feuille de calcul.
- Étant donné que la vidéo est enregistrée en images par seconde (FPS, par exemple, 25 FPS) et que l’EEG-ECG est enregistré en échantillons par seconde (par exemple, 500 Hz), convertissez les numéros d’images et d’échantillons en une unité de mesure courante, telle que les millisecondes (ms), pour pouvoir créer une chronologie unique.
- Pour chaque capteur (vidéos et enregistrements physiologiques), calculez les temps entre les déclenchements, appelés ici intervalles entre les déclencheurs (ITI), en soustrayant l’horodatage ms pour chaque paire de marqueurs consécutifs.
REMARQUE : Bien que les heures de démarrage des capteurs d’enregistrement soient différentes, les ITI en ms pour le même ensemble de déclencheurs sur les différents capteurs (vidéos et EEG) doivent toujours correspondre. Par conséquent, pour valider cela, calculez la différence dans chaque ITI (ITI Lag) entre chaque capteur et l’EEG maître. - Vérifiez la qualité des décalages vidéo-EEG ITI. Étant donné que le taux d’échantillonnage/FPS est différent entre les deux capteurs, l’EEG a généralement un taux d’échantillonnage beaucoup plus élevé que les vidéos, ce qui permet une erreur avec une tolérance ± 1 image vidéo (ici, 40 ms) pour les décalages EEG-vidéo ITI calculés.
- Vérifiez la qualité de l’EEG adulte - EEG nourrisson ITI Lags. Comme ils ont la même fréquence d’échantillonnage, permettez une tolérance d’erreur de ± 1 échantillon EEG (ici, 2 ms).
- Une fois ces vérifications terminées, calculez les décalages entre chaque capteur et la chronologie du capteur maître (dans ce cas, l’EEG du nourrisson).
- Soustrayez l’horodatage ms de chaque marqueur de déclenchement de l’EEG maître des marqueurs respectifs de chaque capteur (vidéos, EEG adultes). Cela produit N décalages (N = nombre de déclencheurs) pour chaque capteur.
- Pour chaque capteur, calculez la moyenne de ces décalages et arrondissez-les pour obtenir le nombre final de décalage par rapport à l’EEG maître. Utilisez ces numéros de décalage pour couper la vidéo et les données EEG afin qu’elles démarrent en même temps que l’EEG maître.
- Codage vidéo simple
- Pour identifier les différentes étapes de l’expérience dans les vidéos (par exemple, le début et la fin des tâches expérimentales ou les interruptions), notez les horodatages spécifiques dans les images à l’aide d’un logiciel de montage vidéo.
- Prétraitement EEG
- Coupez les fichiers EEG des adultes et des nourrissons au début et à la fin de la tâche.
- Identifiez et supprimez les canaux défectueux
- Notez tous les canaux qui semblent continuellement bruyants ou qui ne contiennent aucun signal tout au long de l’intégralité ou de la majorité de l’enregistrement de la tâche.
REMARQUE : Pour les enregistrements à faible densité, l’objectif est de conserver autant de canaux que possible. Ainsi, pour les canaux qui ne sont défectueux que pendant de courtes périodes, il est préférable de supprimer le segment de données corrompu à un stade ultérieur de l’analyse plutôt que le canal lui-même. - Tracez et inspectez visuellement la densité spectrale de puissance (PSD) pour identifier les canaux périphériques.
- Notez tous les canaux qui semblent continuellement bruyants ou qui ne contiennent aucun signal tout au long de l’intégralité ou de la majorité de l’enregistrement de la tâche.
- Pour supprimer les tendances linéaires lentes (plus de 2 s), filtrez les données à l’aide d’un filtre passe-haut FIR de base avec une fréquence de coupure de 0,5 Hz.
- Pour éliminer le bruit à haute fréquence des sources myogéniques et externes, filtrez les données à l’aide d’un filtre passe-bas FIR de base avec une fréquence de coupure de 35 Hz.
- Segmentez les données en époques consécutives et non superposées.
- Rejetez automatiquement tous les segments dont la valeur minimale est inférieure à -100 μV (pour les adultes) et -150 (pour les nourrissons) et/ou la valeur maximale supérieure à +100 μV (pour les adultes) et +150 (pour les nourrissons).
- Inspectez visuellement tous les segments qui n’ont pas été exclus dans la section 11.3.6. Rejeter manuellement tous les segments contenant des artefacts. Si un seul segment 1s est acceptable situé entre les segments rejetés, supprimez la période entière afin qu’aucun segment 1s ne soit conservé.
- Pour l’analyse INS / dyadique, analysez uniquement les segments acceptés qui sont communs aux adultes et aux nourrissons. En supprimant tous les segments de l’adulte qui sont rejetés chez le nourrisson et vice versa, assurez-vous que les séries chronologiques EEG de l’adulte et du nourrisson restent parfaitement alignées.
Résultats
Les participants inclus dans cette étude étaient des nourrissons âgés de 8 à 12 mois, généralement en développement, et leur mère et/ou grand-mère qui parlaient l’anglais ou l’anglais et une deuxième langue à la maison. Les EEG à 7 électrodes et un ECG à dérivation unique d’adultes et de nourrissons, ainsi que des enregistrements vidéo et audio de trois caméras et microphones, ont été acquis simultanément au cours des tâches. Les activités neuronales ont été mesurées sur F3, F4, C3, Cz, C4, P3 et P4 selon le système international 10-20. Les différents flux de données ont été alignés temporellement et coupés au début et à la fin de l’expérience, de sorte que tous les enregistrements ont commencé au point temporel t = 0 (figure 4).

Figure 4 : Synchronisation des flux de données. Trois caméras (vue du nourrisson, vue combinée et vue du soignant), l’ECG brut du soignant et du nourrisson, ainsi que l’EEG brut du soignant et du nourrisson, sont synchronisés sur la même chronologie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le tableau 1 présente les taux de rétention des données EEG et les mesures de qualité pour les 5 premières dyades de l’ensemble de données avec un total de 10 participants. Après le rejet d’un canal incorrect (Figure 5), les segments de données contenant des artefacts ont été rejetés à l’aide d’un seuil de tension automatisé suivi d’une inspection visuelle des segments restants (Figure 6). Les résultats ont montré que les enregistrements EEG avaient une durée moyenne de M = 562,96 s (ET ± 148,94 s). Parmi celles-ci, M = 34,30 % (écart-± 13,00 %) des données sur les adultes et M = 46,32 % (écart-± 16,63 %) des données sur les nourrissons ont été acceptés à la suite d’un rejet automatique et manuel. Si l’on ne considère que les données appariées entre l’adulte et le nourrisson, le taux de rétention est tombé à M = 20,58 % (écart-type ± 9,51 %), laissant M = 215,00 s (écart-± 117,54 s) de données sur les tâches appariées. De plus, un total de 0 à 2 canaux par dyade ont été exclus en raison de la mauvaise qualité des données.
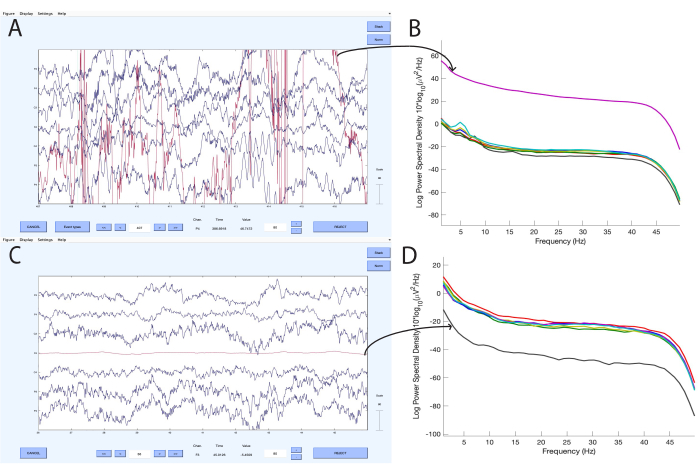
Figure 5 : Identification des canaux défectueux. Diagramme de défilement de données EEG et de densité spectrale de puissance (PSD) pour 7 canaux EEG dans lequel on observe que le canal Cz est plat (A : défilement de données, B : tracé PSD) ou que le canal F3 est excessivement bruyant (C : défilement de données, D : tracé PSD). La détection des canaux défectueux a été effectuée dans EEGLAB17. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Rejet d’un artefact. Les époques avec des artefacts étaient rejetées automatiquement selon un seuil de rejet (A), (B) suivi d’un rejet manuel par inspection visuelle. La partie en surbrillance du graphique montre les segments rejetés en fonction du seuil de rejet (A) ou du rejet manuel (B), respectivement. Les données ont été visualisées dans EEGLAB17. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Adulte | Enfant | Correspondait | |||||
| ID | Durée d’enregistrement (s) | Mauvaises chaînes | % d’époques acceptées | Mauvaises chaînes | % d’époques acceptées | Mauvaises chaînes | % d’époques acceptées (appariées) |
| 1 | 898 | NA | 35.7 | Cz | 25.2 | Cz | 15.3 |
| 2 | 1234 | NA | 38.2 | Cz, F3 | 61.8 | Cz, F3 | 21.2 |
| 3 | 1088 | F3, F4 | 52.4 | F3, F4 | 63.1 | F3, F4 | 36.7 |
| 4 | 873 | NA | 27.9 | P3 | 34.6 | P3 | 12.8 |
| 5 | 975 | NA | 17.2 | NA | 47.0 | NA | 16.9 |
Tableau 1. Rapport de qualité des données EEG pour 5 dyades pendant les tâches expérimentales.
Discussion
Dans ce protocole, nous effectuons des mesures dans les maisons des participants où les nourrissons et les soignants peuvent se sentir plus à l’aise et leurs comportements peuvent être plus représentatifs de leurs interactions dans la vie réelle par opposition à un laboratoire, augmentant ainsi la validité écologique7. De plus, les enregistrements dans l’environnement familial peuvent alléger le fardeau des participants, par exemple en ce qui concerne les temps de déplacement, et peuvent ainsi rendre certains groupes de participants plus accessibles. Cependant, parallèlement à ces avantages, les enregistrements d’hyperbalayage EEG naturalistes dans des contextes réels posent leur propre ensemble de défis et de limites en ce qui concerne la conception expérimentale et le protocole, ainsi que les artefacts de données. Nous aborderons ci-dessous les défis et les solutions possibles pour les enregistrements à domicile.
L’environnement naturaliste peut introduire un ensemble de variables confondantes telles que l’espace, la température et les interruptions, qui peuvent différer entre les groupes de participants à la maison, mais rester constantes dans un laboratoire contrôlé. Le protocole d’hyperbalayage EEG nécessite beaucoup d’équipement technique, par exemple plusieurs caméras, microphones et ordinateurs portables d’enregistrement, et par conséquent, le manque d’espace suffisant dans les maisons des participants peut parfois être un problème. Les chercheurs doivent être conscients de ne pas installer l’équipement au hasard ou dans un endroit encombré. Par exemple, il est important de veiller à ne pas installer d’appareils sur des tables avec de la nourriture ou des boissons et de s’assurer que les trépieds de l’appareil photo ne bloquent pas le passage dans les espaces étroits. Une façon d’éviter les problèmes d’espace serait de visiter la maison du participant à l’avance afin de planifier correctement à l’avance toute contrainte d’espace. Il est également utile d’envoyer des rappels aux participants pour qu’ils vident l’espace requis des articles. Les appareils photo et les trépieds doivent être placés à l’écart autant que possible, surtout lorsqu’ils sont hors de portée de l’endroit où le bébé est assis pendant la séance. Avant tout, la sécurité de toutes les parties doit être prise en compte à toutes les étapes de la configuration. Un autre facteur que les chercheurs peuvent rencontrer dans les milieux naturalistes est la variation des températures. À Singapour, où les températures sont élevées tout au long de la journée et de l’année, des artefacts de sueur peuvent apparaître dans les données EEG, qui peuvent être mieux contrôlés dans un environnement de laboratoire avec une climatisation appropriée. L’utilisation de ventilateurs pour garder les participants au frais introduit également d’autres artefacts en raison de la proximité d’appareils électriques, et l’air soufflé peut déplacer les cheveux des participants, ainsi que les fils EEG, ce qui entraîne une mauvaise qualité des données. Idéalement, la climatisation devrait être utilisée pendant la session car elle gardera les participants au frais. Néanmoins, si cela n’est pas possible, un ventilateur suspendu ou un ventilateur sur pied peut être utilisé à la place tout en s’assurant qu’il n’est pas placé trop près des participants pour éviter de créer du bruit dans les données EEG. D’autres alternatives seraient de programmer la séance à un moment plus frais de la journée si possible afin d’éviter les artefacts de transpiration. Enfin, les chercheurs doivent également se méfier du fait que des interruptions peuvent se produire dans un cadre naturaliste, surtout s’ils mènent la séance au domicile des participants. Des membres de la famille peuvent se trouver à proximité, ce qui peut entraîner une violation de la vie privée lors du tournage de la séance dans une salle commune où ils peuvent se promener. Cela peut également être une distraction pour le nourrisson de voir d’autres soignants ou membres de la famille pendant la tâche, ce qui peut biaiser les mesures EEG. Il serait préférable de rappeler aux participants que pour que la session se déroule sans heurts, il serait idéal d’avoir d’autres membres de la famille dans une autre pièce. Les chercheurs peuvent également essayer de mener la séance le plus efficacement possible afin de ne pas trop gêner les autres membres du ménage. Enfin, les chercheurs doivent s’assurer que toutes les données sont recueillies et que les éléments nécessaires sont complétés avant de quitter le domicile du participant. Avoir une liste de contrôle claire et organisée des documents et des éléments à remplir peut aider à éviter de manquer des étapes importantes et à les terminer efficacement et en temps opportun.
Outre les variables confondantes trouvées dans un environnement naturaliste, certains aspects du protocole devront également être ajustés pour chaque séance dans un cadre naturel qui sont autrement contrôlés dans un environnement de laboratoire. La standardisation ne sera pas possible pour certains aspects, tels que les angles de caméra et l’éclairage. Il est essentiel de disposer de données de haute qualité et comparables tout en assurant une flexibilité dans la configuration. Les angles de caméra peuvent changer en fonction de la maison de chaque participant en raison de différences dans la disposition et l’espace, ce qui peut rendre plus difficile l’annotation ultérieure de vidéos pour des événements et des mesures comportementales spécifiques. De même, l’éclairage différera également dans chaque maison, ce qui peut affecter la qualité de la vidéo. Les chercheurs peuvent être bien préparés en créant un ensemble général de normes qui peuvent être adaptées, par exemple en s’assurant que les participants ne sont pas assis contre une source principale de lumière et en sachant quels angles de caméra privilégier. Un autre facteur variable serait le mobilier disponible à utiliser lors de chaque session. Étant donné que les chercheurs ne peuvent probablement pas apporter de meubles au domicile des participants, ils devront compter sur des meubles que les participants possèdent déjà. Pour cette raison, les différents meubles utilisés peuvent modifier la dynamique physique entre la personne qui s’occupe de l’enfant et le nourrisson. Par exemple, différents types de chaises pour bébé changeront la hauteur et la position auxquelles le bébé est assis pendant la tâche. Cela peut affecter la façon dont la personne qui s’occupe de l’enfant interagit avec l’enfant et également affecter les données EEG en raison d’artefacts potentiels de mouvements musculaires ou d’autres facteurs. Au cours de l’étape de prétraitement de l’analyse des données, les chercheurs peuvent être en mesure d’identifier les artefacts EEG causés par des mouvements spécifiques en cherchant des conseils à partir des vidéos synchronisées. De plus, avoir une idée générale des types de comportements qui vont être observés ou analysés peut aider à s’assurer que les données nécessaires sont capturées malgré les variations de la dynamique physique.
Une autre implication de la configuration naturaliste de l’environnement domestique des expériences EEG concerne la qualité et la facilité d’utilisation des données des capteurs physiologiques. Les enregistrements EEG sont sujets à des interférences d’artefacts provenant de sources environnementales (non physiologiques, telles que le bruit de ligne18) et physiologiques (oculaire, sueur, myogénique)19. Bien que l’EEG sans fil soit généralement moins vulnérable au bruit de ligne, les appareils électriques de la maison, par exemple les ventilateurs, les écrans de télévision et la climatisation, introduiront des artefacts de bruit. Les artefacts de mouvement, en revanche, sont encore plus importants dans un cadre naturaliste et contribuent à réduire la rétention des données11,20, la réduction du rapport signal/bruit21 et la vulnérabilité de l’analyse des données dans l’interprétation11. L’EEG dyadique et l’EEG infantile présentent un défi supplémentaire en matière de rétention des données en raison de durées d’enregistrement plus courtes, de présentations d’artefacts moins stéréotypées et, dans le cas de l’hyperbalayage, de la nécessité d’apparier des segments analysables propres dans le temps 14,22,23. L’atténuation de ces facteurs repose sur une conception expérimentale réfléchie et un dispositif expérimental bien calibré22. Bien que les compositions EEG à haute densité permettent certaines techniques de correction d’artefacts et d’augmentation des données, telles que l’analyse en composantes indépendantes (ICA) et la suppression des composantes de bruit canoniques, cela n’est pas recommandé avec des configurations à faible densité. En revanche, le fait de s’appuyer sur l’annotation manuelle des artefacts et la suppression des canaux et segments EEG concernés entraîne une perte de données plus importante. Le protocole proposé peut également être réalisé avec plus de canaux EEG, mais au prix d’un temps de préparation plus long. Ces avantages d’un temps d’acquisition plus court par rapport à des données EEG plus riches doivent être soigneusement mis en balance les uns avec les autres. Ici, une estimation réaliste des taux de rétention des données à partir des enregistrements domestiques naturalistes est rapportée, en respectant des normes de qualité strictes en utilisant une combinaison d’étiquetage automatisé des pics de tension et de rejet manuel des artefacts. Bien que les taux de rétention aient été faibles (M = 34 % pour les adultes et M = 46 % pour les nourrissons), ils se situent dans la plage exceptée pour les enregistrements EEG naturalistes nourrissons-adultes, p. ex., à titre de comparaison, Dikker et coll.12 ont signalé un taux de rétention de 38 % pendant la tâche de discussion dans l’EEG adulte utilisant des électrodes sèches. La quantité de données propres récupérées à partir du paradigme peut être intégrée dans d’autres analyses, telles que les analyses de connectivité basées sur le temps et la fréquence. D’autres pipelines semi-automatisés pour la correction d’artefacts d’enregistrements EEG à faible densité (par exemple, HAPPILEE24), bien qu’ils ne relèvent pas du présent article, pourraient aider à supprimer les artefacts sans utiliser d’ICA et ainsi réduire considérablement la perte de données.
Pour garantir un EEG de haute qualité mais une collecte de données réalisable, les chercheurs devront tenir compte de la façon dont le cadre naturaliste affecte les tâches choisies pour la session expérimentale. Par exemple, le choix des tâches peut être basé sur ce que l’on trouverait couramment dans les maisons des participants, comme une table à manger, des chaises, des chaises pour bébé, un tapis de jeu, etc. Cela permettrait de réduire le nombre d’équipements ou de meubles encombrants à transporter d’un côté à l’autre et de réduire le temps d’installation et de nettoyage. Dans cette expérience, des livres et des jouets adaptés au jeu sur table ont été utilisés, permettant au soignant et à l’enfant de maintenir une dynamique de jeu naturaliste tout en limitant les mouvements libres afin que les artefacts EEG des mouvements musculaires puissent être réduits. Par conséquent, dans le protocole actuel, les jouets ont été choisis en fonction de ce qui refléterait les interactions naturelles. Par exemple, les jouets à aspiration qui peuvent être placés en position stationnaire pour que la personne qui s’occupe de l’enfant puissent s’y engager sur la table ont l’avantage de ne pas tomber de la table, ce qui peut provoquer des artefacts de mouvement lorsque la personne qui s’occupe de la personne essaie de les ramasser. Les chercheurs doivent également se méfier du temps de préparation et de nettoyage pour réduire le fardeau des participants.
Bien que le choix d’effectuer des mesures d’hyperbalayage EEG dans un environnement naturaliste présente de nombreux avantages pour des données plus valides sur le plan écologique, les chercheurs doivent être conscients des limites et des défis qui peuvent découler de la conception expérimentale et mettre en œuvre des mesures suffisantes pour atténuer les effets autant que possible. Les chercheurs doivent s’efforcer de trouver un équilibre entre une conception écologique et un contrôle expérimental lorsqu’ils optimisent leur paradigme et planifient leurs visites. Comme décrit ci-dessus, une certaine souplesse est nécessaire en ce qui concerne le montage expérimental, ce qui introduit toutefois une plus grande variabilité entre les participants. Bien que cela ne soit pas souhaitable d’un point de vue expérimental, cela peut être plus représentatif de l’environnement réel des participants. De plus, la configuration naturaliste peut introduire davantage d’artefacts et d’autres types d’artefacts dans les données EEG, comme indiqué ci-dessus. Celles-ci peuvent, dans une certaine mesure, être atténuées par des techniques appropriées de prétraitement et d’analyse de l’EEG, mais peuvent généralement entraîner une perte plus élevée et une qualité inférieure des données. De plus, le matériel utilisé, en particulier les appareils photo et les trépieds, présente l’inconvénient d’être relativement encombrant et lourd, ce qui le rend difficile à transporter et moins adapté aux espaces confinés. Enfin, le système d’électrodes humides nécessite du matériel expérimental supplémentaire (par exemple, du gel, des seringues, des gants, des lingettes) et des temps de préparation plus longs. Les expérimentateurs doivent faire très attention à ne pas laisser de désordre dans les maisons des participants, par exemple en mettant du gel sur certaines parties des meubles, et expliquer à l’avance qu’il y a un risque que le nourrisson puisse le faire. Les électrodes sèches peuvent être une bonne alternative pour contourner ces problèmes et gagner du temps de configuration. Ainsi, pour les enregistrements d’hyperbalayage dans des groupes plus importants (par exemple, dans des salles de classe), ces méthodes peuvent être choisies (par exemple, voir 12). Par conséquent, en affinant et en adaptant ce protocole aux circonstances actuelles, il a le potentiel d’être appliqué dans de nombreux types de contextes naturalistes, tels que les écoles et les lieux de travail, pour capturer une plus grande variété de données d’hyperbalayage et de données comportementales.
Déclarations de divulgation
Aucun conflit d’intérêts ne doit être déclaré.
Remerciements
Le travail a été financé par une bourse postdoctorale présidentielle de l’Université technologique de Nanyang qui a été attribuée à VR.
matériels
| Name | Company | Catalog Number | Comments |
| 10 cc Luer Lock Tip syringe without Needle | Terumo Corporation | ||
| actiCAP slim 8-channel electrode set (LiveAMP8) | Brain Products GmbH | ||
| Arduino Software (IDE) | Arduino | Arduino IDE 1.8.19 | The software used to write the code for the Arduino microcontroller. Alternate programming software may be used to accompany the chosen microcontroller unit. |
| Arduino Uno board | Arduino | Used for building the circuit of the trigger box. Alternate microcontroller boards may be used. | |
| BNC connectors | BNC connectors to connect the various parts of the trigger box setup. | ||
| BNC Push button | Brain Products GmbH | BP-345-9000 | BNC trigger push button to send triggers. |
| BNC to 2.5 mm jack trigger cable (80 cm) | Brain Products GmbH | BP-245-1200 | BNC cables connecting the 2 LiveAmps to the trigger box. |
| BrainVision Analyzer Version 2.2.0.7383 | Brain Products GmbH | EEG analysis software. | |
| BrainVision Recorder License with dongle | Brain Products GmbH | S-BP-170-3000 | |
| BrainVision Recorder Version 1.23.0003 | Brain Products GmbH | EEG recording software. | |
| Custom 8Ch LiveAmp Cap passive (infant EEG caps) | Brain Products GmbH | LC-X6-SAHS-44, LC-X6-SAHS-46, LC-X6-SAHS-48 | For infant head sizes 44, 46, 48 . Alternate EEG caps may be used. |
| Dell Latitude 3520 Laptops | Dell | Two laptops, one for adult EEG recording and one for infant EEG recording. Alternate computers may be used. | |
| Dental Irrigation Syringes | |||
| LiveAmp 8-CH wireless amplifier | BrainProducts GmbH | BP-200-3020 | Two LiveAmps, one for adult EEG and one for infant EEG. Alternate amplifier may be used. |
| Manfrotto MT190X3 Tripod with 128RC Micro Fluid Video Head | Manfrotto | MT190X3 | Alternate tripods may be used. |
| Matlab Software | The MathWorks, Inc. | R2023a | Alternate analysis and presentation software may be used. |
| Power bank (10000 mAh) | Philips | DLP6715NB/69 | Alternate power banks may be used. |
| Raw EEG caps | EASYCAP GmbH | For Adult head sizes 52, 54, 56, 58. Alternate EEG caps may be used. | |
| Rode Wireless Go II Single Set | Røde Microphones | Alternate microphones may be used. | |
| Sony FDR-AX700 Camcorder | Sony | FDR-AX700 | Alternate camcorders or webcams may be used. |
| SuperVisc High-Viscosity Gel | EASYCAP GmbH | NS-7907 |
Références
- Hari, R., Henriksson, L., Malinen, S., Parkkonen, L. Centrality of social interaction in human brain function. Neuron. 88 (1), 181-193 (2015).
- Endevelt-Shapira, Y., Djalovski, A., Dumas, G., Feldman, R. Maternal chemosignals enhance infant-adult brain-to-brain synchrony. Sci Adv. 7 (50), (2021).
- Santamaria, L., et al. Emotional valence modulates the topology of the parent-infant inter-brain network. NeuroImage. 207, 116341 (2020).
- Nguyen, T., et al. The effects of interaction quality on neural synchrony during mother-child problem solving. Cortex. 124, 235-249 (2020).
- Reindl, V., Gerloff, C., Scharke, W., Konrad, K. Brain-to-brain synchrony in parent-child dyads and the relationship with emotion regulation revealed by fNIRS-based hyperscanning. NeuroImage. 178, 493-502 (2018).
- Reindl, V., et al. Conducting hyperscanning experiments with functional near-infrared spectroscopy. J Vis Exp. (143), e58807 (2019).
- Gardner, F. Methodological issues in the direct observation of parent-child interaction: Do observational findings reflect the natural behavior of participants. Clin Child Fam Psychol Rev. 3, 185-198 (2000).
- Xu, J., Zhong, B. Review on portable EEG technology in educational research. Comput Hum Behav. 81, 340-349 (2018).
- Troller-Renfree, S. V., et al. Feasibility of assessing brain activity using mobile, in-home collection of electroencephalography: methods and analysis. Dev Psychobiol. 63 (6), e22128 (2021).
- Bögels, S., Levinson, S. C. The brain behind the response: Insights into turn-taking in conversation from neuroimaging. Res Lang Soc. 50 (1), 71-89 (2017).
- Georgieva, S., et al. Toward the understanding of topographical and spectral signatures of infant movement artifacts in naturalistic EEG. Front Neurosci. 14, 452947 (2020).
- Dikker, S., et al. Brain-to-brain synchrony tracks real-world dynamic group interactions in the classroom. Curr Biol. 27 (9), 1375-1380 (2017).
- Oliveira, A. S., Bryan, R. S., Hairston, W. D., Peter, K., Daniel, P. F. Proposing metrics for benchmarking novel EEG technologies towards real-world measurements. Front Hum Neurosci. 10, 188 (2016).
- Turk, E., Endevelt-Shapira, Y., Feldman, R., vanden Heuvel, M. I., Levy, J. Brains in sync: Practical guideline for parent-infant EEG during natural interaction. Front Psychol. 13, 833112 (2022).
- Kayhan, E., et al. A dual EEG pipeline for developmental hyperscanning studies. Dev Cogn Neurosci. 54, 101104 (2022).
- Ayrolles, A., et al. HyPyP: a Hyperscanning Python pipeline for inter-brain connectivity analysis. Soc Cogn Affect Neurosci. 16 (1-2), 72-83 (2021).
- Delorme, S., Makeig, S. EEGLAB: an open-source toolbox for analysis of single-trial EEG dynamics. J Neurosci Meth. 134, 9-21 (2004).
- Nathan, K., Contreras-Vidal, J. L. Negligible motion artifacts in scalp electroencephalography (EEG) during treadmill walking. Front Hum Neurosci. 9, 708 (2016).
- Stone, D. B., Tamburro, G., Fiedler, P., Haueisen, J., Comani, S. Automatic removal of physiological artifacts in EEG: The optimized fingerprint method for sports science applications. Front Hum Neurosci. 12, 96 (2018).
- Noreika, V., Georgieva, S., Wass, S., Leong, V. 14 challenges and their solutions for conducting social neuroscience and longitudinal EEG research with infants. Infant Behav Dev. 58, 101393 (2020).
- Ng, B., Reh, R. K., Mostafavi, S. A practical guide to applying machine learning to infant EEG data. Dev Cogn Neurosci. 54, 101096 (2022).
- vander Velde, B., Junge, C. Limiting data loss in infant EEG: putting hunches to the test. Dev Cogn Neurosci. 45, 100809 (2020).
- Bell, M. A., Cuevas, K. Using EEG to study cognitive development: Issues and practices. J Cogn Dev. 13 (3), 281-294 (2012).
- Lopez, K. L., et al. HAPPILEE: HAPPE in low electrode electroencephalography, a standardized pre-processing software for lower density recordings. NeuroImage. 260, 119390 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon