Method Article
Évaluation quantitative en temps réel de la réaction en chaîne de la polymérase de l’expression des microARN dans les reins et le sérum de souris atteintes d’insuffisance rénale dépendante de l’âge
Dans cet article
Résumé
Nous présentons une méthode d’évaluation de l’expression des microARN dans les reins et le sérum de souris atteintes d’insuffisance rénale dépendante de l’âge par réaction en chaîne de la polymérase quantitative à transcription inverse.
Résumé
Les microARN (miARN) sont de petits ARN non codants composés de 21 à 25 bases. Ils ne sont pas traduits en protéines mais travaillent plutôt à entraver le fonctionnement de leurs ARN messagers cibles (ARNm) en les déstabilisant et en perturbant leur traduction. Bien que les profils d’expression des miARN dans divers organes et tissus de souris aient été étudiés, il n’existe pas de méthodes standard pour purifier et quantifier les miARN rénaux et sériques de souris. Nous avons établi une méthode efficace et fiable pour extraire et évaluer l’expression des miARN dans le sérum et les reins de souris atteintes d’insuffisance rénale dépendante de l’âge.
La méthode utilise la réaction en chaîne quantitative par transcription inverse et polymérase (qRT-PCR), et le protocole nécessite six étapes: (1) préparation de souris à résistance 1 accélérée par sénescence (SAMR1) et de souris sujettes à la sénescence (SAMP1); (2) extraire des échantillons de sérum de ces souris; 3° extraire un échantillon de rein de chaque souris; (4) extraire l’ARN total (y compris les miARN) des échantillons de rein et de sérum de chaque souris; (5) la synthèse de l’ADN complémentaire (ADNc) avec transcription inverse à partir du miARN ; (6) effectuer une qRT-PCR en utilisant l’ADNc obtenu.
Ce protocole a été utilisé pour confirmer que, par rapport aux témoins, l’expression de miRNA-7218-5p et miRNA-7219-5p était significativement modifiée dans les reins et le sérum d’un modèle murin d’insuffisance rénale dépendante de l’âge. Ce protocole a également clarifié la relation entre le rein et le sérum du modèle murin d’insuffisance rénale liée à l’âge. Ce protocole peut être utilisé pour déterminer l’expression des miARN dans les reins et le sérum de souris atteintes d’insuffisance rénale liée à l’âge.
Introduction
L’expression de divers ARNm qui jouent un rôle important à la fois dans la physiologie et la maladie (par exemple, l’inflammation, la fibrose, les troubles métaboliques et le cancer) est connue pour être régulée par les miARN, qui sont de courts ARN non codants qui causent la dégradation et inhibent la transcription de l’ARNm1. Il est donc possible que certains miARN puissent servir de nouveaux biomarqueurs et/ou cibles thérapeutiques candidats pour diverses maladies 2,3,4,5. Des recherches ont été menées sur les profils d’expression des miARN dans une variété d’organes et de tissus de souris (y compris le cerveau6, le cœur7, le poumon8, le foie9 et le rein10). Cependant, il n’existe pas de méthodes standard ou établies pour extraire et évaluer les miARN dans les reins ou le sérum de souris atteintes d’insuffisance rénale dépendante de l’âge.
Par conséquent, nous avons établi un protocole qui peut être utilisé pour purifier et détecter de manière fiable l’expression des miARN dans le sérum et les reins de souris atteintes d’insuffisance rénale liée à l’âge. Le protocole comporte six étapes principales : (1) préparation des souris mâles SAMR1 âgées de 50 semaines et des souris mâles SAMP1 ; 2) l’extraction d’échantillons de sang de la veine cave inférieure des deux souches de souris, suivie de l’utilisation d’un tube à bec contenant de l’héparine, suivie d’une centrifugation, pour obtenir un échantillon de sérum; (3) l’extraction de l’échantillon de rein de l’homogénéisateur de silicium de souris-A est utilisée pour homogénéiser l’échantillon de rein séparément, et l’échantillon est ensuite transféré dans un système de déchiquetage de biopolymères sur une colonne de spin de microcentrifugeuse11; (4) extraction d’ARN total (contenant des miARN) à partir des échantillons de sérum à l’aide d’une colonnede spin 12 à base de membrane de silice et d’ARN total contenant de l’ARN miARN à partir des échantillons de rein à l’aide d’une colonne de spin11 à base de membrane de silice; (5) synthèse d’ADN complémentaire (ADNc) à partir de l’ARN total à l’aide de la transcriptase inverse, de la poly(A) polymérase et de l’amorce oligo-dT13,14; et (6) enfin, la détermination de l’expression des miARN à l’aide de qRT-PCR et d’un colorant intercalant13,14.
Ce nouveau protocole était basé sur des études qui ont réussi à extraire et à évaluer des miARN dans divers types de tissus11,12,13. Il a été démontré que le système de déchiquetage des biopolymères du protocole était capable de purifier l’ARN total de haute qualité des tissus11. La précision et la sensibilité des aspects de ce protocole utilisés pour l’évaluation de l’expression des miARN par qRT-PCR avec un colorant intercalant ont été établies13,14, par exemple, la synthèse de l’ADNc avec transcriptase inverse, poly(A) polymérase, et oligo-dT amorces à partir de l’ARN total extrait. Le nouveau protocole présente plusieurs avantages : simplicité, gain de temps et réduction des erreurs techniques. Il peut donc être utilisé pour des investigations qui nécessitent une identification précise et sensible des profils de miARN rénaux et sériques. Les études de nombreuses conditions pathologiques peuvent également utiliser le nouveau protocole.
Les profils d’expression des miARN chez les souris SAMP1, qui sont un modèle d’insuffisance rénale dépendante de l’âge, peuvent être déterminés comme indiqué ci-dessous. Chez l’homme, l’insuffisance rénale dépendante de l’âge est associée à la progression de l’insuffisance rénale et se caractérise à la fois par une augmentation de la zone de fibrose interstitielle rénale et par la progression de la glomérulosclérose15,16. L’insuffisance rénale liée à l’âge est également une caractéristique importante et fréquente de l’insuffisance rénale chronique et de l’insuffisance rénale terminale15,16.
Protocole
Le protocole expérimental a été approuvé par le Comité d’éthique animale de l’Université médicale de Jichi et réalisé conformément au Guide de l’Université médicale de Jichi pour les animaux de laboratoire et à ses directives concernant l’utilisation et les soins des animaux de laboratoire. Ce protocole utilise quatre souris mâles SAMR1 âgées de 50 semaines et des souris mâles SAMP1 (40-45 g).
1. Prélèvement d’échantillons de sérum
- Préparez ce qui suit pour chaque souris : des aiguilles de 30 g avec une seringue de 1,0 mL, un tube de centrifugation de spitz de 1,0 ml avec de l’héparine, des tubes de microcentrifugation de 1,5 mL, un anesthésique à l’isoflurane, une feuille de liège, de l’éthanol à 70 %, deux cotons-tiges humidifiés avec une solution saline tamponnée au phosphate (PBS), une boîte de Petri avec du PBS, une pince à épiler et des ciseaux chirurgicaux.
- Anesthésier la souris avec 1,5% d’isoflurane et maintenir à 1,5%. Administrer un analgésique (méloxicam 5 mg/kg) par voie sous-cutanée, puis injecter 1,0 mL d’éthanol à 70 % dans son abdomen et le placer en décubitus dorsal sur la feuille de liège.
- Confirmer la profondeur de l’anesthésie par la disparition du réflexe de retrait de la pédale. Avec la pince à épiler et les ciseaux chirurgicaux, inciser la peau de l’abdomen. Coupez les muscles et la membrane péritonéale de la vessie au bord inférieur gauche des côtes.
- Utilisez la pince à épiler pour soulever la membrane péritonéale et faites une incision latérale dans le bord supérieur de la membrane péritonéale avec les ciseaux chirurgicaux. Continuez l’incision le long du bord inférieur des côtes.
- Identifiez la veine cave inférieure en utilisant les deux cotons-tiges humidifiés au PBS. Insérez l’une des aiguilles de 30 G avec la seringue de 1,0 ml dans la veine cave inférieure, puis tirez la seringue. Retirez lentement l’aiguille de la veine cave inférieure pour éviter l’hémolyse. Transférer le sang dans le tube à bec de 1,0 ml avec de l’héparine, puis mélanger en inversant le tube plusieurs fois.
NOTE: La souris est euthanasiée par luxation cervicale. - Faire tourner le tube à bec à température ambiante (RT), 3 000 × g pendant 10 min.
- Aspirez lentement le surnageant, assurez-vous qu’il ne contient pas de sédiments, puis transférez-le dans un tube microcentrifuge inutilisé de 1,5 mL.
- Conserver le tube à −80 °C avant utilisation.
REMARQUE : Si vous passez immédiatement à l’étape 3, il n’est pas nécessaire de stocker le tube à −80 °C.
2. Prélèvement d’échantillons de reins
- Préparez ce qui suit pour chaque souris : des cryotubes de 2,0 mL, un anesthésique à l’isoflurane, une feuille de liège, de l’éthanol à 70 %, une boîte de Petri avec du PBS, une pince à épiler et des ciseaux chirurgicaux.
- Anesthésier la souris avec 1,5% d’isoflurane et maintenir à 1,5%. Administrer un analgésique (méloxicam 5 mg/kg) par voie sous-cutanée, puis injecter 1,0 mL d’éthanol à 70 % dans son abdomen et le placer en décubitus dorsal sur la feuille de liège.
- Confirmer la profondeur de l’anesthésie par la disparition du réflexe de retrait de la pédale. Utilisez la pince à épiler et les ciseaux chirurgicaux pour faire une incision dans la peau abdominale. Coupez les muscles et la membrane péritonéale de la vessie au bord inférieur gauche des côtes.
- Utilisez la pince à épiler pour soulever la membrane péritonéale et faites une incision latérale dans le bord supérieur de la membrane péritonéale avec les ciseaux chirurgicaux. Continuez l’incision le long du bord inférieur des côtes.
- Identifiez le rein gauche. Reflux avec PBS pour évacuer le sang des vaisseaux jusqu’à ce que le rein prenne une couleur blanc jaunâtre. Extrayez d’abord tout le rein à l’aide de ciseaux chirurgicaux pour sectionner l’artère et la veine rénales gauches. Placez le rein dans une boîte de Petri et lavez-le soigneusement avec du PBS.
NOTE: La souris est euthanasiée par luxation cervicale. - Utilisez la pince à épiler et les ciseaux chirurgicaux pour couper le rein en échantillons de 10 mg (10 mg est une taille d’échantillon appropriée pour l’étape suivante). Placez chaque échantillon de rein dans son propre cryotube de 2,0 mL. Fermez le capuchon du tube.
- Pour un stockage à long terme, transférer chaque cryotube dans de l’azote liquide et le stocker à −80 °C.
3. Extraction totale d’ARN à partir d’un échantillon de sérum
- Préparez d’abord les éléments suivants : un mélangeur vortex, un réactif de lyse à base de phénol/guanidine, 80 % d’éthanol, 100 % d’éthanol, 100 % de chloroforme, des colonnes de spin en biopolymère (dans des tubes de prélèvement de 2,0 mL 11), des colonnes de spin ancrées à membrane (dans des tubes de collecte de 2,0 mL11), un tampon de lavage #1 (c.-à-d. tampon de lavage contenant de la guanidine et de l’éthanol à100 % dans un rapport de 1:2), un tampon de lavage #2 (c.-à-d. un tampon de lavage #2 (c.-à-d. tampon de lavage contenant de la guanidine et de l’éthanol à 100 % dans un rapport de 1:4), eau sans RNase, tubes microcentrifugés de 1,5 mL et tubes microcentrifugeuses de 2,0 mL.
- Tout d’abord, prélevez un échantillon de sérum de 200 μL dans un tube microcentrifuge de 1,5 mL, puis ajoutez 1 000 μL du réactif de lyse à base de phénol / guanidine. Vortex le mélange pendant 5 s.
- Incuber l’échantillon à TA pendant 5 min.
- Ajouter 200 μL de chloroforme à l’échantillon de sérum dans le tube et fermer hermétiquement le bouchon du tube. Retourner le tube 15x pour mélanger le chloroforme et l’échantillon de sérum.
- Chaque échantillon est incubé à TA pendant 3 min. Ensuite, faire tourner l’échantillon à 4 °C pendant 15 min à 12 000 x g.
- Transférer les 300 μL de surnageant dans un nouveau tube microcentrifuge de 1,5 mL sans perturber la pastille. Ajouter 450 μL d’éthanol à 100% et vorter le tube pendant 5 s.
REMARQUE : Dans toutes les étapes suivantes, placez la colonne de spin ancrée dans la membrane pour la séparation de l’ARN et de l’ADN dans un tube de collecte de 2,0 mL pour la centrifuger. - Ensuite, retirez 700 μL de l’échantillon, chargez-le sur une colonne de spin ancrée dans une membrane et fermez le capuchon. Faites tourner la colonne à RT pendant 15 s à 8 000 × g et laissez le surnageant dans la colonne. Jetez les granulés qui restent dans le tube de collecte.
- Ajouter 700 μL de tampon de lavage #1 qui fait partie de la trousse sérum/plasma (voir le tableau des matériaux) à la colonne de spin ancrée à la membrane pour nettoyer soigneusement l’échantillon. Fermez le capuchon de la colonne et faites tourner la colonne à RT pendant 15 s à 8 000 × g, puis laissez le surnageant dans la colonne. Jetez les granulés qui restent dans le tube de collecte.
- Pour éliminer les sels traces, prenez 500 μL de tampon de lavage #2 et chargez-le sur une colonne de spin ancrée dans la membrane. Après avoir fermé le capuchon de la colonne, faites tourner la colonne à RT pendant 15 s à 8 000 × g et laissez le surnageant dans la colonne. Jetez la pastille dans le tube de collecte.
- Pour éliminer les sels traces, prenez 500 μL d’éthanol à 80 % et chargez-les sur une colonne de spin ancrée dans la membrane. Après avoir fermé le capuchon de la colonne, faites tourner la colonne à RT pendant 15 s à 8 000 × g et laissez le surnageant dans la colonne. Jetez la pastille dans le tube de collecte.
- Faire tourner à nouveau la colonne de spin ancrée à membrane à TA pendant 5 min à 15 000 × g.
- Après avoir transféré la colonne de spin ancrée dans la membrane dans un nouveau tube de collecte de 1,5 mL, ajoutez 14 μL d’eau sans RNase à la colonne pour dissoudre l’ARN total. Après avoir fermé le bouchon de la colonne, attendez 5 minutes avec le tube laissé à RT. Faites tourner la colonne à nouveau pendant 1 min à 15 000 × g à TA.
- Conserver les tubes avec des échantillons à −80 °C avant utilisation.
4. Extraction de l’ARN total d’un échantillon de rein
- Préparez d’abord les éléments suivants : un homogénéisateur de silicium, de la glace, un mélangeur vortex, 100 % éthanol, 100 % chloroforme, colonnes de spin en biopolymère (dans des tubes de collecte de 2,0 mL11), colonnes de spin ancrées à membrane (dans des tubes de collecte de 2,0 mL11), réactif de lyse à base de phénol/guanidine, tampon de lavage #1 (le même tampon que l’étape 3.1.), tampon de lavage #2 (le même tampon que l’étape 3.1.), Eau sans RNase, tubes microcentrifugés de 1,5 mL et tubes microcentrifugeuses de 2,0 mL.
- Placez un échantillon de rein de 10 mg dans l’homogénéisateur de silicium et ajoutez 700 μL du réactif de lyse à base de phénol/guanidine.
- Configurez l’homogénéisateur. Appuyez doucement et tournez le pilon de l’homogénéisateur contre l’échantillon de rein pour homogénéiser l’échantillon. Continuer à appuyer et à tordre le pilon jusqu’à ce que l’échantillon de rein soit complètement homogénéisé dans le réactif de lyse à base de phénol/guanidine.
- Pour une homogénéisation plus poussée, prenez le lysat homogénéisé (dans un tube de collecte de 2,0 mL) et transférez-le dans une colonne de spin en biopolymère.
- Centrifuger le lysat homogénéisé à TA pendant 3 min à 14 000 × g , puis transférer la totalité de la pastille précipitée dans un tube microcentrifuge inutilisé de 1,5 mL pour retourner la pastille précipitée
- Mélanger la pastille avec 140 μL de chloroforme dans le tube; Ensuite, fermez fermement le capuchon du tube. Retourner le tube 15x pour mélanger le lysat et le chloroforme.
NOTE: Le chloroforme peut être utilisé en toute sécurité sans capot. - Incuber l’échantillon à TA pendant 2-3 min. Centrifuger l’échantillon à 4 °C pendant 15 min à 12 000 × g.
- Transférer le surnageant (qui est habituellement ~300 μL) dans un nouveau tube microcentrifuge de 1,5 mL, sans perturber le précipité. Ajouter 1,5 fois son volume (qui est habituellement ~450 μL) d’éthanol à 100%. Vortex le mélange pendant 5 s.
REMARQUE : Dans toutes les étapes suivantes, placez la colonne de spin ancrée dans la membrane pour séparer l’ARN et l’ADN dans un tube de collecte de 2,0 mL pour la centrifuger. - Charger 700 μL d’échantillon sur l’une des colonnes de spin ancrées dans la membrane. Fermer le bouchon et centrifuger la colonne à 15 000 × g pendant 15 s. Jetez le lysat précipité restant dans le tube de collecte.
- Ajoutez 700 μL de tampon de lavage #1 à la colonne d’essorage pour bien la laver. Fermer le bouchon et centrifuger la colonne à 15 000 × g pendant 15 s. Jetez le lysat précipité restant dans le tube de collecte.
- Pour éliminer les traces de sel, chargez 500 μL de tampon de lavage #2 sur la colonne de spin ancrée dans la membrane. Après avoir fermé le bouchon de colonne, centrifuger la colonne à 15 000 × g pendant 15 s. Jeter le lysat précipité dans le tube de collecte.
- Répétez l’étape 4.11.
- Centrifuger à nouveau la colonne de spin ancrée à membrane pendant 1 min à 15 000 × g. Jeter le lysat précipité dans le tube de collecte.
- Prenez la colonne de spin ancrée à membrane et transférez-la dans un nouveau tube de collecte de 1,5 mL. Ajouter 30 μL d’eau exempte de RNase dans la colonne pour dissoudre l’ARN total. Après avoir fermé le bouchon de la colonne, attendez 5 min avec le tube à TA, puis centrifugez la colonne pendant 1 min à 15 000 × g.
- Transférer le volume total de l’échantillon contenant l’ARN total dans un nouveau tube microcentrifuge. Placez le tube sur de la glace et mesurez la concentration totale d’ARN par spectrophotométrie. Assurez-vous que la concentration totale d’ARN est ~300-1,500 ng / μL.
- Conserver les tubes contenant des échantillons à −80 °C avant utilisation.
5. Synthèse de l’ADNc avec transcription inverse de l’ARN total dans le sérum
NOTE: Les informations minimales pour la publication des lignes directrices des expériences quantitatives de PCR en temps réel (MIQE) recommandent d’utiliser de meilleures pratiques expérimentales pour obtenir des résultats fiables et sans équivoque17. Dans ce protocole, l’ADNc est synthétisé à partir de l’ARN total purifié dans une procédure en deux étapes utilisant la transcriptase inverse, la poly(A) polymérase et les amorces oligo-dT.
- Préparez d’abord ce qui suit : un mélangeur vortex, un cycleur thermique, des tubes à bandes à huit puits, le bouchon de chaque tube à huit bandes, de l’eau distillée, de la glace, la trousse de transcriptase inverse (voir le tableau des matériaux)13,14 à l’état fondu et des tubes microcentrifuges de 1,5 mL.
- Démarrez le cycleur thermique.
- Préparer la solution de mélange principal; pour obtenir un total de 8,0 μL de mélange maître par tube à bande de huit puits, ajouter 2,0 μL de mélange de transcriptase inverse (inclus dans la trousse) et 2,0 μL de mélange d’acides nucléiques 10x à 4,0 μL de tampon de transcription inverse dans un tube microcentrifuge de 1,5 mL.
- Placer 8,0 μL de la solution de mélange maître dans chaque tube d’un tube à bande à huit puits.
- Placez une partie aliquote de 12 μL d’ARN total dans chaque tube du tube à bande de huit puits et fermez le bouchon du tube. Centrifuger le tube pendant 15 s à TA et 2 000 × g.
- Placer le tube dans le thermocycleur et incuber pendant 60 min à 37 °C. Incuber l’échantillon pendant 5 minutes supplémentaires à 95 °C min pour synthétiser l’ADNc.
- Après l’incubation, transférer l’ADNc dans un nouveau tube microcentrifuge de 1,5 mL. Diluer l’ADNc dix fois (1:10) avec de l’eau distillée. Vortex et centrifuger le tube pendant 5 s à TA et 2 000 × g.
- Conservez temporairement l’ADNc dilué sur de la glace. Conserver les échantillons dilués à −80 °C avant utilisation.
6. Synthèse de l’ADNc avec transcription inverse de l’ARN total dans le rein
NOTE: Les lignes directrices MIQE encouragent de meilleures pratiques expérimentales pour assurer des résultats fiables et sans équivoque17. Ce protocole utilise la transcriptase inverse, la poly(A) polymérase et les amorces oligo dT pour synthétiser l’ADNc à partir de 1,0 μg d’ARN total purifié dans une procédure en deux étapes.
- Tout d’abord, préparez ce qui suit : un mélangeur vortex, un cycleur thermique, des tubes microcentrifugeuses de 1,5 mL, des tubes à bande à huit puits, le bouchon de chaque tube à huit bandes, de l’eau distillée, de la glace et une trousse de transcriptase inverse (voir le tableau des matériaux)13,14 à l’état fondu.
- Démarrez le cycleur thermique.
- Préparer la solution de mélange principal; pour obtenir un total de 8,0 μL de solution de mélange maître par tube, ajouter 2,0 μL du mélange de transcriptase inverse inclus dans la trousse et 2,0 μL de mélange d’acides nucléiques 10x à 4,0 μL du tampon de transcription inverse.
- Ajouter 8,0 μL de la solution de mélange maître à chaque tube d’un tube à bande à huit puits.
- Ajustez la densité totale de l’ARN comme suit. Pour la séparation de 1,0 μg d’ARN total d’un échantillon de rein avec 12 μL d’eau exempte de RNase, prélever une quantité appropriée d’ARN total et la transférer dans de l’eau distillée en utilisant la concentration mesurée comme décrit ci-dessus (à l’étape 4.15.).
REMARQUE: En présence de contamination de l’ADN, l’ADN contaminé est co-amplifié par qRT-PCR. - Effectuez le même processus que celui décrit ci-dessus aux étapes 5.5.-5.8.
7. La qRT-PCR du miARN
NOTE: Une méthode d’intercalateur est utilisée pour la qRT-PCR des miARN. Les amorces sont utilisées pour l’ARN : U6 petit nucléaire 2 (RNU6-2), miRNA-223-3p, miRNA-423-5p, miRNA-7218-5p et miRNA-7219-5p.
- Préparez ce qui suit : un mélangeur vortex, un système de PCR en temps réel, une plaque de réaction à 96 puits pour la qRT-PCR, un film adhésif pour la plaque de réaction à 96 puits, un applicateur de film adhésif, un rotor de centrifugeuse à 96 puits, des amorces spécifiques aux miARN, une trousse de PCR à base de colorant vert contenant 2x mélange maître de PCR et 10x amorce universelle (voir le tableau des matériaux)13,14, et un tube microcentrifuge de 1,5 mL.
- Vortex après les avoir mélangés dans un tube microcentrifuge de 1,5 mL : 6,25 μL d’eau distillée, 1,25 μL chacun d’un apprêt miARN de 5 μM dissous dans de l’eau exempte de nucléase, 12,5 μL de 2x mélange maître PCR et 2,5 μL d’apprêt universel 10x.
- Préparer et faire fondre l’ADNc synthétisé comme décrit à l’étape 5 (sérum) ou à l’étape 6 (rein). Vortex et centrifuger l’ADNc pendant 5 s.
- Prélever 22,5 μL d’aliquotes du réactif (tel que décrit à l’étape 7.2. ci-dessus) et les placer séparément dans chaque puits de la plaque de 96 puits.
- Ajouter une partie aliquote de 2,5 μL d’ADNc à chaque puits de la plaque.
- Pour fixer le film adhésif à la plaque, utilisez l’applicateur de film adhésif. Centrifuger la plaque pendant 30 s à 1 000 x g dans le rotor de la centrifugeuse à 96 puits. Stabiliser la réaction au fond de chaque puits.
8. Utilisation du système et du logiciel PCR en temps réel pour exécuter le programme de cyclisme PCR
- Commencez le système de PCR en temps réel. Placez la plaque créée comme décrit à l’étape 7.6. dans le système de PCR en temps réel. Modifier les paramètres; donnez un nom à l’expérience, puis sélectionnez 96 puits (0,2 mL ) comme type d’expérience du système, CT comparatif (ΔΔCT) comme méthode de quantification, standard comme mode d’exécution du système et SYBR Green Reagents comme réactifs pour détecter la séquence cible.
- Donnez le nom de l’échantillon et des miARN cibles, et nommez l’échantillon et le miARN cible dans chaque puits. Attribuer des échantillons en double pour obtenir des données appropriées pour confirmer les résultats, et choisir un échantillon de référence et le témoin endogène. Pour que le colorant soit utilisé comme référence passive, sélectionnez aucun. Pour éliminer la contamination croisée des réactifs, configurez une transcriptase inverse négative et un contrôle sans modèle pour l’expression des miARN.
- Ensuite, assurez-vous que le volume de réaction est réglé à 20 μL et que les conditions de cycle PCR sont réglées comme suit : 95 °C pendant 15 min, puis 40 cycles de dénaturation à 94 °C pendant 15 s, recuit à 55 °C pendant 30 s, et enfin extension à 70 °C pendant 30 s.
- Cliquez sur analyser dans le logiciel du système pour analyser les données qRT-PCR une fois le processus terminé. Confirmez que la ligne de seuil automatiquement sélectionnée par le programme est appropriée pour chaque puits.
- Vérifier la valeur du cycle seuil (CT) du contrôle endogène et des miARN cibles analysés dans chaque échantillon. Déterminer les valeurs CT par l’intersection de la courbe d’amplification et de la ligne de seuil.
REMARQUE : Dans la présente étude, RNU6-2 et miRNA-423-5p ont été utilisés comme témoins endogènes pour les niveaux d’expression des miARN cibles, et la méthode ΔΔCT a été utilisée pour déterminer les niveaux d’expression relatifs de chaque miARNcible 18.
Résultats
Pour le modèle murin d’insuffisance rénale liée à l’âge, nous avons utilisé des souris mâles SAMP1 âgées de 50 semaines pesant entre 40 et 45 g. Environ 0,8 mL de sang a été recueilli par souris et transféré dans un tube à bec de 1,0 ml contenant de l’héparine, inversé et centrifugé. Chaque rein a été rincé avec du PBS, disséqué et stocké dans de l’azote liquide pour une analyse plus approfondie. Des souris SAMR1 âgées de cinquante semaines ont servi de témoins. Sur la base des données miARN qRT-PCR obtenues à l’aide de ce modèle d’insuffisance rénale dépendante de l’âge, nous avons observé que le taux rénal de miRNA-7219-5p était significativement augmenté et que le taux rénal de miRNA-7218-5p était considérablement diminué chez les souris SAMP1 par rapport aux témoins (Figure 1). Les taux sériques de miRNA-7219-5p et miRNA-7218-5p ont été considérablement augmentés chez les souris SAMP1 par rapport aux témoins (Figure 2). Les niveaux d’expression de miRNA-223-3p n’ont pas changé dans les deux souches et entre les reins et le sérum (Figure 1 et Figure 2).

Figure 1 : MicroARN exprimés différentiellement dans les reins de souris SAMP1. Analyse qRT-PCR de l’expression de miRNA-223-3p, miRNA-7218-5p et miRNA-7219-5p chez des souris SAMR1 (témoin, n = 4) et SAMP1 (n = 4). Les données sont des moyennes ± des erreurs-types (barres d’erreur); Les tests T ont été utilisés pour analyser les différences entre les groupes; p < 0,05 a été jugé significatif (*p < 0,05), n.-é. : non significatif. Abréviations : miARN = microARN ; SAMP1 = souris sujette à la sénescence accélérée; SAMR1 = résistance de souris accélérée par sénescence 1; qRT-PCR = réaction en chaîne quantitative de transcription inverse-polymérase. Veuillez cliquer ici pour voir une version agrandie de cette figure.
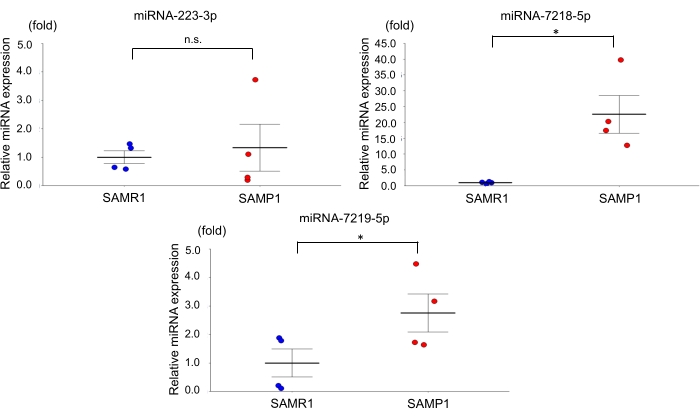
Figure 2 : MiARN exprimés différentiellement dans le sérum de souris SAMP1. Analyse qRT-PCR de l’expression de miRNA-223-3p, miRNA-7218-5p et miRNA-7219-5p chez les souris SAMR1 (témoin, n = 4) et SAMP1 (n = 4). Les données sont moyennes ± SE (barres d’erreur); Les tests T ont été utilisés pour étudier les différences significatives entre les groupes. *p < 0,05 par test t. Abréviations : miARN = microARN ; SAMP1 = souris sujette à la sénescence accélérée; SAMR1 = résistance de souris accélérée par sénescence 1; qRT-PCR = transcription inverse-réaction en chaîne par polymérase quantitative Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les niveaux d’expression des miARN cibles ont été déterminés avec succès par le protocole décrit ci-dessus en utilisant la qRT-PCR. L’évaluation des miARN extraits est une étape importante dans l’obtention de données qRT-PCR significatives. Pour confirmer la qualité adéquate des miARN avant d’effectuer la qRT-PCR, la spectrophotométrie doit être utilisée pour déterminer le rapport d’absorbance à 260 nm à celui à 280 nm. Une contamination de l’ADN peut se produire et/ou des dimères d’amorce dans chaque puits de la plaque de réaction peuvent être présents si la qRT-PCR ne fournit pas une seule amplification PCR de la longueur et de la température de fusion prévues, ou si elle fournit une courbe de fusion monomodale.
Les niveaux d’expression des miARN peuvent être évalués par plusieurs méthodes autres que la qRT-PCR, y compris le transfert de Northern, un microréseau et des tests de protection contre les ribonucléases. Cependant, la méthode qRT-PCR est une procédure sensible, précise, simple et reproductible qui nécessite un volume d’échantillon inférieur à ceux requis pour les tests de Northern blot et de protection contre la ribonucléase19. Étant donné que les puces à ADN peuvent mesurer l’expression de dizaines de milliers de miARN simultanément, elles peuvent être utilisées pour identifier les marqueurs de miARN candidats. Les données des puces à ADN montrent également une forte corrélation globale avec les données obtenues par qRT-PCR20. Cependant, aucun consensus n’a été atteint quant à la méthodologie optimale pour comparer les données de microréseaux obtenues dans différentes études21.
L’évaluation des miARN sériques présente les caractéristiques suivantes. Tout d’abord, il est facile de recueillir du sérum, et comme les miARN sériques sont stables contre le gel et la décongélation, la température et l’acide, les miARN peuvent être de bons biomarqueurs. Deuxièmement, il existe une forte homologie des miARN entre les espèces, et les résultats des expériences sur les animaux sont facilement extrapolés aux humains. Troisièmement, les miARN sériques ont montré un potentiel d’utilisation en tant que médicaments thérapeutiques3. Plusieurs études ont également démontré que le niveau d’expression des miARN dans les organes est corrélé avec le miARN dans le sérum22,23,24. Dans la présente étude, miRNA-223-3p, dont les taux rénaux n’ont pas montré de différence significative entre les souris SAMR1 et SAMP1, n’a pas non plus montré de différence significative entre les souches dans le sérum. En revanche, miRNA-7218-5p et miRNA-7219-5p, dont les niveaux rénaux ont montré une différence significative entre les souris SAMR1 et SAMP1, ont montré des différences considérables entre les souches dans le sérum.
Ce protocole présente les limitations suivantes. Premièrement, son utilité n’a pas été vérifiée dans d’autres organes tels que le foie et les poumons, et deuxièmement, il n’a pas été testé sur d’autres animaux de laboratoire tels que les rats, les chiens et les porcs. Plusieurs groupes de recherche ont utilisé ce protocole pour la purification et la détection des miARN par qRT-PCR et ont rapporté que ce protocole permettait la purification d’ARN de haute qualité à partir de tissus et de sérum 13,14,22,23,24. Il a été démontré que cette méthode a une précision et une sensibilité élevées pour détecter l’expression des miARN 13,14,22,23,24. Les résultats de la présente étude démontrent que ce protocole peut détecter avec succès l’expression de miARN dans le sérum et les reins de souris. Par conséquent, le protocole peut être utilisé pour déterminer les profils d’expression des miARN sériques et rénaux chez les souris présentant diverses pathologies. En raison de la simplicité du protocole, un grand nombre d’échantillons peuvent être traités simultanément. Les analyses de l’expression de nombreux miARN dans diverses conditions pathologiques du rein peuvent donc utiliser le protocole décrit ici.
Il y a certains aspects du protocole à garder à l’esprit. Pour éviter la dégradation des miARN purifiés qui se produirait à température ambiante, les miARN doivent être conservés sur de la glace. Les échantillons de rein doivent être homogénéisés jusqu’à ce qu’ils soient complètement dissous dans le réactif de lyse. Le rein de souris contient une quantité substantielle de tissu conjonctif qui est insoluble dans le réactif de lyse, et donc un broyeur de colonne est nécessaire pour une homogénéisation plus poussée. De plus, le miARN témoin endogène approprié (avec une expression stable parmi les échantillons) doit être validé tout au long de la mise en place d’une expérience qRT-PCR. En effet, l’interférence de diverses substances pendant l’exécution de ce protocole peut modifier les niveaux d’expression des miARN de contrôle endogènes, ce qui peut compromettre les résultats. En conclusion, cet article décrit un protocole qRT-PCR pour la détection, la purification et l’évaluation de l’expression des miARN dans le sérum et les reins de souris atteintes d’insuffisance rénale dépendante de l’âge.
Déclarations de divulgation
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| 1.0 mL spitz with heparin | Greiner-bio-one | 450534 | |
| Buffer RPE (wash buffer #2 containing guanidine and ethanol in ratio of 1:4) | Qiagen | 79216 | Wash buffer 2 |
| Buffer RWT (wash buffer #1 containing guanidine and ethanol in ratio of 1:2) | Qiagen | 1067933 | Wash buffer 1 |
| MicroAmp Optical 96-well reaction plate for qRT-PCR | Thermo Fisher Scientific | 4316813 | 96-well reaction plate |
| MicroAmp Optical Adhesive Film | Thermo Fisher Scientific | 4311971 | Adhesive film for 96-well reaction plate |
| miRNA-223-3p primer | Qiagen | MS00003871 | 5'-CGUGUAUUUGACAAGCUGAGUU G-3' |
| miRNA-423-5p primer | Qiagen | MS00012005 | 5'-UGAGGGGCAGAGAGCGAGACU UU-3' |
| miRNA-7218-5p primer | Qiagen | MS00068067 | 5'-UGCAGGGUUUAGUGUAGAGGG -3' |
| miRNA-7219-5p primer | Qiagen | MS00068081 | 5'-UGUGUUAGAGCUCAGGGUUGA GA-3' |
| miRNeasy Mini kit | Qiagen | 217004 | Membrane anchored spin column in a 2.0 mL collection tube |
| miRNeasy Serum/Plasma kit | Qiagen | 217184 | Membrane anchored spin column in a 2.0 mL collection tube |
| miScript II RT kit (reverse transcription buffer) | Qiagen | 218161 | Reverse transcriptase kit |
| miScript SYBR Green PCR kit | Qiagen | 218073 | Green dye-based PCR kit |
| QIA shredder | Qiagen | 79654 | Biopolymer spin columns in a 2.0 mL collection tube |
| QIAzol Lysis Reagent (phenol/guanidine-based lysis reagent) | Qiagen | 79306 | Phenol/guanidine-based lysis reagent |
| QuantStudio 12K Flex Flex Real-Time PCR system | Thermo Fisher Scientific | 4472380 | Real-time PCR instrument |
| QuantStudio 12K Flex Software version 1.2.1. | Thermo Fisher Scientific | 4472380 | Real-time PCR instrument software |
| RNase-free water | Qiagen | 129112 | |
| RNU6-2 primer | Qiagen | MS00033740 | Not disclosed due to confidentiality |
| SAMP1 male mice | Nippon SLC Corporation | Not assigned | |
| SAMR1 male mice | Nippon SLC Corporation | Not assigned | |
| Takara biomasher standard | Takara Bio | 9790B | Silicon homogenizer |
Références
- Huang, Y. The novel regulatory role of lncRNA-miRNA-mRNA axis in cardiovascular diseases. Journal of Cellular and Molecular Medicine. 22 (12), 5768-5775 (2018).
- Yang, C., Dou, R., Yin, T., Ding, J. MiRNA-106b-5p in human cancers: diverse functions and promising biomarker. Biomedicine and Pharmacotherapy. 127, 110211 (2020).
- Lu, T. X., Rothenberg, M. E. MicroRNA. The Journal of Allergy and Clinical Immunology. 141 (4), 1202-1207 (2018).
- McGuire, A., Brown, J. A., Kerin, M. J. Metastatic breast cancer: the potential of miRNA for diagnosis and treatment monitoring. Cancer and Metastasis Reviews. 34 (1), 145-155 (2015).
- Bjorkman, S., Taylor, H. S. MicroRNAs in endometriosis: biological function and emerging biomarker candidates. Biology of Reproduction. 100 (5), 1135-1146 (2019).
- Zhou, C. X., et al. miRNA and circRNA expression patterns in mouse brain during toxoplasmosis development. BMC Genomics. 21 (1), 46 (2020).
- Jing, R., Zhong, Q. Q., Long, T. Y., Pan, W., Qian, Z. X. Downregulated miRNA-26a-5p induces the apoptosis of endothelial cells in coronary heart disease by inhibiting PI3K/AKT pathway. European Review for Medical and Pharmacological Sciences. 23 (11), 4940-4947 (2019).
- Xie, W., et al. miR-34b-5p inhibition attenuates lung inflammation and apoptosis in an LPS-induced acute lung injury mouse model by targeting progranulin. Journal of Cellular Physiology. 233 (9), 6615-6631 (2018).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatology. 56 (5), 1946-1957 (2012).
- Ishii, H., et al. MicroRNA expression profiling in diabetic kidney disease. Translational Research. 237, 31-52 (2021).
- Mastropasqua, R., et al. Serum microRNA levels in diabetes mellitus. Diagnostics (Basel). 11 (2), 284 (2021).
- Gordanpour, A., Nam, R. K., Sugar, L., Bacopulos, S., Seth, A. MicroRNA detection in prostate tumors by quantitative real-time PCR (qPCR). Journal of Visualized Experiments: JoVE. (63), e3874 (2012).
- Ahn, J. H., Kwak, J., Lee, J. H., Lee, S. S. Efficient and accurate analysis of microRNA using a specific extension sequence. Molecular Biology Reports. 45 (4), 611-619 (2018).
- Denic, A., Glassock, R. J., Rule, A. D. Structural and functional changes With the aging kidney. Advances in Chronic Kidney Disease. 23 (1), 19-28 (2016).
- Weinstein, J. R., Anderson, S. The aging kidney: physiological changes. Advances in Chronic Kidney Disease. 17 (4), 302-307 (2010).
- Bustin, S. A., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Rajeevan, M. S., Vernon, S. D., Taysavang, N., Unger, E. R. Validation of array-based gene expression profiles by real-time (kinetic) RT-PCR. The Journal of Molecular Diagnostics. 3 (1), 26-31 (2001).
- Chen, Y., Gelfond, J. A., McManus, L. M., Shireman, P. K. Reproducibility of quantitative RT-PCR array in miRNA expression profiling and comparison with microarray analysis. BMC Genomics. 10, 407 (2009).
- Dallas, P. B., et al. Gene expression levels assessed by oligonucleotide microarray analysis and quantitative real-time RT-PCR -- how well do they correlate. BMC Genomics. 6, 59 (2005).
- Petriella, D., et al. miRNA profiling in serum and tissue samples to assess noninvasive biomarkers for NSCLC clinical outcome. Tumour Biology. 37 (4), 5503-5513 (2016).
- Skrzypa, M., et al. miRNA-146a-5p is upregulated in serum and cartilage samples of patients with osteoarthritis. Polski Przeglad Chirurgiczny. 91 (3), 1-5 (2019).
- Farzanehpour, M., et al. Serum and tissue miRNAs: potential biomarkers for the diagnosis of cervical cancer. Journal of Virology Journal. 16 (1), 116 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon