Method Article
Méthode simple modifiée pour l’induction d’un infarctus du myocarde chez la souris
Dans cet article
Résumé
Sous anesthésie adéquate, le cœur de la souris a été extériorisé par l’espace intercostal, et l’infarctus du myocarde a été induit avec succès en ligaturant l’artère descendante antérieure gauche (LAD) à l’aide de matériaux facilement disponibles dans la plupart des laboratoires.
Résumé
L’infarctus du myocarde (IM) représente l’une des principales causes de décès. Les modèles d’IM sont largement utilisés pour étudier les mécanismes pathologiques du remodelage post-IM et l’évaluation de nouvelles thérapies. Différentes méthodes (p. ex., traitement à l’isoprotérénol, cryolésion, ligature de l’artère coronaire, etc.) ont été utilisées pour induire l’infarctus du myocarde. Par rapport au traitement à l’isoprotérénol et à la cryolésion, la ligature de l’artère coronaire peut mieux refléter la réponse ischémique et le remodelage chronique après l’infarctus du myocarde. Cependant, les méthodes traditionnelles de ligature coronaire chez la souris sont techniquement difficiles. La présente étude décrit un processus simple et efficace pour l’induction de l’IM chez la souris avec des matériaux facilement disponibles. La peau de la poitrine de la souris a été ouverte sous anesthésie stable. Le cœur a été immédiatement extériorisé à travers l’espace intercostal après une séparation brutale du grand pectoral et du petit pectoral. La branche descendante antérieure gauche (LAD) a été ligaturée avec une suture 6-0 à 3 mm de son origine. Après la ligature LAD, la coloration au chlorure de 2,3,5-triphényltétrazolium (TTC) a indiqué une induction réussie de l’IM et des changements temporels de la taille de la cicatrice post-IM. Pendant ce temps, les résultats de l’analyse de survie ont montré une mortalité manifeste dans les 7 jours suivant l’infarctus du myocarde, principalement en raison d’une rupture cardiaque. De plus, l’évaluation échocardiographique post-IM a démontré une induction réussie de la dysfonction contractile et du remodelage ventriculaire. Une fois maîtrisé, un modèle d’IM peut être établi chez la souris en 2 à 3 minutes avec des matériaux facilement disponibles.
Introduction
L’infarctus du myocarde (IM) représente l’une des principales causes de décès et d’invalidité dans le monde 1,2,3,4,5. Malgré une reperfusion rapide, il existe actuellement un manque de thérapies efficaces pour traiter le remodelage cardiaque post-IM. En conséquence, des efforts considérables ont été faits pour l’exploration mécanistique et l’exploitation thérapeutique de l’IM 6,7,8. Il convient de noter que l’établissement de modèles d’IM est une condition préalable à l’atteinte de ces objectifs.
Plusieurs méthodes (p. ex., traitement à l’isoprotérénol, cryolésion, ligature de l’artère coronaire, etc.) ont été proposées pour induire des modèles d’IM chez les petits animaux. Le traitement à l’isoprotérénol est une méthode simple d’induction de l’IM, mais il ne peut pas induire d’infarctus de la zone ciblée9. La cryolésion conduit à une nécrose myocardique via la génération de cristaux de glace et une perturbation de la membrane cellulaire plutôt qu’à une ischémie directe10. En revanche, la ligature de l’artère coronaire permet un contrôle précis du site d’occlusion et de l’étendue de la zone de l’infarctus et récapitule fidèlement la réponse de remodelage après l’infarctus11,12. La ligature de l’artère coronaire est généralement effectuée après l’intubation, la ventilation mécanique et la thoracotomie, ce qui est techniquement difficile13,14. Plusieurs protocoles modifiés pour la ligature de l’artère coronaire (p. ex., sans ventilation) ont été rapportés et ont potentialisé l’induction de l’IM, mais il manque des démonstrations visuelles détaillées15,16,17. Ces questions constituent un obstacle financier et technique important pour les groupes qui souhaitent s’engager dans la recherche à l’aide de modèles d’IM. Ce rapport présente une approche pour l’induction de l’IM chez la souris. La méthode actuelle est simple, permet de gagner du temps et utilise des outils et des équipements chirurgicaux que l’on trouve facilement dans la plupart des laboratoires.
Protocole
Les expériences impliquant le travail sur les animaux sont réalisées avec toutes les approbations nécessaires du Comité d’éthique du bien-être des animaux de laboratoire de l’hôpital Renji, Université Jiao Tong de Shanghai, École de médecine (R52021-0506). Des souris C57BL/6J femelles et mâles âgées de 8 à 10 semaines ont été utilisées dans l’étude.
1. Préparation de l’équipement d’anesthésie simplifié (FACULTATIF)
REMARQUE : Il s’agit d’une configuration préopératoire facultative et peut être remplacée par une anesthésie titrable comme mentionné à la section 2. Le comité d’éthique animale de l’établissement et le ou les vétérinaires doivent être consultés avant d’adapter cette configuration aux procédures animales.
- Prenez un tube à centrifuger de 15 mL et faites une coupe perpendiculaire à l’axe long du tube à environ 3 cm de l’ouverture.
REMARQUE : Assurez-vous que la coupe est supérieure à la moitié de la circonférence circulaire de la lumière du tube afin que la valve puisse être insérée avec succès. - Percez des trous (diamètre 2 mm) au niveau de la paroi du tube à centrifuger entre la coupe et l’ouverture du tube.
- Découpez un morceau de la valve de taille appropriée dans une feuille de plastique et insérez la valve dans la coupe sur la paroi du tube.
REMARQUE : La valve peut être utilisée pour contrôler le taux de libération de l’isoflurane en modifiant la profondeur de l’insertion. - À l’intérieur d’une hotte, ouvrez le fond du tube et connectez-le à l’alimentation en oxygène. Placez une boule de coton près de l’extrémité inférieure du tube, ajoutez une charge de 0,5 mL d’isoflurane (tel qu’obtenu, voir le tableau des matériaux) sur la boule de coton et fermez la valve.
- Testez l’efficacité de l’anesthésie en masquant les souris avec des tubes préparés comme décrit ci-dessus. Surveillez la fréquence respiratoire et la profondeur de l’anesthésie en fonction de la réponse de pincement des orteils.
REMARQUE : Une fréquence respiratoire inférieure à 10 fois/10 s suggère une anesthésie excessive et la profondeur d’insertion de la valve doit être ajustée. Pour toutes les procédures impliquant une anesthésie, un filtre à gaz rempli de feuilles de charbon actif doit être utilisé (Figure 1A-i) et la chirurgie doit être effectuée à l’intérieur d’une cagoule.
2. Préparation opératoire et anesthésie
- Préparez et stérilisez tous les instruments nécessaires le jour de l’opération, y compris une paire de pinces, un hémostat micro-moustique, une paire de ciseaux chirurgicaux, deux paires de porte-aiguilles, une suture chirurgicale en soie 4-0, une suture chirurgicale en soie 6-0, un filtre à gaz et une source de lumière (voir le tableau des matériaux) (figure 1A).
- Mettez un masque chirurgical et des gants stériles.
- Appliquez la crème dépilatoire sur la poitrine de la souris et attendez 1 min. Essuyez délicatement la crème dépilatoire et les cheveux avec de la gaze humide.
- Tenez la souris avec la main dominante après l’épilation. Induire l’anesthésie par inhalation d’isoflurane vaporisé (4 %) avec apport d’oxygène (1 L/min) et maintenir à 2-3 % d’isoflurane.
- Confirmer l’anesthésie adéquate par l’absence de réponse de pincement des orteils.
- Appliquez une crème stérile pour les yeux sur les deux yeux pour prévenir la sécheresse de la cornée.
- Fixez les souris sur une plate-forme chirurgicale en position couchée. Appliquez trois fois des tampons à base de povidone iodée (voir le tableau des matériaux) sur la poitrine et couvrez la poitrine désinfectée avec un champ stérile.
3. Induction de l’infarctus du myocarde
- Changez les gants contaminés pour assurer la stérilité.
- Faites une incision cutanée de 0,5 cm le long de la ligne reliant le xiphoïde et l’aisselle après le blocage local avec la lidocaïne.
- Séparez carrément les muscles pectoraux majeurs et pectoraux mineurs à l’aide d’une pince et d’un micro-moustique hémostatique pour exposer le quatrième espace intercostal.
- Ouvrez le quatrième espace intercostal à l’aide d’un micro-hémostat de moustique.
- Extériorisez le cœur en poussant le cœur vers le quatrième espace intercostal avec l’index de la main gauche.
- Fixez le cœur avec la main gauche et ligaturez la branche descendante antérieure gauche avec une suture 6-0 à 3 mm de son origine.
- Replacez rapidement le cœur dans la cavité thoracique.
REMARQUE : Il est sécuritaire d’extérioriser le cœur pendant moins de 30 s. - Évacuez l’air de la cavité thoracique en appuyant doucement sur la cavité thoracique manuellement.
- Fermez la couche musculaire sur les côtes avec une suture en soie 6-0.
- Fermez la peau avec une suture en soie 4-0.
- Placez les souris sur un tampon (37 °C) immédiatement après l’opération.
- Injectez de la buprénorphine (0,05 à 0,1 mg/kg) par voie sous-cutanée toutes les 4 à 6 heures pour réduire la douleur postopératoire jusqu’à 72 heures.
- Remettez les souris opérées dans des cages lorsqu’elles sont complètement rétablies.
REMARQUE : Les souris seront complètement rétablies dans les 3 à 5 minutes suivant la chirurgie. - Surveillez attentivement les souris et donnez-leur de la nourriture humide jusqu’à 7 jours.
4. Prélèvement des tissus
- Sacrifiez les souris à différents moments après l’établissement de l’infarctus du myocarde par luxation cervicale.
- Fixez les souris sacrifiées sur la plate-forme chirurgicale en position couchée.
- Faites une incision ventrale (~3-4 cm) dans la partie supérieure de l’abdomen. Coupez les côtes des deux côtés de la cavité thorax et retirez le diaphragme.
- Perfuser le cœur avec 10 mL de solution saline tamponnée au phosphate froid (1x PBS, 4 °C) par injection intraventriculaire.
- Prélevez le cœur en coupant la racine aortique et conservez immédiatement le cœur à -80 °C.
REMARQUE : Selon l’expérience des auteurs, il est possible d’effectuer une coloration TTC dans les deux semaines suivant le stockage. - Colorer le cœur avec du chlorure de 2,3,5-triphényltétrazolium (TTC).
- Coupez le cœur congelé en sections de 1 mm d’épaisseur sur de la glace à l’aide de lames de rasoir.
- Incuber les tranches de cœur préparées dans une solution de TTC à 1 % (dissoute dans 1x PBS) à 37 °C pendant 10-15 min.
REMARQUE : Après 15 minutes d’incubation, jetez la solution de TTC et plongez les tranches de cœur tachées dans 1x PBS.
- Photographiez les tranches à l’aide d’un appareil photo numérique.
Résultats
Le protocole expérimental et certaines des étapes critiques sont illustrés à la figure 1. L’équipement d’anesthésie simplifiée induit l’anesthésie. Comme le montre la figure 2A, l’anesthésie induite était stable, comme en témoignent les fréquences respiratoires régulières (variaient de 90 à 107 respirations/min chez les souris testées). À la suite de la ligature de l’artère coronaire, l’analyse de coloration TTC a indiqué une induction réussie de l’infarctus du myocarde et des changements temporels de la taille de la cicatrice post-IM (Figure 2B). Pendant ce temps, les résultats de l’analyse de survie ont montré une mortalité manifeste dans les 7 jours suivant l’infarctus du myocarde chez les souris mâles et femelles C57BL/6J (Figure 2C,D). La rupture ventriculaire (56 % chez les souris mâles ; 40 % chez les souris femelles) était une cause fréquente de décès post-IM. De plus, l’évaluation échocardiographique post-IM a démontré l’induction réussie d’un dysfonctionnement contractile et d’un remodelage ventriculaire (Figure 2E,F).
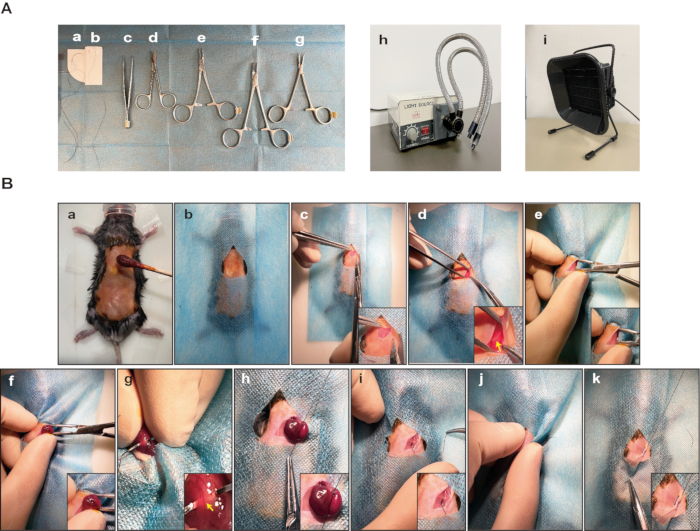
Figure 1 : Matériaux et étapes critiques des méthodes modifiées pour l’induction de l’IM. (A) Instruments chirurgicaux et matériel nécessaires à ce protocole. (a) 4-0 Suture de soie. (b) 6-0 suture de soie. c) Forceps. d) Ciseaux. (e-f) Porte-aiguilles. g) Hémostat de micro-moustiques. (h) Source lumineuse. (i) Filtre à gaz. (B) Images représentatives montrant les étapes clés de l’induction de l’IM chez la souris. a) La souris a été mise en sécurité après l’anesthésie et la povidone iodée a été appliquée sur le site chirurgical. b) Le site chirurgical est drapé. c) Une incision de 0,5 cm au site chirurgical après blocage local avec de la lidocaïne. d) Côtes exposées. La flèche indique les côtes. e) Disséquer les muscles pectoraux majeurs et pectoraux mineurs pour exposer le quatrième espace intercostal. f) Cœur extériorisé. (g-h) LAD ligaturé avec une suture en soie 6-0. La flèche indique LAD. (i) Le cœur est replacé dans la cavité thoracique. j) L’air a été évacué de la cavité thoracique. (k) La couche musculaire s’est refermée sur les côtes avec une suture en soie 6-0 et la peau s’est fermée avec des sutures en soie 4-0. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Changements histologiques et fonctionnels après une ligature de l’artère coronaire. (A) Fréquence respiratoire chez les souris anesthésiées par l’équipement d’anesthésie simplifiée (n = 10). (B) Les résultats de coloration TTC des tranches de cœur (4 tranches de chaque cœur) ont été recueillis à différents moments après l’IM. La zone blanche indiquait une zone d’infarctus, et la zone rouge indiquait un myocarde viable. (C) La courbe de Kaplan-Meier montre le taux de mortalité post-IM chez les souris mâles (n = 20 par groupe). (D) La courbe de Kaplan-Meier montre le taux de mortalité post-IM chez les souris femelles (n = 20 par groupe). (E) Images représentatives de l’analyse échocardiographique à différents moments après l’IM (simulacre, 3 jours, 7 jours, 21 jours et 28 jours après l’IM). (F) L’analyse quantitative des valeurs de la fraction d’éjection ventriculaire gauche (FEVG), du raccourcissement fractionnaire ventriculaire gauche (LVFS), du diamètre systolique final du ventricule gauche (LVsD) et de la dimension de la diastolique terminale du ventricule gauche (LVdD) parmi les groupes indiqués (n = 5 par groupe). **p<0,01 ou ***p<0,001 vs. feinte; ##p<0.01 ou ###p<0.001 vs. Une analyse de variance à un facteur avec le test posthoc de Tukey HSD (Honestly Significant Difference) a été effectuée pour l’analyse statistique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le présent rapport a démontré un protocole simple pour l’induction de l’IM chez la souris avec des matériaux facilement disponibles, qui a été modifié à partir d’une méthode rapportée par Gao16. Les modèles murins d’IM sont indispensables pour l’exploration mécanistique et le dépistage de médicaments pour le dysfonctionnement et le remodelage post-IM12. Parmi les techniques existantes d’induction de l’IM, la ligature de l’artère coronaire représente la plus couramment pratiquée. La ligature de l’artère coronaire récapitule fidèlement la nature ischémique de l’infarctus du myocarde et conduit à une réponse de cicatrisation et de remodelage de la cicatrice similaire au scénario clinique18,19. Cependant, le protocole conventionnel pour la ligature de l’artère coronaire implique l’intubation, la ventilation et une large ouverture du thorax, ce qui est techniquement difficile et prend du temps. Au cours des dernières années, différents protocoles de ligature des artères coronaires ont été rapportés et ont potentialisé l’établissement de l’IM dans une certaine mesure15,16,17. La présente étude a présenté un protocole simple et efficace utilisant des outils et des équipements chirurgicaux que l’on trouve facilement dans la plupart des laboratoires.
Étapes critiques et dépannage
Pour une performance optimale dans la pratique de cette méthode, plusieurs étapes clés sont à noter. Pour extérioriser le cœur, la cavité thoracique ne doit pas être fortement comprimée, ce qui affecterait négativement le flux sanguin coronaire et obscurcirait l’artère coronaire, entraînant l’invisibilité de l’artère coronaire et l’échec de la ligature LAD. De plus, cela peut entraîner de graves lésions pulmonaires. Dans la plupart des cas, une légère poussée contre le côté droit de la paroi thoracique permettra d’extérioriser avec succès le cœur à travers l’espace intercostal ouvert. Parfois, une sensation de résistance lors de l’extériorisation cardiaque peut indiquer un décalage entre l’apex du cœur et l’ouverture intercostale. Cela peut être résolu par de légers mouvements de l’hémostat du micro-moustique le long de la ligne médio-axillaire. Un autre point critique est l’évacuation adéquate de l’air résiduel dans la cavité thoracique avant de suturer les muscles et la peau. Si vous ne le faites pas, la mortalité postopératoire due au pneumothorax augmentera.
Avantages et limites
Les méthodes conventionnelles de ligature coronaire nécessitent une intubation, une ventilation mécanique, des côtes coupées et ne sont pas faciles à identifier pour les artères coronaires en raison d’une fréquence cardiaque élevée. Ces problèmes prolongent considérablement la durée de l’opération et augmentent la mortalité liée à l’opération. Par rapport aux méthodes conventionnelles, le protocole modifié présente les avantages suivants : (1) il permet de gagner du temps (c’est-à-dire qu’il faut environ 3 minutes entre l’anesthésie, la ligature LAD et la suture cutanée réussie) ; (2) Les outils et le matériel chirurgicaux nécessaires sont facilement disponibles dans la plupart des laboratoires. Cependant, une limitation importante de cette méthode unique est le temps limité accordé pour la ligature LAD après l’extériorisation du cœur en raison de l’absence de support de ventilation mécanique. Ainsi, on peut s’attendre à une mortalité élevée causée par le pneumothorax pour les débutants. D’après l’expérience des auteurs, l’extériorisation du cœur pendant moins de 30 s est bien tolérée par toutes les souris testées. Ce laps de temps est suffisant pour qu’un technicien expérimenté termine l’induction de l’IM avec une faible mortalité périopératoire (<5 %).
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de la Fondation nationale des sciences naturelles de Chine (81930007, 81625002, 81800307, 81470389, 81500221, 81770238), du Shanghai Outstanding Academic Leaders Program (18XD1402400), de la Commission des sciences et de la technologie de la municipalité de Shanghai (201409005200), du Shanghai Pujiang Talent Program (2020PJD030) et de la China Postdoctoral Science Foundation (2020M671161, BX20190216).
matériels
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA | T8877-25G | TTC staining |
| 4-0 silk suture | YUANKANG | 4-0 | Surgical instrument |
| Autoclave | HIRAYAMA | HVE-50 | Sterilization for the solid |
| Buprenorphine | Qinghai Pharmaceutical FACTORY Co., Ltd. | H10940181 | reduce post-operative pain |
| Centrifugation tube | Biological Hope | 1850-K | 15ML |
| Depilatory cream | ZIKER BIOTECHNOLOGY | ZK-L2701 | Depilation agent for laboratory animals |
| Forcep | RWD | F12028 | Surgical instrument |
| Gas filter | ZHAOXIN | SA-493 | Operator protection |
| Isoflurane | RWD | 20071302 | Used for anesthesia |
| Light source | Beijing PDV | LG-150B | Operating lamp |
| Micro-mosquito hemostat | FST | 13011-12 | Surgical instrument |
| Needle | BINXIONG | 42180104 | Surgical instrument |
| Needle and the 6-0 silk suture | JIAHE | SC086 | Surgical instrument |
| Needle holder | ShangHaiJZ | J32030 | Surgical instrument |
| Needle holder | ShangHaiJZ | J32010 | Surgical instrument |
| Povidone-iodine swabs | SingleLady | GB26368-2010 | Skin disinfection |
| Scissors | CNSTRONG | JYJ1030 | Surgical instrument |
| Sterile eye cream | Shenyang Xingqi Pharmaceutical Co., Ltd. | H10940177 | prevent corneal dryness |
| Ultra-high resolution ultrasound imaging system for small animals | VisualSonics | Vevo 2100 | Echocardiographic analysis |
Références
- Fu, Y., et al. A simple and efficient method for in vivo cardiac-specific gene manipulation by intramyocardial injection in mice. Journal of Visualized Experiments. (134), e57074(2018).
- Pell, S., Fayerweather, W. E. Trends in the incidence of myocardial infarction and in associated mortality and morbidity in a large employed population. The New England Journal of Medicine. 312 (16), 1005-1011 (1985).
- Ramunddal, T., Gizurarson, S., Lorentzon, M., Omerovic, E. Antiarrhythmic effects of growth hormone--in vivo evidence from small-animal models of acute myocardial infarction and invasive electrophysiology. Journal of Electrocardiology. 41 (2), 144-151 (2008).
- Tabrizchi, R. β-blocker therapy after acute myocardial infarction. Expert Review of Cardiovascular Therapy. 11 (3), 293-296 (2013).
- Virani, S. S., et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 141 (9), 139(2020).
- Cahill, T. J., Choudhury, R. P., Riley, P. R. Heart regeneration and repair after myocardial infarction: Translational opportunities for novel therapeutics. Nature Reviews Drug Discovery. 16 (10), 699-717 (2017).
- Froese, N., et al. Anti-androgenic therapy with finasteride improves cardiac function, attenuates remodeling and reverts pathologic gene-expression after myocardial infarction in mice. Journal of Molecular and Cellular Cardiology. 122, 114-124 (2018).
- Wang, W., et al. Defective branched chain amino acid catabolism contributes to cardiac dysfunction and remodeling following myocardial infarction. American Journal of Physiology-Heart and Circulatory Physiology. 311 (5), 1160-1169 (2016).
- Acikel, M., et al. Protective effects of dantrolene against myocardial injury induced by isoproterenol in rats: Biochemical and histological findings. International Journal of Cardiology. 98 (3), 389-394 (2005).
- vanden Bos, E. J., Mees, B. M. E., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: A comparison with coronary artery ligation. American Journal of Physiology-Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Guo, Y., et al. Demonstration of an early and a late phase of ischemic preconditioning in mice. American Journal of Physiology-Heart and Circulatory Physiology. 275 (4), 1375-1387 (1998).
- Kumar, M., et al. Animal models of myocardial infarction: Mainstay in clinical translation. Regulatory Toxicology and Pharmacology. 76, 221-230 (2016).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. Journal of Visualized Experiments. (73), e50318(2013).
- Johns, T. N., Olson, B. J. Experimental myocardial infarction. I. A method of coronary occlusion in small animals. Annals of Surgery. 140 (5), 675-682 (1954).
- Ahn, D., et al. Induction of myocardial infarcts of a predictable size and location by branch pattern probability-assisted coronary ligation in C57BL/6 mice. American Journal of Physiology. Heart and Circulatory Physiology. 286 (3), 1201-1207 (2004).
- Gao, E., Koch, W. J. A novel and efficient model of coronary artery ligation in the mouse. Methods in Molecular Biology. 1037, 299-311 (2013).
- Most, P., et al. Cardiac S100A1 protein levels determine contractile performance and propensity toward heart failure after myocardial infarction. Circulation. 114 (12), 1258-1268 (2006).
- Christia, P., et al. Systematic characterization of myocardial inflammation, repair, and remodeling in a mouse model of reperfused myocardial infarction. Journal of Histochemistry & Cytochemistry. 61 (8), 555-570 (2013).
- Frantz, S., Bauersachs, J., Ertl, G. Post-infarct remodelling: Contribution of wound healing and inflammation. Cardiovascular Research. 81 (3), 474-481 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon