Method Article
Évaluation et quantification des lacunes micro-épithéliales dans la muqueuse colique à l’aide de la coloration par immunofluorescence
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous décrivons une nouvelle méthode pour visualiser l’emplacement spécifique de l’endroit où la perméabilité transcellulaire et paracellulaire est renforcée dans la muqueuse colique enflammée. Dans ce test, nous appliquons un colorant fluorescent de 10 kDa conjugué à un dextran fixable à la lysine pour visualiser les régions à haute perméabilité (HPR) dans la muqueuse colique.
Résumé
Les cellules épithéliales qui tapissent la muqueuse intestinale créent une barrière physique qui sépare le contenu luminal de l’interstitium. L’altération de la barrière épithéliale a été associée au développement de diverses pathologies telles que les maladies inflammatoires de l’intestin (MICI). Dans la muqueuse enflammée, les érosions superficielles ou micro-érosions qui corrompent les monocouches épithéliales correspondent à des sites de haute perméabilité. Plusieurs mécanismes ont été impliqués dans la formation des micro-érosions, notamment la mue cellulaire et l’apoptose. Ces micro-érosions représentent souvent des trous épithéliales microscopiques répartis de manière aléatoire dans le côlon. La visualisation et la quantification de ces lacunes épithéliales sont devenues un outil important pour étudier la fonction de la barrière épithéliale intestinale. Ici, nous décrivons une nouvelle méthode pour visualiser l’emplacement spécifique de l’endroit où la perméabilité transcellulaire et paracellulaire est renforcée dans la muqueuse colique enflammée. Dans ce test, nous appliquons un colorant fluorescent de 10 kDa conjugué à un dextran fixable à la lysine pour visualiser les régions à haute perméabilité (HPR) dans la muqueuse colique. L’utilisation supplémentaire de marqueurs de mort cellulaire a révélé que les HPR englobent les foyers apoptotiques où l’extrusion/excrétion épithéliale se produit. Le protocole décrit ici fournit une approche simple mais efficace pour visualiser et quantifier les micro-érosions dans l’intestin, ce qui est un outil très utile dans les modèles de maladies, dans lesquels la barrière épithéliale intestinale est compromise.
Introduction
La muqueuse gastro-intestinale (GI) crée une barrière physique qui sépare l’environnement extracellulaire et le milieu interne de l’hôte, et participe à l’absorption des nutriments, de l’eau et des électrolytes. La barrière intestinale comprend une couche de mucus constituée de glycoprotéines, une monocouche de cellules épithéliales et la lamina propria sous-jacente sont des cellules immunitaires et stromales. Les cellules épithéliales intestinales formant la barrière physique sont reliées entre elles par différents complexes protéiques, notamment la jonction adhérente (AJ), la jonction serrée (TJ) et les desmosomes (DM). L’altération de la fonction de la barrière épithéliale augmente la perméabilité intestinale et permet la translocation de substances nocives et d’agents pathogènes de la lumière vers l’interstitium1. Il existe un nombre croissant de maladies où la barrière épithéliale est compromise, telles que les maladies inflammatoires de l’intestin (MICI) comme la maladie de Crohn (MC), la colite ulcéreuse (CU) et la colite indéterminée (CI). L’incidence des MICI augmente dans le monde entier, avec une prévalence approchant les 0,5 % en Occident. Bien que les causes des MICI ne soient pas claires, la réponse immunitaire/inflammatoire excessive déclenchée dans la paroi intestinale contribue directement à la perturbation de la barrière épithéliale en limitant le rétablissement de l’homéostasie épithéliale intestinale 2,3,4. De plus, les patients atteints d’inflammation colique de longue date présentent un risque élevé de développer un cancer colorectal (CCR)5. D’autres pathologies associées à la perturbation de la barrière épithéliale intestinale sont le syndrome du côlon irritable, l’obésité, la maladie cœliaque, la sensibilité au gluten non cœliaque et les allergies alimentaires6. Pour ces raisons, il est urgent de développer des approches expérimentales permettant d’analyser l’intégrité de la barrière épithéliale intestinale dans des modèles animaux imitant la pathogenèse se produisant chez l’homme.
Ici, nous avons évalué la paracellule passive gastro-intestinale et la perméabilité transcellulaire associée à un processus inflammatoire dans l’épithélium colique à l’aide d’une technique simple. Pour étudier le flux transmural des macromolécules, nous avons mesuré la diffusion passive du FITC-dextran (4 kDa) et du RITC-dextran (10 kDa) dans les sacs côliques ex vivo. De plus, en injectant un dextran fluorescent de 10 kDa fixable à la lysine dans la lumière des sacs intestinaux, nous avons spécifiquement identifié les zones à haute perméabilité dans la muqueuse enflammée. L’utilisation de marqueurs d’apoptose et d’anticorps contre les protéines AJ nous a permis de démontrer que les zones de haute perméabilité de la muqueuse enflammée correspondent à des régions spécifiques où les cellules épithéliales subissent une apoptose et où les jonctions cellule-cellule sont perturbées. Cette nouvelle technique peut être utilisée pour évaluer l’intégrité de l’épithélium dans n’importe quel modèle où la barrière épithéliale intestinale est compromise.
Protocole
Toutes les procédures ont été examinées et approuvées par le Comité institutionnel pour le soin et l’utilisation des animaux de laboratoire (CICUAL) de CINVESTAV.
1. Préparation des matériaux et des réactifs
- Préchauffer la solution de Hartmann (130 mM de NaCl, 28 mM de lactate, 4 mM de KCl, 1,5 mM de CaCl2) à 37 °C tout en bouillonnant avec 95 % d’O2/5 % de CO2. Maintenez le pH physiologique (7,4) de la solution.
- Pour analyser la perméabilité paracellulaire passive, préparer une solution de travail en dissolvant 1 mg/mL de FITC-Dextran (4 kDa) et 1 mg/mL de RITC-Dextran (10 kDa) dans une solution de Hartmann préchauffée.
- Préparez une solution de 4 μg/mL d’Alexa Fluor647 Fixable-Dextran (10 kDa) dans la solution de Hartmann. Conservez les solutions de travail dans un tube conique de 15 ml et protégez-les de la lumière jusqu’à l’utilisation.
REMARQUE : 300 μL de solution de travail par côlon seront nécessaires. - Préparez une suture chirurgicale en coupant deux sections de 5 cm pour chaque gros intestin. Enroulez les sutures en un nœud non fermé.
2. Dissection et préparation du trac gastro-intestinal
- Retenir la nourriture solide pendant 6 heures avant d’euthanasier les souris. Fournir de l’eau potable à volonté.
REMARQUE : Si possible, placez les souris sur des suppléments de gel nutritif (eau purifiée, mélasse, citrouille, sirop de maïs, graines de tournesol, protéines de blé, huile végétale, acide alimentaire, hydrocolloïdes, électrolytes, fibre de maïs, mélange minéral NIH-31M, mélange de vitamines NIH-31M). - Euthanasier les souris dans une chambre de CO2 suivie d’une luxation cervicale conformément aux protocoles éthiques de l’établissement.
- Stérilisez l’abdomen et le thorax avec de l’éthanol à 70 %.
- À l’aide d’une paire de ciseaux, faites une incision au milieu de l’abdomen et exposez la cavité péritonéale.
- À des fins d’orientation, séparez et disséquez le gros intestin en coupant à l’extrémité de l’intestin grêle (partie terminale de l’iléon) juste avant le cæcum, puis au niveau de la bordure anale. À l’aide d’une pince chirurgicale, on retire délicatement le mésentère et on place le côlon dans la solution de Hartmann.
- Il est important de noter que, pour maintenir l’uniformité entre les animaux, identifiez les sections similaires et utilisez-les pour évaluer la perméabilité. L’utilisation de régions proches du caecum est fortement recommandée.
- Utilisez une seringue à insuline équipée d’une canule en plastique émoussée pour rincer doucement le contenu luminal présent dans le côlon. Si les selles sont fermes, poussez soigneusement à l’aide d’une pince émoussée. Une fois les matières fécales retirées, laver 3 fois avec 400 μL de solution Hartmann.
- Attachez la région proximale (la plus proche du cæcum) et placez une boucle de suture pré-nouée dans la région distale du côlon. À l’aide d’une seringue équipée d’une canule en plastique émoussée, remplissez le sac intestinal avec la solution contenant la sonde de désir. Retirez délicatement la canule en plastique et attachez la boucle dans la région distale.
- Placez le sac intestinal dans un tube conique de 15 mL avec 6 mL de solution de Hartmann et incubez pendant 1 h pour évaluer le flux paracellulaire passif de FITC/RITC-Dextran ou 30 min pour analyser le flux de l’Alexa Fluor Fixable-Dextran.
- Maintenez les tubes coniques contenant les sacs intestinaux à 37 °C avec 5 % de CO2 et protégez-les de la lumière.
- Mesurer la perméabilité passive à l’aide de FITC/RITC-Dextran. À 0 et 60 min, prélever un échantillon de 100 μL dans le tube conique et le transférer sur une plaque à 96 puits. Rajoutez 100 μL de support frais pour remplacer le volume perdu.
- Mesure d’échantillons et d’étalons pour FITC/RITC sur un lecteur de plaques fluorescentes (excitation/émission FITC : 495 nm/519 nm ; Excitation/émission RITC : 570/595 nm).
- Pour mesurer la perméabilité passive à l’aide d’Alexa Fluor 647 Fixable-Dextran, retirez les intestins, coupez près du nœud de cravate chirurgical et coupez l’intestin pour exposer la lumière afin d’éliminer la solution avec la sonde. Lavez la lumière de l’intestin 2 fois avec la solution froide de Hartmann.
- Placez le tissu dans un moule à moules préalablement rempli de composé à température de coupe optimale (O.C.T.). Orientez le tissu verticalement ou horizontalement en fonction du côté à sectionner. Conservez les échantillons à -80 °C.
3. Coloration immunofluorescente
- Fixez des sections congelées de 20 micromètres avec 3,7 % de paraformaldéhyde (PFA) pendant 20 min à température ambiante, puis lavez-les 3 fois avec une solution saline tamponnée au phosphate froid (PBS ; 37 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4 et 1,8 mM KH2 PO4).
REMARQUE : Les sections verticales des intestins ont tendance à se détacher si les lavages sont très forts. - Perméabiliser avec 0,2 % TX-100/PBS pendant 12 min à température ambiante puis laver 3 fois avec du PBS froid.
- Bloc avec 0,2 % BSA/PBS pendant 1 heure à température ambiante.
- Diluer l’anticorps primaire dans une solution bloquante et incuber pendant 1 h à température ambiante. Laver 3 fois avec du PBS froid.
- Incuber pendant 1 h avec des anticorps secondaires dans une solution bloquante. Laver 3 fois avec du PBS froid.
- Appliquez un produit de montage sur les coupes et scellez-le à l’aide d’une lamelle. Les lames peuvent être stockées jusqu’à 3 mois à -20 °C.
Résultats
Dans la muqueuse enflammée, les érosions superficielles ou les microérosions compromettent l’intégrité de la monocouche de cellules épithéliales et représentent des sites de haute perméabilité 7,8. Pour évaluer de telles possibilités, nous avons analysé la perméabilité passive dans la muqueuse colique enflammée dans un modèle murin de colite au sulfate de sodium dextran. En bref, pendant 5 jours, les souris C57BL/6J ont reçu 2,5 % de DSS (p/v, 40-50 kDa) dissous dans l’eau potable. Ce modèle se caractérise par l’induction de lésions des cellules épithéliales et d’un dysfonctionnement de la barrière épithéliale dans le gros intestin, ce qui permet à son tour l’entrée des antigènes luminaux dans la lamina propria. Un tel processus entraîne une stimulation du système immunitaire, conduisant à la sécrétion de cytokines et de chimiokines pro-inflammatoires qui aggravent encore les dommages épithéliaux9. Comme le montre la figure 1A, les souris exposées au DSS ont montré une perte de poids corporel de ~12 % après 5 jours de traitement. Du sang fécal et de la diarrhée ont également été détectés chez toutes les souris traitées par le DSS. De plus, les souris colitiques ont montré une réduction de la longueur du côlon statistiquement significative (figure 1B). Ainsi, l’indice d’activité de la maladie (IAD) englobant la perte de poids chez l’animal, la consistance des selles, la diarrhée, le sang occulte et les saignements rectaux macroscopiques a augmenté après 5 jours de traitement par DSS (Figure 1C). L’analyse histopathologique a révélé la présence d’érosions épithéliales, d’ulcérations, d’infiltrats immunitaires et d’œdèmes dans la muqueuse colitique de souris colitiques (Figure 2).
La perturbation de la barrière épithéliale, y compris l’apoptose des cellules épithéliales intestinales et les jonctions intercellulaires dysfonctionnelles, a été prise en compte pour l’augmentation de la perméabilité passive dans la muqueuse enflammée10,11. Par conséquent, nous avons mesuré indirectement la perméabilité dans la muqueuse colique en surveillant le flux passif de sondes marquées par fluorescence (FITC et RITC-dextran). Comme le montre la figure 3A, le processus inflammatoire induit après l’administration de DSS a augmenté la perméabilité transmurale, comme le montre l’augmentation du flux passif de FITC-dextran (4 kDa) et de RITC-dextran (10 kDa). De plus, comme le montre la figure 3B, l’analyse par transfert Western a confirmé l’augmentation de l’apoptose dans la muqueuse colique chez les souris traitées par le DSS, comme le montre la présence de caspase 3 active (Acasp-3). Ainsi, les données suggèrent fortement que pendant l’inflammation, le processus apoptotique déclenché dans la muqueuse enflammée contribue à la perturbation de la fonction de barrière épithéliale.
Ensuite, nous avons évalué la localisation des zones à haute perméabilité dans la muqueuse enflammée en analysant le flux d’un lysine dextran fixable par fluorescence de 10 kDa. Nous avons utilisé une molécule de 10 kDa pour restreindre le flux uniquement aux régions très perméables avec une taille de pores élevée. Chez les souris témoins, le dextran fixable a été conservé à la surface apicale des cryptes du côlon (flèches blanches) et a été délimité par le faisceau serré de filaments d’actine au niveau des microvillosités de bordure en brosse (Figure 4A). Cependant, chez les souris colitiques, le dextran fixable a pénétré dans le cytosol des cellules épithéliales du côlon, démontrant que l’inflammation induit un flux transcellulaire actif (astérisques). Après une analyse plus approfondie, nous avons observé la présence de dextran fixable dans l’interstitium chez les souris colitiques (flèches) mais pas chez les animaux témoins, indiquant un flux net du côté luminal vers le côté interstitiel (Figure 4B). Dans la zone perméable, le dextran fixable cytosolique était clairement incorporé dans les cellules épithéliales regroupées en microrégions du côté luminal et ces cellules étaient positives pour le marqueur apoptotique Acasp-3 (Figure 4C). Il est important de noter qu’également à la surface, dans les zones de haute perméabilité où les cellules épithéliales subissent l’apoptose (foyers apoptotiques), nous avons remarqué une distribution aberrante de l’E-cadhérine (Figure 4C, Arrows) et un effet non observé dans le tissu témoin. De plus, les résultats ont montré que le dextran fixable était internalisé dans les cellules anoikis présentes au niveau de la lumière, et certaines de ces cellules présentaient une faible coloration cytosolique pour l’E-cadhérine (pointe de flèche) (Figure 4D). Contrairement à l’E-cadhérine, les cellules épithéliales intestinales enrichies en dextran fixable cytosolique ont montré une coloration claire pour ZO-1 au niveau de la TJ (Figure 4E), aucune coloration pour ZO-1 n’a été détectée dans les cellules détachées (données non présentées). Ainsi, en conclusion, nous avons démontré que le dextran fixable est un bon outil pour identifier les sites de haute perméabilité dans l’intestin et qu’il est internalisé dans les cellules apoptotiques et anoïkis.

Graphique 1. Induction de la colite aiguë à l’aide du DSS. (A) Changements quotidiens du poids corporel des souris C57BL/6J traitées avec un DSS à 2,5 % pendant 5 jours. Le poids corporel est exprimé en pourcentage du poids corporel au jour 0. (B) Changements macroscopiques observés dans les côlons de souris traitées avec du DSS pendant 5 jours. Panneau supérieur. Image représentative de côlons prélevés sur des souris témoins et colitiques. Panneau inférieur. Un raccourcissement de la longueur du côlon a été observé chez les souris traitées au DSS. (C) Score clinique (indice d’activité de la maladie ; DAI) sur 5 jours après l’eau (témoins ; n 5) ou un traitement oral au sulfate de sodium (DSS) à 2,5 %. L’IAD, qui englobe la perte de poids corporel, la consistance des selles et le sang dans les matières fécales, a augmenté chez les souris colitiques. Les données sont présentées sous forme ± moyennes MEB (n=5). Les valeurs P ont été calculées à l’aide d’une ANOVA à deux facteurs avec le test post hoc de Sidak (A) et le test t de Student (B, C). **p < 0,01 ; p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
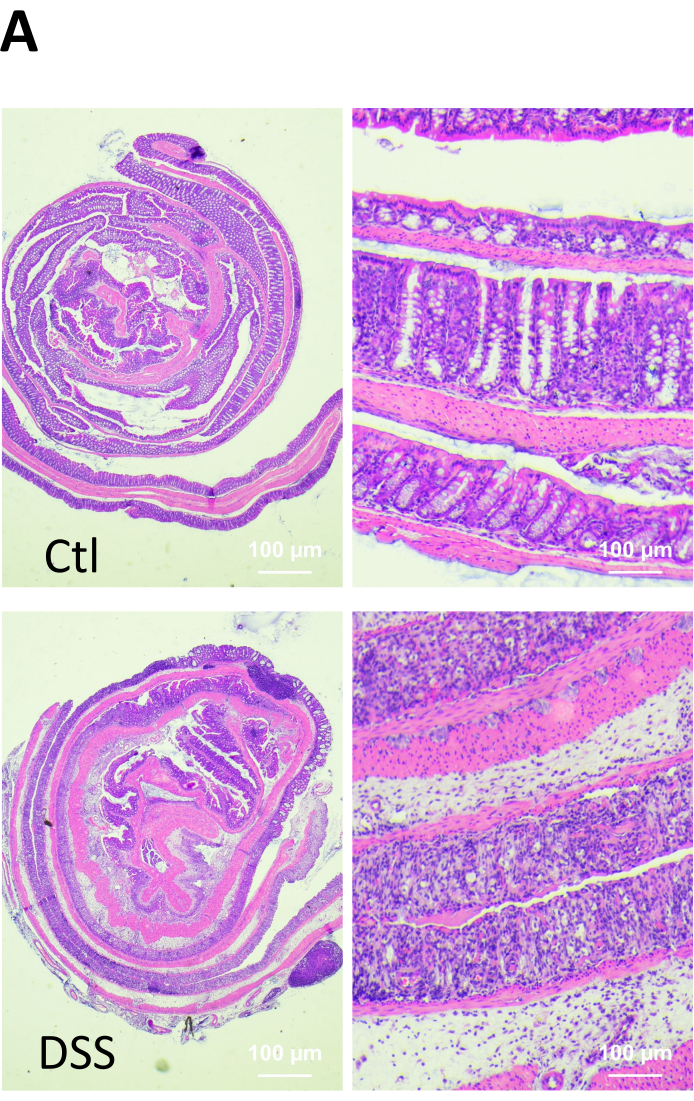
Graphique 2. Changements microscopiques dans la muqueuse colique de souris saines et traitées au DSS. À la fin de l’expérience, les animaux ont été euthanasiés et les échantillons de tissus ont été fixés, noyés dans de la paraffine, sectionnés et colorés à l’hématoxyline et à l’éosine (H&E). Des infiltrations de cellules inflammatoires (flèche), des ulcérations (pointe de flèche) et une perte d’architecture cryptale (érosion, e) ont été observées dans le côlon de souris traitées au DSS. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 3. Le transport paracellulaire passif du Dextran marqué fluorescent est amélioré pendant la colite. (A) Analyse du transport paracellulaire passif du dextran marqué fluorescent dans les sacs intestinaux de souris saines et colitiques. Des sacs intestinaux ont été préparés à partir de côlons prélevés sur des souris C57BL/6J du même âge traitées avec de l’eau ou 2,5 % de DSS pendant 5 jours. Les sacs ont été chargés avec une solution contenant 1 mg/ml de FITC-dextran-4 kDa (MW 4 400 Da) et 1 mg/ml de RITC-dextran-10 kDa (MW 10 000 Da). Le flux paracellulaire passif des sondes fluorescentes a été mesuré après 60 min. La perméabilité paracellulaire est augmentée après l’induction de la colite. (B) Évaluation de la caspase-3 active (Acasp-3) dans la muqueuse colique de souris traitées au DSS. Des lysats de cellules entières ont été préparés à partir d’échantillons de côlon prélevés sur des souris C57BL/6J du même âge traitées avec de l’eau ou 2,5 % de DSS pendant 5 jours. 30 μg de protéines ont été chargés et séparés dans des gels de polyacrylamide SDS à 12 %, transférés sur une membrane de nitrocellulose et soumis à un western blot pour Acasp-3. Le GAPDH a été utilisé comme contrôle de chargement. La présence de Caspase-3 active est augmentée après l’induction de la colite. n = 5. Les données sont présentées sous forme ± moyennes MEB (n=5). Les valeurs P ont été calculées à l’aide d’une ANOVA à deux facteurs avec le test post hoc de Sidak (A) et le test de Mann-Whitney (B). *p < 0,05 ***p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
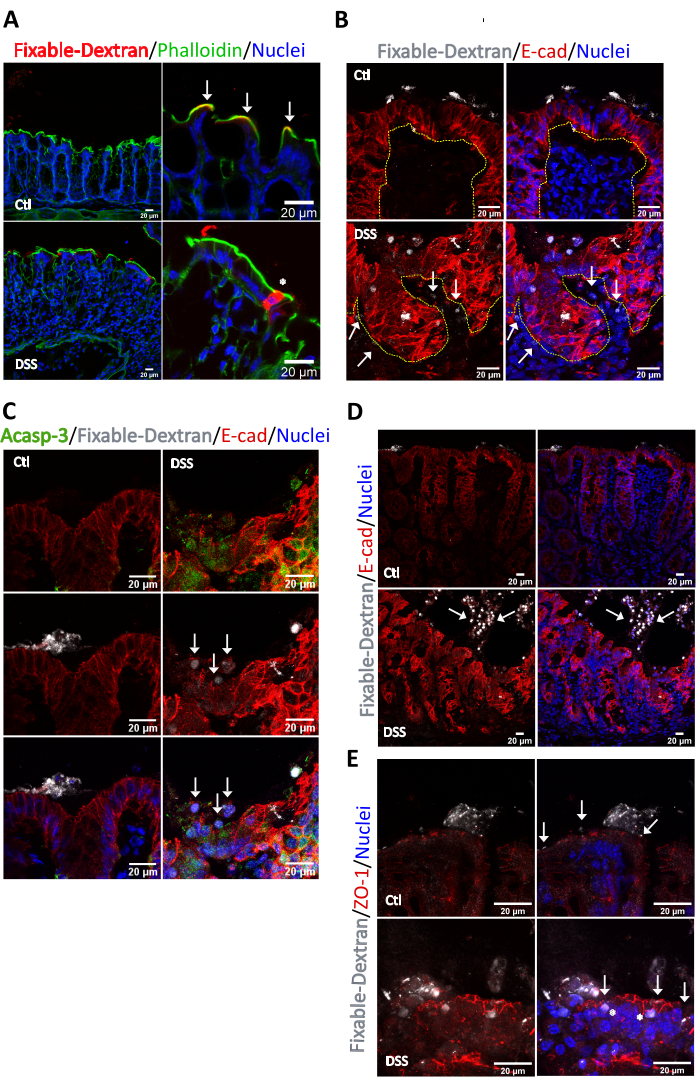
Graphique 4. Identification de sites de perméabilité dans la muqueuse colique de souris saines et traitées par DSS. Des sacs intestinaux ont été préparés à partir de côlons prélevés sur des souris C57BL/6J du même âge traitées avec de l’eau ou 2,5 % de DSS pendant 6 jours. Les sacs ont été chargés d’une solution contenant 4 μg/mL de dextran fixable Alexa Fluor 647, 10 kDa. Le flux paracellulaire passif de la sonde fluorescente a été arrêté après 30 min. Les sacs côliques ont été fixés, intégrés dans l’OCT, sectionnés et colorés pour l’immunofluorescence. (A) Dans des conditions de contrôle, le dextran fixable (rouge) a été détecté en apposition rapprochée avec (flèches) l’anneau d’actine apical (vert) limitant la surface apicale des colonocytes face à la face luminale. Après le traitement par DSS, la continuité de l’anneau d’actine apical a été perturbée (astérisque). Le dextran fixable a pénétré dans le cytosol des cellules épithéliales de surface. (B) Analyse du dextran fixable et de l’E-cadhérine sur des sites de haute perméabilité. Dans des conditions de contrôle, le dextran fixable a été retenu du côté luminal. Dans la muqueuse colitique, du dextran fixable a été détecté au niveau du cytosol des cellules épithéliales tapissant la surface de la crypte et dans plusieurs régions de l’interstitium (flèches). Les cellules épithéliales qui incorporaient du dextran fixable étaient situées à la surface de la crypte et présentaient une distribution aberrante de E-cadhérine. Une ligne pointillée délimite la crypte. n = 5. (C) Analyse de la caspase-3 active et de l’E-cadhérine aux sites de haute perméabilité identifiés avec le dextran fixable dans la muqueuse colitique de souris colitiques. La caspase-3 active (verte) a été enrichie aux sites de haute perméabilité. Les flèches marquent les cellules épithéliales avec une coloration aberrante pour l’E-cadhérine qui étaient présentes à la surface de la crypte. n = 5. (D) Analyse du dextran fixable et de l’E-cadhérine. Dans des conditions de contrôle, le dextran fixable a été retenu du côté luminal. Dans la muqueuse colitique, du dextran fixable a été détecté au niveau du cytosol des cellules épithéliales détachées situées au niveau de la lumière intestinale (flèches). Les cellules épithéliales marquées au dextran fixable ont montré une présence claire d’E-cadhérine cytosolique. n = 5. (E) Analyse du dextran fixable et du ZO-1. Dans des conditions de contrôle, le dextran fixable a été conservé du côté luminal au-dessus du TJ (marqué par ZO-1). Dans la muqueuse colitique, du dextran fixable a été détecté au niveau du cytosol des cellules épithéliales détachées et dans les cellules épithéliales à la surface de la crypte (astérisques). ZO-1 localisé au niveau de la TJ dans des conditions de contrôle et colitiques (Arrows). n = 5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’homéostasie épithéliale résultant de l’équilibre entre la prolifération cellulaire et l’apoptose épithéliale maintient une barrière intestinale correcte et fonctionnelle. De nombreux troubles cliniques, tels que les MICI, sont accompagnés ou caractérisés par des altérations de la perméabilité intestinale, une inflammation de la muqueuse et une perturbation de l’homéostasie épithéliale1. L’interaction entre ces processus est encore très controversée. Par conséquent, le développement de nouvelles approches de recherche pour étudier correctement ces processus est un sujet important dans le domaine. Il existe plusieurs protocoles publiés pour l’étude indirecte de la perméabilité intestinale pendant l’inflammation, tels que la mesure de la résistance électrique transépithéliale dans les monocouches épithéliales et la quantification des sondes hydrophobes marquées au fluorophore dans les organoïdes intestinaux, les intestins de souris et les sacs intestinaux 10,11,12,13. Bien qu’elles aient démontré que l’absorption d’une substance augmente ou diminue dans la muqueuse intestinale, ces méthodes ne parviennent pas à analyser d’autres événements importants qui contribuent directement aux changements de la perméabilité. Par exemple, en omettant d’identifier les zones spécifiques où l’intégrité de l’épithélium est compromise, ces études limitent la compréhension des mécanismes de transport ou des fonctions biologiques responsables de l’atteinte à la perméabilité intestinale. De plus, étant donné que la perméabilité intestinale peut varier considérablement d’une région à l’autre, ces études pourraient générer des erreurs telles que des résultats faussement positifs. Par conséquent, le fait de compléter ces études par des évaluations non quantitatives spécifiques à un site, comme celle décrite ici, permettra de déterminer la région exacte où se produit l’écoulement des substances dans l’épithélium endommagé. Ce nouveau test de perméabilité permet non seulement de mieux comprendre l’intégrité de la muqueuse régionale dans les maladies digestives, mais aussi d’étudier les mécanismes perturbés contribuant à un tel processus.
La nouvelle technique décrite est une combinaison de deux techniques décrites précédemment, la préparation de sacs intestinaux pour évaluer la fonction de la barrière muqueuse ex vivo12 et l’utilisation de traceurs fluorescents fixables pour analyser la perméabilité vasculaire cérébrale13. En utilisant cette technique, nous avons observé que l’altération de la barrière épithéliale après une lésion de l’IEC augmente le flux général d’antigènes luminaux vers le compartiment interstitiel. L’utilisation d’un dextran fixable de 10 kDa a été choisie pour analyser spécifiquement la localisation des zones hautement perméables avec une grande taille de pores dans la muqueuse colitique. Par conséquent, les sites de haute perméabilité de la muqueuse enflammée qui ont été détectés ici englobent des foyers apoptotiques où les colonocytes de surface subissent une apoptose ou une extrusion, un processus connu sous le nom d’anoïkis. Cependant, l’utilisation de sondes de différentes tailles pourrait être un outil utile pour discriminer où le flux paracellulaire et transcellulaire est affecté dans l’intestin. Il est à noter que les cellules subissant l’apoptose/anoikis incorporent toujours du dextran fixable de 10 kDa, ce qui rend la technique utile pour identifier les zones où les membranes plasmocytaires des cellules épithéliales sont compromises. Au cours de l’anoikis, plusieurs molécules de jonction cellule-cellule sont perdues ou redistribuées, et la technique pourrait également être utile pour identifier ces protéines. En fait, nous avons observé ici que l’E-cadhérine est perdue de la membrane plasmique latérale ou internalisée dans l’IEC marquée avec du dextran fixable. Ainsi, les résultats présentés ici démontrent que l’augmentation de la perméabilité intestinale au cours de l’inflammation est affectée par la perturbation de la continuité de la barrière épithéliale provoquée par la mort de l’IEC (apoptose/anoïkis) et pas seulement par la perturbation de la fonction des jonctions serrées14.
À notre connaissance, un protocole similaire utilise l’endomicroscopie laser confocale in vivo pour évaluer la présence de micro-érosions et de lésions épithéliales dans l’intestin en temps réel. Une telle technique permet d’identifier les cellules extrudées dans la muqueuse enflammée et non enflammée de l’intestin. Cependant, en l’absence de marqueurs spécifiques pour évaluer les mécanismes, le type de cellule et même la machinerie impliquée dans la perturbation de l’intégrité épithéliale, ce protocole est très limité8. De plus, en utilisant cette technique, nous ne pouvons pas mesurer le degré de perturbation épithéliale, l’intégrité de la couche de gel muqueux ou la présence de changements subtils qui peuvent ne pas être apparents. De plus, la présence de changements régionaux dans la fonction de barrière pourrait être perdue. Par conséquent, notre protocole apparaît comme une option plus solide pour étudier la perméabilité de la barrière épithéliale dans la muqueuse intestinale. Cependant, il faut tenir compte du fait que notre méthode utilise des tissus fixés et que les observations correspondent donc à des tissus post-mortem ou biopsiés.
En conclusion, le protocole décrit ici fournit une approche simple mais efficace pour visualiser et quantifier les microérosions et la mort cellulaire épithéliale (apoptose/anoïkis) dans l’intestin, ce qui est un outil très utile dans les modèles de maladies dans lesquels la barrière épithéliale intestinale est compromise.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
La recherche a été partiellement soutenue par la subvention SEP-Conacyt (n° 179 à NV/PND) et soutenue par le financement sectoriel pour la recherche et l’éducation via la subvention pour les sciences fondamentales de Conacyt (n° A1-S-20887 à PND). Nous tenons à exprimer notre gratitude à Norma Trejo, M.V.Z. Raúl Castro Luna, M.C. Leonel Martínez, Felipe Cruz Martínez, Victor Manuel García Gómez et M.V.Z. Ricardo Gaxiola Centeno pour leur aide et leur assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| Active Caspase-3 antibody (1:1000) | Cell signaling | 9664 | Cleaved caspase-3 (Asp175)(5AE1) Rabbit mAb |
| Alexa Fluor 488 anti rabbit (1:1000) | Invitrogen | A21206 | |
| Alexa Fluor 594 anti rat (1:1000) | Invitrogen | A21209 | |
| Confocal microscope (Leica TCS SP8x) | Leica | HyD detectors and White Light Laser | |
| E-Cadherin antibody (1:750) | Sigma | MABT26 | Rat monoclonal Delma-1 antibody |
| Ethanol 70% | Generic | ||
| Fixable-Dextran | Invitrogen | D22914 | Dextran, Alexa Fluor, 10,000 MW, anionic, fixable |
| FITC Dextran | Sigma | 46944 | Fluorescein isothiocyanate–dextran M. Wt. 4 kDa |
| Hartmann's Solution | PiSA | HT PiSA | |
| Incubator (AutoFlow NU-8500) | Nuaire | ||
| Microplate reader (Tecan Infinite 200 PRO) | Tecan | ||
| Nunc F96 MicroWell Black and White Polystyrene Plate | ThermoFisher Scientific | ||
| Paraformaldehyde | Sigma | P6148 | |
| Phalloidin (1:1000) | Invitrogen | A12380 | Alexa Fluor 568 Phalloidin |
| RITC Dextran | Sigma | R8881-100MG | Rhodamine B Isothiocyanate-Dextran. M. Wt. 10 kDa |
| Secondary antibodies (1:10000) | Jackson ImmunoResearch Laboratories | HRP-conjugated secondary antibodies | |
| Suture threads | Generic | Braided silk and braided polyester surgical sutures are prefered. | |
| ZO-1 (1:1000) | Invitrogen | 40-2200 | Rb anti-ZO-1 |
Références
- König, J., et al. Human Intestinal Barrier Function in Health and Disease. Clinical and Translational Gastroenterology. 7 (10), 196(2016).
- Gassler, N., et al. Inflammatory bowel disease is associated with changes of enterocytic junctions. American Journal of Physiology-Gastrointestinal and Liver Physiology. 281 (1), 216-228 (2001).
- Negroni, A., Cucchiara, S., Stronati, L. Apoptosis, Necrosis, and Necroptosis in the Gut and Intestinal Homeostasis. Mediators of Inflammation. 2015, 250762(2015).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Choi, C. -H. R., Bakir, I. A., Hart, A. L., Graham, T. A. Clonal evolution of colorectal cancer in IBD. Nature Reviews Gastroenterology & Hepatology. 14 (4), 218-229 (2017).
- González-González, M., Díaz-Zepeda, C., Eyzaguirre-Velásquez, J., González-Arancibia, C., Bravo, J. A., Julio-Pieper, M. Investigating Gut Permeability in Animal Models of Disease. Frontiers in Physiology. 9, (2019).
- Poulsen, S. S., Pedersen, N. T., Jarnum, S. "Microerosions" in rectal biopsies in Crohn's disease. Scandinavian Journal of Gastroenterology. 19 (5), 607-612 (1984).
- Neumann, H., et al. Assessment of Crohn's disease activity by confocal laser endomicroscopy. Inflammatory Bowel Diseases. 18 (12), 2261-2269 (2012).
- Laroui, H., et al. Dextran Sodium Sulfate (DSS) Induces Colitis in Mice by Forming Nano-Lipocomplexes with Medium-Chain-Length Fatty Acids in the Colon. PLoS ONE. 7 (3), (2012).
- John, L. J., Fromm, M., Schulzke, J. -D. Epithelial barriers in intestinal inflammation. Antioxidants & Redox Signaling. 15 (5), 1255-1270 (2011).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145 (2), 407-415 (2013).
- Mateer, S. W., Cardona, J., Marks, E., Goggin, B. J., Hua, S., Keely, S. Ex Vivo Intestinal Sacs to Assess Mucosal Permeability in Models of Gastrointestinal Disease. Journal of Visualized Experiments: JoVE. (108), e53250(2016).
- Devraj, K., Guérit, S., Macas, J., Reiss, Y. An In Vivo Blood-brain Barrier Permeability Assay in Mice Using Fluorescently Labeled Tracers. Journal of Visualized Experiments: JoVE. (132), e57038(2018).
- Stamatovic, S. M., Johnson, A. M., Sladojevic, N., Keep, R. F., Andjelkovic, A. V. Endocytosis of tight junction proteins and the regulation of degradation and recycling. Annals of the New York Academy of Sciences. 1397 (1), 54-65 (2017).
- Srinivasan, B., et al. TEER Measurement Techniques for In Vitro Barrier Model Systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19(2018).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. The Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon