Method Article
Bewertung und Quantifizierung von Mikroepithellücken in der Dickdarmschleimhaut mittels Immunfluoreszenzfärbung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit beschreiben wir eine neue Methode, um die spezifische Stelle sichtbar zu machen, an der die transzelluläre und parazelluläre Permeabilität in der entzündeten Dickdarmschleimhaut erhöht ist. In diesem Assay wenden wir einen 10 kDa Fluoreszenzfarbstoff an, der an ein Lysin-fixierbares Dextran konjugiert ist, um Regionen mit hoher Permeabilität (HPR) in der Dickdarmschleimhaut sichtbar zu machen.
Zusammenfassung
Epithelzellen, die die Darmschleimhaut auskleiden, bilden eine physikalische Barriere, die den luminalen Inhalt vom Interstitium trennt. Eine Beeinträchtigung der Epithelbarriere wurde mit der Entwicklung verschiedener Pathologien wie entzündlichen Darmerkrankungen (IBD) in Verbindung gebracht. In der entzündeten Schleimhaut entsprechen oberflächliche Erosionen oder Mikroerosionen, die die epithelialen Monoschichten korrumpieren, Stellen mit hoher Permeabilität. Mehrere Mechanismen wurden mit der Bildung von Mikroerosionen in Verbindung gebracht, darunter Zellablösung und Apoptose. Diese Mikroerosionen stellen oft mikroskopisch kleine Epithellücken dar, die zufällig im Dickdarm verteilt sind. Die Visualisierung und Quantifizierung dieser Epithellücken hat sich als wichtiges Instrument zur Untersuchung der Funktion der intestinalen Epithelbarriere erwiesen. In dieser Arbeit beschreiben wir eine neue Methode, um die spezifische Stelle sichtbar zu machen, an der die transzelluläre und parazelluläre Permeabilität in der entzündeten Dickdarmschleimhaut erhöht ist. In diesem Assay wenden wir einen 10 kDa Fluoreszenzfarbstoff an, der an ein Lysin-fixierbares Dextran konjugiert ist, um Regionen mit hoher Permeabilität (HPR) in der Dickdarmschleimhaut sichtbar zu machen. Die zusätzliche Verwendung von Zelltodmarkern zeigte, dass HPR apoptotische Herde umfassen, in denen epitheliale Extrusion/Ausscheidung stattfindet. Das hier beschriebene Protokoll bietet einen einfachen, aber effektiven Ansatz zur Visualisierung und Quantifizierung von Mikroerosionen im Darm, was ein sehr nützliches Werkzeug in Krankheitsmodellen ist, in denen die intestinale Epithelbarriere beeinträchtigt ist.
Einleitung
Die Magen-Darm-Schleimhaut bildet eine physikalische Barriere, die das extrazelluläre Milieu und das innere Wirtsmilieu trennt und an der Aufnahme von Nährstoffen, Wasser und Elektrolyten beteiligt ist. Die Darmbarriere umfasst eine Schleimschicht, die aus Glykoproteinen besteht, eine Monoschicht aus Epithelzellen, und die darunter liegende Lamina propria sind Immun- und Stromazellen. Die Darmepithelzellen, die die physikalische Barriere bilden, sind durch verschiedene Proteinkomplexe miteinander verbunden, zu denen die Adherens-Verbindung (AJ), die Tight Junction (TJ) und die Desmosomen (DMs) gehören. Eine Beeinträchtigung der epithelialen Barrierefunktion erhöht die Darmpermeabilität und ermöglicht die Translokation von Schadstoffen und Krankheitserregern aus dem Lumen in das Interstitium1. Es gibt immer mehr Krankheiten, bei denen die Epithelbarriere beeinträchtigt ist, wie z. B. die entzündlichen Darmerkrankungen (CED) wie Morbus Crohn (CD), Colitis ulcerosa (UC) und unbestimmte Colitis (IC). Die Inzidenz von CED nimmt weltweit zu, wobei die Prävalenz im Westen bei 0,5 % liegt. Obwohl die Ursachen der IBD unklar sind, trägt die übermäßige Immun-/Entzündungsreaktion, die in der Darmwand ausgelöst wird, direkt zur Störung der Epithelbarriere bei, indem sie die Wiederherstellung der intestinalen Epithelhomöostase einschränkt 2,3,4. Darüber hinaus haben Patienten mit langjähriger Darmentzündung ein hohes Risiko, an Darmkrebs (CRC) zu erkranken5. Andere Pathologien, die mit einer Störung der Darmepithelbarriere verbunden sind, sind das Reizdarmsyndrom, Fettleibigkeit, Zöliakie, Nicht-Zöliakie-Glutensensitivität und Nahrungsmittelallergien6. Aus diesen Gründen besteht ein dringender Bedarf an der Entwicklung experimenteller Ansätze, die es ermöglichen, die Integrität der intestinalen Epithelbarriere in Tiermodellen zu analysieren, die die beim Menschen auftretende Pathogenese nachahmen.
In dieser Arbeit untersuchten wir mit einer einfachen Technik die gastrointestinale passive parazelluläre und die transzelluläre Permeabilität, die mit einem Entzündungsprozess im Dickdarmepithel verbunden ist. Um die transmurale Strömung von Makromolekülen zu untersuchen, haben wir die passive Diffusion von FITC-Dextran (4 kDa) und RITC-Dextran (10 kDa) in Dickdarmsäcken ex vivo gemessen. Darüber hinaus haben wir durch die Injektion eines fluoreszierenden 10 kDa Lysin-fixierbaren Dextrans in das Lumen der Darmsäcke gezielt die Bereiche mit hoher Permeabilität in der entzündeten Schleimhaut identifiziert. Durch die Verwendung von Apoptosemarkern und Antikörpern gegen AJ-Proteine konnten wir zeigen, dass Bereiche mit hoher Permeabilität in der entzündeten Schleimhaut bestimmten Regionen entsprechen, in denen Epithelzellen Apoptose durchlaufen und Zell-Zell-Verbindungen gestört sind. Diese neue Technik kann verwendet werden, um die Integrität des Epithels in jedem Modell zu bewerten, in dem die Darmepithelbarriere beeinträchtigt ist.
Protokoll
Alle Verfahren wurden vom CINVESTAV Institutional Committee for Care and Use of Laboratory Animals (CICUAL) überprüft und genehmigt.
1. Vorbereitung von Materialien und Reagenzien
- Hartmann-Lösung (130 mM NaCl, 28 mM Laktat, 4 mM KCl, 1,5 mM CaCl2) auf 37 °C vorwärmen, während sie mit 95 % O2/5 % CO2 sprudelt. Halten Sie den physiologischen pH-Wert (7,4) für die Lösung aufrecht.
- Zur Analyse der passiven parazellulären Permeabilität wird eine Arbeitslösung hergestellt, indem 1 mg/ml FITC-Dextran (4 kDa) und 1 mg/ml RITC-Dextran (10 kDa) in vorgewärmter Hartmann-Lösung gelöst werden.
- Bereiten Sie eine 4 μg/ml-Lösung von Alexa Fluor647 Fixable-Dextran (10 kDa) in Hartmann-Lösung vor. Bewahren Sie Arbeitslösungen in einem konischen 15-ml-Röhrchen auf und schützen Sie sie bis zum Gebrauch vor Licht.
HINWEIS: Es sind 300 μl Arbeitslösung pro Doppelpunkt erforderlich. - Bereiten Sie eine chirurgische Naht vor, indem Sie zwei 5 cm lange Abschnitte für jeden Dickdarm schneiden. Schlingen Sie die Nähte zu einem ungeschlossenen Knoten.
2. Dissektion und Aufbereitung des gastrointestinalen Tracs
- Halten Sie feste Nahrung 6 Stunden lang zurück, bevor Sie die Mäuse einschläfern. Stellen Sie ad libitum Trinkwasser zur Verfügung.
HINWEIS: Wenn möglich, setzen Sie die Mäuse auf Nährgelpräparate (gereinigtes Wasser, Melasse, Kürbis, Maissirup, Sonnenblumenkerne, Weizenprotein, Pflanzenöl, Lebensmittelsäure, Hydrokolloide, Elektrolyte, Maisfasern, NIH-31M Mineral Mix, NIH-31M Vitamin Mix). - Einschläferung von Mäusen in einer CO2 -Kammer, gefolgt von einer Gebärmutterhalsluxation gemäß den institutionellen Ethikprotokollen.
- Sterilisieren Sie den Bauch und den Brustkorb mit 70% Ethanol.
- Machen Sie mit einer Schere einen Schnitt in der Mitte des Bauches und legen Sie die Bauchhöhle frei.
- Trennen und präparieren Sie den Dickdarm zur Orientierung, indem Sie am Ende des Dünndarms (Endteil des Ileums) direkt vor dem Blinddarm und dann am Analrand schneiden. Entfernen Sie das Mesenterium vorsichtig mit einer chirurgischen Pinzette und legen Sie den Dickdarm in die Hartmann-Lösung.
- Um die Konsistenz zwischen den Tieren zu wahren, ist es wichtig, ähnliche Abschnitte zu identifizieren und zur Bewertung der Durchlässigkeit zu verwenden. Es ist sehr empfehlenswert, Regionen in der Nähe des Blinddarms zu verwenden.
- Verwenden Sie eine Insulinspritze, die mit einer stumpfen Kunststoffkanüle ausgestattet ist, um den im Dickdarm vorhandenen Luminalgehalt sanft zu spülen. Ist der Stuhl fest, drücken Sie vorsichtig mit Hilfe einer stumpfen Pinzette. Nachdem der Kot entfernt wurde, 3 Mal mit 400 μl Hartmann-Lösung waschen.
- Binden Sie die proximale Region (die dem Blinddarm am nächsten liegt) ab und platzieren Sie eine vorgebundene Nahtschlaufe im distalen Bereich des Dickdarms. Füllen Sie mit Hilfe einer Spritze, die mit einer stumpfen Kunststoffkanüle ausgestattet ist, den Darmsack mit der Lösung, die die Wunschsonde enthält. Entfernen Sie vorsichtig die Kunststoffkanüle und binden Sie die Schlaufe im distalen Bereich fest.
- Legen Sie den Darmsack in ein konisches 15-ml-Röhrchen mit 6 mL Hartmann-Lösung und inkubieren Sie ihn 1 Stunde lang, um den passiven parazellulären Fluss von FITC/RITC-Dextran zu bewerten, oder 30 Minuten, um den Fluss des Alexa Fluor Fixable-Dextran zu analysieren.
- Halten Sie die konischen Röhren, die die Darmsäcke enthalten, bei 37 °C mit 5 % CO2 und schützen Sie sie vor Licht.
- Zur Messung der passiven Permeabilität mittels FITC/RITC-Dextran. Bei 0 und 60 min wird eine 100-μl-Probe aus dem konischen Röhrchen entnommen und auf eine 96-Well-Platte umgefüllt. Fügen Sie 100 μl frisches Medium wieder hinzu, um das verlorene Volumen zu ersetzen.
- Messung von Proben und Standards für FITC/RITC auf einem Fluoreszenzplatten-Reader (FITC-Anregung/-Emission: 495 nm/519 nm; RITC Anregung/Emission: 570/595 nm).
- Um die passive Permeabilität mit Alexa Fluor 647 Fixable-Dextran zu messen, entfernen Sie den Darm, schneiden Sie in der Nähe des chirurgischen Krawattenknotens und schneiden Sie den Darm so auf, dass das Lumen freigelegt wird, um die Lösung mit der Sonde zu entfernen. Waschen Sie das Darmlumen 2 Mal mit kalter Hartmann-Lösung.
- Legen Sie das Gewebe in eine Tissue-Form, die zuvor mit Optimum Cutting Temperature Compound (O.C.T.) gefüllt wurde. Richten Sie das Gewebe vertikal oder horizontal entsprechend der zu schneidenden Seite aus. Lagern Sie die Proben bei -80 °C.
3. Immunfluoreszenz-Färbung
- Fixierte Schnitte von 20 Mikrometern mit 3,7 % Paraformaldehyd (PFA) für 20 min bei Raumtemperatur und dann 3 Mal mit kalter phosphatgepufferter Kochsalzlösung waschen (PBS; 37 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4 und 1,8 mM KH2 PO4).
HINWEIS: Vertikale Schnitte aus dem Darm neigen dazu, sich zu lösen, wenn die Waschungen sehr stark sind. - Mit 0,2% TX-100/PBS 12 min bei Raumtemperatur permeabilisieren und anschließend 3 mal mit kaltem PBS waschen.
- Mit 0,2 % BSA/PBS 1 Stunde bei Raumtemperatur blockieren.
- Den Primärantikörper in Blockierungslösung verdünnen und 1 h bei Raumtemperatur inkubieren. 3 Mal mit kaltem PBS waschen.
- 1 h mit Sekundärantikörpern in Blockierungslösung inkubieren. 3 Mal mit kaltem PBS waschen.
- Tragen Sie Eindeckmedium auf die Schnitte auf und versiegeln Sie sie mit einem Deckglas. Die Objektträger können bis zu 3 Monate bei -20 °C gelagert werden.
Ergebnisse
In der entzündeten Schleimhaut beeinträchtigen oberflächliche Erosionen oder Mikroerosionen die Integrität der Epithelzell-Monoschicht und stellen Stellen mit hoher Permeabilität dar 7,8. Um solche Möglichkeiten zu bewerten, analysierten wir die passive Permeabilität in der entzündeten Dickdarmschleimhaut in einem Dextran-Natriumsulfat-Colitis-Mausmodell. Kurz gesagt, C57BL/6J-Mäuse erhielten 5 Tage lang 2,5 % DSS (w/v, 40-50 kDa), gelöst im Trinkwasser. Dieses Modell zeichnet sich dadurch aus, dass es eine Schädigung der Epithelzellen und eine Dysfunktion der Epithelbarriere im Dickdarm induziert, was wiederum den Eintritt luminaler Antigene in die Lamina propria ermöglicht. Ein solcher Prozess führt zu einer Stimulation des Immunsystems, was zur Sekretion von proinflammatorischen Zytokinen und Chemokinen führt, die die Epithelschädigung weiter verstärken9. Wie in Abbildung 1A gezeigt, zeigten die Mäuse, die DSS ausgesetzt waren, nach 5-tägiger Behandlung einen Körpergewichtsverlust von ~12%. Stuhlblut und Durchfall wurden auch bei allen DSS-behandelten Mäusen nachgewiesen. Darüber hinaus zeigten kolitische Mäuse eine statistisch signifikante Verringerung der Dickdarmlänge (Abbildung 1B). Somit stieg der Krankheitsaktivitätsindex (DAI), der den Gewichtsverlust der Tiere, die Stuhlkonsistenz, Durchfall, okkultes Blut und grobe rektale Blutungen umfasst, nach 5-tägiger DSS-Behandlung an (Abbildung 1C). Die histopathologische Analyse ergab das Vorhandensein von Epithelerosionen, Ulzerationen, Immuninfiltrat und Ödemen in der Dickdarmschleimhaut von kolitischen Mäusen (Abbildung 2).
Eine Störung der Epithelbarriere, einschließlich der Apoptose von Darmepithelzellen und dysfunktionaler interzellulärer Verbindungen, wurde für die Zunahme der passiven Permeabilität in der entzündeten Mukosa verantwortlich gemacht10,11. Daher haben wir indirekt die Permeabilität in der Dickdarmschleimhaut gemessen, indem wir den passiven Fluss von fluoreszenzmarkierten Sonden (FITC und RITC-Dextran) überwacht haben. Wie in Abbildung 3A gezeigt, erhöhte der nach der Verabreichung von DSS induzierte Entzündungsprozess die transmurale Permeabilität, wie die Zunahme des passiven Flusses von FITC-Dextran (4 kDa) und RITC-Dextran (10 kDa) zeigt. Darüber hinaus bestätigte die Western-Blot-Analyse, wie in Abbildung 3B gezeigt, die Zunahme der Apoptose in der Dickdarmschleimhaut von DSS-behandelten Mäusen, was durch das Vorhandensein von aktiver Caspase 3 (Acasp-3) gezeigt wurde. Die Daten deuten daher stark darauf hin, dass während der Entzündung der apoptotische Prozess, der in der entzündeten Schleimhaut ausgelöst wird, zur Störung der epithelialen Barrierefunktion beiträgt.
Als nächstes untersuchten wir die Lokalisation der Bereiche mit hoher Permeabilität in der entzündeten Schleimhaut, indem wir den Fluss eines fluoreszierenden fixierbaren Lysin-Dextrans von 10 kDa analysierten. Wir haben ein 10 kDa-Molekül verwendet, um die Strömung nur auf hochdurchlässige Bereiche mit hoher Porengröße zu beschränken. Bei Kontrollmäusen wurde das fixierbare Dextran an der apikalen Oberfläche der Dickdarmkrypten (weiße Pfeile) zurückgehalten und durch das enge Bündel von Aktinfilamenten an der Bürstengrenze des Mikrovillus begrenzt (Abbildung 4A). Bei kolitischen Mäusen drang das fixierbare Dextran jedoch in das Zytosol der Dickdarmepithelzellen ein, was zeigt, dass eine Entzündung einen aktiven transzellulären Fluss induziert (Sternchen). Bei weiteren Analysen beobachteten wir das Vorhandensein von fixierbarem Dextran im Interstitium bei kolitischen Mäusen (Pfeile), nicht jedoch bei Kontrolltieren, was auf einen Nettofluss von der luminalen zur interstitiellen Seite hinweist (Abbildung 4B). Im undichten Bereich wurde das zytosolische fixierbare Dextran eindeutig in Epithelzellen eingebaut, die in Mikroregionen auf der luminalen Seite gruppiert waren, und diese Zellen waren positiv für den apoptotischen Marker Acasp-3 (Abbildung 4C). Wichtig ist, dass wir auch an der Oberfläche in den Bereichen mit hoher Permeabilität, in denen die Epithelzellen Apoptose durchlaufen (apoptotische Herde), eine aberrante Verteilung für E-Cadherin (Abbildung 4C, Pfeile) und einen Effekt beobachteten, der im Kontrollgewebe nicht beobachtet wurde. Darüber hinaus zeigten die Ergebnisse, dass das fixierbare Dextran in Anoikis-Zellen internalisiert wurde, die am Lumen vorhanden waren, und einige dieser Zellen zeigten eine schwache zytosolische Färbung für E-Cadherin (Pfeilspitze) (Abbildung 4D). Im Gegensatz zu E-Cadherin zeigten die mit zytosolischem fixierbarem Dextran angereicherten Darmepithelzellen eine klare Färbung für ZO-1 am TJ (Abbildung 4E), für ZO-1 wurde keine Färbung für ZO-1 in abgelösten Zellen nachgewiesen (Daten nicht gezeigt). Zusammenfassend haben wir gezeigt, dass fixierbares Dextran ein gutes Werkzeug ist, um Stellen mit hoher Permeabilität im Darm zu identifizieren und in apoptotischen und Anoikiszellen internalisiert wird.

Abbildung 1. Induktion einer akuten Kolitis mit DSS. (A) Tägliche Veränderungen des Körpergewichts von C57BL/6J-Mäusen, die 5 Tage lang mit 2,5 % DSS behandelt wurden. Das Körpergewicht wird als Prozentsatz des Körpergewichts am Tag 0 ausgedrückt. (B) Makroskopische Veränderungen, die im Dickdarm von Mäusen beobachtet wurden, die 5 Tage lang mit DSS behandelt wurden. Obere Platte. Repräsentatives Bild von Dickdarmen, die von Kontroll- und kolitischen Mäusen entnommen wurden. Untere Platte. Eine Verkürzung der Dickdarmlänge wurde bei DSS-behandelten Mäusen beobachtet. (C) Klinischer Score (Krankheitsaktivitätsindex; DAI) über einen Zeitraum von 5 Tagen nach einer oralen Behandlung mit Wasser (Kontrollen; n 5) oder 2,5 % Dextran-Natriumsulfat (DSS). Der DAI, der den Verlust des Körpergewichts, die Konsistenz, den Stuhl und das Blut im Kot umfasst, war bei kolitischen Mäusen erhöht. Die Daten werden als Mittelwerte ± SEM dargestellt (n=5). Die P-Werte wurden unter Verwendung einer bidirektionalen ANOVA mit dem Post-hoc-Test (A) von Sidak und dem t-Test von Student (B, C) berechnet. **p < 0,01; p < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
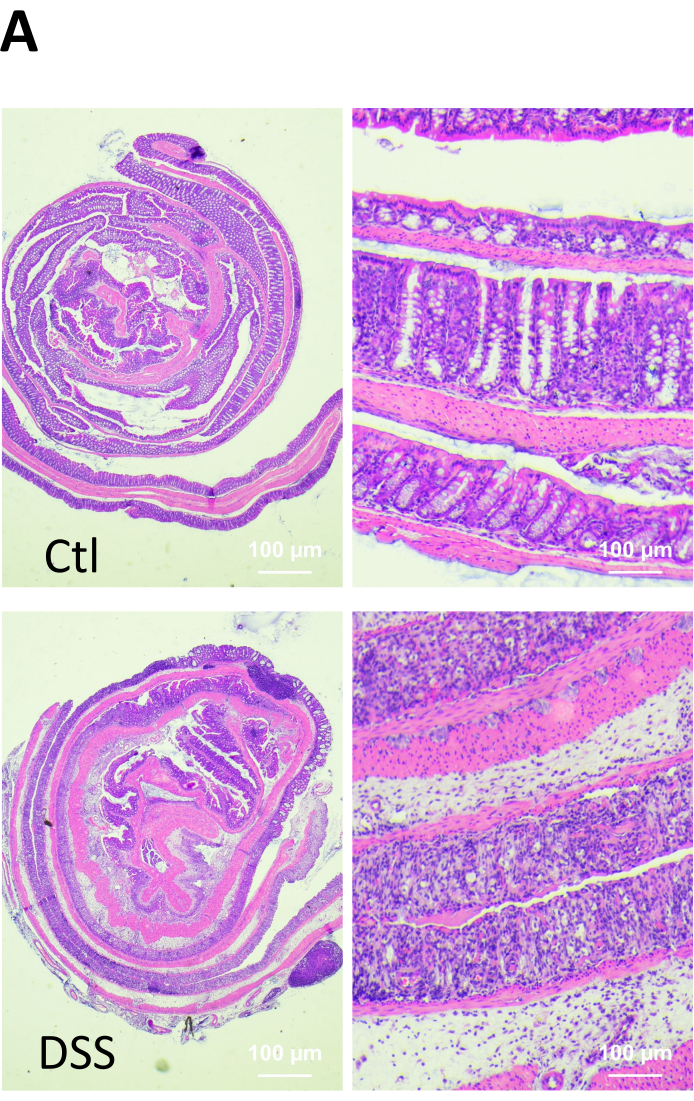
Abbildung 2. Mikroskopische Veränderungen in der Dickdarmschleimhaut von gesunden und DSS-behandelten Mäusen. Am Ende des Versuchs wurden die Tiere eingeschläfert und die Gewebeproben fixiert, in Paraffin eingebettet, geschnitten und mit Hämatoxylin und Eosin (H&E) gefärbt. Infiltration von Entzündungszellen (Pfeil), Ulzerationen (Pfeilspitze) und Verlust der kryptalen Architektur (Erosion, e) wurden im Dickdarm von DSS-behandelten Mäusen beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3. Der passive parazelluläre Transport von fluoreszenzmarkiertem Dextran ist während der Kolitis verstärkt. (A) Analyse des passiven parazellulären Transports von fluoreszenzmarkiertem Dextran in Darmsäcken von gesunden und kolitischen Mäusen. Die Darmsäcke wurden aus Dickdarm hergestellt, die von altersgleichen C57BL/6J-Mäusen entnommen und 5 Tage lang mit Wasser oder 2,5 % DSS behandelt wurden. Die Säcke wurden mit einer Lösung beladen, die 1 mg/ml FITC-Dextran-4 kDa (MW 4.400 Da) und 1 mg/ml RITC-Dextran-10 kDa (MW 10.000 Da) enthielt. Der passive parazelluläre Fluss der Fluoreszenzsonden wurde nach 60 min gemessen. Die parazelluläre Permeabilität ist nach Colitis-Induktion erhöht. (B) Bewertung der aktiven Caspase-3 (Acasp-3) in der Dickdarmschleimhaut von DSS-behandelten Mäusen. Ganzzelllysate wurden aus Dickdarmproben hergestellt, die von altersgleichen C57BL/6J-Mäusen entnommen wurden, die 5 Tage lang mit Wasser oder 2,5 % DSS behandelt wurden. 30 μg Protein wurden geladen und in 12% SDS-Polyacrylamid-Gele getrennt, auf eine Nitrocellulosemembran übertragen und für Acasp-3 Western blotted. Als Ladesteuerung wurde GAPDH eingesetzt. Das Vorhandensein von aktivem Caspase-3 ist nach Colitis-Induktion erhöht. n = 5. Die Daten werden als Mittelwerte ± SEM dargestellt (n=5). Die P-Werte wurden unter Verwendung einer bidirektionalen ANOVA mit dem Post-hoc-Test (A) und dem Mann-Whitney-Test (B) von Sidak berechnet. *p < 0,05 ***p < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
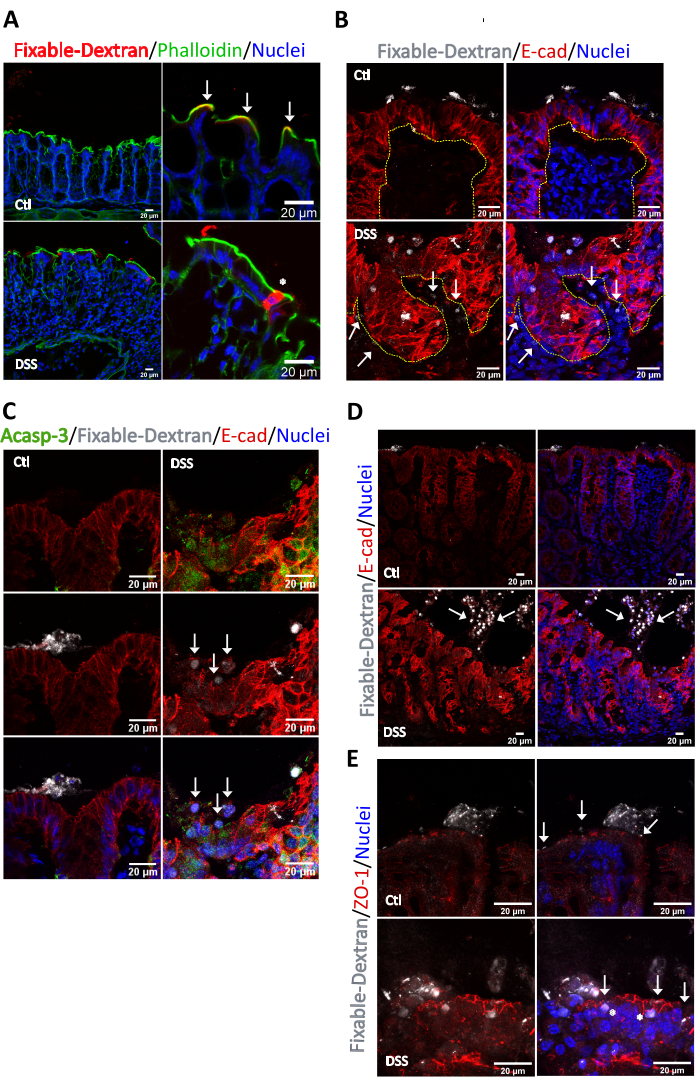
Abbildung 4. Identifizierung von Permeabilitätsstellen in der Dickdarmschleimhaut von gesunden und DSS-behandelten Mäusen. Darmsäcke wurden aus Dickdarm hergestellt, der von altersgleichen C57BL/6J-Mäusen entnommen wurde, die 6 Tage lang mit Wasser oder 2,5 % DSS behandelt wurden. Die Säcke wurden mit einer Lösung beladen, die 4 μg/ml fixierbares Alexa Fluor 647 Dextran, 10 kDa, enthielt. Der passive parazelluläre Fluss der Fluoreszenzsonde wurde nach 30 min gestoppt. Die Dickdarmsäcke wurden fixiert, in OCT eingebettet, geschnitten und auf Immunfluoreszenz gefärbt. (A) Unter Kontrollbedingungen wurde das fixierbare Dextran (rot) in enger Apposition mit (Pfeilen) des apikalen Aktinrings (grün) nachgewiesen, der die apikale Oberfläche der Kolonozyten zur luminalen Seite hin begrenzt. Nach der DSS-Behandlung war die Kontinuität des apikalen Aktinrings gestört (Sternchen). Das fixierbare Dextran dringt in das Zytosol der Oberflächenepithelzellen ein. (B) Analyse von fixierbarem Dextran und E-Cadherin an Stellen mit hoher Permeabilität. Unter Kontrollbedingungen wurde das fixierbare Dextran auf der luminalen Seite beibehalten. In der kolitischen Mukosa wurde fixierbares Dextran am Zytosol von Epithelzellen nachgewiesen, die die Kryptenoberfläche auskleiden, und in mehreren Regionen des Interstitiums (Pfeile). Epithelzellen, die fixierbares Dextran enthielten, befanden sich an der Kryptenoberfläche und zeigten eine aberrante Verteilung von E-Cadherin. Die gestrichelte Linie begrenzt die Krypta. n = 5. (C) Analyse von aktiver Caspase-3 und E-Cadherin an den Stellen mit hoher Permeabilität, die mit dem fixierbaren Dextran in der Dickdarmschleimhaut von kolitischen Mäusen identifiziert wurden. Aktive Caspase-3 (grün) wurde an den Stellen mit hoher Permeabilität angereichert. Pfeile markieren Epithelzellen mit aberranter Färbung für E-Cadherin, die an der Kryptenoberfläche vorhanden waren. n = 5. (D) Analyse von fixierbarem Dextran und E-Cadherin. Unter Kontrollbedingungen wurde das fixierbare Dextran auf der luminalen Seite beibehalten. In der kolitischen Mukosa wurde fixierbares Dextran am Zytosol abgelöster Epithelzellen nachgewiesen, die sich am Darmlumen befinden (Pfeile). Epithelzellen, die mit fixierbarem Dextran markiert waren, zeigten ein deutliches Vorhandensein von zytosolischem E-Cadherin. n = 5. (E) Analyse von fixierbarem Dextran und ZO-1. Unter Kontrollbedingungen wurde das fixierbare Dextran an der luminalen Seite oberhalb des TJ zurückgehalten (markiert durch ZO-1). In der kolitischen Mukosa wurde fixierbares Dextran am Zytosol abgelöster Epithelzellen und in Epithelzellen an der Kryptenoberfläche nachgewiesen (Sternchen). ZO-1 lokalisiert am TJ unter Kontroll- und Kolitbedingungen (Pfeile). n = 5. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Epithelhomöostase, die aus dem Gleichgewicht der Zellproliferation und der epithelialen Apoptose resultiert, erhält eine ordnungsgemäße und funktionelle Darmbarriere. Viele klinische Erkrankungen, wie z. B. IBD, gehen mit Veränderungen der Darmpermeabilität, Entzündungen der Schleimhaut und Störungen der epithelialen Homöostase einher oder sind dadurch gekennzeichnet1. Das Zusammenspiel dieser Prozesse ist nach wie vor höchst umstritten. Daher ist die Entwicklung neuer Forschungsansätze, um diese Prozesse richtig zu untersuchen, ein wichtiges Thema in diesem Bereich. Es gibt mehrere veröffentlichte Protokolle zur indirekten Untersuchung der Darmpermeabilität während einer Entzündung, wie z. B. die Messung des transepithelialen elektrischen Widerstands in epithelialen Monoschichten und die Quantifizierung von hydrophoben Fluorophor-markierten Sonden in Darmorganoiden, Mausdärmen und Darmsäcken 10,11,12,13. Obwohl gezeigt wurde, dass die Aufnahme einer Substanz in der Darmschleimhaut zu- oder abnimmt, sind diese Methoden nicht in der Lage, andere wichtige Ereignisse zu analysieren, die direkt zu den Veränderungen der Durchlässigkeit beitragen. Da diese Studien z. B. nicht die spezifischen Bereiche identifizieren, in denen die Integrität des Epithels beeinträchtigt ist, schränken sie das Verständnis der Transportmechanismen oder der biologischen Funktionen ein, die für die Beeinflussung der Darmpermeabilität verantwortlich sind. Da die Darmpermeabilität von Region zu Region stark variieren kann, könnten diese Studien zu Fehlern wie falsch positiven Ergebnissen führen. Daher wird die Ergänzung dieser Studien durch nicht-quantitative ortsspezifische Bewertungen wie die hier beschriebene es ermöglichen, den genauen Bereich zu bestimmen, in dem der Stofffluss im geschädigten Epithel stattfindet. Dieser neue Permeabilitätstest ermöglicht nicht nur ein besseres Verständnis der regionalen Schleimhautintegrität bei Verdauungserkrankungen, sondern auch die Untersuchung der gestörten Mechanismen, die zu einem solchen Prozess beitragen.
Die beschriebene neue Technik ist eine Kombination aus zwei zuvor beschriebenen Techniken, der Präparation von Darmsäcken zur Beurteilung der Schleimhautbarrierefunktion ex vivo12 und der Verwendung von fixierbaren fluoreszierenden Tracern zur Analyse der Gefäßpermeabilität des Gehirns13. Mit dieser Technik konnten wir beobachten, dass eine Beeinträchtigung der Epithelbarriere nach IEC-Schädigung den allgemeinen Fluss von luminalen Antigenen zum interstitiellen Kompartiment verstärkt. Die Verwendung eines 10 kDa fixierbaren Dextrans wurde gewählt, um spezifisch die Lokalisation von hochpermeablen Bereichen mit großer Porengröße in der kolitischen Schleimhaut zu analysieren. Daher umfassen die hier nachgewiesenen Stellen mit hoher Permeabilität in der entzündeten Schleimhaut apoptotische Herde, an denen Oberflächenkolonozyten Apoptose oder Extrusion durchlaufen, ein Prozess, der als Anoikis bekannt ist. Die Verwendung von Sonden unterschiedlicher Größe könnte jedoch ein nützliches Werkzeug sein, um zu unterscheiden, wo der parazelluläre und transzelluläre Fluss im Darm beeinflusst ist. Bemerkenswert ist, dass Zellen, die sich einer Apoptose/Anoikis unterziehen, immer 10 kDa fixierbares Dextran enthalten, was die Technik nützlich macht, um die Bereiche zu identifizieren, in denen die Plasmazellmembranen der Epithelzellen beeinträchtigt sind. Während der Anoikis gehen mehrere Zell-Zell-Verbindungsmoleküle verloren oder werden umverteilt, und die Technik könnte auch hilfreich sein, um diese Proteine zu identifizieren. Tatsächlich haben wir hier beobachtet, dass E-Cadherin aus der lateralen Plasmamembran verloren geht oder in IEC internalisiert wird, das mit fixierbarem Dextran markiert ist. Die hier vorgestellten Ergebnisse zeigen somit, dass die Erhöhung der Darmpermeabilität während einer Entzündung durch die Störung der epithelialen Barrierekontinuität durch den IEC-Tod (Apoptose/Anoikis) und nicht nur durch eine Störung der Funktion der Tight Junctionsbeeinflusst wird 14.
Unseres Wissens verwendet ein ähnliches Protokoll die konfokale Laser-Endomikroskopie in vivo , um das Vorhandensein von Mikroerosionen und Epithelschäden im Darm in Echtzeit zu bewerten. Eine solche Technik identifiziert extrudierende Zellen in der entzündeten und nicht entzündeten Darmschleimhaut. In Ermangelung spezifischer Marker zur Bewertung der Mechanismen, des Zelltyps und sogar der Maschinerie, die an der Störung der epithelialen Integrität beteiligt ist, ist dieses Protokoll jedoch sehr begrenzt8. Darüber hinaus können wir mit dieser Technik nicht den Grad der epithelialen Störung, die Integrität der Schleimhautgelschicht oder das Vorhandensein subtiler Veränderungen messen, die möglicherweise nicht sichtbar sind. Auch das Vorhandensein regionaler Veränderungen in der Barrierefunktion könnte verloren gehen. Daher scheint unser Protokoll eine stärkere Option zu sein, um die Durchlässigkeit der epithelialen Barriere in der Darmschleimhaut zu untersuchen. Es muss jedoch berücksichtigt werden, dass bei unserer Methode fixiertes Gewebe verwendet wird und daher die Beobachtungen postmortalem oder biopsiertem Gewebe entsprechen.
Zusammenfassend lässt sich sagen, dass das hier beschriebene Protokoll einen einfachen, aber effektiven Ansatz zur Visualisierung und Quantifizierung von Mikroerosionen und Epithelzelltod (Apoptose/Anoikis) im Darm bietet, was ein sehr nützliches Werkzeug in Krankheitsmodellen ist, in denen die intestinale Epithelbarriere beeinträchtigt ist.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Forschung wurde teilweise durch den SEP-Conacyt-Zuschuss (Nr. 179 an NV/PND) und durch die sektorielle Finanzierung für Forschung und Bildung über den Zuschuss für Grundlagenforschung von Conacyt (Nr. A1-S-20887 an PND) unterstützt. Wir danken Norma Trejo, M.V.Z. Raúl Castro Luna, M.C. Leonel Martínez, Felipe Cruz Martínez, Victor Manuel García Gómez und M.V.Z. Ricardo Gaxiola Centeno für ihre Hilfe und technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Active Caspase-3 antibody (1:1000) | Cell signaling | 9664 | Cleaved caspase-3 (Asp175)(5AE1) Rabbit mAb |
| Alexa Fluor 488 anti rabbit (1:1000) | Invitrogen | A21206 | |
| Alexa Fluor 594 anti rat (1:1000) | Invitrogen | A21209 | |
| Confocal microscope (Leica TCS SP8x) | Leica | HyD detectors and White Light Laser | |
| E-Cadherin antibody (1:750) | Sigma | MABT26 | Rat monoclonal Delma-1 antibody |
| Ethanol 70% | Generic | ||
| Fixable-Dextran | Invitrogen | D22914 | Dextran, Alexa Fluor, 10,000 MW, anionic, fixable |
| FITC Dextran | Sigma | 46944 | Fluorescein isothiocyanate–dextran M. Wt. 4 kDa |
| Hartmann's Solution | PiSA | HT PiSA | |
| Incubator (AutoFlow NU-8500) | Nuaire | ||
| Microplate reader (Tecan Infinite 200 PRO) | Tecan | ||
| Nunc F96 MicroWell Black and White Polystyrene Plate | ThermoFisher Scientific | ||
| Paraformaldehyde | Sigma | P6148 | |
| Phalloidin (1:1000) | Invitrogen | A12380 | Alexa Fluor 568 Phalloidin |
| RITC Dextran | Sigma | R8881-100MG | Rhodamine B Isothiocyanate-Dextran. M. Wt. 10 kDa |
| Secondary antibodies (1:10000) | Jackson ImmunoResearch Laboratories | HRP-conjugated secondary antibodies | |
| Suture threads | Generic | Braided silk and braided polyester surgical sutures are prefered. | |
| ZO-1 (1:1000) | Invitrogen | 40-2200 | Rb anti-ZO-1 |
Referenzen
- König, J., et al. Human Intestinal Barrier Function in Health and Disease. Clinical and Translational Gastroenterology. 7 (10), 196(2016).
- Gassler, N., et al. Inflammatory bowel disease is associated with changes of enterocytic junctions. American Journal of Physiology-Gastrointestinal and Liver Physiology. 281 (1), 216-228 (2001).
- Negroni, A., Cucchiara, S., Stronati, L. Apoptosis, Necrosis, and Necroptosis in the Gut and Intestinal Homeostasis. Mediators of Inflammation. 2015, 250762(2015).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Choi, C. -H. R., Bakir, I. A., Hart, A. L., Graham, T. A. Clonal evolution of colorectal cancer in IBD. Nature Reviews Gastroenterology & Hepatology. 14 (4), 218-229 (2017).
- González-González, M., Díaz-Zepeda, C., Eyzaguirre-Velásquez, J., González-Arancibia, C., Bravo, J. A., Julio-Pieper, M. Investigating Gut Permeability in Animal Models of Disease. Frontiers in Physiology. 9, (2019).
- Poulsen, S. S., Pedersen, N. T., Jarnum, S. "Microerosions" in rectal biopsies in Crohn's disease. Scandinavian Journal of Gastroenterology. 19 (5), 607-612 (1984).
- Neumann, H., et al. Assessment of Crohn's disease activity by confocal laser endomicroscopy. Inflammatory Bowel Diseases. 18 (12), 2261-2269 (2012).
- Laroui, H., et al. Dextran Sodium Sulfate (DSS) Induces Colitis in Mice by Forming Nano-Lipocomplexes with Medium-Chain-Length Fatty Acids in the Colon. PLoS ONE. 7 (3), (2012).
- John, L. J., Fromm, M., Schulzke, J. -D. Epithelial barriers in intestinal inflammation. Antioxidants & Redox Signaling. 15 (5), 1255-1270 (2011).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145 (2), 407-415 (2013).
- Mateer, S. W., Cardona, J., Marks, E., Goggin, B. J., Hua, S., Keely, S. Ex Vivo Intestinal Sacs to Assess Mucosal Permeability in Models of Gastrointestinal Disease. Journal of Visualized Experiments: JoVE. (108), e53250(2016).
- Devraj, K., Guérit, S., Macas, J., Reiss, Y. An In Vivo Blood-brain Barrier Permeability Assay in Mice Using Fluorescently Labeled Tracers. Journal of Visualized Experiments: JoVE. (132), e57038(2018).
- Stamatovic, S. M., Johnson, A. M., Sladojevic, N., Keep, R. F., Andjelkovic, A. V. Endocytosis of tight junction proteins and the regulation of degradation and recycling. Annals of the New York Academy of Sciences. 1397 (1), 54-65 (2017).
- Srinivasan, B., et al. TEER Measurement Techniques for In Vitro Barrier Model Systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19(2018).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. The Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten