Method Article
Evaluación y cuantificación de micro brechas epiteliales en la mucosa colónica mediante tinción de inmunofluorescencia
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, describimos un nuevo método para visualizar la ubicación específica donde se mejora la permeabilidad transcelular y paracelular en la mucosa colónica inflamada. En este ensayo, aplicamos un colorante fluorescente de 10 kDa conjugado con un dextrano fijable en lisina para visualizar regiones de alta permeabilidad (HPR) en la mucosa colónica.
Resumen
Las células epiteliales que recubren la mucosa intestinal crean una barrera física que separa el contenido luminal del intersticio. El deterioro de la barrera epitelial se ha asociado con el desarrollo de diversas patologías como las enfermedades inflamatorias intestinales (EII). En la mucosa inflamada, las erosiones superficiales o microerosiones que corrompen las monocapas epiteliales corresponden a sitios de alta permeabilidad. Varios mecanismos han sido implicados en la formación de microerosiones, incluyendo el desprendimiento celular y la apoptosis. Estas microerosiones a menudo representan brechas epiteliales microscópicas distribuidas aleatoriamente en el colon. La visualización y cuantificación de esas brechas epiteliales se ha convertido en una herramienta importante para investigar la función de la barrera epitelial intestinal. Aquí, describimos un nuevo método para visualizar la ubicación específica donde se mejora la permeabilidad transcelular y paracelular en la mucosa colónica inflamada. En este ensayo, aplicamos un colorante fluorescente de 10 kDa conjugado con un dextrano fijable en lisina para visualizar regiones de alta permeabilidad (HPR) en la mucosa colónica. El uso adicional de marcadores de muerte celular reveló que la HPR abarca focos apoptóticos donde se produce la extrusión/desprendimiento epitelial. El protocolo aquí descrito proporciona un enfoque simple pero efectivo para visualizar y cuantificar las microerosiones en el intestino, que es una herramienta muy útil en modelos de enfermedad, en los que la barrera epitelial intestinal está comprometida.
Introducción
La mucosa gastrointestinal (GI) crea una barrera física que separa el entorno extracelular y el entorno interno del huésped, y participa en la absorción de nutrientes, agua y electrolitos. La barrera intestinal abarca una capa de moco constituida por glicoproteínas, una monocapa de células epiteliales, y la lámina propia subyacente son células inmunes y estromales residen. Las células epiteliales intestinales que forman la barrera física están unidas entre sí por diferentes complejos proteicos, que incluyen la unión adherente (AJ), la unión estrecha (TJ) y los desmosomas (DM). El deterioro de la función de barrera epitelial aumenta la permeabilidad intestinal y permite la translocación de sustancias nocivas y patógenos del lumen al intersticio1. Cada vez son más las enfermedades en las que la barrera epitelial se ve comprometida, como las enfermedades inflamatorias intestinales (EII) como la enfermedad de Crohn (EC), la colitis ulcerosa (CU) y la colitis indeterminada (CI). La incidencia de la EII está aumentando en todo el mundo, con una prevalencia cercana al 0,5% en Occidente. Aunque las causas de la EII no están claras, la respuesta inmunitaria/inflamatoria excesiva desencadenada en la pared intestinal contribuye directamente a la ruptura de la barrera epitelial al limitar el restablecimiento de la homeostasis epitelial intestinal 2,3,4. Además, los pacientes con inflamación colónica de larga duración tienen un alto riesgo de desarrollar cáncer colorrectal (CCR)5. Otras patologías asociadas a la ruptura de la barrera epitelial intestinal son el síndrome del intestino irritable, la obesidad, la enfermedad celíaca, la sensibilidad al gluten no celíaca y las alergias alimentarias6. Por estas razones, existe una necesidad urgente para el desarrollo de enfoques experimentales que permitan analizar la integridad de la barrera epitelial intestinal en modelos animales que imitan la patogénesis que ocurre en humanos.
En este trabajo se evaluó la permeabilidad paracelular pasiva gastrointestinal y la permeabilidad transcelular asociada a un proceso inflamatorio en el epitelio colónico mediante una técnica sencilla. Para investigar el flujo transmural de macromoléculas, medimos la difusión pasiva de FITC-dextrano (4 kDa) y RITC-dextrano (10 kDa) en sacos colónicos ex vivo. Además, mediante la inyección de un dextrano fluorescente fijable en lisina de 10 kDa en la luz de los sacos intestinales, identificamos específicamente las áreas con alta permeabilidad en la mucosa inflamada. El uso de marcadores de apoptosis y anticuerpos contra las proteínas AJ permitió demostrar que las áreas de alta permeabilidad en la mucosa inflamada corresponden a regiones específicas donde las células epiteliales sufren apoptosis y se rompen las uniones célula-célula. Esta nueva técnica se puede utilizar para evaluar la integridad del epitelio en cualquier modelo en el que la barrera epitelial intestinal esté comprometida.
Protocolo
Todos los procedimientos fueron revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales de Laboratorio (CICUAL) del CINVESTAV.
1. Preparación de materiales y reactivos
- Precalentar la solución de Hartmann (130 mM de NaCl, 28 mM de lactato, 4 mM de KCl, 1,5 mM de CaCl2) a 37 °C mientras burbujea con 95% de O2/5% de CO2. Mantener el pH fisiológico (7,4) de la solución.
- Para analizar la permeabilidad paracelular pasiva, prepare una solución de trabajo disolviendo 1 mg/mL de FITC-Dextrano (4 kDa) y 1 mg/mL de RITC-Dextrano (10 kDa) en una solución de Hartmann precalentada.
- Prepare una solución de 4 μg/mL de Alexa Fluor647 Fixable-Dextran (10 kDa) en la solución de Hartmann. Almacene las soluciones de trabajo en un tubo cónico de 15 ml y protéjalas de la luz hasta su uso.
NOTA: Serán necesarios 300 μL de solución de trabajo por colon. - Prepare una sutura quirúrgica cortando dos secciones de 5 cm para cada intestino grueso. Enrolla las suturas en un nudo sin cerrar.
2. Disección y preparación de la tráqueo gastrointestinal
- Suspenda los alimentos sólidos durante 6 horas antes de sacrificar a los ratones. Proporcionar agua potable ad libitum.
NOTA: Si es posible, coloque a los ratones en suplementos de gel nutritivo (agua purificada, melaza, calabaza, jarabe de maíz, semillas de girasol, proteína de trigo, aceite vegetal, ácido alimentario, hidrocoloides, electrolitos, fibra de maíz, mezcla mineral NIH-31M, mezcla de vitaminas NIH-31M). - Eutanasia de ratones en una cámara de CO2 seguida de luxación cervical de acuerdo con los protocolos éticos institucionales.
- Esterilizar el abdomen y el tórax con etanol al 70%.
- Con unas tijeras, haga una incisión en el centro del abdomen y exponga la cavidad peritoneal.
- Para fines de orientación, separe y diseccione el intestino grueso cortando en el extremo del intestino delgado (porción final del íleon) justo antes del ciego y luego en el borde anal. Use pinzas quirúrgicas para extraer suavemente el mesenterio y colocar el colon en la solución de Hartmann.
- Es importante destacar que, con el fin de mantener la consistencia entre los animales, identifique secciones similares y utilícelas para evaluar la permeabilidad. Es muy recomendable utilizar regiones cercanas al ciego.
- Utilice una jeringa de insulina equipada con una cánula de plástico roma para enjuagar suavemente el contenido luminal presente en el colon. Si las heces son firmes, empuje con cuidado con la ayuda de pinzas romas. Una vez eliminadas las heces, lavar 3 veces con 400 μL de solución de Hartmann.
- Amarre la región proximal (la más cercana al ciego) y coloque un asa de sutura preatada en la región distal del colon. Con la ayuda de una jeringa equipada con una cánula de plástico roma, llene el saco intestinal con la solución que contiene la sonda de deseo. Retire con cuidado la cánula de plástico y ate el lazo en la región distal.
- Colocar el saco intestinal en un tubo cónico de 15 mL con 6 mL de solución de Hartmann e incubar durante 1 h para evaluar el flujo paracelular pasivo de FITC/RITC-Dextrano o 30 min para analizar el flujo de Alexa Fluor Fixable-Dextran.
- Mantener los tubos cónicos que contienen los sacos intestinales a 37 °C con 5% de CO2 y proteger de la luz.
- Medir la permeabilidad pasiva utilizando FITC/RITC-Dextran. A los 0 y 60 min, tome una muestra de 100 μL del tubo cónico y transfiérala a una placa de 96 pocillos. Vuelva a añadir 100 μL de medios nuevos para reemplazar el volumen perdido.
- Muestras de medición y estándares para FITC/RITC en un lector de placas fluorescentes (excitación/emisión FITC: 495 nm/519 nm; Excitación/emisión RITC: 570/595 nm).
- Para medir la permeabilidad pasiva con Alexa Fluor 647 Fixable-Dextran, retire los intestinos, corte cerca del nudo de amarre quirúrgico y corte el intestino para exponer el lumen para eliminar la solución con la sonda. Lave el lumen del intestino 2 veces con solución fría de Hartmann.
- Coloque el tejido en un molde de tejido previamente lleno con compuesto de temperatura óptima de corte (O.C.T.). Oriente el tejido vertical u horizontalmente según el lado a seccionar. Almacene las muestras a -80 °C.
3. Tinción inmunofluorescente
- Fije las secciones congeladas de 20 micrómetros con paraformaldehído (PFA) al 3,7% durante 20 minutos a temperatura ambiente y luego lave 3 veces con solución salina tamponada con fosfato frío (PBS; 37 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4 y 1,8 mM KH2 PO4).
NOTA: Las secciones verticales de los intestinos tienden a desprenderse si los lavados son muy fuertes. - Permeabilizar con 0.2% TX-100/PBS durante 12 min a temperatura ambiente y luego lavar 3 veces con PBS frío.
- Bloquee con 0.2% BSA/PBS durante 1 hora a temperatura ambiente.
- Diluir el anticuerpo primario en solución bloqueante e incubar durante 1 h a temperatura ambiente. Lavar 3 veces con PBS frío.
- Incubar durante 1 h con anticuerpos secundarios en solución bloqueante. Lavar 3 veces con PBS frío.
- Aplique medio de montaje a los cortes y selle con un cubreobjetos. Los portaobjetos pueden almacenarse hasta 3 meses a -20 °C.
Resultados
En la mucosa inflamada, las erosiones superficiales o microerosiones comprometen la integridad de la monocapa de células epiteliales y representan sitios de alta permeabilidad 7,8. Para evaluar estas posibilidades, analizamos la permeabilidad pasiva en la mucosa colónica inflamada en un modelo murino de colitis por sulfato sódico de dextrano. En resumen, durante 5 días, los ratones C57BL/6J recibieron un 2,5% de DSS (p/v, 40-50 kDa) disuelto en agua potable. Este modelo se caracteriza por inducir daño celular epitelial y disfunción de la barrera epitelial en el intestino grueso, lo que a su vez permite la entrada de antígenos luminales en la lámina propia. Este proceso da lugar a la estimulación del sistema inmunitario, lo que conduce a la secreción de citocinas proinflamatorias y quimiocinas que aumentan aún más el daño epitelial9. Como se muestra en la Figura 1A, los ratones expuestos a DSS exhibieron una pérdida de peso corporal de ~ 12% después de 5 días de tratamiento. También se detectó sangre fecal y diarrea en todos los ratones tratados con DSS. Además, los ratones colíticos mostraron una reducción en la longitud del colon que fue estadísticamente significativa (Figura 1B). Por lo tanto, el índice de actividad de la enfermedad (DAI) que abarca la pérdida de peso de los animales, la consistencia de las heces, la diarrea, la sangre oculta y el sangrado rectal macroscópico aumentó después de 5 días de tratamiento con DSS (Figura 1C). El análisis histopatológico reveló la presencia de erosiones epiteliales, ulceraciones, infiltrado inmune y edema en la mucosa colónica de ratones colíticos (Figura 2).
La ruptura de la barrera epitelial, incluyendo la apoptosis de las células epiteliales intestinales y las uniones intercelulares disfuncionales, han sido explicadas por el aumento de la permeabilidad pasiva en la mucosa inflamada10,11. Por lo tanto, medimos indirectamente la permeabilidad en la mucosa colónica mediante el monitoreo del flujo pasivo de sondas marcadas con fluorescencia (FITC y RITC-dextrano). Como se muestra en la Figura 3A, el proceso inflamatorio inducido después de la administración de DSS aumentó la permeabilidad transmural, como lo demuestra el aumento en el flujo pasivo de FITC-dextrano (4 kDa) y RITC-dextrano (10 kDa). Además, como se muestra en la Figura 3B, el análisis de Western blot confirmó el aumento de la apoptosis en la mucosa colónica de ratones tratados con DSS, como lo demuestra la presencia de caspasa 3 activa (Acasp-3). Por lo tanto, los datos sugieren fuertemente que durante la inflamación, el proceso apoptótico desencadenado en la mucosa inflamada contribuye a la interrupción de la función de barrera epitelial.
A continuación, evaluamos la localización de las áreas con alta permeabilidad en la mucosa inflamada mediante el análisis del flujo de un dextrano de lisina fijable fluorescente de 10 kDa. Utilizamos una molécula de 10 kDa para restringir el flujo solo a regiones altamente permeables con alto tamaño de poro. En los ratones control, el dextrano fijable fue retenido en la superficie apical de las criptas colónicas (flechas blancas) y fue delimitado por el apretado haz de filamentos de actina en el borde del cepillo de las microvellosidades (Figura 4A). Sin embargo, en ratones colíticos, el dextrano fijable penetró en el citosol de las células epiteliales del colon, lo que demuestra que la inflamación induce un flujo transcelular activo (asteriscos). Tras un análisis más detallado, observamos la presencia de dextrano fijable en el intersticio en ratones colíticos (flechas), pero no en los animales control, lo que indica un flujo neto desde el lado luminal al intersticial (Figura 4B). En el área permeable, el dextrano fijable citosólico estaba claramente incorporado en las células epiteliales agrupadas en microrregiones en el lado luminal y esas células fueron positivas para el marcador apoptótico Acasp-3 (Figura 4C). Es importante destacar que también en la superficie, en las áreas de alta permeabilidad donde las células epiteliales sufren apoptosis (focos apoptóticos), observamos una distribución aberrante para la E-cadherina (Figura 4C, flechas) y un efecto no observado en el tejido control. Además, los resultados mostraron que el dextrano fijable estaba internalizado en las células anoikis presentes en el lumen, y algunas de esas células mostraron una leve tinción citosólica para E-cadherina (punta de flecha) (Figura 4D). A diferencia de la E-cadherina, las células epiteliales intestinales enriquecidas con dextrano fijable citosólico mostraron una clara tinción para ZO-1 en la TJ (Figura 4E), no se detectó ninguna tinción para ZO-1 en la célula desprendida (datos no mostrados). Por lo tanto, en conclusión demostramos que el dextrano fijable es una buena herramienta para identificar sitios de alta permeabilidad en el intestino y está internalizado en células apoptóticas y anoikis.

Figura 1. Inducción de colitis aguda mediante DSS. (A) Cambios diarios en el peso corporal de ratones C57BL/6J tratados con 2.5% DSS durante 5 días. El peso corporal se expresa como porcentaje del peso corporal en el día 0. (B) Cambios macroscópicos observados en los colones de ratones tratados con DSS durante 5 días. Panel superior. Imagen representativa de colones recolectados de ratones control y colíticos. Panel inferior. Se observó un acortamiento de la longitud del colon en ratones tratados con DSS. (C) Puntuación clínica (Índice de Actividad de la Enfermedad; DAI) durante 5 días después del tratamiento oral con agua (controles; n 5) o sulfato sódico de dextrano al 2,5% (DSS). El DAI que abarca la pérdida de peso corporal, la consistencia de las heces y la sangre en las heces aumentó en los ratones colíticos. Los datos se presentan como medios ± SEM (n=5). Los valores de p se calcularon mediante un ANOVA de dos factores con la prueba post hoc de Sidak (A) y la prueba t de Student (B, C). **p < 0,01; p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
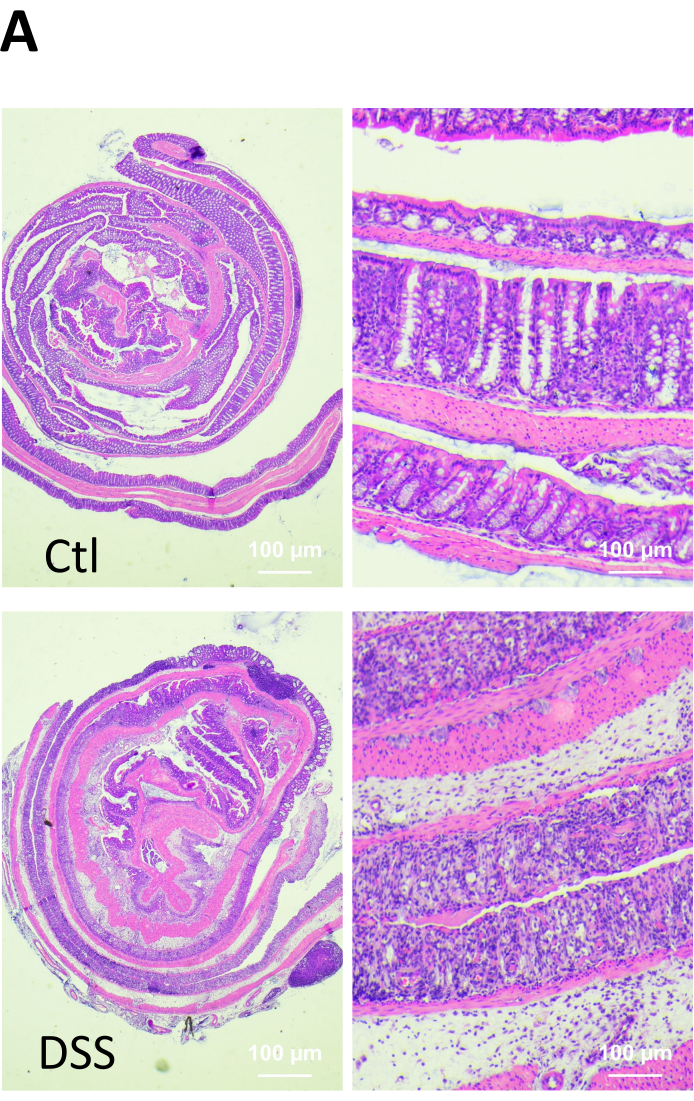
Figura 2. Cambios microscópicos en la mucosa colónica de ratones sanos y tratados con DSS. Al final del experimento, los animales fueron sacrificados y las muestras de tejido se fijaron, se incrustaron en parafina, se seccionaron y se tiñeron con hematoxilina y eosina (H&E). Se observó infiltración de células inflamatorias (flecha), ulceraciones (punta de flecha) y pérdida de arquitectura críptica (erosión, e) en el colon de ratones tratados con DSS. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. El transporte paracelular pasivo de Dextrano marcado con fluorescencia se mejora durante la colitis. (A) Análisis del transporte paracelular pasivo de dextrano marcado con fluorescencia en sacos intestinales de ratones sanos y colíticos. Los sacos intestinales se prepararon a partir de colones recolectados de ratones C57BL/6J de la misma edad tratados con agua o DSS al 2,5% durante 5 días. Los sacos se cargaron con una solución que contenía 1 mg/ml de FITC-dextrano-4 kDa (MW 4.400 Da) y 1 mg/ml de RITC-dextrano-10 kDa (MW 10.000 Da). El flujo paracelular pasivo de las sondas fluorescentes se midió después de 60 min. La permeabilidad paracelular aumenta después de la inducción de la colitis. (B) Evaluación de Caspasa-3 activa (Acasp-3) en la mucosa colónica de ratones tratados con DSS. Los lisados de células enteras se prepararon a partir de muestras de colon recolectadas de ratones C57BL/6J de la misma edad tratados con agua o DSS al 2,5% durante 5 días. Se cargaron 30 μg de proteína y se separaron en geles de poliacrilamida SDS al 12%, se transfirieron a una membrana de nitrocelulosa y se utilizaron con Western blot para Acasp-3. Se utilizó GAPDH como control de carga. La presencia de Caspasa-3 activa aumenta después de la inducción de la colitis. n = 5. Los datos se presentan como medios ± SEM (n=5). Los valores de p se calcularon mediante un ANOVA de dos factores con la prueba post hoc de Sidak (A) y la prueba de Mann-Whitney (B). *p < 0,05 ***p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
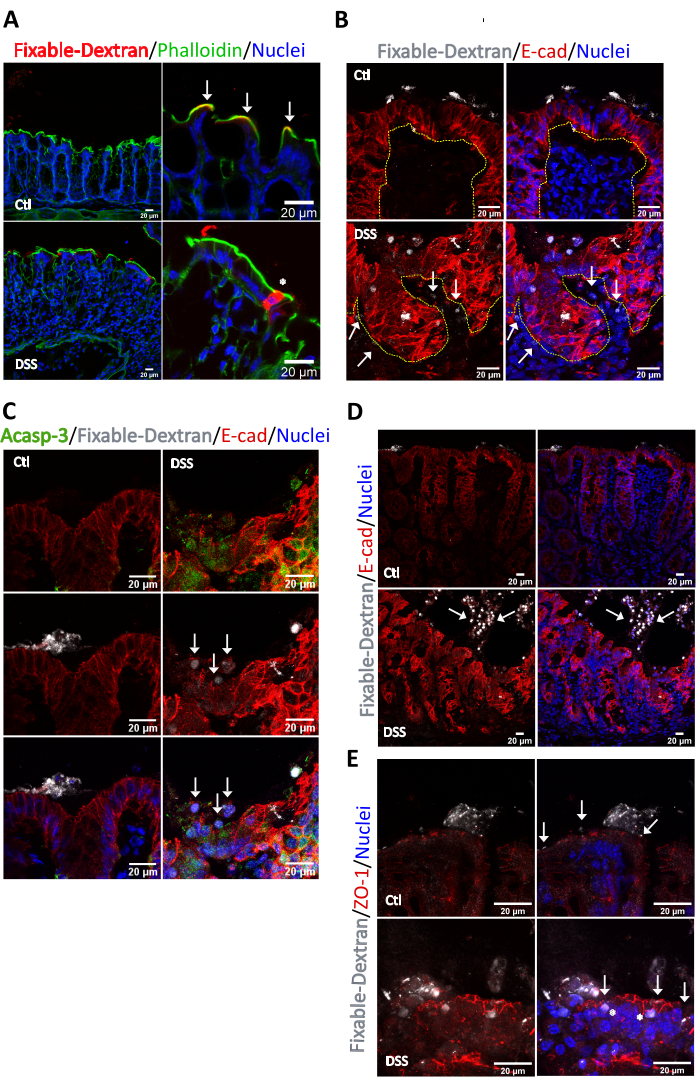
Figura 4. Identificación de sitios de permeabilidad en la mucosa colónica de ratones sanos y tratados con DSS. Los sacos intestinales se prepararon a partir de colones recolectados de ratones C57BL/6J de la misma edad tratados con agua o 2.5% DSS durante 6 días. Los sacos se cargaron con una solución que contenía 4 μg/mL de dextra Alexa Fluor 647 fijable, 10 kDa. El flujo paracelular pasivo de la sonda fluorescente se detuvo después de 30 min. Los sacos colónicos se fijaron, se incrustaron en OCT, se seccionaron y se tiñeron para inmunofluorescencia. (A) En condiciones de control, el dextrano fijable (rojo) se detectó en estrecha aposición con (flechas) el anillo de actina apical (verde) que limita la superficie apical de los colonocitos frente al lado luminal. Después del tratamiento con DSS, se interrumpió la continuidad del anillo de actina apical (asterisco). El dextrano fijable penetró en el citosol de las células epiteliales de superficie. (B) Análisis de dextrano fijable y E-cadherina en sitios de alta permeabilidad. En condiciones de control, el dextrano fijable se retuvo en el lado luminal. En la mucosa cólica, se detectó dextrano fijable en el citosol de las células epiteliales que recubren la superficie de la cripta y en varias regiones del intersticio (flechas). Las células epiteliales que incorporaron dextrano fijable se localizaron en la superficie de la cripta y mostraron una distribución aberrante de E-cadherina. La línea discontinua delimita la cripta. n = 5. (C) Análisis de caspasa-3 activa y E-cadherina en los sitios de alta permeabilidad identificados con el dextrano fijable en la mucosa colónica de ratones colíticos. La caspasa-3 activa (verde) se enriqueció en los sitios de alta permeabilidad. Las flechas marcan las células epiteliales con tinción aberrante para E-cadherina que estaban presentes en la superficie de la cripta. n = 5. (D) Análisis de dextrano fijable y E-cadherina. En condiciones de control, el dextrano fijable se retuvo en el lado luminal. En la mucosa cólica se detectó dextrano fijable en el citosol de células epiteliales desprendidas localizadas en la luz intestinal (Arrows). Las células epiteliales marcadas con dextrano fijable mostraron una clara presencia de E-cadherina citosólica. n = 5. (E) Análisis de dextrano fijable y ZO-1. En condiciones de control, el dextrano fijable se retuvo en el lado luminal por encima del TJ (marcado por ZO-1). En la mucosa cólica, se detectó dextrano fijable en el citosol de las células epiteliales desprendidas y en las células epiteliales en la superficie de la cripta (asteriscos). ZO-1 localizado en la TJ en condiciones control y colíticas (Arrows). n = 5. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La homeostasis epitelial resultante del equilibrio de la proliferación celular y la apoptosis epitelial mantiene una barrera intestinal adecuada y funcional. Muchos trastornos clínicos, como la EII, se acompañan o caracterizan por alteraciones de la permeabilidad intestinal, inflamación de la mucosa y alteración de la homeostasis epitelial1. La interacción entre esos procesos sigue siendo muy controvertida. Por lo tanto, el desarrollo de nuevos enfoques de investigación para investigar adecuadamente esos procesos es un tema importante en el campo. Existen varios protocolos publicados para el estudio indirecto de la permeabilidad intestinal durante la inflamación, como la medición de la resistencia eléctrica transepitelial en monocapas epiteliales y la cuantificación de sondas hidrofóbicas marcadas con fluoróforos en organoides intestinales, intestinos de ratón y sacos intestinales 10,11,12,13. A pesar de demostrar que la absorción de una sustancia aumenta o disminuye en la mucosa intestinal, estos métodos se quedan cortos a la hora de analizar otros eventos importantes que contribuyen directamente a los cambios en la permeabilidad. Por ejemplo, al no identificar las áreas específicas donde la integridad del epitelio se ve comprometida, estos estudios limitan la comprensión de los mecanismos de transporte o las funciones biológicas responsables de afectar la permeabilidad intestinal. Además, dado que la permeabilidad intestinal puede variar mucho según la región, estos estudios podrían generar errores como falsos positivos. Por lo tanto, complementar esos estudios con evaluaciones no cuantitativas específicas del sitio, como la que se describe aquí, permitirá determinar la región exacta donde se produce el flujo de sustancias en el epitelio dañado. Este nuevo ensayo de permeabilidad no solo permite una mejor comprensión de la integridad de la mucosa regional en las enfermedades digestivas, sino que también permite el estudio de los mecanismos alterados que contribuyen a dicho proceso.
La nueva técnica descrita es una combinación de dos técnicas previamente descritas, la preparación de sacos intestinales para evaluar la función de barrera de la mucosa ex vivo12 y el uso de trazadores fluorescentes fijables para analizar la permeabilidad vascular cerebral13. Mediante el uso de esta técnica, observamos que el deterioro de la barrera epitelial después del daño IEC aumenta el flujo general de antígenos luminales al compartimento intersticial. Se eligió el uso de un dextrano fijable de 10 kDa para analizar específicamente la localización de áreas altamente permeables con un gran tamaño de poro en la mucosa colítica. Por lo tanto, los sitios de alta permeabilidad en la mucosa inflamada que se detectaron aquí abarcan focos apoptóticos donde los colonocitos superficiales sufren apoptosis o extrusión, un proceso conocido como anoikis. Sin embargo, el uso de sondas de diferentes tamaños podría ser una herramienta útil para discriminar dónde se ve afectado el flujo paracelular y transcelular en el intestino. Cabe destacar que las células sometidas a apoptosis/anoikis siempre incorporaron dextrano fijable de 10 kDa, lo que hace que la técnica sea útil para identificar las áreas donde las membranas plasmáticas de las células epiteliales están comprometidas. Durante la anoikis, varias moléculas de unión célula-célula se pierden o se redistribuyen, y la técnica también podría ser útil para identificar esas proteínas. De hecho, aquí observamos que la E-cadherina se pierde de la membrana plasmática lateral o se internaliza en IEC marcada con dextrano fijable. Así, los resultados presentados aquí demuestran que el aumento de la permeabilidad intestinal durante la inflamación se ve afectado por la ruptura de la continuidad de la barrera epitelial causada por la muerte por IEC (apoptosis/anoikis) y no solo por la alteración en la función de las uniones estrechas14.
Hasta donde sabemos, un protocolo similar emplea endomicroscopía láser confocal in vivo para evaluar la presencia de microerosiones y daño epitelial en el intestino en tiempo real. Dicha técnica identifica las células extruidas en la mucosa inflamada y no inflamada del intestino. Sin embargo, en ausencia de marcadores específicos para evaluar los mecanismos, el tipo de célula e incluso la maquinaria involucrada en la alteración de la integridad epitelial, este protocolo es muy limitado8. Además, con esta técnica no podemos medir el grado de perturbación epitelial, la integridad de la capa de gel mucoso o la presencia de cambios sutiles que pueden no ser evidentes. Además, la presencia de cambios regionales en la función de barrera podría perderse. Por lo tanto, nuestro protocolo se presenta como una opción más fuerte para investigar la permeabilidad de la barrera epitelial en la mucosa intestinal. Sin embargo, hay que tener en cuenta que nuestro método utiliza tejido fijo y por lo tanto las observaciones corresponden a tejido postmortem o biopsia.
En conclusión, el protocolo aquí descrito proporciona un enfoque simple pero efectivo para visualizar y cuantificar las microerosiones y la muerte de células epiteliales (apoptosis/anoikis) en el intestino, lo cual es una herramienta muy útil en modelos de enfermedades en las que la barrera epitelial intestinal está comprometida.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
La investigación fue apoyada parcialmente por la beca SEP-Conacyt (No.179 a NV/PND) y apoyada por el financiamiento sectorial para investigación y educación a través de la beca para Ciencias Básicas del Conacyt (No. A1-S-20887 a PND). Queremos expresar nuestro agradecimiento a Norma Trejo, M.V.Z. Raúl Castro Luna, M.C. Leonel Martínez, Felipe Cruz Martínez, Víctor Manuel García Gómez y M.V.Z. Ricardo Gaxiola Centeno por su ayuda y asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Active Caspase-3 antibody (1:1000) | Cell signaling | 9664 | Cleaved caspase-3 (Asp175)(5AE1) Rabbit mAb |
| Alexa Fluor 488 anti rabbit (1:1000) | Invitrogen | A21206 | |
| Alexa Fluor 594 anti rat (1:1000) | Invitrogen | A21209 | |
| Confocal microscope (Leica TCS SP8x) | Leica | HyD detectors and White Light Laser | |
| E-Cadherin antibody (1:750) | Sigma | MABT26 | Rat monoclonal Delma-1 antibody |
| Ethanol 70% | Generic | ||
| Fixable-Dextran | Invitrogen | D22914 | Dextran, Alexa Fluor, 10,000 MW, anionic, fixable |
| FITC Dextran | Sigma | 46944 | Fluorescein isothiocyanate–dextran M. Wt. 4 kDa |
| Hartmann's Solution | PiSA | HT PiSA | |
| Incubator (AutoFlow NU-8500) | Nuaire | ||
| Microplate reader (Tecan Infinite 200 PRO) | Tecan | ||
| Nunc F96 MicroWell Black and White Polystyrene Plate | ThermoFisher Scientific | ||
| Paraformaldehyde | Sigma | P6148 | |
| Phalloidin (1:1000) | Invitrogen | A12380 | Alexa Fluor 568 Phalloidin |
| RITC Dextran | Sigma | R8881-100MG | Rhodamine B Isothiocyanate-Dextran. M. Wt. 10 kDa |
| Secondary antibodies (1:10000) | Jackson ImmunoResearch Laboratories | HRP-conjugated secondary antibodies | |
| Suture threads | Generic | Braided silk and braided polyester surgical sutures are prefered. | |
| ZO-1 (1:1000) | Invitrogen | 40-2200 | Rb anti-ZO-1 |
Referencias
- König, J., et al. Human Intestinal Barrier Function in Health and Disease. Clinical and Translational Gastroenterology. 7 (10), 196(2016).
- Gassler, N., et al. Inflammatory bowel disease is associated with changes of enterocytic junctions. American Journal of Physiology-Gastrointestinal and Liver Physiology. 281 (1), 216-228 (2001).
- Negroni, A., Cucchiara, S., Stronati, L. Apoptosis, Necrosis, and Necroptosis in the Gut and Intestinal Homeostasis. Mediators of Inflammation. 2015, 250762(2015).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Choi, C. -H. R., Bakir, I. A., Hart, A. L., Graham, T. A. Clonal evolution of colorectal cancer in IBD. Nature Reviews Gastroenterology & Hepatology. 14 (4), 218-229 (2017).
- González-González, M., Díaz-Zepeda, C., Eyzaguirre-Velásquez, J., González-Arancibia, C., Bravo, J. A., Julio-Pieper, M. Investigating Gut Permeability in Animal Models of Disease. Frontiers in Physiology. 9, (2019).
- Poulsen, S. S., Pedersen, N. T., Jarnum, S. "Microerosions" in rectal biopsies in Crohn's disease. Scandinavian Journal of Gastroenterology. 19 (5), 607-612 (1984).
- Neumann, H., et al. Assessment of Crohn's disease activity by confocal laser endomicroscopy. Inflammatory Bowel Diseases. 18 (12), 2261-2269 (2012).
- Laroui, H., et al. Dextran Sodium Sulfate (DSS) Induces Colitis in Mice by Forming Nano-Lipocomplexes with Medium-Chain-Length Fatty Acids in the Colon. PLoS ONE. 7 (3), (2012).
- John, L. J., Fromm, M., Schulzke, J. -D. Epithelial barriers in intestinal inflammation. Antioxidants & Redox Signaling. 15 (5), 1255-1270 (2011).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145 (2), 407-415 (2013).
- Mateer, S. W., Cardona, J., Marks, E., Goggin, B. J., Hua, S., Keely, S. Ex Vivo Intestinal Sacs to Assess Mucosal Permeability in Models of Gastrointestinal Disease. Journal of Visualized Experiments: JoVE. (108), e53250(2016).
- Devraj, K., Guérit, S., Macas, J., Reiss, Y. An In Vivo Blood-brain Barrier Permeability Assay in Mice Using Fluorescently Labeled Tracers. Journal of Visualized Experiments: JoVE. (132), e57038(2018).
- Stamatovic, S. M., Johnson, A. M., Sladojevic, N., Keep, R. F., Andjelkovic, A. V. Endocytosis of tight junction proteins and the regulation of degradation and recycling. Annals of the New York Academy of Sciences. 1397 (1), 54-65 (2017).
- Srinivasan, B., et al. TEER Measurement Techniques for In Vitro Barrier Model Systems. Journal of Laboratory Automation. 20 (2), 107-126 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19(2018).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. The Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados