Method Article
Cryoconservation d’ovocytes prélevés dans le tissu ovarien pour optimiser la préservation de la fertilité chez les filles et les femmes prépubères
Dans cet article
Résumé
Nous proposons un protocole de préservation de la fertilité chez les filles prépubères et les femmes à risque d’insuffisance ovarienne prématurée. Il combine la congélation du tissu ovarien et la cryoconservation des ovocytes prélevés dans le tissu ovarien. Cette stratégie améliore la sécurité et optimise le potentiel reproductif de la préservation de la fertilité, maximisant ainsi les chances d’accouchement.
Résumé
La cryoconservation du tissu ovarien humain (OTC) est de plus en plus utilisée dans le monde entier pour préserver la fertilité féminine chez les filles prépubères et les femmes à risque d’insuffisance ovarienne prématurée (IOP) dans le cadre de traitements gonadotoxiques urgents ou de chirurgie ovarienne. La préservation de la fertilité est un défi car il n’y a pas de consensus sur la prise en charge des patients, les stratégies de préservation de la fertilité, ou même les protocoles techniques de laboratoire, ce qui implique que chaque procédure doit être adaptée aux caractéristiques du profil du patient et à son propre rapport bénéfice-risque. Pendant l’OTC, les ovocytes matures/immatures peuvent être aspirés directement à partir de follicules antraux grands/petits dans des échantillons de tissu ovarien et/ou être libérés dans des milieux de culture à partir de follicules en croissance lors de la dissection du tissu ovarien chez les filles prépubères et les femmes. Dans ce manuscrit, nous présentons un protocole qui combine la congélation du tissu ovarien avec la cryoconservation d’ovocytes matures/immatures prélevés sur des échantillons de tissu ovarien, améliorant ainsi le potentiel reproductif de la préservation de la fertilité. La collecte, la manipulation et le stockage appropriés du tissu ovarien et des ovocytes avant, pendant et après la cryoconservation seront décrits. L’utilisation ultérieure et l’innocuité d’échantillons de tissus ovariens et d’ovocytes cryoconservés/décongelés seront également abordés, ainsi que le moment optimal pour la maturation in vitro des ovocytes immatures. Nous recommandons l’utilisation systématique de ce protocole dans la préservation de la fertilité des filles et des femmes prépubères, car il augmente le potentiel reproductif global de la préservation de la fertilité (c’est-à-dire la vitrification des ovocytes en plus de l’OTC) et améliore également la sécurité et l’utilisation de la préservation de la fertilité (c’est-à-dire la décongélation des ovocytes par rapport à la greffe ovarienne), maximisant ainsi les chances de réussite de l’accouchement pour les patientes à risque de POI.
Introduction
Le domaine de la préservation de la fertilité s’est développé au cours des deux dernières décennies en raison du nombre croissant de patientes à risque d’insuffisance ovarienne prématurée (IOP)1,2,3. Les options médicales actuellement disponibles pour préserver la fertilité sont la cryoconservation du tissu ovarien (OTC)4, la congélation d’ovocytes/embryons après stimulation ovarienne5, l’administration d’analogues de la GnRH6 ou la transposition ovarienne7. L’OTC est une avancée majeure pour la préservation de la fertilité, en particulier chez les filles prépubères, où c’est la seule option actuellement disponible pour préserver la fertilité, ainsi que chez les femmes qui ne peuvent pas retarder le début de leur traitement gonadotoxique 2,4.
L’OTC permet la préservation d’un grand nombre de follicules primordiaux, qui sont situés dans le 1 mm externe du cortex ovarien2. Le tissu ovarien congelé/décongelé peut être utilisé par la suite par greffe (orthotopique ou hétérotopique, autologue ou donneur) ou cultivé in vitro pour obtenir des ovocytes matures2. Il a été démontré que la greffe d’échantillons de tissu ovarien prépubère congelé-décongelé induit la puberté 8,9. Chez les femmes, les résultats reproductifs après l’autogreffe orthotopique du cortex ovarien congelé-décongelé sont rassurants, avec des taux de naissances vivantes atteignant 57,5 % après des conceptions naturelles10 et entre 30 % et 70 % après des conceptions par des techniques de procréation assistée (ART)11. Depuis la première naissance vivante par transplantation orthotopique de tissu ovarien humain congelé/décongelé en 200412, cette technique a permis la naissance d’au moins 130 enfants dans le monde2. Les fonctions hormonales et reproductives du tissu greffé durent généralement plusieurs années 11,13,14, confirmant sa fonctionnalité à long terme.
Cependant, l’auto-transplantation d’échantillons de tissu ovarien comporte un risque théorique de réintroduction de cellules malignes viables chez certaines patientes 15,16,17,18, en particulier chez les survivants de leucémie 19. À ce jour, aucun cas de transmission du cancer par la greffe de cortex ovarien congelé/décongelé n’a été rapporté chez des survivants sains du cancer11, suggérant que la nature fibreuse et avasculaire du cortex ovarien pourrait représenter un microenvironnement inhospitalier pour la dissémination des cellules malignes. Néanmoins, la greffe de tissu ovarien représente toujours une technique expérimentale et difficile, indiquant que l’utilisation d’ovocytes devrait actuellement être considérée comme une approche plus facile et plus sûre que la greffe de tissu ovarien pour restaurer la fertilité. Il est intéressant de noter que les ovocytes immatures pourraient être facilement récupérés du tissu ovarien pendant l’OTC chez les filles prépubères et les femmes16, ce qui suggère qu’il pourrait représenter une source fiable pour maximiser le potentiel de restauration de la fertilité en plus de la congélation du tissu cortical ovarien. Ces ovocytes pourraient être aspirés manuellement ex vivo en laboratoire de PMA à partir de follicules antraux visibles ou être isolés de milieux usagés après dissection de tissu ovarien. Les ovocytes récupérés pourraient alors être directement vitrifiés à un stade immature ou être mûris avant l’étape de vitrification en utilisant la maturation in vitro (IVM)20,21.
Dans ce manuscrit, nous proposons un protocole qui combine la cryoconservation du tissu ovarien avec l’isolement et la cryoconservation d’ovocytes matures (au stade MII) et/ou immatures (c’est-à-dire les ovocytes de la vésicule germinale (GV) et des ovocytes au stade de la métaphase I (MI)) prélevés dans le tissu ovarien. Ce protocole décrit toutes les étapes spécifiques requises pour maximiser le potentiel de préservation de la fertilité chez les filles et les femmes prépubères.
Protocole
Toutes les femmes (de plus de 18 ans) ainsi que toutes les filles mineures et leurs parents ont signé un formulaire de consentement éclairé afin de préserver la fertilité de la patiente à risque de POI. Ce protocole est considéré comme une procédure de PMA de routine dans notre centre de préservation de la fertilité. Il suit les directives du comité d’éthique de la recherche humaine de nos institutions.
1. Contrôle de la qualité
- Inclure les femmes âgées ≤ 38 ans, contenant une concentration d’hormone anti-müllérienne circulante >1 ng/mL et montrant la présence d’un risque accru de POI dû au traitement gonadotoxique. Exclure les femmes éligibles à la vitrification des ovocytes pour une procédure de préservation de la fertilité, les femmes atteintes d’une maladie qui empêche de donner un consentement pleinement éclairé ou les femmes présentant un risque élevé de complications à la suite d’une anesthésie ou d’une intervention chirurgicale.
- Confirmez la présence d’un consentement signé du patient avant d’entreprendre cette procédure.
- Identifiez deux emplacements vacants à l’intérieur de deux réservoirs de stockage distincts en cryoconservation. La moitié des cryotubes/pailles sera conservée dans le premier réservoir de stockage tandis que l’autre moitié des cryotubes/pailles sera conservée dans l’autre réservoir afin de minimiser le risque de perte totale des échantillons en cas de défaillance du réservoir.
- Vérifiez la disponibilité et le fonctionnement de tous les dispositifs médicaux requis dans ce protocole. Pour l’étape de dissection, il est recommandé d’utiliser des ciseaux chirurgicaux de dissection stériles à lames droites tranchantes et à pointes finement aiguisées, ainsi que des pinces à tissus stériles atraumatiques.
- Vérifier que toutes les étapes de contrôle qualité ont été respectées pour tous les dispositifs médicaux (en particulier, la validation et le contrôle de routine des processus de stérilisation, la vérification et le suivi des numéros de péremption/de lot).
- Maintenez un environnement aseptique/stérile tout au long de la procédure et réalisez avec prudence toutes les précautions de sécurité.
- Utilisez des plats, des pipettes et des instruments chirurgicaux différents pour chaque patient.
2. La veille de la conservation
- Préparez une boîte de Pétri FIV stérile de 60 mm contenant un milieu de FIV recouvert d’huile minérale et incubez la boîte pendant la nuit à 37 °C dans une atmosphère de 5 % d’O2 et de 5 % de CO2. Utilisez cette boîte pour prélever les complexes cumulus-ovocytes (COC) qui seront potentiellement récupérés dans le tissu (voir rubrique 7.2).
- Préparez une boîte de Pétri FIV stérile de 35 mm contenant un milieu de FIV et incubez la boîte pendant une nuit à 37 °C dans une atmosphère de 5 % d’O2 et de 5 % de CO2. Utilisez cette parabole pour l’étape de dénudation des ovocytes (voir rubrique 9.1).
- Préparez une boîte de Pétri FIV stérile de 35 mm contenant un milieu de FIV recouvert d’huile minérale et incubez la boîte pendant la nuit à 37 °C dans une atmosphère de 5 % d’O2 et 5 % de CO2. Utilisez cette boîte pour recueillir les ovocytes après l’étape de dénudation (voir rubrique 9.4).
3. Prélèvement et transport de tissu ovarien
- Effectuez la chirurgie laparoscopique sous anesthésie générale à l’aide d’un port de 10 mm positionné au niveau de l’ombilic et de deux ports de 5 mm, l’un positionné dans le quadrant inférieur gauche et l’autre positionné dans le triangle droit.
- Réaliser une ovariectomie unilatérale partielle ou complète selon la décision consensuelle de l’oncologue, du chirurgien et du personnel médical de l’unité de TAR en fonction de la réserve ovarienne, de la taille et de l’aspect macroscopique des deux ovaires (Figure 1, A1–B1) et du protocole gonadotoxique prévu. Effectuez une ovariectomie avec des ciseaux tranchants ou une agrafe chirurgicale. N’utilisez pas d’appareil de dissection qui pourrait induire des lésions collatérales, électriques ou thermiques au tissu ovarien à préserver.
REMARQUE : Une ovariectomie unilatérale complète est généralement pratiquée chez les filles prépubères16,22, tandis qu’une ovariectomie unilatérale partielle peut être couramment réalisée chez les patientes adultes ayant de gros ovaires et/ou une réserve ovarienne élevée.
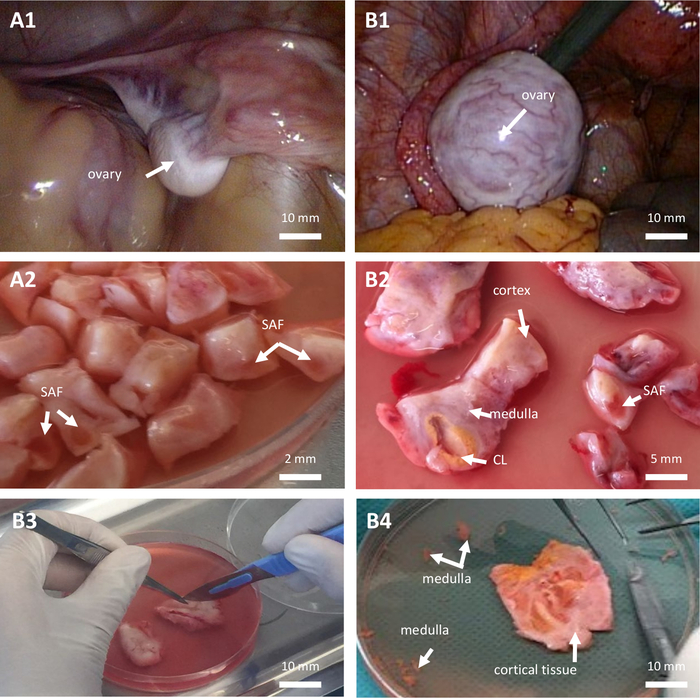
Figure 1 : Cryoconservation du tissu ovarien. Cryoconservation du tissu ovarien chez une fille prépubère (A, patiente de 7 ans) et chez une femme (B, patiente de 28 ans) toutes deux atteintes de leucémie myéloïde aiguë. (A1 à B1) Vue laparoscopique de l’ovaire. (A2–B2–B3) Dissection du tissu ovarien. (B4) Tissu ovarien cortical. CL : corps jaune. SAF : petit follicule antral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Effectuez l’évacuation du tissu ovarien à l’aide d’un sac de prélèvement d’échantillons laparoscopique fait à la main ou dans le commerce.
- Mettez le tissu ovarien dans un tube stérile contenant un milieu de culture à 4 °C. Le tissu doit être complètement immergé dans le milieu de culture.
- Transportez immédiatement le tissu ovarien dans une poche isotherme à 4 °C jusqu’au laboratoire de PMA pour des résultats optimaux.
REMARQUE : Si nécessaire, le tissu ovarien peut être transporté à des températures froides (environ 4 °C) jusqu’à 26 h après le prélèvement sans menacer la qualité du tissu23.
4. Préparation du tissu ovarien
- Transférez le tissu ovarien dans une boîte de Pétri FIV stérile de 90 mm contenant 20 ml de milieu de culture pré-refroidi à 4 °C.
- Placez la boîte de Pétri contenant le tissu ovarien sur une plaque froide (à 4 °C) posée sur un banc propre à flux laminaire vertical pour minimiser le risque de contamination par des micro-organismes.
5. Aspiration manuelle des follicules à partir d’échantillons de tissu ovarien
- Aspirer les follicules antraux visibles (s’ils sont présents à la surface du tissu ovarien) à l’aide d’une aiguille de seringue de 21 G reliée à une seringue jetable de 1 mL.
REMARQUE : Cette étape peut être délicate. Une alternative peut être d’ouvrir doucement chaque follicule antral visible avec un scalpel et de rincer l’intérieur de chaque follicule avec des supports de FIV afin de libérer doucement les COC dans les supports de dissection. - Rincez les fluides folliculaires collectés dans une boîte de Pétri de FIV stérile de 60 mm contenant 5 ml de milieu de culture de FIV à température ambiante.
- Rincez la seringue avec 1 ml de milieu de culture FIV à température ambiante et rincez le liquide dans la même boîte de Pétri FIV. Répétez cette étape deux fois.
- Identifiez et isolez les COC à l’aide d’un microscope inversé (grossissement de 50x à 200x).
- Transférez les COC sains à l’aide d’une pipette dans une nouvelle boîte de Pétri FIV stérile de 60 mm contenant un milieu de FIV pré-équilibré recouvert d’huile à 37 °C dans une atmosphère de 5 % d’O2 et de 5 % de CO2.
REMARQUE : Les COC sains contiennent un ovocyte translucide. Jetez les COC atrétiques présentant un ovocyte de couleur brune. - Conservez la boîte de Pétri FIV dans l’incubateur à 37 °C dans une atmosphère de 5 % d’O2 et de 5 % de CO2 jusqu’à l’étape de dénudation (voir étape 9).
6. Dissection du tissu ovarien
- Préparez la solution fraîche de congélation dans un tube stérile de 50 ml. La solution de congélation contient 1,5 M de diméthylsulfoxyde (DMSO) et 10 % d’albumine sérique humaine dans le milieu de culture de FIV. Tourbillonnez doucement.
REMARQUE : Il doit être préparé juste avant utilisation. - Coupez le tissu ovarien et enlevez la moelle autant que possible (Figure 1, B4).
- Couper le cortex ovarien en tranches de 10 mm x 10 mm x 1 mm ou de 0,5 mm x 0,5 mm x 1 mm dans le cas d’une ovariectomie unilatérale complète ou partielle, respectivement (Figure 1, A2–B2–B3). La coupe est réalisée avec des ciseaux chirurgicaux tranchants stériles et des pinces atraumatiques.
REMARQUE : Une tranche de tissu ovarien est conservée intacte avec le cortex ovarien et la moelle pour une analyse histologique plus poussée (voir étape 8). - Après la dissection, effectuez deux étapes de lavage (ou plus, si nécessaire) pour chaque échantillon cortical ovarien dans 1 ml de milieu de culture de FIV pour prélever le sang. Après le lavage, transférez tous les échantillons de tissus dans une nouvelle boîte de Pétri de 60 mm avec un milieu de culture FIV frais.
- Placez chaque échantillon de corticum ovarien dans un cryotube contenant 1 mL de solution de congélation.
REMARQUE : Le mélange n’est pas nécessaire. La tranche de tissu ovarien conservée pour une analyse histologique plus poussée n’est pas cryoconservée (voir étape 8). - Conserver les échantillons pendant 30 min à 4 °C pour l’équilibrage avec la solution de congélation.
- Cryoconservez tous les échantillons avec une technique de congélation lente. La vitesse de refroidissement est de -2 °C/min de +4 °C à -9 °C, -50 °C/min à -30 °C ; maintenir pendant 1 min, +4 °C/min jusqu’à -15 °C, -2 °C/min jusqu’à -40 °C ; et enfin -25 °C/min jusqu’à -150 °C à l’aide d’un congélateur programmable.
- Retirez immédiatement les cryotubes et plongez-les dans de l’azote liquide à -196 °C.
- Placez la moitié des cryotubes dans un premier réservoir de stockage d’azote liquide et l’autre moitié des cryotubes dans un deuxième réservoir d’azote liquide.
7. Isolation manuelle du COC du milieu de dissection
- Identifier les COC à partir du milieu de dissection à l’aide d’un microscope (grossissement de 50x à 200x) (Figure 2).

Figure 2 : COC matures et immatures prélevés dans le tissu ovarien. COC matures (A) et immatures (B1–B3,C1–C2) prélevés dans le tissu ovarien. (A) COC mature contenant un ovocyte mature (présence du premier corps polaire, ovocyte de stade Métaphase II). (B1) COC immature sain contenant un ovocyte immature (pas de corps polaire, ovocyte de stade Métaphase I). (B2 à B3) COC immatures sains contenant des ovocytes germinés immatures au stade vésiculaire (pas de corps polaire, ovocytes au stade de la prophase I). (C1 à C2) COC malsains contenant un ovocyte de couleur brune atrétique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Transférez les COC sains à l’aide d’une pipette dans une nouvelle boîte de Pétri FIV stérile de 60 mm contenant un milieu de FIV pré-équilibré recouvert d’huile à 37°C dans une atmosphère de 5 % O2 et 5 % CO2 (voir étape 2.1).
REMARQUE : Jetez les COC atrétiques. - Conservez la boîte de Pétri FIV dans l’incubateur à 37 °C dans une atmosphère de 5 % d’O2 et de 5 % de CO2 jusqu’à l’étape de dénudation (voir étape 9).
8. Analyse histologique du tissu ovarien
- Fixez la tranche restante de tissu ovarien (contenant à la fois le cortex ovarien et la moelle) dans une solution de formol à 3 % dans un banc propre chimique pour un examen histologique.
REMARQUE : Il ne doit être effectué qu’une fois que les échantillons corticaux sont congelés et stockés avec succès.
ATTENTION : La solution de formol est irritante, corrosive et toxique. Cette étape doit être effectuée avec soin et en dehors du laboratoire de FIV. - Prescrire une analyse histologique complète de cet échantillon de tissu ovarien avec une évaluation de la présence potentielle de cellules malignes ainsi qu’une description du nombre et du type de follicules ovariens (c’est-à-dire follicules primordiaux, primaires, secondaires et antraux, respectivement).
9. Dénudation et sélection des ovocytes
- Effectuer la dénudation des ovocytes. Exposer brièvement les COC à une solution d’hyaluronidase (80 UI/mL ou concentration finale 0,1 mg/mL) par pipetage doux (aspiration et expulsion répétées des COC dans la solution de dénudation) à l’aide d’une pointe de pipette de grand diamètre (volume 0,1 à 20 μL, longueur : 40,5 mm, diamètre du cône de travail : 6 mm, diamètre de l’ouverture : 0,36 mm) pendant 30 s, immédiatement suivie de deux étapes de lavage dans un milieu pré-équilibré recouvert d’huile minérale pour éliminer l’excès d’enzyme (voir étape 2.1).
- Optimisez l’élimination des cumulus et des cellules de la couronne radiale par pipetage doux à l’aide d’une pointe de pipette de 150 μm dans un milieu de FIV pré-équilibré (voir étape 2.1).
- Effectuez une étape de sélection des ovocytes sains à l’aide d’un microscope inversé (grossissement de 200x à 400x). Le stade de maturation des ovocytes sains peut être celui des ovocytes de stade GV, MI ou MII (Figure 3). Les ovocytes sains ont les caractéristiques morphologiques suivantes : un cytoplasme intact et rond, une taille comprise entre 100 et 150 μm et une couleur pâle.
REMARQUE : Jetez les ovocytes atrétiques et malsains (Figure 3, D1-D3).

Figure 3 : Ovocytes matures et immatures prélevés dans le tissu ovarien. (A) Ovocytes matures (ovocyte de stade Métaphase II : présence du premier globule polaire (PB, flèche), pas de noyau visible), (B1–B2) Ovocytes immatures (ovocyte de stade Métaphase I : pas de globule polaire, pas de noyau visible), (C1–C3) Ovocytes immatures (ovocytes germinaux au stade vésiculaire (VG) : pas de globule polaire, présence d’un grand halo avec des nucléoles à l’intérieur du cytoplasme (flèche)). Chez C1, les ovocytes germinaux au stade vésiculaire présentent une taille hétérogène. (D1 à D3) Ovocytes atrétiques. PB : corps polaire. GV : Vésicule germinal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Incuber des ovocytes sains à l’intérieur de l’incubateur à 37 °C, 5 % d’O2 et 5 % de CO2 jusqu’à l’étape de vitrification (voir étape 2.1).
10. Vitrification des ovocytes
- Confirmer l’identification du patient ou de l’échantillon.
- Effectuez une nouvelle étape de sélection d’ovocytes sains à l’aide d’un microscope inversé (grossissement de 200x à 400x).
REMARQUE : Jetez les ovocytes atrétiques et malsains. - Prenez une photo de chaque ovocyte sain à l’aide d’un microscope inversé juste avant l’étape de vitrification. Notez le stade de maturation de chaque ovocyte.
REMARQUE : Joignez toutes ces données (image, taille, stade de maturation) dans le dossier du patient. - Utilisez des numéros d’identification différents par paillette pour les différencier si vous cryoconservez plus d’une paillette par patient.
- Cryoconserver un ou deux ovocyte(s) par paillette.
REMARQUE : Les ovocytes viables matures et immatures doivent être cryoconservés séparément. Lors de la cryoconservation de deux ovocytes ensemble dans la même paille, il est recommandé de sélectionner des ovocytes ayant des caractéristiques morphologiques similaires. - Cryoconservez les ovocytes sains à l’aide d’un kit de vitrification selon les instructions du fabricant (voir tableau des matériaux).
- Chargez les ovocytes cryoconservés sur un dispositif approprié pour la cryoconservation dans l’azote liquide conformément aux instructions du fabricant (voir tableau des matériaux).
- Placez la moitié des pailles dans un premier réservoir de stockage d’azote liquide et l’autre moitié des pailles dans un deuxième réservoir d’azote liquide.
Résultats
Au total, 81 OTC de 81 patientes ont été réalisées entre 2007 et 2020, dont 43 filles prépubères et 38 femmes. L’âge moyen des patientes (filles prépubères et femmes) était de 14,21 ± 9,61 ans (moyenne ± erreur type). Le plus jeune patient avait 5 mois et le plus âgé avait 33,6 ans (tableau 1). L’âge moyen des filles et des femmes prépubères était de 6,84 ± 4,81 ans (min-max : 0,5-15,1) et de 22,76 ± 5,92 ans (min-max : 14,2-33,6), respectivement (Mann-Whitney, p = 3,37 x 10-10).
Le pourcentage de patients ayant des antécédents de traitement gonadotoxique avant OTC était de 48,84 % (21/43) chez les filles prépubères et de 13,16 % (5/38) chez les femmes (Chi2, p = 0,0006). Une ovariectomie complète a été réalisée pour la majorité des patientes (88,89 % (72/81), 43 filles prépubères et 29 femmes) alors qu’une ovariectomie partielle n’a été réalisée que chez 9 femmes (Fisher’s Exact Test, p = 0,0006). La figure 4 montre l’impact négatif de l’utilisation d’un appareil de dissection qui pourrait induire des lésions électriques ou thermiques collatérales au tissu ovarien lors d’une ovariectomie. La figure 5 montre les impacts négatifs de deux traitements différents sur la qualité du tissu ovarien prélevé. Le pourcentage de patientes ayant obtenu un résultat positif pour le prélèvement d’ovocytes dans le tissu ovarien était de 41,86 % (18/43) chez les filles prépubères et de 71,05 % (27/38) chez les femmes (Chi2, p = 0,0008). Aucun ovocyte n’a pu être isolé chez 36 patientes. La plus jeune patiente sur laquelle des ovocytes ont été prélevés avait 3 ans alors que la plus âgée avait 33,6 ans. Le nombre total d’ovocytes matures et immatures était de 71 ovocytes (min-max, 1-9 par patiente) chez les filles prépubères et de 377 ovocytes (min-max, 1-27 par patiente) chez les femmes (Fisher’s Exact Test, p = 1). Le nombre moyen d’ovocytes prélevés par ovariectomie était de 1,65 ± 2,68 chez les filles prépubères et de 9,92 ± 9,51 chez les femmes (Mann Whitney, p = 9,15 x 10-5). Chez les femmes, le nombre moyen d’ovocytes prélevés était similaire dans l’ovariectomie partielle par rapport à l’ovariectomie complète (13,11 ± 7,18 contre 8,93 ± 10,03, Mann-Whitney, p = 0,16). Le nombre moyen d’ovocytes prélevés par patiente avec un prélèvement positif était significativement plus élevé chez les femmes que chez les filles prépubères (13,98 ± 6,38 contre 3,94 ± 2,86, Mann-Whitney, p = 0,0003). Le prélèvement d’ovocytes matures (c’est-à-dire d’ovocytes au stade MII) était extrêmement rare chez les femmes (c’est-à-dire qu’un seul ovocyte mature d’une femme) et inexistant chez les filles prépubères. Au total, 71 ovocytes immatures (4 ovocytes au stade MI et 67 ovocytes au stade GV) ont été prélevés chez des filles prépubères et 376 ovocytes immatures (soit 28 ovocytes au stade MI et 348 ovocytes au stade GV) ont été prélevés chez les femmes (Fisher’s Exact Test, p = 0,8). Le pourcentage d’ovocytes atrétiques était significativement plus élevé chez les filles prépubères que chez les femmes (Chi2, p = 1,43 x 10-7).
Le pourcentage de patientes ayant bénéficié d’une cryoconservation d’ovocytes prélevés dans le tissu ovarien était de 23,26 % (10/43) chez les filles prépubères et de 65,79 % (25/38) chez les femmes (Chi2, p = 0,0001) (Tableau 2). Le nombre total d’ovocytes matures et immatures cryoconservés était de 38 ovocytes (c’est-à-dire 2 ovocytes de stade MI et 36 d’ovocytes de stade GV) chez les filles prépubères et de 310 ovocytes (c’est-à-dire 23 MI et 286 GV) chez les femmes (Fisher’s Exact Test, p = 1 et p = 1, respectivement). Le nombre moyen d’ovocytes cryoconservés par patiente ayant eu la chance de bénéficier de la congélation des ovocytes était de 3,80 ± 2,35 chez les filles prépubères et de 12,40 ± 6,40 chez les femmes (Mann-Whitney, p = 0,0008).
Après la préservation de la fertilité, la majorité des patientes ont choisi de poursuivre le stockage des échantillons de tissu ovarien et d’ovocytes (tableau supplémentaire 1). La principale raison de la destruction de la préservation de la fertilité était la mort des patientes (9,30 % (4/43) chez les filles prépubères et 15,79 % (6/38) chez les femmes). Aucune demande d’utilisation n’a été demandée à ce jour. La perte de suivi était de 4,65 % (2/43) chez les filles prépubères et de 10,53 % (4/38) chez les femmes.
| Filles prépubères | Femme | Analyses statistiques | Valeur P | ||
| n = 43 | n = 38 | ||||
| Âge (moyenne ± SE) (min-max) | 6,84 ± 4,81 (0,5 à 15,1) | 22,76 ± 5,92 (14,2 à 33,6) | Mann-Whitney | 3,37 x 10 à 10 | |
| % de patients ayant des antécédents de traitement gonadotoxique | 48.84% (21/43) | 13.16% (5/38) | Chi2 | 0.0006 | |
| Ovariectomie complète/partielle | 43/0 | 29/9 | Le test exact de Fisher | 0.0006 | |
| Nombre d’ovocytes prélevés par ovariectomie (moyenne +/- SE) | 1,65 ± 2,68 | 9,92 ± 9,51 | Mann-Whitney | 9,15 x 10-5 | |
| Nombre d’ovocytes prélevés par ovariectomie complète (moyenne +/- SE) | 1,65 ± 2,68 | 8,93 ± 10,03A | Mann-Whitney | 0.0068 | |
| Nombre d’ovocytes prélevés par ovariectomie partielle (moyenne +/- SE) | - | 13.11 ± 7.18A | Mann-Whitney | 0,16a | |
| % de patientes avec un prélèvement positif d’ovocytes dans le tissu ovarien | 41.86% (18/43) | 71.05% (27/38) | Chi2 | 0.008 | |
| Nombre d’ovocytes prélevés par patiente avec un prélèvement positif (moyenne +/- SE) | 3,94 ± 2,86 | 13.98 ± 6.38 | Mann-Whitney | 0.0003 | |
| Nombre total d’ovocytes matures (min-max par patiente avec un prélèvement positif) | 0 (0-0) | 1 (0-1) | Le test exact de Fisher | 1 | |
| Nombre total d’ovocytes immatures (min-max par patiente avec un prélèvement positif) | 71 (1-9) | 376 (1-26) | |||
| Stade de maturation des ovocytes immatures | 4 M1 | 28 m1 | Le test exact de Fisher | 0.80 | |
| 67 GV | 348 GV | ||||
| % d’ovocytes atrétiques matures et immatures | 46.48% (33/71) | 18.04% (68/377) | Chi2 | 1,43 x 10-7 | |
Tableau 1 : Caractéristiques cliniques et paramètres biologiques du prélèvement d’ovocytes dans le tissu ovarien. SE = erreur type. unAnalyse statistique du nombre d’ovocytes prélevés dans le tissu ovarien obtenu après une ovariectomie partielle par rapport à l’ovariectomie complète chez la femme.
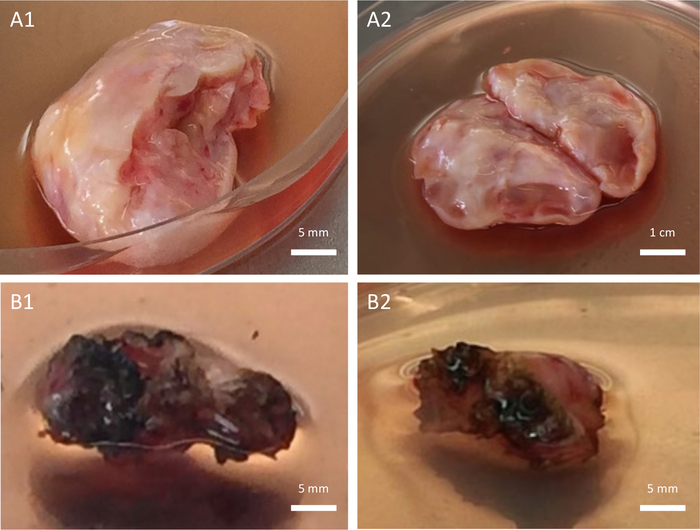
Figure 4 : Qualité du tissu ovarien. Tissu ovarien collecté de haute qualité (A1-A2) par rapport à de faible qualité (B1-B2). La mauvaise qualité est due à l’utilisation d’un dispositif de dissection inapproprié qui avait induit des lésions collatérales au tissu ovarien lors de l’ovariectomie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
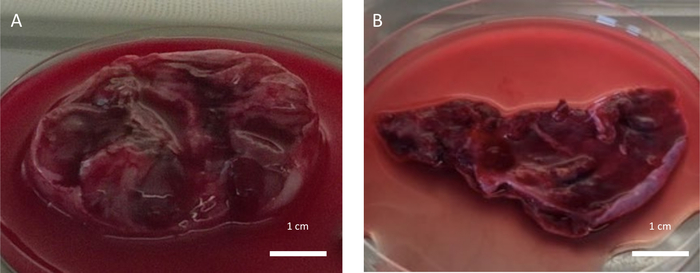
Figure 5 : Tissu ovarien de mauvaise qualité. Tissu ovarien collecté de mauvaise qualité en raison des impacts négatifs de (A) la ponction ovarienne après une stimulation hormonale effectuée 2 jours avant l’OTC et (B) un traitement de chimiothérapie récent administré la semaine avant l’OTC. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Filles prépubères | Femme | Analyses statistiques | Valeur P | ||
| n = 43 | n = 38 | ||||
| % de patientes ayant bénéficié d’une cryoconservation d’ovocytes prélevés dans le tissu ovarien | 23.26% (10/43) | 65.79% (25/38) | Chi2 | 0.0001 | |
| Nombre d’ovocytes cryoconservés par patiente avec une cryoconservation (moyenne +/- SE) | 3,80 ± 2,35 | 12.40 ± 6.40 | Mann-Whitney | 0.0008 | |
| Nombre total d’ovocytes matures sains cryoconservés (min-max par patiente) | 0 (0-0) | 1 (0-1) | Le test exact de Fisher | 1 | |
| Nombre total d’ovocytes cryoconservés immatures sains | 38 (1-9) | 309 (1-23) | |||
| Stade de maturation d’ovocytes cryoconservés immatures sains | 2 M1 | 23 M1 | Le test exact de Fisher | 1 | |
| 36 GV | 286 GV | ||||
Tableau 2 : Proportion de patientes ayant bénéficié de la cryoconservation d’ovocytes prélevés dans le tissu ovarien et paramètres biologiques d’ovocytes cryoconservés.
Tableau supplémentaire 1 : Stockage/destruction de la fertilité, préservation et suivi des patients. Préservation de la fertilité : tissu ovarien cryoconservé +/- ovocytes prélevés dans le tissu ovarien. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le présent manuscrit fournit un protocole combinant la congélation du tissu ovarien et la cryoconservation des ovocytes prélevés dans le tissu ovarien, augmentant ainsi le potentiel de fertilité chez les filles prépubères et les femmes à risque de POI. Nous recommandons vivement d’effectuer ce protocole avant le début de tout traitement gonadotoxique afin d’optimiser la quantité (c’est-à-dire le nombre d’ovocytes viables) ainsi que la qualité (c’est-à-dire l’intégrité de l’ADN et la compétence du cytoplasme) des ovocytes conservés, optimisant ainsi leur sécurité pour une utilisation clinique24. S’il n’est pas possible d’effectuer ce protocole avant toute forme de traitement gonadotoxique, ce protocole peut également être mis en œuvre après le début du traitement gonadotoxique, mais une extrême prudence est alors conseillée lors de l’utilisation de ces ovocytes dans le cadre d’un PMA, justifiant des précautions spécifiques telles que le test génétique préimplantatoire (PGT), une surveillance fœtale attentive et l’amniocentèse16.
En l’absence d’un consensus clair sur la quantité de tissu ovarien qui doit être prélevée pour la préservation de la fertilité, nous recommandons de réaliser une ovariectomie complète chez les filles prépubères ainsi que chez les patientes associées à un risque modéré/élevé de POI ou à une faible réserve ovarienne. En effet, le volume de tissu ovarien prélevé lors de l’ovariectomie sera directement corrélé au nombre d’ovocytes pouvant être prélevés puis cryoconservés pour la même patiente. Dans nos résultats, nous avons observé que les nombres d’ovocytes prélevés étaient similaires dans l’ovariectomie partielle par rapport à l’ovariectomie complète chez les femmes, mais ce résultat reflète les différences de réserve ovarienne entre les patientes à qui nous avons proposé une ovariectomie partielle (c’est-à-dire les patientes jeunes associées à une réserve ovarienne élevée et à un faible risque de POI) et celles à qui nous avons proposé une ovariectomie totale (i.e. les patientes plus âgées associées à une faible réserve ovarienne et à un risque modéré/élevé de POI)16. À ce jour, aucun dommage significatif de l’ovariectomie unilatérale sur la fertilité féminine à long terme n’a été signalé et le début de la ménopause semble similaire (ou au pire peut-être 1 an plus tôt chez l’homme), probablement en raison d’un mécanisme compensatoire qui conduit à un taux de recrutement plus lent des follicules primordiaux11,25. Par conséquent, il ne semble pas y avoir d’effet négatif significatif de l’ovariectomie complète, alors qu’elle pourrait permettre la cryoconservation d’un grand nombre d’ovocytes, augmentant ainsi les chances d’avoir une naissance vivante. De plus, l’utilisation d’ovocytes cryoconservés par fécondation in vitro est beaucoup plus facile et plus sûre que la greffe de tissu cortical ovarien cryoconservé/décongelé car le risque de réensemencement de la maladie de la patiente est alors évité. Par conséquent, cette approche est particulièrement appropriée dans les maladies du sang ou métastatiques associées à un risque de réensemencement possible de la malignité à partir de tissu ovarien transplanté 15,16,17,18, en particulier chez les patientes atteintes de leucémie 19.
À ce jour, la congélation lente semble donner de meilleurs résultats que la vitrification pour la cryoconservation d’échantillons de tissu ovarien, mais la vitrification est nettement meilleure pour la congélation d’ovocytes26. Ces résultats expliquent pourquoi nous avons choisi de préserver le tissu ovarien avec la technique de congélation lente alors que les ovocytes récupérés ont été vitrifiés. Nous choisissons également de vitrifier les ovocytes immatures avant toute étape de maturation in vitro (MIV) car nous espérons que les performances de la MIV seront significativement améliorées à l’avenir. À l’heure actuelle, les données sont rares sur le moment optimal de la vitrification des ovocytes (c’est-à-dire avant ou après la MIV), ce qui empêche toute conclusion sur la stratégie la plus efficace. Une seule méta-analyse sur ce sujet a été publiée en 201827, mais elle concerne principalement les ovocytes immatures récupérés après stimulation hormonale (et non les ovocytes prélevés dans le tissu ovarien) et n’évalue que le taux de maturation des ovocytes et aucun autre résultat clinique (tels que les taux de fécondation, le développement de l’embryon ou les taux de grossesse/naissances vivantes). De plus, le même protocole IVM a été réalisé avant et après les étapes de vitrification/décongélation, excluant l’impact des progrès futurs des protocoles IVM. Comme les ovocytes congelés pour la préservation de la fertilité ne seront pas utilisés avant plusieurs années, voire des décennies dans le cas des filles prépubères, des progrès seront très certainement réalisés dans les protocoles de GIV dans les années à venir, laissant espérer de meilleurs résultats en termes de taux de maturation des ovocytes ainsi que de potentiel de développement/implantation.
On dispose de peu de données sur le potentiel de développement des ovocytes dérivés du tissu ovarien après une ovariectomie, en particulier chez des filles prépubères. Certaines études rapportant des taux plus élevés d’atrésie et de morphologie anormale combinés à un potentiel de maturation plus faible 16,28,29 dans les ovocytes prélevés chez les filles prépubères par rapport aux femmes, tandis que d’autres publications décrivant des caractéristiques similaires sont de référence 16,24,30,31,32,33,34,35. À notre connaissance, il n’y a pas de rapport de grossesse après MIV d’ovocytes congelés pendant l’enfance ou l’adolescence. Chez les femmes, les taux de grossesse clinique et la morbidité néonatale semblent similaires après la MIV par rapport à la FIV/ICSI standard36. D’autres rapports sont nécessaires sur le potentiel de restauration de la fertilité des ovocytes prélevés dans le tissu ovarien, en particulier chez les patientes prépubères.
Déclarations de divulgation
Aucun des auteurs n’a d’intérêts concurrents.
Remerciements
Nous remercions tous les membres de nos centres impliqués dans l’activité de préservation de la fertilité (gynécologues, biologistes, oncologues et anatomopathologistes). L’étude a été menée dans le cadre des procédures de routine pour la préservation de la fertilité. Aucun financement n’a été reçu.
matériels
| Name | Company | Catalog Number | Comments |
| 1 ml disposable syringe | CDD | 1323101/7002655 | Other material and sizes may also be suitable |
| 21-gauge syringe needle | Merck | Z192481 | Other material and sizes may also be suitable |
| 35 mm IVF Petri Dish | Nunc | 150255 | Other material and sizes may also be suitable |
| 60 mm IVF Petri Dish | Nunc | 150270 | Other material and sizes may also be suitable |
| 90 mm IVF Petri Dish | Nunc | 150360 | Other material and sizes may also be suitable |
| Atraumatic forceps | Medlane | PI 299 04 | Other material and sizes may also be suitable |
| Continuous Single Culture Complete with HSA | Irvine Scientific | 90165 | IVF culture medium for follicular fluid collection, COCs incubation, oocyte denudation and oocyte incubation until the vitrification step. |
| Cryotube | Thermo Scientific | 368632 | Other products may also be suitable |
| Dimethylsulfoxide (DMSO) | MILTENYI BIOTEC SAS | 170-076-303 | CryoMACS DMSO 10 (EP) |
| GT40 | Air Liquide | 1,13,517 | Storage tank |
| HSV High Security Vitrification Straw | Irvine Scientific | 25251 | Vitrification straws |
| Human serum albumin | Vitrolife | 10064 | Other products may also be suitable |
| Leibovitz L15 medium | Eurobio | CM1L15000U | Culture medium for ovarian tissue collection, transport and tissue dissection |
| Leibovitz L15 medium | Eurobio | CM1L15000U | Culture medium for freezing solution |
| Mars-IVF Class II Workstation/L126 IVF Dual | CooperSurgical | WM1500/6-133-911-121 | Workstation |
| Programmable freezer | Planner KRYO 500 | Kryo 560-16 | Other equipements may also be suitable |
| Scissors with sharp straight blades and finely sharpened points | Medlane | CI 034 03 | Other material and sizes may also be suitable |
| Stripper | CooperSurgical | MXL3-STR-CGR | Other products may also be suitable |
| Tips (150µm) for Stripper | CooperSurgical | MXL3-150 | Other products may also be suitable |
| Vitrification Kit | Irvine Scientific | 90133 | Protocols are available at http://www.irvinesci.com/products/90133-so-vitrification-freeze-solutions. Other products may also be suitable |
Références
- Ataman, L. M., et al. Creating a global community of practice for oncofertility. Journal of Global Oncology. 2 (2), 83-96 (2016).
- Rivas Leonel, E. C., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Chae-Kim, J. J., Gavrilova-Jordan, L. Premature ovarian insufficiency: procreative management and preventive strategies. Biomedicines. 7 (1), (2018).
- Anderson, R. A., Wallace, W. H. B., Telfer, E. E. Ovarian tissue cryopreservation for fertility preservation: clinical and research perspectives. Human Reproduction Open. 2017 (1), (2017).
- Donnez, J., Dolmans, M. M. Fertility preservation in women. The New England Journal of Medicine. 377 (17), 1657-1665 (2017).
- Lambertini, M., et al. Ovarian suppression using luteinizing hormone-releasing hormone agonists during chemotherapy to preserve ovarian function and fertility of breast cancer patients: a meta-analysis of randomized studies. Annals of Oncology. 26 (12), 2408-2419 (2015).
- Gubbala, K., et al. Outcomes of ovarian transposition in gynaecological cancers; a systematic review and meta-analysis. Journal of Ovarian Research. 7, 69(2014).
- Poirot, C., et al. Induction of puberty by autograft of cryopreserved ovarian tissue. Lancet. 379 (9815), 588(2012).
- Ernst, E., Kjaersgaard, M., Birkebaek, N. H., Clausen, N., Andersen, C. Y. Case report: stimulation of puberty in a girl with chemo- and radiation therapy induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. European Journal of Cancer. 49 (4), 911-914 (2013).
- Pacheco, F., Oktay, K. Current success and efficiency of autologous ovarian transplantation: a meta-analysis. Reproductive Sciences. 24 (8), 1111-1120 (2017).
- Silber, S., Kagawa, N., Kuwayama, M., Gosden, R. Duration of fertility after fresh and frozen ovary transplantation. Fertility and Sterility. 94 (6), 2191-2196 (2010).
- Donnez, J., et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet. 364 (9443), 1405-1410 (2004).
- Donnez, J., et al. Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue: a review of 60 cases of reimplantation. Fertility and Sterility. 99 (6), 1503-1513 (2013).
- Jensen, A. K., et al. Outcomes of transplantations of cryopreserved ovarian tissue to 41 women in Denmark. Human Reproduction. 30 (12), 2838-2845 (2015).
- Abir, R., et al. Occasional involvement of the ovary in Ewing sarcoma. Human Reproduction. 25 (7), 1708-1712 (2010).
- Abir, R., et al. Cryopreservation of in vitro matured oocytes in addition to ovarian tissue freezing for fertility preservation in paediatric female cancer patients before and after cancer therapy. Human Reproduction. 31 (4), 750-762 (2016).
- Abir, R., et al. Ovarian minimal residual disease in chronic myeloid leukaemia. Reproductive BioMedicine Online. 28 (2), 255-260 (2014).
- Dolmans, M. M., Luyckx, V., Donnez, J., Andersen, C. Y., Greve, T. Risk of transferring malignant cells with transplanted frozen-thawed ovarian tissue. Fertility and Sterility. 99 (6), 1514-1522 (2013).
- Soares, M., et al. Eliminating malignant cells from cryopreserved ovarian tissue is possible in leukaemia patients. The British Journal of Haematology. 178 (2), 231-239 (2017).
- Son, W. Y., Henderson, S., Cohen, Y., Dahan, M., Buckett, W. Immature oocyte for fertility preservation. Frontiers in Endocrinology. 10, 464(2019).
- Yang, Z. Y., Chian, R. C. Development of in vitro maturation techniques for clinical applications. Fertility and Sterility. 108 (4), 577-584 (2017).
- Imbert, R., et al. Safety and usefulness of cryopreservation of ovarian tissue to preserve fertility: a 12-year retrospective analysis. Human Reproduction. 29 (9), 1931-1940 (2014).
- Duncan, F. E., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction. 152 (6), 201-210 (2016).
- Abir, R., et al. Selection of patients before and after anticancer treatment for ovarian cryopreservation. Human Reproduction. 23 (4), 869-877 (2008).
- Yasui, T., et al. Factors associated with premature ovarian failure, early menopause and earlier onset of menopause in Japanese women. Maturitas. 72 (3), 249-255 (2012).
- Cobo, A., Diaz, C. Clinical application of oocyte vitrification: a systematic review and meta-analysis of randomized controlled trials. Fertility and Sterility. 96 (2), 277-285 (2011).
- Mohsenzadeh, M., Salehi-Abargouei, A., Tabibnejad, N., Karimi-Zarchi, M., Khalili, M. A. Effect of vitrification on human oocyte maturation rate during in vitro maturation procedure: A systematic review and meta-analysis. Cryobiology. 83, 84-89 (2018).
- Anderson, R. A., McLaughlin, M., Wallace, W. H., Albertini, D. F., Telfer, E. E. The immature human ovary shows loss of abnormal follicles and increasing follicle developmental competence through childhood and adolescence. Human Reproduction. 29 (1), 97-106 (2014).
- Revel, A., et al. At what age can human oocytes be obtained. Fertility and Sterility. 92 (2), 458-463 (2009).
- Margulis, S., et al. morphogenetic protein 15 expression in human ovaries from fetuses, girls, and women. Fertility and Sterility. 92 (5), 1666-1673 (2009).
- Kedem, A., et al. Alginate scaffold for organ culture of cryopreserved-thawed human ovarian cortical follicles. Journal of Assisted Reproduction and Genetics. 28 (9), 761-769 (2011).
- Lerer-Serfaty, G., et al. Attempted application of bioengineered/biosynthetic supporting matrices with phosphatidylinositol-trisphosphate-enhancing substances to organ culture of human primordial follicles. Journal of Assisted Reproduction and Genetics. 30 (10), 1279-1288 (2013).
- Ben-Haroush, A., Sapir, O., Fisch, B. Aspiration of immature oocytes during cesarean section for fertility preservation and future surrogacy. American Journal of Obstetrics and Gynecology. 203 (1), 12-14 (2010).
- Farhi, J., Sapir, O., Maman, M., Fisch, B., Ben-Haroush, A. Novel protocol for scheduling oocyte retrieval in IVM cycles in PCOS patients: a case series. Reproductive BioMedicine Online. 23 (6), 765-768 (2011).
- Segers, I., et al. In vitro maturation (IVM) of oocytes recovered from ovariectomy specimens in the laboratory: a promising "ex vivo" method of oocyte cryopreservation resulting in the first report of an ongoing pregnancy in Europe. Journal of Assisted Reproduction and Genetics. 32 (8), 1221-1231 (2015).
- Ellenbogen, A., Shavit, T., Shalom-Paz, E. IVM results are comparable and may have advantages over standard IVF. Facts, Views & Vision in ObGyn. 6 (2), 77-80 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.