Method Article
حفظ البويضات المسترجعة بالتبريد من أنسجة المبيض لتحسين الحفاظ على الخصوبة لدى الفتيات والنساء قبل البلوغ
In This Article
Summary
نقترح بروتوكولا للحفاظ على الخصوبة لدى الفتيات قبل البلوغ والنساء المعرضات لخطر قصور المبيض المبكر. فهو يجمع بين تجميد أنسجة المبيض وحفظ البويضات المسترجعة من أنسجة المبيض. تعمل هذه الاستراتيجية على تحسين السلامة وتحسين الإمكانات الإنجابية للحفاظ على الخصوبة ، مما يزيد من فرصة الولادة.
Abstract
يستخدم حفظ أنسجة المبيض البشري بالتبريد (OTC) بشكل متزايد في جميع أنحاء العالم للحفاظ على خصوبة الإناث لدى الفتيات قبل البلوغ والنساء المعرضات لخطر قصور المبيض المبكر (POI) في سياق العلاجات العاجلة السامة للغدد التناسلية أو جراحة المبيض. يعد الحفاظ على الخصوبة أمرا صعبا لأنه لا يوجد إجماع بشأن إدارة المريض أو استراتيجيات الحفاظ على الخصوبة أو حتى بروتوكولات المختبر الفنية ، مما يعني أنه يجب تكييف كل إجراء مع خصائص ملف المريض ونسبة المخاطر إلى الفوائد الخاصة به. أثناء OTC ، يمكن شفط البويضات الناضجة / غير الناضجة مباشرة من البصيلات الشعرية الكبيرة / الصغيرة داخل عينات أنسجة المبيض و / أو يتم إطلاقها في وسط المزرعة من البصيلات النامية أثناء تشريح أنسجة المبيض في الفتيات والنساء قبل البلوغ. في هذه المخطوطة ، نقدم بروتوكولا يجمع بين تجميد أنسجة المبيض وحفظ البويضات الناضجة / غير الناضجة بالتبريد التي تم استردادها من عينات أنسجة المبيض ، مما يحسن القدرة الإنجابية للحفاظ على الخصوبة. سيتم وصف الجمع المناسب لأنسجة المبيض والبويضات والتعامل معها وتخزينها قبل وأثناء وبعد الحفظ بالتبريد. كما ستتم مناقشة الاستخدام اللاحق وسلامة عينات أنسجة المبيض والبويضات المحفوظة بالتبريد / المذابة ، بالإضافة إلى التوقيت الأمثل للنضج المختبري للبويضات غير الناضجة. نوصي بالاستخدام المنهجي لهذا البروتوكول في الحفاظ على الخصوبة للفتيات والنساء قبل البلوغ لأنه يزيد من الإمكانات الإنجابية الكاملة للحفاظ على الخصوبة (أي تزجيج البويضات بالإضافة إلى OTC) ويحسن أيضا سلامة واستخدام الحفاظ على الخصوبة (أي ذوبان البويضات مقابل طعم المبيض) ، مما يزيد من فرصة الولادة الناجحة للمرضى المعرضين لخطر POI.
Introduction
نما مجال الحفاظ على الخصوبة على مدى العقدين الماضيين بسبب العدد المتزايد من المرضى المعرضين لخطر قصور المبيض المبكر (POI) 1،2،3. الخيارات الطبية المتاحة حاليا للحفاظ على الخصوبة هي حفظ أنسجة المبيض بالتبريد (OTC) 4 ، وتجميد البويضات / الأجنة بعد تحفيز المبيض5 ، وإعطاء نظائر GnRH6 ، أو تبديل المبيض7. يعد OTC تقدما كبيرا في الحفاظ على الخصوبة ، لا سيما عند الفتيات قبل البلوغ ، حيث هو الخيار الوحيد المتاح حاليا للحفاظ على الخصوبة وأيضا في النساء اللواتي لا يستطعن تأخير بدء العلاج السام للغددالتناسلية 2،4.
يسمح OTC بالحفاظ على عدد كبير من البصيلات البدائية ، والتي تقع في الجزء الخارجي 1 مم من قشرة المبيض2. يمكن استخدام أنسجة المبيض المجمدة / المذابة لاحقا عن طريق الكسب غير المشروع (تقويم العظام أو غير المتجانس ، الذاتي أو المتبرع) أو زراعتها في المختبر للحصول على بويضات ناضجة2. ثبت أن طعم عينات أنسجة المبيض قبل البلوغ المجمدة المذابة يحفز البلوغ8،9. في النساء ، تكون النتائج الإنجابية بعد التطعيم الذاتي لتقويم قشرة المبيض المجمدة المذابة مطمئنة ، حيث تصل معدلات المواليد الأحياء إلى 57.5٪ بعد الحمل الطبيعي10 وبين 30٪ إلى 70٪ بعد الحمل المساعد على الإنجاب (ART)11. منذ أول ولادة حية من زرع تقويم العظام لأنسجة المبيض البشري المجمدة / المذابة في عام 200412 ، سمحت هذه التقنية بولادة ما لا يقل عن 130 طفلا في جميع أنحاءالعالم 2. تستمر الوظائف الهرمونية والتناسلية لأنسجة الكسب غير المشروع بشكل عام لعدة سنوات11،13،14 ، مما يؤكد وظيفتها على المدى الطويل.
ومع ذلك ، فإن الزرع الذاتي لعينات أنسجة المبيض ينطوي على خطر نظري لإعادة إدخال خلايا خبيثة قابلة للحياة في بعض المرضى15،16،17،18 ، خاصة في الناجين من سرطانالدم 19. حتى الآن ، لم يتم الإبلاغ عن أي حالة انتقال للسرطان عن طريق طعم قشرة المبيض المجمدة / المذابة في الناجين الأصحاء من السرطان11 ، مما يشير إلى أن الطبيعة اللاوعائية الليفية لقشرة المبيض يمكن أن تمثل بيئة مكروية غير مضيافة لنشر الخلايا الخبيثة. ومع ذلك ، لا يزال تطعيم أنسجة المبيض يمثل تقنية تجريبية وصعبة ، مما يشير إلى أنه يجب اعتبار استخدام البويضات حاليا نهجا أسهل وأكثر أمانا من ترقيع أنسجة المبيض لاستعادة الخصوبة. ومن المثير للاهتمام ، أنه يمكن استرداد البويضات غير الناضجة بسهولة من أنسجة المبيض أثناء OTC في كل من الفتيات والنساء في سن البلوغ16 ، مما يشير إلى أنه يمكن أن يمثل مصدرا موثوقا به لتعظيم إمكانات استعادة الخصوبة بالإضافة إلى تجميد الأنسجة القشرية المبيضية. يمكن شفط هذه البويضات يدويا خارج الجسم الحي في مختبر العلاج المضاد للفيروسات القهقرية من البصيلات الباطنة المرئية أو عزلها عن الوسائط المستهلكة بعد تشريح أنسجة المبيض. يمكن بعد ذلك تزجيج البويضات المسترجعة مباشرة في مرحلة غير ناضجة أو أن تنضج قبل خطوة التزجيج باستخدام النضج في المختبر (IVM) 20،21.
في هذه المخطوطة ، نقترح بروتوكولا يجمع بين حفظ أنسجة المبيض بالتبريد مع عزل وحفظ التبريد للبويضات الناضجة (البويضات في مرحلة MII) و / أو البويضات غير الناضجة (أي الحويصلة الجرثومية (GV) والبويضات في مرحلة Metaphase I (MI)) المسترجعة من أنسجة المبيض. يحدد هذا البروتوكول جميع الخطوات المحددة المطلوبة لتعظيم إمكانات الحفاظ على الخصوبة لدى كل من الفتيات والنساء قبل البلوغ.
Protocol
وقعت جميع النساء (فوق سن 18 عاما) وكذلك جميع الفتيات القاصرات وأولياء أمورهن على نموذج موافقة مستنيرة للحفاظ على خصوبة المريض المعرضة لخطر الإصابة ب POI. يعتبر هذا البروتوكول إجراء روتينيا للعلاج المضاد للفيروسات القهقرية في مركزنا للحفاظ على الخصوبة. يتبع إرشادات لجنة أخلاقيات البحث البشري في مؤسساتنا.
1. مراقبة الجودة
- تشمل سن الإناث ≤ 38 عاما ، وتحتوي على تركيز الهرمون المضاد للمولر المنتشر >1 نانوغرام / مل ويظهر وجود خطر متزايد للإصابة ب POI بسبب العلاج السام للتنادل. استبعاد النساء المؤهلات لتزجيج البويضات لإجراء الحفاظ على الخصوبة ، والنساء اللواتي يعانين من حالة تمنع إعطاء موافقة مستنيرة تماما أو النساء المعرضات لخطر كبير من مضاعفات التخدير أو الجراحة.
- تأكد من وجود موافقة موقعة للمريض قبل البدء في هذا الإجراء.
- حدد موقعين شاغرين داخل صهريجين متميزين لتخزين الحفظ بالتبريد. سيتم الاحتفاظ بنصف أنابيب التبريد / القش في خزان التخزين الأول بينما سيتم الاحتفاظ بالنصف الآخر من أنابيب التبريد / القش في الخزان الآخر لتقليل مخاطر الفقد الكلي للعينات في حالة تعطل الخزان.
- تحقق من توفر ووظائف جميع الأجهزة الطبية المطلوبة في هذا البروتوكول. يوصى باستخدام مقص تشريح جراحي معقم بشفرات مستقيمة حادة ونقاط حادة ونقاط حادة بدقة بالإضافة إلى ملقط الأنسجة اللارضحي المعقم لخطوة التشريح.
- تأكد من احترام جميع خطوات مراقبة الجودة لجميع الأجهزة الطبية (على وجه الخصوص ، التحقق من الصحة والتحكم الروتيني في عمليات التعقيم ، والتحقق من رقم انتهاء الصلاحية / الدفعة وتتبعها).
- حافظ على بيئة معقمة / معقمة طوال العملية وتأكد بحذر من جميع احتياطات السلامة.
- استخدم أطباق وماصات وأدوات جراحية مختلفة لكل مريض.
2. اليوم السابق للحفظ
- قم بإعداد طبق بتري معقم 60 مم يحتوي على وسيط أطفال الأنابيب مغطى بالزيت المعدني واحتضان الطبق طوال الليل عند 37 درجة مئوية في جو 5٪ O2 و 5٪ CO2. استخدم هذا الطبق لجمع مجمعات البويضات الركامية (COCs) التي من المحتمل استرجاعها من الأنسجة (انظر القسم 7.2).
- قم بإعداد طبق بتري معقم 35 مم يحتوي على وسط التلقيح الاصطناعي واحتضان الطبق طوال الليل عند 37 درجة مئوية في جو 5٪ O2 و 5٪ CO2. استخدم هذا الطبق لخطوة تعرية البويضات (انظر القسم 9.1).
- قم بإعداد طبق بتري معقم 35 مم يحتوي على التلقيح الاصطناعي المتوسط المغطى بالزيت المعدني واحتضان الطبق طوال الليل عند 37 درجة مئوية في جو 5٪ O2 و 5٪ CO2. استخدم هذا الطبق لجمع البويضات بعد خطوة التعرية (انظر القسم 9.4).
3. جمع أنسجة المبيض ونقلها
- قم بإجراء الجراحة بالمنظار تحت التخدير العام باستخدام منفذ واحد مقاس 10 مم في السرة ومنفذين مقاس 5 مم ، أحدهما في الربع الأيسر السفلي والآخر على اليمين.
- إجراء استئصال المبيض الجزئي أو الكامل من جانب واحد وفقا لقرار الإجماع من طبيب الأورام والجراح والطاقم الطبي لوحدة العلاج المضاد للفيروسات القهقرية بناء على احتياطي المبيض والحجم والجانب العياني لكلا المبيضين (الشكل 1 ، A1-B1) وبروتوكول السمية للغدد التناسلية المخطط له. قم بإجراء استئصال المبيض بمقص حاد أو دعامة جراحية. لا تستخدم أي جهاز تشريح يمكن أن يسبب إصابة جانبية أو كهربائية أو حرارية لأنسجة المبيض المراد الحفاظ عليها.
ملاحظة: يتم إجراء استئصال المبيض الكامل من جانب واحد بشكل عام في الفتيات قبل البلوغ16،22 ، في حين أن استئصال المبيض الجزئي من جانب واحد يمكن تحقيقه بشكل شائع في المرضى البالغين الذين يعانون من تكاثر المبايض الكبيرة و / أو احتياطي المبيض العالي.
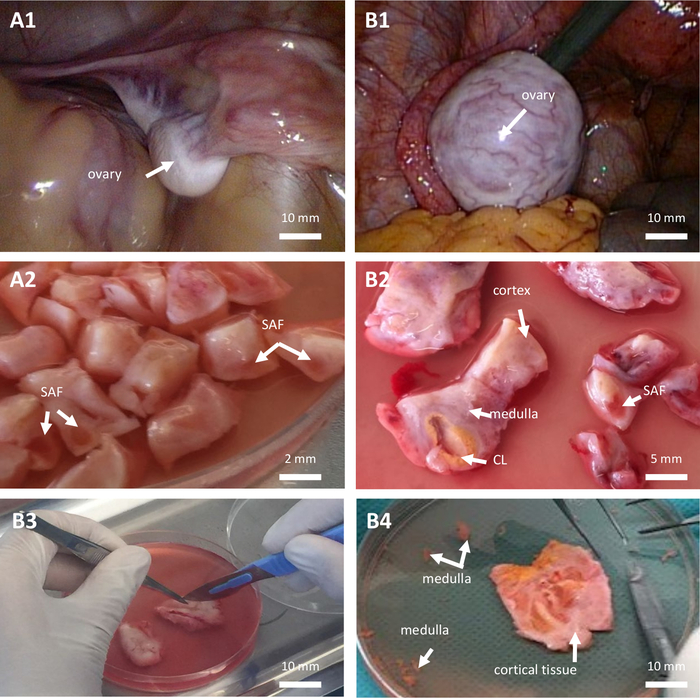
الشكل 1: حفظ أنسجة المبيض بالتبريد. حفظ أنسجة المبيض بالتبريد في فتاة قبل البلوغ (أ ، مريضة تبلغ من العمر 7 سنوات) وفي امرأة (B ، مريضة تبلغ من العمر 28 عاما) كلاهما يعاني من سرطان الدم النخاعي الحاد. (أ1 - ب 1) منظر بالمنظار للمبيض. (أ2 - ب 2 - ب 3) تشريح أنسجة المبيض. (ب 4) أنسجة المبيض القشرية. CL: الجسم الأصفر. SAF: جريب ضئيل صغير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بإجراء إخلاء أنسجة المبيض باستخدام كيس استرجاع عينات بالمنظار يدويا أو تجاري.
- ضع أنسجة المبيض في أنبوب معقم يحتوي على وسط مزرعة عند 4 درجات مئوية. يجب غمر الأنسجة تماما في وسط الثقافة.
- انقل أنسجة المبيض على الفور في كيس معزول عند 4 درجات مئوية إلى مختبر العلاج المضاد للفيروسات القهقرية للحصول على أفضل النتائج.
ملاحظة: إذا لزم الأمر ، يمكن نقل أنسجة المبيض في درجات حرارة باردة (حوالي 4 درجات مئوية) إلى المختبر لمدة تصل إلى 26 ساعة بعد التجميع دون تهديد جودة الأنسجة23.
4. تحضير أنسجة المبيض
- انقل أنسجة المبيض إلى طبق بتري معقم 90 مم يحتوي على 20 مل من وسط المزرعة المبرد مسبقا عند 4 درجات مئوية.
- ضع طبق بتري الذي يحتوي على أنسجة المبيض على صفيحة باردة (عند 4 درجات مئوية) موضوعة على مقعد نظيف عمودي للتدفق الصفحي لتقليل مخاطر تلوث الكائنات الحية الدقيقة.
5. الشفط اليدوي للجريب من عينات أنسجة المبيض
- استنشق البصيلات التاجية المرئية (إذا كانت موجودة على سطح أنسجة المبيض) بإبرة حقنة 21 جم متصلة بحقنة 1 مل يمكن التخلص منها.
ملاحظة: قد تكون هذه الخطوة صعبة. قد يكون البديل هو فتح كل بصيلة غاضية مرئية برفق بمشرط وشطف الجزء الداخلي من كل بصيلة بوسائط التلقيح الاصطناعي من أجل إطلاق COCs برفق داخل وسط التشريح. - اغسل السوائل المسامية المجمعة في طبق بتري معقم مقاس 60 مم يحتوي على 5 مل من وسط ثقافة التلقيح الاصطناعي في درجة حرارة الغرفة.
- اشطف المحقنة ب 1 مل من وسط ثقافة التلقيح الاصطناعي في درجة حرارة الغرفة واغسل السائل في نفس طبق بتري التلقيح الاصطناعي. كرر هذه الخطوة مرتين.
- تحديد وعزل COCs تحت مجهر مقلوب (تكبير 50x-200x).
- انقل COCs السليمة باستخدام ماصة إلى طبق بتري معقم جديد مقاس 60 مم يحتوي على وسط أطفال الأنابيب المتوازن مسبقا المغطى بالزيت عند 37 درجة مئوية في جو من 5٪ O2 و 5٪ CO2.
ملاحظة: تحتوي COCs الصحية على بويضة شفافة. تخلص من COCs الأذينية التي تقدم بويضة بنية اللون. - قم بتخزين طبق بتري التلقيح الاصطناعي في الحاضنة عند 37 درجة مئوية في جو من 5٪ O2 و 5٪ CO2 حتى خطوة التعرية (انظر الخطوة 9).
6. تشريح أنسجة المبيض
- تحضير محلول التجميد الطازج في أنبوب معقم سعة 50 مل. يحتوي محلول التجميد على 1.5 مليون ثنائي ميثيل سلفوكسيد (DMSO) و 10٪ من ألبومين المصل البشري في وسط زراعة أطفال الأنابيب. دوامة بلطف.
ملاحظة: يجب تحضيره قبل الاستخدام مباشرة. - قطع أنسجة المبيض وإزالة النخاع قدر الإمكان (الشكل 1 ، ب 4).
- قطع قشرة المبيض إلى شرائح بقياس 10 مم × 10 مم × 1 مم أو 0.5 مم × 0.5 مم × 1 مم في حالة استئصال المبيض من جانب واحد بالكامل أو جزئي ، على التوالي (الشكل 1 ، A2 - B2 - B3). يتم إجراء القطع بمقص حاد جراحي معقم وملقط غير رضحي.
ملاحظة: يتم الاحتفاظ بشريحة واحدة من أنسجة المبيض سليمة مع كل من قشرة المبيض والنخاع لمزيد من التحليل النسيجي (انظر الخطوة 8). - بعد التشريح ، قم بإجراء خطوتي غسيل (أو أكثر ، إذا لزم الأمر) لكل عينة قشرية للمبيض في 1 مل من وسط ثقافة التلقيح الاصطناعي لإزالة الدم. بعد الغسيل ، انقل جميع عينات المناديل إلى طبق بتري جديد مقاس 60 مم مع وسط ثقافة أطفال الأنابيب الطازج.
- ضع كل عينة من قشرة المبيض في أنبوب تبريد يحتوي على 1 مل من محلول التجميد.
ملاحظة: الخلط غير ضروري. لا يتم حفظ شريحة أنسجة المبيض المحفوظة لمزيد من التحليل النسيجي بالتبريد (انظر الخطوة 8). - احتفظ بالعينات لمدة 30 دقيقة عند 4 درجات مئوية لتحقيق التوازن مع محلول التجميد.
- حفظ جميع العينات بالتبريد بتقنية التجميد البطيء. معدل التبريد هو -2 درجة مئوية / دقيقة من +4 درجة مئوية حتى -9 درجة مئوية ، -50 درجة مئوية / دقيقة حتى -30 درجة مئوية ؛ استمر خلال 1 دقيقة ، +4 درجة مئوية / دقيقة حتى -15 درجة مئوية ، -2 درجة مئوية / دقيقة حتى -40 درجة مئوية ؛ وأخيرا -25 درجة مئوية / دقيقة حتى -150 درجة مئوية باستخدام فريزر قابل للبرمجة.
- قم بإزالة الأنابيب المبردة على الفور واغمرها في النيتروجين السائل عند -196 درجة مئوية.
- ضع نصف أنابيب التبريد في خزان تخزين النيتروجين السائل الأول والنصف الآخر من أنابيب التبريد في خزان النيتروجين السائل الثاني.
7. عزل COC يدويا عن وسائط التشريح المستهلكة
- حدد COCs من وسائط التشريح المستهلكة تحت المجهر (تكبير 50x-200x) (الشكل 2).

الشكل 2: COCs الناضجة وغير الناضجة المسترجعة من أنسجة المبيض. COCs الناضجة (A) وغير الناضجة (B1-B3 ، C1-C2) التي تم استردادها من أنسجة المبيض. (أ) COC الناضج الذي يحتوي على بويضة ناضجة (وجود الجسم القطبي الأول ، بويضة المرحلة الثانية). (ب 1) COC صحي غير ناضج يحتوي على بويضة غير ناضجة (بدون جسم قطبي ، بويضة المرحلة الأولى). (ب 2 - ب 3) COCs صحية غير ناضجة تحتوي على بويضات غير ناضجة في مرحلة الحويصلة الجرثومية (بدون جسم قطبي ، بويضات المرحلة الأولى). (ج1 - ج2) COCs غير الصحية التي تحتوي على بويضة بنية اللون الأذني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- انقل COCs السليمة باستخدام ماصة إلى طبق بتري معقم جديد مقاس 60 مم يحتوي على وسيط أطفال الأنابيب المتوازن مسبقا المغطى بالزيت عند 37 درجة مئوية في جو من 5٪ O2 و 5٪ CO2 (انظر الخطوة 2.1).
ملاحظة: تخلص من COCs الكرياتية. - قم بتخزين طبق بتري التلقيح الاصطناعي في الحاضنة عند 37 درجة مئوية في جو من 5٪ O2 و 5٪ CO2 حتى خطوة التعرية (انظر الخطوة 9).
8. التحليل النسيجي لأنسجة المبيض
- قم بإصلاح الشريحة المتبقية من أنسجة المبيض (التي تحتوي على كل من قشرة المبيض والنخاع) في محلول فورمالين بنسبة 3٪ في مقعد كيميائي نظيف للفحص النسيجي.
ملاحظة: يجب إجراؤه فقط بمجرد تجميد العينات القشرية وتخزينها بنجاح.
تنبيه: محلول الفورمالين مزعج وتآكل وسام. يجب تنفيذ هذه الخطوة بعناية وخارج مختبر أطفال الأنابيب. - وصف تحليل نسيجي كامل لعينة أنسجة المبيض هذه مع تقييم الوجود المحتمل للخلايا الخبيثة بالإضافة إلى وصف لعدد ونوع بصيلات المبيض (أي البصيلات البدائية والأولية والثانوية والجراحية ، على التوالي).
9. تعرية البويضات واختيارها
- إجراء تعرية البويضات. قم بتعريض COCs لفترة وجيزة لمحلول الهيالورونيداز (80 وحدة دولية / مل أو التركيز النهائي 0.1 مجم / مل) مع سحب العينة اللطيف (الشفط المتكرر وطرد COCs في محلول التعري) باستخدام طرف ماصة كبير القطر (الحجم 0.1-20 ميكرولتر ، الطول: 40.5 مم ، قطر مخروط العمل: 6 مم ، فتحة القطر: 0.36 مم) لمدة 30 ثانية ، تليها مباشرة خطوتان للغسيل في وسط متوازن مسبقا مغطى بالزيت المعدني لإزالة الإنزيم الزائد (انظر الخطوة 2.1).
- قم بتحسين إزالة الخلايا الركامية والهالة عن طريق سحب العينة اللطيف باستخدام طرف ماصة 150 ميكرومتر في وسط التلقيح الاصطناعي المتوازن مسبقا (انظر الخطوة 2.1).
- قم بإجراء خطوة اختيار من البويضات السليمة باستخدام مجهر مقلوب (تكبير 200x-400x). يمكن أن تكون مرحلة نضج البويضات السليمة هي بويضات GV أو MI أو MII (الشكل 3). تتميز البويضات السليمة بالخصائص المورفولوجية التالية: سيتوبلازم سليم ومستدير ، وحجم يتراوح بين 100-150 ميكرومتر ، ولون شاحب.
ملاحظة: تخلص من البويضات الرشيقية وغير الصحية (الشكل 3 ، D1-D3).

الشكل 3: البويضات الناضجة وغير الناضجة المسترجعة من أنسجة المبيض. (أ) البويضة الناضجة (بويضة المرحلة الثانية: وجود جسم قطبي أول (PB ، سهم) ، لا توجد نواة مرئية) ، (B1-B2) البويضات غير الناضجة (بويضة المرحلة الأولى: لا يوجد جسم قطبي ، لا نواة مرئية) ، (C1-C3) البويضات غير الناضجة (بويضات المرحلة الجرثومية (VG): لا يوجد جسم قطبي ، وجود هالة كبيرة مع نوى داخل السيتوبلازم (السهم)). في C1 ، تظهر بويضات المرحلة الجرثومية حجما غير متجانس. (D1 - D3) البويضات الكريمية. PB: الجسم القطبي. الأصوات العالمية: الحويصلة الجرثومة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- احتضان البويضات السليمة داخل الحاضنة عند 37 درجة مئوية و 5٪ O2 و 5٪ CO2 حتى خطوة التزجيج (انظر الخطوة 2.1).
10. تزجيج البويضات
- تأكيد تحديد المريض / العينة.
- قم بإجراء خطوة اختيار جديدة للبويضات السليمة باستخدام مجهر مقلوب (تكبير 200x-400x).
ملاحظة: تخلص من البويضات الرشيقية وغير الصحية. - التقط صورة لكل بويضة صحية باستخدام مجهر مقلوب قبل خطوة التزجيج مباشرة. لاحظ مرحلة نضج كل بويضة.
ملاحظة: إرفاق كل هذه البيانات (الصورة ، الحجم ، مرحلة النضج) في ملف المريض. - استخدم أرقام تعريف مختلفة لكل قشة للتمييز بينها في حالة حفظ أكثر من ماصة واحدة بالتبريد لكل مريض.
- حافظ بالتبريد على بويضة واحدة أو اثنتين لكل قشة.
ملاحظة: يجب حفظ البويضات الناضجة وغير الناضجة القابلة للحياة بالتبريد بشكل منفصل. عند حفظ بويضتين بالتبريد معا في نفس القش ، يوصى باختيار البويضات ذات الخصائص المورفولوجية المماثلة. - حافظ على البويضات الصحية بالتبريد باستخدام مجموعة التزجيج وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
- قم بتحميل البويضات المحفوظة بالتبريد على جهاز مناسب للتخزين بالتبريد في النيتروجين السائل وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
- ضع نصف القش في خزان تخزين النيتروجين السائل الأول والنصف الآخر من القش في خزان نيتروجين سائل ثان.
النتائج
تم إجراء ما مجموعه 81 فتاة بدون وصفة طبية من 81 مريضة بين عامي 2007 و 2020 ، بما في ذلك 43 فتاة قبل البلوغ و 38 امرأة. كان متوسط عمر المريضات (الفتيات والنساء قبل البلوغ) 14.21 ± 9.61 سنة (متوسط ± الخطأ المعياري). كان أصغر مريض يبلغ من العمر 5 أشهر وأكبرهم يبلغ من العمر 33.6 عاما (الجدول 1). كان متوسط عمر الفتيات والنساء قبل البلوغ 6.84 ± 4.81 سنة (الحد الأدنى - الحد الأقصى: 0.5-15.1) و 22.76 ± 5.92 سنة (الحد الأدنى - الحد الأقصى: 14.2-33.6) ، على التوالي (مان ويتني ، ص = 3.37 × 10-10).
كانت النسبة المئوية للمرضى الذين لديهم تاريخ من العلاج السام للغدد التناسلية قبل OTC 48.84٪ (21/43) في الفتيات قبل البلوغ و 13.16٪ (5/38) عند النساء (Chi2 ، p = 0.0006). تم إجراء استئصال المبيض الكامل لغالبية المرضى (88.89٪ (72/81) ، 43 فتاة قبل البلوغ و 29 امرأة) بينما تم إجراء استئصال المبيض الجزئي فقط في 9 نساء (اختبار فيشر الدقيق ، ص = 0.0006). يوضح الشكل 4 التأثير السلبي لاستخدام جهاز التشريح الذي يمكن أن يسبب إصابة كهربائية أو حرارية جانبية لأنسجة المبيض أثناء استئصال المبيض. يوضح الشكل 5 الآثار السلبية لعلاجين مختلفين على جودة أنسجة المبيض التي تم جمعها. كانت النسبة المئوية للمرضى الذين لديهم استرجاع إيجابي للبويضات من أنسجة المبيض 41.86٪ (18/43) في الفتيات قبل البلوغ و 71.05٪ (27/38) عند النساء (Chi2 ، p = 0.0008). لا يمكن عزل أي بويضات في 36 مريضا. كان أصغر مريض تم استرداد البويضات منه يبلغ من العمر 3 سنوات بينما كان أكبرهم يبلغ من العمر 33.6 عاما. كان العدد الإجمالي للبويضات الناضجة وغير الناضجة 71 بويضة (الحد الأدنى - الحد الأقصى ، 1-9 لكل مريض) في الفتيات قبل البلوغ و 377 بويضة (الحد الأدنى - الحد الأقصى ، 1-27 لكل مريض) في النساء (اختبار فيشر الدقيق ، ص = 1). كان متوسط عدد البويضات المسترجعة لكل استئصال المبيض 1.65 ± 2.68 في الفتيات قبل البلوغ و 9.92 ± 9.51 عند النساء (مان ويتني ، ص = 9.15 × 10-5). في النساء ، كان متوسط عدد البويضات المسترجعة متشابها في استئصال المبيض الجزئي مقارنة باستئصال المبيض الكامل (13.11 ± 7.18 مقابل 8.93 ± 10.03 ، مان ويتني ، ص = 0.16). كان متوسط عدد البويضات المسترجعة لكل مريض مع استرجاع إيجابي أعلى بشكل ملحوظ في النساء مقارنة بالفتيات قبل البلوغ (13.98 ± 6.38 مقابل 3.94 ± 2.86 ، مان ويتني ، ص = 0.0003). كان استرجاع البويضات الناضجة (أي البويضة في مرحلة MII) نادرا للغاية عند النساء (أي بويضة واحدة ناضجة فقط من امرأة واحدة) وغير موجود في الفتيات قبل البلوغ. تم الحصول على ما مجموعه 71 بويضة غير ناضجة (أي 4 بويضات في مرحلة MI و 67 بويضة في مرحلة GV) من الفتيات قبل البلوغ و 376 بويضة غير ناضجة (أي 28 MI-stage و 348 GV Phase) تم استردادها من النساء (اختبار فيشر الدقيق ، ص = 0.8). كانت النسبة المئوية للبويضات الرشيقية أعلى بشكل ملحوظ في الفتيات قبل البلوغ مقارنة بالنساء (تشي2 ، ص = 1.43 × 10-7).
كانت النسبة المئوية للمرضى الذين يعانون من حفظ البويضات بالتبريد المسترجعة من أنسجة المبيض 23.26٪ (10/43) في الفتيات قبل البلوغ و 65.79٪ (25/38) عند النساء (Chi2 ، p = 0.0001) (الجدول 2). كان العدد الإجمالي للبويضات الناضجة وغير الناضجة المحفوظة بالتبريد 38 بويضة (أي 2 من مرحلة MI و 36 بويضة في مرحلة GV) في الفتيات قبل البلوغ و 310 بويضات (أي 23 MI و 286 GV) في النساء (اختبار فيشر الدقيق ، ص = 1 و ص = 1 ، على التوالي). كان متوسط عدد البويضات المحفوظة بالتبريد لكل مريض أتيحت له الفرصة للاستفادة من تجميد البويضات 3.80 ± 2.35 في الفتيات قبل البلوغ و 12.40 ± 6.40 عند النساء (مان ويتني ، ص = 0.0008).
بعد الحفاظ على الخصوبة ، اختار غالبية المرضى الاستمرار في تخزين عينات أنسجة المبيض والبويضات (الجدول التكميلي 1). كان السبب الرئيسي لتدمير الحفاظ على الخصوبة هو وفاة المرضى (9.30٪ (4/43) في الفتيات قبل البلوغ و 15.79٪ (6/38) عند النساء). لم يطلب أي طلب للاستخدام حتى الآن. كانت خسارة المتابعة 4.65٪ (2/43) في الفتيات قبل البلوغ و 10.53٪ (4/38) عند النساء.
| الفتيات قبل البلوغ | نساء | التحليلات الإحصائية | قيمة P | ||
| ن = 43 | ن = 38 | ||||
| العمر (متوسط ± جنوب شرق) (الحد الأدنى إلى الحد الأقصى) | 6.84 ± 4.81 (0.5-15.1) | 22.76 ± 5.92 (14.2-33.6) | مان ويتني | 3.37 س 10-10 | |
| النسبة المئوية للمرضى الذين لديهم تاريخ من العلاج السام للغدد التناسلية | 48.84% (21/43) | 13.16% (5/38) | تشي2 | 0.0006 | |
| استئصال المبيض الكامل/الجزئي | 43/0 | 29/9 | اختبار فيشر الدقيق | 0.0006 | |
| عدد البويضات المسترجعة لكل استئصال المبيض (متوسط +/- SE) | 1.65 ± 2.68 | 9.92 ± 9.51 | مان ويتني | 9.15 س 10-5 | |
| عدد البويضات المستردة لكل استئصال المبيض الكامل (متوسط +/- SE) | 1.65 ± 2.68 | 8.93 ± 10.03أمبير | مان ويتني | 0.0068 | |
| عدد البويضات المسترجعة لكل استئصال جزئي للمبيض (متوسط +/- SE) | - | 11.13 ± 7.18أ | مان ويتني | 0.16أ | |
| ٪ من المرضى الذين لديهم استرجاع إيجابي للبويضات من أنسجة المبيض | 41.86% (18/43) | 71.05% (27/38) | تشي2 | 0.008 | |
| عدد البويضات المسترجعة لكل مريض مع استرجاع إيجابي (متوسط +/- SE) | 3.94 ± 2.86 | 13.98 ± 6.38 | مان ويتني | 0.0003 | |
| إجمالي عدد البويضات الناضجة (الحد الأدنى - الحد الأقصى لكل مريض مع استرجاع إيجابي) | 0 (0-0) | 1 (0-1) | اختبار فيشر الدقيق | 1 | |
| إجمالي عدد البويضات غير الناضجة (الحد الأدنى للحد الأقصى لكل مريض مع استرجاع إيجابي) | 71 (1-9) | 376 (1-26) | |||
| مرحلة نضج البويضات غير الناضجة | 4 م1 | 28 م1 | اختبار فيشر الدقيق | 0.80 | |
| 67 جيجا فولت | 348 جيجا فولت | ||||
| ٪ من البويضات الناضجة وغير الناضجة | 46.48% (33/71) | 18.04% (68/377) | تشي2 | 1.43 س 10-7 | |
الجدول 1: الخصائص السريرية للمريض والمعلمات البيولوجية لاسترجاع البويضات من أنسجة المبيض. SE = خطأ قياسي. أالتحليل الإحصائي لعدد البويضات المسترجعة من أنسجة المبيض التي تم الحصول عليها بعد استئصال المبيض الجزئي مقارنة باستئصال المبيض الكامل عند النساء.
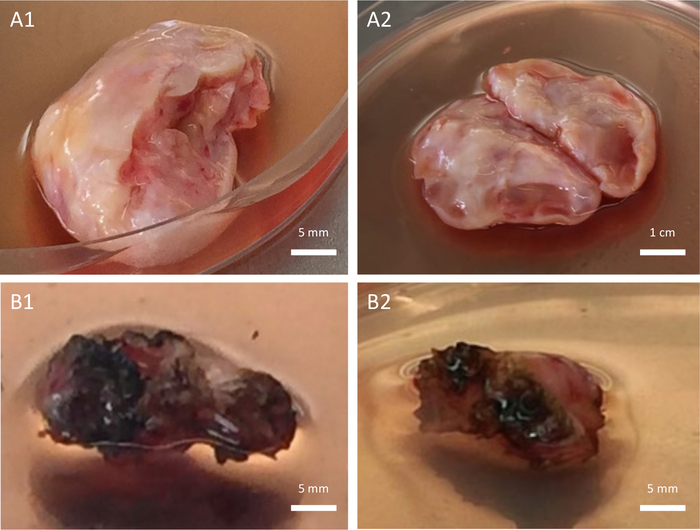
الشكل 4: جودة أنسجة المبيض. أنسجة المبيض المجمعة ذات الجودة العالية (A1-A2) مقابل منخفضة الجودة (B1-B2). ترجع الجودة المنخفضة إلى استخدام جهاز تشريح غير مناسب تسبب في إصابة جانبية لأنسجة المبيض أثناء استئصال المبيض. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
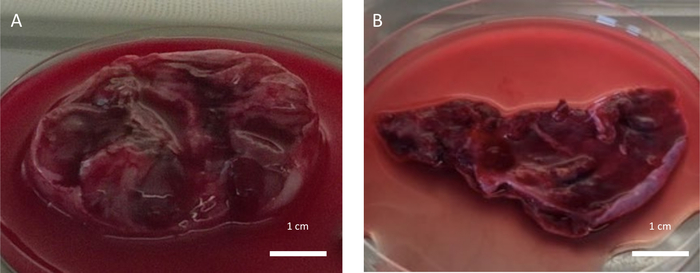
الشكل 5: أنسجة المبيض منخفضة الجودة. تم جمع أنسجة المبيض ذات الجودة المنخفضة بسبب الآثار السلبية ل (أ) ثقب المبيض بعد التحفيز الهرموني الذي تم إجراؤه قبل يومين من OTC و (ب) العلاج الكيميائي الأخير الذي تم إجراؤه في الأسبوع السابق لعلاج OTC. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الفتيات قبل البلوغ | نساء | التحليلات الإحصائية | قيمة P | ||
| ن = 43 | ن = 38 | ||||
| النسبة المئوية للمرضى الذين يعانون من حفظ البويضات بالتبريد المسترجعة من أنسجة المبيض | 23.26% (10/43) | 65.79% (25/38) | تشي2 | 0.0001 | |
| عدد البويضات المحفوظة بالتبريد لكل مريض مع حفظ بالتبريد (متوسط +/- SE) | 3.80 ± 2.35 | 12.40 ± 6.40 | مان ويتني | 0.0008 | |
| العدد الإجمالي للبويضات الناضجة الصحية المحفوظة بالتبريد (الحد الأدنى للحد الأقصى لكل مريض) | 0 (0-0) | 1 (0-1) | اختبار فيشر الدقيق | 1 | |
| العدد الإجمالي للبويضات الصحية غير الناضجة المحفوظة بالتبريد | 38 (1-9) | 309 (1-23) | |||
| مرحلة نضج البويضات الصحية غير الناضجة المحفوظة بالتبريد | 2 م1 | 23 م1 | اختبار فيشر الدقيق | 1 | |
| 36 جيجا فولت | 286 جيجا فولت | ||||
الجدول 2: نسبة المرضى الذين استفادوا من البويضات الحفظ بالتبريد المسترجعة من أنسجة المبيض والمعلمات البيولوجية للبويضات المحفوظة بالتبريد.
الجدول التكميلي 1: تخزين / تدمير الحفاظ على الخصوبة ومتابعة المرضى. الحفاظ على الخصوبة: أنسجة المبيض المحفوظة بالتبريد +/- البويضات المسترجعة من أنسجة المبيض. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
توفر المخطوطة الحالية بروتوكولا يجمع بين تجميد أنسجة المبيض وحفظ البويضات المسترجعة بالتبريد من أنسجة المبيض ، مما يزيد من احتمالية الخصوبة لدى الفتيات قبل البلوغ والنساء المعرضات لخطر الإصابة ب POI. نوصي بشدة بتنفيذ هذا البروتوكول قبل بدء أي علاج سام للغدد التناسلية من أجل تحسين الكمية (أي عدد البويضات القابلة للحياة) بالإضافة إلى الجودة (أي سلامة الحمض النووي وكفاءة السيتوبلازم) للبويضات المحفوظة ، وتحسين سلامتها للاستخدام السريري24. إذا لم يكن من الممكن تنفيذ هذا البروتوكول قبل أي شكل من أشكال العلاج السام للغدد التناسلية ، فيمكن أيضا إجراء هذا البروتوكول بعد بدء العلاج السام للغدد التناسلية ولكن ينصح بعد ذلك بتوخي الحذر الشديد عند استخدام هذه البويضات في العلاج المضاد للفيروسات القهقرية ، مما يستدعي احتياطات محددة مثل الاختبار الجيني قبل الزرع (PGT) ، والمراقبة الدقيقة للجنين ، وبزل السلى16.
في حالة عدم وجود إجماع واضح على كمية أنسجة المبيض التي يجب استردادها للحفاظ على الخصوبة ، نوصي بإجراء استئصال المبيض الكامل للفتيات قبل البلوغ وكذلك في المرضى المرتبطين بخطر متوسط / مرتفع من POI أو مع انخفاض احتياطي المبيض. في الواقع ، سيكون حجم أنسجة المبيض التي تم جمعها أثناء استئصال المبيض مرتبطا ارتباطا مباشرا بعدد البويضات التي يمكن استرجاعها ثم حفظها بالتبريد لنفس المريض. في نتائجنا ، لاحظنا أن أعداد البويضات المسترجعة كانت متشابهة في استئصال المبيض الجزئي مقارنة باستئصال المبيض الكامل لدى النساء ، لكن هذه النتيجة تعكس الاختلافات في احتياطي المبيض بين المرضى الذين اقترحنا عليهم استئصال المبيض الجزئي (أي المرضى الصغار المرتبطين باحتياطي مبيض مرتفع وخطر منخفض من POI) وأولئك الذين اقترحنا عليهم استئصال المبيض الكلي (أي ، المرضى الأكبر سنا المرتبطين باحتياطي مبيض منخفض وخطر معتدل / مرتفع ل POI) 16. حتى الآن ، لم يتم الإبلاغ عن أي ضرر كبير لاستئصال المبيض من جانب واحد على خصوبة الإناث على المدى الطويل ويبدو ظهور انقطاع الطمث مشابها (أو في أسوأ الأحوال ربما قبل عام واحد في الإنسان) ، ربما بسبب آلية تعويضية تؤدي إلى تباطؤ معدل تجنيد البصيلات البدائية11،25. وبالتالي ، يبدو أنه لا يوجد تأثير سلبي كبير لاستئصال المبيض الكامل بينما يمكن أن يسمح بحفظ عدد كبير من البويضات بالتبريد ، مما يزيد من فرص الولادة الحية. علاوة على ذلك ، فإن استخدام البويضات المحفوظة بالتبريد عن طريق الإخصاب في المختبر أسهل بكثير وأكثر أمانا من تطعيم أنسجة المبيض القشرية المحفوظة بالتبريد / المذابة بسبب خطر إعادة زرع مرض المريض بعد ذلك. ومن ثم ، فإن هذا النهج مناسب بشكل خاص في أمراض الدم أو النقيلية المرتبطة بخطر إعادة بذر الأورام الخبيثة المحتملة من أنسجة المبيضالمزروعة 15،16،17،18 ، وتحديدا في مرضى سرطان الدم19.
حتى الآن ، يبدو أن التجميد البطيء يعطي نتائج أفضل من التزجيج لحفظ عينات أنسجة المبيض بالتبريد ولكن من الواضح أن التزجيج أفضل لتجميد البويضات26. توضح هذه النتائج سبب اختيارنا للحفاظ على أنسجة المبيض بتقنية التجميد البطيء بينما تم تزجيج البويضات المسترجعة. نختار أيضا تزجيج البويضات غير الناضجة قبل أي خطوة من خطوات النضج في المختبر (IVM) لأننا نأمل أن يتحسن أداء IVM بشكل كبير في المستقبل. في الوقت الحاضر ، هناك ندرة البيانات حول التوقيت الأمثل لتزجيج البويضات (أي قبل أو بعد IVM) ، مما يمنع أي استنتاج بشأن الاستراتيجية الأكثر كفاءة. تم نشر تحليل تلوي واحد فقط حول هذا الموضوع في عام 201827 ، ولكنه يتعلق بشكل أساسي بالبويضات غير الناضجة التي تم استردادها بعد التحفيز الهرموني (وليس البويضات المسترجعة من أنسجة المبيض) بالإضافة إلى أنه يقيم فقط معدل نضج البويضات ولا توجد نتائج سريرية أخرى (مثل معدلات الإخصاب أو تطور الجنين أو معدلات الحمل / المواليد الأحياء). علاوة على ذلك ، تم تنفيذ نفس بروتوكول IVM قبل وبعد خطوات التزجيج / الذوبان ، باستثناء تأثير التطورات المستقبلية في بروتوكولات الإدارة المتكاملة للنواجه. نظرا لأن البويضات المجمدة للحفاظ على الخصوبة لن تستخدم لعدة سنوات أو حتى عقود في حالة الفتيات قبل البلوغ ، فمن المؤكد أنه سيتم إحراز تقدم في بروتوكولات IVM في السنوات القادمة ، مما يعطي الأمل في نتائج أفضل من حيث معدل نضج البويضات وكذلك إمكانات النمو / الزرع.
تتوفر بيانات محدودة عن الإمكانات التنموية للبويضات المشتقة من أنسجة المبيض بعد استئصال المبيض ، وتحديدا من الفتيات قبل البلوغ. أبلغت بعض الدراسات عن معدلات أعلى من رتق البشرة والتشكل غير الطبيعي جنبا إلى جنب مع إمكانية نضج أقل16،28،29 في البويضات المسترجعة من الفتيات قبل البلوغ مقارنة بالنساء ، في حين أن المنشورات الأخرى التي تصف خصائص متشابهة هي المرجع16،24،30،31،32،33،34،35. على حد علمنا ، لا يوجد تقرير عن الحمل بعد IVM للبويضات المجمدة أثناء الطفولة أو المراهقة. في النساء، تبدو معدلات الحمل السريري والمراضة الوليدية متشابهة بعد IVM مقارنة بالتلقيح الاصطناعي القياسي/الحقن المجهري 36. هناك ما يبرر المزيد من التقارير حول إمكانات استعادة الخصوبة للبويضات المسترجعة من أنسجة المبيض ، وتحديدا في مرضى ما قبل البلوغ.
Disclosures
لا يوجد لدى أي من المؤلفين مصالح متنافسة.
Acknowledgements
نشكر جميع أعضاء مراكزنا المشاركين في نشاط الحفاظ على الخصوبة (أطباء أمراض النساء وعلماء الأحياء وأطباء الأورام وأخصائيي تشريح الأمراض). أجريت الدراسة كجزء من الإجراءات الروتينية للحفاظ على الخصوبة. ولم يتلق أي تمويل.
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml disposable syringe | CDD | 1323101/7002655 | Other material and sizes may also be suitable |
| 21-gauge syringe needle | Merck | Z192481 | Other material and sizes may also be suitable |
| 35 mm IVF Petri Dish | Nunc | 150255 | Other material and sizes may also be suitable |
| 60 mm IVF Petri Dish | Nunc | 150270 | Other material and sizes may also be suitable |
| 90 mm IVF Petri Dish | Nunc | 150360 | Other material and sizes may also be suitable |
| Atraumatic forceps | Medlane | PI 299 04 | Other material and sizes may also be suitable |
| Continuous Single Culture Complete with HSA | Irvine Scientific | 90165 | IVF culture medium for follicular fluid collection, COCs incubation, oocyte denudation and oocyte incubation until the vitrification step. |
| Cryotube | Thermo Scientific | 368632 | Other products may also be suitable |
| Dimethylsulfoxide (DMSO) | MILTENYI BIOTEC SAS | 170-076-303 | CryoMACS DMSO 10 (EP) |
| GT40 | Air Liquide | 1,13,517 | Storage tank |
| HSV High Security Vitrification Straw | Irvine Scientific | 25251 | Vitrification straws |
| Human serum albumin | Vitrolife | 10064 | Other products may also be suitable |
| Leibovitz L15 medium | Eurobio | CM1L15000U | Culture medium for ovarian tissue collection, transport and tissue dissection |
| Leibovitz L15 medium | Eurobio | CM1L15000U | Culture medium for freezing solution |
| Mars-IVF Class II Workstation/L126 IVF Dual | CooperSurgical | WM1500/6-133-911-121 | Workstation |
| Programmable freezer | Planner KRYO 500 | Kryo 560-16 | Other equipements may also be suitable |
| Scissors with sharp straight blades and finely sharpened points | Medlane | CI 034 03 | Other material and sizes may also be suitable |
| Stripper | CooperSurgical | MXL3-STR-CGR | Other products may also be suitable |
| Tips (150µm) for Stripper | CooperSurgical | MXL3-150 | Other products may also be suitable |
| Vitrification Kit | Irvine Scientific | 90133 | Protocols are available at http://www.irvinesci.com/products/90133-so-vitrification-freeze-solutions. Other products may also be suitable |
References
- Ataman, L. M., et al. Creating a global community of practice for oncofertility. Journal of Global Oncology. 2 (2), 83-96 (2016).
- Rivas Leonel, E. C., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Chae-Kim, J. J., Gavrilova-Jordan, L. Premature ovarian insufficiency: procreative management and preventive strategies. Biomedicines. 7 (1), (2018).
- Anderson, R. A., Wallace, W. H. B., Telfer, E. E. Ovarian tissue cryopreservation for fertility preservation: clinical and research perspectives. Human Reproduction Open. 2017 (1), (2017).
- Donnez, J., Dolmans, M. M. Fertility preservation in women. The New England Journal of Medicine. 377 (17), 1657-1665 (2017).
- Lambertini, M., et al. Ovarian suppression using luteinizing hormone-releasing hormone agonists during chemotherapy to preserve ovarian function and fertility of breast cancer patients: a meta-analysis of randomized studies. Annals of Oncology. 26 (12), 2408-2419 (2015).
- Gubbala, K., et al. Outcomes of ovarian transposition in gynaecological cancers; a systematic review and meta-analysis. Journal of Ovarian Research. 7, 69(2014).
- Poirot, C., et al. Induction of puberty by autograft of cryopreserved ovarian tissue. Lancet. 379 (9815), 588(2012).
- Ernst, E., Kjaersgaard, M., Birkebaek, N. H., Clausen, N., Andersen, C. Y. Case report: stimulation of puberty in a girl with chemo- and radiation therapy induced ovarian failure by transplantation of a small part of her frozen/thawed ovarian tissue. European Journal of Cancer. 49 (4), 911-914 (2013).
- Pacheco, F., Oktay, K. Current success and efficiency of autologous ovarian transplantation: a meta-analysis. Reproductive Sciences. 24 (8), 1111-1120 (2017).
- Silber, S., Kagawa, N., Kuwayama, M., Gosden, R. Duration of fertility after fresh and frozen ovary transplantation. Fertility and Sterility. 94 (6), 2191-2196 (2010).
- Donnez, J., et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue. Lancet. 364 (9443), 1405-1410 (2004).
- Donnez, J., et al. Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue: a review of 60 cases of reimplantation. Fertility and Sterility. 99 (6), 1503-1513 (2013).
- Jensen, A. K., et al. Outcomes of transplantations of cryopreserved ovarian tissue to 41 women in Denmark. Human Reproduction. 30 (12), 2838-2845 (2015).
- Abir, R., et al. Occasional involvement of the ovary in Ewing sarcoma. Human Reproduction. 25 (7), 1708-1712 (2010).
- Abir, R., et al. Cryopreservation of in vitro matured oocytes in addition to ovarian tissue freezing for fertility preservation in paediatric female cancer patients before and after cancer therapy. Human Reproduction. 31 (4), 750-762 (2016).
- Abir, R., et al. Ovarian minimal residual disease in chronic myeloid leukaemia. Reproductive BioMedicine Online. 28 (2), 255-260 (2014).
- Dolmans, M. M., Luyckx, V., Donnez, J., Andersen, C. Y., Greve, T. Risk of transferring malignant cells with transplanted frozen-thawed ovarian tissue. Fertility and Sterility. 99 (6), 1514-1522 (2013).
- Soares, M., et al. Eliminating malignant cells from cryopreserved ovarian tissue is possible in leukaemia patients. The British Journal of Haematology. 178 (2), 231-239 (2017).
- Son, W. Y., Henderson, S., Cohen, Y., Dahan, M., Buckett, W. Immature oocyte for fertility preservation. Frontiers in Endocrinology. 10, 464(2019).
- Yang, Z. Y., Chian, R. C. Development of in vitro maturation techniques for clinical applications. Fertility and Sterility. 108 (4), 577-584 (2017).
- Imbert, R., et al. Safety and usefulness of cryopreservation of ovarian tissue to preserve fertility: a 12-year retrospective analysis. Human Reproduction. 29 (9), 1931-1940 (2014).
- Duncan, F. E., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction. 152 (6), 201-210 (2016).
- Abir, R., et al. Selection of patients before and after anticancer treatment for ovarian cryopreservation. Human Reproduction. 23 (4), 869-877 (2008).
- Yasui, T., et al. Factors associated with premature ovarian failure, early menopause and earlier onset of menopause in Japanese women. Maturitas. 72 (3), 249-255 (2012).
- Cobo, A., Diaz, C. Clinical application of oocyte vitrification: a systematic review and meta-analysis of randomized controlled trials. Fertility and Sterility. 96 (2), 277-285 (2011).
- Mohsenzadeh, M., Salehi-Abargouei, A., Tabibnejad, N., Karimi-Zarchi, M., Khalili, M. A. Effect of vitrification on human oocyte maturation rate during in vitro maturation procedure: A systematic review and meta-analysis. Cryobiology. 83, 84-89 (2018).
- Anderson, R. A., McLaughlin, M., Wallace, W. H., Albertini, D. F., Telfer, E. E. The immature human ovary shows loss of abnormal follicles and increasing follicle developmental competence through childhood and adolescence. Human Reproduction. 29 (1), 97-106 (2014).
- Revel, A., et al. At what age can human oocytes be obtained. Fertility and Sterility. 92 (2), 458-463 (2009).
- Margulis, S., et al. morphogenetic protein 15 expression in human ovaries from fetuses, girls, and women. Fertility and Sterility. 92 (5), 1666-1673 (2009).
- Kedem, A., et al. Alginate scaffold for organ culture of cryopreserved-thawed human ovarian cortical follicles. Journal of Assisted Reproduction and Genetics. 28 (9), 761-769 (2011).
- Lerer-Serfaty, G., et al. Attempted application of bioengineered/biosynthetic supporting matrices with phosphatidylinositol-trisphosphate-enhancing substances to organ culture of human primordial follicles. Journal of Assisted Reproduction and Genetics. 30 (10), 1279-1288 (2013).
- Ben-Haroush, A., Sapir, O., Fisch, B. Aspiration of immature oocytes during cesarean section for fertility preservation and future surrogacy. American Journal of Obstetrics and Gynecology. 203 (1), 12-14 (2010).
- Farhi, J., Sapir, O., Maman, M., Fisch, B., Ben-Haroush, A. Novel protocol for scheduling oocyte retrieval in IVM cycles in PCOS patients: a case series. Reproductive BioMedicine Online. 23 (6), 765-768 (2011).
- Segers, I., et al. In vitro maturation (IVM) of oocytes recovered from ovariectomy specimens in the laboratory: a promising "ex vivo" method of oocyte cryopreservation resulting in the first report of an ongoing pregnancy in Europe. Journal of Assisted Reproduction and Genetics. 32 (8), 1221-1231 (2015).
- Ellenbogen, A., Shavit, T., Shalom-Paz, E. IVM results are comparable and may have advantages over standard IVF. Facts, Views & Vision in ObGyn. 6 (2), 77-80 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.