Method Article
Une méthode pour la reconstruction 3D et l'analyse de la réalité virtuelle des cellules gliales et neuronales
Dans cet article
Résumé
Le pipeline décrit est conçu pour la segmentation des ensembles de données de microscopie électronique plus grands que les gigaoctets, afin d'extraire des morphologies de cellules entières. Une fois que les cellules sont reconstruites en 3D, un logiciel personnalisé conçu autour de besoins individuels peut être utilisé pour effectuer une analyse qualitative et quantitative directement en 3D, en utilisant également la réalité virtuelle pour surmonter l'occlusion de vue.
Résumé
La section en série et l'imagerie à haute résolution subséquente du tissu biologique à l'aide de la microscopie électronique (EM) permettent la segmentation et la reconstruction de piles à haute résolution pour révéler des modèles ultrastructuraux qui n'ont pas pu être résolus à l'aide de la 2D Images. En effet, ce dernier pourrait conduire à une mauvaise interprétation des morphologies, comme dans le cas des mitochondries; l'utilisation de modèles 3D est donc de plus en plus courante et appliquée à la formulation d'hypothèses fonctionnelles basées sur la morphologie. À ce jour, l'utilisation de modèles 3D générés à partir de piles d'images lumineuses ou électroniques rend les évaluations qualitatives et visuelles, ainsi que la quantification, plus pratiques à effectuer directement en 3D. Comme ces modèles sont souvent extrêmement complexes, un environnement de réalité virtuelle est également important d'être mis en place pour surmonter l'occlusion et de tirer pleinement parti de la structure 3D. Ici, un guide étape par étape de la segmentation de l'image à la reconstruction et l'analyse est décrit en détail.
Introduction
Le premier modèle proposé pour une configuration de microscopie électronique permettant une section de série automatisée et l'imagerie remonte à 19811; la diffusion de ces installations automatisées et améliorées pour imager de grands échantillons à l'aide d'EM a augmenté au cours des dix dernières années2,3, et les travaux présentant des reconstructions denses impressionnantes ou des morphologies complètes immédiatement suivi4, 5,6,7,8,9,10.
La production de grands ensembles de données est venue avec la nécessité d'améliorer les pipelines pour la segmentation de l'image. Les outils logiciels pour la segmentation manuelle des sections de série, tels que RECONSTRUCT et TrakEM211,12, ont été conçus pour la microscopie électronique de transmission (TEM). Comme l'ensemble du processus peut prendre énormément de temps, ces outils ne sont pas appropriés lorsqu'il s'agit de milliers de micrographes en série qui peuvent être générés automatiquement avec des techniques automatisées de section série EM (3DEM), telles que microscopie électronique à balayage par bloc-face (SBEM)3 ou microscopie électronique à balayage de faisceau d'ions focalisé (FIB-SEM)2. Pour cette raison, les scientifiques ont mis des efforts dans le développement d'outils semi-automatisés, ainsi que des outils entièrement automatisés, pour améliorer l'efficacité de segmentation. Des outils entièrement automatisés, basés sur l'apprentissage automatique13 ou des algorithmes de classification des pixels non formés à la fine pointe de la technologie14, sont améliorés pour être utilisés par une plus grande communauté; néanmoins, la segmentation est encore loin d'être entièrement fiable, et de nombreux travaux sont encore basés sur le travail manuel, qui est inefficace en termes de temps de segmentation, mais fournit toujours une fiabilité complète. Les outils semi-automatisés, tels que ilastik15, représentent un meilleur compromis, car ils fournissent une lecture immédiate de la segmentation qui peut être corrigée dans une certaine mesure, bien qu'elle ne fournisse pas un cadre de relecture réel, et peut être intégrée en utilisant TrakEM2 en parallèle16.
La segmentation à grande échelle est, à ce jour, principalement limitée aux connectomiques; par conséquent, les informaticiens sont plus intéressés à fournir des cadres pour les visualisations intégrées de grands ensembles de données annotées et d'analyser les modèles de connectivité déduits par la présence de contacts synaptiques17,18. Néanmoins, des reconstructions 3D précises peuvent être utilisées pour des analyses morphométriques quantitatives, plutôt que pour des évaluations qualitatives des structures 3D. Des outils comme NeuroMorph19,20 et l'analyse du glycogène10 ont été développés pour prendre des mesures sur les reconstructions 3D pour les longueurs, les surfaces et les volumes, et sur la distribution des points de nuage, complètement jetant la pile EM d'origine8,10. Les astrocytes représentent une étude de cas intéressante, parce que l'absence d'indices visuels ou de schémas structurels répétitifs donne aux chercheurs un indice sur la fonction des unités structurelles individuelles et, par conséquent, l'absence d'une ontologie adéquate des processus astrocytiques. 21, il est difficile de concevoir des outils analytiques. Une tentative récente a été Abstractocyte22, qui permet une exploration visuelle des processus astrocytiques et l'inférence des relations qualitatives entre les processus astrocytiques et les neurites.
Néanmoins, la commodité de l'imagerie des tissus sectionnés sous EM vient du fait que la quantité d'informations cachées dans des échantillons de cerveau intacts est énorme et l'interprétation des images d'une seule section peut surmonter ce problème. La densité des structures dans le cerveau est si élevée que les reconstructions 3D de quelques objets visibles à la fois rendraient impossible de les distinguer visuellement. Pour cette raison, nous avons récemment proposé l'utilisation de la réalité virtuelle (VR) comme méthode améliorée pour observer des structures complexes. Nous nous concentrons sur les astrocytes23 pour surmonter l'occlusion (qui est le blocage de la visibilité d'un objet d'intérêt avec un second, dans un espace 3D) et faciliter les évaluations qualitatives des reconstructions, y compris la relecture, ainsi que les quantifications des caractéristiques utilisant le nombre de points dans l'espace. Nous avons récemment combiné l'exploration visuelle VR avec l'utilisation de GLAM (modèle d'absorption de lactate dérivé du glycogène), une technique pour visualiser une carte de la probabilité de navette de lactate des neurites, en considérant les granules de glycogène comme des corps électroluminescents23; en particulier, nous avons utilisé la VR pour quantifier les pics de lumière produits par GLAM.
Protocole
1. Traitement d'image à l'aide des Fidji
- Ouvrez la pile d'images en faisant glisser et en laissant tomber le fichier natif du microscope contenant la pile, ou en faisant glisser et en laissant tomber le dossier contenant toute la pile d'images dans la fenêtre du logiciel.
REMARQUE: Fidji est en mesure de reconnaître automatiquement tous les formats d'image standard, tels que .jpg, .tif, et .png, ainsi que les formats de fichiers propriétaires des fournisseurs de microscope. Bien que le protocole suivant ait été optimisé pour les piles d'images de 3DEM, ces étapes peuvent également être utilisées pour les ensembles de données de microscopie légère. - Une fois la pile ouverte, rendez-vous sur Image 'gt; Propriétés pour vous assurer que la taille du voxel a été lue à partir des métadonnées. Si ce n'est pas le cas, il peut être entré manuellement.
- Assurez-vous de transformer l'image en 8 bits. Cliquez sur L'image et sélectionnez 8 bits.
- Si la pile d'origine était dans différents fichiers séquentiels / dossiers, utilisez Concatenate pour les fusionner dans une seule pile en sélectionnant l'image 'gt; Stacks 'gt; Outils 'gt; Concatenate.
- Enregistrer la pile en sélectionnant le fichier 'gt; Enregistrer comme. Il sera enregistré sous forme d'un seul fichier .tif et peut être utilisé comme une sauvegarde et pour un traitement ultérieur.
- Si la pile d'origine est acquise sous forme de tuiles différentes, appliquez des coutures dans TrakEM2.
- Créer un nouveau projet TrakEM2 en utilisant le nouveau TrakEM2 (blanc).
- Dans l'interface utilisateur graphique viewport (GUI), importer les piles en cliquant sur le bouton de la souris droite 'gt; Import 'gt; Import pile, et d'importer toutes les tuiles ouvertes dans l'interface graphique principale Fidji. Assurez-vous de redimensionner la taille de la toile pour s'adapter à la pile entière en cliquant à droite 'gt; Afficher 'gt; Resize Canvas/Layer Set, et choisissez la taille y/x pixel en fonction de la taille finale du montage.
REMARQUE: Par exemple, si le montage doit être finalisé à l'aide de quatre tuiles de 4 096 x 4 096 pixels, la taille de la toile devrait être d'au moins 8 192 x 8 192 pixels. Envisagez de le rendre légèrement plus grand, et la recadrer plus tard. - Superposez les parties communes des tuiles individuelles en les faisant glisser et en les laissant tomber sur l'ensemble de couches. Utilisez le curseur supérieur gauche pour modifier la transparence pour aider à la superposition.
- Montage et réaligner les piles en cliquant sur le bouton de la souris droite 'gt; Align, puis sélectionnez l'une des options (voir la note ci-dessous).
REMARQUE: SBEM ou FIB-SEM sont généralement déjà bien alignés, mais des désalignements mineurs peuvent se produire. Les couches d'alignement est le pipeline automatisé pour l'alignement z ; Montage plusieurs couches est le pipeline automatisé pour aligner les tuiles sur chaque pile z, pour l'ensemble du volume; Align mosaïque multicouche combine les deux options précédentes. Cette opération est longue et soumise à la mémoire d'accès aléatoire (RAM) de la machine. Envisagez d'utiliser un ordinateur haut de gamme et laissez-le fonctionner pendant des heures/jours, selon la taille de la pile. - Enfin, exporter les piles d'images et les enregistrer en utilisant la souris à droite cliquez sur 'gt; Faire l'image plate, puis assurez-vous de sélectionner la première à la dernière image dans les menus déroulants Démarrer et Fin.
- Utilisation des fonctions intégrées TrakEM2, segmentez les structures d'intérêt si nécessaire.
- Dans l'interface graphique du TrakEM2, cliquez à droite sur N'importe quoi sous la fenêtre Template et sélectionnez Ajouter un nouvel enfant .)
- Faites glisser et déposer N'importe quoi sur le dessus du dossier sous les objets de projet,et un tout y apparaîtra.
- Faites glisser et déposez la liste de zone du modèle au Tout situé sous les objets du projet.
- Sur le port d'images, sélectionnez l'espace Z avec le curseur. La liste de zone apparaîtra, avec un numéro d'iD unique. Sélectionnez l'outil de brosse en haut (en bas à droite) et utilisez la souris pour segmenter une structure en remplissant son cytosol, sur toute la pile z.
- Exporter le masque segmenté à utiliser dans ilastik comme graine pour la sculpture par le clic droit soit sur l'objet de la liste de zone sur la liste de l'espace Z, ou sur le masque dans le viewport, et sélectionnez Export 'gt; Listes de zone comme étiquettes (tif).
- Selon la résolution nécessaire pour d'autres reconstructions, si possible, réduire la taille des pixels de la pile d'images par downsampling, compte tenu des exigences de mémoire du logiciel qui sera utilisé pour la segmentation et la reconstruction. Utilisez l'image 'gt; Ajuster 'gt; Taille.
REMARQUE: ilastik gère des piles allant jusqu'à 500 pixels sur xy bien. En outre, l'échantillonnage vers le bas réduira la résolution de la pile; par conséquent, tenir compte de la taille minimale à laquelle l'objet semble encore reconnaissable et, par conséquent, peut être segmenté. - Pour améliorer le contraste et aider à la segmentation, le filtre de masque Unsharp peut être appliqué pour rendre les membranes plus croustillantes. Utilisez le processus de traitement de l'utilisationde l'application de la procédure .
- Exporter la pile d'images comme des images uniques pour un traitement ultérieur dans le logiciel de segmentation, (par exemple, ilastik), en utilisant le fichier 'gt; Enregistrer comme ... Séquence d'image et choisissez le format .tif.
2. Segmentation (semi-automatisée) et reconstruction utilisation de ilastik 1.3.2
- Dans l'interface graphique ilastik principale, sélectionnez le module de sculpture.
- Chargez la pile d'images à l'aide d'Ajouter de nouveaux euros.
- Sélectionnez répertoire entier et choisissez le dossier contenant la pile d'images enregistrée en tant que fichiers uniques. Au bas de la nouvelle fenêtre, où les options de chargement des images sont présentes, assurez-vous de garder Z sélectionné.
- Pour les étapes suivantes, toutes les opérations et boutons peuvent être trouvés sur le côté gauche du logiciel principal GUI. Sous l'onglet Prétraitement, utilisez les options standard déjà vérifiées. Utilisez des lignes brillantes (filtres de crête) et maintenez l'échelle du filtre à 1.600. Ce paramètre peut être modifié par la suite.
- Une fois le prétraitement terminé, sélectionnez la page suivante dans le menu déroulant du module d'étiquetage. Un objet et un Contexte sont présents par défaut.
-
Sélectionnez la graine d'objet en cliquant dessus, et tracez une ligne au-dessus de la structure d'intérêt ; ensuite, sélectionnez la graine d'arrière-plan et dessinez une ou plusieurs lignes à l'extérieur de l'objet à reconstruire. Ensuite, cliquez sur Segment, et attendez.
REMARQUE : Selon la puissance de l'ordinateur et la taille de la pile, la segmentation peut prendre de quelques secondes à quelques heures. Une fois que c'est fait, un masque semi-transparent soulignant la segmentation doit apparaître sur le dessus de la structure segmentée.- Faites défiler la pile pour vérifier la segmentation. La segmentation peut ne pas être exacte et ne pas suivre la structure d'intérêt avec précision ou s'en déverser. Corriger tout débordement en plaçant une graine de fond sur la segmentation renversée, et ajouter une graine d'objet sur le segment non reconstruit de l'objet d'intérêt.
- Si la segmentation n'est toujours pas correcte, essayez de modifier avec le paramètre Bias, qui augmentera ou diminuera la quantité de pixels classifiés incertains tel qu'accepté. Sa valeur est de 0,95 par défaut; diminuer pour limiter tout débordement (généralement à pas moins de 0,9) ou augmenter si la segmentation est trop prudente (jusqu'à 1).
- Une autre possibilité est de revenir à l'étape 2.4 (en cliquant sur Preprocessing) et de modifier la taille du filtre; l'augmentation de la valeur (p. ex., à 2) réduira au minimum les effets sonores de sel et de poivre, mais rendra également les membranes plus floues et les détails plus petits plus difficiles à détecter. Cela pourrait limiter les débordements.
- Réitérez autant que nécessaire, tant que tous les objets désirés ont été segmentés. Une fois qu'un objet est terminé, cliquez sur Enregistrer l'objet courant,ci-dessous Segment. Deux nouvelles graines apparaîtront, pour commencer la segmentation d'un nouvel objet.
- Extrait maille surface tout de suite que les fichiers .obj en cliquant sur Export tous les maillage.
- Si d'autres relectures sont nécessaires, la segmentation peut être extraite sous forme de masques binaires. Sélectionnez le masque pour l'exporter en cliquant sur parcourir les objets; puis, cliquez à droite sur segmentation 'gt; Export et, ensuite, sous l'info fichier de sortie, sélectionnez séquence tif comme format.
3. Relecture/Segmentation (Manuel) à TrakEM2 (Fidji)
- Chargez la pile d'images et créez un nouveau projet TrekEM2 selon l'étape 1.6.1.
- Importer les masques qui ont besoin de relecture en utilisant l'option Étiquettes d'importation comme listesde zone , disponible dans le même menu d'importation utilisé pour importer la pile d'images.
- Sélectionnez la liste de zone importée dans l'espace Z et utilisez l'outil Brosse pour examiner la segmentation.
- Visualisez le modèle en 3D en cliquant à droite sur la liste de zone 'gt; Afficher en 3D. Dans la fenêtre suivante demandant un nombre de rééchantillonnage, une valeur plus élevée générera un maillage de résolution inférieure.
REMARQUE: Selon la taille de l'objet, envisagez d'utiliser une valeur comprise entre 4 et 6, ce qui donne généralement le meilleur compromis entre la résolution et le détail morphologique. - Exporter le maillage 3D comme front de vague .obj en choisissant parmi le fichier menu 'gt; surfaces d'exportation 'gt; Wavefront.
4. Analyse 3D
- Ouvrez Blender. Pour les étapes suivantes, assurez-vous d'installer la boîte à outils NeuroMorph (disponible à https://neuromorph.epfl.ch/index.html) et la boîte à outils d'analyse du glycogène (disponible à https://github.com/daniJb/glyco-analysis).
- Importer les objets à l'aide de l'importation de lot NeuroMorph en cliquant sur Les objets d'importation sous le menu Scène, pour importer plusieurs objets à la fois. Assurez-vous d'activer L'utilisation remesh et l'ombrage lisse.
REMARQUE: Il n'est pas recommandé de cliquer sur Finalize remesh s'il y a incertitude quant à la taille initiale de l'objet. Importer la profondeur de l'arbre à la valeur 7 (par défaut) est généralement bon de maintenir une résolution acceptable et la morphologie de l'objet. - Sélectionnez l'objet d'intérêt du outliner et modifiez la profondeur octree de la fonction de remesh sous le menu Modifiers itérativement pour minimiser le nombre de vertiges et pour éviter de perdre des détails dans la résolution et la morphologie correcte. Lors de la modification de la profondeur octree, le maillage sur l'interface graphique principale va changer en conséquence. Une fois terminé, cliquez sur Appliquer pour finaliser le processus.
REMARQUE: Les valeurs autour de 4 sont généralement bonnes pour les petits objets (tels que les densités postsynaptiques), les valeurs autour de 7 pour les plus grandes (comme les longs axones ou dendrites), et les valeurs autour de 8 ou 9 pour les morphologies cellulaires complètes où les détails des différentes résolutions devraient être Maintenu. - Utilisez l'outil de superposition d'image Image pile interactions sur le panneau gauche, sous le menu NeuroMorph, pour charger la pile d'images. Assurez-vous d'entrer la taille physique de la pile d'images pour x, y, et x (en microns ou nanomètres, selon les unités de la maille) et sélectionnez le chemin de la pile en cliquant sur Source Z. X et Y sont des plans orthogonaux; ils sont facultatifs et ne seront chargés que si l'utilisateur insère un chemin valide.
- Ensuite, sélectionnez un maillage sur le viewport en cliquant à droite sur elle, entrez le mode d'édition en appuyant sur Tab, sélectionnez un (ou plusieurs) vertices en utilisant la souris clic droit, et enfin, cliquez sur Afficher l'image à vertex. Un (ou plusieurs) plan coupé (s) avec le micrographe apparaîtra superposé sur le dessus de la maille.
- Sélectionnez le plan coupé en cliquant à droite dessus, appuyez sur Ctrl etfaites défiler le modèle 3D à l'aide du rouleau de souris. Cela peut également être utilisé comme méthode de relecture.
- Utilisez des outils de mesure pour quantifier les surfaces, les volumes et les longueurs. Ces opérations sont documentées plus en détail par Jorstad et coll.19 et sur le site WebneuroMorph 24.
- Utilisez l'outil d'analyse du glycogène pour quantifier la proximité du glycogène vers les épines et les boutons. Les opérations sont documentées plus en détail dans une publication précédente10 et dans le référentiel d'analyse du glycogène25.
- Importer les objets à l'aide de l'importation de lot NeuroMorph en cliquant sur Les objets d'importation sous le menu Scène, pour importer plusieurs objets à la fois. Assurez-vous d'activer L'utilisation remesh et l'ombrage lisse.
- Exécuter GLAM23. Le code, exécutable, et certains fichiers de test sont disponibles dans le référentiel GLAM26.
- Préparez deux fichiers géométriques en format .ply : un fichier source contenant des granules de glycogène et un fichier cible contenant les surfaces de morphologie.
- Préparer trois fichiers colormap .ascii (chaque ligne contenant t-norm(0.1) R(0.255) G(0.255) B(0.255)) pour représenter les valeurs d'absorption locales, les valeurs de pointe et les valeurs d'absorption moyennes.
- Exécutez le script C MD GLAM, avec les fichiers de géométrie (étape 4.2.1) et les fichiers colormap (étape 4.2.2), en définissant le rayon d'influence (en microns), la valeur d'absorption maximale prévue et un seuil normalisé pour regrouper les pics d'absorption. Pour plus d'informations sur d'autres paramètres, exécutez le script avec l'option -aide.
- Exportez les résultats sous forme de fichiers .ply ou .obj : objets cibles cartographiés avec des valeurs GLAM, marqueurs de pic d'absorption représentés comme des sphères codées par couleur, et objets cibles codés en couleur par rapport à la valeur d'absorption moyenne.
- Ouvrez les données VR Interact. Le code exécutable DE VR Data Interact est disponible dans un référentiel public27.
- Importer des mailles à visualiser, en suivant les instructions dans le menu VR. Assurez-vous d'importer les fichiers .obj calculés à l'étape 4.2.1, au cas où une analyse GLAM serait nécessaire.
Résultats
En utilisant la procédure présentée ci-dessus, nous montrons les résultats sur deux piles d'images de différentes tailles, pour démontrer comment la flexibilité des outils permet d'étendre la procédure à des ensembles de données plus grands. Dans ce cas, les deux ensembles de données 3DEM sont (i) rat P14, cortex somatosensoriel, couche VI, 100 m x 100 m x 76,4 m4 et (ii) rat P60, hippocampe CA1, 7,07 m x 6,75 m x 4,73 m10.
Les étapes de prétraitement (Figure 1) peuvent être effectuées de la même manière pour les deux jeux de données, simplement en tenant compte du fait qu'un ensemble de données plus important comme la première pile, qui est de 25 Go, nécessite du matériel plus performant pour gérer la visualisation et le traitement de données de grande taille . La deuxième pile est seulement 1 Go, avec une taille parfaitement isotropic voxel.
La taille des données peut ne pas être directement liée au champ de vision (FOV), plutôt qu'à la résolution de la pile elle-même, qui dépend de la taille maximale du pixel du capteur du microscope, et du grossissement de la pile. Dans tous les cas, logiquement, les vFO plus grands sont susceptibles d'occuper plus d'espace physique par rapport aux plus petits FoV, s'ils sont acquis à la même résolution.
Une fois que la pile d'images est importée, comme indiqué dans la section 1 du protocole, dans le logiciel Fidji (Figure 1A), une version scientifique de ImageJ12, un point important est de s'assurer que le format d'image est 8 bits (Figure 1B). Cela étant donné que de nombreux logiciels d'acquisition différentes sociétés de microscopie producteurs génèrent leur format de fichier propriétaire en 16 bits pour stocker des métadonnées pertinentes à des informations sur le processus d'acquisition (c.-à-d., la taille des pixels, l'épaisseur, le courant / tension de la faisceau d'électrons, pression de chambre) avec la pile d'image. Ces ajustements permettent aux scientifiques d'enregistrer la mémoire, car les métadonnées 8 bits supplémentaires contenant n'affectent pas les images. Le deuxième paramètre important à vérifier est la taille du voxel, qui permet ensuite d'effectuer la reconstruction après la segmentation à l'échelle correcte (micromètres ou nanomètres; Figure 1B).
Les piles peuvent avoir besoin d'être réalignées et/ou cousues si elles ont été acquises à l'aide du carrelage; ces opérations peuvent être effectuées dans TrakEM2 (Figure 2A), bien qu'en ce qui concerne le réalignement, les techniques automatisées 3DEM comme FIB-SEM ou 3View sont généralement bien réalignées.
Une dernière étape nécessite le filtrage et, éventuellement, le downsampling de la pile, selon les objets qui doivent être reconstruits et si l'échantillonnage vers le bas affecte la reconnaissance des caractéristiques reconstruites. Par exemple, pour la plus grande pile (du cortex somatosensoriel des rats P14), il n'a pas été possible de compromettre la résolution au profit de l'efficacité de la reconstruction, tandis que pour la plus petite pile (de l'hippocampe CA1 de rats P60), il était possible de le faire parce que la résolution était bien au-dessus de ce qui était nécessaire pour que les plus petits objets soient reconstruits. Enfin, l'utilisation du masque non aiguisé améliore la différence entre les membranes et l'arrière-plan, ce qui le rend favorable pour les reconstructions de logiciels comme ilastik qui utilise des gradients pour pré-évaluer les frontières.
Après le traitement de l'image, la reconstruction peut être effectuée soit manuellement à l'aide de TrakEM2, soit semi-automatiquement à l'aide d'ilastik (Figure 2C). Un jeu de données comme le plus petit énuméré ici (ii), qui peut être échantillonné pour s'adapter à la mémoire, peut être entièrement segmenté à l'aide d'ilastik (Figure 2B) pour produire une reconstruction dense. Dans le cas du premier jeu de données répertorié ici (i), nous avons réussi à charger et à prétraiter l'ensemble de données avec un poste de travail Linux avec 500 Go de RAM. La segmentation éparse de 16 morphologies complètes a été obtenue avec un pipeline hybride, en extrayant la segmentation approximative qui a été relue manuellement à l'aide de TrakEM2.
L'analyse 3D de caractéristiques comme les surfaces, les volumes ou la distribution de glycogène intracellulaire peut être effectuée dans un environnement Blender (Figure 3) en utilisant des codes personnalisés, tels que NeuroMorph19 ou l'analyse du glycogène10.
Dans le cas d'ensembles de données contenant des granules de glycogène ainsi, l'analyse de leur distribution peut être déduite à l'aide de GLAM, un code C qui générerait des colormaps avec zone d'influence directement sur le maillage.
Enfin, ces ensembles de données complexes peuvent être visualisés et analysés à l'aide de la VR, qui s'est avérée utile pour l'analyse des ensembles de données avec une vue occluded particulière (figure 4). Par exemple, les pics déduits des cartes GLAM ont été facilement déduits visuellement des dendrites dans le deuxième jeu de données discuté ici.
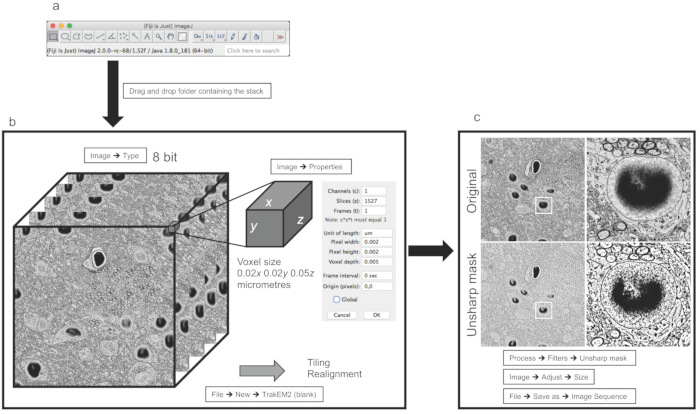
Figure 1: Traitement et préparation de l'image pour la segmentation de l'image. (a) Gui des Fidji principaux. (b) Exemple d'images empilées provenant d'un jeu de données (i) discutées dans les résultats représentatifs. Le panneau de droite affiche les propriétés permettant à l'utilisateur de définir la taille du voxel. (c) Exemple d'opération de filer et de redimensionnement appliquée à une seule image. Les panneaux de droite montrent des grossissements du centre de l'image. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2: Segmentation et reconstruction à l'aide de TrakEM2 et ilastik. (a) TrakEM2 GUI avec des objets segmentés manuellement (en rouge). ( b) Le masque exporté du panneau a peut être utilisé comme entrée (graine) pour (c) segmentation semi-automatisée (découpage). De ilastik, les masques (rouge) peuvent être exportés vers TrakEM2 pour la relecture manuelle. (d) Les masques peuvent ensuite être exportés sous forme de mailles triangulaires 3D pour révéler des structures reconstruites. Dans cet exemple, quatre neurones, astrocytes, microglies et péricytes de l'ensemble de données (i) (discutés dans les résultats représentatifs) ont été reconstruits à l'aide de ce processus. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
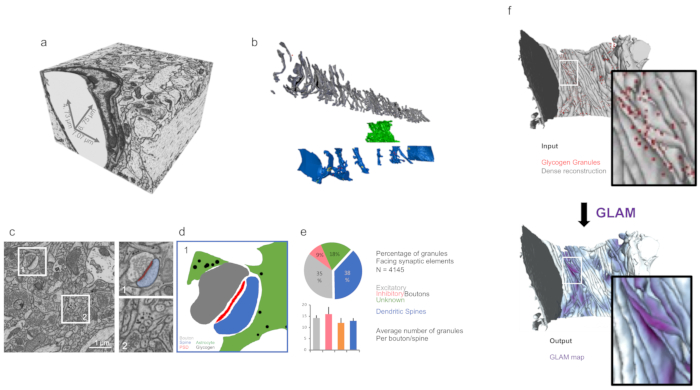
Figure 3: Analyse 3D des morphologies reconstruites à l'aide d'outils personnalisés. (a) Volume imageur isotropique de l'ensemble de données FIB-SEM (ii) (comme il est discuté dans les résultats représentatifs). (b) Reconstruction dense du panneau a. Gris et axones; processus vert et astrocytique; bleus et dendrites. (c) Micrographe montrant des exemples de cibles pour des quantifications telles que des synapses (jeu de données (i)) et des granules de glycogène astrocytique (ensemble de données (ii)) dans les grossissements droits. (d) Masque du panneau c montrant la distribution des granules de glycogène autour des synapses. (e) Quantification de la distribution de glycogène à partir de l'ensemble de données du panneau c, à l'aide de la boîte à outils d'analyse du glycogène de Blender. Les barres d'erreur indiquent les erreurs standard. N 4 145 granules de glycogène. (f) Une illustration graphique de la visualisation d'entrée et de sortie de GLAM. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
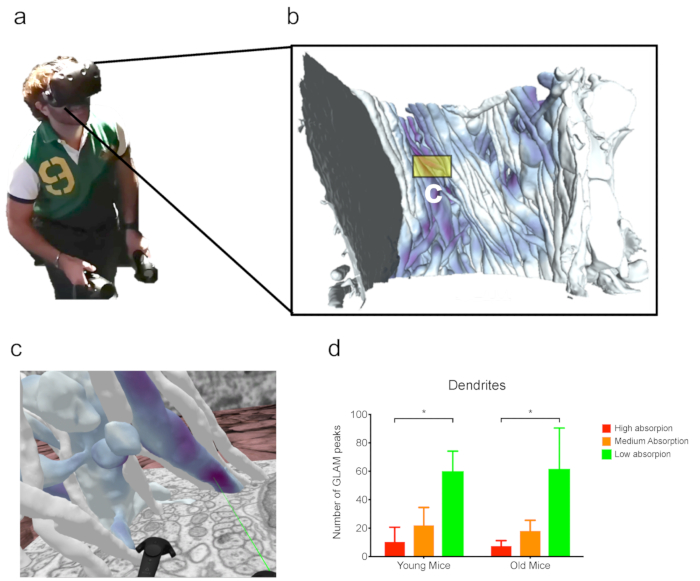
Figure 4: Analyse en VR. (a) Un utilisateur portant un casque VR tout en travaillant sur (b) la reconstruction dense de l'ensemble de données FIB-SEM (ii) (comme discuté dans les résultats représentatifs). (c) Scène VR immersive d'un sous-ensemble de neurites du panneau b. Le laser vert pointe vers un pic GLAM. (d) Exemple d'une analyse de glam compte dans VR. N 3 souris par barre. Analyse de FIB-SEM tirée d'une publication précédente28. Les barres d'erreur indiquent les erreurs standard; p lt; 0.1, aNOVA à sens unique. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
La méthode présentée ici est un guide utile étape par étape pour la segmentation et la reconstruction 3D d'un jeu de données EM à plusieurs échelles, qu'ils proviennent de techniques d'imagerie à haute résolution, comme FIB-SEM, ou d'autres techniques automatisées de sections et d'imagerie en série. FIB-SEM a l'avantage d'atteindre potentiellement l'isotropie parfaite dans la taille de voxel en coupant des sections aussi minces que 5 nm utilisant un faisceau focalisé d'ion, son FOV pourrait être limité à 15-20 m en raison des artefacts latéraux, qui sont probablement dus au dépôt du tissu coupé si le FO V dépasse cette valeur. De tels artefacts peuvent être évités en utilisant d'autres techniques, telles que SBEM, qui utilise un couteau en diamant pour couper des sections de série à l'intérieur de la chambre de microscope. Dans ce dernier cas, la résolution z peut être d'environ 20 nm au mieux (généralement, 50 nm), mais le FOV pourrait être plus grand, bien que la résolution de pixel devrait être compromise pour une vaste région d'intérêt. Une solution pour surmonter ces limitations (magnification vs FOV) est de diviser la région d'intérêt dans les tuiles et d'acquérir chacund e-toi à une résolution plus élevée. Nous avons montré ici les résultats d'un jeu de données sBEM (i) dans les résultats représentatifs et d'un jeu de données de pile FIB-SEM (ii) dans les résultats représentatifs.
Alors que la génération de jeux de données de plus en plus grands est de plus en plus courante, les efforts visant à créer des outils de classification des pixels et de segmentation automatisée de l'image se multiplient; Néanmoins, à ce jour, aucun logiciel n'a prouvé une fiabilité comparable à celle de la relecture humaine, qui est donc encore nécessaire, peu importe le temps qu'il a. En général, les ensembles de données plus petits qui peuvent être réduits, comme dans le cas du jeu de données (ii), peuvent être densément reconstruits par un seul utilisateur expert en une semaine, y compris le temps de relecture.
Le protocole présenté ici implique l'utilisation de trois logiciels en particulier: Fidji (version 2.0.0-rc-65/1.65b), ilastik (version 1.3.2 rc2), et Blender (2.79), qui sont tous des programmes open-source et multi-plateforme et téléchargeables gratuitement. Fidji est une version de ImageJ, alimenté par des plugins pour l'analyse d'image biologique. Il a une architecture logicielle robuste et est suggéré car il est une plate-forme commune pour les scientifiques de la vie et comprend TrakEM2, l'un des premiers et les plus largement utilisés plugins pour la segmentation de l'image. Un problème rencontré par de nombreux utilisateurs ces derniers temps est la transition de Java 6 à Java 8, qui crée des problèmes de compatibilité; par conséquent, nous suggérons de s'abstenir de mettre à jour Java 8, si possible, pour permettre aux Fidji de fonctionner correctement. ilastik est un logiciel puissant fournissant un certain nombre de cadres pour la classification des pixels, chacun documenté et expliqué sur leur site Web. Le module de sculpture utilisé pour la segmentation semi-automatisée des piles EM est pratique car il permet aux scientifiques de réduire le temps passé sur le travail manuel de mois en jours pour un utilisateur expérimenté, comme en un seul clic un neurite entier peut être segmenté en quelques secondes. L'étape de prétraitement est très intense d'un point de vue matériel, et de très grands ensembles de données, comme la pile SBEM présentée ici, qui était de 26 Go, nécessitent des stratégies particulières pour s'intégrer dans la mémoire, étant donné que l'on achèterait un ensemble de données volumineux parce que ne peut pas domaine de vision et de résolution. Par conséquent, l'échantillonnage vers le bas pourrait ne pas être une solution appropriée dans ce cas. La dernière version du logiciel peut faire le prétraitement en quelques heures avec un poste de travail Linux puissant, mais la segmentation prendrait quelques minutes, et le défilement à travers la pile serait encore relativement lent. Nous utilisons toujours cette méthode pour une première segmentation approximative, et la relisons à l'aide de TrakEM2. Enfin, Blender est un logiciel de modélisation 3D, avec un puissant moteur de rendu 3D, qui peut être personnalisé avec des scripts python qui peuvent être intégrés dans l'interface graphique principale comme add-ons, tels que NeuroMorph et l'analyse du glycogène. La flexibilité de ce logiciel vient avec l'inconvénient que, contrairement à Fidji, par exemple, il n'est pas conçu pour la visualisation en ligne de grands jeux de données; par conséquent, la visualisation et la navigation à travers de grands maillage (dépassant 1 Go) peuvent être lents et peu efficaces. Pour cette raison, il est toujours conseillé de choisir des techniques qui réduisent la complexité des mailles, mais attention à ne pas perturber la morphologie originale de la structure d'intérêt. La fonction de remesh est pratique et est une fonctionnalité intégrée de l'outil d'importation de lots NeuroMorph. Un problème avec cette fonction est que, selon le nombre de vertices du maillage d'origine, la valeur de profondeur octree, qui est liée à la résolution finale, doit être modifiée en conséquence. Les petits objets peuvent être remeshed avec une petite profondeur d'octree (par exemple 4), mais la même valeur pourrait perturber la morphologie des objets plus grands, qui a besoin de plus grandes valeurs (6 au mieux, à 8 ou même 9 pour un maillage très grand, comme une cellule pleine). Il est conseillé de rendre ce processus itératif et de tester les différentes profondeurs d'octree si la taille de l'objet n'est pas claire.
Comme mentionné précédemment, un aspect qui doit être pris en compte est le pouvoir de calcul à consacrer à la reconstruction et l'analyse, liés au logiciel qui est utilisé. Toutes les opérations présentées dans les résultats représentatifs de ce manuscrit ont été obtenues à l'aide d'un MacPro, équipé d'une carte graphique AMD FirePro D500 Graphics, de 64 Go de RAM et d'un processeur Intel Xeon E5 avec 8 cœurs. Fidji dispose d'une bonne architecture logicielle pour le traitement de grands jeux de données; par conséquent, il est recommandé d'utiliser un ordinateur portable avec une bonne performance matérielle, comme un MacBook Pro avec un processeur Intel i7 de 2,5 GHz et 16 Go de RAM. le logiciel ilastik est plus exigeant en termes de ressources matérielles, en particulier pendant l'étape de prétraitement. Bien que downsampling la pile d'image est une bonne astuce pour limiter les demandes matérielles du logiciel et permet à l'utilisateur de traiter une pile avec un ordinateur portable (généralement si elle est inférieure à 500 pixels en x,y,z), nous suggérons l'utilisation d'un haut de gamme ordinateur pour exécuter ce logiciel en douceur. Nous utilisons un poste de travail équipé d'un processeur Intel Xeon Gold 6150 avec 16 cœurs et 500 Go de RAM.
Lorsqu'ils reçoivent une reconstruction 3D précise, les scientifiques peuvent jeter les micrographes originaux et travailler directement sur les modèles 3D pour extraire des données morphométriques utiles pour comparer les cellules du même type, ainsi que différents types de cellules, et profiter de la VR pour évaluations qualitatives et quantitatives des morphologies. En particulier, l'utilisation de ce dernier s'est avérée bénéfique dans le cas d'analyses de morphologies denses ou complexes qui présentent l'occlusion visuelle (c.-à-d. le blocage de la vue d'un objet d'intérêt dans l'espace 3D par un second placé entre l'observateur et le fi rst objet), ce qui rend difficile de les représenter et de les analyser en 3D. Dans l'exemple présenté, un utilisateur expérimenté a pris environ 4 heures non consécutives pour observer les jeux de données et compter les objets. Le temps consacré à l'analyse de la VR peut varier car des aspects comme la maladie de VR (qui peut, dans une certaine mesure, être lié au mal de voiture) peuvent avoir un impact négatif sur l'expérience d'utilisateur ; dans ce cas, l'utilisateur peut préférer d'autres outils d'analyse et limiter son temps consacré à la VR.
Enfin, toutes ces étapes peuvent être appliquées à d'autres techniques de microscopie et non-EM qui génèrent des piles d'images. EM génère des images qui sont, en général, difficiles à manipuler et à segmenter, par rapport, par exemple, la microscopie à fluorescence, où quelque chose de comparable à un masque binaire (signal par rapport à un fond noir), qui en principe peut être facilement rendu en 3D pour traitement ultérieur, doit souvent être traitée.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par la subvention de recherche compétitive de l'Université des sciences et de la technologie (KAUST) du Roi Abdullah (KAUST) à P.J.M.
matériels
| Name | Company | Catalog Number | Comments |
| Fiji | Open Source | 2.0.0-rc-65/1.65b | Open Source image processing editor www.fiji.sc |
| iLastik | Open Source | 1.3.2 rc2 | Image Segmentation tool www.ilastik.org |
| Blender | Blender Foundation | 2.79 | Open Source 3D Modeling software www.blender.org |
| HTC Vive Headset | HTC | Vive / Vive Pro | Virtual Reality (VR) Head monted headset www.vive.com |
| Neuromorph | Open Source | --- | Collection of Blender Addons for 3D Analysis neuromorph.epfl.ch |
| Glycogen Analysis | Open Source | --- | Blender addon for analysis of Glycogen https://github.com/daniJb/glyco-analysis |
| GLAM | Open Source | --- | C++ Code For generating GLAM Maps https://github.com/magus74/GLAM |
Références
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. Journal of Neuroscience. 28, 2959-2964 (2008).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLOS Biology. 2, e329 (2004).
- Coggan, J. S., et al. A Process for Digitizing and Simulating Biologically Realistic Oligocellular Networks Demonstrated for the Neuro-Glio-Vascular Ensemble. Frontiers in Neuroscience. 12, (2018).
- Tomassy, G. S., et al. Distinct Profiles of Myelin Distribution Along Single Axons of Pyramidal Neurons in the Neocortex. Science. 344, 319-324 (2014).
- Wanner, A. A., Genoud, C., Masudi, T., Siksou, L., Friedrich, R. W. Dense EM-based reconstruction of the interglomerular projectome in the zebrafish olfactory bulb. Nature Neuroscience. 19, 816-825 (2016).
- Kasthuri, N., et al. Saturated Reconstruction of a Volume of Neocortex. Cell. 162, 648-661 (2015).
- Calì, C., et al. The effects of aging on neuropil structure in mouse somatosensory cortex—A 3D electron microscopy analysis of layer 1. PLOS ONE. 13, e0198131 (2018).
- Calì, C., Agus, M., Gagnon, N., Hadwiger, M., Magistretti, P. J. Visual Analysis of Glycogen Derived Lactate Absorption in Dense and Sparse Surface Reconstructions of Rodent Brain Structures. , (2017).
- Calì, C., et al. Three-dimensional immersive virtual reality for studying cellular compartments in 3D models from EM preparations of neural tissues. Journal of Comparative Neurology. 524, 23-38 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, 52-61 (2005).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLOS ONE. 7, e38011 (2012).
- Januszewski, M., et al. High-precision automated reconstruction of neurons with flood-filling networks. Nature Methods. 1, (2018).
- Shahbazi, A., et al. Flexible Learning-Free Segmentation and Reconstruction of Neural Volumes. Scientific Reports. 8, 14247 (2018).
- Sommer, C., Straehle, C., Köthe, U., Hamprecht, F. A. Ilastik: Interactive learning and segmentation toolkit. , (2011).
- Holst, G., Berg, S., Kare, K., Magistretti, P., Calì, C. Adding large EM stack support. , (2016).
- Beyer, J., et al. ConnectomeExplorer: query-guided visual analysis of large volumetric neuroscience data. IEEE Transactions on Visualization and Computer Graphics. 19, 2868-2877 (2013).
- Beyer, J., et al. Culling for Extreme-Scale Segmentation Volumes: A Hybrid Deterministic and Probabilistic Approach. IEEE Transactions on Visualization and Computer. , (2018).
- Jorstad, A., et al. NeuroMorph: A Toolset for the Morphometric Analysis and Visualization of 3D Models Derived from Electron Microscopy Image Stacks. Neuroinformatics. 13, 83-92 (2015).
- Jorstad, A., Blanc, J., Knott, G. NeuroMorph: A Software Toolset for 3D Analysis of Neurite Morphology and Connectivity. Frontiers in Neuroanatomy. 12, 59 (2018).
- Calì, C. Astroglial anatomy in the times of connectomics. Journal of Translational Neuroscience. 2, 31-40 (2017).
- Mohammed, H., et al. Abstractocyte: A Visual Tool for Exploring Nanoscale Astroglial Cells. IEEE Transactions on Visualization and Computer Graphics. , (2017).
- Agus, M., et al. GLAM: Glycogen-derived Lactate Absorption Map for visual analysis of dense and sparse surface reconstructions of rodent brain structures on desktop systems and virtual environments. Computers & Graphics. 74, 85-98 (2018).
- École Polytechnique Fédérale de Lausanne. . NeuroMorph Analysis and Visualization Toolset. , (2018).
- . GitHub - daniJb/glycol-analysis: Glycogen_analysis.py is a python-blender API based script that performs analysis on a reconstructed module of glycogen data Available from: https://github.com/daniJb/glyco-analysis (2018)
- . GitHub – magus74/GLAM: Glycogen Lactate Absorption Model Available from: https://github.com/magus74/GLAM (2019)
- Agus, M., et al. GLAM: Glycogen-derived Lactate Absorption Map for visual analysis of dense and sparse surface reconstructions of rodent brain structures on desktop systems and virtual environments. Dryad Digital Repository. , (2018).
- Calì, C., et al. Data from: The effects of aging on neuropil structure in mouse somatosensory cortex—A 3D electron microscopy analysis of layer 1. Dryad Digital Repository. , (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon