Method Article
Une méthode pour la mesure de la fonction des glandes salivaires chez les souris
Dans cet article
Résumé
Hypofonction de la glande salivaire est une conséquence fréquente du traitement de la maladie et le rayonnement auto-immune. L’évaluation reproductible de fonction des glandes salivaires chez les modèles murins de ces maladies est un défi technique. Ici, on décrit une méthode simple pour la mesure précise et reproductible de la production de salive chez les souris.
Résumé
Les patients atteints du syndrome de Sjögren, une maladie auto-immune affectant les glandes exocrines, développent une inflammation des glandes salivaires et ont réduit la production de salive. De même, la production de salive est gravement compromise chez les patients recevant des traitements de radiothérapie pour les cancers de la tête et du cou. Les modèles de rongeurs, mis au point pour imiter ces conditions cliniques, facilitent la compréhension de la pathogenèse de la maladie et permettant le développement de nouvelles stratégies thérapeutiques. Par conséquent, la capacité pour mesurer la fonction des glandes salivaires chez les modèles animaux avec précision, de façon reproductible et à plusieurs reprises est essentielle. S’appuyant sur des procédures décrites précédemment dans la littérature, a développé une méthode qui remplit ces critères et a été utilisé pour évaluer la fonction des glandes salivaires chez les souris. Un autre avantage de cette nouvelle méthode est qu’elle est facilement maîtrisée et a peu de variation entre opérateurs. Fonction des glandes salivaires est évaluée comme la quantité (poids ou volume) ou le taux (mL/min) de la salive produite en réponse à la stimulation de la pilocarpine. La salive est une bonne source pour l’analyse de la teneur en protéines, les concentrations de l’immunoglobuline et autres biomolécules.
Introduction
Les glandes salivaires produisent la salive en réponse à divers stimuli neurologiques et mécanique1. Les stimuli sont transportés à travers le système nerveux sympathique et parasympathique sur les récepteurs adrénergiques et cholinergiques dans la glande. Pilocarpine est un agent cholinergique, para-sympathomimétique qui agit principalement sur les récepteurs muscariniques. Dans la glande salivaire, il induit la production de salive en agissant sur les récepteurs muscariniques de l’acétylcholine M31. La production de salive après l’administration de pilocarpine est un indicateur de la capacité des glandes salivaires à répondre à la stimulation et est couramment utilisée comme mesure de la fonction des glandes salivaires.
Une mesure précise de la production de salive est critique dans l’étude des maladies des glandes salivaires, y compris le syndrome de Sjögren2 et rayonnements des blessures suite de traitement du cancer de tête et le cou3. Plusieurs méthodes différentes ont été développées pour mesurer la production de salive chez les rongeurs. Il s’agit de canulation directe du excréteur salivaire conduit4, la collecte de salive de la cavité buccale sous vide5et la collection à l’aide de capillaires de verre6 ou une micropipette7,,8, 9. direct canulation du canal salivaire fournit la plus exacte et pure de salive. Toutefois, il s’agit d’une procédure techniquement difficile, et le potentiel de causer des lésions canalaires n’empêche collections répétitives de salive de l’animal même. Collecte de salive sous vide peut conduire à des résultats variables en raison de l’assèchement de la salive dans le tube. Cette perte est encore exagérée chez les souris avec diminution de la salivation. Capillaires en verre permettent la collecte de salive pour les analyses suivantes, cependant, changements de viscosité de la salive sécrétée dans l’état du malade permet un remplissage efficace du capillaire. Plus loin, tentatives de balayer la cavité buccale afin de recueillir la salive résiduelle peuvent entraîner blessures. La méthode de la pipette permet de collection complète, et pour le même opérateur, il est remarquablement constant entre les expériences. Toutefois, pour des raisons inconnues, cette méthode montre une variation importante entre les différents opérateurs. Par conséquent, pour permettre des comparaisons appropriées, il devient impératif que le même opérateur effectue toutes les expériences liées à un projet spécifique. De toute évidence, il s’agit d’un inconvénient majeur pour un laboratoire.
Pour surmonter ces problèmes, il a développé une méthode que les méthodes de collecte de salive combine utilisé pour les humains et les rongeurs. La méthode de l’écouvillon, décrite ci-dessous pour mesurer le volume de salive induite par la pilocarpine est simple, reproductible, non influencé par l’opérateur et peut être effectuée à plusieurs reprises chez le même animal. En outre, il permet de recueillir la salive pour les analyses subséquentes des protéines, les immunoglobulines ou les autres biomolécules.
Protocole
Le protocole décrit ci-après a été approuvé par le Comité de l’emploi et d’institutionnels animalier et il suit les directives éthiques établies par le National Institutes of Health. Toutes les données présentées dans ce rapport ont été générées en utilisant des souris femelles qui étaient de 10-12 semaines d’âge. La suite de variétés de souris ont été utilisée : C57BL/6, BALB/c, DBA1, 129S et F1 (B6XA/J). Toutes les souris ont été logés dans des cages de barrière (5 animaux par cage) dans des conditions spécifiques exempts de micro-organismes pathogènes et fournis nourriture et eau ad libitum.
1. préparation
- Pour préparer une solution mère de chlorhydrate de pilocarpine, peser 10 mg du composé et dissoudre dans 1,776 mL de sérum physiologique isotonique stérile au Vortex, pour donner une solution mère de 5,63 mg/mL. Il n’y a pas besoin de stériliser cette solution. Mais si vous le souhaitez, la filtrer à travers un filtre de 0,2 µM. Enregistrez cette solution-mère dans plusieurs parties aliquotes dans un congélateur à-80 oC pendant 3 mois. Chaque stock congelé est à usage unique. Une fois décongelé, ne pas recongeler la solution de la pilocarpine.
- Prenez 0,6 mL microtubes et soigneusement percez un petit trou dans le fond de chaque tube avec une aiguille de calibre 18 chauffée. La valeur de ces tubes en tubes de 2 mL. Les tubes ne sont pas nécessairement stériles.
- À l’aide d’une lame de rasoir sharp, stérile, dépecée cylindriques écouvillons absorbants environ 2 cm de longueur. Couper chaque morceau de 2 cm en diagonale pour donner 2 écouvillons en forme coniques. Placez un écouvillon dans chacun des microtubes à centrifuger 0,6 mL.
- Peser le tube à centrifuger 0,6 mL contenant l’écouvillon sec.
- Transférer les souris à étudier dans une nouvelle cage propre avec des bouteilles d’eau. Gardez les souris sans nourriture pendant au moins 2 h avant le début du prélèvement de salive pour empêcher les particules alimentaires de contaminer la salive prélevée.
Remarque : Il n’est pas nécessaire de garder 1 souris par cage pour cette procédure. Cependant, le nombre de souris placés dans chaque cage dépend de l’établissement des règles et règlements pour l’utilisation des animaux. - Juste avant la fin de 2 h, préparer la solution de travail de pilocarpine (0,0563 mg/mL) en diluant la solution stock 100 x dans une solution saline stérile. Il n’est pas nécessaire de filtre plu stériliser cette solution. Gardez toujours la solution de pilocarpine de travail sur la glace.
Remarque : Le tableau 1 donne la quantité de pilocarpine à doser pour une gamme de poids de corps de la souris pour donner une dernière dose de 0,375 mg/kg de poids corporel.
2. mode opératoire
- Peser chaque souris et la dose du mélange anesthésique pour chaque souris à l’aide du tableau 1. Injecter la première souris avec le volume approprié du mélange anesthésique par voie intrapéritonéale. Réglez la minuterie pendant 2 min (souches de souris la plupart testés dans ce protocole aller dormir en 2 min). Veiller à ce que la souris est correctement anesthésiée par manque de marche lorsqu’il est placé sur une surface plane. Si la souris est toujours à pied, attendez supplémentaire 2 min avant de passer à l’étape suivante. Appliquez une goutte de lubrifiant pommade ophtalmique à deux yeux pour éviter le dessèchement.
Remarque : Dans le tableau 1, la dose du mélange anesthésique est 0,007 mL/g de poids corporel. La gamme optimale pour cette procédure est de 0,006 à 0,008 mL/g de poids corporel. Cependant, après 4 min, si la souris est toujours marcher ou présentant des mouvements saccadés, consulter le vétérinaire institutionnel pour bien augmenter la dose de l’anesthésique. - Déterminer la dose de pilocarpine pour la souris à l’aide du tableau 1 et injecter la quantité appropriée par voie intrapéritonéale. Réglez la minuterie pendant 2 min et insérez le tube de drisse de 50 mL de la souris jusqu'à ce que la tête et les oreilles s’en tenir sur l’extrémité coupée. Placer le tube à un angle de 45 degrés, avec la tête en bas et la face ventrale vers le haut. Scotchez le tube à l’Office de procédure pour l’empêcher de bouger.
NOTE : Le tableau 1 fournit la posologie pour souris de plus de 17 g, que cette procédure n’a pas été tentée sur des souris pesant moins de 17 g. - À la fin de 2 min, doucement reposer une paire fermée de micro dissection forceps dans la bouche, puis soulever la mâchoire inférieure vers le haut pour ouvrir la bouche. Poussez la pince 1-2 mm plus loin dans la bouche, en vous assurant que la langue est vu reposant sur le bras supérieur de la pince. Avec une autre paire de pinces fines, tenir l’écouvillon sec préalablement pesé près de sa pointe conique.
- Faites doucement glisser l’extrémité conique de l’écouvillon dans la bouche. Retirer les pinces tout en laissant l’extrémité de l’écouvillon dans la cavité buccale.
- Saisissez l’extrémité la plus large de l’écouvillon s’étendant à l’extérieur de la bouche et tourner pour permettre à la superficie maximale de contact avec la bouche. Garder l’écouvillon dans cette position pendant 15 min.
Remarque : Ceci assure que l’écouvillon reste dans la bouche pendant la durée de la collection. Notez que l’extrémité conique de l’écouvillon agit comme une mèche et la partie plus large de l’écouvillon reste en dehors de la bouche. - À la fin de 15 min, doucement tourner l’écouvillon pour collecter une salive qui n’a pas été absorbée et placer l’écouvillon humide dans le tube à centrifuger 0,6 mL. Fermer le tube et mettez-le dans le tube 2 mL mis dans la glace.
NOTE : Pour l’instant, la muqueuse buccale paraîtra complètement sec. La souris peut maintenant être déplacée retour dans sa cage pour la récupération de l’anesthésie. - Transférer la souris dans la cage. Placer les boulettes de nourriture humide dans la cage après prélèvement de salive pour aider plus rapide réhydratation.
Remarque : Les souris réveillent avec 10 min après la fin de la collection. Injection sous-cutanée d’une solution saline isotonique préchauffé 0,2 mL peut également être indiquée pour accélérer la reprise. - Passez à la prochaine souris. Toutes les souris doivent être surveillés jusqu'à ce qu’ils ont complètement récupéré et sont ambulatoires.
3. les mesures
- À la fin de toutes les collections, peser les tubes de 0,6 mL avec l’écouvillon humide. Calculer la différence entre le poids et le poids sec pour obtenir le poids de la salive produite. Placer le tube de 0,6 mL avec de la salive dans le tube 2 mL.
- Couper les bouchons des tubes de 2 ml. Puis, centrifuger les tubes de 2 mL pendant 2 min à 7500 x g, à 4 ° c dans une centrifugeuse micro pour récupérer la salive. Mesurer le volume de salive obtenue à l’aide d’une micropipette.
- Exprimer les résultats comme la salive poids (mg)10 durant 15 min ou en proportion du poids de salive (mg) / poids (g) de la souris.
Remarque : Si on a mesuré le volume de salive extraite hors de l’écouvillon, exprimer les résultats en volume de salive récupéré (mL) ou le rapport du volume de salive (mL) / poids (g) de souris.
Résultats
Dans les systèmes de modèle expérimental de souris, la capacité à produire de la salive en réponse à la stimulation de la pilocarpine est utilisée comme un indicateur de fonction des glandes salivaires. La production de salive a été mesurée chez des souris femelles C57BL/6 11 semaines par la méthode de l’écouvillon. Dans la Figure 1 a, les résultats sont exprimés comme la quantité de salive (mg) recueillie suite à des doses croissantes de la pilocarpine. À la dose de 1 mg/kg de poids corporel, certains des souris commence à exposer la détresse (involontaires tremblements et frissons). C’est pourquoi des doses plus élevées de la pilocarpine, au-delà de 1 mg/kg de poids corporel n’ont pas été testées dans cette étude. L' Figure 1 b, les résultats sont représentés comme le ratio du poids de salive (mg) pour le poids de corps de la souris (g). Ensemble, ces données montrent une relation bonne dose-effet entre la production de quantité et de la salive de pilocarpine. Le volume de salive récupéré de l’écouvillon a été également mesuré. Comme le montre la Figure 1, il y a une concordance significative entre le poids de la salive et le volume où 1 mg de salive est égal à 0,001 mL.
Les résultats obtenus avec la méthode de prélèvement sont similaires à ceux obtenus avec la méthode de collecte de pipette. Figure 2 a montre que la quantité moyenne de salive prélevé par la méthode de prélèvement et la méthode de la pipette est très similaire et que les différences ne sont pas statistiquement significatives. Figure 2 b 2C et 2D montrent que l’écouvillonnage n’avait aucune incidence estimation de biomolécules dans la salive. En effet, en comparaison avec la méthode de la pipette, l’écouvillonnage ont suivi une tendance globalement plus élevée dans les concentrations moyennes de protéines salivaires totales (Figure 2), l’activité de lysozyme salivaire (Figure 2D) et IgA salivaire (Figure 2E). Toutefois, ces différences n’étaient pas statistiquement significatives.
La méthode de collecte de salive décrite ici est capable de détecter des différences d’un montant de salive produite par les souches de souris différente (Figure 3) et des glandes salivaires Hypofonction induite par différentes maladies (Figure 4). Figure 3 a montre les résultats de la pilocarpine induit la production de salive des souris C57BL/6, BALB/c, DBA1/J et 129S6 femelles de 10-12-week-old. Les souris 129S6 produit la plus petite quantité de salive par rapport aux autres souches. Il est à noter que les différences dans le poids corporel de ces souris n’étaient pas significativement différents (Figure 3 b). Ensuite, la méthode écouvillon a été utilisée pour détecter l’Hypofonction de la glande salivaire et deux exemples sont présentés dans la Figure 4. Figure 4 a montre un résultat représentatif des glandes salivaires Hypofonction induite par l’activation de l’immunité innée après injection du lipopolysaccharide (LPS) (10 µg/souris, par voie intrapéritonéale). Souris de contrôle ont été injectés avec saline11. Chez les souris traitées LPS montrent une baisse significative dans la salive par rapport aux témoins. Transfert passif des anticorps réagissant avec l’antigène le syndrome de Sjögren A/Ro52 induit Hypofonction de la glande salivaire, et ce modèle imite certains aspects du syndrome de Sjögren9. Comme le montre la Figure 4 b, souris injectées avec alun adjuvant plus des anticorps anti-Ro52 ensemble étaient significativement plus faible production de salive par rapport aux souris non traitées ou souris traitées seulement avec l’alun.
La méthode de l’écouvillon est simple à mettre en œuvre et l’opérateur indépendant. La figure 5 illustre la production de salive des souris C57BL/6 femelles 10 13-semaines, au cours d’expériences effectuées à 6 points dans le temps différentes de 2 opérateurs différents. Opérateur, j’ai commencé avec seulement 2 mois d’expérience de manutention opérateur II avait 6 mois de souris précédente expérience dans la manoeuvre, mais a été introduit seulement à la méthode de prélèvement de salive pour une semaine de la souris. Ces données ont été produites dans des expériences menées à presque un an d’intervalle, à l’aide de 0,375 mg/kg dose de pilocarpine. Les ratios de salive obtenus par les deux opérateurs montrent un éventail de lectures (1,84 à 5,87). Opérateur de j’ai expériences s’étend sur une période de 10 semaines alors que les expériences d’opérateur II ont été réalisées sur 3 jours consécutifs près d’un an plus tard (Figure 5 a). Notamment, les rapports de salive obtenus au fil du temps n’étaient pas significativement différents (p = 0,064 ; Test de Kruskal-Wallis). Pour plus amples comparer des variations entre opérateurs, les ratios de poids de salive par g de poids corporel de 3 expériences pour chaque opérateur ont été regroupées et sont indiquées dans la Figure 5 b. Salive rapports obtenus par opérateur, j’ai (moyenne + SEM ; 4,45 + 0,152, n = 38) ne diffèrent pas sensiblement de 2 opérateur (moyenne + SEM ; 4.21 + 0,169 ; n = 25 ; p = 0,296 par test de Mann Whitney).

Figure 1 : production de salive dépend de la dose de pilocarpine. Des souris C57BL6/J (11 semaines femelles, 5 par groupe) ont été injectés avec différentes doses de pilocarpine (0,25 mg/kg, 0,5 mg/kg et 1,0 mg/kg de poids corporel) et la production de salive a été mesurée pendant 15 min. (A) résultats sont représentés sous forme de quantité de salive mg (moyenne ± SEM). (B) les données sont représentées comme ratio moyen de salive (salive mg par g de poids corporel souris). Salive (C) des souris C57BL/6 femelles de 11 semaines (n = 5) ont été recueillies par la méthode de l’écouvillon. Pilocarpine a été utilisé à une dose de 0,375 mg/kg de poids corporel. Les écouvillons humides ont été pesés pour mesurer la quantité de salive produite en mg. La salive dans les écouvillons a été ensuite récupérée par centrifugation, et les volumes de la salive Récupérée ont été mesurés. L’entente importante est observée entre le poids de la salive dans le volume de mg et de la salive en µL. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
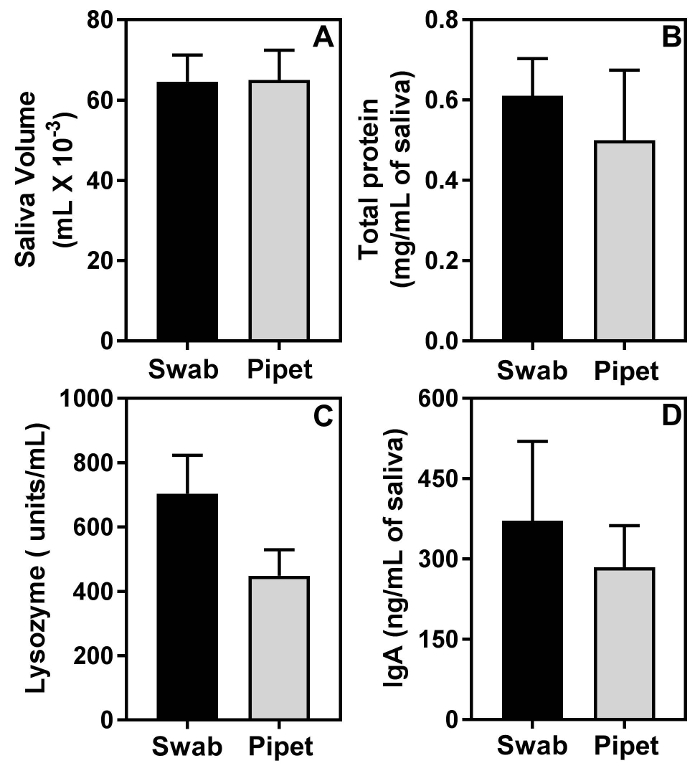
Figure 2 : l’écouvillonnage n’influe pas sur l’analyse de biomolécules dans la salive. Salive de 2 groupes de souris C57BL/6 femelles de 11 semaines, (n = 5 souris par groupe), a été capturé, soit par la méthode de l’écouvillon, soit par la méthode de la micropipette. Les différences dans les volumes moyens de salive (A), des quantités moyennes de protéines (B), consommation moyenne de l’activité de lysozyme (C) et moyenne quantités d’IgA entre les 2 groupes ne sont pas statistiquement significatifs. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : la méthode de l’écouvillon de prélèvement de salive détecte des différences dans la ligne de base de la production de salive par différentes souches de souris. (A) salive des souris femelles de (10-12-week-old) ont été prélevés pendant 15 min à l’aide d’une dose de pilocarpine de 0,375 mg/kg de poids corporel. (B) le poids corporel moyen entre les groupes de souris ne différaient pas significativement. Signification statistique a été analysée par le Kruskal-Wallis, test, suivi par Dunn de test de comparaisons multiples. Un p < 0,05 était considérée comme significative. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : écouvillonnage détecte Hypofonction de la glande salivaire. (A) (B6 X A / J) des souris femelles F1 ont été injectés avec une solution de LPS (0,1 mg/mL, 0,1 mL par souris par voie intrapéritonéale) ou une solution saline et salive mesurait 26 h plus tard. Une expérience représentative montre une significative (p = 0,0079) goutte d’eau (60 %) dans la production de salive chez les souris traitées avec le LPS. (B) Hypofonction de la glande salivaire a été mesurée dans un système de modèle expérimental de souris pour le syndrome de Sjögren. Le modèle précédemment publiées transfert passif pour l’induction du dysfonctionnement glandulaire a été utilisé4 avec quelques modifications. Les souris C57BL/6 femelles (10-12 semaines) ont été injectés avec adjuvant d’alun. Jours 14 à 20 de souris ont été injectés avec 0,05 mL de sérum de lapin anti-Ro52 et la production de salive a été mesurée après 24 h. noter une importante (p = 0,0003) goutte d’eau (50 %) dans la production de salive chez les souris traitées avec du sérum de l’alun et anti-Ro52. Signification statistique a été analysée par le Kruskal-Wallis, test, suivi par Dunn de test de comparaisons multiples. Un p < 0,05 était considérée comme significative. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
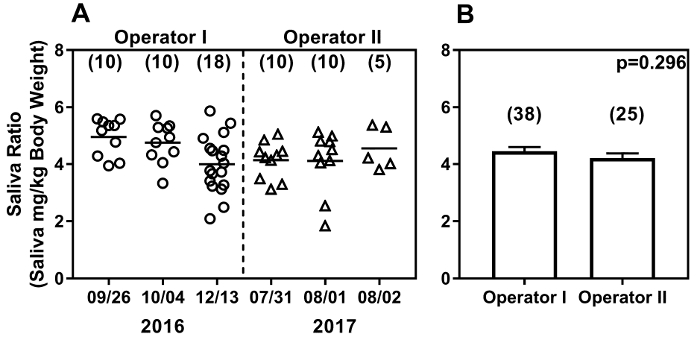
Figure 5 : l’écouvillonnage donne des résultats reproductibles au fil du temps (A) et entre opérateurs B. L’écouvillonnage montre des résultats comparables entre les deux opérateurs avec des longueurs différentes de souris, expérience dans des expériences menées sur un an, dans la manoeuvre. Production de salive de référence dans les souris C57BL/6 femelles (10-13 semaines d’âge) a été mesurée par chaque opérateur. Les résultats sont exprimés en poids de salive produite (mg/g de poids corporel). Dates de prélèvement de salive sont sur l’axe des abscisses et montre les résultats des données recueillies au fil du temps (A). Chaque point de données représente une souris, et le nombre de souris analysées à chaque fois est indiqué entre parenthèses. Les ratios de salive Baseline (moyenne + SEM) regroupées à partir de 3 expériences figurent (B)et ne sont pas significativement différents entre les opérateurs. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La production de salive est un processus complexe et dépend de nombreux facteurs. Par conséquent, la fonction des glandes salivaires chez les animaux de laboratoire de mesure peut être un défi. Un autre défi est que des mesures répétées de la fonction des glandes salivaires chez le même animal sont tenus d’établir l’apparition de la maladie ou de démontrer la récupération après un traitement.
L’écouvillonnage décrite dans le présent rapport est techniquement simple à réaliser avec de multiples options pour représenter les données. Les résultats obtenus sont reproductibles, avec peu de variations entre opérateurs. La méthode peut détecter une réduction de la production de salive dans différents modèles de dysfonctionnement des glandes salivaires. Un avantage important est l’utilisation de polymères hautement absorbants inertes et récupération efficace de la salive collectée, permettant la mesure des biomolécules salivaire. Un autre avantage de cette méthode est qu’il est possible d’effectuer cette procédure en même temps chez la souris jusqu'à 2 à la fois par un seul opérateur. C’est nettement plus efficace que certaines des autres méthodes, où il est effectué en une seule souris à la fois.
La variabilité dans les mesures de la production de salive ont été la bête noire de toutes les techniques de mesure de salive. Afin de réduire la variabilité, il est important de respecter strictement le protocole. Étapes critiques incluent : sélectionner le même temps de la journée de jeûne des souris et la collecte de salive, échéant dose d’anesthésique et pilocarpine (tableau 1) et poids précis rendus des tampons secs et humides. Gestion du temps attentif est nécessaire pour définir jusqu'à 2 souris à la fois pour le prélèvement de salive.
Comme illustré à la Figure 3, la quantité de salive produite par souris est dépendante de la souche. Ainsi, échéant souche, âge et sexe souris correspondants doivent être utilisés comme contrôles. Titrage de la dose de pilocarpine, pour la souche spécifique et les conditions expérimentales étudiées, est fortement recommandée. Bien qu’une dose plus élevée de la pilocarpine au-delà de 0,5 mg/kg induit une production accrue de salive, d’évaluer l’Hypofonction glandulaire, il est recommandé d’utiliser une dose plus faible. Cela permet d’identifier des différences mineures dans la production de salive entre le malade et contrôler la souris. Doses de 0,5 mg/kg de poids corporel et 0,375 mg/kg de poids corporel ont été utilisées avec succès pour démontrer l’Hypofonction de la glande salivaire. Toutefois, il est à noter que certains systèmes de modèle expérimental peuvent nécessiter des périodes plus ou moins longues de collection que celle décrite dans le présent protocole. Cela doit être testé par chaque laboratoire.
Une limitation de cette méthode et les méthodes de mesure plus de salive est la nécessité d’une anesthésie. Le rapport avec la méthode vide ne comprend pas l’utilisation d’anesthésiques5. Toutefois, l’absence de l’anesthésie induit des niveaux variables de l’anxiété chez les souris. Ils ont tendance à lutter et à mordre la tubulure, et qui à leur tour, peuvent influencer l’efficacité sortie et collecte de salive. Isoflurane anesthésie chez le rat provoque une halte-accueil pilocarpine induit salive production12. En revanche, la kétamine augmente les sécrétions salivaires et bronchiques grâce à une stimulation sympathique13. Nous et autres avons utilisé avec succès la kétamine et xylazine mélange comme anesthésique pour mesurer la pilocarpine induit la production de salive4,7,8,9. La plage recommandée pour l’anesthésie chirurgicale est de 100 à 200 mg/kg de la kétamine et de 5 à 16 mg/kg de xylazine14. La dose de 0,008 0,006 mL/g de poids corporel utilisée dans cette méthode (correspond à 60-80 mg/kg de la kétamine et 6-8 mg/kg de xylazine) tombe dans la partie inférieure de la fourchette recommandée et est suffisante pour assurer un niveau constant d’immobilisation sans anesthésie profonde .
La méthode de prélèvement a été créée comme une alternative à la méthode de la micropipette couramment utilisés. L’inconvénient majeur de la méthode de la pipette a été la grande variabilité entre opérateurs et la nécessité de recueillir la salive d’une souris à la fois. La méthode écouvillon répond à ces deux problèmes. Les avantages incluent limitant le nombre d’animaux nécessaires pour atteindre la puissance dans les analyses statistiques et une efficacité accrue. Cotons-tiges remplaçant avec les écouvillons de polymère inerte offrent une meilleure option puisque cotons-tiges sont connus à l’impact de quantification des molécules biologiquement actives de15.
Compte tenu de la simplicité de la méthode de l’écouvillon et sa reproductibilité élevée entre différents individus, il est à espérer que l’écouvillonnage facilitera les meilleures comparaisons de modèles murins entre institutions et chercheurs dans des laboratoires différents.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer.
Remerciements
L’étude a été financée par une subvention du National Institutes of Health, National Institute of Dental and Craniofacial Research (DE025030).
matériels
| Name | Company | Catalog Number | Comments |
| Chemicals for saliva collection | |||
| Pilocarpine hydrochloride | Alfa Aesar, Tewksbury, MA, USA | B21410 | Dilute in sterile isotonic saline. Store single use aliquots of 100X stock at -80oC |
| Name | Company | Catalog Number | Comments |
| Anesthesia Mix solution | Mix 1 mL ketamine hydrochloride + 0.5 mL xylazine + 8.5 mL sterile isotonic saline in a sterile vial. Can be used for 3 months. | ||
| Zetamine (Ketamine hydrochloride) | Vet One, Boise, Idaho, USA | C3N VT1 | Stock is 100 mg/mL |
| Anased (Xylazine) | Med-Vet International, Mettawa, IL, USA | RXANASED-20 | Stock is 20 mg/mL |
| Isotonic sterile saline | Vet One, Boise, Idaho, USA | 501032 | Used as diluent |
| Artificial tears (lubricant ophthalmic ointment) | Henry Schien, Dublin, OH, USA | 48272 | Used to prevent eyes from drying during the procedure |
| Name | Company | Catalog Number | Comments |
| Materials for saliva collection | |||
| SalivaBio Children's swab | Salimetrics, LLC Carlsbad, CA, USA | N/A | Individually wrapped swabs |
| 50 mL polypropylene tubes | VWR, Radnor, PA, USA | 89004-364 | Cut off the bottom 1 cm of the tube. Make sure that the cut edge is smooth. |
| Microcentrifuge tubes 0.6 mL | VWR, Radnor, PA, USA | 87003-290 | Make holes in the bottom of tube with heated 18 gauge needles |
| Microcentrifuge tubes 2 mL | VWR, Radnor, PA, USA | 87003-298 | |
| Insulin Syringes with permanently attached needles | Becton Dickinson and Company, Franklin Lakes, NJ, USA | 324702 | |
| 18 gauge regular bevel needles | Becton Dickinson and Company, Franklin Lakes, NJ, USA | 305195 | |
| Sterile scalpel blade #11 | Integra York Inc PA, USA | 4-311 | |
| Microdissecting forceps | Roboz, Gaithersburg, MD, USA | RS-5139 | Serrated angular 0.8 mm tip, 4" length |
| Label tape | Santa Cruz Biotechnology, Dallas, TX, USA | sc-224487 | |
| 3 channel timer | Amazon.com, Seattle, WA, USA | B06W2KCYVN | |
| Analytical Balance | Mettler Toledo, Columbus OH, USA | ||
| Name | Company | Catalog Number | Comments |
| Chemicals/ reagents for inducing salivary dysfunction | |||
| LPS | Invivogen, San Deigo, CA, USA | tlrl-b5lps | Dissolve in endotoxin free water, and store stock solution at 5 mg/mL . dilute in sterile HBSS 100 ug/mL - inject 100 uL/ moue ip |
| Imject Alum adjuvant | Thermo Scientific | 77161 | Dilute 1:1 in sterile saline. Inject intraperitoneally 0.1 mL/mouse |
| Rabbit anti-Ro52 antiserum | Generated in lab | Immunization of rabbits with recombinant mouse Ro52 | |
| Name | Company | Catalog Number | Comments |
| Chemicals/ Kits for saliva analyses | |||
| Salivary lysozyme estimation | |||
| EnzChek Lysozyme Assay Kit | Molecular Probes, Eugene, OR, USA | E-22013 | Used as per manufacturer's instructions |
| Name | Company | Catalog Number | Comments |
| Salivary IgA estimation by sandwich ELISA | |||
| Mouse IgA | Southern Biotech, Birmingham, AL, USA | 0106-01 | Standards for sandwich ELISA - range 30 ng/mL to 0.5 ng/mL |
| Goat anti- mouse IgA unlabeled | Southern Biotech, Birmingham, AL, USA | 1040-01 | Coat at 1 ug/mL in bicarbonate buffer |
| Goat anti- mouse IgA HRP | Southern Biotech, Birmingham, AL, USA | 1040-05 | Detection antibody used at 1:4000 dilution |
| TMB substrate | Becton Dickinson and Company, Franklin Lakes, NJ, USA | 555214 | Used as per manufacturer's instructions |
| Immulon 4HBX Microtiter 96 well plates | Thermo Scientific, Rochester, NY, USA | 3855 | |
| Name | Company | Catalog Number | Comments |
| Salivary protein estimation | |||
| Bio-Rad Protein Assay Dye Reagent Concentrate | BioRad, Hercules, CA, USA | 5000006 | For protein estimation as per manufacturer's instructions |
Références
- Proctor, G. B. The physiology of salivary secretion. Periodontol 2000. 70 (1), 11-25 (2016).
- Fox, R. I. Sjögren's syndrome. Lancet. 366 (9482), 321-331 (2005).
- Eisbruch, A., Kim, H. M., Terrell, J. E., Marsh, L. H., Dawson, L. A., Ship, J. A. Xerostomia and its predictors following parotid-sparing irradiation of head-and-neck cancer. Int J Radiat Oncol Biol Phys. 50 (3), 695-704 (2001).
- Marmary, Y., Fox, P. C., Baum, B. J. Fluid secretion rates from mouse and rat parotid glands are markedly different following pilocarpine stimulation. Comp Biochem Physiol A Comp Physiol. 88 (2), 307-310 (1987).
- Lin, A. L., Johnson, D. A., Wu, Y., Wong, G., Ebersole, J. L., Yeh, C. K. Measuring short-term gamma-irradiation effects on mouse salivary gland function using a new saliva collection device. Arch Oral Biol. 46 (11), 1085-1089 (2001).
- Scofield, R. H., Asfa, S., Obeso, D., Jonsson, R., Kurien, B. T. Immunization with short peptides from the 60-kDa Ro antigen recapitulates the serological and pathological findings as well as the salivary gland dysfunction of Sjogren's syndrome. J Immunol. 175 (12), 8409-8414 (2005).
- Deshmukh, U. S., Nandula, S. R., Thimmalapura, P. R., Scindia, Y. M., Bagavant, H. Activation of innate immune responses through Toll-like receptor 3 causes a rapid loss of salivary gland function. J Oral Pathol Med. 38 (1), 42-47 (2009).
- Deshmukh, U. S., Ohyama, Y., Bagavant, H., Guo, X., Gaskin, F., Fu, S. M. Inflammatory stimuli accelerate Sjögren's syndrome-like disease in (NZB x NZW)F1 mice. Arthritis Rheum. 58 (5), 1318-1323 (2008).
- Szczerba, B. M., et al. Interaction between innate immunity and Ro52-induced antibody causes Sjögren's syndrome-like disorder in mice. Ann Rheum Dis. 75 (3), 617-622 (2016).
- Takakura, A., Moreira, T., Laitano, S., De Luca Júnior, L., Renzi, A., Menani, J. Central muscarinic receptors signal pilocarpine-induced salivation. J Dent Res. 82 (12), 993-997 (2003).
- Yao, C., et al. Lipopolysaccharide-induced elevation and secretion of interleukin-1beta in the submandibular gland of male mice. Immunology. 116 (2), 213-222 (2005).
- Knudsen, J., Nauntofte, B., Josipovic, M., Engelholm, S. A., Hyldegaard, O. Effects of isoflurane anesthesia and pilocarpine on rat parotid saliva flow. Radiat Res. 176 (1), 84-88 (2011).
- Kohrs, R., Durieux, M. E. Ketamine: teaching an old drug new tricks. Anesth Analg. 87 (5), 1186-1193 (1998).
- Cold Spring Harbor Protocols. Cold Spring Harb Protoc. , Available from: http://cshprotocols.cshlp.org/ (2006).
- Kozaki, T., Hashiguchi, N., Kaji, Y., Yasukouchi, A., Tochihara, Y. Effects of saliva collection using cotton swab on cortisol enzyme immunoassay. Eur J Appl Physiol. 107 (6), 743-746 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon