Method Article
小鼠涎腺功能的测定方法
摘要
涎腺功能是自身免疫性疾病和放射治疗的常见后果。小鼠涎腺功能的重现性评价这些疾病的模型是一个技术挑战。在这里, 一个简单的方法, 准确和重复的测量唾液生产的小鼠描述。
摘要
干燥氏综合征是一种影响外分泌腺体的自身免疫性疾病, 它会发展涎腺炎症并减少唾液的产生。同样, 在接受放疗治疗头颈部癌症的患者中, 唾液的分泌也受到严重损害。啮齿动物模型, 开发, 以模仿这些临床条件, 促进了解疾病的发病机制, 并允许发展新的治疗策略。因此, 在动物模型中准确、性和反复测量涎腺功能的能力是至关重要的。根据文献中描述的程序, 建立了符合这些标准的方法, 并用于评价小鼠唾液腺功能。这种新方法的另一个优点是它易于掌握, 并具有极少的互操作性变化。唾液腺功能是评估的数量 (重量或体积) 或速率 (毫升/分钟) 的反应产生的匹罗卡品刺激。收集的唾液是分析蛋白质含量、免疫球蛋白浓度和其他生物分子的好来源。
引言
唾液腺产生唾液, 以响应各种神经和机械刺激1。刺激是通过交感神经和副交感神经系统的肾上腺素和胆碱受体在腺体。匹罗卡品是一种胆碱能交感神经剂, 主要作用于毒蕈受体。在唾液腺, 它通过作用于毒蕈乙酰胆碱受体 M31来诱导唾液的产生。在匹罗卡品管理的唾液生产是一个指标的能力, 唾液腺反应刺激和通常使用作为衡量唾液腺功能。
唾液生产的准确测量是研究涎腺疾病的关键, 包括干燥氏综合征2和头颈癌治疗后的辐射损伤3。几种不同的方法已经被开发, 以测量唾液生产啮齿动物。这些包括排泄涎腺导管的直接插管4, 从口腔中收集的唾液在真空下的5, 并收集使用玻璃毛细管6或微7,8,9. 唾液腺导管的直接插管提供了最准确和纯净的唾液。然而, 这是一个技术上具有挑战性的过程, 和潜在的造成导管损伤排除重复唾液收集来自同一动物。在真空中收集唾液会导致因唾液从管子中干燥而产生的变化。这种损失是进一步夸大小鼠与减少流涎。玻璃毛细管允许收集唾液进行后续分析, 但是, 在患病状态下分泌的唾液粘度的变化防止毛细血管的有效充填。此外, 试图清扫口腔, 以收集残留的唾液可能导致伤害。吸管方法允许完全收集, 对于同一个算子, 它在实验之间是非常一致的。但是, 由于未知的原因, 此方法在不同运算符之间显示出显著的差异。因此, 要允许进行适当的比较, 同样的操作者必须执行与特定项目相关的所有实验。显然, 这是一个实验室的主要劣势。
为了克服这些问题, 制定了一个程序, 将唾液收集方法用于人类和啮齿动物。用棉签法测定匹罗卡品引起的唾液体积简单、重现性好, 不受操作者影响, 可在同一动物中重复进行。此外, 它允许收集唾液, 随后分析蛋白质, 免疫球蛋白, 或其他生物分子。
研究方案
下文所述的议定书得到了机构动物保育和使用委员会的批准, 并遵循了国家卫生研究院制定的道德准则。本报告所列的所有数据都是使用10-12 周龄的雌性小鼠产生的。使用的小鼠如下: C57BL/6, balb/c, DBA1, 129S, 和 (B6XA/J) F1。所有小鼠都被安置在屏障笼 (每笼5只动物) 的特定无病原体条件, 并提供饲料和水 ad 随意。
1. 准备
- 要准备一份盐酸匹罗卡品的溶液, 重10毫克的化合物, 并将其溶于1.776 毫升的无菌等渗盐水中, 由涡流, 给出一个5.63 毫克/毫升的股票溶液。没有必要对此解决方案进行消毒。但如果需要, 通过0.2 µM 过滤器过滤。将此库存解决方案存储在-80 oC 冰箱中的多个等分中, 可长达3月。每一个冷冻库存是一次性使用。一旦解冻, 不要冻结的匹罗卡品溶液。
- 采取0.6 毫升离心管, 并小心地打在每个管底部的一个小孔与一个加热的18口径针。将这些管子设置成2毫升的管子。管子不必是无菌的。
- 使用锋利的无菌刀片, 将圆柱形吸水棉签切成2厘米长的碎片。斜切每2厘米的一块, 给2圆锥状的棉签。在0.6 毫升离心管中每一个都放一个棉签。
- 称0.6 毫升离心管含有干拭子。
- 把老鼠转移到一个新的干净的笼子里, 用水瓶来研究。在开始收集唾液之前, 将没有食物的小鼠保持至少2小时, 以防止食物颗粒污染所收集的唾液。
注意: 此过程不需要保持每笼1鼠标。然而, 在每个笼子里放置的老鼠数量取决于具体机构的动物使用规则和规定。 - 在2小时结束前, 准备工作的匹罗卡品解决方案 (0.0563 毫克/毫升), 稀释的库存溶液100x 在无菌盐水。这是没有必要进一步过滤消毒这个解决方案。在冰上始终保持工作的匹罗卡品解决方案。
注:表 1给出了用于一系列鼠标体重的匹罗卡品的数量, 以给出0.375 毫克/千克体重的最终剂量。
2. 程序
- 使用表 1对每个鼠标进行权衡, 并确定每个鼠标的麻醉组合剂量。将第一只老鼠注射到腹腔内的麻醉药的适当容积。设置2分钟的定时器 (在这个协议中测试的大多数小鼠菌株去睡觉2分钟)。当放置在平坦的表面上时, 确保鼠标被正确地麻醉。如果鼠标仍在行走, 请等待额外的2分钟, 然后再继续下一步。应用一滴润滑油眼膏, 以防止干燥。
注: 在表 1中, 麻醉剂混合物的剂量是0.007 毫升/克体重。这个过程的最佳范围是0.006 到0.008 毫升/克体重。然而, 4 分钟后, 如果鼠标仍然行走或表现出生涩的运动, 请咨询机构兽医适当增加麻醉剂量。 - 使用表 1确定用于鼠标的匹罗卡品的剂量, 并通过腹腔内路由注入适当的量。将定时器设置为2分钟, 并将鼠标插入50毫升抑制剂管, 直到头部和耳朵伸出切口为止。将管子置于45度角, 头部向下, 腹面朝上。把管子贴到手术板上, 防止它移动。
注:表 1为小鼠提供了17克以上的剂量, 因为这一过程没有尝试对体重低于17克的小鼠。 - 在2分钟结束时, 轻轻地将一双闭合的显微解剖钳插入口中, 并将下颚向上提起以打开嘴巴。把镊子1-2 毫米进一步推入口中, 确保舌头被看见放在钳子的顶臂上。用另一对精致的镊子, 按住前称的干拭子接近其锥形尖端。
- 轻轻地将拭子的锥形尖端滑入口中。取出镊子, 在口腔中留下棉签的尖端。
- 抓住更宽的棉签的一端延伸到嘴的外面, 旋转它以允许与嘴巴接触的最大面积。保持棉签在这个位置15分钟。
注意: 这可确保拭子在收集期间保持在口中。请注意, 棉签的锥形尖端起到灯芯的作用, 拭子的较宽部分仍留在口腔外。 - 在15分钟结束时, 轻轻旋转拭子以收集未被吸收的唾液, 并将湿拭子放入0.6 毫升离心管中。关闭管, 并设置在2毫升管放在冰。
注: 此时, 口腔黏膜会出现完全干燥。现在, 老鼠可以被移回笼子里, 从麻醉中恢复过来。 - 将鼠标移到笼子里。在唾液收集后将湿润的食物颗粒放在笼子里, 以帮助更快的补液。
注意: 小鼠在收集结束后10分钟内醒来。皮下注射0.2 毫升预热等渗盐水也可给予加速恢复。 - 继续下一只鼠标。所有的小鼠都应该被监测, 直到它们完全恢复并处于流动状态。
3. 测量
- 在所有的收集结束, 重量0.6 毫升管与湿拭子。计算湿重和干重之间的差异以获得唾液的重量。将0.6 毫升管与唾液放回2毫升管。
- 切断2毫升管子的盖子然后, 离心2毫升管2分钟在 7500 x g, 在4oC 在一个微型离心机, 以恢复唾液。测量用微获得的唾液体积。
- 表达的结果为唾液重量 (mg)10超过15分钟或作为唾液重量 (mg)/小鼠体重 (g) 的比率。
注: 如果从拭子中提取出的唾液量被测量出来, 则表明唾液体积 (毫升) 或唾液体积 (毫升)/小鼠体重 (g) 的比值。
结果
在实验小鼠模型系统中, 以匹罗卡品刺激产生唾液的能力被用作唾液腺功能的指标。用拭子法测定了11周老 C57BL/6 雌性小鼠的唾液分泌。在图 1A中, 结果被表示为在增加的匹罗卡品之后收集的唾液量 (mg)。在1毫克/千克体重的剂量, 一些小鼠开始表现出窘迫 (不由自主的颤抖和颤抖)。因此, 在本研究中没有对1毫克/千克体重的匹罗卡品进行测试。在图 1B中, 结果以唾液重量 (mg) 与小鼠体重 (g) 的比值表示。总的来说, 这些数据显示了一个很好的剂量反应关系之间的匹罗卡品数量和唾液生产。还测量了从拭子中回收的唾液量。如图 1C所示, 唾液重量与体积之间有很大的一致性, 1 毫克的唾液等于0.001 毫升。
用拭子法获得的结果与用吸管收集法获得的效果相似。图 2A显示了用拭子法和吸管法收集的平均唾液量是非常相似的, 差异在统计学上并不显著。图 2B, 2C和2D表明, 拭子方法不影响唾液中生物分子的估计。事实上, 与吸管方法相比, 拭子法在总唾液蛋白 (图 2C)、唾液溶菌酶活性 (图 2D) 和唾液 IgA (图 2E) 的平均水平上呈总体较高的趋势。然而, 这些差异在统计学上并不显著。
这里描述的唾液收集方法能检测不同的小鼠品系 (图 3) 和不同疾病条件 (图 4) 诱发的涎腺功能产生的唾液数量的差异。图 3A显示了10-12 周前的雌性 C57BL/6、balb/c、DBA1/J 和129S6 小鼠的唾液产生的结果。与其他菌株相比, 129S6 小鼠产生的唾液含量最低。应该指出的是, 这些小鼠体重的差异没有明显的不同 (图 3B)。其次, 用拭子法检测涎腺功能, 并在图 4中显示了两个示例。图 4A显示了在注射脂多糖 (LPS) (10 µg/鼠腹腔) 后, 由于先天免疫激活而诱发的涎腺功能的典型结果。控制小鼠注射生理盐水11。与对照组相比, LPS 治疗的小鼠唾液明显下降。被动转移抗体反应与干燥氏综合征抗原 A/Ro52 诱导涎腺功能, 这个模型模仿某些方面的干燥氏综合征9。如图 4B所示, 注射佐剂明矾加 anti-Ro52 抗体的小鼠与未经治疗的小鼠或只用明矾处理的小鼠相比, 唾液产量显著降低。
该方法易于实现, 操作独立。图 5显示了10-13 周前的雌性 C57BL/6 小鼠的唾液分泌, 在6不同时间点的实验中, 2 不同的操作者进行了试验。操作员我开始仅2月的鼠标处理经验, 而操作员 II 有6月以前的鼠标处理经验, 但只介绍了唾液收集方法一周。这些数据是在几乎相隔一年的实验中产生的, 使用了0.375 毫克/千克的匹罗卡品。两个算子得到的唾液比值显示了一系列读数 (1.84 到 5.87)。操作员 i 的实验跨越了10周的时间, 而操作员 II 的实验是在将近一年后连续3天进行的 (图 5A)。值得注意的是, 随着时间推移获得的唾液比值没有显著差异 (p = 0.064;克鲁斯卡尔-沃利斯测试)。为了进一步比较间运算符的变化, 每个运算符的3实验中的唾液重量与每克体重的比值都汇集在一起, 并显示在图 5B中。由操作者获得的唾液比 (平均 + sem; 4.45 + 0.152, n=38) 与算子 2 (平均 + sem; 4.21 + 0.169; n=25; p = 0.296 由曼恩惠特尼测试) 没有显著差异。

图 1: 唾液产量取决于匹罗卡品剂量.C57BL6/J 的老鼠 (11 周大的雌性, 5 每组) 注射不同剂量的匹罗卡品 (0.25 毫克/千克, 0.5 毫克/千克和1.0 毫克/千克体重) 和唾液生产被测量为 15 min. (A)结果表示为毫克唾液量 (平均± SEM)。(B)数据表示为平均唾液比 (每克老鼠体重的毫克唾液)。(C)用拭子法收集了11周老的雌性 C57BL/6 小鼠 (n=5) 的唾液。匹罗卡品使用的剂量为0.375 毫克/千克体重。用湿拭子称量, 测量毫克唾液的数量。然后用离心法回收拭子中的唾液, 测定唾液的体积。µL 唾液重与唾液体积之间有显著的一致性.请单击此处查看此图的较大版本.
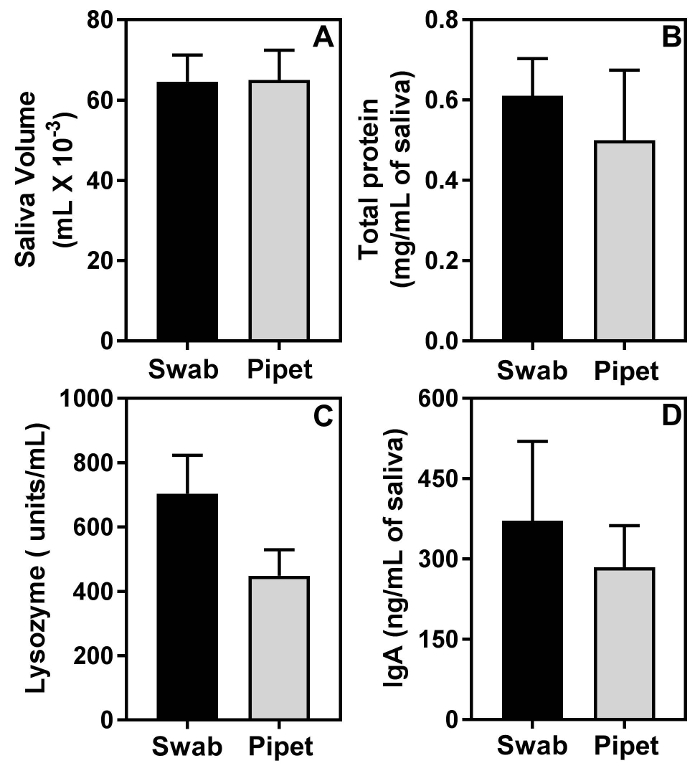
图 2: 拭子方法不影响唾液中生物分子的分析.2组11周老雌性 C57BL/6 小鼠 (每组 n=5 小鼠) 的唾液是用拭子法或 micropipet 法收集的。平均体积的唾液 (a), 平均数量的蛋白质 (B), 平均数量的溶菌酶活性 (C), 和平均数量的 IgA 之间的2组统计不显著。请单击此处查看此图的较大版本.

图 3: 唾液收集法检测不同品系的小鼠唾液分泌的差异.(a)用匹罗卡品0.375 毫克/千克体重收集雌性 (10-12 周) 小鼠的唾液15分钟。(B)小鼠组间的平均体重没有显著差异。克鲁斯卡尔-瓦利斯试验分析了统计意义, 其次是邓恩的多重比较试验。一个 p < 0.05 被认为是重要的。请单击此处查看此图的较大版本.

图 4: 拭子方法检测涎腺功能.(a) (B6 X/J) F1 雌性小鼠注射了两种 LPS 溶液 (0.1 毫克/毫升, 每只老鼠0.1 毫升, 腹腔) 或生理盐水, 唾液在26小时后被测量。有代表性的实验表明, 在小鼠的唾液生产中有明显的 (p = 0.0079) 下降 (60%) 的 LPS 治疗。(B)在干燥氏综合征的实验小鼠模型系统中测定涎腺功能。以前公布的被动转移模型的诱导腺功能障碍使用4 , 很少修改。用明矾佐剂注射雌性 C57BL/6 小鼠 (10-12 周)。在天14和20小鼠注射0.05 毫升兔 anti-Ro52 血清和唾液生产后, 测量 24 h. 注意在用明矾和 anti-Ro52 血清治疗的小鼠唾液中有显著的 (p = 0.0003) 滴 (50%)。克鲁斯卡尔-瓦利斯试验分析了统计意义, 其次是邓恩的多重比较试验。一个 p < 0.05 被认为是重要的。请单击此处查看此图的较大版本.
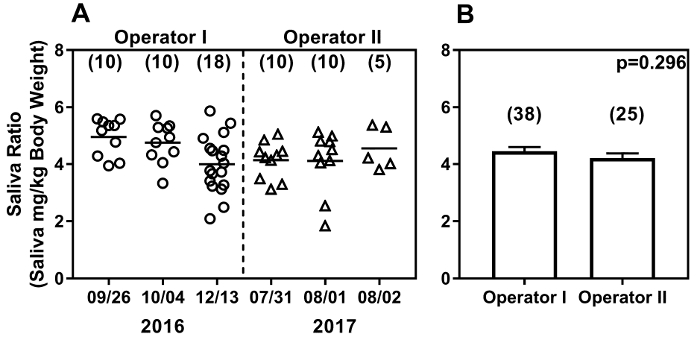
图 5: 拭子方法在时间 (a) 和运算符 (B) 之间生成可重现的结果.拭子法显示了两个不同长度的操作者在一年内进行实验时的比较结果。C57BL/6 雌性小鼠 (10-13 周龄) 的基线唾液产量由每位操作者测量。结果被表达为唾液重量 (毫克/克体重)。唾液收集的日期在 X 轴上, 并且随着时间的推移收集的数据的结果显示为(A).每个数据点代表一个鼠标, 每次分析的小鼠数量显示在括号中。基线唾液比 (平均 + SEM) 汇集从3实验显示(B), 并没有显着不同的运营商之间。请单击此处查看此图的较大版本.
讨论
唾液生产是一个复杂的过程, 受多种因素的影响。因此, 测定实验动物涎腺功能是一个挑战。另一项挑战是, 在同一动物中反复测量唾液腺功能, 以确定疾病的发病或在治疗后证明恢复。
本报告中描述的拭子方法在技术上是简单的, 可以使用多个选项来表示数据。所得到的结果是可重现的, 但很少有互操作性变化。该方法可检测不同模型涎腺功能障碍的唾液分泌减少。一个重要的优势是使用惰性, 高吸水性的聚合物和有效的唾液收集, 允许测量唾液腺生物分子。这种方法的另一个优点是, 可以同时在多达2只老鼠的情况下, 由一个单一的操作者同时执行这个过程。这比其他方法的效率要高得多, 它是一次在单个鼠标上执行的。
唾液生产测量的变异是所有唾液测量技术的祸根。为了使可变性最小化, 严格遵守协议是很重要的。关键步骤包括: 选择当天的同一时间禁食小鼠和收集唾液, 适当剂量的麻醉剂和匹罗卡品 (表 1), 和准确的重量记录干和湿拭子。需要仔细的时间管理, 以建立多达2只老鼠在一次唾液收集。
如图 3所示, 小鼠产生的唾液量是依赖于应变的。因此, 适当的应变, 年龄, 和性别匹配的小鼠应使用作为控制。对匹罗卡品的用量、特定菌株和试验条件的滴定进行了强烈的推荐。虽然超过0.5 毫克/千克的匹罗卡品会导致唾液的分泌增加, 但要评估腺功能, 建议使用较低剂量。这样就可以识别患病和控制小鼠之间唾液产生的细微差异。剂量为0.5 毫克/千克体重和0.375 毫克/千克体重已成功地用于证明涎腺功能。然而, 应当指出, 某些实验模型系统可能需要较本议定书所述的更短或更长的收集周期。这应该由每个实验室测试。
这种方法的局限性, 大多数唾液测量方法是需要麻醉。报告与真空方法不包括使用麻醉剂5。然而, 缺乏麻醉导致不同程度的焦虑的小鼠。他们往往挣扎和咬油管, 这反过来, 会影响唾液的产量和收集效率。异氟醚麻醉在大鼠体内诱导出一滴--匹罗卡品诱发唾液产量12。相比之下, 氯胺酮通过交感神经刺激增加了支气管和唾液分泌物13。我们和其他人成功地使用了氯胺酮和嗪合剂作为测定匹罗卡品诱发唾液的麻醉剂生产4,7,8,9。手术麻醉的推荐范围是100-200 毫克/千克的氯胺酮和5-16 毫克/千克的嗪14。这种方法所使用的 0.006-0. 008 毫升/克体重的剂量 (相当于60-80 毫克/千克的氯胺酮和6-8 毫克/千克的嗪) 落在建议范围的下端, 足以提供稳定的固定水平而不需要深麻醉.
用拭子法作为常规 micropipet 法的替代方法。吸管方法的主要缺点是高互操作性和需要一次收集唾液从一只老鼠。拭子方法解决了这两个问题。其好处包括限制在统计分析中获得权力所需的动物数量和提高效率。用惰性高分子拭子取代棉签提供了一个更好的选择, 因为棉签已知会影响生物活性分子的定量15。
由于拭子法的简单性和不同个体之间的高重复度, 希望拭子法能够更好地比较不同实验室和机构的研究人员之间的小鼠模型。
披露声明
作者没有利益冲突透露。
致谢
这项研究得到了国家卫生研究院、国家牙科和颅面研究研究所 (DE025030) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| Chemicals for saliva collection | |||
| Pilocarpine hydrochloride | Alfa Aesar, Tewksbury, MA, USA | B21410 | Dilute in sterile isotonic saline. Store single use aliquots of 100X stock at -80oC |
| Name | Company | Catalog Number | Comments |
| Anesthesia Mix solution | Mix 1 mL ketamine hydrochloride + 0.5 mL xylazine + 8.5 mL sterile isotonic saline in a sterile vial. Can be used for 3 months. | ||
| Zetamine (Ketamine hydrochloride) | Vet One, Boise, Idaho, USA | C3N VT1 | Stock is 100 mg/mL |
| Anased (Xylazine) | Med-Vet International, Mettawa, IL, USA | RXANASED-20 | Stock is 20 mg/mL |
| Isotonic sterile saline | Vet One, Boise, Idaho, USA | 501032 | Used as diluent |
| Artificial tears (lubricant ophthalmic ointment) | Henry Schien, Dublin, OH, USA | 48272 | Used to prevent eyes from drying during the procedure |
| Name | Company | Catalog Number | Comments |
| Materials for saliva collection | |||
| SalivaBio Children's swab | Salimetrics, LLC Carlsbad, CA, USA | N/A | Individually wrapped swabs |
| 50 mL polypropylene tubes | VWR, Radnor, PA, USA | 89004-364 | Cut off the bottom 1 cm of the tube. Make sure that the cut edge is smooth. |
| Microcentrifuge tubes 0.6 mL | VWR, Radnor, PA, USA | 87003-290 | Make holes in the bottom of tube with heated 18 gauge needles |
| Microcentrifuge tubes 2 mL | VWR, Radnor, PA, USA | 87003-298 | |
| Insulin Syringes with permanently attached needles | Becton Dickinson and Company, Franklin Lakes, NJ, USA | 324702 | |
| 18 gauge regular bevel needles | Becton Dickinson and Company, Franklin Lakes, NJ, USA | 305195 | |
| Sterile scalpel blade #11 | Integra York Inc PA, USA | 4-311 | |
| Microdissecting forceps | Roboz, Gaithersburg, MD, USA | RS-5139 | Serrated angular 0.8 mm tip, 4" length |
| Label tape | Santa Cruz Biotechnology, Dallas, TX, USA | sc-224487 | |
| 3 channel timer | Amazon.com, Seattle, WA, USA | B06W2KCYVN | |
| Analytical Balance | Mettler Toledo, Columbus OH, USA | ||
| Name | Company | Catalog Number | Comments |
| Chemicals/ reagents for inducing salivary dysfunction | |||
| LPS | Invivogen, San Deigo, CA, USA | tlrl-b5lps | Dissolve in endotoxin free water, and store stock solution at 5 mg/mL . dilute in sterile HBSS 100 ug/mL - inject 100 uL/ moue ip |
| Imject Alum adjuvant | Thermo Scientific | 77161 | Dilute 1:1 in sterile saline. Inject intraperitoneally 0.1 mL/mouse |
| Rabbit anti-Ro52 antiserum | Generated in lab | Immunization of rabbits with recombinant mouse Ro52 | |
| Name | Company | Catalog Number | Comments |
| Chemicals/ Kits for saliva analyses | |||
| Salivary lysozyme estimation | |||
| EnzChek Lysozyme Assay Kit | Molecular Probes, Eugene, OR, USA | E-22013 | Used as per manufacturer's instructions |
| Name | Company | Catalog Number | Comments |
| Salivary IgA estimation by sandwich ELISA | |||
| Mouse IgA | Southern Biotech, Birmingham, AL, USA | 0106-01 | Standards for sandwich ELISA - range 30 ng/mL to 0.5 ng/mL |
| Goat anti- mouse IgA unlabeled | Southern Biotech, Birmingham, AL, USA | 1040-01 | Coat at 1 ug/mL in bicarbonate buffer |
| Goat anti- mouse IgA HRP | Southern Biotech, Birmingham, AL, USA | 1040-05 | Detection antibody used at 1:4000 dilution |
| TMB substrate | Becton Dickinson and Company, Franklin Lakes, NJ, USA | 555214 | Used as per manufacturer's instructions |
| Immulon 4HBX Microtiter 96 well plates | Thermo Scientific, Rochester, NY, USA | 3855 | |
| Name | Company | Catalog Number | Comments |
| Salivary protein estimation | |||
| Bio-Rad Protein Assay Dye Reagent Concentrate | BioRad, Hercules, CA, USA | 5000006 | For protein estimation as per manufacturer's instructions |
参考文献
- Proctor, G. B. The physiology of salivary secretion. Periodontol 2000. 70 (1), 11-25 (2016).
- Fox, R. I. Sjögren's syndrome. Lancet. 366 (9482), 321-331 (2005).
- Eisbruch, A., Kim, H. M., Terrell, J. E., Marsh, L. H., Dawson, L. A., Ship, J. A. Xerostomia and its predictors following parotid-sparing irradiation of head-and-neck cancer. Int J Radiat Oncol Biol Phys. 50 (3), 695-704 (2001).
- Marmary, Y., Fox, P. C., Baum, B. J. Fluid secretion rates from mouse and rat parotid glands are markedly different following pilocarpine stimulation. Comp Biochem Physiol A Comp Physiol. 88 (2), 307-310 (1987).
- Lin, A. L., Johnson, D. A., Wu, Y., Wong, G., Ebersole, J. L., Yeh, C. K. Measuring short-term gamma-irradiation effects on mouse salivary gland function using a new saliva collection device. Arch Oral Biol. 46 (11), 1085-1089 (2001).
- Scofield, R. H., Asfa, S., Obeso, D., Jonsson, R., Kurien, B. T. Immunization with short peptides from the 60-kDa Ro antigen recapitulates the serological and pathological findings as well as the salivary gland dysfunction of Sjogren's syndrome. J Immunol. 175 (12), 8409-8414 (2005).
- Deshmukh, U. S., Nandula, S. R., Thimmalapura, P. R., Scindia, Y. M., Bagavant, H. Activation of innate immune responses through Toll-like receptor 3 causes a rapid loss of salivary gland function. J Oral Pathol Med. 38 (1), 42-47 (2009).
- Deshmukh, U. S., Ohyama, Y., Bagavant, H., Guo, X., Gaskin, F., Fu, S. M. Inflammatory stimuli accelerate Sjögren's syndrome-like disease in (NZB x NZW)F1 mice. Arthritis Rheum. 58 (5), 1318-1323 (2008).
- Szczerba, B. M., et al. Interaction between innate immunity and Ro52-induced antibody causes Sjögren's syndrome-like disorder in mice. Ann Rheum Dis. 75 (3), 617-622 (2016).
- Takakura, A., Moreira, T., Laitano, S., De Luca Júnior, L., Renzi, A., Menani, J. Central muscarinic receptors signal pilocarpine-induced salivation. J Dent Res. 82 (12), 993-997 (2003).
- Yao, C., et al. Lipopolysaccharide-induced elevation and secretion of interleukin-1beta in the submandibular gland of male mice. Immunology. 116 (2), 213-222 (2005).
- Knudsen, J., Nauntofte, B., Josipovic, M., Engelholm, S. A., Hyldegaard, O. Effects of isoflurane anesthesia and pilocarpine on rat parotid saliva flow. Radiat Res. 176 (1), 84-88 (2011).
- Kohrs, R., Durieux, M. E. Ketamine: teaching an old drug new tricks. Anesth Analg. 87 (5), 1186-1193 (1998).
- Cold Spring Harbor Protocols. Cold Spring Harb Protoc. , Available from: http://cshprotocols.cshlp.org/ (2006).
- Kozaki, T., Hashiguchi, N., Kaji, Y., Yasukouchi, A., Tochihara, Y. Effects of saliva collection using cotton swab on cortisol enzyme immunoassay. Eur J Appl Physiol. 107 (6), 743-746 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。