Method Article
Extraction et caractérisation des tensio-actifs de l'atmosphère Aérosols
Dans cet article
Résumé
Des procédés sont présentés pour l'extraction ciblée d'agents tensioactifs présents dans les aérosols atmosphériques et la détermination de leurs concentrations absolues et les courbes de tension superficielle dans l'eau, y compris leur concentration micellaire critique (CMC).
Résumé
des composés tensio-actifs, ou des agents tensio-actifs, présents dans les aérosols atmosphériques sont censés jouer un rôle important dans la formation de nuages d'eau liquide dans l'atmosphère de la Terre, un processus central dans la météorologie, l'hydrologie, et pour le système de climatisation. Mais parce que l'extraction spécifique et la caractérisation de ces composés ont fait défaut depuis des décennies, on sait très peu sur leur identité, les propriétés, le mode d'action et de ses origines, empêchant ainsi la pleine compréhension de la formation des nuages et ses liens potentiels avec les écosystèmes de la Terre.
Dans cet article, nous présentons récemment des procédés mis au point pour 1) l'extraction ciblée de tous les agents tensio-actifs à partir d'échantillons d'aérosols atmosphériques et pour la détermination de 2) leurs concentrations absolues dans la phase d'aérosol et 3) leurs courbes de tension superficielle statique dans l'eau, y compris leur Critical Concentration micellaire (CMC). Ces méthodes ont été validées avec des tensioactifs 9 références, including anionique, cationique et les non-ioniques. Des exemples de résultats sont présentés pour des agents tensioactifs présents dans les fines particules d'aérosol (diamètre <1 um) collectées sur un site côtier en Croatie et suggestions pour des améliorations futures et d'autres caractérisations que celles présentées sont discutées.
Introduction
Les nuages sont essentiels dans l'atmosphère de la Terre, pour l'hydrologie de la plupart des environnements et des écosystèmes, et pour le système climatique. Toutefois, certains aspects de leurs mécanismes de formation ne sont pas encore compris, en particulier, les contributions des composés chimiques présents dans les particules d'aérosol qui agissent comme des noyaux de condensation. Théorie 1 prévoit que les composés tensio-actifs, ou des agents tensioactifs, présents dans les particules d'aérosol devraient fortement améliorer la formation de gouttelettes de nuages en abaissant leur tension superficielle, ainsi leur énergie de formation. Mais ces effets sont restés hors de portée à l'observation depuis des décennies et le rôle des agents tensio-actifs sur la formation des nuages est actuellement refusée par une grande partie de la communauté atmosphérique et ignoré dans toutes les enquêtes des nuages et des modèles atmosphériques et climatiques.
L'une des raisons du manque de compréhension du rôle des agents tensio-actifs d'aérosols dans la formation des nuages a été l'absence de méthode ISOtard et les caractériser. A la différence des échantillons provenant d' autres environnements, l'analyse des échantillons atmosphériques face à des défis récurrents 2 tels que le volume d'échantillon très faible et de masse (ici, typiquement entre 10 et 100 pg) et de la complexité chimique (mélanges de sels, de minéraux, ainsi que de nombreux composés organiques). Pour surmonter ces difficultés et d'améliorer la compréhension de l'aérosol tensioactifs certains procédés ont été récemment mis au point par notre groupe à 1) extraire spécifiquement ces composés à partir d'échantillons d'aérosols atmosphériques, 2) déterminer leurs concentrations absolues dans la phase d'aérosol et 3) déterminer leurs courbes de tension de surface dans de l'eau, y compris leur concentration micellaire critique (CMC), la concentration à laquelle les agents tensio-actifs sont saturés à la surface et commencent à former des micelles dans la masse. Les dernières versions de ces méthodes sont présentées dans le présent document.
D'autres améliorations et d'autres types de caractérisations, qui pourraient être utilisés en compà ceux qui sont présentés lement, sera discuté. Les applications récentes de ces méthodes ont déjà montré comment ces analyses peuvent améliorer la compréhension du rôle des agents tensio - actifs dans la formation des nuages, mettant en évidence ce rôle lui - même, 3 déterminer les concentrations d' agents tensioactifs dans les aérosols atmosphériques 3, 4, 5, 6 et mode d'action formation de gouttelettes de nuages, 3, 6 indiquant leur origine biogène, 3, 4, 7 et d' expliquer leur manque d'observation par des instruments classiques. 8, 9, 10
Protocole
1. Préparer le matériel pour le Protocole comme indiqué dans le tableau 1
| Matériel | Préparation / lavage |
| Consommables (seringues en plastique, des aiguilles, des flacons de 4 ml, pipettes Pasteur, Conseils d'micropipette) | A utiliser directement, sans traitement préalable et mis au rebut après utilisation. |
| La verrerie (des béchers (pour l' eau ultrapure), 15, 30, et des bouteilles de 60 ml avec des bouchons de liège, des tubes d'extraction en phase solide (SPE) et des barres d'agitation magnétiques) | Laver avec de l'éthanol (uniquement pour les flacons utilisés pour la méthode colorimétrique). |
| séquentiellement rinçage à l'eau du robinet, l'éthanol, l'eau du robinet et de l'eau ultrapure. | |
| Remplir les flacons de verre et bécher contenant les bouchons, Agitateurs magnétiques, et SPE tubes avec de l'eau ultra pure et placez-les dans un bain à ultrasons pendant 15 min. | |
| Retirer l'eau et rincer à l'eau ultra pure. | |
| Sécher la verrerie dans l'air à la température ambiante. | |
| Une fois séché, fermez toutes les bouteilles et les stocker sous couvert pour éviter la collecte de la poussière. | |
| Pour éviter toute contamination, utiliser la verrerie distincte pour l'extraction de l'eau et la colorimétrie. | |
| Pinces et ciseaux | Laver avec de l'éthanol puis de l'eau ultra-pure. |
| Sécher avec de l'air comprimé. | |
| Des boîtes de Petri en verre et couvercles | Laver à l'eau du robinet et une brosse, puis avec de l'éthanol. |
| Rincer à l'eau du robinet puis de l'eau ultra pure. | |
| Sécher à l'air à la température ambiante. | |
| Une fois séché, fermer les boîtes et Storles e sous couvert pour éviter la collecte de la poussière. | |
| Collecteur de vide SPE | Laver avec de l'éthanol puis de l'eau ultra-pure. |
| Sécher avec de l'air comprimé. | |
| Cuvette de quartz (par analyse UV-Vis) | Laver avec de l'éthanol et rincer à l'eau du robinet puis de l'eau ultra pure. |
| Sécher avec de l'air comprimé. |
Tableau 1: Liste des matériaux et objets en verre utilisé pour le protocole, y compris leur préparation et leur lavage.
2. Manipulation des échantillons d'aérosols
REMARQUE: La méthode d'extraction présentée ici a été mis au point pour des échantillons d'aérosols atmosphériques recueillies sur des filtres en fibres de quartz, d'un poids total d'au moins 8 ug. La méthode de prélèvement d'échantillons d'aérosols sur les filtres dans l'atmosphère ne sera pas expliqué ici, mais de nombreuxles descriptions se trouvent dans la littérature, tels que les références 2, 3, 4, 5, 6 Seules les étapes suivantes sont soulignées.
- Nombre de chaque filtre individuel.
REMARQUE: tout au long du protocole, les filtres doivent être manipulés avec des pincettes propres et maintenues par leur bord. - Condition préalable des filtres et des feuilles d'aluminium ou des boîtes de Petri en verre avant l'échantillonnage en les cuisant à 773 K pendant 6 h.
- Pré-pesée, dans des conditions de température et d'humidité contrôlées, les filtres à l'aide d'une microbalance ayant une précision d'au moins 1 ug, pour déterminer le poids de pré-échantillonnage.
- Prélever des échantillons en blanc régulièrement au début, pendant et à la fin de la période d'échantillonnage, en plaçant un filtre sur le porte-filtre de l'échantillonneur mais en gardant la pompe pour la même durée que pour la collecte d'échantillon réel ( p. si le prélèvement d'échantillons dure 24 h, le filtre blanc doit être laissé dans l'échantillonneur, avec la pompe, pendant 24 h). Analyser ces blancs avec le même protocole que pour les échantillons réels.
- Dès que possible après le prélèvement, l'emballage des filtres dans des récipients (feuilles d'aluminium soutenus ou des boîtes de Pétri de verre) et les stocker dans un congélateur à -18 ° C (255 K) jusqu'à l'analyse.
- Laissez les filtres à équilibrer dans un dessicateur pendant 24 h avant la pesée. Déterminer chaque volume d'échantillon (masse d'aérosol collectées sur des filtres) par pesée après échantillonnage (et soustraire le poids de pré-échantillonnage) sous la même température contrôlée et à l'humidité relative pendant la pré-pesée.
3. Extraction des tensio-actifs à partir d'échantillons d'aérosols
- Extraction de l' eau
- Immerger les échantillons de filtre dans de l'eau ultrapure pendant 2 heures à 279 ± 1 K dans des boîtes de Petri en verre, fermer le couvercle et secouer les boîtes de Petri tout en les maintenant à plat, sur l'etrès 30 min.
REMARQUE: les filtres de 47 mm sont immergés dans 7 ml et les 150 mm dans 35 ml. Avec 120 mm de verre boîtes de Petri, les filtres 150 mm doivent être coupés en quatre morceaux avec des ciseaux propres avant d'être placé dans le plat. - Nettoyer un filtre de seringue (0,40 um PVDF) avec 3 x 1 ml d'eau ultrapure.
- Filtrer la solution obtenue à l'étape 3.1.1 avec le filtre de seringue propre et le placer dans une bouteille en verre pré-pondérés 60 mL. Rincer la boîte de Pétri avec 5 ml d'eau ultrapure, filtrer l'eau avec le filtre de la seringue et l'ajouter à la solution dans le flacon de verre 60 ml. Puis pondérer la bouteille en verre de 60 ml contenant la solution pour déterminer le volume d'eau filtrée et la concentration en agent tensioactif dans l'étape 4.4.5.
- Immerger les échantillons de filtre dans de l'eau ultrapure pendant 2 heures à 279 ± 1 K dans des boîtes de Petri en verre, fermer le couvercle et secouer les boîtes de Petri tout en les maintenant à plat, sur l'etrès 30 min.
- SPE extraction (extraction en phase solide)
- Attacher les cartouches de C18 à base de silice SPE (voir Liste des matériaux pour des détails sur les cartouches) sur le collecteur de vide SPE, qui lui - même est reliéà une pompe.
- Laver les cartouches en faisant circuler de 6 ml d'acétonitrile à un débit de 1 mL / min et en appliquant un vide à la pompe. Répéter l'opération avec 6 ml d'eau ultra-pure. Arrêter la pompe pour maintenir le niveau d'eau assez élevé et de garder la cartouche humide.
- L'écoulement de l'échantillon obtenu à l'étape 3.1.3 à travers la cartouche SPE à raison de moins de 1 mL / min.
- Débit 1 ml d'eau ultra pure que la cartouche de nettoyage et de sécher la cartouche en appliquant un vide plus fort sur l'entité ad hoc mis en place.
- Eluer la fraction d'agent tensio-actif absorbé sur la colonne par écoulement de 4 ml d'acétonitrile à travers elle à une vitesse d'écoulement inférieure à 1 mL / min.
- On évapore la solution d'acétonitrile obtenue avec un flux de N 2 pour obtenir un extrait sec de tensioactif et re-dissoudre l'extrait sec dans 60 ul d'eau ultrapure.
NOTE: Les extraits de 60 pi obtenus à partir de cette méthode peut alors être utilisé comme solution mère pour diverses caractérisations des agents tensio-actifs.
- On évapore la solution d'acétonitrile obtenue avec un flux de N 2 pour obtenir un extrait sec de tensioactif et re-dissoudre l'extrait sec dans 60 ul d'eau ultrapure.
- Détermination de l'efficacité d'extraction
NOTE: L'efficacité du procédé d'extraction pour les différents types d'agents tensio-actifs doivent être déterminés pour la détermination de leurs concentrations absolues dans la section 4. Pour cela, le protocole suivant doit être appliquée pour faire référence à des tensioactifs tels que, par exemple, du dodécyl sulfate de sodium (SDS), le dioctyl sodium sulfosuccinate (AOT), benzyltetradecyl diméthylammonium (zephiramine), le chlorure de cétyltriméthylammonium (CTAC), (1,1,3,3-tétraméthylbutyl) phényl-glycol polyethylene (voir Matériaux List), le polyéthylène glycol, l'éther de dodécyle ( voir Matériels Liste), surfactine, rhamnolipide ou L-α-phosphatidylcholine.- Doper les solutions aqueuses standard de référence (10 -9 à 10 -4 mole de tensio - actifs dans de 1 ml d' eau ultrapure) sur des filtres à quartz propre (grammage 0,85 gm -2) avec une micropipette. En parallèle, ajouter la même quantité de ces solutions directly dans des flacons comme des « solutions initiales ».
- Sécher les filtres (placées dans des boîtes de Petri) dans un dessiccateur pendant 24 h et on extrait les filtres avec des agents tensioactifs selon le protocole dans la section 3.1 à 3.2.
- Mesurer la concentration des composés de référence dans la première (solutions de référence dans des flacons de l'étape 3.3.1) et les solutions extraites (étape 3.3.2) avec les procédés décrits dans la section 4. Les rendements d'extraction sont déterminées par le rapport de thèses concentrations.
NOTE: En règle générale, dans ce travail, pour SDS et AOT (Les agents tensio-actifs anioniques), cette efficacité a été jugée 65 ± 10%, pour zephiramine et CTAC (Les tensioactifs cationiques), il était de 20 ± 5%, et pour (1,1 , 3,3-tétraméthylbutyl) glycol phényl-polyéthylène (voir Matériaux List), le polyéthylène éther dodécylique de glycol (voir Matériaux List), surfactine, rhamnolipide, et la L-α-phosphatidylcholine (tensioactifs non ioniques), il était de 90 ± 10%.
- Extractisur la fraction de tensioactif total dans des échantillons
NOTE: Pour vérifier que la méthode d'extraction proposée supprime tous les agents tensio - actifs présents dans les échantillons analysés ( par exemple tous les composés abaissant leur tension de surface), le test suivant peut être réalisé.- Mesurer la tension de surface (voir la section 5) d'une solution connue de composé de référence (ou d'un extrait de l'échantillon) après la première extraction (étape 3.1.3). Il devrait être d' environ 50 mN m -1.
- Mesure de la tension superficielle de la solution à gauche après les deuxièmes étapes d'extraction, soit recueilli après passage à travers la colonne SPE dans l' étape 3.2.3. Cette valeur doit être proche de 72,8 ± 1 mN m -1, celle de l' eau pure, indiquant que la plupart ou tous les composés tensio-actifs présents dans les échantillons ont été enlevés par extraction.
4. Détermination des concentrations en aérosol tensioactives phase
REMARQUE:Une technique colorimétrique a été choisi pour la détermination des concentrations de tensioactifs en phase d'aérosol, qui fournit des concentrations absolues et présente une sensibilité suffisante pour tensio-actifs dans des échantillons environnementaux. 11, 12, 13, 14 mais il nécessite de mesurer séparément les concentrations de tensioactifs anioniques, cationiques et des tensioactifs non ioniques à cause des réactifs différents doivent être utilisés pour chaque type d'agent tensio - actif. Toutes les solutions pour le protocole suivant doivent être préparés avec micropipettes de précision et de toutes les réactions doivent être effectuées dans des flacons en verre.
- Titrage colorimétrique de tensio - actifs anioniques
- Préparer une solution de tampon acétate dans l'eau à pH = 5 (solution d'acétate de sodium 0,2 M / solution d'acide acétique 0,2 M, 70/30 en volume) avec un volume d'au moins n 200 uL, où n est le nombre d'échantillons à analysé.
- Préparer une solution d'EDTA 0,1 M avec un volume d'au moins 100 uL nx, où n est le nombre d'échantillons à analyser.
- Préparer une solution de sulfate de sodium à 1 M dans de l'eau avec un volume d'au moins 500 uL nx, où n est le nombre d'échantillons à analyser.
- Préparer une solution de violet d'éthyle (C 31 H 42 N 3) 11, 15, 16, 17 0,49 g L -1 dans l' eau avec un volume d'au moins 200 uL nx, où n est le nombre d'échantillons à analyser.
- Si à partir des extraits d'échantillons de 60 pi obtenus dans la section 3, les diluer à 10 ml avec de l'eau ultra pure en utilisant micropipettes dans une bouteille en verre de 60 ml avec un couvercle. Dans le cas contraire, prendre 10 ml d'échantillon et ajouter 200 ul de solution tampon d'acétate, 100 ul de la solution d'EDTA, 500 ul de la solution de sulfate de sodium et 200 ul de l'éthyleune solution de violet à l'aide de micropipettes.
- Ajouter 2,5 ml de toluène à la solution avec une micropipette, une barre d'agitation magnétique, et on agite pendant 1 heure à 500 tours par minute.
- Laisser les phases aqueuse et organique pour définir pendant environ 10 min. Une fois qu'ils sont séparés, éliminer la phase de toluène (phase supérieure) avec une pipette Pasteur en verre pour effectuer l'analyse UV-vis (voir la section 4.4).
- Titrage colorimétrique des agents tensio - actifs cationiques
- Préparer une solution de tampon acétate dans l'eau à pH = 5 (solution d'acétate de sodium 0,2 M / solution d'acide acétique 0,2 M, 70/30 en volume) avec un volume d'au moins nx 1 mL, où n est le nombre d'échantillons à analysé.
- Préparer une solution de bleu disulfine (C 27 H 32 N 2 O 6 S 2) 11, 18 à 2,58 g L - 1 dans un mélange eau 90:10 / éthanol (diluant le colorant d' abord avec le volume d'eau, puis en ajoutant le volume de l'éthanol), avec un volume d'au moins 500 uL nx, où n est le nombre d'échantillons à analyser.
- Placer 10 ml d'échantillon dans un flacon en verre de 30 ml avec un couvercle et ajouter 1 mL de la solution tampon d'acétate et 500 ul de la solution de bleu disulfine en utilisant des micropipettes.
- Ajouter 2,5 ml de chloroforme avec une micropipette, une barre d'agitation magnétique, et on agite pendant 1 heure à 500 tours par minute.
- Après avoir laissé les phases aqueuse et organique se séparer pendant environ 10 minutes, éliminer le chloroforme (phase inférieure) avec une seringue pour effectuer l'analyse UV-Vis (voir la section 4.4).
- Titrage colorimétrique d'agents tensioactifs non ioniques
NOTE: Pour le titrage de tensio - actifs non-ioniques, il n'a pas été possible d'identifier un colorant réagissant avec les agents tensio - actifs non-ioniques, mais le thiocyanate de cobalt (Co (NCS) 2) a été choisi car il réagit avec une large gamme de composés. 12, 19- Préparer unsolution de thiocyanate de cobalt en mélangeant nx 6,2 g de thiocyanate d'ammonium et 2,8 g nx hexahydrate de nitrate de cobalt dans 10 ml d'eau nx, où n est le nombre d'échantillons à analyser.
- Placer 3 ml d'échantillon dans un flacon en verre de 15 ml avec un couvercle et ajouter 1 mL de la solution de thiocyanate de cobalt avec une micropipette.
- Ajouter 2 mL de chloroforme avec une micropipette, une barre d'agitation magnétique, et on agite pendant 1 heure à 500 tours par minute
- Après avoir laissé les phases aqueuse et organique se séparer pendant environ 10 minutes, éliminer le chloroforme (phase inférieure), en utilisant une seringue pour effectuer l'analyse d'absorption UV-Vis (voir la section 4.4).
- L' étalonnage des courbes et quantification par UV-Vis spectroscopie
- Établir une courbe d'étalonnage (absorbance vs courbes de concentration) pour les agents tensioactifs anioniques, en mesurant l'absorbance à 612 nm d'une série de solutions connues d'un composé de référence, tels que le SDS ou AOT.
Remarque: En général 12 solutions avec des concentrationsentre 0 et 5 uM (et y compris quelques répétitions) doit être utilisé pour établir la courbe.
Une courbe d'étalonnage unique doit être obtenu avec les deux composés anioniques (SDS et AOT) avec une pente de ε = 0,37 ± 0,02 uM cm -1 et une limite de détection de 0,054 uM, pour tous les agents tensio - actifs anioniques. - Établir une courbe d'étalonnage pour des tensioactifs cationiques par une approche similaire, mais mesurant l'absorbance à 628 nm et en utilisant des composés de référence tels que Zephiramine ou CTAC.
REMARQUE: la pente doit être e = 0,35 ± 0,05 uM cm -1 et la limite de détection 0,059 uM, pour tous les agents tensio - actifs cationiques. - Établir une courbe d'étalonnage pour des agents tensioactifs non ioniques par une approche similaire, mais pour une gamme de concentration de 0 à 20 um, en mesurant l'absorbance à 317 nm, et en utilisant de l'éther dodécylique de polyéthylène glycol (voir Matériaux List) comme composé de référence.
- Pour déterminer les concentrations d'agent tensio-actif de colorantcomplexe dans les solutions organiques obtenues dans la section 4.1, 4.2 et 4.3, le lieu ~ 1,5 à 2 ml de ces solutions dans une cellule de 1 cm de quartz et de mesurer son absorbance à 612, 628 et 317 nm, respectivement, avec un spectrophotomètre UV-Vis. Avant chaque mesure de la solution, de prendre une ébauche du solvant organique (toluène par méthode de tensioactif anionique et de chloroforme pour des procédés de tensioactifs cationiques et non ioniques)
NOTE: Contrairement aux agents tensio-actifs anioniques et cationiques, en utilisant du thiocyanate de cobalt en tant que colorant donne différentes courbes d'étalonnage avec différents agents tensio-actifs non ioniques. En utilisant l' éther dodécylique de polyéthylène glycol, comme le suggère ici, sous - estime les concentrations de la plupart des agents tensio - actifs non ioniques, assurant ainsi que les erreurs sur les mesures sont toujours du même signe, par exemple sous - estimer les concentrations réelles. La pente en utilisant l' éther dodécylique de polyethylene glycol comme référence devrait donner une pente de ε = 0,013 ± 0,001 uM -1 et une limite de détection de 0,3 uM.
NOTE: Sur la base de la différence de calibration pentes de obtenue avec différents agents tensio - actifs non-ioniques et le fait que certains agents tensio - actifs peuvent ne pas être détectés du tout par le thiocyanate de cobalt , nous avons estimé 6 la sous - estimation systématique de la concentration en agent tensio - actif non ionique avec cette méthode à environ un facteur 2, qui est la principale source d'incertitudes dans les concentrations totales d'agents tensioactifs. - Déterminer la concentration totale en agent tensioactif dans chaque échantillon comme étant la somme des concentrations des tensioactifs anioniques, cationiques, et les tensioactifs non-ioniques mesurées séparément 6 et après avoir corrigé chaque concentration par l'efficacité du volume extrait de l' étape 3.1.3 et par l'efficacité de l' extraction respective déterminée l'étape 3.3.
NOTE: Les incertitudes globales de ces concentrations totales est estimée à 33%, principalement en raison des incertitudes sur les concentrations de tensio-actifs non ioniques. - Déterminer les concen tensioactifs moyennetrations dans l'échantillon d'aérosol en multipliant la concentration obtenue pour l'extrait par le rapport entre le volume d'échantillon d'aérosol au volume d'extrait (60 ul).
- Établir une courbe d'étalonnage (absorbance vs courbes de concentration) pour les agents tensioactifs anioniques, en mesurant l'absorbance à 612 nm d'une série de solutions connues d'un composé de référence, tels que le SDS ou AOT.
5. Détermination des courbes de tension superficielle absolue Surfactant dans l'eau
- Les mesures de la tension superficielle par goutte suspendue tensiométrie
NOTE: Pour les échantillons d'aérosols, les mesures de tension de surface sont mieux réalisés avec la méthode des gouttelettes de suspension, car cela est la méthode nécessitant le plus petit volume d'échantillon (pour plus de détails sur le tensiomètre, voir Liste des matériaux). Bien que de telles mesures sont effectuées sur des gouttelettes d'un diamètre compris entre 1,4 et 2,4 mm, des expériences ont montré que la tension de surface mesurée est identique à celle des gouttelettes de la taille du micron contenant la même concentration d'agent tensio-actif. 10, 20 Tout au long des mesures, la température doit être constante pour au moins0, ± 3 K, et le volume des gouttelettes doit être surveillée en continu pour écarter l'effet d'évaporation. Chaque gouttelette doit être laissé à l'équilibre (la valeur de tension de surface ne varie pas de plus) avant d'effectuer une mesure et chaque mesure doit être répétée 3 à 5 fois.- Démarrez la caméra et le logiciel tensiomètres (voir Matériaux Liste des références). Calibrer le tensiomètre en mesurant la tension superficielle de gouttelettes d'eau ultrapure, en suivant le protocole ci-dessous dans les étapes 5.1.2-5.1.5.
- Remplir une seringue de 1 ml avec une aiguille Ø 0,30 mm aiguille (par σ <45 mN m -1) ou un Ø 0,51 mm (pour σ> 45 mN m -1) avec la solution d'agent tensio - actif obtenu à l' étape 3.2.6 et placez - le sur le tensiomètre, en veillant à ce que la pointe de l'aiguille se trouve dans le champ de la caméra.
- Produire une gouttelette d'un diamètre compris entre 1 et 3 mm à la pointe de l'aiguille en appuyant sur le piston.
- Prenez une photo ou une vidéo de la goutte avant qu'il ne tombe avec elogiciel e.
- Exécuter la fonction d'analyse du logiciel en fonction de la forme de gouttelettes à l'équation de Young-Laplace et obtenir une valeur de tension de surface. A noté ci-dessus, cette opération doit être répétée plusieurs fois pour la même goutte jusqu'à ce que la tension superficielle ne varie pas plus, pour faire en sorte que les agents tensio-actifs ont atteint l'équilibre dans la goutte.
NOTE: les incertitudes globales sur ces mesures de tension de surface sont généralement de ± (0,3-1,0) mN m -1.
- Courbes complètes de tension de surface et CMC
- Mesurer la tension superficielle de l'extrait initial, obtenu à l'étape 3.2.6, suivant le protocole 5.1.
- Mesurer la concentration totale en agent tensioactif dans le même extrait, en suivant les protocoles de la section 4. Cette tension de concentration et la surface de cet extrait servira de point de départ de la courbe.
- Pour tracer le reste de la courbe, diluer l'extrait d'un facteur 2 par adding eau ultra-pure avec une micropipette. Mesurer la tension superficielle de la solution diluée.
- Répétez l' étape 5.2.2 jusqu'à ce que la solution a atteint (ou près de) la tension superficielle de l' eau pure (72,8 ± 1 mN m -1). Les valeurs de tension superficielle et les facteurs de dilution pour chacune de ces solutions diluées fourniront les points définissant la courbe de la tension superficielle.
- Déterminer la concentration moyenne de l'agent tensioactif dans l'échantillon d'aérosol initial en multipliant la concentration de l'extrait par le rapport de l'extrait au volume de l'échantillon.
REMARQUE: le volume d'échantillon d'aérosol est généralement inférieure à celle de l'extrait de 60 ul, la concentration en agent tensio-actif d'aérosol est habituellement plus grande que la concentration de l'extrait, ainsi le point le plus éloigné sur l'axe des x de la courbe. - Tracer la courbe de tension de surface (Figure 2). Pour cela, placer le premier point correspondant aux conditions de l'aérosol (axe x = des concentrations d tensioactifsdans l'échantillon d'aérosol déterminé à l'étape 5.2.5; l'axe y = tension superficielle minimale mesurée dans la solution d'extrait de 60 ul à l'étape 5.2.1). Ensuite, placer le second point correspondant à l'extrait de 60 ul de l'étape 5.2.1 (axe x = concentration de l'agent tensio-actif dans l'extrait de 60 ul; axe y = tension superficielle minimale mesurée dans la solution d'extrait de 60 ul). Ensuite, placer le troisième point correspondant à l'extrait d'aérosol dilué de l'étape 5.2.2 (axe x = concentration agent tensio-actif dans la solution d'extrait dilué 120 ul = concentration dans la solution d'extrait de 60 ul divisé par un facteur de 2; axe y: surface minimum la tension mesurée de la solution d'extrait de 120 ul), et ainsi de suite jusqu'à la dernière tension de surface mesurée (étape 5.2.3)
- Une fois la courbe de la tension superficielle établie, à déterminer la CMC graphiquement en déterminant l'intersection entre la pente forte et le niveau de tension de surface minimale (voir figure 2).
NOTE: Seulement si ela concentration en tensioactif e dans l'extrait est nettement au-dessus de la CMC (au-dessus de la transition abrupte de la courbe), la valeur de la CMC et de la tension superficielle minimale peut être déterminée avec précision. Mais si cette concentration est inférieure à la CMC, la valeur exacte de la CMC ne peut pas être déterminée et la tension superficielle de l'extrait ne donnera une limite supérieure de celle de l'échantillon.
Résultats
Remarque: Avant d'être appliqué à des échantillons atmosphériques, tous les protocoles présentés dans cette section ont été testés avec 9 agents tensio-actifs de référence et les courbes de tension de surface, les tensions de surface minimum et cmc obtenus sont en excellent accord avec la littérature. 21, 22
1. Les concentrations
aérosols de fines (<1 um de diamètre, ou « PM1 ») des échantillons ont été prélevés sur des filtres en fibre de quartz sur le site côtier de Rogoznica, Croatie en Février 2015. Ces échantillons ont été traités et extraits comme décrit dans les sections 2 et 3, respectivement, ce manuscrit. Les concentrations des tensioactifs anioniques, cationiques et non ioniques et la concentration totale en tensio - actif dans le volume d'échantillon d'aérosol, surf C, p (M), ont été mesurées selon la section 4. Til résultats sont présentés sur la figure 1, et la prédominance des preuves de tensioactifs anioniques et non ioniques parmi les agents tensio - actifs mesurés.
2. La tension de surface de la courbe de tension échantillon et surface pour Extracted Surfactants
La combinaison de mesures de tension de surface , comme décrit dans la section 5, et les mesures de concentration, a donné lieu à des courbes de tension de surface absolue pour les mêmes échantillons, comme représenté sur la figure 2. Ces courbes indiquent la concentration en agent tensio - actif dans l'échantillon d'aérosol et la tension superficielle de ces échantillons ( « σ min ») et permettent de déterminer graphiquement les valeurs de CMC (figure 2).

Figure1: les concentrations en tensioactifs fines aérosols (PM1) recueillies dans Rogoznica, Croatie. Les concentrations de tensioactif anionique (en bleu), cationique (en rouge), des agents tensioactifs non ioniques (en vert) et la concentration totale en tensioactif dans la phase d'aérosol (somme de chaque concentration de tensioactif), surf C, p (M), mesurées avec la colorimétrie procédé de fines (<1 um) aérosols atmosphériques recueillies au niveau du site côtier de Rogoznica, Croatie en Février 2015. les résultats montrent clairement la dominance de tensioactifs anioniques et non ioniques. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
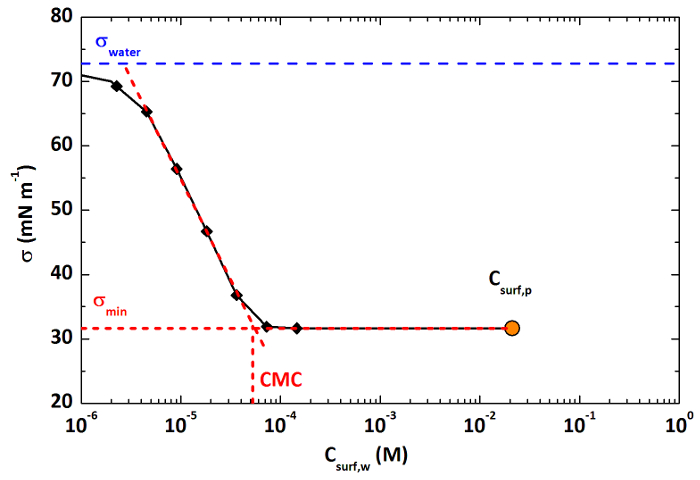
Figure 2: Courbe de tension superficielle typique et CMC pour les agents tensio - actifs dans des aérosols à partir deRogoznica, Croatie. la courbe de tension de surface absolue pour les agents tensio-actifs dans l'échantillon de 02/03/2015 obtenue en combinant la tension de surface et des mesures de concentration. Les points noirs représentent la tension de surface mesurée de l'extrait d'agent tensio-actif. Le point orange à la fin de la courbe représente la concentration calculée de l'échantillon d'aérosol (étape 4.4.6), et « σ min » sa tension superficielle. La détermination graphique de la CMC est illustré. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Dans le protocole, toutes les étapes critiques ont été détaillées. Ils comprennent la collecte des aérosols sur les filtres, l'extraction des agents tensio-actifs d'eux (en utilisant une double extraction: une extraction à l'eau suivie d'une extraction SPE) et l'analyse des extraits (tension de surface et des mesures de concentration).
Pour le procédé entier, un contrôle de qualité ont été réalisés 1) par l'application de la méthode d'extraction et d' analyse sur les filtres vierges (déviation <5 mN m -1 par rapport à l' eau ultra pure sur la tension superficielle et l' absorbance sous la limite de détection pour la colorimétrie procédé), 2) en déterminant l'efficacité d'extraction et de leurs incertitudes , y compris la reproductibilité / répétabilité, le% d'agents tensio - actifs extraits dans une plage de concentration, 3) en vérifiant les interférents potentiels sur la méthode colorimétrique, à savoir en vérifiant que le procédé détecte seul le type d'agent tensio-actif ciblé (anionic, cationiques et non ioniques) et ne voient pas les autres comme en détail dans les références 4, 6) en vérifiant interférents potentiels des extraits d'aérosol (sels inorganiques, des petits acides) sur la méthode colorimétrique comme entièrement détaillée en référence 6.
À notre connaissance, la méthode d'extraction pour tensio-actifs à partir d'échantillons atmosphériques présentés dans cet article est actuellement le plus sélectif dans la chimie atmosphérique. En particulier, il est beaucoup plus sélectif que les simples extractions d'eau réalisées dans le passé pour l'enquête de ces composés. 11, 23, 24 La seconde étape d'extraction est important , car il a été montré pour éliminer les composants ioniques, tels que des sels inorganiques et des petits acides organiques, qui sont en grande concentration dans les échantillons d'aérosol et interfèrent avec la concentration mesurNTS. 6 Ce procédé d'extraction a également été montré pour éliminer tous les agents tensio - actifs présents dans les échantillons, à la surface et dans la masse. Les extraits résultants sont assez concentrés ainsi pour permettre caractérisations précises de ces composés.
Cependant, en plus des agents tensio-actifs, il est possible que d'autres composés non polaires ou légèrement polaires sont extraites des aérosols atmosphériques. Par exemple, « humiques comme substances » (HULIS), qui sont généralement obtenus par les méthodes similaires 25 et, en fonction de la région d'échantillonnage, pourraient être présents dans les extraits. Ces composés sont seulement légèrement tensioactif par rapport aux agents tensio - actifs caractérisés dans nos échantillons, 26, 27, 28 ainsi ne devrait pas contribuer de manière significative à la tension superficielle ou CMC mesurée. Cependant, ils sont polyacides et peuvent interférer avec le conce anionique Les mesures de ntration. À l'avenir, leur contribution aux concentrations tensio - actifs ( à savoir si oui ou non ils réagissent avec du violet d'éthyle, le colorant utilisé pour titrer les tensioactifs anioniques) devra être déterminé. Si leur contribution est importante, des mesures supplémentaires pourraient être ajoutées à la méthode d'extraction, pour éliminer, par exemple, tous les composés qui sont actifs dans l'UV-Vis ou par fluorescence, qui comprendrait HULIS mais pas tensio-actifs.
Jusqu'à présent, aucune autre méthode pour la mesure de la tension superficielle d'aérosols et de la courbe de la tension superficielle des agents de surface d'aérosol que celui présenté dans ce manuscrit est disponible. La technique des gouttelettes de suspension est recommandée pour ces mesures car il est le seul nécessitant des volumes d'échantillons compatibles avec des échantillons atmosphériques. techniques optiques, de mesure directement la tension de surface sur les particules de la taille du micron, sans extraction, sont en cours d'élaboration. 10,ass = « xref »> 20, 29 Jusqu'à présent, ils ne sont applicables aux particules produites en laboratoire , mais pourrait un jour être appliqué à ceux atmosphériques.
La méthode colorimétrique présenté dans ce travail pour la mesure de la concentration en agent tensio - actif a été préalablement appliquée à des échantillons d'aérosols atmosphériques 11, 13, 14, 30 , mais seulement à des extraits de l' eau et de ne pas doubler extraits, comme dans notre procédé. Ceci est une différence importante que, comme souligné ci-dessus, la seconde étape d'extraction élimine les composés tels que les sels inorganiques et les acides organiques faibles, qui interfèrent avec les mesures de concentration. 6
Une technique électrochimique, initialement mis au point pour l'eau de mer et des échantillons aqueux plus importants, a également été utilisée pour mesurer la concentration d'agents tensioactifs dans atmosaérosols phériques. 31, 32 Cette méthode est relative, à savoir les concentrations d'agents tensioactifs obtenus dépendent des composés de référence sélectionnés et supposons que la sensibilité de détection de l' ensemble des tensioactifs est identique. La limite de détection déclarée pour cette technique est de 0,02 mg L -1 lors de l' utilisation de tétra-octylphenolethoxylate comme référence, ainsi 0,03 uM, et comparable à la limite de détection d'environ 0,05 uM pour les tensioactifs anioniques et cationiques , par la méthode colorimétrique. Mais en raison des incertitudes dans la détermination des concentrations totales et non-ioniques tensioactifs par la méthode colorimétrique, il serait intéressant de comparer les deux méthodes (inter-étalonnage).
Quelques points dans les méthodes présentées pourraient être améliorées.
Un autre colorant que le thiocyanate de cobalt qui permettrait de détecter tous les agents tensio-actifs non-ioniques et de l'esprit de la même sensibilité serait très useful et réduire la principale source d'incertitudes dans les mesures de concentration en cours.
L'efficacité d'extraction pour les tensioactifs cationiques, actuellement estimé à 20%, pourrait également être améliorée, car ces composés sont souvent à la limite de détection dans des échantillons de l'atmosphère. Cela pourrait se faire, par exemple, en utilisant une colonne SPE spécifique.
Les extractions et les conditions de titrage pourraient être améliorées. Par exemple, en utilisant en parallèle trois différentes SPE set-up, chaque optimisé pour une classe d'agents tensio-actifs, pourrait améliorer l'efficacité de l'extraction, et d'améliorer la qualité de la procédure (moins de risques de contamination). L'optimum de densité de sorbant de la cartouche de SPE pour la masse de l'échantillon à analyser peut également été déterminée. Les conditions pour les réactions de titrage (pH, des additifs) pourraient également être optimisées, pour améliorer encore la sensibilité des mesures de concentration, à savoir réduire les limites de détection.
jove_content Des essais supplémentaires ou des étapes peuvent être ajoutées au protocole d'extraction d'exclure les composés non tensioactifs qui peuvent avoir été extraites. Par exemple, la présence potentielle de HULIS dans les échantillons peut être étudiée par des techniques optiques (UV-Vis ou fluorescence).
D' autres modifications, sans pour autant améliorer la qualité de l'analyse proprement dite, apporteraient plus d' informations sur les tensioactifs atmosphériques, tels que l' application de la présente méthode pour différentes tailles fractions ( à savoir les sous-populations) de l'aérosol plutôt que sur l' ensemble des particules recueillies, comme présenté ici. D'autres types d'analyses pourraient également être appliqués à des extraits tels que, LC / MS HR, MS en tandem, ou par RMN pour déterminer la structure chimique des agents tensioactifs ou UV-Vis absorbance, la fluorescence, ou polarimétrie, pour indiquer la présence d'hautement composés conjugués ou chiraux dans les extraits.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été financé par SONATA, un projet commun entre l'Agence française Nationale de la Recherche (ANR-13-IS08-0001) et la National Science Foundation. Christine Baduel est financé par l'Agence Nationale de la Recherche française (ANR) par le biais du projet ANR-16-ACHN-0026. Les auteurs remercient aussi chaleureusement Marija Marguš, Ana Cvitesic, Sanja Frka Milosavljević et Irena Ciglenecki, de Rudjer Boskovic Institut de Zagreb, en Croatie pour l'aide à l'échantillonnage d'aérosol à Marina Frapa, Rogoznica, Croatie.
matériels
| Name | Company | Catalog Number | Comments |
| Quartz filters | Fioroni | for example Ø47mm or Ø150mm, Grammage 85g/m2 | |
| Aluminium foils or glass Petri dishes | backed in oven (773 K, 6h) | ||
| Tweezers, scissors | |||
| Desiccator | |||
| SPE (Solid Phase Extraction) set-up | |||
| SPE vacuum manifold Ac-Elut | Varian | ||
| Pump Laboxat | Knf LAB | ||
| Nitrogen dryer set-up | hand-made | ||
| Compressed Nirogen 4.5 in bottle B50, 200 bar at 15°C | Linde | ||
| Tensiometer | Dataphysics | OCA 15EC | |
| Software | SCA software for OCA version 4-4.1 | ||
| UV-Vis spectrometer | Agilent | 8453 | |
| Stir-plates | |||
| Glassware | |||
| Glass Petri dishes | for the water extraction step | ||
| Beakers | |||
| 15 mL, 30 mL, 60 mL glass bottles with corks | |||
| Tubes for SPE | |||
| Magnetic stirring bars | |||
| Ultrasound bath | for glassware washing | ||
| Micropipettes (0.5 - 5 mL, 0.100 - 1mL, 10 - 100 μL) | Rainin Pipette-Life XLS | ||
| Disposable small equipment | |||
| Syringe filters 0.40μm PVDF | Fisherbrand | ||
| SPE C18 cartridges Strata C18-E cartridges 500 mg / 3 mL | Phenomenex | ||
| Plastic syringes | |||
| Needles | |||
| 4 mL-vials | |||
| Pasteur glass pipettes | |||
| Micropipette tips | |||
| Chemicals | |||
| Sodium dodecyl sulfate (SDS) ≥ 98.5 % Bioreagent | Sigma- Aldrich | L3771 | |
| Dioctyl sulfosuccinate sodium salt (AOT) ≥ 97% | Sigma- Aldrich | 323586 | |
| Benzyltetradecyldimethylammonium (zephiramine) ≥ 99.0 % anhydrous Fluka | Sigma- Aldrich | 13401 | |
| Cetyltrimethylammonium chloride solution (CTAC) 25 wt % in H2O | Sigma- Aldrich | 292737 | |
| (1,1,3,3-tetramethylbutyl)phenyl-polyethylene glycol (Triton X114) laboratory grade | Sigma- Aldrich | X114 | |
| Polyethylene glycol dodecyl ether (Brij35) Fluka Bio Chemika | Sigma- Aldrich | 858366 | |
| L-α-phosphatidylcholine from egg yolk type XVI-E lyophilized powder ≥ 99 % | Sigma- Aldrich | P3556 | |
| Surfactin from Bacillus subtilis ≥ 98 % | Sigma- Aldrich | S3523 | |
| R-95Dd rhamnolipid (95 % dirhamnolipid, 5 % monorhamnolipid) | Sigma- Aldrich | L510025 | |
| Ethyl violet cationic triarylmethane dye | Sigma- Aldrich | 228842 | |
| Patent Blue VF dye content 50 % | Sigma-Aldrich | 198218 | |
| Ammonium thiocyanate ≥ 99 % puriss. p.a., ACS reagent | Sigma-Aldrich | 31120 | |
| Cobalt(II) nitrate hexahydrate ≥ 98 % ACS reagent | Sigma-Aldrich | 239267 | |
| Acetic anhydride ≥ 99 % ReagentPlus | Sigma-Aldrich | 320102 | |
| Sodium acetate ≥ 99.0 % anhydrous Reagent Plus | Sigma-Aldrich | S8750 | |
| Ethylenediaminetetraacetic acid 99.4− 100.6 % ACS reagent powder | Sigma-Aldrich | E9884 | |
| Sodium sulfate anhydrous ≥ 99.0 % granulated puriss. p.a. ACS reagent Fluka | Sigma-Aldrich | 71960 | |
| Ethanol puriss. p.a. ACS Reagent reag. Ph. Eur. 96% (v/v) | Sigma-Aldrich | 32294 | |
| Acetonitrile ≥ 99.9 % HiPerSolv CHROMANORM Reag. Ph. Eur. (European Pharmacopoeia Reagent) grade gradient for HPLC | VWR BDH Prolabo | 20060.32 | to be manipulated under hood |
| Chloroform 99 % stable with 0.8−1 % ethanol | Alfa Aesar | L13200-0F | to be manipulated under hood |
| Toluene > 99 % | Chimie Plus | 24053 | to be manipulated under hood |
| Denatured ethanol for washing | |||
| Ultra-Pure water | Ultrapure water system Purelab Classic, Elga |
Références
- Köhler, H. The nucleus in and the growth of hygroscopic droplets. Trans. Faraday Soc. 32, 1152-1161 (1936).
- Noziere, B. CLOUDS. Don't forget the surface. Science. 351, 1396-1397 (2016).
- Onaizi, S. A., Nasser, M. S., Twaiq, F. Adsorption and thermodynamics of biosurfactant, surfactin, monolayers at the air-buffered liquid interface. Colloid Polym Sci. 292, 1649-1656 (2014).
- Ekström, S., et al. A possible role of ground-based microorganisms on cloud formation in the atmosphere. Biogeosci. 7, 387-394 (2010).
- Baduel, C., Nozière, B., Jaffrezo, J. -. L. Summer/winter variability of the surfactants in aerosols from Grenoble, France. Atmos. Environ. 47, 413-420 (2012).
- Gérard, V., et al. Anionic, Cationic, and Nonionic Surfactants in Atmospheric Aerosols from the Baltic Coast at Askö, Sweden: Implications for Cloud Droplet Activation. Environ. Sci. Technol. 50, 2974-2982 (2016).
- Renard, P., et al. Screening of cloud microorganisms isolated at the Puy de Dôme (France) station for the production of biosurfactants. Atmos Chem Phys. 16, 12347-12358 (2016).
- Nozière, B., Baduel, C., Jaffrezo, J. -. L. The dynamic surface tension of atmospheric aerosol surfactants reveals new aspects of cloud activation. Nature Comm. 5, 4335 (2014).
- Ruehl, C. R., Davies, J. F., Wilson, K. R. An interfacial mechanism for cloud droplet formation on organic aerosols. Science. 351, 1447-1450 (2016).
- Jimenez, J. L., et al. Evolution of Organic Aerosols in the Atmosphere. Science. 326, 1525-1529 (2009).
- Latif, M. T., Brimblecombe, P. Surfactants in Atmospheric Aerosols. Environ. Sci. Technol. 38, 6501-6506 (2004).
- Amirov, R. R., Skvortsova, E. A., Saprykova, Z. A. Complexation of Cobalt(II) with Thiocyanate Ions in Aqueous Solutions of Nonionogenic Surfactants. Russ. J. Coord. Chem. 29, 554-558 (2003).
- Jaafar, S. A., et al. Surfactants in the sea-surface microlayer and atmospheric aerosol around the southern region of Peninsular Malaysia. Mar. Pollut. Bull. 84, 35-43 (2014).
- Mustaffa, N., Latif, M., Ali, M., Khan, M. Source apportionment of surfactants in marine aerosols at different locations along the Malacca Straits. Environ Sci Pollut Res. 21, 6590-6602 (2014).
- Motomizu, S., Fujiwara, S., Fujiwara, A., Toei, K. Solvent extraction-spectrophotometric determination of anionic surfactants with ethyl violet. Anal. Chem. 54, 392-397 (1982).
- Yamamoto, K., Motomizu, S. Solvent extraction-spectrophotometric determination of anionic surfactants in sea water. Analyst. 112, 1405-1408 (1987).
- Schmitt, T. M. . Analysis of Surfactants (Surfactant Science). 96, 421-443 (2001).
- Hummel, D. O. . Handbook of Surfactant Analysis: Chemical, Physico-chemical and Physical Methods. , 203 (2000).
- Pacheco e Silva, V., al, e. Method to measure surfactant in fluid. US patent. , (2013).
- Bzdek, B. R., Power, R. M., Simpson, S. H., Reid, J. P., Royall, C. P. Precise, contactless measurements of the surface tension of picolitre aerosol droplets. Chem Sci. 7, 274-285 (2016).
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiol. Mol. Biol. R. 61, 47-64 (1997).
- Christofi, N., Ivshina, I. B. Microbial surfactants and their use in field studies of soil remediation. J. Appl. Microbiol. 93, 915-929 (2002).
- Facchini, M. C., Mircea, M., Fuzzi, S., Charlson, R. J. Cloud albedo enhancement by surface-active organic solutes in growing droplets. Nature. 401, 257-259 (1999).
- Mircea, M., et al. Importance of the organic aerosol fraction for modeling aerosol hygroscopic growth and activation: a case study in the Amazon Basin. Atmos. Chem. Phys. 5, 3111-3126 (2005).
- Varga, B., Kiss, G., Ganszky, I., Gelencsér, A., Krivácsy, Z. Isolation of water-soluble organic matter from atmospheric aerosol. Talanta. 55, 561-572 (2001).
- Kiss, G., Tombácz, E., Hansson, H. -. C. Surface Tension Effects of Humic-Like Substances in the Aqueous Extract of Tropospheric Fine Aerosol. J Atmos Chem. 50, 279-294 (2005).
- Salma, I., Ocskay, R., Varga, I., Maenhaut, W. Surface tension of atmospheric humic-like substances in connection with relaxation, dilution, and solution pH. J. Geophys. Res. 111, D23205 (2006).
- Taraniuk, I., Graber, E. R., Kostinski, A., Rudich, Y. Surfactant properties of atmospheric and model humic-like substances (HULIS). Geophys. Res. Lett. 34, L16807 (2007).
- Morris, H. S., Grassian, V. H., Tivanski, A. V. Humidity-dependent surface tension measurements of individual inorganic and organic submicrometre liquid particles. Chemical Science. 6, 3242-3247 (2015).
- Roslan, R. N., et al. Surfactants in the sea-surface microlayer and their contribution to atmospheric aerosols around coastal areas of the Malaysian peninsula. Mar. Pollut. Bull. 60, 1584-1590 (2010).
- Orlović-Leko, P., Kozarac, Z., Ćosović, B., Strmečki, S., Plavšić, M. Characterization of atmospheric surfactants in the bulk precipitation by electrochemical tools. J Atmos Chem. 66, 11-26 (2010).
- Frka, S., et al. Surface-active substances in atmospheric aerosol: an electrochemical approach. Tellus B. 64, 12 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon