Method Article
RMN Spectroscopie comme outil robuste pour l'évaluation rapide du profil des suppléments Lipid huile de poisson
Dans cet article
Résumé
Ici, à haute résolution du 1 H et 13 C spectroscopie de résonance magnétique nucléaire (RMN) a été utilisé comme outil rapide et fiable pour l' analyse quantitative et qualitative des suppléments d'huile de poisson encapsulées.
Résumé
Le régime alimentaire occidental est pauvre en n -3 acides gras, donc la consommation de suppléments d'huile de poisson est recommandé d'augmenter l'apport de ces nutriments essentiels. L'objectif de cette étude est de démontrer l'analyse qualitative et quantitative des suppléments d'huile de poisson encapsulées en utilisant une haute résolution H et spectroscopie RMN 13 C en utilisant deux instruments différents de RMN; 500 MHz et un instrument de 850 MHz. Les deux protons (1 H) et du carbone (13 C) Les spectres de RMN peuvent être utilisées pour la détermination quantitative des constituants majeurs des suppléments d'huile de poisson. Quantification des lipides dans les suppléments d'huile de poisson est atteint grâce à l'intégration des signaux de RMN appropriés dans les spectres 1D pertinents. Les résultats obtenus par 1 H et 13 C - RMN sont en accord avec l'autre, malgré la différence de résolution et de sensibilité entre les deux noyaux et les deux instruments. 1 H RMN offreSA analyse plus rapide par rapport à 13 C - RMN, comme le spectre peut être enregistré en moins de 1 min, par opposition à l' analyse 13 C - RMN, qui dure de 10 minutes à une heure. Le 13 spectre de RMN C, cependant, est beaucoup plus informative. Il peut fournir des données quantitatives pour un plus grand nombre d'acides gras individuels et peut être utilisé pour déterminer la distribution de position des acides gras sur le squelette glycerol. Les deux noyaux peuvent fournir des informations quantitatives en une seule expérience sans la nécessité d'étapes de purification ou de séparation. La force du champ magnétique affecte principalement les 1 H spectres RMN en raison de sa résolution inférieure par rapport à 13 C RMN, cependant, même les instruments de RMN à plus faible coût peuvent être efficacement appliquées en tant que méthode standard par les laboratoires de l' industrie alimentaire et de contrôle de la qualité.
Introduction
La consommation de n -3 acides gras dans le régime alimentaire est avérée être bénéfique contre plusieurs maladies telles que des troubles cardiaques 1, 2, 3, 4 maladies inflammatoires et le diabète 5. Le régime alimentaire occidental est considéré comme pauvre en n -3 acides gras et donc la consommation de suppléments d'huile de poisson est recommandé d'améliorer la n -6 / -3 n équilibre dans la nutrition des consommateurs 1. Malgré la récente augmentation de la consommation de suppléments d'huile de poisson, des questions demeurent sur la sécurité, l'authenticité et la qualité de certains de ces produits. L'analyse de la composition rapide et précise des suppléments d'huile de poisson est essentiel d'évaluer correctement la qualité de ces produits commerciaux et d'assurer la sécurité des consommateurs.
Les méthodes les plus communes pour l'évaluation du supplément d'huile de poissons sont chromatographie en phase gazeuse (GC) et la spectroscopie infrarouge (IR). Bien que ces méthodes sont très sensibles, ils souffrent de plusieurs inconvénients 6. L' analyse GC prend beaucoup de temps (4-8 h) parce que la séparation et la dérivatisation des composés individuels est requis 7 et l' oxydation des lipides peuvent se produire lors de l'analyse 8, 9. Bien que la spectroscopie IR peut être quantitative, un modèle de prédiction doit être construit en utilisant la régression des moindres carrés partiels (PLSR), bien qu'il y ait des exceptions dans lesquelles bandes IR peut être attribué à un seul composé 10. PLSR nécessite l'analyse d'un grand nombre d'échantillons, ce qui augmente le temps de l'analyse 11. Pour cette raison, il y a un intérêt croissant pour le développement de nouvelles méthodes d'analyse qui permettent une analyse précise et rapide d'un grand nombre d'échantillons d'huile de poisson. Des organisations telles que l'OffiCE des compléments alimentaires (ODS) aux National Institutes of Health (NIH) et la Food and Drug Administration (FDA) ont collaboré avec l'Association of Official Analytical Chemists (AOAC) pour développer ces nouvelles méthodes 12, 13.
L' une des méthodes d' analyse les plus prometteurs pour le dépistage et l'évaluation des matrices à plusieurs composants, tels que les suppléments alimentaires, est la spectroscopie par résonance magnétique (RMN) nucléaire 14, 15. spectroscopie RMN présente plusieurs avantages: il est une technique non destructive et quantitative, il faut un minimum d'aucune préparation de l'échantillon, et il se caractérise par une excellente précision et la reproductibilité. En outre, la spectroscopie RMN est une méthode respectueuse de l'environnement car il utilise seulement de petites quantités de solvants. Le principal inconvénient de la spectroscopie de RMN est sa sensibilité relativement faible par rapport à d'autres analytiméthodes cal Cependant, les progrès technologiques récents dans l'instrumentation tels que des champs magnétiques forts, des sondes cryogéniques de différents diamètres, le traitement de données de pointe et polyvalents séquences d'impulsions et de techniques ont augmenté la sensibilité jusqu'à la plage des nM. Bien que l'instrumentation RMN est le coût élevé, la longue durée de spectromètres RMN et les nombreuses applications de RMN réduisent le coût de l'analyse à long terme. Ce protocole vidéo détaillé est destiné à aider les nouveaux praticiens dans le domaine éviter les pièges associés à 1 H et 13 C RMN analyse spectroscopique des suppléments d'huile de poisson.
Protocole
1. Préparation de l'échantillon RMN
Note: Attention, s'il vous plaît consulter toutes les fiches de sécurité des matières pertinentes (FS) avant utilisation. Chloroforme deutéré (CDCI3) utilisé dans la préparation de l' échantillon est toxique. S'il vous plaît utiliser toutes les pratiques de sécurité appropriées lors de l'exécution de préparation d'échantillon comprenant l'utilisation d'une hotte et de l'équipement de protection individuelle (lunettes de sécurité, gants, blouse, pantalon pleine longueur, à bout fermé chaussures).
- Préparation de 1 H et 13 échantillons C
- Extraire 120 ul (~ 110 mg) d'huile de poisson à partir d'une capsule diététique en utilisant une seringue et le placer dans un flacon en verre de 4 ml. Noter le poids de l'huile de poisson.
- dissolution de l'échantillon
- Dissoudre environ 120 ul d'huile de poisson dans 500 ul de CDCl 3 contenant 0,01% de tétraméthylsilane (TMS) utilisé comme référence pour la 1 H et 13 déplacements chimiques C.
REMARQUE: TMS est utiliséD uniquement pour le calibrage de décalage chimique (voir les numéros d'étape 2.2.1.2.7 et 2.2.2.2.7), pas de quantification (voir numéros d'étape 2.2.1.3 et 2.2.2.3) fins. - Préparer un 2,6-di- tert - butyl-4-méthylphénol (BHT) solution mère, si quantification exprimée en mg / g est souhaitée, en dissolvant environ 220 mg de BHT et 15 mg de chrome (III) acétylacétonate (Cr ( acac) 3) dans 20 ml de CDCl 3 contenant 0,01% de TMS. Utiliser 500 ul de la solution mère pour dissoudre 100 mg (± 10 mg) d'huile de poisson.
- Dissoudre environ 120 ul d'huile de poisson dans 500 ul de CDCl 3 contenant 0,01% de tétraméthylsilane (TMS) utilisé comme référence pour la 1 H et 13 déplacements chimiques C.
- Après dissolution de l'huile (cela prend quelques secondes), transférer la totalité de la solution directement dans un tube de RMN de haute qualité à 5 mm et fixer un capuchon. Analyser les échantillons dans les 24 heures après la préparation des échantillons.
2. Préparation de l'instrument RMN
Note: Attention, méfiez-vous que la présence de champs magnétiques puissants produits par les instruments de RMN peut affecter les dispositifs médicaux et implfourmis , tels que les stimulateurs cardiaques et prothèses chirurgicales, ainsi que des articles électroniques tels que les cartes de crédit, montres, etc. prudence supplémentaire est nécessaire lorsque l'analyse est effectuée en utilisant des aimants non-blindage. Deux instruments de RMN ont été utilisés pour l'acquisition de 1 H et 13 C Les spectres de RMN; un spectromètre fonctionnant à 850,23 MHz et 213,81 MHz pour 1 H et 13 noyaux de C, respectivement, équipé d'un inverse refroidi à l'hélium-résonance triple (TCI) sonde de 5 mm et un spectromètre fonctionnant à 500,20 MHz et 125,77 MHz pour 1 H et 13 C noyaux, respectivement, muni d'une large bande observée (BBO) refroidi à l'azote sonde de 5 mm. Toutes les expériences ont été effectuées à 25 ± 0,1 ° C et les spectres ont été traités par un ensemble standard logiciel d'acquisition et de traitement d'analyse des données de RMN (voir Matériaux List).
- Préparation pour l' acquisition des spectres RMN
Note: 1 H et RMN 13 C Les spectrespeut être acquise par conséquent sans retirer l'échantillon de l'instrument.- Insérer le tube de RMN dans une turbine de filage (voir Matériaux List).
- Placer la centrifugeuse et le tube sur le sommet d'une jauge de profondeur graduée et pousser doucement la partie supérieure du tube jusqu'à ce que sa partie inférieure touche le fond de la jauge.
- Placer l'échantillon RMN dans un endroit ouvert du SampleCase. Notez le numéro de fente est placé dans l'échantillon.
- Pour charger l'échantillon dans la RMN, le retour à l'ordinateur de commande et tapez « sx # », où # est la fente du SampleCase tenant votre échantillon.
- Attendre que le signal du deuterium de CDCl 3 à apparaître sur l'écran de la fenêtre de verrouillage. Si elle ne semble pas automatiquement, tapez « lockdisp ». Dès que le signal du deuterium est visible, de type « lock » sur la ligne de commande et sélectionner dans la liste du solvant « CDCl 3 » afin de verrouiller l'échantillon en utilisant la résonance du deuterium CDCl 3.
NOTE: Deutérium signal peut ne pas apparaître si l'utilisateur précédent a utilisé un solvant différent. L'utilisateur doit attendre l'indicateur que l'échantillon est vers le bas, puis verrouiller. - Tapez « bsmsdisp » dans la ligne de commande pour assurer la filature n'est pas actif. Si le bouton « SPIN » est vert, cliquez dessus pour désactiver la filature.
- Tapez la commande « nouveau » pour créer un nouvel ensemble de données. Entrez un nom pour l'ensemble de données dans l'onglet « NOM » et le numéro d'expérience dans l'onglet « EXPNO ». Utilisez le numéro « 1 » dans l'onglet « PROCNO ». Dans l'onglet « Expérience », cliquez sur « Sélectionner » et choisissez le fichier de paramètres « PROTON ». Ecrire le titre de l'expérience dans l'onglet « TITLE ». Cliquez sur "OK".
- Type « getprosol » dans la ligne de commande pour obtenir les paramètres standard pour la sonde à courants de RMN et de solvant.
- Répétez l' étape 2.1.7 pour 13 C, en sélectionnant la séquence d'impulsions « C13IG » dans l'onglet « Expérience » pour le 1D 13 C inverse gexpérience découplé ATED.
- Type « getprosol » dans la ligne de commande pour obtenir les paramètres standard pour la sonde à courants de RMN et de solvant.
- Tapez la commande « atma » pour effectuer le réglage automatique et l'appariement de la sonde pour les deux noyaux de carbone et de protons.
- Effectuer gradient à une dimension de calage pour obtenir un champ magnétique très homogène, et donc la forme de la ligne optimale pour les signaux de RMN.
- Utiliser la procédure automatique standard pour 1D calage, simplement en exécutant séquentiellement les commandes « qu topshim 1dfast ss », « qu topshim ss tuneb » et « rapport topshim qu » sur la ligne de commande.
- Optimisation des paramètres
- 90 ° calibrage d'impulsions
- Créer un nouvel ensemble de données pour 1 H (voir les étapes 2.1.7 et 2.1.8).
- Tapez la commande « paropt » sur la ligne de commande pour démarrer le programme d'automatisation pour l'étalonnage du 90 ° pulelle-même. Sélectionner la durée d'impulsion, p1, comme paramètre à modifier.
- Commençons par « 2 » ps que la valeur initiale de p1, entrez « 2 » uS incréments et réaliser des expériences « 16 ».
- Créer un nouveau jeu de données pour 13 C (voir étape 2.1.9) et répéter le processus pour les 13 noyaux de C (voir les étapes 2.2.1.2 et 2.2.1.3).
- T 1 mesure mesuré par la méthode de null 16 pour 1 H
REMARQUE: La méthode null utilise la séquence d'impulsions d'inversion - récupération, constituée d'une suite d'impulsions à 180 ° par un retard (tau), pour permettre la détente le long de l'axe z et une impulsion à 90 ° finale qui crée l'aimantation transversale observable.- Créer un nouvel ensemble de données pour 1 H (voir les étapes 2.1.7 et 2.1.8).
- Tapez « pulprog t1ir1d » pour changer la séquence d'impulsions à l'expérience inversion-récupération.
- Tapez les commandes suivantes sur le commanligne d configurer la largeur spectrale en ppm, le centre de l'émetteur RF, le nombre de balayages le nombre de balayages factices et le nombre de points de données « sw 8 », « O1P 3,8 », « ns 2 », « ds 2" et "td 64K".
- Type « p1 (valeur) » et entrer les valeurs de durée de 90 ° impulsion telle que déterminée par l'étalonnage de l'impulsion (voir étape 2.2.1) et de type « p2 (valeur) » pour l'impulsion de 180 ° (la valeur de durée pour les 180 ° impulsion est la durée d'impulsion de 90 ° multiplié par deux).
- Réglez le retard de recyclage à une valeur très grande, par exemple 10 s en tapant « d1 10 ».
- Set tau à un court - valeur, par exemple 10 ms, en tapant « d7 10ms » dans la ligne de commande.
- Régler le gain du récepteur (RG) à une valeur appropriée en utilisant la commande « RGA » pour le calcul automatique de RG.
- Exécuter un spectre en tapant la commande « ZG ».
- Exécuter Fourier transformation en tapant « efp »dans la ligne de commande.
- Effectuer une correction automatique de phase en tapant la commande « APK » dans la ligne de commande. Si des ajustements de phase supplémentaires sont nécessaires pour améliorer encore le spectre, cliquez sur l'onglet « Processus », puis cliquez sur l'icône « Ajuster la phase » pour entrer dans le mode de correction de phase.
- Utiliser le ordre zéro (0) et du premier ordre (1) des icônes de correction de phase en faisant glisser la souris jusqu'à ce que tous les signaux sont en mode d'absorption négative. Appliquer et enregistrer les valeurs de correction de phase en cliquant sur le bouton « Retour et Enregistrer » pour quitter le mode de correction de phase.
- Augmenter le tau jusqu'à ce que tous les pics sont positifs ou nulled en répétant les étapes 2.2.2.6-2.2.2.9. Pour déterminer la valeur T 1, il suffit de diviser la valeur de tau , où le pic est nulled avec LN2.
- T 1 mesure mesuré par la méthode de 16 à 13 null C
- Créer un nouveau jeu de données pour 13 C (voir étape 2.1.9)
- Type « pulprog t1irpg » pour changer la séquence d'impulsions à l'expérience inversion-récupération pour les noyaux de carbone.
- Tapez les commandes suivantes sur la ligne de commande pour établir la largeur spectrale en ppm, le centre de l'émetteur RF, le nombre de balayages, le nombre de balayages factices et le nombre de points de données: « sw 200 », « O1P 98 » , "ns 8", "ds 2" et "td 64K".
- Type « p1 (valeur) » et entrer les valeurs de durée de 90 ° impulsion telle que déterminée par l'étalonnage de l'impulsion (voir étape 2.2.1) et de type « p2 (valeur) » pour l'impulsion à 180 ° (la valeur de durée est le 90 ° durée de l'impulsion multipliée par deux).
- Définissez le délai de recyclage à une valeur très importante, comme 100 s en tapant « d1 100 ».
- Set tau à un court - valeur, par exemple 100 ms en tapant « d7 100ms » dans la ligne de commande.
- Réglez le Fichgain er (RG) à une valeur appropriée en utilisant la commande « RGA » pour le calcul automatique de RG.
- Exécuter un spectre en tapant la commande « ZG ».
- Exécuter Fourier transformation en tapant « PEF » dans la ligne de commande.
- Effectuer une correction de phase automatique en tapant la commande « APK » dans la ligne de commande. Si des ajustements de phase supplémentaires sont nécessaires pour améliorer encore le spectre, cliquez sur l'icône et les icônes de correction de phase pour l'ordre zéro « Ajuster la phase » (0) et la phase de premier ordre (1) correction.
- En cliquant sur les icônes de correction de phase d'ordre zéro et de premier ordre, faites glisser la souris jusqu'à ce que tous les signaux sont en mode d'absorption négatif. Appliquer et enregistrer les valeurs de correction de phase en cliquant sur le bouton « Retour et Enregistrer » pour quitter le mode de correction de phase.
- Augmenter le tau jusqu'à ce que tous les pics sont positifs ou nulled en répétant les étapes 2.2.3.6-2.2.3.9. Déterminerla valeur T 1, il suffit de diviser la valeur de tau , où le pic est nulled avec LN2.
- 90 ° calibrage d'impulsions
- Une dimension (1D) RMN Spectra
- 1 Les spectres ' H-RMN
- Acquisition des données RMN
- Aller à la 1 jeu de données de H créé à l' étape 2.1.7 et en utilisant le « impulsion-acquisition » standard séquence d'impulsions, « zg », en tapant « pulprog zg » dans la ligne de commande.
- Tapez les commandes suivantes sur la ligne de commande pour établir la largeur spectrale en ppm, le centre de l'émetteur RF, le nombre de balayages, le nombre de balayages factices, le nombre de points de données et la durée d'impulsion pour un angle d'impulsion de 90 ° : "sw 8", "O1P 3,8", "ns 2", "ds 2", "td 64K" et "p1 (tel que déterminé par l' étalonnage d'impulsion)" (voir étape 2.2.1).
REMARQUE: Les points de données 32K peuvent être utilisés pour l'instrument 500 MHz. - Définir un délai de relaxation de 7 s pour l'instrument de 500 MHz ou 9 s pour l'instrument de 850 MHz en tapant "d1" ou "7s d1 9s", respectivement, dans la ligne de commande.
- Régler le gain du récepteur (RG) à une valeur appropriée en utilisant la commande « RGA » pour le calcul automatique de RG.
- Tapez « baseopt digmod » pour acquérir un spectre de référence amélioré.
- Démarrez l'acquisition en tapant la commande-acquire d'impulsion « ZG » dans la ligne de commande.
- Le traitement des données RMN
- Tapez « si 64K » dans la ligne de commande pour appliquer zéro remplissage et définir la taille du spectre réel à 64K.
- Régler le paramètre élargissant la ligne de 0,3 Hz en tapant « lb 0,3 » dans la ligne de commande pour appliquer une fonction de pondération (décroissance exponentielle) avec un facteur élargissement de ligne de 0,3 Hz avant la transformation de Fourier.
- Exécuter Fourier transformation en tapant « PEF » dans la commandeligne.
- Effectuer une correction de phase automatique en tapant la commande « APK » dans la ligne de commande. Si des ajustements de phase supplémentaires sont nécessaires pour améliorer encore le spectre, cliquez sur l'onglet « Processus », puis cliquez sur l'icône et les icônes de correction de phase pour l'ordre zéro « Ajuster la phase » (0) et de premier ordre (1) correction de phase .
- En cliquant sur les icônes de correction de phase d'ordre zéro et de premier ordre, faites glisser la souris jusqu'à ce que tous les signaux sont en mode d'absorption positive. Appliquer et enregistrer les valeurs de correction de phase en cliquant sur le bouton « Retour et Enregistrer » pour quitter le mode de correction de phase.
- Appliquer une fonction polynôme du quatrième ordre pour la correction de ligne de base lors de l'intégration en saisissant la commande « abs n ».
NOTE: Ceci assure une base spectrale plat avec une intensité minimale. - Déplacements chimiques en ppm Rapport de TMS (δ = 0). Cliquez sur l'étalonnage ( "Calib. Axest ") icône, et placer le curseur sur la ligne rouge au-dessus du signal TMS RMN (pic le plus proche de 0). clic gauche et saisir « 0 ».
- L' analyse des données de RMN
- Intégrer la région spectrale de δ 1,1 à ô 0,6, ainsi que les pics à δ 4,98, δ 5,05 et δ 5,81 avec l'icône « Intégrer » (sous l'onglet « process ») et le point culminant ( « Définir une nouvelle région ») icône. cliquez et tirez vers la gauche à travers les Intégrales.
REMARQUE: S'il est nécessaire de se concentrer sur une région, cliquez sur l'icône en surbrillance pour désactiver et le clic gauche et faites glisser la souris pour zoomer sur la région. Pour régler l'intensité de seuil, utilisez le bouton central de la souris si nécessaire. Cliquez sur l'icône en surbrillance à nouveau pour rendre la fonction d'intégration active, puis passer à la pointe suivante.- Normaliser la somme des intégrales ci-dessus à 100 en cliquant droit sur la valeur intégrale qui apparaissents sous le signal et sélectionnez « Normaliser somme de Intégrales ». Entrez la valeur « 100 » dans la boîte et cliquez sur le « Retour et Enregistrer » pour quitter le mode d'intégration.
- Lors de l' utilisation du BHT comme étalon interne, l' intégration du pic à δ 6,98 et définir l'intégrale correspondant aux millimoles de BHT par 0,5 ml de la solution mère.
- Intégrer les pics d'intérêt (voir l'étape 2.3.1.3.1) se prolongeant à partir de 10 Hz de chaque côté de la pointe, lorsque cela est possible.
- Procéder pour effectuer 13 des spectres RMN C-acquisition et de traitement d'une manière similaire.
- Intégrer la région spectrale de δ 1,1 à ô 0,6, ainsi que les pics à δ 4,98, δ 5,05 et δ 5,81 avec l'icône « Intégrer » (sous l'onglet « process ») et le point culminant ( « Définir une nouvelle région ») icône. cliquez et tirez vers la gauche à travers les Intégrales.
- Acquisition des données RMN
- 13 Les spectres RMN C
- Acquisition des données RMN
- Aller à la 13 C ensemble de données et en utilisant la séquence d'impulsions découplée fermée inverse, « zgig » en tapant « pulprog zgig » dans la ligne de commande.
REMARQUE: Pour exécuter une expérience de carbone avec la norme Decou à large bandePLED séquence d'impulsions, dans la ligne de commande de type « pulprog zgpg ». - Tapez les commandes suivantes sur la ligne de commande pour établir la largeur spectrale en ppm, le centre de l'émetteur RF, le nombre de balayages, le nombre de balayages factices, le nombre de points de données et la durée d'impulsion pour un angle d'impulsion de 90 ° : "sw 200", "O1P 95", "16 ns" "ds 2", "td 64K" et "p1 (tel que déterminé par l'étalonnage d'impulsion)" (voir l'étape 2.2.1.4).
- Définir un délai de relaxation de 35 s pour l'instrument de 500 MHz ou de 45 s pour l'instrument de 850 MHz en tapant "d1" ou "35s 45s" d1, respectivement, dans la ligne de commande. Lorsque vous utilisez le BHT, le retard de relaxation devrait être de 50 s dans l'instrument 500 MHz et 60 s dans l'instrument 850 MHz.
- Régler le gain du récepteur (RG) à une valeur appropriée en utilisant la commande « RGA » pour le calcul automatique de RG.
- Tapez « baseopt digmod » dans la ligne de commande pour acquérir un spectre wième ligne de base améliorée.
- Démarrez l'acquisition en tapant la commande-acquire d'impulsion « ZG » dans la ligne de commande.
- Aller à la 13 C ensemble de données et en utilisant la séquence d'impulsions découplée fermée inverse, « zgig » en tapant « pulprog zgig » dans la ligne de commande.
- Le traitement des données RMN
- Tapez « si 64K » dans la ligne de commande pour appliquer zéro remplissage et définir la taille du spectre réel à 64K.
- Régler le paramètre élargissant la ligne de 1,0 Hz en tapant « lb 1,0 » dans la ligne de commande pour appliquer une fonction de pondération (décroissance exponentielle) avec un facteur élargissement de ligne de 1,0 Hz avant la transformation de Fourier.
- Exécuter Fourier transformation en tapant « PEF » dans la ligne de commande.
- Effectuer une correction de phase automatique en tapant la commande « APK » dans la ligne de commande. Si des ajustements de phase supplémentaires sont nécessaires pour améliorer encore le spectre, cliquez sur l'onglet « Processus », puis cliquez sur l'icône « Ajuster la phase » et les icônes de correction de phase pour l'ordre zéro (0) et la phase de premier ordre (1) correction .
- En cliquant sur les icônes d'ordre zéro et de correction de phase de premier ordre, faites glisser la souris jusqu'à ce que tous les signaux sont en mode d'absorption positive. Appliquer et enregistrer les valeurs de correction de phase en cliquant sur le bouton « Retour et Enregistrer » pour quitter le mode de correction de phase.
NOTE: Pour les spectres de carbone enregistrés sur la fréquence de Larmor de 214 MHz (l'instrument 850 MHz) la correction des erreurs dépendant de la fréquence (de premier ordre) peut être difficile et prend du temps pour les utilisateurs moins expérimentés en raison des effets importants hors résonance du impulsion à 90 °.
- En cliquant sur les icônes d'ordre zéro et de correction de phase de premier ordre, faites glisser la souris jusqu'à ce que tous les signaux sont en mode d'absorption positive. Appliquer et enregistrer les valeurs de correction de phase en cliquant sur le bouton « Retour et Enregistrer » pour quitter le mode de correction de phase.
- Appliquer une fonction polynôme du quatrième ordre pour la correction de ligne de base lors de l'intégration en saisissant la commande « n abs » dans la ligne de commande.
- Déplacements chimiques en ppm Rapport de TMS (δ = 0). Cliquez sur l'étalonnage ( « Calib. Axe ») icône et placez le curseur avec la ligne rouge sur le dessus du signal RMN à être référencé. Clic gauche et tapez « 0 ».
- L' analyse des données de RMN
- Intégrer la région spectrale de δ 175 à l' aide de 171 ô l'icône « Intégrer » (sous l'onglet « Processus ») et le point culminant ( « Définir nouvelle région ») icône. cliquez et tirez vers la gauche à travers les Intégrales.
REMARQUE: S'il est nécessaire de se concentrer sur une région, cliquez sur l'icône en surbrillance pour désactiver et le clic gauche et faites glisser la souris pour zoomer sur la région. Cliquez sur l'icône en surbrillance à nouveau pour rendre la fonction d'intégration active, puis passer à la pointe suivante.- Réglez l'intégrale à 100 en faisant un clic droit sur la valeur intégrale qui apparaît sous le signal et sélectionnez « Calibrer courant intégrale ». Entrez la valeur « 100 » dans la boîte et cliquez sur le « Retour et enregistrer » pour quitter le mode d'intégration.
- Lors de l' utilisation du BHT comme étalon interne, l' intégration du pic à δ 151,45 et définir l'intégrale égale àles millimoles de BHT par 0,5 ml de la solution mère.
- Intégrer les pics d'intérêt extension 5 Hz de chaque côté du pic (voir étape 2.3.2.3.1).
- Intégrer la région spectrale de δ 175 à l' aide de 171 ô l'icône « Intégrer » (sous l'onglet « Processus ») et le point culminant ( « Définir nouvelle région ») icône. cliquez et tirez vers la gauche à travers les Intégrales.
- Acquisition des données RMN
- 1 Les spectres ' H-RMN
Résultats
1 H et 13 C Les spectres de RMN ont été recueillies pour des suppléments d'huile de poisson disponibles dans le commerce en utilisant deux instruments de RMN; 850 MHz et un spectromètre de 500 MHz. Ces spectres peuvent être utilisés pour la détermination quantitative de composants d'huile de poisson, comme l'acide docosahexaénoïque (DHA) et l' acide eicosapentaénoïque (EPA), ainsi que d' autres composés tels que n - 1 des chaînes acyle et l' indice importants sur le plan nutritionnel , tels que le n -6 / n -3 ratio. La quantification peut être réalisée même sans l'utilisation d'un étalon interne, cependant, les résultats quantitatifs doivent être exprimés en pourcentages molaires relatifs. Lorsque les données doivent être exprimées en valeurs absolues (mg / g), une norme interne est nécessaire. Les résultats obtenus par RMN sont hautement reproductibles avec des écarts - types relatifs (RSD) allant de 0,3% à 2% pour 13 l' analyse RMN de C et de 0,5% à 2,5% pour l' analyse RMN 1 H, en fonction de t il lipides. Le RSD légèrement plus élevé pour 1 H RMN est souvent observée car les spectres de protons ont tendance à être surchargé, ce qui affecte la précision de l'analyse, en particulier pour les résonances qui ont un signal plus faible par rapport au bruit (S / N). Un très bon accord a été trouvé entre les 850 MHz et l'instrument de 500 MHz avec RSD allant de 1% à 4%. RSD relativement élevée (jusqu'à 8%) ont été observés lorsque l'on compare les résultats obtenus par 1 H et 13 C, en particulier pour des composés qui apparaissent à des concentrations plus faibles telles que les n - 1 des chaînes acyle. spectroscopie RMN a été préalablement validé comme outil d'analyse des lipides, y compris la détermination de certains composants d'huile de poisson. Les résultats ont montré qu'il est en bon accord avec les méthodes traditionnelles, telles que GC 17, 18.
Analyse RMN 1 H
"xfig"> La figure 1 compare les spectres 1 H RMN acquis sur (A) de 850 MHz et (B) un instrument de 500 MHz. Le spectre de 850 MHz est caractérisé par une résolution plus élevée, mais les principaux composants de l' huile de poisson , y compris le DHA, l' EPA et n -6 / n -3 rapport peut aussi être déterminé à partir du spectre de 500 MHz. Les 1 signaux H-RMN d'acides gras d'huile de poisson qui peuvent être utilisés à des fins de quantification sont représentés dans le tableau 1, alors que l'attribution complète de RMN du spectre 1 H - RMN de l' huile de poisson peut être trouvé ailleurs 19.
1 H - RMN a donné les données fiables pour la quantification de la quantité totale de n -3, -6 n, DHA, acides gras trans, n - 1 des chaînes acyle et d' acides gras saturés (SFA). Pour l'analyse RMN 1 H, l'utilisation des relations appropriées est nécessaire parce que la plupart des signals appartiennent à des groupes de protons qui sont communs aux différents acides gras et des lipides. Pour cette raison, dans la plupart des cas , la concentration des acides gras dans l' huile de poisson peut être déterminée que par la combinaison des différents signaux RMN 1 H, incorporés dans les rapports appropriés. En outre, ces équations contiennent des coefficients arithmétiques qui normalisent la différence de nombre de protons associés à chaque groupe. Quand un étalon interne est utilisé , l'équation suivante doit être considérée: C = I / I est × N IS / N × A × MW / m (1), où C est la concentration de l'analyte en mg / g d'huile de poisson, I est l'intégrale de résonance qui est uniquement attribuable au lipide d'intérêt, i est le domaine d'un signal de proton qui appartient uniquement à l'étalon interne, N est le nombre de protons du groupe fonctionnel qui est analysé,N est le nombre de protons de l'étalon interne qui sont utilisés pour l'analyse, A est le nombre de millimoles d'étalon interne, MW est le poids moléculaire de l'acide gras (exprimée en esters de méthyle), et m est la quantité d'huile de poisson exprimée en g.
Exemple 1, DHA: La proportion de DHA est déterminée par l'équation C DHA = ¾ I DHA / S, où I DHA est l'intégrale du signal à δ 2,39 , qui fait partie des protons ß a- H et H de DHA, et S est la somme des intégrales des protons méthyliques des SFA, n -6, -9 n, n - 3, des acides gras trans plus les intégrales des pics de N - 1 des chaînes acyle à δ 4,98, S 5,05 et 5,81 δ. L'intégrale I DHA est normalisée en multipliant par 3/4 car elle correspond à quatre protons, alors que l'intégrale S correspond à trois protons. 1 H RMN est pas capable de donner des informations sur la distribution de position des acides gras sur le squelette de glycérol et donc ne peut être utilisé pour la quantification de la quantité totale d'acides gras. L'analyse RMN 1 H d'un supplément d'huile de poisson encapsulée a montré qu'il se compose de 10,5% de DHA. La concentration du DHA dans le même échantillon en utilisant le BHT a été jugée 105,23 mg / g. Ces valeurs sont très proches des valeurs obtenues avec 13 C - RMN (voir l' exemple 2 pour 13 analyse C).
Exemple 2, n - 1 des chaînes acyle: La concentration de N - 1 des chaînes acyle est donnée par la relation C n-1 = I 3 n-1 / S, où I n-1 est l'intégrale du signal à 5,818 δ. Cele signal correspond à un proton et doit donc être normalisé en multipliant par trois. Lors de l' utilisation du BHT, n - 1 des chaînes acyle sont déterminées par l'équation C n-1 = I 2 n-1 / I BHT. Les résultats ne peuvent être exprimées en mg / g parce que le PM de n -1 chaînes acyl est inconnue.
Exemple 3, n -6 / n -3 rapport: Cet indice importante peut être calculé à partir du rapport des intensités normalisées de la résonance à δ 2,77, ce qui correspond aux protons bis-allylique de n -6 chaînes acyle (deux protons) sur le triplet à δ 0,97 qui appartient à n -3 acides gras et correspond à trois protons. La relation est C n-6 / n-3 C = 02/03 I A / I B, où I A et I B sont des intégrales des signauxδ 2,77 à 0,97 et δ, respectivement. n -6 acides gras sont déterminées à partir de la relation C = n-6 3 / 2I n-6 / S, où I n-6 est solidaire des bis-allyliques protons à δ 2,77.
Exemple 4, les acides gras trans: acides gras trans peut être calculée à partir de l'équation C = I trans trans / S, où I est l'intégrale trans du signal à δ 0,91. La présente échantillon contenait 3,07% d'acides gras trans, tel que déterminé par RMN 1 H en utilisant l'instrument de 850 MHz. Le même échantillon analysé dans un instrument à 500 MHz a été trouvé qu'il contenait 3,03% d'acides gras trans.
Exemple 5, les acides gras saturés (SFA): La concentration de SFA peut être calculATED partir de l'équation C = S SFA - C n-3 - C n-6 - C n-9 - C n-1 - C trans. n -9 acides gras (acide oléique principalement) peuvent être quantifiés conformément à l'équation C = N-9 (3/4 Q - 02/03 I n-6) / S, où Q est l'intégrale des protons allyliques de n -6 et -9 à n δ 2,01. La quantité de SFA dans un échantillon d'huile de poisson disponible dans le commerce a été jugée 36,1%. Le même échantillon analysé par 13 C - RMN se révèle contenir 33,8% SFA. SFA représentent un groupe de divers FA (par exemple stéarique et palmitique) avec différents MW et donc leur concentration si l' huile de poisson ne peut pas être exprimée en mg / g.
Exemple 6, stérols totaux: La quantité de stérols totaux (libres et estérifiés) peut être déterminée par le signal des protons méthyle au niveau du carbone 18 qui apparaît à δ 0,68, en utilisant l'équation C = I ste / S. Le rapport molaire des stérols totaux dans un échantillon d'huile de poisson disponibles dans le commerce a été jugée 0,32%. BHT peut également être utilisé pour la détermination de la concentration absolue de stérols. Les principaux stérols dans l'huile de poisson sont le cholestérol et de la vitamine D (ou de son précurseur 7-déhydrocholestérol) et sont souvent ajoutés dans les suppléments. Ces composés ont un poids moléculaire très similaire. Par conséquent, les résultats peuvent être exprimés en mg / g et sont calculées selon l'équation C = 2/3 I STE / I est un × MW STE / m, où MW STE est la masse moléculaire (386) du cholestérol, qui constitue la la majorité de la fraction stérolique dans l' huile de poisson 20. La quantité de stérols dans le même échantillon en utilisant le BHT a été de 3,8 mg / g d'huile de poisson. La détermination individuelle du cholestérol (δ 0,680) et de 7-déhydrocholestérol (δ 0,678) est réalisable sur un instrument de 850 MHz après l'application d'une fonction de fenêtre pour l' amélioration de la résolution.
13 C RMN Analyse
La figure 2 illustre le spectre 13 C - RMN acquis sur (A) de 850 MHz et (B) un instrument de 500 MHz dans la zone carbonyle de carbone. Les deux spectres sont très similaires et peuvent fournir la même quantité d'informations. Le spectre RMN 13 C peut être utilisé avec succès pour l'analyse des acides gras additionnels tels que les acides stéaridonique (SDA) et eicosatétraénoïque (ETA), cependant d' autres analyses sont nécessaires pour les échantillons dans lesquels ces acides sont à des concentrations inférieures. Les 13 spectres de C sont caractérisés par une grande résolution en raison de la grande largeur spectrale et l'application de découplage à large bande, quiélimine l'effet de couplage scalaire et produit singulets. Pour cette raison, il est limité chevauchement même lors de l'utilisation d'un instrument de 500 MHz.
Le 13 spectre RMN C est beaucoup plus informative par rapport au spectre RMN 1 H et peut fournir des données quantitatives plus complètes parce que moins de chevauchement de signal est observé (figures 1 et 2). La région spectrale la plus utile du spectre 13 C est la région du carbone du groupe carbonyle , car il fournit des informations quantitatives pour un grand nombre d'acides gras, ainsi que pour leur distribution de position sur le squelette de glycérol 19, 21, 22. La zone de groupe méthyle de δ 14,5 à 13,5 ô peut être utilisé pour la détermination rapide de la quantité totale de n -3, n -6, -9 et n gras saturésacides (SFA), ainsi que les acides gras trans. Cependant, dans le spectromètre de RMN à 500 MHz, il y a un chevauchement partiel des n -6 et -9 n acides gras saturés (SFA). L'application d'une fonction de fenêtre pour l'amélioration de la résolution peut résoudre ce problème, bien que l'instrument 850 MHz est toujours considéré comme une option plus fiable. La région oléfinique du spectre de carbone peut être utilisé pour la quantité totale de n - 3 et n - 1 des chaînes acyle, ainsi que pour la détermination des acides gras individuels tels que la DHA, EPA, acide arachidonique (AA), linolénique (Ln) n -3, et l' acide oléique (OL) (voir le tableau 2). 13 C RMN peut également être appliquée pour la caractérisation de l' huile de poisson à partir d' autres sources, telles que des suppléments riches en esters éthyliques (EE) en utilisant les signaux de carbone à δ 14,31 (méthyle) et δ 60,20 (méthylène).
Pour une analyse de carbone, les acides gras peuvent être déterminé en divisant l'intégrale des aliphatiques appropriés, oléfinique, et des signaux de carbonyle avec l'intégrale totale de toutes les chaînes acyle, selon la relation générale C = I / S (2), où C est la concentration de l'analyte dans molaire (% ), I est l'intégrale de résonance qui est uniquement attribuable au lipide d'intérêt, et s est l'intégrale totale du signal (s) qui représente la teneur totale en lipides de l'échantillon. L'intégrale totale S des chaînes acyle peut être déterminée par l' intégration de la région de δ 175 à 171 et ô est fixée à 100.
La quantification des acides gras en mg / g d'huile de poisson est réalisée en utilisant un étalon interne , sur la base de la relation suivante: C = I / I est × A × MW / m (3), où C est la concentration de l'analyte dans mg / gde l' huile de poisson, I est l'intégrale de résonance qui est uniquement attribuable au lipide d'intérêt, I IS est la zone d'un signal de carbone qui appartient uniquement à l'étalon interne, A est le nombre de millimoles d'étalon interne, MW est le moléculaire poids du composé d'intérêt (pour les acides gras exprimés en esters de méthyle), et m est la quantité d'huile de poisson en g. Les 13 signaux de C-RMN d'acides gras d'huile de poisson qui peuvent être utilisés à des fins de quantification sont représentés dans le tableau 2, tandis que l'attribution complète de RMN du spectre RMN 13 C peuvent être trouvées ailleurs 19.
Exemple 1, l' EPA à la position sn - 2: La quantité (%) de l' EPA à la position sn -2 est calculé en divisant l'intégrale du signal à δ 172,56 par S. La quantité de l' EPA à la position sn -2 dans une commercially échantillon disponible a été trouvé à 3,4% en utilisant l'instrument 850 MHz. En utilisant le même spectromètre et le BHT comme étalon interne, la quantité de l' EPA à la position sn - 2 exprimée en mg / g d'huile de poisson est 29,73 mg / g. Le même échantillon analysé dans un instrument à 500 MHz a été trouvé qu'il contenait 3,6% ou 31,39 mg / g d'EPA en position sn - 2. Des résultats similaires peuvent être obtenus lorsque le calcul des ratios moléculaires relatifs de l' EPA à sn - 2 en utilisant un spectre entièrement découplée. En effet, le carbone du carbonyle de l'EPA est affectée par le découplage des protons au même degré négligeable que les autres atomes de carbone du carbonyle, qui sont utilisés comme référence. Cependant, des écarts importants sont observés lors de l' utilisation du BHT, parce que le carbone du BHT à δ 151,45, qui est utilisée pour la quantification, recevoir un rehaussement de NOE différent par rapport aux atomes de carbone de carbonyle d'acides gras. Pour cette raison, il faut éviter le spectre totalement découplé lors de l'utilisation des normes internes ou l'intégration carbons avec différentes multiplicités.
Exemple 2, la quantité totale de DHA: La quantité totale (%) de DHA est simplement calculée en ajoutant les quantités de DHA dans sn -1,3 et la position sn - 2 comme déterminé par les signaux de RMN à δ δ 172,48 et 172,08, respectivement. Le même échantillon analysé avec 1 H - RMN (voir l' exemple 1 de 1 analyse H) se révèle contenir 10,3% de DHA selon l' une 13 analyse par RMN C. La quantité de DHA peut également être exprimée en mg / g en utilisant un standard interne et de l'équation 3. La quantité totale de DHA était 103,25 mg / g.
Exemple 3, la quantité totale de SDA: La quantité totale (%) de SDA est déterminée en additionnant les intégrales des signaux à δ δ 172,99 et 172,60 appartenant aux atomes de carbone du carbonyle du SDA sur la position sn -1,3 etsn -2, respectivement, puis en divisant la somme par S. L'échantillon analysé est révélé contenir SDA 3,93% ou 34,54 mg / g.
Exemple 4, n -3 Ln: n -3 Ln (%) peuvent être déterminées en divisant l'intégrale du signal à δ 131,85 avec l'intégrale S. Le rapport molaire de n -3 Ln dans l'échantillon d'huile de poisson analysé était de 0,7%. La concentration absolue en utilisant le BHT a été calculée comme étant de 5,5 mg / g.
Exemple 5, les acides gras trans: Le rapport molaire des acides gras trans est déterminée en divisant l'intégrale du signal à δ 13,80 par S. L'analyse du même échantillon qui a été analysé par RMN 1 H et a été jugée 3,07% de trans FA, a également été analysée par RMN 13 C et sa teneur en acides gras trans est révélé être 3,42%. Til 13 C L' analyse par RMN du même échantillon sur un instrument à 500 MHz a montré une teneur de 3,64% d'acides gras trans. La quantité de trans FA en mmol / g d'huile de poisson peut être déterminée en utilisant BHT comme étalon interne et l'équation C = I / I est × A / m, mais les résultats ne peuvent pas être exprimés en mg / g parce que le pic à δ 13,80 correspond à divers acides gras trans, trans principalement en DHA et EPA trans, avec différents MW.
Exemple 6, EE: La concentration en EE dans un échantillon d'huile de poisson est calculée en divisant l'intégrale de la zone spectrale de δ 60,50 à 60,00 ô, qui correspond aux atomes de carbone du méthylène du EE de divers acides gras, avec S. L'analyse d'un échantillon d'huile de poisson EE a montré qu'il était composé de 100% EE. Il convient de noter que dans les échantillons EE, EPA can est calculée soit par le pic de carbonyle à δ 173,60 ou par le carbone EE de méthylène à δ 60,20, tandis que le DHA peut être calculé en utilisant le signal à δ 60,31 et / ou le signal à δ 173,09.
Une liste complète des signaux de diagnostic qui peuvent être utilisés à des fins de quantification par 13 C et une analyse par H RMN peuvent être trouvées dans les tableaux 1 et 2, respectivement, alors qu'une description détaillée des équations qui peuvent être utilisés pour cette analyse peut être trouvé ailleurs 19.
RMN peut en outre être appliquée à l'évaluation de l'état d'oxydation des suppléments d'huile de poisson. La figure 3 compare les spectres RMN 1 H d'un échantillon d'huile de poisson dans deux conditions d'oxydation; l'exposition au chauffage et à l'exposition aux rayons ultraviolets (UV)lumière. l'oxydation des lipides est un processus complexe, et la composition de produits d'oxydation dépend des conditions d'oxydation. Les principaux produits d'oxydation sont des hydroperoxydes (ô), 8,0 à 8,8 diènes conjugués hydroperoxydes (δ 5.4-6.7), et des aldéhydes (A 9.0- 10).

Figure 1. L'analyse RMN 1 H. 850,23 (A) et 500,20 MHz (B) Spectre 1 H-RMN d'un supplément d'huile de poisson dans une solution de CDCI3. Les signaux de RMN d'EPA et de DHA qui peuvent être utilisées pour leur détermination sont présentés. Le pic à δ 0,97 peut être utilisée pour la détermination de la quantité totale de n -3 acides gras. L'enveloppe à δ 1,39 à 1,20 est coupée, car il fait partie des protons du méthylène de l' ensemble à chaîne grasses et ne peut pas être utilisé à des fins d'identification ou de quantification. Le 1 H spectre de RMN est caractérisée par une largeur spectrale plus étroite (SW) par rapport au spectre RMN 13 C , et donc par une résolution spectrale inférieure. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
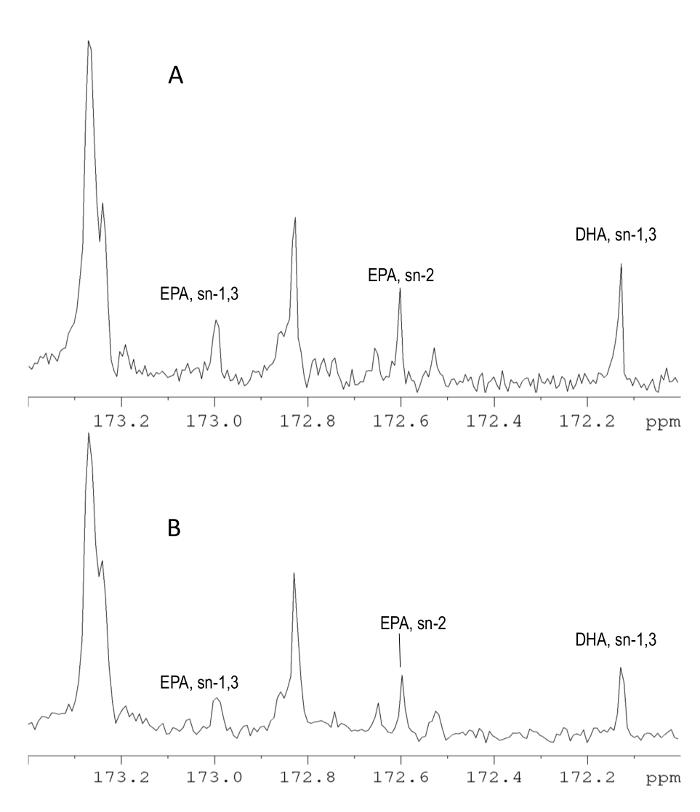
Figure 2. L'analyse 13 C - RMN. 213,81 (A) et 125,77 MHz (B) 13 du spectre C-RMN d'un supplément d'huile de poisson dans une solution de CDCl 3 dans la région du carbone du groupe carbonyle. Les signaux de RMN d'EPA et de DHA sur sn -1,3 et position sn - 2 sont représentés. Ces signaux peuvent être utilisés pour la détermination quantitative de l'EPA et le DHA. Bien que la speCtra enregistré à 213,81 MHz sont caractérisés par une plus haute résolution et la sensibilité, les spectres 125,77 MHz peut également être utilisé pour la détermination des principaux composés. L'application de découplage dans l'expérience 13 C RMN élimine l'effet de couplage scalaire entre les noyaux de carbone et d' hydrogène et ainsi les signaux apparaissent sous forme de singulets rendant l'analyse plus facile par rapport au spectre RMN 1 H. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3. L' oxydation de l' huile de poisson. Le 1 H spectre de RMN de l' huile de poisson oxydé dépend des conditions d'oxydation. Les résonances attribuées aux hydroperoxydes (A) de 8,0 à 8,8, conjugated diènes hydroperoxydes (δ 5.4-6.7) et les aldéhydes sont présentés. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
| δ ppm | Proton | Composé |
| 0,677 | CH 3 (18) | Cholestérol |
| 0,678 | CH 3 (18) | 7-déhydrocholestérol |
| 0,88 | CH 2 CH 3 (t), J ω1, ω2 = 7,27 Hz | n -9, SFA chaînes acyles |
| 0,883 | CH 2 CH 3 (t), J ω1, ω2 = 7,08 Hz | n -6 chaînes acyles |
| 0,911 | CH 2 CH 3 (t), J ω; 1, ω2 = 7,65 Hz | Trans chaînes acyles |
| 0,973 | CH 2 CH 3 (t), J ω1, ω2 = 7,63 Hz | n -3 chaînes acyles |
| 1,25 | CH 2 CH 3 (t), J = 7,20 Hz | esters éthyliques |
| 1,697 | OCOCH2CH 2 (t), J H α, Η β = Hz | chaîne acyle EPA |
| 2,391 | OCOCH 2 CH 2 (t) | chaîne acyle DHA |
| 2,772 | CH = CHCH 2 CH = CH | n -6 chaînes acyles |
| 2,81 | CH = CHCH 2 CH = CH | n -3 chaînes acyles |
| 3,593 | 3'a-CH 2 OCO | Glycerol de 1-MAG |
| 3,722 | 3'a, 3217; b-CH 2 OCO (br) | Glycerol en 1,2-DAG |
| 4,073 | 2'-CHOH (br) | Glycérol de 1,3-DAG |
| 4,121 | CH 2 CH 3 multiplet | esters éthyliques |
| 4,173 | 1'b, 3'b-CH 2 OCO (dd) | Glycérol de 1,3-DAG |
| 4,238 | 1'a-CH 2 OCO (dd) | Glycerol en 1,2-DAG |
| 4,329 | 1'b-CH 2 OCO (dd) | Glycerol en 1,2-DAG |
| 4,989 | -CH = CH 2 cis (dd) | n -1 chaînes acyles |
| 5,052 | -CH = CH 2 trans (dd) | n -1 chaînes acyles |
| 5,082 | 2'-CHOCO | Glycerol en 1,2-DAG |
| 5,268 | 2'; -Choco | Glycérique de TAG |
| 5,436 | CH = CHCH 2 CH = CH 2 | n -1 chaînes acyles |
| 5,818 | -CH = CH 2 | n -1 chaînes acyles |
Tableau 1: L'attribution du spectre RMN 1H. le 1 déplacements chimiques H-RMN de signaux d'acides gras d'huile de poisson qui peuvent être utilisés à des fins de quantification en solution CDCl 3 sont présentés. Les déplacements chimiques sont mesurés en ppm et fournissent des informations sur l'environnement chimique des noyaux.
| δ ppm | Carbone |
| 173,24 | C1 SFA (sn -1,3) |
| 172,21 | C1 LO, LO (sn -1,3) |
| 173,16 | C1 ETA (sn -1,3) |
| 173,13 | C1 DPA (sn -1,3) |
| 173,03 | C1 SDA (sn -1,3) |
| 172,97 | C1 EPA (sn -1,3) |
| 172,73 | C1 ETA (sn -2) |
| 172,69 | C1 DPA (sn -2) |
| 172,61 | C1 SDA (sn -2) |
| 172,56 | C1 EPA (sn -2) |
| 172,48 | C1 DHA (sn -1,3) |
| 172,08 | C1 DHA (sn -2) |
| 136,8 | Cω1, n -1 |
| 131,85 | Cω3 LN |
| 130,37 | AA C15 |
| 130,11 | C9 LN |
| 130,06 | LO C13 |
| 129,54 | C5 DHA sn -2 |
| 129,47 | La -1,3 C5 de DHA |
| 128,94 | C5 EPA |
| 128,76 | C6 EPA |
| 128,45 | C17 n -3 |
| 127,71 | n -3 |
| 127,53 | C4 DHA sn -2 |
| 127,5 | La -1,3 C4 de DHA |
| 126,86 | Cω4, tout n -3 |
| 114,71 | Cω2, n -1 |
| 60,08 | DHA, les esters éthyliques |
| 59,96 | EPA, les esters éthyliques |
| 59,95 à 59,85 | D' autres FA, les esters éthyliques |
| 33,48 | C2 EPA sn -2 |
| 33,32 | La -1,3 de C2 EPA |
| 31,44 | C3 n - 1 |
| 27,05 | Allyliques n -6 |
| 26,49 | La -1,3 de C4 EPA |
| 26,47 | C4 EPA sn -2 |
| 24.6 | C3 EPA |
| 24,48 | C3 SDA sn -1,3 |
| 24,44 | C3 SDA sn -2 |
| 14,27 | Cω1, tout n -3 |
| 14.13 | Cω1, SFA |
| 14.11 | Cω1, OL |
| 14,07 | Cω1, LO |
| 13.8 | Cω1, trans FA |
Tableau 2: L'attribution du spectre 13 C - RMN. Les 13 déplacements chimiques C-RMN de signaux d'acides gras d'huile de poisson qui peuvent être utilisés pour la quantification purposes en solution CDCl 3 sont présentés.
Figure supplémentaire S1: Comparaison entre le 13 C Les spectres de RMN acquis en utilisant la norme de découplage large bande (A) et l'inverse de découplage fermée (B) séquences d'impulsions. Les spectres ont été enregistrés pour le même échantillon avec le même nombre de balayages, traitées avec les mêmes paramètres de traitement et sont présentés avec le même facteur d'échelle. S'il vous plaît cliquer ici pour télécharger ce chiffre.
Discussion
Modifications et stratégies de dépannage
Qualité spectrale. La largeur de raie du signal RMN et donc la résolution du spectre RMN est fortement dépendante de calage, qui est un procédé pour l'optimisation de l'homogénéité du champ magnétique. Pour une analyse de routine, 1D est shimming n'est pas nécessaire et suffisante d'une 3D shimming, étant donné qu'il est réalisé par le personnel de RMN sur une base régulière. Si cela est le cas, il faut effectuer un calage 3D avant l'analyse en utilisant un échantillon contenant 0,6 ml de H 2 O: D 2 O (90:10). Pour obtenir un meilleur et plus rapide calage, l'échantillon doit être centré dans la région d'excitation / détection de la bobine de fréquence radio (RF), en utilisant la jauge de profondeur graduée, avant qu'il ne soit placé dans l'alésage de l'aimant. Un autre facteur qui affecte calage tourne l'échantillon à une vitesse de rotation de 10 à 20 Hz. Bien que le filage de l'échantillon à cette vitesse de rotation permet d'améliorer les cales radiales (X, Y, XY, XZ, YZ, X 2 -Y 2, etc.), il est généralement pas recommandé afin d'éviter l'apparition de bandes latérales filature de premier ordre ou plus. Cependant, lorsque l'on travaille sur les instruments qui fonctionnent à Larmor des fréquences inférieures à 400 MHz, le filage est recommandé pour les expériences 1D RMN.
Résolution, ainsi que la sensibilité, sont affectées par le gain du récepteur (rg) de valeur. De faibles valeurs du gain du récepteur réduire la sensibilité, tandis que des valeurs supérieures à débordement cause appropriée du convertisseur analogique-numérique (ADC). Résultats de dépassement ADC en ligne et les formes non symétriques signaux ne peuvent pas être utilisés à des fins quantitatives parce que les premiers points de la précession libre (FID) peuvent être perdues. Dans la plupart des cas, la commande « RGA » calcule une valeur rg appropriée. Cependant, dans certains cas, la valeur rg calculée par le logiciel est supérieure à la valeur idéale et il y a une distorsion dans la forme Lorentzienne du signal RMN. Dansun tel cas, l'utilisateur devra une plus petite valeur de rg entrée manuellement en tapant « rg (valeur) » dans la ligne de commande. Une valeur typique de RG pour les échantillons analysés avec ce protocole est de 8.
Souvent, lorsqu'on utilise refroidi cryogéniquement sondes RMN avec un haut facteur de qualité (facteur Q), un grand retard (temps mort)> 200US entre la dernière impulsion et la période de détection est nécessaire pour éviter les artefacts tels qu'une bosse autour de la fréquence de l'émetteur et un roulement dans la ligne de base du spectre. Cependant, un tel retard provoque une grande erreur de phase de premier ordre négatif, qui peut également introduire un roulement de base et les grands creux autour de la base des signaux forts. Dans ces cas, une séquence d'impulsions d'écho de spin restauré z peut être utilisé pour produire des spectres de RMN avec des lignes de base sensiblement améliorées, même si une petite réduction de la sensibilité peut se produire 23.
Phospholipides. En plus de l'analyse de l'huile de poissondes échantillons riches en triglycérides et les esters d'éthyle, de RMN peuvent être utilisées pour l'analyse d'échantillons d'huile de poisson riche en phospholipides (PL). Cependant, une attention particulière est nécessaire pour ces échantillons, car les agrégats de forme Pls, ce qui peut provoquer une réduction significative de la résolution spectrale et la sensibilité. Pour l'analyse de ces échantillons, un mélange solvant de chloroforme deutérié: methanol (CDCl 3: CD 3 OD) dans un rapport de 70:30 est nécessaire pour obtenir des spectres de haute qualité.
Standard interne. BHT a été choisi comme étalon interne dans cette étude car il est une molécule hautement symétrique par simple , 1 H et 13 C Les spectres RMN et aucun de ses pics se chevauchent avec celles de constituants d'huile de poisson. BHT a un signal dans le spectre de RMN H 1, qui apparaît comme un singulet à 6,97 δ et fait partie des deux protons aromatiques équivalents (para - position par rapport au groupe OH) et un signal àδ 151,45 dans le spectre RMN 13 C qui appartient à l'atome de carbone quaternaire aromatique portant le groupe -OH. Ces deux signaux ont pas de chevauchement avec l'un des constituants dans l'huile de poisson, et peuvent donc être utilisés à des fins de quantification. D' autres composés tels que le 1,2,4,5-tétrachloro-3-nitrobenzène (TCNB) ou le chlorure d'éthylène peuvent également être utilisées comme étalons internes alternatives, cependant, ils sont caractérisés par des valeurs T 1 plus longues.
Limites de la technique
La quantification de divers acides gras et des lipides dans les suppléments d'huile de poisson est obtenue par intégration des signaux de RMN de diagnostic appropriés dans les spectres 1D. Ces signaux doivent appartenir uniquement à un composant d'échantillon spécifique et doivent avoir aucune interférence avec les signaux provenant d'autres composés. Cela peut être un problème pour une analyse RMN H puisque le spectre RMN 1 H est caractérisé par une faible résolution en raison de la courte distance de chechangements. miques En outre, la présence d' un couplage scalaire (J) produit multiplets et rend l'analyse plus complexe. Par exemple, les esters éthyliques (EE) peuvent être quantifiés en utilisant RMN 1 H par le triplet caractéristique (J = 7,20 Hz) , du groupe méthyle à δ 1,25 et le multiplet à δ 4,12, qui appartient aux protons de méthylène du groupe ester. Cependant, lors de l' utilisation des instruments de RMN fonctionnant à Larmor des fréquences inférieures à 850 MHz, l'analyse de l' EE en utilisant 1 doit être évitée H RMN à cause de la superposition partielle du pic à δ 4,12 avec le pic à δ 4,14 de TG, et le chevauchement de le signal à δ 1,25 avec le signal large des protons de méthylène aliphatiques à δ 1,23 à 1,35. Les grands écarts ont également été observées entre le 1 H et 13 C analyse de l' EPA dans certains échantillons, 13 C - RMN était plus proche de la composition marquée fournies par til fabricant. Ceci est probablement dû au chevauchement du signal à δ 1,69, qui est utilisé pour l' analyse de l' EPA, avec des signaux d'autres composés qui apparaissent dans certains types de suppléments d'huile de poisson. D'autres erreurs dans quantifications peuvent survenir lors de l'utilisation d'un étalon interne en raison de la pureté incertaine de la norme interne et d'erreurs de pesée.
L'analyse de la composition peut être exprimée en concentrations molaires relatives sans l'utilisation d'un étalon interne. Si les résultats doivent être exprimés en concentrations absolues, par exemple en milligramme de l'acide gras par gramme d'huile (mg / g), l'utilisation d'un étalon interne est nécessaire. Cependant, dans les cas où le signal de RMN d'intérêt appartient à plusieurs composés ayant des poids moléculaires différents, les résultats ne peuvent pas être exprimés en mg / g, même en utilisant un étalon interne. De plus, l'utilisation de la norme interne augmente généralement la durée de l'analyse en raison de la plus interne commune ormes, tels que BHT, sont de petites molécules à forte symétrie moléculaire, ce qui conduit à de longs temps de relaxation. Depuis le temps de répétition (délai entre les impulsions + temps d'acquisition) est réglée en fonction du T 1 temps de relaxation la plus longue dans l'échantillon, l'utilisation d'un étalon interne augmentera la durée des expériences que des délais plus longs entre les impulsions sont nécessaires. Ceci est un facteur particulièrement important pour 13 l' analyse RMN C en raison du temps de relaxation T 1 exceptionnellement longue des noyaux de carbone. L'addition d'un composé paramagnétique tel que le Cr (acac) 3 peut réduire efficacement le temps de relaxation T 1. La concentration recommandée de Cr (acac) 3 est de 0,75 mg / ml de solution. Des concentrations plus élevées de Cr (acac) 3 peuvent être considérés pour une réduction supplémentaire de T 1, cependant, la prudence est nécessaire afin d'éviter une diminution du rapport S / N du fait de l'élargissement de la ligne.
ntent "> Bien que le 13 C - RMN se caractérise par une résolution spectrale beaucoup plus élevé par rapport à 1 H, la sensibilité du 13 C expérience de RMN est nettement plus faible en raison de la faible abondance naturelle (1,1%) et la faible rapport gyromagnétique (67,26 10 6 rad s -1 T -1) de 13 noyaux C. En outre, les longues T 1 temps de relaxation de 13 C augmentent la durée de l'analyse. Cela peut être un problème lorsque l'huile disponible pour l' analyse est limitée, car une augmentation nombre de balayages doit être utilisé pour obtenir un signal raisonnable par rapport au bruit.Les limites de la sensibilité et la résolution des spectres RMN empêchent l'analyse de nombreux composés mineurs dans l'huile de poisson qui peuvent être analysés avec d'autres techniques telles que la GC. Par exemple, une Η RMN est incapable de séparer les stérols individuels ou des acides gras (par exemple, palmitique et stéarique) , tandis que 13 Cne sont pas en mesure de déterminer les composés qui apparaissent à très faible concentration dans l' huile de poisson tels que l' acide dodécanoïque et myristique, qui se chevauchent avec les signaux de tous les acides gras saturés à δ δ 173,24 et 172,82. Bien que l'augmentation de la quantité d'échantillon qui est analysé fait l'analyse de certains composés mineurs possibles, la prudence est nécessaire pour les échantillons très concentrés, en raison de leur viscosité accrue. Des solutions très visqueuses contenant plus de 150 mg d'huile doit être évitée , car il y a une diminution du rapport S / N du fait de l'élargissement de la ligne provoquée par les T spin-spin réduite 2 temps de relaxation. En outre, des délais plus longs entre les impulsions sont nécessaires en raison de la plus T 1 et il y a plusieurs questions en calant et donc dans la résolution.
Tous les composés analysés dans l'huile de poisson avec de RMN peuvent être quantifiés simultanément dans un instantané sans utiliser aucune étape de séparation ou de purification. L'une RMNalyse est rapide que le spectre 1 H peut être enregistrée en moins d'une minute, alors que le 13 C - RMN acquisition dure 10 min. Il convient de noter, toutefois, qu'il ya quelques facteurs qui influent sur le temps d'acquisition de données. Plus précisément, pour 13 C - RMN, le temps de fonctionnement de 10 minutes ne peut être réalisée sans l'utilisation d'étalons internes, et l'utilisation de sondes refroidies cryogéniquement, dans lequel la bobine RF et le préamplificateur sont refroidis et donc le bruit thermique est réduite au minimum. Une augmentation d'un facteur 10 à 15 dans le temps expérimental doit être prévu pour 13 l' analyse RMN C lorsque la température ambiante sondes (classiques) sont utilisés.
Signification par rapport aux méthodes existantes
La spectroscopie RMN a prouvé être un outil puissant pour la détermination qualitative et quantitative de la composition des suppléments d'huile de poisson, et en raison de son rapidness il a le potentiel à appliquer pour le criblage à haut débit d'un vaste nu mbre d'échantillons d'huile de poisson. spectroscopie RMN est par définition une méthode quantitative depuis la zone de signal est directement proportionnelle au nombre de noyaux qui provoquent le signal. Bien que les produits chimiques très toxiques sont nécessaires pour préparer des échantillons de RMN, ce procédé est respectueux de l' environnement parce que de telles petites quantités de ce chimiques (par exemple , CDCl3) sont utilisés , par opposition à d' autres méthodes qui nécessitent de grandes quantités de solvant pour éluer les échantillons. En outre, la RMN présente plusieurs avantages par rapport à d'autres méthodes d'analyse. Aucun étalonnage des normes est nécessaire avant l'analyse, et une préparation minimale de l'échantillon sans étapes de séparation et de purification est généralement adoptée, ce qui rend RMN un outil d'analyse très rapide. En outre, 13 C - RMN est la meilleure méthode disponible pour déterminer la distribution de position des différents acides gras sur le squelette de glycérol. Bien que l'hydrolyse enzymatique a été utilisé comme une solution de rechange ne sont pas toujours fiables= "xref"> 24. Ceci est d' une importance particulière , car il y a un grand intérêt pour l' étude de la régiospécificité de différents acides gras dans les aliments, comme il a été constaté que cela affecte leur fonction dans l' alimentation humaine 25, 26.
Applications futures
En dépit de l'accord entre l'analyse RMN et l'étiquette des produits, ainsi que le fait qu'il ya des études MONTRANT entre GC et RMN, nous pensons que les études interlaboratoires plus rigoureuses et complètes sont nécessaires pour examiner l'accord entre RMN et traditionnel méthodologies pour l'analyse des constituants d'huile de poisson en utilisant un plus grand nombre d'échantillons, des produits d'huile de poisson de différentes origines et des solutions étalons certifiés.
Une autre application future importante de la RMN dans l'analyse de l'huile de poisson sera la détermination des produits d'oxydation. En plus de la déterminationdes composés majeurs dans l'huile de poisson, plusieurs produits d'oxydation primaire et secondaire dans l'huile de poisson, tels que des aldéhydes et des peroxydes, sont présents. RMN 1 H peut être éventuellement appliqué pour l'évaluation de l'état d'oxydation dans les suppléments d'huile de poisson, dans différentes conditions d'oxydation, comme représenté sur la figure 3. Le plus grand défi dans cette analyse sera la mission de RMN et l'identification des produits d'oxydation individuels. Les progrès de la sensibilité du matériel de RMN également permettre l'identification des stérols individuels en utilisant 13 C RMN. La spectroscopie RMN peut également être appliquée pour l'analyse des tissus de poissons dans son ensemble, même sans extraction en utilisant haute résolution magique Angle Spinning (HR-MAS) RMN.
Étapes critiques au sein du Protocole
Deux des étapes les plus critiques qui affectent la précision des spectres de RMN quantitative impliquent la sélection d'une impulsion à 90 ° et l'utilisation d'un retard entre puGE ≥ 5 x T 1. L'angle d'impulsion est proportionnelle à la largeur d'impulsion qui est un paramètre RMN calibré qui dépend de l'instrumentation et l'échantillon. Une impulsion de 90 ° est essentiel pour la conversion complète de l'aimantation longitudinale (z) de l'aimantation transversale observable (xy). Il est important de noter que, avant l'étalonnage d'impulsion, la RMN sondé doit être bien réglé et adapté. Cela permettra d'optimiser le transfert de la puissance RF à l'échantillon et ainsi maximiser S / N et assurer un découplage efficace. Le réglage de la sonde est principalement influencée par la constante diélectrique de l'échantillon, de sorte que s'il y a des différences dans la concentration entre les échantillons, répéter le processus de réglage pour chacun d'eux. L'expérience 1D 13 C RMN implique à la fois 13 C et 1 H canaux de sorte réglage automatique et l' appariement est nécessaire pour les deux noyaux.
Un retard entre les impulsions de plus de 5 x T 1 assure la complète recovery de l'aimantation nette de sa valeur initiale. Si toutes les résonances dans le spectre ne sont pas complètement détendu avant chaque impulsion, le signal est partiellement supprimée et cela conduit à des inexactitudes dans l'intégration. T 1 est la valeur d' un facteur critique qui affecte la durée de l'expérience et il dépend de l'intensité du champ magnétique ainsi que la viscosité de l'échantillon. Étant donné que la viscosité entre les échantillons est similaire, les temps de relaxation T 1 doivent être déterminées pour chaque instrument seulement au début de la session d'analyse.
Une autre caractéristique importante de l'analyse de l' huile de poisson avec 13 C - RMN est la sélection de la séquence d'impulsions appropriée. La méthode la plus fiable pour l' analyse quantitative de 13 C est le test inverse de découplage fermée, où un découplage de protons à large bande est appliqué seulement pendant la période d'acquisition et par conséquent il n'y a pas de transfert de polarisation à partir de 1 H à 13C par l'effet Overhauser nucléaire (NOE). Cependant, bien que peut être utilisé à des fins quantitatives, il faut être prudent lorsqu'on utilise cette expérience car il existe différents facteurs de NOE entre les atomes de carbone avec différentes multiplicités et comparaison donc solidaire entre les groupes méthyle, méthylène, le méthane et les carbones carbonyle doivent être évitées l'expérience RMN entièrement découplée. Malgré cela, lorsque seuls carbones de multiplicité similaires et l'environnement chimique sont pris en compte dans l'analyse, la méthode entièrement découplée est fiable. Un exemple est carbones carbonyle d'acides gras qui ont été trouvés pour avoir aucune différence significative dans les facteurs NOE après le découplage 27. En outre, pour carbones porteurs de protons, l'expérience totalement découplée fournit une sensibilité plus élevée en raison de la contribution NOE sur l'intensité du signal de RMN. Une comparaison entre les spectres acquis avec les deux séquences d'impulsions est représenté sur la Figure S1.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par les aliments pour thème Découverte de la santé à l'Ohio State University et le Département des sciences de l'alimentation et de la technologie à l'Ohio State University. Les auteurs tiennent à remercier l'installation de RMN à l'Ohio State University et l'installation de RMN à l'Université Penn State.
matériels
| Name | Company | Catalog Number | Comments |
| Avance III 850 NMR instrument | Bruker | ||
| Avance III 500 NMR instrument | Bruker | ||
| TCI 5 mm probe | Bruker | Helium cooled inverse (proton deetected) NMR probe featuring three independent channels (1H, 13C, 15N) | |
| BBO prodigy 5 mm probe | Bruker | Nitrogen cooled observe (X-nuclei detected) probe, featuring two channels; one for 1H and 19F detectionand one for X-nuclei (covering from 15N to 31P) | |
| Spinner turbin | Bruker | NMR spinners are made by polymer materials and they have a rubber o-ring to hold the NMR tube securely in place | |
| Topspin 3.5 | Bruker | ||
| deuterated chloroform | Sigma-Aldrich | 865-49-6 | 99.8 atom % D, contains 0.03 TMS |
| 2,6-Di-tert-butyl-4-methylphenol | Sigma-Aldrich | 128-37-0 | purity >99% |
| Fish oil samples | |||
| NMR tubes | New Era | NE-RG5-7 | 5mm OD Routine “R” Series NMR Sample Tube |
| BSMS | Bruker | Bruker Systems Management System; control system device |
Références
- Simopoulos, A. P. The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomed. Pharmacother. 56 (8), 365-379 (2002).
- Goodnight, S. H. Jr, Harris, W. S., Connor, W. E. The effects of dietary omega 3 fatty acids on platelet composition and function in man: a prospective, controlled study. Blood. 58 (5), 880-885 (1981).
- Harper, C., Jacobsen, T. Usefulness of omega-3 fatty acids and the prevention of coronary heart disease. Am. J. Cardiol. 96 (11), 1521-1529 (2005).
- Kremer, J. M., et al. Effects of high-dose fish oil on rheumatoid arthritis after stopping nonsteroidal antiinflammatory drugs. Clinical and immune correlates. Arthritis and Rheumatol. 38 (8), 1107-1114 (1995).
- Malasanos, T., Stackpoole, P. Biological effects of omega-3 fatty acids in diabetes mellitus. Diabetes Care. 14, 1160-1179 (1991).
- Han, Y., Wen, Q., Chen, Z., Li, P. Review of Methods Used for Microalgal Lipid-Content Analysis. Energ. Procedia. 12, 944-950 (2011).
- Guillén, M., Ruiz, A. 1H nuclear magnetic resonance as a fast tool for determining the composition of acyl chains in acylglycerol mixtures. Eur. J. Lipid Sci. Technol. 105, 502-507 (2003).
- Sacchi, R., Medina, I., Aubourg, S. P., Addeo, F., Paolillo, L. Proton nuclear magnetic resonance rapid and structure specific determination of ω-3 polyunsaturated fatty acids in fish lipids. J. Am Oil Chem Soc. 70, 225-228 (1993).
- Igarashi, T., Aursand, M., Hirata, Y., Gribbestad, I. S., Wada, S., Nonaka, M. Nondestructive quantitative acid and n-3 fatty acids in fish oils by high-resolution 1H nuclear magnetic resonance spectroscopy. J. Am. Oil Chem. Soc. 77, 737-748 (2000).
- Plans, M., Wenstrup, M., Saona, L. Application of Infrared Spectroscopy for Characterization Dietary Omega-3 Oil Supplements. J. Am. Oil Chem. Soc. 92, 957-966 (2015).
- Jian-hua, C. I. A. Near-infrared Spectrum Detection of Fish Oil DHA Content Based on Empirical Mode Decomposition and Independent Component Analysis. J Food Nutr Res. 2 (2), 62-68 (2014).
- Millen, A. E., Dodd, K. W., Subar, A. F. Use of vitamin, mineral, nonvitamin, and nonmineral supplements in the United States: The 1987, 1992, and 2000 National Health Interview Survey results. J. of Am. Diet Assoc. 104 (6), 942-950 (2004).
- Dwyer, J. T., et al. Progress in developing analytical and label-based dietary supplement databases at the NIH office of dietary supplements. J. Food Compos. Anal. 21, S83-S93 (2008).
- Monakhova, Y. B., Ruge, I., Kuballa, T., Lerch, C., Lachenmeier, D. W. Rapid determination of coenzyme Q10 in food supplements using 1H NMR spectroscopy. Int. J. Vitam. Nutr. Res. 83 (1), 67-72 (2013).
- Monakhova, Y. B., et al. Standardless 1H NMR determination of pharmacologically active substances in dietary supplements and medicines that have been illegally traded over the internet. Drug Test. Anal. 5 (6), 400-411 (2013).
- Berger, S., Braun, S. 200 and more NMR experiments: a practical course. , Wiley-VCH. Weinheim. (2004).
- Knothe, G., Kenar, J. A. Determination of the fatty acid profile by 1H-NMRspectroscopy. Eur. J. Lipid Sci. Technol. 106, 88-96 (2004).
- Sacchi, R., Medina, J. I., Aubourg, S. P., Paolillo, I. G. L., Addeo, F. Quantitative High-Resolution 13C NMR Analysis of Lipids Extracted from the White Muscle of Atlantic Tuna (Thunnus alalunga). J. Agric. Food Chem. 41 (8), 1247-1253 (1993).
- Dais, P., Misiak, M., Hatzakis, E. Analysis of marine dietary supplements using NMR spectroscopy. Anal. Methods. 7 (12), 5226-5238 (2015).
- Pickova, J., Dutta, P. C. Cholesterol Oxidation in Some Processed Fish Products. J. Anal. Oil Chem. Soc. 80 (10), 993-996 (2003).
- Siddiqui, N., Sim, J., Silwood, C. J. L., Toms, H., Iles, R. A., Grootveld, M. Multicomponent analysis of encapsulated marine oil supplements using high-resolution 1H and 13C NMR techniques. J. of Lipid Rsrch. 44 (12), 2406-2427 (2003).
- Sua´rez, E. R., Mugford, P. F., Rolle, A. J., Burton, I. W., Walter, J. A., Kralovec, J. A. 13C-NMR Regioisomeric Analysis of EPA and DHA in Fish Oil Derived Triacylglycerol Concentrates. J. Am. Oil Chem. Soc. 87, 1425-1433 (2010).
- Youlin, X. A., Moran, S., Nikonowiczband, E. P., Gao, X. Z-restored spin-echo 13C 1D spectrum of straight baseline free of hump, dip and roll. Magn. Reson. Chem. 46, 432-435 (2008).
- Tengku-Rozaina, T. M., Birch, E. J. Positional distribution of fatty acids on hoki and tuna oil triglycerides by pancreatic lipase and 13C NMR analysis. Eur. J. Lipid Sci. Technol. 116 (3), 272-281 (2014).
- Berry, S. E. E. Triacylglycerol structure and interesterification of palmitic and stearic acid-rich fats:An overview and implications for cardiovascular disease. Nutr. Res. Rev. 22 (1), 3-17 (2009).
- Hunter, J. E. Studies on effects of dietary fatty acids as related to their position on triglycerides. Lipids. 36, 655-668 (2001).
- Vlahov, G. Regiospecific analysis of natural mixtures of triglycerides using quantitative 13C nuclear magnetic resonance of acyl chain carbonyl carbons. Magnetic Res. in Chem. 36, 359-362 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon