Method Article
核磁共振作为鱼油补充剂的血脂的快速评价一个强大的工具
摘要
这里,高分辨率1 H和13 C核磁共振(NMR)光谱被用作包封的鱼油补充剂的定量和定性分析的快速和可靠的工具。
摘要
西方饮食同n-3脂肪酸差,因此建议鱼油补充剂的消费,以增加这些必需营养素的摄入量。这个工作的目的是利用高分辨率1个 H和13利用两个不同的NMR仪器C NMR光谱法证实包封的鱼油补充剂的定性和定量分析;一个500兆赫和850兆赫的仪器。两个质子(1个 H)和碳(13 C)NMR谱可用于定量测定鱼油补充剂的主要成分。在鱼油补充剂脂质的定量是通过适当的NMR信号的积分在相关1D光谱来实现。通过1 H和13 C NMR得到的结果彼此一致,尽管在两个核和两个仪器之间的分辨率和灵敏度的差异。 1 H-NMR报价SA的快速分析相比13 C NMR,作为频谱可被记录在小于1分钟,而相比之下,13点 C NMR分析,它从10分钟持续到一小时。 13 C NMR谱,然而,更加丰富。它可以用于单个脂肪酸更大数量提供定量数据,并可以被用于确定在甘油骨架的脂肪酸的位置分布。两者的核可以提供仅在一个实验中的定量信息,而无需纯化或分离步骤。的磁场的强度主要影响:1个 H NMR谱由于相对于13 C NMR其较低的分辨率,但是,即使是更低的成本NMR仪器可以有效地应用为食品工业和质量控制实验室的标准方法。
引言
在饮食Ñ-3脂肪酸的消费已被证明是对几个条件有利如心脏疾病1,2,3,炎性疾病4和糖尿病5。西方饮食被认为是穷人的N-3脂肪酸,因此建议鱼油补充剂的消费,提高n个 -6 / N -3平衡消费者的营养1。尽管鱼油补充剂的消费,最近越来越多,问题仍然是关于安全性,真实性,以及一些产品的质量。鱼油补充剂的快速和准确的成分分析是必不可少的,以正确评估这些商业产品的质量,保证消费者的安全。
鱼油补充评估的最常见方法s为气相色谱法(GC)和红外光谱(IR)。虽然这些都是高度敏感的方法,他们从几个缺点遭受6。 GC分析是因为单独的化合物的分离和衍生化,需要7和分析8,9期间可能发生的脂质氧化耗时(4-8小时)。虽然IR光谱可以是定量,需要一个预测模型,使用偏最小二乘回归(PLSR)构造,但也有例外,其中IR带可以归因于一个单一的化合物10。 PLSR需要大量的样品,从而增加了分析11的时间的分析。出于这个原因,存在的新的分析方法,使大量的鱼油样品的准确,快速分析发展的越来越大的兴趣。组织,如OFFI在健康(NIH)和美国食品和药物管理局(FDA)全国学院膳食补充剂(ODS)的CE与官方分析化学师协会(AOAC)合作开发这些新方法12,13。
一个用于筛选和多组分基质,如膳食补充品的评价最有前途的分析方法,是核磁共振(NMR)光谱14,15。 NMR光谱法有几个优点:它是一种非破坏性的和定量技术,它需要极少的无样品制备,并且其特征在于优良的精确度和再现性。此外,NMR光谱是一种环境友好的方法,因为它仅使用少量的溶剂。 NMR光谱法的主要缺点是其相对低的灵敏度相比其他analytiCAL方法,但是,例如更强的磁场,各种直径的低温探针,先进的数据处理,和通用的脉冲序列和技术在仪表最近的技术进步增加了灵敏度高达nM范围内。虽然核磁共振仪器是成本高,核磁共振波谱仪的长寿命和NMR的许多应用降低了分析的,从长远来看成本。这个详细的视频协议的目的是帮助本领域从业者新避免与1个 H和13个 C NMR光谱分析鱼油补充剂的相关联的缺陷。
研究方案
1. NMR样品制备
注意:注意,使用前请咨询所有相关的材料安全数据表(MSDS)。在样品制备中使用的氘代氯仿(CDCL 3)是有毒的。进行样品制备,包括使用通风橱和个人保护设备的时,请使用所有的适当的安全实践(安全眼镜,手套,实验室外套,全长裤,封闭趾鞋)。
- 1个 H和13个 C样品的制备
- 用注射器从膳食胶囊提取鱼油的120μL(〜110毫克),并将其放置在一个4姆·格拉斯小瓶中。记录鱼油的重量。
- 溶样
- 溶解约120μL鱼油中含有被用作1 H和13角 C化学位移的参考四甲基硅烷(TMS)的0.01%CDCL 3的500μL。
注:TMS是使用ð仅化学位移校准(见步骤编号2.2.1.2.7和2.2.2.2.7),而不是定量(见步骤编号2.2.1.3和2.2.2.3)的目的。 - 制备2,6- 二叔丁基-4-甲基苯酚(BHT)的储备溶液中,如果量化以mg / g的需要,通过将BHT的约220毫克和15毫克铬(III),乙酰丙酮的(铬( ACAC)3)在20ml CDCL 3的含TMS的0.01%。使用储备溶液的500微升溶解100毫克(±10毫克)的鱼油。
- 溶解约120μL鱼油中含有被用作1 H和13角 C化学位移的参考四甲基硅烷(TMS)的0.01%CDCL 3的500μL。
- 油(这需要几秒钟)溶解后,转移所有的溶液直接进入一个高品质5毫米NMR管和附连的盖。制备样品之后分析24个小时内的样本。
2. NMR仪器制备
注:注意,提防强磁场的通过NMR仪器产生的存在可以影响医疗器械并实现了一套蚁如起搏器和外科假体,以及电子项目,如信用卡,手表等时使用非屏蔽磁体所执行的分析的附加警告是必需的。两个NMR仪器被用于获取1 H和13 C NMR谱的;分光计在850.23 MHz和213.81 MHz的分别用于1 H和13个 C核,操作,装配有三重共振氦冷却逆(TCI)5毫米探针和光谱仪在500.20 MHz和125.77 MHz的1 H和13 C操作核,分别配备有观察到宽波段(BBO)氮冷却5毫米探针。 (见材料列表),在25±0.1ºC进行所有实验和光谱通过一个标准的NMR数据分析采集和处理软件程序包进行处理。
- 用于获取NMR谱制备
注:1 H和13 C NMR谱可以在不从仪器中取出样品因此获得的。- 插入NMR管插入一个微调涡轮机(参见材料列表)。
- 放置旋转器和一个分级深度计的顶部的管,轻轻地按压管的顶部,直至其底部接触轨距的底部。
- 放置NMR样品中SampleCase的打开位置。注意样品被放置在槽号。
- 加载在NMR样品,返回到控制计算机和类型"SX#",其中#是在SampleCase保持你的样品槽中。
- 等待CDCL 3的氘信号出现在锁定窗口画面上。如果没有自动出现,键入"lockdisp"。一旦氘信号是可见的,类型的命令行上的"锁定",并且为了使用CDCL 3氘共振锁定样品从溶剂的列表中选择"CDCL 3"。
注:氘小号如果先前的用户所使用的不同的溶剂ignal可能不会出现。用户应该等待该样品是向下的指标,然后锁定。 - 键入"bsmsdisp"在命令行中,以确保纺纱不活跃。如果"旋转"按钮为绿色,单击它停用纺纱。
- 键入"新建"命令来创建一个新的数据集。该数据在"名称"选项卡,在"EXPNO"选项卡中的实验数设置输入一个名称。在"PROCNO"选项卡使用数字"1"。在"实验"选项卡,点击"选择",然后选择"质子"参数文件。写实验的标题在"标题"选项卡。点击"确定"。
- 在命令行键入"getprosol",以获得用于当前NMR探针和溶剂的标准参数。
- 重复步骤2.1.7 13 C,选择"C13IG"脉冲序列中的"实验"标签用于1D的13 C逆克ated分离实验。
- 在命令行键入"getprosol",以获得用于当前NMR探针和溶剂的标准参数。
- 键入命令"灵魂"来执行自动调谐和探针的匹配为碳和质子核。
- 用于NMR信号进行一维梯度匀场实现高度均匀的磁场,并且因此最佳线形状。
- 使用标准的自动过程来1D匀场,简单地通过顺序地执行这些命令"曲topshim 1dfast SS","曲topshim tuneb SS",并且在命令行上"去topshim报告"。
- 参数优化
- 的90°脉冲校准
- 创建1小时(见2.1.7步骤和2.1.8)新的数据集。
- 在命令行上的命令"paropt"开始自动化程序用于校准90°PULSE。选择脉冲持续时间,P1,作为参数进行修改。
- 开始"2"作为微秒p1的初始值,输入"2"μs的增量,并执行"16"的实验。
- 创建一个新的数据的13 C设置(见步骤2.1.9)并重复此过程13个 C核(参见步骤2.2.1.2和2.2.1.3)。
- 通过零位法16 1小时测量的T 1个测量
注:空方法使用反转恢复脉冲序列,由延迟(TAU)由180°脉冲的后续的,以允许松弛沿着z轴和最终的90°脉冲,其产生可观察到的横向磁化。- 创建1小时(见2.1.7步骤和2.1.8)新的数据集。
- 输入"PULPROG t1ir1d"脉冲序列改变到反转恢复实验。
- 输入在comman以下命令d线的设置以ppm光谱宽度,RF发射器的中心,扫描伪扫描的次数和数据点"SW 8"的数量,"O1P 3.8","NS 2","DS的数量2" 和 "TD 64K"。
- 类型"P1(值)",并作为由脉冲校准确定为90°脉冲输入持续时间值(见步骤2.2.1),并输入"P2(值)"为180°脉冲(对于180°的持续时间值脉冲是90°脉冲持续时间乘以二)。
- 通过键入"D1 10"循环延迟设置为一个非常大的值,如10秒。
- 通过在命令行键入"D7 10ms的"设定的tau到短值,如10毫秒。
- 设置使用命令"RGA"为RG的自动计算接收机增益(RG)到适当的值。
- 通过键入命令"ZG"运行的频谱。
- 通过键入"EFP"执行傅立叶变换在命令行。
- 通过在命令行键入命令"APK"执行自动相位校正。如果需要额外的相位调整,以进一步提高频谱,点击中的"进程选项卡",然后单击"调节相位"图标进入相位校正模式。
- 通过拖动鼠标,直到所有的信号在负吸收模式使用零阶(0)和一阶(1)的相位校正的图标。申请并通过点击"返回并保存"按钮退出相位校正模式保存相位修正值。
- 增加的tau,直到所有的峰是正或零化通过重复步骤2.2.2.6-2.2.2.9。为了确定T 1值,简单地划分在峰值零化与LN2的tau蛋白值。
- 通过零位法16 13℃下测定T 1个测量
- 创建一个新的数据对13 C中(参见步骤2.1.9)
- 类型"PULPROG t1irpg"改变脉冲序列的反转恢复实验碳核。
- 在命令行设置以ppm光谱宽度,RF发射器的中心,扫描的次数,虚设扫描次数和数据点的数量上的以下命令:"SW 200","O1P 98" , "NS 8", "DS 2" 和 "TD 64K"。
- 类型"P1(值)",并作为由脉冲校准确定为90°脉冲输入持续时间值(见步骤2.2.1)和类型"P2(值)"为180°脉冲(持续时间值是90°脉冲持续时间乘以二)。
- 通过键入"D1 100"循环延迟设置为一个非常大的值,如100秒。
- 集的tau到短值,如100毫秒通过在命令行键入"D7 100毫秒"。
- 设置接收地ER增益(RG)到适当的值使用命令"RGA"为RG的自动计算。
- 通过键入命令"ZG"运行的频谱。
- 通过在命令行中键入"EFP"执行傅立叶变换。
- 通过在命令行中输入命令"APK"执行自动相位校正。如果需要额外的相位调整,以进一步提高频谱,点击"调节相位"图标和用于零阶(0)和第一阶相(1)校正的相位校正的图标。
- 而在零阶和第一阶相位校正的图标点击,拖动鼠标,直到所有的信号在负吸收模式。申请并通过点击"返回并保存"按钮退出相位校正模式保存相位修正值。
- 增加的tau,直到所有的峰是正或零化通过重复步骤2.2.3.6-2.2.3.9。为了确定的T 1值,简单地划分在峰值零化与LN2的tau蛋白值。
- 的90°脉冲校准
- 一维(1D)。NMR谱
- 1 H-NMR谱
- NMR数据的采集
- 转到步骤2.1.7创建的1个 H数据集和通过在命令行键入"PULPROG ZG"使用标准的"脉冲获取"脉冲序列" ZG"。
- 在命令行上下面的命令来设置,以ppm光谱宽度,RF发射器的中心,扫描的次数,虚设扫描的数量,数据点的数目和脉冲持续时间为90°脉冲角: "SW 8", "3.8 O1P", "NS 2", "DS 2", "TD 64K"和"P1(如通过脉冲校准测定)"(见步骤2.2.1)。
注:32K数据点可用于500 MHz仪器上。 - 通过键入"D1 7S"或"D1 787-9",分别在命令行上设置的7个S为500 MHz仪器上或9号为850 MHz仪器上的松弛延迟。
- 设置使用命令"RGA"为RG的自动计算接收机增益(RG)到适当的值。
- 键入"digmod baseopt"以获取与改善基线频谱。
- 通过在命令行键入脉冲获取命令"ZG"开始采集。
- NMR数据的处理
- 在命令行键入"SI 64K"应用零填充和所述真实频谱的大小设置为64K。
- 通过在命令行键入"磅0.3",以用线展宽0.3赫兹的因子前,傅立叶变换应用的加权函数(指数衰减)设置谱线增宽参数至0.3赫兹。
- 通过在命令中键入"EFP"执行傅立叶变换线。
- 通过在命令行中输入命令"APK"执行自动相位校正。如果需要额外的相位调整,以进一步提高频谱,点击中的"进程选项卡",然后单击"调节相位"图标和用于零阶(0)和一阶(1)的相位校正的相位校正图标。
- 而在零阶和第一阶相位校正的图标点击,拖动鼠标,直到所有的信号都是正的吸收模式。申请并通过点击"返回并保存"按钮退出相位校正模式保存相位修正值。
- 通过键入命令"ABS N"时整合申请基线校正的多项式四阶函数。
注意:这确保了与最小强度平坦的光谱基线。 - 由TMS以ppm报告化学位移(δ= 0)。点击校准("CALIB。斧是")的图标,并且将光标与上TMS NMR信号(峰最接近于0)的顶部上的红线。左键点击并输入‘0’。
- NMR数据分析
- 整合的光谱区从δ1.1至在δ4.98δ0.6以及峰,δ5.05和δ5.81使用"整合"图标("进程"标签下)和高亮("定义新的区域")的图标。通过积分右键单击并拖动。
注意:如果有需要关注的区域,点击高亮显示图标停用左键点击并拖动鼠标以放大的区域。调节阈值强度,如果需要的话使用鼠标按钮。再次点击高亮显示图标,使整合功能激活,然后移动到下一个高峰。- 正常化有关显示的积分值以上的积分,以100通过右击的总和S的信号下,选择"归一化的积分之和"。输入框中的值"100",然后单击"返回并保存"退出一体化模式。
- 当使用BHT作为内部标准,在整合δ6.98峰值和设定的积分等于BHT的每0.5毫升储备溶液的毫摩尔。
- 整合的感兴趣的峰(参见步骤2.3.1.3.1)从峰值的每一侧延伸10赫兹,在可能的情况。
- 进行到以类似的方式执行13 C-NMR谱的采集和处理。
- 整合的光谱区从δ1.1至在δ4.98δ0.6以及峰,δ5.05和δ5.81使用"整合"图标("进程"标签下)和高亮("定义新的区域")的图标。通过积分右键单击并拖动。
- NMR数据的采集
- 13 C-NMR谱
- NMR数据的采集
- 转至13 C数据集,并通过在命令行键入"PULPROG zgig"使用逆门控去耦脉冲序列" zgig"。
注意:要运行碳实验与标准的宽带decouPLED的脉冲序列,在命令行键入"PULPROG zgpg"。 - 在命令行上下面的命令来设置,以ppm光谱宽度,RF发射器的中心,扫描的次数,虚设扫描的数量,数据点的数目和脉冲持续时间为90°脉冲角: "SW 200", "95 O1P", "NS 16" "DS 2", "TD 64K" 和 "P1(如通过脉冲校准测定)"(见步骤2.2.1.4)。
- 通过键入"D1 35S"或"D1 45S",分别在命令行上设置的35秒为500 MHz仪器上或45秒为850 MHz仪器上的松弛延迟。当使用BHT,弛豫延迟应该是在500 MHz仪器上50秒和60秒在850兆赫的仪器。
- 设置使用命令"RGA"为RG的自动计算接收机增益(RG)到适当的值。
- 在命令行键入"digmod baseopt"来获取光谱瓦特第i个改进的基线。
- 通过在命令行键入脉冲获取命令"ZG"开始采集。
- 转至13 C数据集,并通过在命令行键入"PULPROG zgig"使用逆门控去耦脉冲序列" zgig"。
- NMR数据的处理
- 在命令行键入"SI 64K"应用零填充和所述真实频谱的大小设置为64K。
- 通过在命令行键入"磅1.0",以用线展宽1.0赫兹的因子前,傅立叶变换应用的加权函数(指数衰减)设置谱线增宽参数为1.0赫兹。
- 通过在命令行中键入"EFP"执行傅立叶变换。
- 通过在命令行中输入命令"APK"执行自动相位校正。如果需要额外的相位调整,以进一步提高频谱,点击中的"进程选项卡",然后单击"调节相位"图标和用于零阶(0)和第一阶相(1)修正的相位校正图标。
- 虽然点击零阶和第一阶相位校正图标,拖动鼠标,直到所有的信号都是正的吸收模式。申请并通过点击"返回并保存"按钮退出相位校正模式保存相位修正值。
注:对于记录在214兆赫(850兆赫的仪器)的频率相关的错误(一阶)的校正的拉莫尔频率碳谱可以是具有挑战性的并且对于缺乏经验的用户的因大的偏共振效应耗时的90°脉冲。
- 虽然点击零阶和第一阶相位校正图标,拖动鼠标,直到所有的信号都是正的吸收模式。申请并通过点击"返回并保存"按钮退出相位校正模式保存相位修正值。
- 通过在命令行键入命令"ABS N"时整合申请基线校正的多项式四阶函数。
- 由TMS以ppm报告化学位移(δ= 0)。点击校准("CALIB。轴")的图标,并且将光标与NMR信号的顶部红线被引用。左键点击并输入"0"。
- NMR数据分析
- 整合的光谱区从δ175使用"整合"图标("进程"标签下)和高亮〜δ171("定义新区域")的图标。通过积分右键单击并拖动。
注意:如果有需要关注的区域,点击高亮显示图标停用左键点击并拖动鼠标以放大的区域。再次点击高亮显示图标,使整合功能激活,然后移动到下一个高峰。- 这样做对信号下出现的整数值,右键点击设置积分为100,然后选择"校准电流积分"。输入框中的值"100",然后单击"返回并保存",退出一体化模式。
- 当使用BHT作为内标,在δ151.45整合的峰值和设定的积分等于每0.5 ml的储备溶液的BHT的毫摩尔。
- 整合的延伸从所述峰值的每侧5赫兹感兴趣的峰(参见步骤2.3.2.3.1)。
- 整合的光谱区从δ175使用"整合"图标("进程"标签下)和高亮〜δ171("定义新区域")的图标。通过积分右键单击并拖动。
- NMR数据的采集
- 1 H-NMR谱
结果
1 H和13个 C NMR光谱收集使用两个NMR仪器市售鱼油补充剂; 850 MHz和500 MHz光谱。这些光谱可用于定量测定鱼油的组分,如二十二碳六烯酸(DHA)和二十碳五烯酸(EPA),以及其它化合物,如正 -1酰基链的和营养的重要指标,如正 -6 / N -3比。所述定量可即使不使用内标来进行,然而,定量结果必须表示为相对摩尔百分比。当数据需要以绝对值(毫克/克),待表达,需要的内标。由NMR得到的结果是,相对标准偏差(RSD)为0.3%至13 C NMR分析2%和0.5%到1 H NMR分析2.5%高度可再现的,这取决于吨他脂质。 1 1 H NMR稍高RSD经常观察到,因为质子光谱往往是过于拥挤,从而影响分析的准确性,特别是对于具有较低的信噪比(S / N)的共振。一个非常好的协议850兆赫和相对标准偏差为1%至4%的500 MHz仪器上之间找到。比较由1 H和13 C得到的结果时,特别是对出现在较低的浓度,例如正 -1酰基链的化合物,观察到相对高的相对标准偏差(高达8%)。 NMR光谱先前已经验证为对于脂质分析的工具,包括一些鱼油组件的确定。结果表明,它是在与传统的方法,如GC 17,18一致。
1 H NMR分析
"XFIG">图1(A)上的850 MHz和(B)500 MHz仪器上获得的1 H NMR的谱图进行比较。 850兆赫频谱的特征在于较高的分辨率,但是鱼油的主要部件,包括DHA,EPA和n -6 / N -3也可以从500 MHz的谱确定的比例。可用于定量目的的鱼油脂肪酸的1 H-NMR的信号示于表1,而鱼油的1 H NMR谱的完整NMR分配可以在别处19找到。
1 H-NMR,得到可靠的数据对于n -3的总量的定量,N -6,DHA, 反式脂肪酸,n -1 个酰基链,和饱和脂肪酸(SFA)。用于1 H NMR分析,是必需的,因为大多数S的使用的适当的关系ignals属于通用于不同的脂肪酸和脂类的质子组。出于这个原因,在大多数情况下的脂肪酸的鱼油的浓度可仅通过各种:1个 H NMR信号的组合来确定,在适当的关系并入。另外,这些方程包含归一化不同数目与每个组相关联的质子的算术系数。当使用内标下面的公式,应考虑:C = I / I IS×N IS / N×A×MW / M(1),其中C是在毫克/克鱼油的分析物的浓度, 我是唯一地归因于所关注的脂质的共振的积分,将i是唯一地属于内部标准的质子信号的面积,N是所分析的官能团的质子数,n 为是被用于分析的内标物的质子数,A为内标物的毫摩尔,MW是脂肪酸的分子量(在甲基酯表示),且m是鱼油的量以克表示。
实施例1,DHA:DHA的比例是由方程式C DHA =¾ 我 DHA / S,其中I DHA是信号中的δ2.39的积分属于DHA的Hα和Hβ质子,和S来确定是SFA的甲基质子的积分的总和,N -6, 正 -9, 正 -3, 反式脂肪酸加n -1 个酰基链的峰中的δ4.98的积分,δ5.05和δ5.81。积分我 DHA是诺玛由3/4乘以因为它对应于四个质子,而积分S对应三个质子lized。 1 H-NMR是不能够提供有关的在甘油骨架的脂肪酸位置分布信息,因此只能用于脂肪酸的合计量的定量。包封的鱼油补充的1点 H NMR分析表明,它由DHA 10.5%。 DHA的使用BHT相同的样品中的浓度发现为105.23毫克/克。这些值非常接近用13 C NMR(见实施例2进行13个 C-分析)获得的值。
实施例2,n -1 个酰基链:n -1 个酰基链的浓度是通过关系式C n-1个给定= 3 I N-1 / S,其中,I N-1是信号的在δ5.818积分。这个信号对应于一个质子,因此需要通过由三个相乘来归一化。当使用BHT,n -1 个酰基链通过公式C N-1 = 2 I N-1 / I BHT确定。结果不能在毫克/克来表示,因为n -1 个酰基链的MW是未知的。
实施例3中,n -6 / N比-3:此重要索引可以从谐振的归一化强度的比率在2.77δ来计算,其对应至n -6酰基链(两个质子)的双-烯丙基质子过在δ0.97三重属于至n-3脂肪酸和对应于三个质子。的关系为C n-6 / C 的n-3 = 3/2 I A / I B,其中,I A和I B是信号的积分在δ分别2.77和0.97δ,。 Ñ-6脂肪酸从关系式C N-6 = 3 / 2I 的n-6 / S,其中,I N-6是在δ2.77积分双-烯丙基质子的确定。
例4中, 反式脂肪酸: 反式脂肪酸可从方程式C 反式 = I 反式 / S,其中I是反式的信号的δ0.91的积分来计算。本样品含有的反式脂肪酸3.07%,通过1 H NMR使用850 MHz仪器上测定。在500MHz的仪器分析的相同的样品,发现其含有的反式脂肪酸3.03%。
例5中,饱和脂肪酸(SFA):SFA的浓度可以是演算ated从方程式C SFA = S - C N-3 - C N-6 - C N-9 - C N-1 - Visual C 反式 。 Ñ9脂肪酸(主要是油酸)可根据方程式C定量N-9 =(3/4 Q - 3/2 余 的n-6)/ S,其中Q是n的烯丙基质子的积分-6和n -9在δ2.01。 SFA的市售鱼油样品中的量被发现是36.1%。用13 C NMR分析的相同的样品,发现其含有33.8%SFA。 SFA代表一组不同的FA( 例如硬脂酸和棕榈)具有不同MW的,因此它们的浓度如果鱼油不能在毫克/克来表示。
实施例6,总甾醇: 总甾醇的量(游离和酯化)可通过所述SIG来确定NAL在碳18的甲基质子出现在δ0.68,使用方程式C的= I STE / S。市售鱼油样品中总甾醇的摩尔比被发现是0.32%。 BHT也可用于固醇的绝对浓度的确定。在鱼油的主要甾醇是胆固醇和维生素D(或其前体7-脱氢胆固醇),并且通常在补充加入。这些化合物具有非常相似的兆瓦。因此,结果可以以mg / g的根据等式表达并计算C = 2/3 我 STE / I IS A×MW STE / m,其中MW是STE胆固醇的分子质量(386),其构成大部分鱼油20甾分数。使用BHT在同一样品中的甾醇的量为3.8毫克/克鱼油。个人判断胆固醇(δ 0.680)和7-脱氢胆固醇(δ0.678)是上的窗函数的应用分辨率增强后的850 MHz仪器上是可行的。
13 C NMR分析
图2示出了(A)的850 MHz和(B)中的羰基碳区域500 MHz仪器上获取的13 C NMR谱。两个光谱非常相似,并且可以提供相同的信息量。 13 C NMR光谱可以被成功地用于附加脂肪酸的分析,例如十八碳四(SDA)和二十碳四烯酸(ETA)的酸中,需要在这些酸是在较低浓度的样品然而更多的扫描。聚丙烯的13 C光谱的特征在于高的分辨率,因为大光谱宽度和宽带去耦的应用,其中的消除了标量耦合的影响,并产生单峰。出于这个原因,存在有限的使用500 MHz仪器上时甚至重叠。
13 C NMR光谱是多更多的信息相比,1个 H NMR谱和因为较少的信号重叠,观察到可以提供更全面的定量数据( 图1和2)。所述的13 C光谱中最有用的光谱区域是羰基碳区域,因为它提供了大量的脂肪酸以及它们在甘油骨架19,21,22的位置的分布的定量信息。从δ14.5甲基面积为δ13.5可以被用于快速确定Ñ-3的总量的, 正 -6, 正 -9和饱和脂肪酸酸(SFA),以及反式脂肪酸。然而,在500 NMR光谱仪,有n的部分重叠-6和n -9饱和脂肪酸(SFA)。虽然850 MHz的仪器仍然被认为是更可靠的选择为分辨率增强窗函数的应用程序可能会解决这个问题。碳光谱的烯烃区域可以被用于n的总量-3和n -1酰基链,以及用于确定个体脂肪酸如DHA,EPA,花生四烯酸(AA),亚麻酸(LN)N -3和油酸(OL)( 见表2)。 13 C NMR还可以应用于为鱼油的来自其它来源,如补充富含使用碳信号在δ14.31(甲基)乙酯(EE)的表征和δ60.20(亚甲基)。
对于碳分析,脂肪酸可以是determ的通过将适当的脂族,烯属,以及羰基与所有的酰基链的总积分信号的积分INED,根据一般关系C = I / S(2),其中C是被分析物的以摩尔(浓度% ),I是唯一地归因于所关注的脂质的共振的积分,S是表示该样品的总脂质含量信号(S)的总积分。酰基链的总积分S可通过该区域从δ175积分以δ171被确定,并且被设置为100。
使用下面的关系的基础上,内标进行的以mg /克鱼油脂肪酸的定量:C = I / I IS×A×MW / M(3),其中C是被分析物中的浓度毫克/克鱼油的, 我是唯一地归因于所关注的脂质的共振的积分,将i是唯一地属于该内标碳信号的面积,A为内标物的毫摩尔,MW是分子重量的感兴趣的化合物(在甲基酯表示脂肪酸),并且m是鱼油的以g的量。可用于定量目的的鱼油脂肪酸的13 C-NMR的信号示于表2,而13 C NMR谱的完整NMR分配可以在别处19找到。
实施例1,EPA在SN -2位置:EPA对SN -2位置的量(%)通过用S除以信号的积分在δ172.56计算。 EPA的在共同的sn -2位量mmercially可用发现样品用850兆赫的仪器为3.4%。使用相同光谱仪和BHT作为内标,EPA的在sn -2位的量以mg /鱼油的g为29.73毫克/克。在500MHz的仪器分析的相同的样品,发现其含有3.6%或31.39毫克/克的EPA分别在sn -2位置。类似的结果可以在SN计算EPA的相对分子比时-2使用完全解耦光谱来获得。这是因为,EPA的羰基碳是受质子去耦到相同的程度可忽略不计的其他羰基碳,这是用来作为参考。然而,在使用BHT时,因为BHT的δ151.45碳,其用于量化相比,脂肪酸的羰基碳接收不同NOE增强大的偏差得到遵守。出于这个原因,完全去耦图谱应使用内部标准或整合c当被避免arbons不同的多重性。
实施例2中,DHA的总量: DHA的总量(%)简单地通过由NMR信号在δ分别172.48和δ172.08,测定添加DHA的量在SN -1,3-和sn -2位计算。用1 H NMR分析相同样品(参见实施例1的1个 H分析)被发现根据13个 C NMR分析含有10.3%的DHA。 DHA的量也可以以毫克/克通过使用内标和等式3 DHA的总量为103.25毫克/克表示。
实施例3,SDA的总量:SDA的总量(%)是通过在δ172.99加入的信号的积分和δ172.60属于SDA的羰基碳上的位置SN -1,3-和确定SN -2,分别接除以S上的总和。分析的样品被发现含有3.93%SDA或34.54毫克/克。
实施例4中,n -3 LN:N -3 LN(%)可以通过与积分小号除以信号的积分在δ131.85来确定。 Ñ-3 Ln的分析鱼油样品中的摩尔比为0.7%。使用BHT绝对浓度计算为5.5毫克/克。
实施例5, 反式脂肪酸: 反式脂肪酸的摩尔比是通过将积分信号中的δ13.80带S确定。将其用1 H NMR分析,发现其为反式 FA的3.07%的同一样品的分析,还分析了用13 C NMR和其反式脂肪酸含量被发现是3.42%。 Ť他13 C NMR在500 MHz仪器上在同一样品的分析表明反式脂肪酸的3.64%的含量。可使用BHT作为内部标准和方程式C来确定反式 FA的毫摩尔/克鱼油的量= I / I IS×A / 米 ,然而结果不能以mg / g,因为此时的峰,在δ13.80表达对应于各种反式脂肪酸,主要是反式 DHA和EPA 的反式 ,具有不同的MW。
实施例6,EE: EE的鱼油样品中的浓度是通过将所述光谱区域的积分从δ60.50到60.00δ,其对应于各种脂肪酸的EE的亚甲基碳,其中S计算。一个EE鱼油样品的分析表明,它由100%EE的。应当指出的是,EE样品中,EPA CAN为或者通过羰基峰在δ173.60或通过在δ60.20亚甲基EE碳计算的,而DHA可以利用信号在δ60.31和/或在δ173.09的信号计算。
可用于定量目的的用13 C和1个 H NMR分析的诊断信号的一个完整的列表可以分别在表1和2中 ,可以发现,而可用于该分析的方程的详细说明可发现其他地方19。
NMR可以额外地施加的鱼油补充剂的氧化状态的评估。 图3比较了两种氧化条件下鱼油样品的1个 H NMR光谱;暴露于加热和暴露于紫外线(UV)光。脂质氧化是一个复杂的过程,和氧化产物的组成取决于氧化条件。主要氧化产物的氢过氧化物(δ8.0-8.8),共轭二烯的氢过氧化物(δ5.4-6.7),以及醛类(δ9.0- 10)。

图1。 的1 H NMR分析。 850.23(A)和500.20兆赫(B)补充鱼油在CDCl 3溶液的1 H-NMR谱。可用于它们的确定EPA和DHA的NMR信号被示出。在δ0.97的峰可以用于n个 -3脂肪酸的总量的确定。在δ1.39-1.20包络被剪切,因为它属于所有脂肪链的亚甲基质子s,不能用于任何鉴定或定量目的。的1个 H NMR谱的特征是相对于13 C NMR光谱,从而通过低的光谱分辨率更窄的光谱宽度(SW)。 请点击此处查看该图的放大版本。
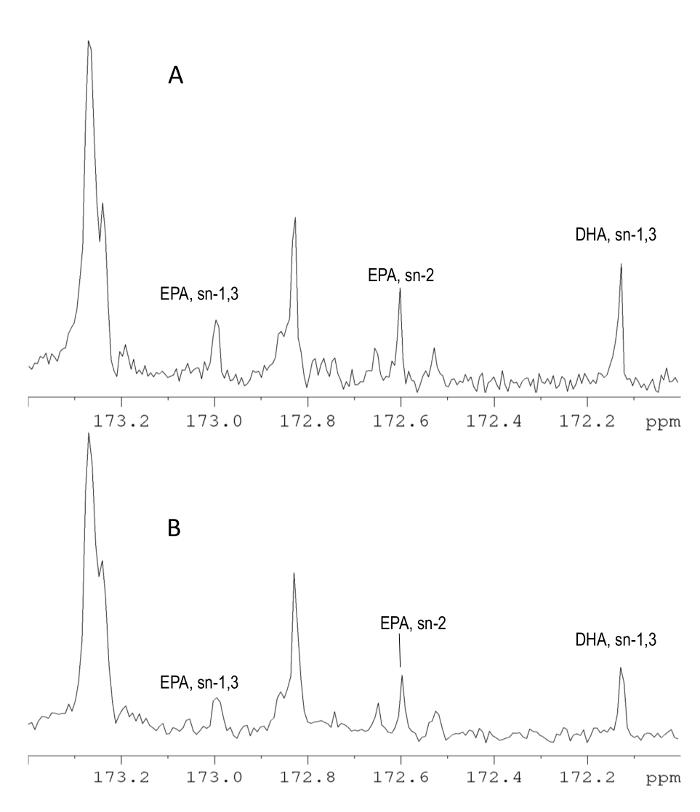
图2。 13点 C NMR分析。 213.81(A)和125.77兆赫(B)补充鱼油在羰基碳区域CDCL 3溶液的13 C-NMR谱。 EPA和DHA的对Sn -1,3-和sn -2位置的NMR信号被示出。这些信号可用于定量测定的EPA和DHA。虽然SPE记录在213.81兆赫CTRA的特征在于较高的分辨率和灵敏度,在125.77兆赫谱也可用于主要化合物的确定。在13 C NMR实验解耦的应用消除了碳和氢核,从而将信号显示为单峰相比,1 H NMR谱使分析变得更容易之间的标量耦合的影响。 请点击此处查看该图的放大版本。

图3。 鱼油氧化。氧化鱼油的1个 H NMR谱依赖于氧化条件。归因于氢过氧化物(δ8.0-8.8),c中的共振onjugated二烯氢过氧化物(δ5.4-6.7),和醛被示出。 请点击此处查看该图的放大版本。
| δPPM | 质子 | 复合 |
| 0.677 | CH 3(18) | 胆固醇 |
| 0.678 | CH 3(18) | 7-脱氢 |
| 0.88 | CH 2 CH 3(t)的,Jω1,ω2= 7.27赫兹 | Ñ-9,SFA酰基链 |
| 0.883 | CH 2 CH 3(t)的,Jω1,ω2= 7.08赫兹 | Ñ-6酰基链 |
| 0.911 | CH 2 CH 3(t)的,Jω1,ω2= 7.65赫兹 | 跨酰基链 |
| 0.973 | CH 2 CH 3(t)的,Jω1,ω2= 7.63赫兹 | Ñ-3酰基链 |
| 1.25 | CH 2 CH 3(t)的,J = 7.20赫兹 | 乙酯 |
| 1.697 | OCOCH2CH 2(t)的,J Hα,Ηβ=赫兹 | EPA酰基链 |
| 2.391 | OCOCH 2 CH 2(t)的 | DHA酰基链 |
| 2.772 | CH = CHCH 2 CH = CH | Ñ-6酰基链 |
| 2.81 | CH = CHCH 2 CH = CH | Ñ-3酰基链 |
| 3.593 | 3'A-CH 2 OCO | 1-MAG的甘油 |
| 3.722 | 3'a中,3217; B-CH 2 OCO(BR) | 1,2-DAG的甘油 |
| 4.073 | 2'-CHOH(BR) | 1,3-DAG的甘油 |
| 4.121 | CH 2 CH 3多重峰 | 乙酯 |
| 4.173 | 1'B,3'B-CH 2 OCO(DD) | 1,3-DAG的甘油 |
| 4.238 | 1'A-CH 2 OCO(DD) | 1,2-DAG的甘油 |
| 4.329 | 1'B-CH 2 OCO(DD) | 1,2-DAG的甘油 |
| 4.989 | -CH = CH 2分 的顺式 (DD) | n -1 个酰基链 |
| 5.052 | -CH = CH 2 反式 (DD) | n -1 个酰基链 |
| 5.082 | 2'- CHOCO | 1,2-DAG的甘油 |
| 5.268 | 2'; -CHOCO | TAG的甘油 |
| 5.436 | CH = CHCH 2 CH = CH 2 | n -1 个酰基链 |
| 5.818 | -CH = CH 2 | n -1 个酰基链 |
表1:1 H NMR谱的分配。该 其可用于在CDCl 3溶液量化目的鱼油脂肪酸信号的1 H-NMR的化学位移被呈现。化学位移以ppm测量并且提供关于核的化学环境的信息。
| δPPM | 碳 |
| 173.24 | C1 SFA(SN -1,3) |
| 172.21 | C1 OL,LO(SN -1,3) |
| 173.16 | C1 ETA(SN -1,3) |
| 173.13 | C1 DPA(SN -1,3) |
| 173.03 | C1 SDA(SN -1,3) |
| 172.97 | C1 EPA(SN -1,3) |
| 172.73 | C1 ETA(SN -2) |
| 172.69 | C1 DPA(SN -2) |
| 172.61 | C1 SDA(SN -2) |
| 172.56 | C1 EPA(SN -2) |
| 172.48 | C1 DHA(SN -1,3) |
| 172.08 | C1 DHA(SN -2) |
| 136.8 | Cω1,N -1 |
| 131.85 | Cω3LN |
| 130.37 | C15 AA |
| 130.11 | C9 LN |
| 130.06 | C13 LO |
| 129.54 | C5 DHA SN -2 |
| 129.47 | C5 DHA SN -1,3 |
| 128.94 | C5 EPA |
| 128.76 | C6 EPA |
| 128.45 | C17ñ-3 |
| 127.71 | ñ-3 |
| 127.53 | C4 DHA SN -2 |
| 127.5 | C4 DHA SN -1,3 |
| 126.86 | Cω4,所有n -3 |
| 114.71 | Cω2,N -1 |
| 60.08 | DHA, 乙酯 |
| 59.96 | EPA, 乙酯 |
| 59.95-59.85 | 其他FA, 乙酯 |
| 33.48 | C2 EPA SN -2 |
| 33.32 | C2 EPA SN -1,3 |
| 31.44 | C3 N-1 |
| 27.05 | 烯丙基ñ-6 |
| 26.49 | C4 EPA SN -1,3 |
| 26.47 | C4 EPA SN -2 |
| 24.6 | C3 EPA |
| 24.48 | C3 SDA SN -1,3 |
| 24.44 | C3 SDA SN -2 |
| 14.27 | Cω1,所有n -3 |
| 14.13 | Cω1,SFA |
| 14.11 | Cω1,OL |
| 14.07 | Cω1,LO |
| 13.8 | Cω1, 反式 FA |
表2:13 C NMR谱的分配。可用于定量purp鱼油脂肪酸信号的13 C-NMR化学位移在CDCl 3溶液中的操作系统被呈现。
补充图S1:13 C NMR谱的比较使用标准的宽带去偶(A)和门控去耦(B)的脉冲序列的倒数获得的。的光谱记录为具有相同数目的扫描的相同的样品,用同样的处理参数处理和被示为具有相同的比例因子。 请点击这里下载这个数字。
讨论
修改和策略疑难解答
光谱质量 。 NMR信号,从而NMR谱的分辨率的线宽是高度依赖于匀场,这是用于磁场的均匀性的优化的方法。对于常规分析,1D匀场是足够的,并不需要3D匀场,因为它是通过NMR人员定期进行。 D 2 O中(90:10):如果不是这种情况下,3D匀场必须被分析之前,使用含有0.6毫升氧化氢的样品进行的。为了实现更好更快匀场,样品需要在射频(RF)线圈的激发/检测区域为中心,使用分级的深度计,它被放置在磁体膛之前。影响匀场的另一个因素是在10-20赫兹的旋转速率旋转的样本。虽然在这个旋转速度旋转该样品改善了径向垫片(X,Y,XY,XZ,YZ,X 2 -Y 2, 等等 ),它一般不以避免第一或更高阶的旋转边带的外观建议。然而,当对在拉莫尔操作工具的工作频率低于400兆赫,纺纱被推荐用于1D NMR实验。
分辨率,以及灵敏度,由接收器增益(RG)值的影响。接收器增益的低的值降低灵敏度,而值比模拟 - 数字转换器(ADC)的适当的原因溢出更高。在非对称线形状ADC溢出结果和信号不能用于定量目的,因为自由感应衰减(FID)的第一点可能会丢失。在大多数情况下,命令"RGA"计算出恰当的RG值。然而,在一些情况下,由软件计算出的RG值比理想值高并且在NMR信号的洛伦兹形状的失真。在这样的情况下,用户应通过在命令行键入"RG(值)"手动输入一个较小的RG的值。的样品,与该协议分析的典型RG值是8。
通常情况下,使用低温时冷却NMR探针具有高品质因子(Q因子),一个大的延迟(死区时间)> 200us的最后一个脉冲和检测周期之间需要避免伪像,例如围绕所述发射器的频率的驼峰而在频谱的基线滚动。然而,这样的长延迟将导致大的负一阶相位误差,这也可以引入一个基线轧和大倾角的强信号的底座周围。在这些情况下,Z-恢复自旋回波脉冲序列可以被用于生产具有改进的显著基线NMR谱,虽然小灵敏度降低,可能会出现23。
磷脂 。除了鱼油的分析富含甘油三酸酯和乙基酯的样品,NMR可以用于鱼油样品富含磷脂(PLS)的分析。然而,需要特别注意对这样的样品,因为的PL形式的聚集体,这会导致在光谱分辨率和灵敏度的显著降低。对于这些样品的分析,氘代氯仿的混合溶剂:甲醇:以70:30的比率(CDCL 3 CD 3 OD)是必需的,用于获得高品质的光谱。
内部标准 。 BHT被选定为在该研究中的内标,因为它是通过简单的1 H和13 C NMR光谱的高度对称的分子和没有其峰与那些鱼油成分的重叠。 BHT具有在1 H NMR谱信号,该信号表现为一个单峰在δ6.97和属于两个等效芳香质子( 对 -在相对于OH基团的位置),并且在信号δ151.45在属于芳族季碳带有-OH基团的13 C NMR光谱。这两个信号具有与任何在鱼油组分的没有重叠,因此可用于定量目的。如1,2,4,5-四氯-3-硝基苯(TCNB)或乙烯氯化物的其它化合物也可以用作替代的内部标准,然而,它们的特征在于长T 1的值。
该技术的局限性
各种脂肪酸和脂质在鱼油补充剂的定量是通过在一维谱相应的诊断NMR信号的积分实现。这样的信号应该属于只对特定的样品组分,并且必须具有与来自其它化合物的信号没有干扰。由于1 H NMR谱的特征在于低的分辨率,这可能是用于1所 H NMR分析的问题,由于车的短程MICAL变化。另外,标量耦合的存在(J)产生多重峰,使分析更复杂。例如,乙酯(EE)可以使用1 H-NMR通过甲基的特征三重峰(J = 7.20赫兹)中的δ1.25量化和多重峰在δ4.12,属于酯基的亚甲基质子。然而,使用在拉莫尔操作NMR文书时,频率低于850兆赫,应避免EE的使用。1 H NMR的分析,因为该峰的部分重叠的在δ4.12与峰δ甘油三酯的4.14,并重叠在δ1.25信号与脂族的亚甲基质子的在δ1.23-1.35的宽信号。大的偏差也被一些样品中EPA的1个 H和13 C分析之间观察到,13 C NMR更接近于由吨提供的标记组合物他制造商。这可能是由于信号在δ1.69重叠,其用于EPA分析,与出现在一些类型的鱼油补充剂的其他化合物的信号。使用内标时由于内部标准的不确定纯度和从称重误差可能出现在的量化的附加误差。
的组成分析,可以在相对摩尔浓度在不使用内标来表示。如果结果需要在绝对浓度中表达,例如作为每克的油状物(毫克/克)脂肪酸毫克,需要使用内标。然而,在感兴趣的NMR信号属于具有不同分子量的多种化合物的情况下,结果不能使用内标甚至当表示为mg / g以下。此外,使用内标物通常增加了分析的长度,因为最常见的内部小号标准协商,如BHT,是小分子与高分子对称性,这导致长的弛豫时间。由于重复时间(脉冲+采集时间之间的延迟)根据所述样品中的最长松弛时间T 1设定,采用内部标准的将增加的实验的持续时间,需要的脉冲之间更长的延迟。这是因为碳核的异常长T 1弛豫时间为13次 C NMR分析中的特别重要的因素。如Cr(ACAC)加入顺磁化合物的3能够有效地降低T 1弛豫时间。铬(ACAC)3的推荐浓度为0.75毫克/毫升的溶液。铬(ACAC)3的更高的浓度可考虑用于进一步减少T1 的 ,但是,谨慎,以避免在S / N降低所需由于谱线增宽。
ntent">虽然13 C NMR的特征在于高得多的光谱分辨率相比1个 H,13 C NMR实验的灵敏度显著较低,因为低天然丰度(1.1%)和低的旋磁比(67.26 10 6弧度秒-1 T -1)的13个 C核。此外,13 C中的长T 1弛豫时间的增加分析的长度,这可能是一个问题,当用于分析的可用的油是有限的,因为增加的扫描次数应该被用来实现一个合理的信噪比。在灵敏度和NMR谱的分辨率限制防止可与其它技术,如GC分析在鱼油许多次要化合物的分析。例如,1ΗNMR无法个别甾醇或脂肪酸( 例如棕榈酸和硬脂酸),而13 C分离是不能够确定在鱼油出现在非常低的浓度,其与所有饱和脂肪酸的信号重叠化合物,例如十二烷和十四烷酸,在δ173.24和172.82δ。虽然增加被分析的样品的量,使可行一些轻微的化合物的分析,需要非常浓的样品小心,因为它们的粘度增加。应避免含有超过150毫克的油非常粘稠的解决方案,因为存在由于减少引起的自旋-自旋Ť2弛豫时间线加宽在S / N的降低。另外,需要因为较长的T 1的脉冲之间的较长的延迟并有在匀场,因此在解决几个问题。
与NMR鱼油分析的所有化合物可以同时在一个快照进行量化,而无需使用任何分离或纯化步骤。该NMR的alysis是快速的,如通过1个 H光谱可以被记录在小于一分钟,而13 C NMR采集持续10分钟。但是,应该指出的是,有一些影响数据采集时间的几个因素。具体而言,13 C NMR,在10分钟的运行时间仅可在不使用内部标准实现的,并与使用低温冷却探针,其中,所述RF线圈和前置放大器被冷却,因此热噪声被最小化。在实验时间为10-15倍的增加应该预计为13种 C NMR分析时,室温下使用(常规的)的探针。
相对于现有方法的意义
核磁共振光谱证明是定性和定量测定鱼油补充剂的组成的一个强大的工具,因为它的快速性的它有可能被应用为广大NU的高通量筛选鱼油样品MBER。 NMR光谱是通过定义的定量方法,因为信号区域是直接比例于将引起信号的核的数量。而需要急性毒性化学品,以制备将NMR样品,因为使用这种化学物质( 如 CDCL 3),例如少量的,而不是需要大量的溶剂来洗脱样品的其它方法该方法是环境友好的。另外,NMR相比于其他分析方法具有若干优点。与标准无需校准之前进行分析,并且没有任何分离和纯化步骤的最小样品制备通常被采用,这使得NMR非常快速的分析工具。此外,13 C NMR是用于确定在甘油骨架的各种脂肪酸的位置分布的最佳可用方法。而酶水解已被用作替代并不总是可靠= "外部参照"> 24。这是特别重要的,因为在研究食物中的各种脂肪酸的区域专一一个显著的兴趣,因为它已经发现,这会影响他们在人类饮食中25,26功能。
未来应用
尽管NMR分析,产品的标签之间的协议,以及一个事实,即有数字显示GC和NMR之间的协议的一些研究,我们认为,更加严格和全面的内部实验室研究需要考察NMR和传统之间的协议方法使用的样品,不同来源的鱼油产品更大数量的鱼油成分的分析,和认证的标准溶液。
鱼油分析NMR的另一个重要的应用前景将是氧化产物的决心。除了确定在鱼油的主要化合物,几个初级和次级氧化产物在鱼油,如醛和过氧化物,都存在。 1 H-NMR可潜在地应用于在鱼油补充剂氧化状态的评价中,不同的氧化条件下,如示于图3。在这种分析中,最大的挑战将是NMR分配与个人氧化产物的鉴定。在NMR硬件的灵敏度的进步也将允许使用13 C NMR个体固醇的识别。 NMR谱也可以通过使用高分辨率魔角旋转(HR-MAS)NMR应用于鱼组织的分析作为一个整体,即使没有任何萃取。
该协议中的关键步骤
的影响定量NMR谱的准确性的最关键的步骤涉及两个90°脉冲的选择和使用的PU之间的延迟的LSES≥5×T 1。脉冲角度正比于它是依赖于仪器和样品校准NMR参数脉冲宽度。一个90°脉冲为纵向(z)的磁化与所述观察到的横向(XY)磁化的完全转化是必不可少的。需要注意的是脉冲校准之前,核磁共振探测需要很好地调整和匹配是非常重要的。这将优化RF功率的传送到样品,从而最大限度地提高S / N,并确保有效的去耦。探头调谐主要是由样品的介电常数的影响,因此,如果有在样本之间的浓度差,重复调谐处理为每一个。一维13 C NMR实验既包括13 C和1个 H通道以便自动调谐和匹配是必要的两个细胞核。
长于5×T 1的脉冲之间的延迟保证了完整REC净磁化至其初始值的卵巢中。如果在光谱中所有的共振都没有,每个脉冲之前完全放松,信号被部分抑制,这导致在积分误差。 T 1个值是影响实验的长度的一个重要因素,它依赖于磁场强度,以及样品的粘度。鉴于样品之间的粘度是相似的,T 1弛豫时间应为每个仪器仅在分析会议开始来确定。
鱼油分析用13 C NMR的另一个重要的特征是适当的脉冲序列的选择。进行定量的13 C分析的最可靠的方法是门控去耦的实验,其中,宽带质子去耦期间采集周期仅施加因此存在由1个 H没有极化转移至13逆通过核极化效应(NOE)C。然而,当完全去耦NMR实验可用于定量目的,因为存在必须避免碳与不同的多重和甲基,亚甲基,甲烷和羰基碳之间,因此积分比较中不同NOE因素使用此实验时,需要小心。尽管这样,当时只有类似的多重性和化学环境的碳在分析中认为,在完全脱钩方法是可靠的。这方面的一个例子是已被发现具有27解耦之后的NOE因素没有显著差异脂肪酸羰基碳。此外,对于碳轴承质子,完全去耦实验由于在NMR信号强度的NOE贡献提供更高的灵敏度。与所述两个脉冲序列获得的光谱之间的比较示于图S1。
披露声明
作者什么都没有透露。
致谢
这项工作是由俄亥俄州立大学食品卫生发现主题和食品科学与技术在美国俄亥俄州立大学的部门支持。作者要感谢俄亥俄州立大学的NMR设施和宾夕法尼亚州立大学的核磁共振设备。
材料
| Name | Company | Catalog Number | Comments |
| Avance III 850 NMR instrument | Bruker | ||
| Avance III 500 NMR instrument | Bruker | ||
| TCI 5 mm probe | Bruker | Helium cooled inverse (proton deetected) NMR probe featuring three independent channels (1H, 13C, 15N) | |
| BBO prodigy 5 mm probe | Bruker | Nitrogen cooled observe (X-nuclei detected) probe, featuring two channels; one for 1H and 19F detectionand one for X-nuclei (covering from 15N to 31P) | |
| Spinner turbin | Bruker | NMR spinners are made by polymer materials and they have a rubber o-ring to hold the NMR tube securely in place | |
| Topspin 3.5 | Bruker | ||
| deuterated chloroform | Sigma-Aldrich | 865-49-6 | 99.8 atom % D, contains 0.03 TMS |
| 2,6-Di-tert-butyl-4-methylphenol | Sigma-Aldrich | 128-37-0 | purity >99% |
| Fish oil samples | |||
| NMR tubes | New Era | NE-RG5-7 | 5mm OD Routine “R” Series NMR Sample Tube |
| BSMS | Bruker | Bruker Systems Management System; control system device |
参考文献
- Simopoulos, A. P. The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomed. Pharmacother. 56 (8), 365-379 (2002).
- Goodnight, S. H. Jr, Harris, W. S., Connor, W. E. The effects of dietary omega 3 fatty acids on platelet composition and function in man: a prospective, controlled study. Blood. 58 (5), 880-885 (1981).
- Harper, C., Jacobsen, T. Usefulness of omega-3 fatty acids and the prevention of coronary heart disease. Am. J. Cardiol. 96 (11), 1521-1529 (2005).
- Kremer, J. M., et al. Effects of high-dose fish oil on rheumatoid arthritis after stopping nonsteroidal antiinflammatory drugs. Clinical and immune correlates. Arthritis and Rheumatol. 38 (8), 1107-1114 (1995).
- Malasanos, T., Stackpoole, P. Biological effects of omega-3 fatty acids in diabetes mellitus. Diabetes Care. 14, 1160-1179 (1991).
- Han, Y., Wen, Q., Chen, Z., Li, P. Review of Methods Used for Microalgal Lipid-Content Analysis. Energ. Procedia. 12, 944-950 (2011).
- Guillén, M., Ruiz, A. 1H nuclear magnetic resonance as a fast tool for determining the composition of acyl chains in acylglycerol mixtures. Eur. J. Lipid Sci. Technol. 105, 502-507 (2003).
- Sacchi, R., Medina, I., Aubourg, S. P., Addeo, F., Paolillo, L. Proton nuclear magnetic resonance rapid and structure specific determination of ω-3 polyunsaturated fatty acids in fish lipids. J. Am Oil Chem Soc. 70, 225-228 (1993).
- Igarashi, T., Aursand, M., Hirata, Y., Gribbestad, I. S., Wada, S., Nonaka, M. Nondestructive quantitative acid and n-3 fatty acids in fish oils by high-resolution 1H nuclear magnetic resonance spectroscopy. J. Am. Oil Chem. Soc. 77, 737-748 (2000).
- Plans, M., Wenstrup, M., Saona, L. Application of Infrared Spectroscopy for Characterization Dietary Omega-3 Oil Supplements. J. Am. Oil Chem. Soc. 92, 957-966 (2015).
- Jian-hua, C. I. A. Near-infrared Spectrum Detection of Fish Oil DHA Content Based on Empirical Mode Decomposition and Independent Component Analysis. J Food Nutr Res. 2 (2), 62-68 (2014).
- Millen, A. E., Dodd, K. W., Subar, A. F. Use of vitamin, mineral, nonvitamin, and nonmineral supplements in the United States: The 1987, 1992, and 2000 National Health Interview Survey results. J. of Am. Diet Assoc. 104 (6), 942-950 (2004).
- Dwyer, J. T., et al. Progress in developing analytical and label-based dietary supplement databases at the NIH office of dietary supplements. J. Food Compos. Anal. 21, S83-S93 (2008).
- Monakhova, Y. B., Ruge, I., Kuballa, T., Lerch, C., Lachenmeier, D. W. Rapid determination of coenzyme Q10 in food supplements using 1H NMR spectroscopy. Int. J. Vitam. Nutr. Res. 83 (1), 67-72 (2013).
- Monakhova, Y. B., et al. Standardless 1H NMR determination of pharmacologically active substances in dietary supplements and medicines that have been illegally traded over the internet. Drug Test. Anal. 5 (6), 400-411 (2013).
- Berger, S., Braun, S. 200 and more NMR experiments: a practical course. , Wiley-VCH. Weinheim. (2004).
- Knothe, G., Kenar, J. A. Determination of the fatty acid profile by 1H-NMRspectroscopy. Eur. J. Lipid Sci. Technol. 106, 88-96 (2004).
- Sacchi, R., Medina, J. I., Aubourg, S. P., Paolillo, I. G. L., Addeo, F. Quantitative High-Resolution 13C NMR Analysis of Lipids Extracted from the White Muscle of Atlantic Tuna (Thunnus alalunga). J. Agric. Food Chem. 41 (8), 1247-1253 (1993).
- Dais, P., Misiak, M., Hatzakis, E. Analysis of marine dietary supplements using NMR spectroscopy. Anal. Methods. 7 (12), 5226-5238 (2015).
- Pickova, J., Dutta, P. C. Cholesterol Oxidation in Some Processed Fish Products. J. Anal. Oil Chem. Soc. 80 (10), 993-996 (2003).
- Siddiqui, N., Sim, J., Silwood, C. J. L., Toms, H., Iles, R. A., Grootveld, M. Multicomponent analysis of encapsulated marine oil supplements using high-resolution 1H and 13C NMR techniques. J. of Lipid Rsrch. 44 (12), 2406-2427 (2003).
- Sua´rez, E. R., Mugford, P. F., Rolle, A. J., Burton, I. W., Walter, J. A., Kralovec, J. A. 13C-NMR Regioisomeric Analysis of EPA and DHA in Fish Oil Derived Triacylglycerol Concentrates. J. Am. Oil Chem. Soc. 87, 1425-1433 (2010).
- Youlin, X. A., Moran, S., Nikonowiczband, E. P., Gao, X. Z-restored spin-echo 13C 1D spectrum of straight baseline free of hump, dip and roll. Magn. Reson. Chem. 46, 432-435 (2008).
- Tengku-Rozaina, T. M., Birch, E. J. Positional distribution of fatty acids on hoki and tuna oil triglycerides by pancreatic lipase and 13C NMR analysis. Eur. J. Lipid Sci. Technol. 116 (3), 272-281 (2014).
- Berry, S. E. E. Triacylglycerol structure and interesterification of palmitic and stearic acid-rich fats:An overview and implications for cardiovascular disease. Nutr. Res. Rev. 22 (1), 3-17 (2009).
- Hunter, J. E. Studies on effects of dietary fatty acids as related to their position on triglycerides. Lipids. 36, 655-668 (2001).
- Vlahov, G. Regiospecific analysis of natural mixtures of triglycerides using quantitative 13C nuclear magnetic resonance of acyl chain carbonyl carbons. Magnetic Res. in Chem. 36, 359-362 (1998).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。