Method Article
La microscopie intravitale du système vasculaire associées à la tumeur en utilisant Advanced dorsale pli fenêtre Chambers sur des souris transgéniques fluorescents
Dans cet article
Résumé
Ce protocole décrit l’imagerie intravitale des souris transgéniques exprimant des marqueurs fluorescents spécifiques des cellules. Intravitale imagerie fournit une méthode non invasive pour les observations à haute résolution dans les animaux vivants à l’aide de windows implantables permettant la visualisation microscopique des processus est possible. Cette méthode est particulièrement utile pour étudier les processus longitudinales.
Résumé
Tumeur et le développement de tumeurs navire, ainsi que la réponse tumorale aux méthodes thérapeutiques, est des processus biologiques hautement dynamiques. L’histologie fournit des informations statiques et n’est souvent pas suffisant pour une interprétation correcte. Intravitale évaluation, dans laquelle un processus est suivi dans le temps, fournit des informations supplémentaires et souvent inattendues. Avec la création d’animaux transgéniques exprimant des marqueurs spécifiques des cellules et des traceurs de cellules vivantes, des améliorations d’équipement d’imagerie et le développement de plusieurs chambres d’imagerie, la microscopie intravitale est devenu un outil important pour mieux comprendre processus biologiques. Cet article décrit un modèle expérimental pour l’étude du développement de navire des tumeurs et des effets thérapeutiques de façon spatiale et temporelle. En utilisant cette configuration, le stade de développement de navire, formation cellulaire et lumen de pointe, la circulation sanguine, extravasation, un lit vasculaire établie et la destruction vasculaire peut être visualisé et suivi. En outre, des effets thérapeutiques, intratumorale sort et la localisation des composés chimiothérapeutiques peuvent également être suivis.
Introduction
Tandis que des études in vitro permettent une imagerie cinétique des processus, in vitro l’expérimentation ne permet pas d’évaluation dans le contexte approprié. Par exemple, l’interaction des cellules tumorales avec compartiments stromales ou de medicaments et de distribution à l’intérieur d’une tumeur ne peut être étudiée dans une plaque de culture. Modèles animaux sont donc utilisés pour imiter la physiologie humaine et la pathologie. Toutefois, l’imagerie longitudinale des processus, en particulier à une résolution subcellulaire, est un défi. Moléculaire, méthodes d’imagerie, telles que l’imagerie par résonance magnétique (IRM), émission de photon unique calculé tomographie (SPECT) et émission positons (TEP), ont des profondeurs de pénétration bonne mais manque de résolution ou ne parviennent pas à illustrer les structures anatomiques. Imagerie optique fournit haute résolution et permet l’imagerie des structures, mais elle est accompagnée de pauvres à pénétration minimale de1. L’application de la microscopie intravitale en combinaison avec la fenêtre de chambre impédancemétriques technologies, comme une dorsale ou fenêtre abdominale, permet à haute résolution d’imagerie in vivo2,3,4. Cette technologie offre des avantages distincts, car il permet l’imagerie longitudinale au fil des heures et même des jours, pour l’imagerie des processus dans le contexte approprié (par exemple, les interactions cellule-cellule dans le tissu imagé) et des résolutions aux limites optiques de avancées microscopes confocaux et multiphotoniques.
L’introduction d’animaux transgéniques avec étiquettes fluorescentes propres protéines ou cellules ouvre une multitude de possibilités pour des expérimentations in vivo et ex vivo . Pour instance, interactions cellules-cellules, la production de protéines et la réponse à la manipulation ou la thérapie peuvent être étudiés in vivo à l’aide de ces modèles5,6,7,8. Positionner ce qui est important, en lieu et temps peuvent être déterminées avec le bon équipement d’imagerie et de la méthodologie. Ici, la microscopie intravitale d’animaux exprimant un marqueur endothélial en combinaison avec des agents injectables dans une tumeur implanté dans une mis à jour le dorsal du pli cutané chambre fenêtre est présenté.
Protocole
Toutes les expériences sur des animaux ont été faites conformément à la législation néerlandaise et protocoles ont été approuvées par le Comité d’expérimentation animale de l’Erasmus MC, Rotterdam, Pays-Bas.
1. bénéficiaire souris
- Les souris transgéniques sont nés, l’écran les animaux pour le génotype approprié à l’aide de procédures standard,9.
Remarque : Dans ce manuscrit, données fournies par un eNOStag-GFP9 développé en interne et une ligne de10 ROSA-mTmG (stock 007676) achetée sont présentées. - Utilisez la souris 12 semaines ou plus et qui sont au-dessus de 20 g.
2. donneur souris
Remarque : Un fragment de la tumeur pour l’implantation dans la fenêtre DOS provient d’un donneur non transgéniques. Selon le type de tumeur, normal (avec des tumeurs syngéniques) ou des souris immunodéficientes (xénogreffes) sont utilisés.
- Cultiver les cellules de tumeur dans un milieu avec les suppléments appropriés dans des flacons de culture à 37 ° C et 5 % de CO2.
- Retirez le support les fioles de cellule, laver une fois avec du PBS 1 x et détacher les cellules à l’aide de 0,25 % de trypsine.
- Inactiver la trypsine en ajoutant le milieu de culture cellulaire. Recueillir les cellules, tourner vers le bas à 1 200 g pendant 5 min et Resuspendre le culot dans 5 mL de PBS.
- Diluer 20 µL de la suspension cellulaire avec 20 µL de trypan blue, qui souille les cellules mortes. Compter le nombre de cellules mortes et vivantes, à l’aide d’un hémocytomètre ; le nombre de cellules mortes ne doit pas dépasser 10 %.
- Tourner les cellules à nouveau à 1 200 g pendant 5 min et Resuspendre le culot dans du PBS glacee, rendement des cellules 1 million par 100 µL. transportent les cellules sur la glace de la salle d’opération.
- Anesthésier l’animal à l’aide d’isoflurane/O2. Sur l’oxygène et régler le débit de 0,5 mL/min. ajuster le vaporisateur isoflurane à 3 %. Après quelques minutes, placez votre souris dans la chambre de l’anesthésie.
NOTE : Pré-remplir la chambre pour s’assurer qu'il est prêt à être utilisé réduire le stress. -
Lorsque la souris est sous sédation, mettre l’animal à la table d’opération de chauffage, maintenue à 37 ° C et placez le museau dans la coiffe de l’anesthésie.
- Remarque : L’animal est sous sédation correctement lorsque aucune réaction à une pincée de coussinet plantaire n’est remarquée.
- Raser la souris pour mieux visualiser le site d’injection. Ensemencer à l’aide d’une seringue d’insuline de 0,5 mL ; injecter 100 µL de cellules dans le flanc de la souris et permettre une tumeur à développer.
- Euthanasier l’animal par dislocation cervicale sous anesthésie approuvé par votre animalier institutionnel et le Comité d’urbanisme. À l’aide de micro ciseaux et pinces, fend la peau à l’emplacement de la tumeur et disséquer la tumeur. Mettre la tumeur dans une boîte de Pétri avec du PBS. À l’aide de micro ciseaux et pinces, couper la tumeur en fragments d’environ 1 mm3 (Figure 1 a-a).
Remarque : La tumeur de la souris du donneur doit être assez grande pour donner suffisamment de matière, mais grands, nécrotiques tumeurs sont à proscrire. Pour la plupart des tumeurs, un diamètre moyen de 10 mm suffit.
3. implantation de la fenêtre de chambre
- Effectuez toutes les procédures dans des conditions aseptiques. Stériliser les instruments chirurgicaux (Figure 1 a) et les matériaux (Figure 1 b) de la chambre.
Remarque : La chambre de fenêtre utilisée ici, avec un poids total de 1,1 g, faite de polyéther éther cétone (PEEK), un matériau léger et synthétique qui est IRM compatible. Coup d’oeil est 3.4-fold plus léger que le titane, qui est couramment utilisé dans la littérature pour ces fenêtres. Il est résistant à la plupart des produits chimiques, est inerte, ne provoque pas de réactions immunitaires et est robuste. Cette fenêtre est également plus petite en conception par rapport à windows publiées antérieurement. Souris munis de ce spectacle de fenêtre pleine capacité de mouvement, peuvent monter et gain de poids comparable à des souris sans une chambre fenêtre. Parce que l’animal peut mordre sur la fenêtre, windows synthétiques peuvent durer un peu plus courtes par rapport à windows de titane ; Cependant, ils sont faciles à faire et sont peu coûteux. Ces fenêtres particulières sont faits maison et peuvent être obtenues sur demande. - Endormir la souris destinataire à l’aide d’anesthésiques par inhalation (c.-à-d., l' isoflurane/O2) dans une chambre de l’anesthésie. Amener la souris à la table d’opération chauffée tenue 37 ° C et placez le museau dans la coiffe de l’anesthésie (voir étape 2.6). Appliquer la pommade ophtalmique pour éviter la sécheresse.
- Enlever les poils de tout le retour en rasant et en appliquant le gel d’enlèvement de cheveux. Prendre soin d’enlever tout le gel en rinçant l’animal soigneusement à l’eau tiède. Sécher l’animal et nettoyer la peau avec l’éthanol à 70 %.
Remarque : La procédure de rasage est aussi possible le jour avant l’implantation de la fenêtre. La crème doivent être enlevés soigneusement avec de l’eau tiède, car cela peut causer une irritation cutanée. - Marquer la ligne centrale de la colonne vertébrale de souris avec un marqueur afin d’assurer le positionnement symétrique de chambre. Repositionner la souris, tirez la peau dans un volet à l’aide de la ligne centrale comme une position de pliage et saisir le milieu du rabat. Placer la fenêtre de telle sorte que le haut du cadre est au moins 2 mm en dessous de l’axe central et le cercle de la zone d’affichage de fenêtre sur la peau avec un marqueur.
- En utilisant une taille de lame/support de bistouri de 15 et micro ciseaux, enlever la peau le long de la ligne circulaire tracée. Veillez à ne pas endommager l’aponévrose sous-jacente.
Remarque : Cela crée la zone d’affichage de fenêtre de la chambre dans laquelle la tumeur est transplantée. - Tirez vers le haut le pli cutané et utilisez un perforateur oreille percer des trous de 1 mm de diamètre à travers la peau, un de chaque côté de la zone d’affichage (Figure 1 a et b).
NOTE : Voici les trous pour les deux boulons fixer les cadres de fenêtre ensemble. - Placer le cadre sur mesure chambre avant à l’aide de boulons (Figures 1 b-a, 1 b-c) et le cadre arrière (Figure 1 b-b) sur les boulons. Placer les écrous (Figure 1 b-d) dans le cadre du dossier sur les boulons.
Remarque : Ces boulons sont utilisés pour fixer les chambres ensemble contre le pli cutané et sont par la suite utilisé pour immobiliser la chambre au cours de l’évaluation sous le microscope. - Tirez la peau 2 à 3 mm au-dessus du sommet des cadres et assurez-vous que la zone d’affichage fenêtre transplantables correspond à la zone de la chambre. Place 23 G aiguilles dans les deux trous de suture peu (Figure 1 b, flèche noire) dans la partie supérieure du cadre. Serrer les écrous sur les boulons avec un tournevis micro (Figure 1 a-c) et un serrage porte-aiguille pour immobiliser les écrous.
Remarque : Prendre des précautions pour s’assurer que la peau ne tourne pas autour des boulons et ne serrez pas trop. - Remplacer les aiguilles par des sutures, commençant par le haut, pour fixer les cadres contre la peau. Cela, pour les 5 paires de trous de suture (Figure 1 b, flèche blanche) dans le cadre.
- Tourner la souris pour faire apparaître l’arrière de la chambre de la fenêtre. Placez un morceau épais de remplissage verre d’un diamètre de 10 mm et une épaisseur de 0. 55 mm (Figure 1 b-e), puis un couvercle en verre standard de 12 mm (Figure 1 b-f). Securiser avec un anneau de sécurité (Figure 1 b-g) dans la zone arrière-chambre.
Remarque : Le verre de remplissage empêche l’espace pour ouvrir entre le carénage et la fenêtre à l’avant, qui est utilisé pour l’imagerie. - Hydrater la zone d’affichage de fenêtre dans lequel la tumeur sera insérée en remplissant une seringue de 1 mL stérile 0,9 % NaCl. Permettre à quelques gouttes de tomber sur cette zone d’affichage. Supprimer les excès sérum physiologique avec un bout de coton stérile.
- Dans le fascia, créez une poche assez grande pour contenir le fragment tumeur de3 mm 1 (Figure 1 a-a) en utilisant une aiguille 25 G avec sa pointe est plié à un angle de 90 ° (Figure 1 a-d). À l’aide d’une aiguille ou une pince de Kelly, insérer le fragment de la tumeur dans le milieu de la zone d’affichage fenêtre transplantables dans cette poche.
- Fermer la zone d’affichage de fenêtre sous un verre standard de 12 mm et une bague de retenue.
Remarque : Une bulle d’air peut se former, mais il va disparaître en quelques heures.
4. avant et après les soins de l’Animal
- Administrer des médicaments pour soulager la douleur (p. ex., buprénorphine de 0,05 mg/kg) par voie sous-cutanée, tel qu’approuvé par votre animalier institutionnel et le Comité d’urbanisme. Laissez la souris récupérer de l’anesthésie sous une lampe chauffante.
- Placez les souris fenêtre individuellement dans une cage et dans une pièce climatisée mis à 32 ° C et au-dessus de 50 % d’humidité. S’assurer que les bouteilles d’eau sont à température ambiante avant de les placer sur la cage pour éviter les fuites. Utiliser des cages et l’enrichissement qui permettent la libre circulation et l’accès à la nourriture et l’eau.
Remarque : Comme cette chambre fenêtre est très bien tolérée, souris montrent un comportement normal. Habitat individuel évite d’endommager la chambre fenêtre causée par les autres souris, et la forte température/humidité empêche le refroidissement vers le bas et la déshydratation de la pli cutané. - Vérifier la souris régulièrement pour mâchées d’envoi des sutures, des boulons/écrous desserrés ou couvercle en verre cassé. Immédiatement, réparer et remplacer lorsque cela se produit. Une couverture en matériau léger peut servir à protéger la fenêtre.
5. intravitale imagerie
Remarque : Dans cette procédure, un microscope multiphotonique et le logiciel de contrôle appropriés sont utilisés. Ici, les paquets de logiciels qui ont été fournies avec les microscopes sont utilisés. En principe, tout logiciel qui est livré avec un microscope et vise pour microscope contrôle ainsi que la capture d’images sera de suite cet effet.
- Allumez le système : PC/microscope, appareil de contrôle confocale, puissance du laser et laser d’émission. Par exemple, avec ce logiciel, lancez le logiciel et d’initialiser la table de microscope (Figure 1E-a et 1E-c) en cliquant sur « initialiser la table ». Allumez le système et réglez-le sur le mode qui permet au PC pour contrôler le microscope, table xy, z-positionnement et capture d’image.
- Allumez la lumière fluorescente (Figure 1E-b).
Remarque : Cela sert à évaluer les images de fluorescence à travers l’oculaire avec champ lumineux. - Passez sur la plate-forme sur mesure, de contrôle de la température (Figure 1C-c; décrit dans l’explication plus en détail) à 37 ° C.
- Allumez l’unité d’anesthésie à l’aide d’isoflurane/O2 (Figure 1E-d). Montez le tube de l’anesthésie sur la platine du microscope (Figure 1C-e). Installer un serrage sur la platine xy pour fixer la pièce de museau d’anesthésie.
- Évaluer préalablement l’animal afin d’établir le stade de développement de tumeur de navire ; Cela dépend de la vitesse de la croissance tumorale, mais il peut varier entre souris individuels.
- Endormir la souris à l’aide d’anesthésiques par inhalation (isoflurane/O2) dans une chambre d’anesthésie (voir étape 2.6).
- Placez l’animal sur la plate-forme de contrôle de la température montée sur la platine du microscope ; Cela empêche le refroidissement de l’animal lorsqu’il est anesthésié. Assurez-vous que le museau de la souris se trouve dans le cône de l’anesthésie et appliquer la pommade ophtalmique si l’évaluation prendra plue de 5 min.
Remarque : Pour une évaluation plue de 1 h, réduire le débit de l’isoflurane à 2 %. - Utiliser les boulons de la chambre de fixer (Figure 1C-b, flèche pleine) de la chambre sur un porte de chambre sur mesure (Figure 1C-a). Vissez ce support (Figure 1C-d, flèche en pointillé) vers la plate-forme chauffée (Figure 1C-c).
Remarque : Cette combinaison empêche les artefacts de mouvement dans la zone d’affichage de fenêtre tout en permettant à l’animal de respirer librement. - Assurez-vous de nettoyer la vitre de la zone d’affichage de fenêtre avec un bout de coton trempé dans de l’eau pour éviter une image floue et les interférences provenant de débris à l’extérieur du verre. Placez la plateforme et la souris sur la platine du microscope (Figure 1).
Remarque : veiller à ce que la queue ne pas coincée entre la plate-forme et la platine du microscope. - Vérifier visuellement le stade de développement de navire de tumeur à l’aide d’un 10 X objectif lumineux-zone et lumière fluorescente.
NOTE : Les navires Fluorescent doivent être au point et la circulation sanguine doit être visible à l’aide du champ lumineux. Lorsque le système vasculaire est clairement visible, évaluer le stade de développement de navire de tumeur. Par exemple, déterminer s’il y a l’angiogenèse précoce avec la croissance des cellules de l’apex ou une vascularisation déjà établis pour la livraison de drogue. Le même animal peut être évalué à nouveau, et comme tumeur de développement est un processus continu. Plusieurs étapes peuvent être observées dans une tumeur unique en même temps.- Lorsqu’il n’est pas possible de mettre l’accent sur le système vasculaire, retirer l’animal de la scène, laisser la souris récupèrent et replacez l’animal dans un espace climatisé. Vérifier à nouveau plus tard. Lorsque la souris est prête pour l’évaluation, continuer avec le processus décrit ci-dessous.
- Allumer le laser confocal et le panneau de configuration en cliquant sur « Laser » et « Ctrl panel » dans l’onglet Configuration
Remarque : Il est recommandé de définir la puissance du laser faible, particulièrement pour le laser Argon, pour prévenir le blanchiment, le chauffage du tissu et du photovieillissement. Le panneau de commande peut être défini à vos préférences personnelles. Pour l’imagerie intravitale utilisant plusieurs fluorophores, il est recommandé d’appliquer les paramètres suivants : « smart gain, 100 V par tour, » « smart offset, 10 % par tour, » «, moyen, » « X position zoom, moyenne, » « position Y, milieu, » et « Position Z, 100 µm par tour ». Avant l’imagerie, régler le décalage pour minimiser le bruit et d’optimiser le rapport signal-bruit. La fonction zoom confocale permet un grossissement plus élevé sans changer les lentilles de l’objectif. X, Y et Z de contrôle est nécessaire pour localiser les domaines d’intérêt. Pour la microscopie intravitale, Z-positionnement devrait être environ 100 µm par tour comme tissu de tique est évalué. - Cliquez sur « Acquisition » dans l’onglet Acquire et modifiez le paramètre pour : « Mode d’Acquisition XYZ ou XYZT, » « Format (512 x 512 ou 1024 x 1024) » et « Speed (400 Hz ou 200 Hz). » Cliquez sur « Sténopé » et définissez-la à 1 unité aérée. Cliquez sur « Bidirectional X ».
Remarque : Pour optimiser les images, un équilibre entre la puissance du laser, de gain et sténopé devrait être radiée, qui est mentionné dans la Discussion. - Lors de l’évaluation de plusieurs fluorophores, sélectionnez « balayage séquentiel » et « entre les images » pour empêcher cordeau, qui est mentionné dans la Discussion. Choisissez « Ligne moyenne 4 » d’obtenir une bonne réduction du bruit.
Remarque : Selon la fluorescence intrinsèque présente chez les animaux transgénique, les autres marqueurs fluorescents, aime dextrans, Hoechst, BSA-FITC, agents chimiothérapeutiques fluorescent ou nanoparticules dilués à la concentration voulue dans 0,9 % NaCl peut être administré et évalués dans la tumeur. Elles sont injectées par la queue ou la veine du pénis. - Cliquez sur « Expérimentation » dans l’onglet Acquire et sélectionnez « Nouveau » pour faire une nouvelles données de base.
- Évaluer l’animal à l’aide, en fonction de la question de recherche, 10 X, 20 X ou 40 X, objectif lentilles. À travers l’oculaire, trouver un poste à évaluer.
Remarque : Il est préférable d’utiliser des lentilles sèches avec une NA aussi élevé que possibles, aussi secs lentilles ont un travail relativement longue distance et ne pas besoin de liquide d’immersion. Dans la Discussion, l’utilisation de lentilles de l’objectif-l’immersion en eau est mentionnée. - Un balayage rapide direct permet de trouver le bon gain et offset pour éviter la surexposition et d’optimiser le rapport signal-bruit. Aussi, maintenir des mêmes paramètres d’imagerie pendant et entre les expériences si comparaison quantitative est nécessaire.
Remarque : D’autres considérations pour l’imagerie optimale sont mentionnées dans la Discussion. Le zoom et la position XYZ peuvent être finalisées pendant le balayage direct en utilisant le panneau de configuration. - Pour mettre une Z-pile, sélectionnez « Z-pile » dans l’onglet Acquire font un Z-scan rapide utilisant la position Z dans le panneau de contrôle et de définir le début et la fin de l’analyse en cliquant sur « Begin µm » et « Fin µm. » Définir la taille de Z-étape liée à la taille de trou d’épingle.
- Capturer les images en cliquant sur « Démarrer ».
Remarque : Comme la microscopie intravitale est tout au sujet cinétique et donc dynamiques sont observées, un compromis entre le temps nécessaire pour acquérir une image et la vitesse des processus biologiques doit être faite. En général, plus la résolution, les canaux plus fluorescents sont scannés et plus le balayage sur le terrain, les plus de pixels par image. Z-piles plus épais se traduisent par un temps plus d’imagerie. Une fois de plus d’imagerie augmente les chances d’artefacts de mouvement et peut endommager les tissus imagés. En outre, sachez que certaines étiquettes fluorescentes de balayage provoque de blanchiment et de toxicité, qui est affectée par la puissance du laser et de la concentration du colorant accumulé. - Après la numérisation de la Z-pile peut être évaluée rapidement en cliquant sur « projection maximale ». La Z-pile est automatiquement enregistrée dans la base de données et peut être renommée.
6. analyse de données
- Selon la question de recherche original, utilisez l’une des plusieurs logiciels, comme ImageJ5, Matlab11ou Amira, analyse des données. Analyse correcte est indispensable.
Résultats
Le principal attribut d’imagerie intravitale est la visualisation longitudinale de processus cellulaires sans intervention invasive. Pour ce faire, les animaux transgéniques exprimant un marqueur fluorescent constitutif ou inductible dans les cellules d’intérêt sont utilisés. La figure 2 illustre l’expression d’étiquettes fluorescentes eNOStag-vert fluorescent protein (GFP)9 et Rosa-mTmG souris lignes10. L’eNOStag-GFP est une lignée de souris qui a été produite interne utilisant un gène tronqué eNOS comme une balise de GFP. Ce qui est important, eNOS est fortement exprimée dans les cellules endothéliales, et le signal de la GFP est clairement visible dans th eGolgi et de la membrane cellulaire (Figure 2 a). Rosa-mTmG souris ont un allèle de journaliste de Cre axés sur la membrane de la fluorescence de deux couleurs. Cette ligne exprime mTomato fluorescence dans les cellules généralisées et mGFP dans les cellules exprimant une recombinase Cre et est largement utilisée pour le traçage de la lignée. Comme un morceau de la tumeur est transplanté provenant d’un donneur non transgéniques, fluorescence rouge est principalement exprimé par pièces de stroma dans la tumeur (par exemple, dans la membrane des cellules vasculaires, cellules, s’est infiltré dans les cellules sanguines et associées à la tumeur fibroblastes (Figure 2 b)).
Formation de vaisseaux est étroitement contrôlée, et un excellent modèle pour étudier c’est le développement rétine12,13. En outre, la croissance tumorale navire est un processus cinétique qui est semblable dans son principe au développement des vaisseaux rétiniens. Cependant, bateaux de tumeur manque d’organisation et, qu’une tumeur est une rénovation en continu, est donc la vascularisation associées à la tumeur. Cela peut avoir ses avantages lorsque la tumeur est utilisé comme un modèle angiogénique, comme tous les stades de développement de navire peuvent souvent être trouvées dans la tumeur même en même temps. Il s’agit d’un front de germination endothélial développe dans une partie non vascularisée de la tumeur (Figure 2) ; vaisseaux endommagés (Figure 2D) ; et un lit vasculaire établi (Figure 2E-j’ai) avec mature, ramifiée navires (Figure 2E-II). Cependant, les cellules endothéliales angiogéniques trouvera aussi dans ces domaines. Quand ils sont stimulés par des stimuli angiogéniques, une cellule endothéliale dépasse filopodes (Figure 2E-III) et peut avancer dans une cellule de pointe, à l’aide de ces filopodes migration directionnelle et du balayage (Figure 2E-IV). Cette cellule de pointe migre dans l’interstitium de tumeur et est suivie par la Division des cellules de tige. Une cellule unique pointe endothéliales possède plusieurs filopodes en expansion, se rétracter et renouveler à tout moment et peut être suivie à l’aide de la microscopie intravitale (Figure 2F).
Deuxièmement, la microscopie intravitale peut servir à déterminer la formation de lumen à un front angiogénique, la circulation tout au long de la tumeur et extravasation sanguine. Selon déjà à ce jour des signaux fluorescents intrinsèques chez l’animal, les différents composés fluorescents peuvent être administrés. Extravasation et du débit sanguin peuvent être visualisées à l’aide de Hoechst, dextrans fluorescents ou BSA-FITC. Pour les longues études sur extravasation flux et particules de sang, circulation longue fluorescent étiqueté pégylé nanoparticules de 100 nm peut être utilisé. Pour plus d’informations sur la préparation de ces nanoparticules, voir une précédente publication5. L’emploi de ces composés est illustré dans la Figure 3. Les cellules endothéliales chez une souris de Rosa-mTmG peuvent être clairement vus envahir le tissu tumoral. Flux sanguin fonctionnelle est démontrée par la fluorescence mauve de nanoparticules systémiquement injectées dans la lumière des tubes vasculaires (Figure 3 a-I). NANOPARTICULES atteint étroitement des cellules endothéliales qui illustrent la formation d’une lumière dans la zone de cellules de tige (Figure 3 a-II). La livraison des agents chimiothérapeutiques administrés systématiquement dépend d’une vascularisation fonctionnelle afin d’atteindre l’interstitium de tumeur, et tel qu’illustré à la Figure 3 b, agents injectables, indépendamment de leur taille, ne pénètrent pas dans les zones avec des navires détruits, compressé de bateaux ou navires avec stase du sang.
Dans la plupart des organes, le revêtement endothélial forme une barrière fonctionnelle entre le sang et les tissus sous-jacents et le passage des molécules est étroitement contrôlée. Associées à la tumeur vasculaire, cependant, est connu pour être perméable, et coupure de pores dépend beaucoup de la tumeur type14. Les dextranes conjugué fluorescent avec différentes tailles peuvent être injectés pour évaluer le débit sanguin, la perméabilité et l’extravasation. Hoechst (615 Da) se diffuse rapidement dans le tissu tumoral et est absorbé par les cellules environnantes (Figure 3-J’ai). Peu de temps après l’injection, dextran de 10 KDa (Figure 3CII) et 2 MDa (Figure 3C-III) se trouvent dans le sang. Cependant, dextran que 10 KDa se retrouve également dans l’interstitium de tumeur, ce qui indique la perméabilité de la paroi endothéliale des molécules plus petites, qui est une caractéristique attribuée aux vaisseaux de la tumeur. 40 min après que injection (Fig. 3C-IV), dextran 10 KDa est éliminé de la circulation sanguine (Figure 3C-V) et l’intensité de fluorescence de dextran 2MDa est diminué ainsi (Figure 3C-VI). Cependant, grands dextranes ne se trouvent pas dans l’interstitium de tumeur, démontrant l’absence de la perméabilité aux grosses molécules dans ce laps de temps.
Physiopathologie des tumeurs, avec ses espaces très proliférantes, nécrotiques et non vascularisées, peut être très instructif lorsque la tumeur est utilisé comme un modèle angiogénique. Toutefois, cela pose un problème de traitement efficace et des enquêtes. L’hétérogénéité du système associées à la tumeur vasculaire entraîne une distribution hétérogène des médicaments administrés, laissant l’ensemble des zones exemptes de drogue15. Afin d’améliorer l’administration de médicaments, plusieurs stratégies peuvent être appliquées15,16,17, et la progression thérapeutique peut être examinée à l’aide de cette conception intravitale. Le système associées à la tumeur vasculaire peut être manipulé à l’aide d’agents vasoactifs pour améliorer la livraison de drogue17. Les résultats de la manipulation de navire de tumeur utilisant alpha de nécrose de tumeur (TNF) comme agent vasoactif en combinaison avec Doxil, la formulation liposomale encapsulée de la doxorubicine, un agent chimiothérapeutique sont présentés dans ce manuscrit5, 18 , 19. à la différence de dextrans, pégylé nanoparticules sont faites pour circuler pendant plusieurs heures, voire plusieurs jours, dans la circulation de sang20.
Tel que mentionné précédemment, la tumeur peut être préalablement numérisées afin d’identifier les secteurs tumeur correct selon la question de recherche. Sort de la drogue peut être évaluée dans les zones avec une vascularisation fonctionnelle par rapport aux zones avec un lit vasculaire déjà endommagé (données non présentées). Pour enquêter sur le sort des agents chimiothérapeutiques sans interférence cytotoxique, nanoparticules avec la même composition que l’agent thérapeutique peuvent être utilisés comme une drogue de modèle. Un animal eNOStag-GFP a été traitée i.v. avec ces nanoparticules et imagés 24h plus tard. NANOPARTICULES étaient encore présents dans le système vasculaire, avec extravasation minime dans l’interstitium de tumeur (Figure 4 a-I). Toutefois, lorsque les nanoparticules ont été administrés en combinaison avec le TNF, extravasation observa de la circulation sanguine dans l’interstitium de tumeur (Figure 4 a-II), en augmentant les medicaments intratumorale. La localisation intracellulaire d’un composé à l’aide de lentilles de l’objectif à haute résolution, peut être reconnue, comme illustré ici par la localisation nucléaire de Hoechst dans les cellules endothéliales verts et de l’interstitium de tumeur (Figure 4 b). En outre, comme beaucoup d’agents chimiothérapeutiques, comme la doxorubicine, intercaler avec l’ADN, la localisation de ces composés peut être évaluée. Doxorubicine a des propriétés fluorescentes rouges, et le nanocarrier peut être étiqueté avec, par exemple, perchlorate de tetramethylindotricarbocyanine (DiD). Un animal eNOStag-GFP a été injecté i.v. avec Doxil-fait en combinaison avec le TNF, et les images ont été prises 24 heures après le traitement. Doxil-extravasé hors des vaisseaux sanguins et a été transporté vers le haut en l’entourant d’un tissu tumoral (Figure 4-j’ai). Une évaluation plus détaillée des différentes cellules (Figure 4C-II) a montré que le transporteur se trouvent dans le cytoplasme, tandis que la doxorubicine libéré a été observée dans le noyau cellulaire.

Figure 1 : Instruments, dorsales pli cutané chambre et installation de l’équipement requis pour le mode opératoire. (A) tumeur fragments (a) et les instruments chirurgicaux nécessaires à l’implantation. Instruments non standards sont un perforateur d’oreille (b), un tournevis micro (c) et une aiguille tordue (d). (B) dorsale du pli cutané chambre fenêtre. Recto (a) et (b) la fenêtre de retour (flèche : trous pour sutures ; flèche : trous pour les boulons), 2 boulons (c), 2 écrous (d), 1 remplissage verre (e), 2 verres de couverture (f) et 2 fixation anneaux (g). En outre, circlips sans crochets (flèche blanche) peut être utilisé lorsque requis. (C) chambre sur mesure porte b, boulons pour la chambre-à porte (b), plate-forme de contrôle de la température (c), les boulons pour fixer le support de la chambre à la plate-forme (d), et le titulaire avec l’anesthésie tube (e). (D) Animal monté dans le porte de la chambre sur la plate-forme. Une tumeur B16BL6 (flèche) est visible dans la zone d’affichage de la fenêtre. (E) l’équipement nécessaire pour l’évaluation intravitale. Ordinateur avec imagerie et microscope contrôle logiciel (a), standard fluorescent lumière (b) et le microscope. Un multiphoton confocal a été utilisé (c) avec un appareil d’anesthésie (d). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
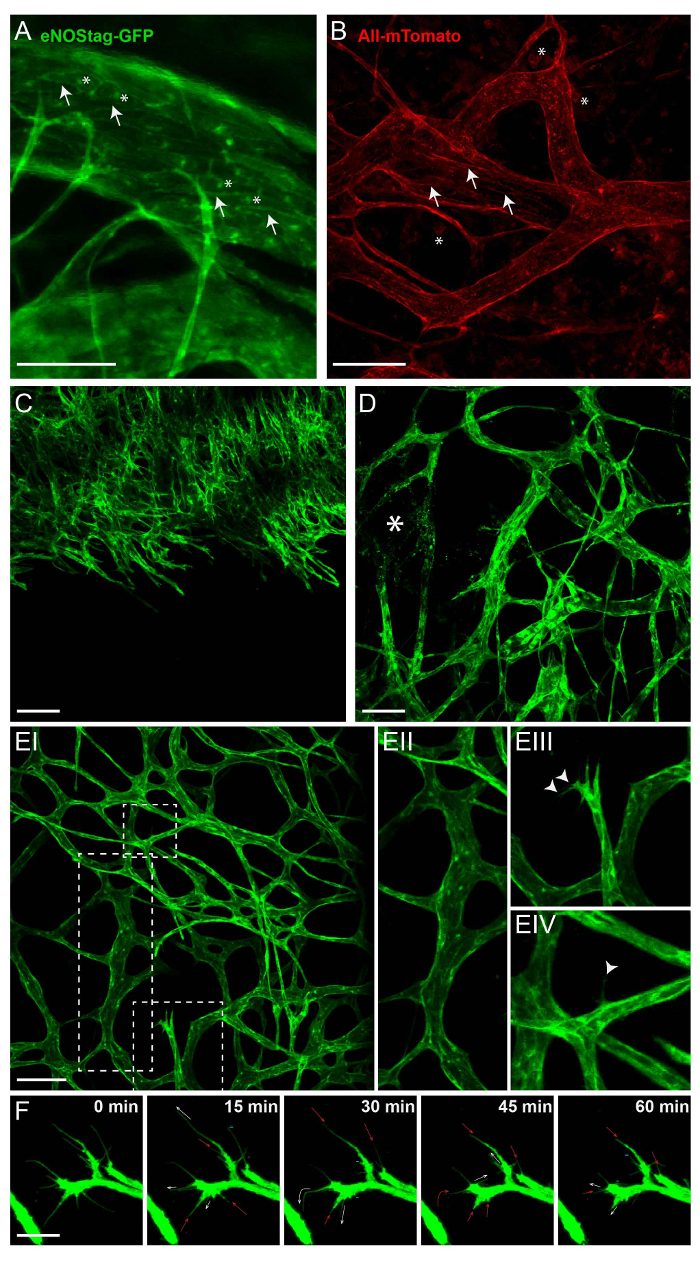
Figure 2 : fluorescence intrinsèque d’animaux transgéniques. Toutes les images présentées ici sont des projections de Z-pile entre 50 et 70 µm d’épaisseur. (A) dans la ligne d’eNOSGFP-tag, GFP est exprimée dans le Golgi (astérisque) et la membrane de la cellule (flèche) des cellules endothéliales. Echelle = 100 µm. (B) intratumorale expression de mTomato dans la ligne de Rosa-mTmG est principalement trouvée dans la membrane cellulaire des cellules vasculaires (flèche) et des cellules sanguines (astérisque). Echelle = 100 µm. (C) A projection de croissance angiogéniques front dans une tumeur non vascularisée. Echelle = 100 µm. (D) A projection d’une partie de la tumeur avec des navires établis et abîmés (astérisque). (E) une projection de la vascularisation tumorale établie (AE) montrant tique mature navires (IIe) ; cellules endothéliales angiogéniques avec filopodes (EIII, pointe de flèche) ; et un navire de maturité, d'où une seule cellule endothéliale s’étend un filopodium (EIV, pointe de flèche) dans l’interstitium. Echelle = 100 µm. mouvement (F) des filopodes, suivi pendant 1 h. Toutes les 15 min, une Z-pile a été prélevée ; une projection maximale est présentée ici. Étendez les filopodes (flèche blanche), stagnant (=), rétractable (flèche rouge), ou même complètement disparaître (-). Echelle = 25 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Administration des étiquettes injectables pour illustrer l’extravasation et la circulation sanguine. Souris de mTmG Rosa (A), A a été injectée avec des nanoparticules fluorescentes violets, et une Z-pile d’un front de cellule pointe invasion a été prise 10 min plus tard (AI). Une projection montrant que des germes plus endothéliales ont une lumière fonctionnelle (AII, flèche). Que rarement choux endothéliales sont visibles sans écoulement (AII, pointe de flèche). Echelle = 250 µm. (B) cette projection Z-pile montre une zone de navire détruit tumeur chez un animal eNOStag-GFP avant le traitement (BI). L’animal a été injectée avec des nanoparticules (violet, BII) et Hoechst (bleu, BIII). Nanoparticules et Hoechst n’atteignent pas des zones détruites, indiquées par les débris cellulaires granulé exprimant toujours GFP. Echelle = 250 µm. (C) une souris eNOStag-GFP a été injectée avec deux dextrans de différentes tailles (rouge = Dextran 2 MDa ; violet = dextran 10 KDa) et Hoechst (bleu = 615 Da), et le seul plan images sont présentés ici. 10 min après l’injection, la présence dans le sang et l’extravasation sont visibles dans la même image. Hoechst extravasates presque immédiatement sur les vaisseaux sanguins et est absorbé par les cellules voisines (CI). Dextran 10 KDa (CII) peut être vu dans les vaisseaux et dans l’interstitium de tumeur. Dextran 2 MDa (CIII) se trouvent dans les vaisseaux. 40 min après l’injection (CIV), Dextran 10 KDa disparaît du sang (CV), et l’intensité de fluorescence de Dextran 2 MDa était aussi réduite (CVI). Echelle = 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
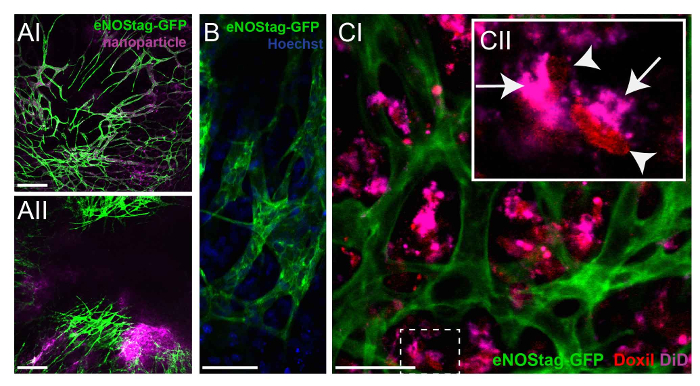
Figure 4 : enquêter sur le sort des agents chimiothérapeutiques. (A) un animal eNOStag-GFP a été traitée i.v. avec des nanoparticules et imagés 24h plus tard. Les nanoparticules sont encore présents dans les vaisseaux, avec extravasation minime dans l’interstitium de tumeur (AI). Nanoparticules sont associées au TNF, extravasation est observée de la circulation sanguine dans l’interstitium de tumeur (AII). Echelle = 250 µm. (B) en utilisant des lentilles à haute résolution, le cytoplasme endothélial (vert) et noyau (bleu) d’une cellule individuelle peuvent être reconnus. Echelle = 50 µm. (C), un animal eNOStag-GFP a été injecté i.v. avec Doxil-fait en combinaison avec le TNF, et les images ont été prises 24 heures plus tard. Ici, l’extravasation de Doxil-a fait sortir les vaisseaux dans la tumeur interstitium est évidente (CI). Une évaluation plus détaillée des cellules individuelles (CII) montre que le transporteur pourpre se trouvent dans le cytoplasme (flèche), tandis que la doxorubicine libéré (rouge) est observée dans le noyau cellulaire (pointe de flèche). Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Comme la tumeur et le développement de tumeurs navire, ainsi que des effets thérapeutiques de tumeur, sont des processus très dynamiques, évaluation intravitale est un outil élégant de faire une évaluation correcte de ces processus de manière spatiale-dépendante du temps et. Avec la multiplication des marqueurs de cellules vivantes, la création d’animaux transgéniques et l’avancement des modalités d’imagerie, imagerie intravitale devient plus populaire. Même si l’histologie est encore couramment utilisée, et une multitude de marqueurs peut être utilisée pour identifier les cellules et structures, découpe de tissu présente des inconvénients lors de l’étude des processus dynamiques. La dissection des tissus est nécessaire, fournir uniquement des informations statiques ; fixation influe sur la qualité de tissu ; et tranchage interactions cellulaires de dommages-intérêts. En outre, lors de l’étude des processus dynamiques, dissection des tissus aux points de temps différents et souvent présumées, nécessite une grande quantité d’animaux. Avec l’imagerie intravitale, les dimensions spatiales de XYZ et la dimension supplémentaire de temps peuvent être évaluées chez le même animal, permettant le positionnement correct des différents acteurs dans l’espace et le temps. Par conséquent, points dans le temps optimale ne sont pas manqués, et le nombre d’animaux utilisé par expérience est considérablement réduit. Deuxièmement, la fenêtre de temps établie avec évaluation intravitale peut être extrapolée pour optimiser l’extraction tissulaire. En troisième lieu, la scène désirée de la croissance des vaisseaux peut être identifiée intravitally et colorée comme un tissu entier-montent.
La conception intravitale mentionnée dans ce manuscrit utilise une combinaison d’animaux transgéniques exprimant une étiquette fluorescente dans les cellules endothéliales, a mis à jour le dorsale du pli cutané modèle de chambre et un microscope multiphoton confocal dédié.
Les cellules endothéliales passent par un certain nombre d’étapes21,22 au cours de l’angiogenèse, et ces étapes peuvent souvent être vus simultanément dans une tumeur. À l’aide de la lignée de souris eNOSTag-GFP, cellules endothéliales individuelles peuvent être suivies, et même filopodes dynamique peut être retracée. C’est donc un bon modèle pour étudier le développement du navire intravitally. Selon les étiquettes intrinsèques déjà à ce jour, les agents fluorescents injectables peuvent être utilisés afin d’évaluer la formation de lumen, débit sanguin, l’extravasation et clairance sanguine. La souris est imagée en continu pendant 5 h. L’évaluation à long terme d’un animal est faisable lorsque plusieurs Précautions concernant l’anesthésie de l’animal, qui a été décrit précédemment23. Comme cette recherche se concentre sur le cancer, les tumeurs tissus ou des cellules ont été implantés. Cependant, nous avons expérimenté également métatarses et poumons embryonnaires. Toutefois, le taux de croissance du tissu sous étude est limité, car après quelques semaines, la peau commence à repousser, qui peut être un problème avec des tissus ou des tumeurs à croissance lente.
Pendant la phase de validation, la partie dorsale que du pli cutané chambre de fenêtre a été considérablement modifié par rapport au modèle classique4. Les cadres sont construits en matériaux synthétiques autoclavable et sont légers et petits, avec une zone de grand-vue de la fenêtre. Le crochet de la bague de retenue (Figure 1Bg, pointe de flèche blanche) est utilisé uniquement pour le retrait facile de l’anneau. Anneaux de retenue sans crochets peut être utilisé lorsque ceux-ci interfèrent avec l’imagerie. La peau est tendue pas trop, desserrant ne se produit pas dans ce modèle, et les infections sont rarement observées. Ces modifications réduisent l’inconfort animale et d’affiner la procédure animale significativement. Outre, les parties métalliques peuvent être facilement supprimées lorsque la tumeur à l’aide de MRI24d’imagerie.
N’importe quel microscope puisse être adoptée à intravitally image dorsale chambres du pli cutané. La principale exigence est la quantité d’espace disponible entre la platine du microscope et la lentille de l’objectif. Un aspect important qui affecte l’imagerie est mouvement. Pour éviter les artefacts de mouvement, une plate-forme qui s’inscrit dans le tableau de microscope (après le retrait de toutes les insertions) et prend en charge de la souris doit être utilisée. Il n’est pas nécessaire de restreindre la souris lorsqu’il est sous anesthésie, et il est préférable de laisser le souffle de souris librement. Toutefois, la fenêtre est boulonnée sur la plate-forme, ce qui donne une fixation optimale du champ de vision (c.-à-d., la tumeur est visible à travers la chambre de la fenêtre). La plate-forme est chauffée à l’aide d’une garniture de chauffage électronique, tel qu’utilisé pour le chauffage des animaux. Cette plate-forme a été effectuée en interne, et les spécifications peuvent être obtenues sur demande. Un objectif de haute résolution est une nécessité lors de l’évaluation des processus intracellulaires et permet d’établir une distinction entre le cytoplasme et le noyau. L’utilisation d’une lentille conique avec une bonne résolution optique (NA élevé) mais une relativement longue distance de travail (préférence 2 mm ou plus) est recommandé. La limitation en imagerie est la profondeur de pénétration et l’intensité de fluorescence des étiquettes. En outre, le photoblanchiment, phototoxicité et la saturation doivent être évitées pendant la formation image.
Ici, un confocal-multiphoton intégré et un microscope confocal ont été utilisés. Le multiphoton est en position verticale, tandis que le confocal est un microscope inversé. L’avantage d’un microscope vertical est la facilité d’utilisation de lentilles immersion dans l’eau. Ces lentilles ont un NA élevée et une longue distance de travail, même à un grossissement élevé (p. ex., 20 ou 40 X). Plus précisément, il est recommandé d’obtenir une lentille de-immersion dans l’eau 20 X NA 1.0, qui est vendu par plusieurs entreprises. Sachez que, lorsqu’on utilise des lentilles de l’immersion, l’objectif et du liquide d’immersion doivent être chauffé à 37 ° C. Pour les meilleures images, il est recommandé d’utiliser les réglages optimaux de confocal (c.-à-d., trou d’épingle à 1 unité aérée, aussi bas que possible, gain pas trop élevé de puissance de laser (surtout si le gain introduit le bruit), line vitesse au maximum et pas avec une moyenne de scans). Surexposition, la saturation et la différence d’intensité entre images, compromettent la qualité des données. Il est recommandé d’éviter la saturation et la surexposition. Ceci peut être contourné par l’acquisition d’images à des réglages différents. Changer le gain est la meilleure façon de changer la luminosité de l’image. Le cas échéant, la puissance du laser peut être réglée. Afin de normaliser la qualité d’image, diapositives avec une intensité de fluorescence fixe peuvent être utilisés. Il faut garder à l’esprit que, même lorsque le microscope est défini de façon optimale, une qualité d’image est déterminée dans une large mesure par la qualité de la chambre de la fenêtre et les tissus
Lorsque vous numérisez simultanément plusieurs marqueurs fluorescents, cordeau, dans lequel un fluorophore est détecté dans le canal d’une autre, doit être évitée. Évitez les cordeau en utilisant une combinaison des fluorophores avec les spectres qui se chevauchent un minimum et par balayage entre les membrures séquentiel. Les images présentées ici ont été analysés à l’aide de 3 balayages séquentiels (piste 1 : GFP, DID ou fluor647 avec le laser 488 et 633 ; Track2 : rhodamine, Doxil ou mTomato avec le laser 543 ; et Track3 : Hoechst avec le laser 405).
La possibilité d’évaluer plusieurs stades de développement de tumeurs bateau, pointe cellule dynamique, formation de lumen, extravasation et blessures vasculaires est montrée ici. À l’aide de la ligne eNOStag-GFP, secteurs tumeur avec un lit vasculaire détruit sont facilement détectés par granulé restes cellulaires exprimant toujours GFP. Aucun agent injectable a été détectée dans ces domaines, indiquant l’absence de flux. Cela signifie que les administrés des agents chimiothérapeutiques n’atteindra pas non plus ces zones. Cependant, destruction du navire peut également être un résultat thérapeutique. Évaluation préliminaire de la tumeur, pour vérifier la destruction du navire avant le traitement, est une condition préalable à l’évaluation thérapeutique précise et peut être facilement réalisée à l’aide de ce dispositif expérimental.
Il y a une multitude de possibilités pour lesquelles la microscopie intravitale peut être utilisée, et discussion détaillée déborde le cadre de la présente publication. Pour donner un bref aperçu, applications possibles comprennent des études sur l’accumulation d’agents chimiothérapeutiques dans le tissu tumoral, le développement des vaisseaux (p. ex., le nombre de navires, les branches et les intersections) et la circulation sanguine, les interactions cellule-cellule, la cellule cible et transformation intracellulaire, ainsi que des exemples mentionnés ci-dessus et ci-contre. Comme l’analyse est basée sur la fluorescence, être au courant des fluctuations d’intensité en raison de la qualité de la fenêtre ou le tissu. En outre, comme un tissu tumoral est relativement épais, fluorescence par dessus ou en dessous du plan de vue a un impact sur le signal dans l’image. Il est préférable de combiner l’analyse quantitative d’image avec des mesures objectives. Par exemple, si vous êtes intéressé dans les concentrations de médicament, enlever le tissu tumoral de la fenêtre après la microscopie intravitale et déterminer le contenu à l’aide avec l’HPLC à comparer avec les images confocales de médicament.
L’évaluation de la réponse tumorale peut être effectuée aussi bien à l’aide de ce modèle, mais avec quelques précautions. On doit réaliser que les tumeurs poussent également vers l’intérieur, dans la peau. Mesures 3D peuvent être effectuées si la pénétration est assez profonde pour couvrir la tumeur entière. Dans un tel cas, colorants rouge sombre devraient être utilisés. La chambre de fenêtre comme décrit ici traite de tumeurs dans un environnement de peau et il est important de souligner que la fenêtre maintienne une température légèrement inférieure à la température de corps de souris normales. Par conséquent, il est préférable d’étudier des tumeurs dans le cadre environnemental droit micro pour confirmer des études intravitale avec la partie dorsale du pli cutané chambre fenêtre. Ce qui est important, la partie dorsale du pli cutané chambre offre un aperçu de la cinétique des processus et des mécanismes, fournissant une base instrumentale pour l’amélioration de la thérapie. On trouvera également des informations supplémentaires sur la biodistribution et pharmacocinétique. Classiquement, ces études de biodistribution sont effectuées en traitant les animaux porteurs de tumeurs et dissection des tumeurs et des organes pour mesurer l’absorption de drogues. En utilisant ce modèle intravital, l’emplacement intratumorale d’un médicament (c.-à-d., intravasculaire, intratumorale, intracellulaire, ou nucléaire) peut être fourni5,25,26. Est non seulement l’emplacement de la drogue, a révélé, mais également le temps fenêtre-de-occasion à saisir pour l’absorption optimale.
En utilisant le dispositif expérimental décrit dans cet article, un large éventail de paramètres peut être évalué dans un cadre temporel et spatial. Plus précisément, nous démontrons que la microscopie intravitale fournit des renseignements importants sur la dynamique de développement de navire de tumeurs et de la réponse thérapeutique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Rien van Haperen et Rini de Crom pour leur développement et leur don de la ligne eNOSTag-GFP, Joost A.P. Rens pour son assistance technique pour le travail d’animaux et les gardiens d’animaux pour leur aide. Les installations de microscopie utilisées font partie du pôle de l’imagerie optique Erasmus, et nous tenons à remercier le personnel de l’OCI pour leur service. Cette étude a été financée par grant DDHK 2000-2224 du Dutch Cancer Society, « Vereniging Trustfonds » Université Érasme de Rotterdam et « Stichting Erasmus Heelkundig Kankeronderzoek », et nous remercions les membres des comités pour leur générosité.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma | D1145 | Supplemented with 10% FCS |
| Trypsin-versene (EDTA) | Lonza | BE17-161E | Make a 0.1% solution in PBS, sterile |
| PBS | |||
| Window frames | Costum made | ||
| Filler glass 10 mm, 0.55 mm | Abrisia technologies | ||
| Cover glass 12mm, #1 thickness | Thermo Scientific/VWR | 631-0713 | |
| Hear removal gel (veet) | for sensitive skin | ||
| Eye ointment | |||
| Buprenorfine hydrochloride | use 0.05 mg/kg | ||
| Anesthesia unit | O2/Isoflurane inhalation unit with an chamber and tubeing+cone | ||
| insulin syringe 0.5ml x 12.7mm 29g, green | BD | 324824 | |
| Needles 23G 1 1/4" | Braun | 4657640 | |
| Needles 25G 5/8" | Braun | 4657853 | |
| Sutures silkan 0.7 | Braun | 1134019 | |
| Nuts | Jeveka | 934 A2 1 | |
| Bolts | Jeveka | 84 A2 1 10 | |
| 0.9% NaCl | |||
| Microscope + software | The space between table and objective need to be wide enough to hold the animal | ||
| Heated temperature controlled platform | Costum made | ||
| Window holder | Costum made | ||
| tetramethylrhodamine 2,000,000 MW dextran | Invitrogen | D7139 | 100 µg/mouse |
| Alexa-fluor 647 10,000 MW dextran | Invitrogen | D22914 | 100 µg/mouse |
| Hoechst 33342 | Invitrogen | H1399 | 25 µg/mouse |
| Pegulated nanoparticles | ref 5 | ||
| LEICA TCS SP5 Multiphoton Microscope | Leica | ||
| LAS AF Software | Leica |
Références
- Massoud, T. F., Gambhir, S. S. Molecular imaging in living subjects: seeing fundamental biological processes in a new light. Genes Dev. 17, 545-580 (2003).
- Ellenbroek, S. I., van Rheenen, J. Imaging hallmarks of cancer in living mice. Nat Rev Cancer. 14, 406-418 (2014).
- Brown, E., Munn, L. L., Fukumura, D., Jain, R. K. In vivo imaging of tumors. Cold Spring Harb Protoc. 2010 (7), (2010).
- Palmer, G. M., et al. In vivo optical molecular imaging and analysis in mice using dorsal window chamber models applied to hypoxia, vasculature and fluorescent reporters. Nat. Protocols. 6, 1355-1366 (2011).
- Seynhaeve, A. L., et al. Tumor necrosis factor alpha mediates homogeneous distribution of liposomes in murine melanoma that contributes to a better tumor response. Cancer Res. 67, 9455-9462 (2007).
- Schiffelers, R. M., et al. Ligand-targeted liposomes directed against pathological vasculature. J Liposome Res. 12, 129-135 (2002).
- Straetemans, T., et al. T-cell receptor gene therapy in human melanoma-bearing immune-deficient mice: human but not mouse T cells recapitulate outcome of clinical studies. Hum Gene Ther. 23, 187-201 (2012).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147, 983-991 (2011).
- van Haperen, R., et al. Functional expression of endothelial nitric oxide synthase fused to green fluorescent protein in transgenic mice. Am J Pathol. 163, 1677-1686 (2003).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Manzoor, A. A., et al. Overcoming limitations in nanoparticle drug delivery: triggered, intravascular release to improve drug penetration into tumors. Cancer Res. 72, 5566-5575 (2012).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5, 1518-1534 (2010).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. J Vis Exp. , e50546 (2013).
- Hobbs, S. K., et al. Regulation of transport pathways in tumor vessels: role of tumor type and microenvironment. Proc Natl Acad Sci U S A. 95, 4607-4612 (1998).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat Rev Cancer. 6, 583-592 (2006).
- Koning, G. A., Eggermont, A. M., Lindner, L. H., Hagen, t. e. n., L, T. Hyperthermia and thermosensitive liposomes for improved delivery of chemotherapeutic drugs to solid tumors. Pharm Res. 27, 1750-1754 (2010).
- Seynhaeve, A. L., Eggermont, A. M., ten Hagen, T. L. TNF and manipulation of the tumor cell-stromal interface: "ways to make chemotherapy effective". Front Biosci. 13, 3034-3045 (2008).
- Brouckaert, P., et al. Tumor necrosis factor-alpha augmented tumor response in B16BL6 melanoma-bearing mice treated with stealth liposomal doxorubicin (Doxil) correlates with altered Doxil pharmacokinetics. Int J Cancer. 109, 442-448 (2004).
- Hoving, S., Seynhaeve, A. L., van Tiel, S. T., Eggermont, A. M., ten Hagen, L. T. Addition of low-dose tumor necrosis factor-alpha to systemic treatment with STEALTH liposomal doxorubicin (Doxil) improved anti-tumor activity in osteosarcoma-bearing rats. Anticancer Drugs. 16, 667-674 (2005).
- Gabizon, A., et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res. 54, 987-992 (1994).
- Bergers, G., Benjamin, L. E. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 3, 401-410 (2003).
- Eilken, H. M., Adams, R. H. Dynamics of endothelial cell behavior in sprouting angiogenesis. Curr Opin Cell Biol. 22, 617-625 (2010).
- Nakasone, E. S., Askautrud, H. A., Egeblad, M. Live imaging of drug responses in the tumor microenvironment in mouse models of breast cancer. J Vis Exp. , e50088 (2013).
- van Vliet, M., et al. MR angiography of tumor-related vasculature: from the clinic to the micro-environment. Radiographics. 25, S85-S97 (2005).
- Dicheva, B. M., et al. Cationic thermosensitive liposomes: a novel dual targeted heat-triggered drug delivery approach for endothelial and tumor cells. Nano Lett. 13, 2324-2331 (2013).
- Li, L., et al. Improved intratumoral nanoparticle extravasation and penetration by mild hyperthermia. J Control Release. 167, 130-137 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon