Method Article
Intravitalen Mikroskopie von Tumor-assoziierten Gefäßsystem mit erweiterten dorsalen Hautfalte Fenster Kammern an transgenen Mäusen fluoreszierende
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die intravitalen Bildgebung von transgenen Mäusen zellspezifische fluoreszierenden Marker zum Ausdruck zu bringen. Intravitalen Bildgebung stellt eine nicht-invasive Methode für hochauflösende Beobachtungen an lebenden Tieren mit implantierbaren Windows durch die mikroskopische Visualisierung von Prozessen möglich ist. Diese Methode ist besonders nützlich, um längs Prozesse zu studieren.
Zusammenfassung
Tumor und Tumorentwicklung Schiff sowie Tumor-Ansprechens auf Therapeutika, sind hochdynamische biologische Prozesse. Histologie enthält statische Informationen und ist oft nicht ausreichend für eine korrekte Interpretation. Zusätzliche und oft unerwartete informiert intravitalen Bewertung, in denen ein Prozess in der Zeit eingehalten wird. Mit der Schaffung von transgenen Tieren, die mit dem Ausdruck zellspezifische Marker und live Zelle Tracer, Verbesserungen für bildgebende Geräte und die Entwicklung von mehreren bildgebenden Kammern geworden intravitalen Mikroskopie ein wichtiges Instrument, um besser zu verstehen biologische Prozesse. Dieses Whitepaper beschreibt ein experimentelles Design zur Untersuchung des Schiffes Tumorentwicklung und therapeutische Effekte in einer räumlichen und zeitlichen Weise. Mit diesem Setup, kann die Bühne Schiff Entwicklung, Tipp Zell- und Lumen Bildung, Durchblutung, Extravasation, eine etablierte vaskulären Bett und vaskuläre Zerstörung visualisiert und gefolgt werden. Darüber hinaus können therapeutische Effekte, intratumorale Schicksal und die Lokalisierung von chemotherapeutischen Substanzen auch verfolgt werden.
Einleitung
Während in-vitro- Studien hohe kinetische Abbildungsleistung Prozesse ermöglichen, können in-vitro- Experimente keine Bewertung im richtigen Kontext. Zum Beispiel, kann nicht das Zusammenspiel von Tumorzellen mit Stromazellen Fächern oder Drug-Delivery und Verteilung innerhalb eines Tumors in einer Kultur-Platte untersucht werden. Tiermodelle sind daher verwendet, um die menschliche Physiologie und Pathologie zu imitieren. Die longitudinale Darstellung der Prozesse, vor allem bei einer subzellulären Auflösung ist jedoch schwierig. Molekulare bildgebende Verfahren, wie z. B. Magnetresonanz-Bildgebung (MRI), berechnet Single Photon Emission Tomographie (SPECT) und Positronen-Emissions-Tomographie (PET), haben gute Eindringtiefe aber mangels Auflösung oder nicht anatomische Strukturen zu veranschaulichen. Optische Bildgebung bietet hohen Auflösung und ermöglicht die Darstellung der Strukturen, aber es wird von Armen auf minimale Penetration1begleitet. Die Anwendung der intravitalen Mikroskopie in Kombination mit Fenster-Kammer Technologien, wie z. B. eine dorsale Hautfalte oder Abdominal-Fenster ermöglicht hochauflösende Bildgebung in Vivo2,3,4. Diese Technologie hat deutliche Vorteile, da sie längs Bildgebung über Stunden und sogar Tage für die Darstellung von Prozessen im richtigen Kontext (z. B. Zell-Zell-Interaktionen im abgebildeten Gewebe) und für Auflösungen an den optischen Grenzen ermöglicht erweiterte multiphoton und konfokale Mikroskope.
Die Einführung von transgenen Tieren mit zellspezifische oder Protein Fluoreszenzmarkierungen eröffnet eine Fülle von Möglichkeiten für in Vivo und ex Vivo Experimente. Für Instanz, Zell-Zell-Interaktionen, die Produktion von Proteinen und die Reaktion auf Manipulation oder Therapie studiert werden können Modelle in Vivo mit diesen5,6,7,8. Wichtig ist, positionieren Sie in Ort und Zeit mit der richtigen bildgebende Geräte und Methoden ermittelt werden. Hier, den intravitalen Mikroskopie von Tieren, die mit dem Ausdruck eines endothelialen Markers in Kombination mit injizierbaren Agenten in einen Tumor in einem modifizierten implantiert dorsalen Hautfalte Fenster Kammer vorgestellt.
Protokoll
Alle Tierversuche wurden gemäß niederländischem Recht getan, und Protokolle wurden genehmigt durch den Ausschuss Tier Experimente von Erasmus MC, Rotterdam, Niederlande.
1. Empfänger Maus
- Wann werden die transgenen Mäuse geboren, die Tiere für die entsprechenden Genotyp mit Standardverfahren9Bildschirm.
Hinweis: In diesem Manuskript werden Daten aus einer eNOStag-GFP Linie9 eine Eigenentwicklung und einer gekauften ROSA-mTmG (007676 Lager)10 Linie dargestellt. - Mäuse, die 12 Wochen alt oder älter sind und sind über 20 g, zu verwenden.
(2) Spender Maus
Hinweis: Ein Tumor-Fragment für die Implantation im dorsalen Fenster ist ein nicht-transgenen Spendertieres entnommen. Je nach Tumorart Normal (mit Phänomen Tumoren) oder immungeschwächte (Xenotransplantate) Mäusen verwendet.
- Wachsen Sie die Tumorzellen in einem Medium mit entsprechender Präparate in Kulturflaschen bei 37 ° C und 5 % CO2.
- Entfernen Sie das Medium aus der Zelle Kolben, einmal mit 1 X PBS waschen Sie und lösen Sie die Zellen mittels Trypsin 0,25 %.
- Die Trypsin durch Zugabe von Zellkulturmedium zu inaktivieren. Sammeln die Zellen spin-down bei 1.200 x g für 5 min und das Pellet in 5 mL PBS aufzuwirbeln.
- Verdünnen Sie 20 µL Zellsuspension mit 20 µL Trypan blau, die tote Zellen Flecken. Die Anzahl der lebenden und toten Zellen unter Verwendung einer Hemocytometer; die Zahl der toten Zellen sollte 10 % nicht überschreiten.
- Drehen Sie die Zellen wieder bei 1.200 x g für 5 min und Aufschwemmen der Zelle Pellet in eiskaltem PBS, ertragreiche 1 Million Zellen pro 100 µL. transportieren die Zellen auf dem Eis in den Operationssaal.
- Betäuben Sie das Tier mit Isofluran/O2. Schalten Sie den Sauerstoff und passen Sie den Fluss auf 0,5 mL/min einstellen der Verdampfer Isoflurane auf 3 %. Platzieren Sie nach ein paar Minuten den Mauszeiger in der Anästhesie-Kammer.
Hinweis: Vorausfüllen der Kammer um sicherzustellen, dass es bereit für den Einsatz um Stress zu minimieren. -
Wenn die Maus sediert ist, bringen Sie das Tier auf dem Operationstisch Heizung, bei 37 ° C gehalten und die Schnauze in die Bugnase Anästhesie.
- Hinweis: Das Tier ist richtig sediert, wenn keine Reaktion auf eine Prise Straßenräuber vermerkt ist.
- Rasieren Sie die Maus, um die Injektionsstelle besser zu visualisieren. Impfen Sie mit einer 0,5 mL Insulin Spritze; Injizieren von 100 µL der Zellen in der Flanke der Maus und lassen Sie einen Tumor zu entwickeln.
- Einschläfern des Tieres durch zervikale Dislokation in Narkose als durch Ihre institutionellen Animal Care und Use Committee genehmigt. Mit Mikro Scheren und Pinzetten, Aufschneiden der Haut an der Stelle des Tumors und den Tumor zu sezieren. Setzen Sie den Tumor in einer Petrischale mit PBS. Verwendung von Mikro Scheren und Pinzetten, Fragmente von ca. 1 mm3 (Abbildung 1A-a) den Tumor geschnitten.
Hinweis: Der Tumor der Spender Maus sollte groß genug, um ausreichend Material zu geben, sondern große, nekrotische Tumoren sollte vermieden werden. Für die meisten Tumoren reicht ein Durchmesser von 10 mm.
3. die Implantation der Kammer Fenster
- Durchzuführen Sie alle Verfahren unter aseptischen Bedingungen. Autoklaven der chirurgischen Instrumenten (Abbildung 1A) und Kammer Materialien (Abbildung 1 b).
Hinweis: Die Fenster-Kammer verwendet hier, mit einem Gesamtgewicht von 1,1 g setzt aus Polyether Ether-Keton (PEEK), eine leichte, synthetischen Material, das MRI ist kompatibel. PEEK ist 3.4-fold leichter als Titan, die häufig in der Literatur für diese Fenster verwendet wird. Es ist beständig gegen die meisten Chemikalien, ist inert, nicht provozieren, Immunreaktionen und ist robust. Dieses Fenster ist auch kleiner im Vergleich zu bisher veröffentlichten Windows Design. Ausgestattet mit diesem Fenster zeigen volle Kapazität von Mäusen Bewegung, können klettern und Gewichtszunahme vergleichbar mit Mäusen ohne eine Fenster-Kammer. Denn das Tier auf dem Fenster beißen kann, synthetische Windows dauert ein wenig kürzer im Vergleich zu Titan Fenster; jedoch sind sie einfach zu machen und sind preiswert. Diese besondere Fenster sind hausgemacht und können auf Wunsch erworben werden. - Beruhigen Sie die Empfänger Maus mit Inhalation Anästhetika (d. h. Isofluran/O2) in einem Anästhesie-Kammer. Bringen Sie die Maus auf dem beheizten Operationstisch bei 37 ° C gehalten und die Schnauze in die Bugnase Anästhesie (siehe Punkt 2.6). Wenden Sie Augensalbe zur Vermeidung von Trockenheit an.
- Entfernen Sie die Haare aus dem gesamten zurück durch Rasieren und Haargel entfernen. Achten Sie darauf, dass alle Gel entfernt wird, durch das Tier sorgfältig mit handwarmem Leitungswasser spülen. Trocknen Sie das Tier und reinigen Sie die Haut mit 70 % Ethanol.
Hinweis: Die Rasur-Prozedur kann auch am Vortag Fenster Implantation erfolgen. Die Creme müssen gründlich mit handwarmem Wasser entfernt werden, da dies zu Hautreizungen führen kann. - Markieren Sie die Mittellinie auf der Maus der Wirbelsäule mit einer Markierung um symmetrische Positionierung der Kammer zu gewährleisten. Positionieren Sie die Maus, ziehen Sie die Haut in einer Klappe über der Mittellinie als Klapp-Position und erfassen Sie die Mitte der Klappe zu. Positionieren Sie das Fenster so, dass die Oberseite des Rahmens mindestens 2 mm unterhalb der Mittellinie und Kreis Bereich der Fenster auf der Haut mit einem Marker ist.
- Mit einem Skalpell Halter/Klingengröße 15 und Mikro Schere entfernen Sie die Haut entlang der gezogenen Kreislinie. Achten Sie darauf, dass Sie nicht zugrunde liegenden Faszie zu beschädigen.
Hinweis: Dies erstellt die Fensterfläche Ansicht der Kammer, in denen der Tumor transplantiert wird. - Ziehen Sie die Hautfalte und verwenden Sie ein Ohr-Puncher um 1 mm im Durchmesser durch die Haut, auf beiden Seiten des Ansichtsbereichs (Abbildung 1A-b) Löcher zu stanzen.
Hinweis: Dies sind Löcher für zwei Schrauben, die Fensterrahmen zusammen zu beheben. - Den maßgeschneiderte vordere Kammer-Rahmen mit Schrauben (Abbildungen 1 b-a, 1 b-c) platzieren und Positionieren des hinteren Rahmens (Abbildung 1 b-b) auf die Schrauben. Der hintere Rahmen auf die Schrauben Muttern (Abbildung 1 b-d) stellen.
Hinweis: Diese Schrauben werden verwendet, um die Kammern zusammen gegen beheben die Hautfalte und werden später verwendet, um die Kammer bei der Auswertung unter dem Mikroskop zu immobilisieren. - Ziehen Sie die Haut ca. 2-3 mm über die Oberkante der Rahmen und stellen Sie sicher, dass der Bereich der transplantierbaren Fenster Bereich Kammer entspricht. Platz 23 G Nadeln durch die beiden kleinen Naht Löcher (Abb. 1 b, schwarzer Pfeil) an der Spitze des Rahmens. Ziehen Sie die Muttern auf den Bolzen mit einem micro Schraubendreher (Abb. 1A-c) und einer Aufspannung Nadelhalter, die Muttern zu immobilisieren.
Hinweis: Vorkehrungen treffen, um sicherzustellen, dass die Haut sich nicht, um die Schrauben einschalten und ziehen Sie nicht zu viel. - Ersetzen Sie die Nadeln mit Nahtmaterial, beginnend an der Spitze, um die Bilder auf der Haut zu beheben. Tun Sie dies für die 5 Paare Naht Löcher (Abb. 1 b, weißer Pfeil) im Rahmen.
- Schalten Sie die Maus, um die Rückseite der Kammer Fenster anzuzeigen. Legen Sie ein dickes Stück Füllstoff Glas mit einem Durchmesser von 10 mm und einer Dicke von 0, 55 mm (Abbildung 1 b-e) und dann ein standard Abdeckung Glas 12 mm (Abbildung 1 b-f). Sichern Sie diese mit einem Sicherungsring (Abbildung 1 b-g) im Bereich Back-Kammer.
Hinweis: Der Füllstoff Glas verhindert Platz soll zwischen der Faszie und die Fenster an der Vorderseite, die für die Bildgebung verwendet wird. - Hydrat Fensterbereich in dem der Tumor eingefügt werden, wird indem eine 1 mL Spritze mit steriler 0,9 % NaCl. Lassen Sie ein paar Tropfen fallen auf diesen Bereich. Entfernen Sie überschüssige Kochsalzlösung mit einem sterilen Wattetupfer.
- Erstellen Sie in der Faszie eine Tasche groß genug für die 1 mm3 Tumor Fragment (Abbildung 1A-a) mit einer 25 G Nadel mit ihrer Spitze in einem 90° Winkel (Bild 1A-d) gebogen ist. Mit einem Nadelhalter oder Kelly Zange, legen Sie das Tumor-Fragment in der Mitte der transplantierbaren Fensterfläche Ansicht in dieser Tasche.
- Schließen Sie Fensterbereich mit einem standard Deckglas von 12 mm und einen Sicherungsring.
Hinweis: Eine Luftblase bilden kann, aber es verschwindet innerhalb von Stunden.
4. vor- und Nachsorge des Tieres
- Verwalten Sie Medikamente zur Schmerzlinderung (z.B. Buprenorphin 0,05 mg/kg) subkutan als durch Ihre institutionellen Animal Care und Use Committee genehmigt. Lassen Sie die Maus wieder aus der Narkose unter eine Wärmelampe.
- Platzieren Sie Fenster-tragenden Mäusen einzeln in einem Käfig und in einem klimatisierten Raum um 32 ° C und über 50 % Luftfeuchtigkeit. Stellen Sie sicher, dass die Flaschen mit Wasser bei Raumtemperatur vor indem sie auf den Käfig auslaufen zu verhindern. Verwenden Sie Käfige und Bereicherung, die ungehinderte Bewegungsfreiheit und den Zugang zu Nahrungsmitteln und Trinkwasser zu ermöglichen.
Hinweis: Da dieses Fenster Kammer sehr gut vertragen wird, zeigen Mäuse normales Verhalten. Individuelle Gehäuse verhindert die Beschädigung der Fenster-Kammer von anderen Mäusen verursacht, und die hohe Temperatur/Luftfeuchtigkeit verhindert die Auskühlung nach unten und Austrocknung der die Hautfalte. - Überprüfen Sie die Maus regelmäßig für gekaut-off Nähte, lose Schrauben/Muttern oder Glasscherben Abdeckung. Sofort reparieren Sie und ersetzen Sie, wenn dies der Fall ist. Eine Abdeckung aus leichtem Material kann verwendet werden, um das Fenster zu schützen.
5. intravitalen Imaging
Hinweis: In diesem Verfahren werden multiphoton Mikroskop und die entsprechenden Steuerungs-Software verwendet. Hier werden Software-Pakete, die mit den Mikroskopen bereitgestellt wurden verwendet. Im Prinzip wird jedes Softwarepaket, das kommt mit einem Mikroskop und soll für Mikroskopkontrolle und für die Erfassung von Bildern Suite dazu.
- Schalten Sie das System: PC/Mikroskop, konfokale Kontrolle Gerät, Laserleistung und laser-Emission. Zum Beispiel mit dieser Software starten Sie die Software und initialisieren Sie den Mikroskoptisch (Abb. 1E-a und 1E-c) zu, indem Sie auf "Tabelle initialisieren." Schalten Sie das System und setzen Sie ihn auf den Modus ermöglicht den PC zu steuern, Mikroskop, Xy-Tisch, Z-Positionierung und Bilderfassung.
- Schalten Sie das Fluoreszenzlicht (Abb. 1E-b).
Hinweis: Hiermit wird Fluoreszenzbilder durch das Okular zusammen mit Hellfeld zu bewerten. - Schalten Sie die maßgeschneiderte, temperaturgeführte Plattform (Abbildung 1 C-c; in der Diskussion etwas ausführlicher beschrieben) bei 37 ° c eingestellt
- Einschalten der Anästhesie mit Isofluran/O2 (Abb. 1E-d). Montieren Sie die Anästhesie-Röhre auf den Mikroskoptisch (Abb. 1 C-e). Installieren Sie eine Klammer auf der Xy-Bühne, die Anästhesie Schnauze Stück zu beheben.
- Vorab bewerten Sie das Tier um den Tumor Schiff Entwicklungsstand zu etablieren; Dies hängt von der Geschwindigkeit des Tumorwachstums, aber es kann variieren zwischen einzelnen Mäusen.
- Beruhigen die Maus mit Inhalation Anästhetika (Isofluran/O2) in einem Anästhesie-Kammer (siehe Punkt 2.6).
- Legen Sie das Tier auf die temperaturgeführte Plattform auf den Mikroskoptisch montiert; Dies verhindert, dass die Abkühlung des Tieres wenn es betäubt ist. Stellen Sie sicher, dass die Schnauze der Maus befindet sich in der Anästhesie-Kegel und gelten Sie Augensalbe, wenn die Auswertung länger als 5 Minuten dauert.
Hinweis: Für eine Bewertung, die länger als 1 h, reduzieren Sie Isofluran-Fluss auf 2 %. - Verwenden Sie die Kammer-Schrauben (Abbildung 1 C-b, volle Pfeil) die Kammer auf eine maßgeschneiderte Kammer-Halter (Abbildung 1 C-a) zu beheben. Schrauben Sie diesen Halter (Abbildung 1 C-d, gestrichelter Pfeil) auf die beheizten Plattform (Abbildung 1 C-c).
Hinweis: Diese Kombination verhindert Bewegungsartefakten im Bereich Fenster gleichzeitig das Tier frei atmen. - Achten Sie darauf, das Glas des Ansichtsbereichs Fenster mit einem Wattestäbchen zu reinigen mitten im Wasser, ein verschwommenes Bild und Störungen, die aus Ablagerungen auf der Außenseite des Glases zu verhindern. Legen Sie die Plattform und die Maus auf den Mikroskoptisch (Abbildung 1).
Hinweis: Achten Sie darauf, dass die Rute nicht zwischen der Plattform und den Mikroskoptisch stecken. - Eine Sichtkontrolle der Entwicklungsstand Tumor Schiff mit einem 10 X-Objektiv, Hellfeld und fluoreszierendes Licht.
Hinweis: Fluoreszierende Schiffe sollte im Fokus und die Durchblutung mit Hellfeld sichtbar werden sollte. Wenn das Gefäßsystem deutlich zu erkennen ist, bewerten Sie die Bühne des Schiffes Tumorentwicklung. Zum Beispiel festzustellen Sie, ob früh einsetzende Angiogenese mit dem Wachstum des Tipp-Zellen oder einem bereits etablierten Gefäßsystem für Drug-Delivery. Das gleiche Tier erneut ausgewertet werden kann, und als Tumor-Entwicklung ist ein kontinuierlicher Prozess. Mehreren Etappen können in einem einzelnen Tumor gleichzeitig beobachtet werden.- Wenn es nicht möglich ist, konzentrieren sich auf das Gefäßsystem, das Tier von der Bühne zu entfernen, lassen Sie die Maus wieder und das Tier zurück in einem klimatisierten Raum. Überprüfen Sie es später erneut. Wenn die Maus zur Auswertung bereit ist, fahren Sie mit dem unten beschriebenen Verfahren.
- Schalten Sie die konfokale Laser und das Control Panel durch Klicken auf "Laser" und "Strg-Panel" in der Registerkarte "Konfiguration"
Hinweis: Es wird empfohlen, die Laserleistung niedrig, insbesondere bei der Argon-Laser, um zu verhindern, Bleichen, die Erwärmung des Gewebes und lichtbedingten eingestellt. Das Control Panel kann auf persönliche Vorlieben eingestellt werden. Für intravitalen Bildgebung mit mehreren Fluorophore es wird empfohlen, die folgenden Einstellungen gelten: "smart zu gewinnen, 100 V pro Zug," "smart Offset, 10 % pro Zug," "Zoom, mittlere," "X-Position, mittlere," "Y-Position, Medium," und "Z-Position, 100 µm pro Runde." Passen Sie vor der Bildgebung den Versatz, um das Rauschen zu minimieren und das Signal-Rausch-Verhältnis zu optimieren. Die konfokale Zoom-Funktion ermöglicht eine höhere Vergrößerung ohne wechseln der Objektive. X, Y und Z Kontrolle ist notwendig, die Felder von Interesse zu finden. Für intravitalen Mikroskopie sollte Z-Positionierung etwa 100 µm pro Runde sein, wie Tick Gewebe ausgewertet wird. - Klicken Sie auf "Übernahme" in der Registerkarte "Acquire" und die Einstellung zu ändern: "Akquisitionsmodus XYZ oder XYZT," "Format (512 x 512 oder 1024 x 1024)" und "Speed (400 Hz oder 200 Hz)." Klicken Sie auf "Pinhole" und setzen Sie ihn auf 1 luftig Einheit. Klicken Sie auf "Bidirektionale X".
Hinweis: Um die Bilder zu optimieren, sollte ein Gleichgewicht zwischen Laserleistung, Verstärkung und Lochkamera gefunden werden, ist in der Diskussion erwähnt. - Bei der Bewertung mehrerer Fluorophore, wählen Sie "sequentieller Scan" und "zwischen den Frames" durchbluten, verhindern, dass die in der Diskussion erwähnt wird. Wählen Sie "Line-Durchschnitt 4" für eine gute Reduzierung des Rauschens zu erhalten.
Hinweis: Abhängig von der intrinsische Fluoreszenz in den transgenen Tieres vorhanden, andere fluoreszierenden Markierungen wie Dextrans, Hoechst, FITC-BSA, fluoreszierende Chemotherapeutika und/oder Nanopartikel verdünnt, um die gewünschte Konzentration in 0,9 % NaCl sein kann verwaltet und bewertet im Tumor. Diese werden durch die Rute oder Penis Vene injiziert. - Klicken Sie auf "Experiment" in der Registerkarte "Acquire" und wählen Sie "Neu" um ein neues Data Basis zu machen.
- Bewerten der Tiere mit, je nach Fragestellung, 10 X, 20 X oder 40 X Objektiv Objektive. Finden Sie durch das Okular eine Position, zu bewerten.
Hinweis: Es ist am besten verwenden Sie trockene Linsen mit einer NA so hoch wie möglich, möglichst trocken-Objektive haben eine relativ lange funktionierende distanzieren und keine Notwendigkeit Immersionflüssigkeit zu tun. In der Diskussion ist die Verwendung von Wasser-Immersion Objektive erwähnt. - Verwenden Sie eine schnelle live Überprüfung um zu finden, die richtige Gain und Offset, Überbelichtung zu vermeiden und das Signal-Rausch-Verhältnis zu optimieren. Außerdem behalten Sie gleiche bildgebende Einstellungen während und zwischen den Experimenten ggf. quantitativer Vergleich bei.
Hinweis: Weitere Überlegungen für die optimale Bildgebung sind in der Diskussion erwähnt. Die XYZ-Position und Zoom können während der live-Bild über das Control Panel abgeschlossen werden. - Um eine Z-Stapel zu machen, wählen Sie "Z-Stapel" in die Registerkarte "Acquire" machen einen schnellen Z-Scan mit der Z-Position in der Systemsteuerung und Anfang und Ende des Scans durch Klicken auf "Begin µm" und "Ende µm." Legen Sie die Z-Schritt Größe im Zusammenhang mit der Lochkamera Größe.
- Erfassen Sie die Bilder, indem Sie auf "start".
Hinweis: Da intravitalen Mikroskopie geht Kinetik und daher dynamische Prozesse eingehalten werden, einen Kompromiss zwischen der Zeit benötigt, um ein Bild zu erhalten und die Geschwindigkeit der biologischen Prozesse erfolgen muss. In der Regel, je höher die Auflösung, die mehr fluoreszierende Kanäle sind gescannt und je größer das Scannen Feld, je mehr Pixel pro Bild. Dicker Z-Stapel übersetzen in eine Zeit, mehr imaging. Eine mehr bildgebende Zeit erhöht sich die Wahrscheinlichkeit von Bewegungsartefakten und verursachen Schaden des Gewebes abgebildet. Achten Sie auch darauf, dass bestimmte Fluoreszenzmarkierungen Scannen verursacht, Bleichen und Toxizität, die Laserleistung und die Konzentration der kumulierten Farbstoff betroffen ist. - Nach dem Scannen des Z-Stacks kann schnell ausgewertet werden, indem Sie auf "maximale Projektion". Der Z-Stack wird automatisch in der Datenbank gespeichert und kann umbenannt werden.
(6) Datenanalyse
- Abhängig von der ursprünglichen Fragestellung verwenden Sie verschiedene Software-Programme, wie z. B. ImageJ5, Matlab11oder Amira, für die Datenanalyse. Korrekte Analyse ist entscheidend.
Ergebnisse
Das wichtigste Attribut der intravitalen Bildgebung ist die longitudinale Visualisierung zellulärer Prozesse ohne invasive Eingriffe. Hierzu dienen transgene Tiere mit dem Ausdruck eines konstitutiven oder induzierbaren fluoreszierenden Markers in den Zellen von Interesse. Abbildung 2 veranschaulicht die Expression von Fluoreszenzmarkierungen in eNOStag-grün fluoreszierenden Proteins (GFP)9 und Rosa-mTmG Maus Linien10. ENOStag-GFP ist eine Mauslinie, die im eigenen Haus mit einem abgeschnittenen eNOS-gen als Tag für GFP produziert wurde. Wichtig ist, eNOS drückt sich besonders in Endothelzellen, und das GFP-Signal ist deutlich zu sehen in th eGolgi und Zellmembran (Abb. 2A). Rosa-mTmG Mäuse haben eine Membran-gezielte Zweifarben-Fluoreszenz Cre Reporter Allel. Diese Zeile drückt mTomato Fluoreszenz im weit verbreiteten Zellen und mGFP in Cre-Rekombinase exprimierenden Zellen und wird erheblich zur Linie nachzeichnen. Wie ein Tumor-Stück von einem nicht-transgenen Spender transplantiert, rote Fluoreszenz wird überwiegend durch Stromazellen Teile im Tumor ausgedrückt (z. B. in der Membran der vaskulären Zellen, Zellen, zirkulierenden Blutzellen infiltriert und Tumor-assoziierten Fibroblasten (Abb. 2 b)).
Schiff-Bildung ist streng geregelt, und ein hervorragendes Modell an dieser Studie ist die Entwicklung Netzhaut12,13. Schiff Tumorwachstum ist auch eine kinetische Prozess, der im Prinzip ähnlich wie Netzhaut Schiff Entwicklung ist. Allerdings Tumor Schiffe Mangels Organisation und wie ein Tumor kontinuierlich umgestaltet wird, so ist das Tumor-assoziierten Gefäßsystem. Dies kann seine Vorteile haben, wenn den Tumor als Vorbild angiogenen verwenden wie alle Entwicklungsstadien Schiff oft zur gleichen Zeit im gleichen Tumor gefunden werden können. Dazu gehören eine endotheliale sprießende Front Hineinwachsen in eine UN-vaskularisierte Teil des Tumors (Abbildung 2); beschädigte Schiffe (Abb. 2D); und ein etablierter vaskulären Bett (Abbildung 2E-ich) mit Reifen, verzweigte Schiffe (Abbildung 2E-II). Endothelzellen angiogenen können jedoch auch in diesen Bereichen gefunden werden. Wenn von angiogenen Reize stimuliert, kann ein Endothelzellen ragt Filopodien (Abbildung 2E-III) und in einer Tipp-Zelle, unter Verwendung dieser Filopodien für Scannen und gerichtete Migration (Abbildung 2E-IV). Dieser Tipp Zelle wandert in den Tumor Interstitium und ist gefolgt von teilender Zellen, Stiel. Eine Einzeldüse endothelial Zelle verfügt über mehrere Filopodien zu erweitern, zurückziehen und jederzeit zu erneuern und mit intravitalen Mikroskopie (Abbildung 2F) verfolgt werden kann.
Zweitens kann intravitalen Mikroskopie verwendet werden, um festzustellen, Lumen Bildung einen angiogenen vorne, Blutfluss in den Tumor und Extravasation. Je nach bereits Gegenwart intrinsische Fluoreszenz Signale in das Tier können verschiedene fluoreszierende Verbindungen verwaltet werden. Durchblutung und Extravasation können mit Hoechst, fluoreszierende Dextrans oder FITC-BSA visualisiert werden. Für die erweiterte Studien über Blut fließen und Partikel Paravasation, lange Umlauf Eindringmittel beschriftet pegylierten Nanopartikel von 100 nm verwendet werden kann. Einzelheiten über die Vorbereitung dieser Nanopartikel finden Sie eine vorherige Veröffentlichung5. Die Beschäftigung dieser Verbindungen ist in Abbildung 3gezeigt. Die endotheliale Tipp Zellen in einer Rosa-mTmG Maus ist deutlich erkennbar, das Tumorgewebe eindringen. Funktionale Blutfluss wird durch die lila Fluoreszenz von systemisch injizierten Nanopartikeln in das Lumen der vaskulären Röhren gezeigt (Abbildung 3A-ich). Nanopartikel erreichen eng endotheliale Tipp Zellen veranschaulicht die Bildung von einem Lumen im Bereich Stiel Zelle (Abbildung 3A-II). Die Lieferung von systemisch verabreichten Chemotherapeutika hängt eine funktionale Gefäßsystem um den Tumor Interstitium zu erreichen, und wie in Abbildung 3 b gezeigt, injizierbare Agenten, unabhängig von ihrer Größe dringen nicht Gebieten mit zerstörten Schiffe, komprimierte Schiffe oder Schiffe mit Blut-Stase.
In den meisten Organen die endotheliale Auskleidung bildet eine funktionelle Barriere zwischen dem Blut und dem darunter liegenden Gewebe, und die Passage der Moleküle ist streng reguliert. Tumor-Assoziierte Gefäßsystem, jedoch ist bekannt, undichte und Porengröße Cut-off hängt stark von der Tumor Typ14. Fluoreszierende konjugiert Dextrans mit verschiedenen Größen können injiziert werden, um den Blutfluss, Durchlässigkeit und Extravasation zu beurteilen. Hoechst (615 Da) diffundiert schnell in Tumorgewebe und von umgebenden Zellen aufgenommen wird (Abbildung 3-ich). Kurz nach der Injektion sind Dextran 10 KDa (Abbildung 3CII) und 2 MDa (Abbildung 3 C-III) im Blut gefunden. Dextran 10 KDa auch gesehen ist in der Tumor-Interstitium zeigt die Durchlässigkeit der endothelialen Auskleidung für kleinere Moleküle, die eine Funktion zugeschrieben, Tumor Schiffe. 40 min nach Injektion (Abbildung 3 C-IV), Dextran, die 10 KDa aus den Blutstrom (Abbildung 3 C-V) und die Fluoreszenz Intensität der Dextran 2MDa deaktiviert ist verringert sowie (Abbildung 3 C-VI). Allerdings sind große Dextrans in der Tumor-Interstitium, zeigt einen Mangel an Durchlässigkeit für große Moleküle innerhalb dieses Zeitrahmens nicht gefunden.
Tumor Pathophysiologie, mit seinen stark wuchernde, nekrotische und UN-vaskularisierte, kann sehr informativ sein, wenn den Tumor als Angiogenese-Modell verwenden. Dies stellt jedoch ein Problem für wirksame Therapie und Untersuchung. Die Heterogenität des Tumor-assoziierten Gefäßsystem bewirkt, dass eine heterogene Verteilung der verabreichten Medikamente, ganze Bereiche drogenfreie15verlassen. Zur Verbesserung der Drug-Delivery können mehrere Strategien angewandte15,16,17, und therapeutischen Fortschritt kann mit diesem intravitalen Design untersucht werden. Das Tumor-assoziierten Gefäßsystem kann mit vasoaktive Agenten Verbesserung Droge Lieferung17manipuliert werden. Der Tumor Schiff Manipulation mit Tumor-Nekrose-Alpha (TNF) als vasoaktive Agent in Kombination mit Doxil, die gekapselte liposomale Formulierung von Doxorubicin, als ein Chemotherapeutikum werden die Ergebnisse in diesem Manuskript5, 18 , 19. im Gegensatz zu Dextrans, pegyliertes Nanopartikel werden gebildet, um für mehrere Stunden, wenn nicht Tage, in die Blut-Zirkulation-20zirkulieren.
Wie bereits erwähnt kann der Tumor-Bereich bereits gescannten, die richtige Tumor Bereiche je nach Fragestellung zu identifizieren sein. Medikament Schicksal kann in Gebieten mit einer funktionalen Gefäßsystem im Vergleich zu Gebieten mit einem vorgeschädigten Gefäß-Bett (Daten nicht gezeigt) ausgewertet werden. Um das Schicksal der Chemotherapeutika zytotoxischen störungsfrei zu untersuchen, können Nanopartikel mit der gleichen Zusammensetzung wie das therapeutische Mittel als Modell Medikament eingesetzt werden. Ein eNOStag-GFP-Tier war behandelten i.v. mit dieser Nanopartikel und 24 h später abgebildet. Nanopartikel waren noch vorhanden, in das Gefäßsystem mit minimalen Extravasation in der Tumor-Interstitium (Abbildung 4A-ich). Wenn Nanopartikel in Kombination mit TNF verabreicht wurden, wurde allerdings Extravasation aus dem Blutstrom in den Tumor Interstitium (Abbildung 4A-II), zunehmende intratumorale Drug-Delivery beobachtet. Mithilfe von hochauflösenden Objektiven kann die intrazelluläre Lokalisation einer Verbindung erkannt werden, wie hier gezeigt durch die nukleare Lage der Hoechst im grünen endothelial Zellen und Zellen des Tumors Interstitium (Abbildung 4 b). Wie viele Chemotherapeutika wie Doxorubicin, mit DNA Schaltungen, kann die Lokalisierung dieser Verbindungen ausgewertet werden. Doxorubicin hat rote fluoreszierende Eigenschaften, und die Nanocarrier kann mit zum Beispiel Tetramethylindotricarbocyanine Perchlorat (Tat) beschriftet werden. Ein eNOStag-GFP Tier i.v. injiziert wurde, mit Doxil-Tat in Kombination mit TNF und Bilder wurden 24 h nach der Behandlung. Doxil-dies aus den Blutgefäßen und wurde oben durch umgebende Tumorgewebe (Abbildung 4-ich). Eine detailliertere Bewertung einzelner Zellen (Abbildung 4 C-II) zeigte, dass der Träger im Zytoplasma, gefunden werden kann, während freigegeben Doxorubicin in der zellulären Kern beobachtet wurde.

Abbildung 1: Instrumente, dorsal Hautfalte Kammer und Geräte-Setup für die Prozedur benötigt. (A) Tumor Fragmente (a) und chirurgische Instrumente für die Implantation benötigt. Nicht standardisierte Instrumente sind ein Ohr Puncher (b), micro Schraubendreher (c) und eine verbogene Nadel (d). (B) Rückenflosse Hautfalte Fenster Kammer. Vorne (a) und (b) Fenster hinten (Pfeil: Löcher für die Fäden; Pfeilspitze: Löcher für die Schrauben), 2 Schrauben (c), 2 Muttern (d), 1 Füllstoff Glas (e), 2 Deckgläser (f) und 2 Beibehaltung Ringe (g). Darüber hinaus kann Sicherungsringe ohne Haken (weiße Pfeilspitze) verwendet werden, wenn erforderlich. (C) maßgeschneiderte Kammer Halter (A), Schrauben für die Inhaber von Kammer zu Kammer (b), temperaturgeführte Plattform (c), Schrauben um die Kammer-Halterung an der Plattform (d) befestigen, und die Halterung mit der Narkose Rohr (e). (D) Tier montiert in der Kammer-Inhaber auf der Plattform. Ein B16BL6 Tumor (Pfeil) ist im Bereich Fenster sichtbar. (E) Ausrüstung für den intravitalen Bewertung erforderlich. Computer mit Bildgebung und Mikroskop Control Software (a) standard fluoreszierendes Licht (b) und das Mikroskop. Ein Multiphoton confocal wurde verwendet (c) mit einem Anästhesie-Einheit (d). Bitte klicken Sie hier für eine größere Version dieser Figur.
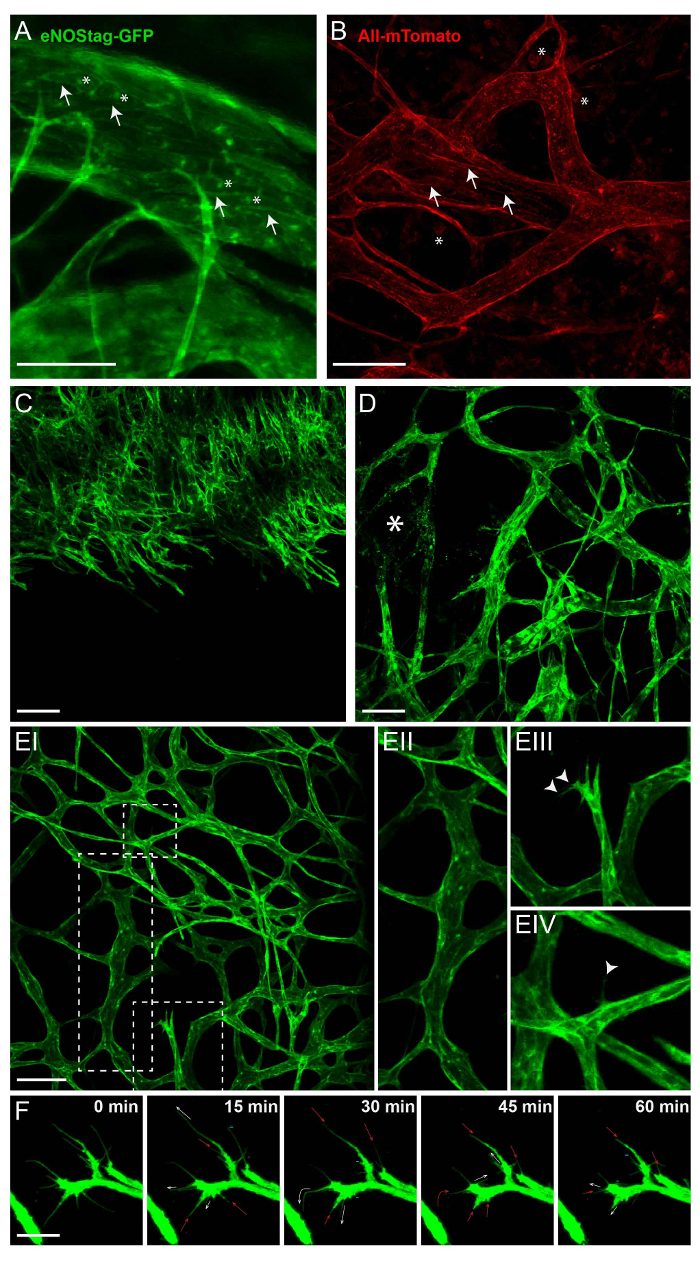
Abbildung 2: intrinsische Fluoreszenz von transgenen Tieren. Alle hier gezeigten Bilder sind Z-Stapel Projektionen zwischen 50 und 70 µm dick. (A) In der eNOSGFP-Slogan drückt sich GFP im Golgi (Sternchen) und Zellmembran (Pfeil) der Endothelzellen. Maßstabsleiste = 100 µm. (B) intratumorale Ausdruck des mTomato in der Rosa-mTmG Zeile findet sich überwiegend in der Zellmembran von vaskulären Zellen (Pfeil) und Blutkörperchen (Sternchen). Maßstabsleiste = 100 µm. (C) A Projektion einer wachsenden angiogenen Front in un-vaskularisierte Tumor. Maßstabsleiste = 100 µm. (D) A Projektion eines Teils des Tumors mit etablierten und beschädigte Schiffe (Sternchen). (E) eine Projektion der etablierten Tumor Vasculature (EI) zeigt Reife Tick Schiffe (EII); angiogenen endotheliale Tipp Zellen mit Filopodien (EIII, Pfeilspitze); und ein Reifen Gefäß, aus dem ein einzelnes Endothelzellen erstreckt sich ein Filopodium (EIV, Pfeilspitze) in das Interstitium. Maßstabsleiste = 100 µm. (F) Bewegung der Filopodien, gefolgt für 1 h. Alle 15 min, war ein Z-Stapel genommen; eine maximale Projektion wird hier vorgestellt. Die Filopodien erweitern (weißen Pfeil), stagniert (=), einziehbaren (roter Pfeil) oder sogar ganz verschwinden (-). Maßstabsleiste = 25 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Verwaltung von injizierbaren Etiketten Extravasation und Blutfluss zu illustrieren. (A) A Rosa mTmG Maus mit lila fluoreszierende Nanopartikel injiziert wurde, und ein Z-Stapel von einer eindringenden Tipp Zelle Front wurde 10 min später (AI). Eine Projektion zeigt, dass die meisten endotheliale Sprossen einen funktionalen Lumen (AII, Pfeil haben). Nur selten können endotheliale Sprossen ohne Strömung (AII, Pfeilspitze) gesehen werden. Maßstabsleiste = 250 µm. (B) diese Z-Stapel-Projektion zeigt einen Tumor zerstörten Schiff in ein eNOStag-GFP Tier vor der Behandlung (BI). Das Tier wurde mit Nanopartikeln (lila, BII) und Hoechst (blau, BIII) injiziert. Nanopartikel und Hoechst erreichen nicht zerstörte Flächen, angezeigt durch granulierten Zellenrückstand GLP noch zum Ausdruck zu bringen. Maßstabsleiste = 250 µm. (C) eine eNOStag-GFP-Maus injiziert wurde, mit zwei Dextrans in verschiedenen Größen (rot = Dextran 2 MDa; violett = Dextran 10 KDa) und Hoechst (blau = 615 Da), und Single-Flugzeug Bilder werden hier vorgestellt. 10 min nach der Injektion, Präsenz im Blut und Extravasation in das gleiche Bild zu sehen sind. Hoechst extravasates fast sofort aus den Blutgefäßen und wird durch die umgebenden Zellen (CI) aufgenommen. Dextran 10 KDa (CII) können in den Behältern und in den Tumor Interstitium gesehen werden. MDa (CIII) Dextran 2 finden Sie in den Gefäßen. 40 min nach der Injektion (CIV), Dextran 10 KDa verschwindet aus dem Blut (CV) und die fluoreszente Intensität der Dextran 2 MDa war auch verminderte (CVI). Maßstabsleiste = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
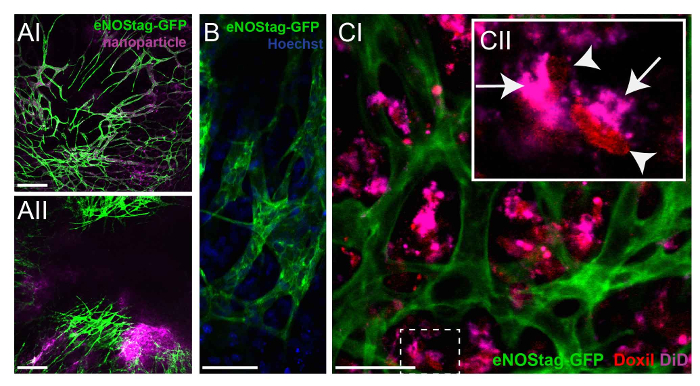
Abbildung 4: das Schicksal der Chemotherapeutika untersuchen. (A) ein eNOStag-GFP-Tier war behandelten i.v. mit Nanopartikeln und 24 h später abgebildet. Nanopartikel sind in Schiffen, mit minimalen Extravasation in der Tumor-Interstitium (AI) noch vorhanden. Wenn Nanopartikel mit TNF kombiniert werden, wird Extravasation aus dem Blutstrom in den Tumor Interstitium (AII) beobachtet. Maßstabsleiste = 250 µm. (B) Using hochauflösende Objektive, die endotheliale Zytoplasma (grün) und Kern (blau) einer einzelnen Zelle können erkannt werden. Maßstabsleiste = 50 µm. (C) eNOStag-GFP Tier wurde mit Doxil i.v. injiziert-Tat in Kombination mit TNF und Bilder wurden 24 h später. Hier, die Extravasation Doxil-hat aus den Gefäßen in den Tumor Interstitium ist offensichtlich (CI). Eine detailliertere Bewertung einzelner Zellen (CII) zeigt, dass die lila Träger im Zytoplasma (Pfeil), gefunden werden kann, während die freigegebenen Doxorubicin (rot) im Nucleus zellulären (Pfeilspitze) beobachtet wird. Maßstabsleiste = 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Tumor und Tumorentwicklung Schiff sowie Tumor therapeutische Effekte, ist hochdynamische Prozesse intravitalen Bewertung ein elegantes Werkzeug, um eine korrekte Einschätzung dieser Prozesse in gewissem Sinne Zeit und räumlichen abhängig zu machen. Mit der zunehmenden Verfügbarkeit von live Zellenmarkierungen, die Schaffung von transgenen Tieren und die Weiterentwicklung der bildgebenden Modalitäten ist intravitalen Bildgebung mehr und mehr populär. Obwohl Histologie noch routinemäßig verwendet, und eine Vielzahl von Markern verwendet werden, kann um Zellen und Strukturen zu identifizieren, hat Gewebe zu schneiden Nachteile bei der Untersuchung von dynamischer Prozessen. Gewebe-Dissektion ist erforderlich, nur statische Informationen; Gewebe-Qualität betrifft, Fixierung; und schneiden schadet zelluläre Interaktionen. Auch bei der Untersuchung von dynamischer Prozessen erfordert Gewebe Dissektion zu verschiedenen und oft vermuteten Zeitpunkten eine große Menge von Tieren. Mit intravitalen Bildgebung können die XYZ Raumdimensionen und die zusätzliche Dimension der Zeit in das gleiche Tier, wodurch die korrekte Platzierung der verschiedenen Akteure möglich in Raum und Zeit ausgewertet werden. Daher optimale Zeitpunkte sind nicht verpasst, und die tierische Zahl pro Experiment verwendet wird deutlich reduziert. Zweitens kann das Zeitfenster eingerichtet mit intravitalen Auswertung extrapoliert werden, um Gewebe Extraktion zu optimieren. Drittens kann die gewünschte Stufe der Behälterwachstum intravitally identifiziert und als ein ganzes-Mount Gewebe gebeizt.
Das intravitalen Design in diesem Manuskript erwähnt verwendet eine Kombination von transgene Tiere mit dem Ausdruck eine fluoreszierende Label in Endothelzellen, eine modifizierte dorsalen Hautfalte Kammer-Modell und eine dedizierte Multiphoton confocal Mikroskop.
Endotheliale Zellen durchlaufen eine Reihe von Stufen21,22 während der Angiogenese, und diese Phasen oft gleichzeitig in einen Tumor gesehen werden. Unter Verwendung der eNOSTag-GFP-Maus-Linie, einzelnen Endothelzellen können verfolgt werden, und sogar Filopodien Dynamik zurückverfolgt werden. Es ist daher ein gutes Modell Schiff Entwicklung intravitally zu studieren. Injizierbare fluoreszierende Agenten ist abhängig von der bereits Gegenwart intrinsische Etiketten lässt sich Lumen Bildung, Durchblutung, Extravasation und Blut Abstand zu bewerten. Die Maus wird kontinuierlich für bis zu 5 h abgebildet. Die langfristige Bewertung des Tieres ist machbar wenn einige Vorsichtsmaßnahmen bezüglich der Betäubung des Tieres getroffen werden, die seit23beschrieben. Da diese Forschung auf Krebs konzentriert, wurden Tumoren Gewebe oder Zellen implantiert. Jedoch experimentierten wir auch mit Mittelfußknochen und embryonale Lunge. Allerdings ist die Wachstumsrate des Gewebes unter Studie Begrenzung wie nach ein paar Wochen die Haut beginnt nachwachsen, was kann ein Problem mit langsam wachsenden Tumoren oder Gewebe.
Während der Phase der Validierung, die dorsale, Hautfalte Fenster Kammer erheblich geändert wurde, im Vergleich zum klassischen Modell4. Die Rahmen bestehen aus Kunststoff autoklavierbar und sind leicht und klein, mit einem großen Fenster-Ansicht. Der Haken des Sicherungsringes (Abbildung 1Bg, weiße Pfeilspitze) dient nur zur einfachen Entnahme des Rings. Halter Ringe ohne Haken können verwendet werden, wenn diese Bildgebung stören. Die Haut ist nicht zu viel gedehnt, Lockerung tritt nicht in diesem Modell und Infektionen sind nur selten zu sehen. Diese Änderungen reduzieren Tier Unbehagen und verfeinern das Tiere Verfahren deutlich. Die Metallteile können auch leicht entfernt werden, wenn den Tumor mit MRI24imaging.
Jedes Mikroskop kann angenommen werden, um intravitally Bild dorsalen Hautfalte Kammern. Die Hauptanforderung ist den verfügbaren Platz zwischen den Mikroskoptisch und das Objektiv. Ein wichtiger Aspekt, der Bildgebung betrifft ist Bewegung. Um Bewegungsartefakte zu verhindern, sollte eine Plattform, die passt in den Mikroskoptisch (nach dem entfernen alle Einsätze) und unterstützt die Maus, verwendet werden. Es ist nicht notwendig, die Maus zurückhalten, wenn es unter Narkose, und es besser ist, die Maus Atem frei zu lassen. Jedoch ist das Fenster auf der Plattform geben optimale Fixierung des Sichtfeldes verschraubt (d. h., der Tumor ist sichtbar durch die Fenster-Kammer). Die Plattform wird beheizt mit einer elektronischen Heizkissen für Tiere Heizung gebräuchlich. Diese Plattform war hausgemacht und Einzelheiten erhalten Sie auf Anfrage. Eine hochauflösende Objektiv ist eine Notwendigkeit, wenn intrazelluläre Prozesse bewerten und macht es möglich, zwischen dem Zytoplasma und Zellkern zu unterscheiden. Die Verwendung einer konischen Linse mit einem guten optischen Auflösung (hohe NA) aber eine relativ lange Arbeitsabstand (vorzugsweise 2 mm oder höher) wird empfohlen. Die Einschränkung in der Bildgebung ist die Eindringtiefe und die Fluoreszenz Intensität der Etiketten. Darüber hinaus müssen während der Bildgebung Immunofluoreszenz, Phototoxizität und Sättigung vermieden werden.
Hier wurden eine integrierte konfokale Multiphoton und einem confocal Mikroskop verwendet. Die Multiphoton ist aufrecht, während die konfokale einem inversen Mikroskop. Der Vorteil von einem aufrechten Mikroskop ist die einfache Handhabung von Eintauchen in Wasser Linsen. Diese Objektive haben eine hohe NA und langem Arbeitsabstand, selbst bei einer hohen (z. B. 20 oder 40 X) Vergrößerung. Insbesondere empfiehlt es sich, eine 20 X NA 1.0 eintauchen in Wasser Linse zu erhalten, die von mehreren Unternehmen verkauft wird. Beachten Sie, dass beim Eintauchen-Objektive verwendet werden, die Objektiv und Immersionflüssigkeit auf 37 ° c erhitzt werden müssen Es empfiehlt sich für die besten Bilder, optimale konfokale Einstellungen verwenden (d. h. Lochkamera 1 luftig Unit, Laserleistung so gering wie möglich zu gewinnen, die nicht zu hoch (vor allem, wenn der Gewinn Lärm führt), Streckengeschwindigkeit auf Maximum, und keine Mittelung der Scans). Überbelichtung, Sättigung und unterschiedliche Intensitäten zwischen Bilder beeinträchtigen die Qualität der Daten. Es wird empfohlen, die Sättigung und Überbelichtung zu vermeiden. Dies kann umgangen werden, indem Bilder bei verschiedenen Gain-Einstellungen. Ändern des Gewinns ist der einfachste Weg, um die Bildhelligkeit ändern. Bei Bedarf kann die Laserleistung eingestellt werden. Um die Bildqualität zu standardisieren, können Folien mit einer festen Fluoreszenzintensität verwendet werden. Man muss im Hinterkopf behalten, dass selbst wenn das Mikroskop optimal eingestellt ist, Bildqualität zu einem großen Teil bestimmt durch die Qualität der Fenster Kammer und Gewebe ist
Wenn Sie mehrere fluoreszierende Markierungen gleichzeitig scannen, muss durchscheinen, in dem ein Fluorophor in den Kanal des anderen erkannt wird vermieden werden. Vermeiden Sie durchbluten mithilfe einer Kombination des Fluorophore mit minimalen überlappende Spektren und sequentielle Scannen zwischen Frames. Die hier präsentierten Bilder wurden mit 3 sequenzielle Scans gescannt (Track 1: GFP, DID oder fluor647 mit dem Laser 488 und 633; track 2: Rhodamin, Doxil oder mTomato mit dem 543 Laser; und Gleis 3: Hoechst mit dem 405 Laser).
Die Möglichkeit mehrere Stufen der Tumorentwicklung Schiff, Tipp Zelldynamik Lumen Bildung, Extravasation und Gefäßschäden zu bewerten ist hier dargestellt. Unter Verwendung der eNOStag-GFP-Linie, sind Tumor-Bereiche mit einem zerstörten vaskulären Bett leicht durch granulierten zellulären Reste noch ausdrücken GFP erkannt. In diesen Bereichen zeigt das Fehlen des Flusses keine injizierbaren Agent festgestellt. Das bedeutet, die Chemotherapeutika verabreicht wird diese Bereiche entweder nicht erreichen. Schiff Zerstörung kann jedoch auch eine therapeutische Ergebnis. Vorbewertung des Tumors, nach Vorbehandlung Schiff Zerstörung suchen ist eine Voraussetzung für die genaue therapeutische Auswertung und kann leicht mit dieser Versuchsanordnung durchgeführt werden.
Es gibt eine Fülle von Möglichkeiten für die intravitalen Mikroskopie verwendet werden kann, und ausführliche Diskussion sprengt den Rahmen dieser Publikation. Um einen kurzen Einblick zu geben, sind Anwendungsmöglichkeiten Studien über die Anhäufung von Chemotherapeutika im Tumorgewebe, die Entwicklung von Schiffen (z. B. die Anzahl der Schiffe, Verzweigungen und Kreuzungen) und Blutfluss, Zell-Zell-Interaktionen, Handy-targeting, und intrazelluläre Verarbeitung sowie Beispiele oben erwähnten und hier zu sehen. Wie auf Fluoreszenz Analyse basierende beachten Sie Intensitätsschwankungen aufgrund der Qualität des Fensters oder der Gewebe. Da Tumorgewebe relativ dick ist, wirkt sich auch Fluoreszenz von oberhalb oder unterhalb der Ebene der Ansicht auf das Signal im Bild. Es empfiehlt sich, die quantitative Bildanalyse mit objektiven Messungen zu kombinieren. Zum Beispiel wenn Interesse an Drogen-Konzentrationen, entfernen Sie das Tumorgewebe aus dem Fenster nach intravitalen Mikroskopie und bestimmen Sie das Medikament Inhalte mit HPLC mit der konfokalen Bilder zu vergleichen.
Die Bewertung des Tumor-Ansprechens kann als gut mit diesem Modell, aber mit einigen Vorsichtsmaßnahmen durchgeführt werden. Man muss erkennen, dass Tumoren auch nach innen, in die Haut wachsen. 3D Messungen können erfolgen, wenn das Eindringen tief genug, um den gesamten Tumor zu decken ist. In einem solchen Fall sollte dunkelrote Farbstoffe verwendet werden. Die Fenster-Kammer als hier beschriebenen Angebote mit Tumoren in einem Hautmilieus, und es ist wichtig, darauf hinzuweisen, dass das Fenster eine Temperatur etwas niedriger als die normale Maus Körpertemperatur hält. Daher empfiehlt es sich, Tumoren in der direkt micro-Umwelt-Setting intravitalen Studien mit der dorsalen bestätigen Hautfalte Fenster Kammer zu studieren. Wichtig ist, die dorsale Hautfalte Kammer bietet Einblick in die Kinetik der Prozesse und Mechanismen, die eine instrumentale Grundlage für die Verbesserung der Therapie. Außerdem erhalten Sie zusätzliche Informationen über die Bioverteilung und Pharmakokinetik. Klassisch, sind diese Bioverteilung Studien durch Behandlung von Tumor-tragenden Tieren und seziert Tumoren/Organe zur Messung der Droge Aufnahme durchgeführt. Mit diesem intravitalen Modell kann die intratumorale Standort eines Medikaments (d. h. intravaskulären, intratumorale, intrazelluläre oder nuklearen)5,25,26mitgeteilt. Nicht nur ist die Lage des Medikaments ergeben, aber auch die Zeit-Fenster-von-Möglichkeit für die optimale Aufnahme.
Verwenden in diesem Artikel beschriebenen Versuchsanordnung, kann eine Vielzahl von Parametern in einer zeitlichen und räumlichen Umgebung ausgewertet werden. Speziell, zeigen hier wir, dass intravitalen Mikroskopie liefert wichtige Erkenntnisse über die Dynamik des Schiffes Tumorentwicklung und therapeutische Reaktion.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchten Rien van Haperen und Rini de Crom für ihre Entwicklung und die Spende von der eNOSTag-GFP-Linie, Joost A.P. Rens für seine technische Unterstützung mit den Tieren arbeiten und die Tierpfleger für ihre Hilfe danken. Die Mikroskopie Einrichtungen verwendet, sind Teil des Erasmus Optical Imaging Center und möchten wir den Mitarbeitern der Organisation der Islamischen Konferenz für ihren Dienst danken. Diese Studie wurde unterstützt durch Zuschuss DDHK 2000-2224 von der niederländischen Krebsgesellschaft, "Vereniging Trustfonds" Erasmus-Universität Rotterdam und "Stichting Erasmus Heelkundig Kankeronderzoek", und wir danken die Mitgliedern der Ausschüsse für ihre großzügige Spende.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma | D1145 | Supplemented with 10% FCS |
| Trypsin-versene (EDTA) | Lonza | BE17-161E | Make a 0.1% solution in PBS, sterile |
| PBS | |||
| Window frames | Costum made | ||
| Filler glass 10 mm, 0.55 mm | Abrisia technologies | ||
| Cover glass 12mm, #1 thickness | Thermo Scientific/VWR | 631-0713 | |
| Hear removal gel (veet) | for sensitive skin | ||
| Eye ointment | |||
| Buprenorfine hydrochloride | use 0.05 mg/kg | ||
| Anesthesia unit | O2/Isoflurane inhalation unit with an chamber and tubeing+cone | ||
| insulin syringe 0.5ml x 12.7mm 29g, green | BD | 324824 | |
| Needles 23G 1 1/4" | Braun | 4657640 | |
| Needles 25G 5/8" | Braun | 4657853 | |
| Sutures silkan 0.7 | Braun | 1134019 | |
| Nuts | Jeveka | 934 A2 1 | |
| Bolts | Jeveka | 84 A2 1 10 | |
| 0.9% NaCl | |||
| Microscope + software | The space between table and objective need to be wide enough to hold the animal | ||
| Heated temperature controlled platform | Costum made | ||
| Window holder | Costum made | ||
| tetramethylrhodamine 2,000,000 MW dextran | Invitrogen | D7139 | 100 µg/mouse |
| Alexa-fluor 647 10,000 MW dextran | Invitrogen | D22914 | 100 µg/mouse |
| Hoechst 33342 | Invitrogen | H1399 | 25 µg/mouse |
| Pegulated nanoparticles | ref 5 | ||
| LEICA TCS SP5 Multiphoton Microscope | Leica | ||
| LAS AF Software | Leica |
Referenzen
- Massoud, T. F., Gambhir, S. S. Molecular imaging in living subjects: seeing fundamental biological processes in a new light. Genes Dev. 17, 545-580 (2003).
- Ellenbroek, S. I., van Rheenen, J. Imaging hallmarks of cancer in living mice. Nat Rev Cancer. 14, 406-418 (2014).
- Brown, E., Munn, L. L., Fukumura, D., Jain, R. K. In vivo imaging of tumors. Cold Spring Harb Protoc. 2010 (7), (2010).
- Palmer, G. M., et al. In vivo optical molecular imaging and analysis in mice using dorsal window chamber models applied to hypoxia, vasculature and fluorescent reporters. Nat. Protocols. 6, 1355-1366 (2011).
- Seynhaeve, A. L., et al. Tumor necrosis factor alpha mediates homogeneous distribution of liposomes in murine melanoma that contributes to a better tumor response. Cancer Res. 67, 9455-9462 (2007).
- Schiffelers, R. M., et al. Ligand-targeted liposomes directed against pathological vasculature. J Liposome Res. 12, 129-135 (2002).
- Straetemans, T., et al. T-cell receptor gene therapy in human melanoma-bearing immune-deficient mice: human but not mouse T cells recapitulate outcome of clinical studies. Hum Gene Ther. 23, 187-201 (2012).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147, 983-991 (2011).
- van Haperen, R., et al. Functional expression of endothelial nitric oxide synthase fused to green fluorescent protein in transgenic mice. Am J Pathol. 163, 1677-1686 (2003).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Manzoor, A. A., et al. Overcoming limitations in nanoparticle drug delivery: triggered, intravascular release to improve drug penetration into tumors. Cancer Res. 72, 5566-5575 (2012).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5, 1518-1534 (2010).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. J Vis Exp. , e50546 (2013).
- Hobbs, S. K., et al. Regulation of transport pathways in tumor vessels: role of tumor type and microenvironment. Proc Natl Acad Sci U S A. 95, 4607-4612 (1998).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat Rev Cancer. 6, 583-592 (2006).
- Koning, G. A., Eggermont, A. M., Lindner, L. H., Hagen, t. e. n., L, T. Hyperthermia and thermosensitive liposomes for improved delivery of chemotherapeutic drugs to solid tumors. Pharm Res. 27, 1750-1754 (2010).
- Seynhaeve, A. L., Eggermont, A. M., ten Hagen, T. L. TNF and manipulation of the tumor cell-stromal interface: "ways to make chemotherapy effective". Front Biosci. 13, 3034-3045 (2008).
- Brouckaert, P., et al. Tumor necrosis factor-alpha augmented tumor response in B16BL6 melanoma-bearing mice treated with stealth liposomal doxorubicin (Doxil) correlates with altered Doxil pharmacokinetics. Int J Cancer. 109, 442-448 (2004).
- Hoving, S., Seynhaeve, A. L., van Tiel, S. T., Eggermont, A. M., ten Hagen, L. T. Addition of low-dose tumor necrosis factor-alpha to systemic treatment with STEALTH liposomal doxorubicin (Doxil) improved anti-tumor activity in osteosarcoma-bearing rats. Anticancer Drugs. 16, 667-674 (2005).
- Gabizon, A., et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res. 54, 987-992 (1994).
- Bergers, G., Benjamin, L. E. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 3, 401-410 (2003).
- Eilken, H. M., Adams, R. H. Dynamics of endothelial cell behavior in sprouting angiogenesis. Curr Opin Cell Biol. 22, 617-625 (2010).
- Nakasone, E. S., Askautrud, H. A., Egeblad, M. Live imaging of drug responses in the tumor microenvironment in mouse models of breast cancer. J Vis Exp. , e50088 (2013).
- van Vliet, M., et al. MR angiography of tumor-related vasculature: from the clinic to the micro-environment. Radiographics. 25, S85-S97 (2005).
- Dicheva, B. M., et al. Cationic thermosensitive liposomes: a novel dual targeted heat-triggered drug delivery approach for endothelial and tumor cells. Nano Lett. 13, 2324-2331 (2013).
- Li, L., et al. Improved intratumoral nanoparticle extravasation and penetration by mild hyperthermia. J Control Release. 167, 130-137 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten