Method Article
La microscopia intravital de la utilización de la vasculatura asociada a Tumor avanzado Dorsal cámaras de ventana pliegues cutáneos en ratones transgénicos fluorescentes
En este artículo
Resumen
Este protocolo describe la imagen intravital de ratones transgénicos que expresaban marcadores fluorescentes específicos de la célula. La proyección de imagen intravital proporciona un método no invasivo para observaciones de alta resolución en animales vivos utilizando windows implantables a través del cual es posible la visualización microscópica de los procesos. Este método es especialmente útil para estudiar procesos longitudinales.
Resumen
Tumor y desarrollo vasos del tumor, así como la respuesta del tumor a la terapéutica, es procesos biológicos altamente dinámicos. Histología proporciona información estática y a menudo no es suficiente para una correcta interpretación. Evaluación intravital, en el que un proceso es seguido en el tiempo, proporciona información adicional y a menudo inesperada. Con la creación de animales transgénicos que expresan marcadores celulares específicos y marcadores de células vivas, mejoras en equipos de proyección de imagen y el desarrollo de varios compartimientos de la proyección de imagen, microscopia intravital se ha convertido en una herramienta importante para entender mejor procesos biológicos. Este papel describe un diseño experimental para la investigación buque de desarrollo del tumor y de los efectos terapéuticos de una manera espacial y temporal. Usando esta configuración, la etapa del desarrollo del buque punta celular y luz de formación, flujo de sangre, extravasación, un lecho vascular establecido y destrucción vascular puede ser visualizada y seguida. Además, efectos terapéuticos, sino intratumoral y la localización de compuestos quimioterapéuticos pueden también seguirse.
Introducción
Mientras que en vitro estudios permiten alta resolución imágenes cinéticas de los procesos, en vitro experimentación no permiten evaluar en el contexto adecuado. Por ejemplo, la interacción de las células del tumor stromal o el suministro de medicamentos y distribución dentro de un tumor no puede ser estudiada en una placa de cultivo. Modelos animales por lo tanto se utilizan para imitar la fisiología humana y la patología. Sin embargo, la proyección de imagen longitudinal de los procesos, especialmente en una resolución subcelular, es un reto. Métodos de la proyección de imagen molecular, como la proyección de imagen de resonancia magnética (MRI), emisión del solo-fotón computada tomografía (SPECT) y tomografía por emisión de positrones (PET), tienen profundidades de penetración buena pero falta resolución o dejar de ilustrar las estructuras anatómicas. La proyección de imagen óptica ofrece alta resolución y permite la proyección de imagen de las estructuras, pero se acompaña de pobres a la penetración mínima1. La aplicación de la microscopia intravital en combinación con la ventana del compartimiento de tecnologías, como una dorsal pliegue o ventana abdominal, permite alta resolución imágenes en vivo2,3,4. Esta tecnología tiene ventajas, ya que permite para la proyección de imagen longitudinal durante horas e incluso días, para la proyección de imagen de los procesos en el contexto adecuado (por ejemplo, interacciones de la célula en el tejido de la imagen) y para las resoluciones de los límites ópticos de avanzados microscopios confocales y multifotón.
La introducción de animales transgénicos con etiquetas fluorescentes específicos de la célula o proteína abre un sinfín de posibilidades para la experimentación in vivo y ex vivo . Por ejemplo, las interacciones célula-célula, la producción de proteínas y la respuesta a la manipulación o el tratamiento pueden ser estudiadas en vivo con estas modelos5,6,7,8. Lo importante es colocar en lugar y tiempo se pueden determinar con la metodología y el equipo de proyección de imagen correcto. Aquí, la microscopia intravital de animales expresan un marcador endotelial en combinación con agentes inyectables en un tumor implantado en la dorsal cámara ventana pliegue cutáneo se presenta.
Protocolo
Todos los experimentos con animales se realizaron conforme a la Ley holandesa, y protocolos fueron aprobados por el Comité de Experimentación Animal de la MC de Erasmus, Rotterdam, los países bajos.
1. receptor ratón
- Cuando nacen los ratones transgénicos, los animales para el genotipo apropiado utilizando procedimientos estándar9de la pantalla.
Nota: En este manuscrito, se presentan los datos obtenidos de un eNOStag-GFP línea9 desarrollado internamente y una línea de10 ROSA-mTmG (acción 007676) comprada. - Uso de ratones que son 12 semanas o más y que están por encima de 20 g.
2. donante ratón
Nota: Un fragmento del tumor para la implantación en la ventana de dorsal se obtiene de un animal donante no transgénicas. Dependiendo del tipo de tumor, se utilizan normal (con tumores syngeneic) o ratones inmunodeficientes (xenoinjertos).
- Crecen las células del tumor en un medio con los suplementos apropiados en frascos de cultivo a 37 ° C y 5% CO2.
- Retire el medio de los frascos de la célula, lavar una vez con PBS 1 x y separar las células utilizando tripsina 0.25%.
- Inactivar la tripsina mediante la adición de medio de cultivo celular. Recoger las células desactivación a 1.200 x g durante 5 minutos y resuspender el precipitado en 5 mL de PBS.
- Diluya 20 μl de la suspensión de células con 20 μl de azul tripán que tiñe las células muertas. Contar el número de células vivas y muertas usando un hemocitómetro; el número de células muertas no debe superar 10%.
- Centrifugar las células otra vez a 1.200 x g durante 5 minutos y resuspender el precipitado de células en PBS helado y rendimiento 1 millón células por μl 100. transportan de las células en hielo a la sala de operaciones.
- Anestesiar el animal utilizando isoflurano/O2. Encienda el oxígeno y ajuste el flujo a 0,5 mL/min ajustar el vaporizador de isoflurano al 3%. Después de unos minutos, colocar el ratón en la cámara de anestesia.
Nota: Rellenar previamente la cámara para asegurarse de que esté listo para su uso minimizar el estrés. -
Cuando el ratón está sedado, llevar el animal a la tabla de funcionamiento, a 37 ° C y el hocico en el cono de nariz de anestesia.
- Nota: El animal está sedado correctamente cuando no hay respuesta a un pellizco de bandolero.
- Afeitarse el ratón para visualizar mejor el sitio de inyección. Inocular con una jeringa de insulina 0, 5 mL; inyectar 100 μl de células en el flanco del ratón y permiten desarrollar un tumor.
- Eutanasia a los animales por dislocación cervical bajo anestesia como aprobado por su Institucional Animal cuidado y uso. Utilizando micro tijeras y pinzas, abrir la piel en la localización del tumor y disecar el tumor. Poner el tumor en una placa de Petri con PBS. Utilizando micro tijeras y pinzas, cortadas el tumor en fragmentos de aproximadamente 1 mm3 (figura 1A).
Nota: El tumor del ratón donante debe ser lo suficientemente grande para dar suficiente material, pero deben evitarse los tumores grandes y necróticos. Para la mayoría de los tumores, un diámetro promedio de 10 mm es suficiente.
3. implantación de la cámara de la ventana
- Realizar todos los procedimientos en condiciones de asepsia. Autoclave de los instrumentos quirúrgicos (figura 1A) y materiales de la cámara (figura 1B).
Nota: La cámara ventana utilizada aquí, con un peso total de 1,1 g, se hace de la cetona del éter del poliéter (PEEK), un material sintético, ligero que es el MRI compatible. PEEK es 3.4-fold más ligero que el titanio, que se utiliza comúnmente en la literatura para estas ventanas. Es resistente a la mayoría de sustancias químicas, es inerte, no produce reacciones inmunes y es robusto. Esta ventana también es menor en diseño comparado con windows previamente publicados. Ratones con esta demostración de la ventana completa capacidad de movimiento, pueden subir y subir de peso comparable a los ratones sin una cámara de la ventana. Porque el animal puede morder en la ventana, windows sintético pueden durar un poco más cortos en comparación con ventanas de titanio; sin embargo, son fáciles de hacer y son barato. Estas ventanas particular son internas y pueden ser adquiridas a petición. - SEDAR el ratón receptor utilizando anestésicos de inhalación (es decir, isoflurano/O2) en una cámara de anestesia. Llevar el ratón a la mesa de operaciones calentada a 37 ° C y colocar el hocico en el cono de nariz de anestesia (ver paso 2.6). Aplique el ungüento de ojo para evitar la sequedad.
- Eliminar el vello de todo el por afeitado y aplicación de gel de eliminación de pelo. Tenga cuidado de que todo el gel se retira enjuagando el animal cuidadosamente con agua del grifo caliente mano. El animal en seco y limpiar la piel con etanol al 70%.
Nota: El procedimiento de afeitar puede también hacerse el día antes de la implantación de la ventana. La crema es necesario retirar completamente con agua caliente de la mano porque esto puede causar irritación de la piel. - Marque la línea central en el lomo del ratón con un marcador para el posicionamiento simétrico de cámara. Vuelva a colocar el ratón, tire de la piel en una aleta con la línea de centro como posición plegable y sujete la mitad de la aleta. Coloque la ventana de tal manera que la parte superior de la estructura es por lo menos 2 mm por debajo de la línea central y el círculo el área de vista de la ventana sobre la piel con un marcador.
- Usando un tamaño de soporte cuchilla de bisturí 15 y micro tijeras, quite la piel a lo largo de la línea trazada circular. Tenga cuidado de no dañar la fascia subyacente.
Nota: Esto crea el área de vista de la ventana de la sala en la que se trasplanta el tumor. - Tire hacia arriba el pliegue cutáneo y utilice un golpeador de oído para perforar agujeros de 1 mm de diámetro a través de la piel, uno a cada lado de la zona de vista (Figura 1A-b).
Nota: Estos son los agujeros para dos tornillos fijar los marcos de la ventana juntos. - Coloque el marco de la cámara frente a la medida usando los pernos (figuras 1B-a, 1B-c) y coloque el bastidor del respaldo (figura 1B-b) en los pernos. Coloque las tuercas (figura 1B-d) en el fotograma posterior en los pernos.
Nota: Estos tornillos se utilizan para fijar las cámaras juntos contra el pliegue cutáneo y más tarde se utilizan para inmovilizar la cámara durante la evaluación bajo el microscopio. - Tire de la piel 2-3 mm sobre la parte superior de los marcos y asegúrese de que el área de la vista de ventana transplantable coincide con el área de cámara. Lugar 23 G agujas a través de los dos orificios de sutura pequeña (figura 1B, flecha negra) en la parte superior del marco. Apretar las tuercas en los pernos con un destornillador micro (figura 1A-c) y un sujeción soporte de la aguja para inmovilizar las tuercas.
Nota: Tomar precauciones para asegurar que la piel no gira alrededor de los pernos y no apriete demasiado. - Reemplazar las agujas con las suturas, a partir de la parte superior, para fijar los marcos contra la piel. Hacer esto para los 5 pares de orificios de sutura (figura 1B, flecha blanca) en el bastidor.
- Gire el ratón para revelar la parte trasera de la cámara de la ventana. Coloque un pedazo grueso de vidrio relleno con un diámetro de 10 mm y un espesor de 0,55 mm (figura 1B-e) y luego un vaso de tapa estándar de 12 mm (figura 1B-f). Seguro estas con un anillo de retención (figura 1B-g) en la zona de detrás de cámara.
Nota: El vidrio relleno evita el espacio para abrir entre la fascia y la ventana en la parte delantera, que se utiliza para la proyección de imagen. - Hidratar el área de vista de la ventana en la que se insertará el tumor llenando una jeringa de 1 mL estéril 0,9% NaCl. Permite unas gotas caer en esta área de la vista. Retire el exceso salino con una punta de algodón estéril.
- En la fascia, se crea un bolsillo lo suficientemente grande para 1 mm3 tumor fragmento (figura 1A-a) utilizando una aguja de 25 G con su punta se dobla en un ángulo de 90 ° (figura 1A-d). Usando un porta aguja o pinzas de Kelly, insertar el fragmento de tumor en el área de la vista de ventana transplantables en este bolsillo.
- Cerrar el área de la vista de ventana con un vidrio de cubierta estándar de 12 mm y un anillo de retención.
Nota: Puede formar una burbuja de aire, pero desaparecerá en horas.
4. pre y postratamiento del Animal
- Administrar medicamentos para aliviar el dolor (es decir, 0,05 mg/kg de buprenorfina) por vía subcutánea como aprobado por su Institucional Animal cuidado y uso. Permitir que el ratón para recuperar de la anestesia bajo una lámpara de calefacción.
- Coloque la ventana teniendo ratones individualmente en una jaula y en una sala climatizada a 32 ° C y por encima de 50% de humedad. Asegúrese de que las botellas de agua a temperatura ambiente antes de colocarlos en la jaula para evitar fugas. Uso de jaulas y enriquecimiento que permite el libre movimiento y acceso a alimentos y agua.
Nota: Como esta cámara de la ventana es muy bien tolerada, ratones muestran comportamiento normal. Vivienda individual previene el daño a la cámara de ventana causada por otros ratones, y la alta temperatura y humedad evita el enfriamiento abajo y deshidratación de los pliegues cutáneos. - Controlar el ratón con regularidad para masticado de suturas, tornillos y tuercas sueltas o cristal roto. Inmediatamente reparar y reemplazar cuando esto sucede. Una cubierta hecha de material ligero puede utilizarse para proteger la ventana.
5. proyección de imagen de intravital
Nota: En este procedimiento, se utilizan un microscopio multifotón y el software de control apropiado. Aquí, se utilizan paquetes de software que se proporcionaron a los microscopios. En principio, cualquier paquete de software que viene con un microscopio y está destinado para el control del microscopio y para la captura de imágenes será suite este fin.
- Encender el sistema: PC/microscopio, poder de mando confocal, energía del laser y laser de emisión. Por ejemplo, con este software, inicie el software e inicializar la tabla de microscopio (Figura 1E-a y 1E-c) haciendo clic en "inicializar tabla." Encienda el sistema y ponerlo en el modo permitiendo la PC controlar el microscopio, mesa de xy, z-posicionamiento y captura de la imagen.
- Encender la luz fluorescente (Figura 1E-b).
Nota: Esto se utiliza para evaluar imágenes de fluorescencia a través del ocular con campo brillante. - Encender la plataforma a la medida, con control de temperatura (figura C 1-c, se describe en la discusión en más detalle) a 37 ° C.
- Encienda la unidad de anestesia con isoflurano/O2 (Figura 1E-d). Monte el tubo de anestesia en la platina del microscopio (figura 1 C-e). Instale una abrazadera en el xy-escenario para fijar la pieza del hocico de anestesia.
- Evaluar previamente al animal para establecer la etapa del desarrollo del buque de tumor; Esto depende de la velocidad de crecimiento del tumor, pero puede variar entre los ratones.
- SEDAR el ratón utilizando anestésicos de inhalación (isoflurano/O2) en una cámara de anestesia (ver paso 2.6).
- Coloque el animal en la plataforma de control de temperatura montada en la platina del microscopio; Esto evita el enfriamiento del animal cuando está anestesiada. Asegúrese de que el hocico del ratón se encuentra en el cono de la anestesia y se aplica ungüento oftálmico si la evaluación se llevará más de 5 minutos.
Nota: Para una evaluación más de 1 h, reducir el flujo de isoflurano al 2%. - Utilice los tornillos de la cámara para fijar (figura 1 C-b, flecha completa) la cámara sobre un soporte de cámara a medida (figura 1C). Atornille el soporte (figura 1C-d, flecha de guiones) a la plataforma de calefacción (figura 1 C-c).
Nota: Esta combinación evita artefactos de movimiento en el área de vista de la ventana mientras sigue permitiendo al animal a respirar libremente. - Asegúrese de limpiar el cristal de la zona de la vista de ventana con una punta de algodón sumergida en agua para evitar una imagen borrosa y la interferencia procedente de desechos en el exterior del vidrio. Coloque la plataforma y el ratón en la platina del microscopio (figura 1).
Nota: tenga cuidado de que la cola no se atascan entre la plataforma y la platina del microscopio. - Revise la etapa de desarrollo de vasos del tumor usando un 10 X objetivo, campo claro y luz fluorescente.
Nota: Los vasos fluorescentes deben estar en foco y el flujo de sangre debe ser visible utilizando campo claro. Cuando se ve claramente la vasculatura, evaluar la etapa del desarrollo del buque de tumor. Por ejemplo, determinar si hay angiogénesis del temprano-inicio con el crecimiento de las células de la punta o una vasculatura ya establecido para la entrega de la droga. El mismo animal puede ser evaluado nuevamente, y como tumor de desarrollo es un proceso continuo. Al mismo tiempo se observan varias etapas en un solo tumor.- Cuando no es posible centrarse en la vasculatura, retirar el animal de la etapa, que el ratón se recupera y coloque el animal de vuelta en un espacio climatizado. Comprobarlo más tarde. Cuando el ratón está listo para la evaluación, continuar con el proceso que se describe a continuación.
- Encienda el láser confocal y el panel de control haciendo clic en "Laser" y "Panel de Ctrl" en la ficha Configuración
Nota: Se recomienda ajustar la potencia del láser baja, particularmente para el láser de argón, para prevenir el blanqueo, el calentamiento de los tejidos y fotodaño. El panel de control puede ajustarse a las preferencias personales. Intravital imagen usando múltiples fluoróforos se recomienda aplicar los siguientes ajustes: "smart gain, 100 V por turno," "smart offset, 10% por turno," ", medio, posición zoom" "X, media," "posición Y, medio," y "Posición de Z, 100 μm por turno." Antes de la proyección de imagen, ajuste la compensación para minimizar el ruido y optimizar la relación señal a ruido. La función de zoom confocal permite un aumento mayor sin cambiar las lentes del objetivo. Control X, Y y Z es necesario ubicar los campos de interés. Para la microscopia intravital, Z-posicionamiento debe ser cerca de 100 μm por turno como tejido de garrapata es evaluado. - Haga clic en "Adquisición" en la ficha de adquisición y cambiar la configuración para: "Modo de adquisición XYZ o XYZT," "Formato (512 x 512 o 1024 x 1024)" y "Velocidad (400 Hz o 200 Hz)." Haga clic en "Pinhole" y establézcalo en 1 unidad aireada. Haga clic en "Bidireccional X".
Nota: Para optimizar las imágenes, un equilibrio entre la energía del laser, aumento y del agujero de alfiler debe ser pulsado, que se menciona en la discusión. - Cuando se evalúan múltiples fluoróforos, seleccionar "análisis secuencial" y "entre bastidores" para evitar el repintado, que se menciona en la discusión. Elegir "Línea media 4" para obtener una buena reducción del ruido.
Nota: Dependiendo de la fluorescencia intrínseca presente en el animal transgénico, marcadores fluorescentes, como dextranos, Hoechst, FITC-BSA, quimioterápicos fluorescente o nanopartículas diluidas a la concentración deseada en 0.9% NaCl puede ser administrado y evaluado en el tumor. Estos son inyectados a través de la cola o vena peneal. - Haga clic en "Experimento" en la ficha de adquisición y seleccione "Nuevo" para hacer la base de nuevos datos.
- Evaluar el uso de animales, dependiendo de la pregunta de investigación, lentes 10 X, 20 X y objetivo 40 X. A través del ocular, encontrar una posición para evaluar.
Nota: Es mejor utilizar lentes seco con un NA tan alto como posibles, secas las lentes tienen un funcionamiento relativamente largo distancia y no la no necesidad de líquido de inmersión. En la discusión, se menciona el uso de lentes del objetivo de inmersión en agua. - Utilice un escaneado rápido para encontrar la adecuada ganancia y offset para evitar la sobreexposición y optimizar la relación señal a ruido. También, mantener la misma configuración de imagen durante y entre experimentos si es necesaria la comparación cuantitativa.
Nota: Se mencionan otras consideraciones para la proyección de imagen óptima en la discusión. La posición de XYZ y el zoom pueden finalizarse durante el escaneado mediante el panel de control. - Para hacer una pila de Z, seleccione "Z-stack" en la ficha de adquisición hacer una rápida exploración de Z utilizando la posición de Z en el panel de control y establecer el inicio y final de la exploración haciendo clic en "Begin μm" y "final." Establezca el tamaño de paso Z relacionadas con el tamaño del agujero de alfiler.
- Capturar las imágenes haciendo clic en "start".
Nota: Como microscopia intravital es cinética y procesos dinámicos por lo tanto se observa, un compromiso entre el tiempo necesario para adquirir una imagen y la velocidad de los procesos biológicos debe hacerse. En general, cuanto mayor sea la resolución, los canales más fluorescentes son escaneados y cuanto mayor sea la exploración de campo, cuanto más píxeles por imagen. Z-pilas más gruesas se traducen en un tiempo más imágenes. Una vez ya imagen incrementa la posibilidad de artefactos de movimiento y puede causar daño al imagen del tejido. Además, ten en cuenta que escanear ciertas etiquetas fluorescentes causa blanqueo y toxicidad, que es afectada por la energía del laser y la concentración de colorante acumulado. - Después de escanear la pila de Z se puede evaluarse rápidamente haciendo clic en "proyección máxima". La pila de Z se guarda automáticamente en la base de datos y puede cambiar el nombre.
6. Análisis de datos
- Dependiendo de la pregunta original de investigación, utilizar uno de varios programas de software, como el ImageJ5, Matlab11o Amira, para análisis de datos. Análisis correcto es crucial.
Resultados
El atributo principal de la proyección de imagen intravital es la visualización longitudinal de procesos celulares sin intervención invasiva. Para ello, se utilizan animales transgénicos que expresan un marcador fluorescente constitutivo o inducible en las células de interés. La figura 2 ilustra la expresión de etiquetas fluorescentes en proteína eNOStag-verde fluorescente (GFP)9 y Rosa mTmG ratón líneas10. ENOStag-GFP es una línea de ratón que se produjo en la empresa utilizando un gen de la trunca eNOS como una etiqueta para GFP. Importante, eNOS es altamente expresada en las células endoteliales, y la señal GFP se ve claramente en th eGolgi y membrana celular (figura 2A). Rosa-mTmG ratones tienen un alelo de reportero de Cre orientada a membrana de fluorescencia de dos colores. Esta línea expresa mTomato fluorescencia en células generalizadas y mGFP en células expresando recombinase de Cre y se utiliza mucho para seguimiento de linaje. Como un pedazo de tumor es trasplantado de un donante no transgénicas, fluorescencia roja predominante se expresa por partes stromal en el tumor (por ejemplo, en la membrana de las células vasculares, circulación de las células, se infiltraron en las células de sangre y tumor-associated fibroblastos (figura 2B)).
Formación de vasos está estrechamente regulada, y un excelente modelo para el estudio de esta es el retina en desarrollo12,13. También, el crecimiento del tumor vaso es un proceso cinético que es similar en principio al desarrollo de vasos retinianos. Sin embargo, los vasos tumorales carecen de organización y, como un tumor es continuamente remodelado, así que la vasculatura asociada a tumor. Esto puede tener sus ventajas al usar el tumor como un modelo de angiogénico, como todas las etapas del desarrollo del buque pueden encontrarse a menudo en el mismo tumor al mismo tiempo. Se trata de un frente brote endotelial creciendo en una parte no vascularizada del tumor (figura 2); vasos dañados (Figura 2D); y un lecho vascular establecido (Figura 2E-I) con madurez, ramificados vasos (Figura 2E-II). Sin embargo, también pueden encontrarse células endoteliales angiogénicos en estas áreas. Cuando se estimula por estímulos angiogénicos, una célula endotelial sobresale filopodios (Figura 2E-III) y puede avanzar en una célula de la punta, utilizando estos filopodios migración direccional y exploración (Figura 2E-IV). Esta célula de punta emigra en el intersticio del tumor y se sigue dividiendo las células tallo. Una sola punta endotelial tiene varios filopodios en expansión, contracción y renovar en cualquier momento y pueden ser rastreados utilizando microscopía intravital (figura 2F).
En segundo lugar, la microscopia intravital puede utilizarse para determinar la formación del lumen en un frente de angiogenic, flujo en todo el tumor y extravasación de sangre. Según ya presente señales fluorescentes intrínsecas en el animal, se pueden administrar diferentes compuestos fluorescentes. Extravasación y flujo de sangre se pueden visualizar utilizando Hoechst, dextranos fluorescentes o FITC-BSA. Estudios extendidos en extravasación de partícula y el flujo de sangre, circulación largo fluorescencia etiquetada pegilado nanopartículas de 100 nm puede ser utilizada. Para obtener más información sobre la preparación de estas nanopartículas, ver publicación anterior5. El empleo de estos compuestos se demuestra en la figura 3. Las células endoteliales de la punta en un ratón Rosa mTmG pueden verse claramente invadiendo el tejido del tumor. Flujo sanguíneo funcional se demuestra por la púrpura de la fluorescencia de nanopartículas inyectadas sistémicamente en la luz de los tubos vasculares (Figura 3A-I). Nanopartículas cerca llegar a las células endoteliales de la punta que ilustra la formación de un lumen en el área de célula de tallo (Figura 3A-II). La entrega de quimioterapia sistémica administrada depende de una vasculatura funcional para alcanzar el intersticio del tumor, y como se muestra en la figura 3B, agentes inyectables, independientes de su tamaño, no penetran en las áreas con vasos destruidos, comprimido los vasos, o recipientes con estasis de sangre.
En la mayoría de los órganos, el revestimiento endotelial forma una barrera funcional entre la sangre y el tejido subyacente, y el paso de las moléculas se regula firmemente. Vasculatura asociada a tumor, sin embargo, es conocido por ser agujereado y corte de tamaño de poro depende mucho del tipo de tumor14. Dextranos conjugados fluorescentes de diferentes tamaños se pueden inyectar para evaluar el flujo sanguíneo, la permeabilidad y la extravasación. Hoechst (615) difunde rápidamente en el tejido del tumor y es tomado por las células circundantes (figura 3-I). Poco después de la inyección, dextrano de 10 KDa (figura 3CII) y MDa 2 (Figura 3 C-III) se encuentran en la sangre. Sin embargo, dextran que 10 KDa también se observa en el intersticio del tumor, lo que indica la permeabilidad del recubrimiento endotelial de moléculas más pequeñas, que es una característica atribuida a los vasos del tumor. 40 minutos después de la inyección (Figura 3 C-IV), 10 KDa se borra desde el torrente sanguíneo (Figura 3 C-V) y la intensidad fluorescente de 2MDa dextrano dextrano es así disminuido (Figura 3 C-VI). Sin embargo, dextranos grandes no se encuentran en el intersticio del tumor, demostrando una falta de permeabilidad a moléculas grandes dentro de este marco de tiempo.
Fisiopatología tumoral, con sus áreas altamente proliferantes, necróticas y no vascularizados, puede ser muy informativa cuando se utiliza el tumor como un modelo de angiogenic. Sin embargo, esto presenta un problema para la investigación y la terapia eficaz. La heterogeneidad de la vasculatura asociada a tumor causa una distribución heterogénea de las drogas administradas, dejando toda las zonas libres de drogas15. Para mejorar el suministro de medicamentos, varias estrategias pueden ser aplicadas15,16,17, y progresión terapéutica puede ser examinada usando este diseño intravital. La vasculatura asociada a tumor se puede manipular con agentes vasoactivos para mejorar el suministro de drogas17. Se presentan los resultados de la manipulación de buque de tumor usando el alfa de necrosis tumoral (TNF) como un agente vasoactivo en combinación con Doxil, la formulación liposomal encapsulada de doxorrubicina, como un agente quimioterapéutico en este manuscrito5, 18 , 19. a diferencia de los dextranos, pegilado nanopartículas se hacen circular por varias horas, incluso días, en la circulación de sangre20.
Como se mencionó anteriormente, el área del tumor puede ser previamente analizado para identificar las áreas de tumor correcta dependiendo de la pregunta de investigación. Destino de la droga puede ser evaluado en áreas con una vasculatura funcional versus áreas con un lecho vascular ya dañado (datos no mostrados). Para investigar el destino de agentes quimioterapéuticos sin interferencia citotóxico, nanopartículas con la misma composición que el agente terapéutico pueden utilizarse como droga modelo. Un animal eNOStag-GFP era tratamiento i.v. con estas nanopartículas y reflejada 24 h más tarde. Las nanopartículas estaban aún presentes en el sistema vascular, con extravasación mínima en el intersticio del tumor (Figura 4A-I). Sin embargo, cuando las nanopartículas fueron administradas en combinación con TNF, se observó extravasación desde el torrente sanguíneo en el intersticio del tumor (Figura 4A-II), aumentando el suministro de medicamentos intratumoral. Mediante el uso de lentes de objetivo de alta resolución, puede reconocerse la localización intracelular de un compuesto, como se muestra aquí por la situación nuclear de Hoechst en verdes células endoteliales y células del intersticio del tumor (Figura 4B). Por otra parte, como muchos quimioterápicos como la doxorrubicina, intercalar con el ADN, se puede evaluar la localización de estos compuestos. Doxorrubicina tiene propiedades fluorescentes rojo, y el nanocarrier puede etiquetarse con, por ejemplo, tetramethylindotricarbocyanine perclorato (hizo). Un animal eNOStag-GFP se inyecta i.v. con Doxil-en combinación con el TNF, e imágenes fueron tomadas 24 h después del tratamiento. DOXIL-extravasada de los vasos sanguíneos y se toma hasta por tumor tejido circundante (figura 4-I). Una evaluación más detallada de células individuales (Figura 4 C-II) demostró que el portador puede encontrarse en el citoplasma, mientras que doxorrubicina liberada se observó en el núcleo celular.

Figura 1: instrumentos, dorsales plicometro cámara y configuración de equipos necesitan para el procedimiento de. (A) fragmentos del Tumor (a) y los instrumentos quirúrgicos necesarios para la implantación. Instrumentos no estándar son un golpeador de oído (b), un destornillador micro (c) y una aguja doblada (d). Dorsal (B) cámara de ventana pliegues cutáneos. Delantera (a) y posterior (b) ventana (flecha: agujeros para suturas, punta de flecha: agujeros para los tornillos), 2 pernos (c), (d) 2 tuercas, 1 relleno de vidrio (e), 2 copas de la cubierta (f) y 2 de retención anillos (g). También, anillos sin ganchos (flecha blanca) de retención pueden ser utilizado cuando sea necesario. (C) cámara por encargo sostenedor (A), los tornillos para el soporte de cámara en cámara (b), plataforma de control de temperatura (c), los pernos para asegurar el soporte de cámara para la plataforma (d), y el titular con la anestesia del tubo (e). (D) Animal montado en el soporte de cámara en la plataforma. Un tumor B16BL6 (flecha) es visible en el área de vista de la ventana. (E) equipo necesario para la evaluación intravital. Equipo de proyección de imagen de microscopio control software (a), estándar fluorescente luz (b) y el microscopio. Un confocal multifotón fue utilizado (c) con una unidad de anestesia (d). Haga clic aquí para ver una versión más grande de esta figura.
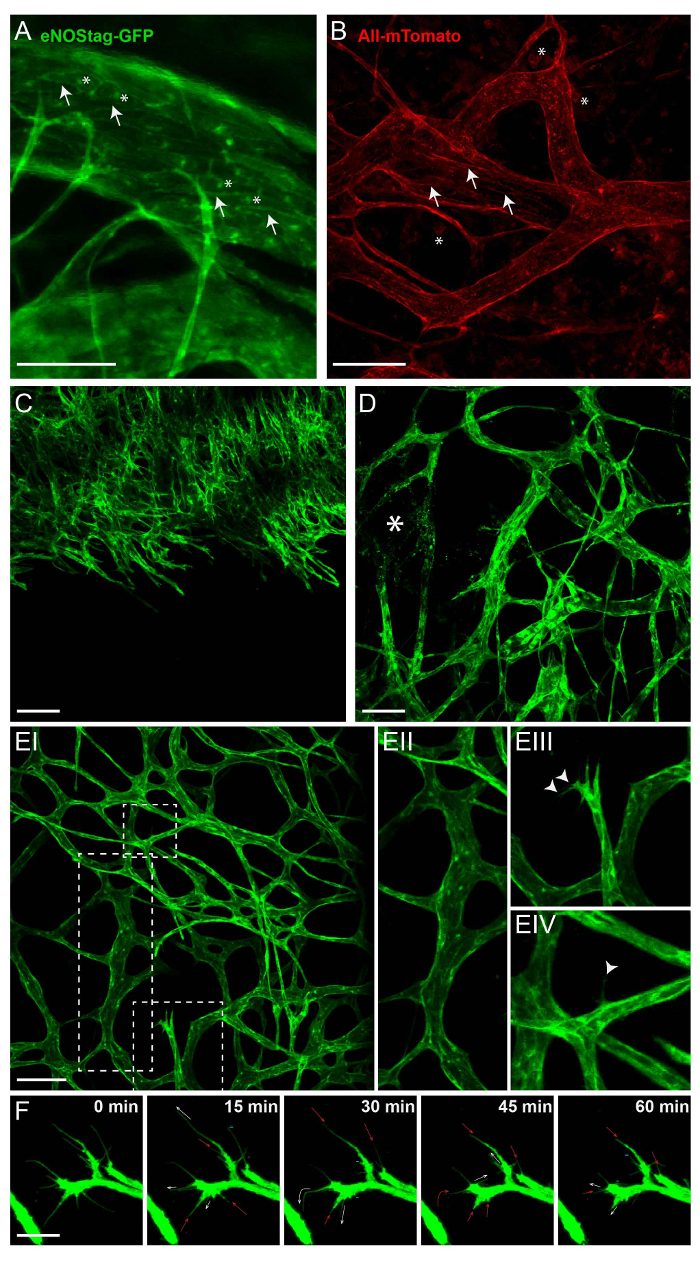
Figura 2: fluorescencia intrínseca de los animales transgénicos. Todas las imágenes que se muestra a continuación son proyecciones Z-stack entre 50 y 70 μm de espesor. (A) en la línea de la etiqueta eNOSGFP, GFP se expresa en el Golgi (asterisco) y la membrana de la célula (flecha) de las células endoteliales. Barra de escala = 100 μm. (B) expresión Intratumoral de mTomato en la línea Rosa mTmG predominante se encuentra en la membrana celular de las células vasculares (flecha) y células de la sangre (asterisco). Barra de escala = 100 μm. (C) A proyección de un crecimiento frente angiogénicos en tumor poco vascularizado. Barra de escala = 100 μm. (D) proyección A parte del tumor con los vasos dañados y establecidos (asterisco). (E) una proyección de la vasculatura del tumor establecido (IE) mostrando madura garrapata vasos (EII); células endoteliales punta de angiogénicos con filopodios (EIII, punta de flecha); y un maduro, de la cual una sola célula endotelial extiende un filopodium (EIV, punta de flecha) en el intersticio. Barra de escala = 100 μm. (F) circulación de los filopodios, seguido por 1 h. Cada 15 minutos, tomó una pila de Z; Aquí se presenta una proyección máxima. Los filopodios están ampliando (flecha blanca), estancamiento (=), retracción (flecha roja), o incluso totalmente desaparece (-). Barra de escala = 25 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 3: administración de inyectables etiquetas para ilustrar la extravasación y el flujo de sangre. Ratón de (A) A Rosa mTmG fue inyectado con nanopartículas fluorescentes color púrpura, y una pila de Z de un frente de células invasoras de punta fue tomada 10 minutos después (AI). Una proyección que muestra que los brotes más endoteliales tienen una luz funcional (AII, flecha). Sólo raramente se observan brotes endoteliales sin flujo (AII, punta de flecha). Barra de escala = 250 μm. (B) esta proyección Z-stack muestra un área de buque destruido tumor en un animal de eNOStag-GFP antes del tratamiento (BI). El animal fue inyectado con nanopartículas (púrpura, BII) y Hoechst (azul, BIII). Nanopartículas y Hoechst no llegan a las áreas destruidas, indicadas por restos de células granuladas aún expresando GFP. Barra de escala = 250 μm. (C) un ratón eNOStag-GFP fue inyectado con dos dextranos de distinto tamaño (rojo = dextrano 2 MDa; morado = dextran 10 KDa) y Hoechst (azul = Da 615), y se presentan imágenes del solo-plano. 10 min después de la inyección, presencia en la sangre y la extravasación se ven en la misma imagen. Hoechst extravasates casi de inmediato de los vasos sanguíneos y es tomado por las células circundantes (CI). Dextran 10 KDa (CII) puede verse en los vasos y en el intersticio del tumor. Dextrano 2 MDa (CIII) puede encontrarse en los vasos. 40 minutos después de la inyección (CIV), Dextran 10 KDa desaparece de la sangre (CV), y la intensidad fluorescente de dextrano 2 MDa fue también menor (CVI). Barra de escala = 100 μm. haga clic aquí para ver una versión más grande de esta figura.
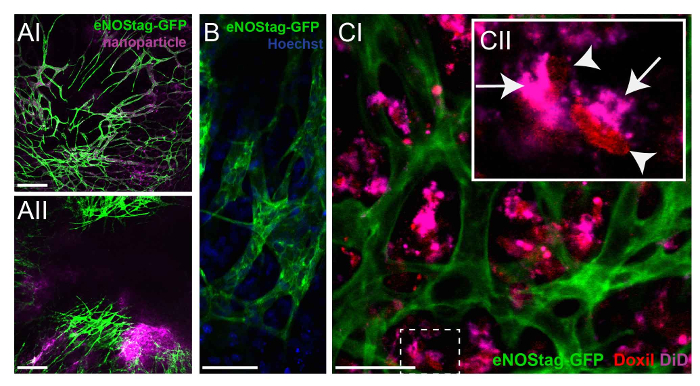
Figura 4: investigar el destino de los agentes quimioterapéuticos. (A) un animal eNOStag-GFP era tratamiento i.v. con nanopartículas y reflejada 24 h más tarde. Las nanopartículas están todavía presentes en vasos, con extravasación mínima en el intersticio del tumor (AI). Cuando las nanopartículas se combinan con TNF, se observa extravasación de la sangre en el intersticio del tumor (AII). Barra de escala = 250 μm. (B) usando las lentes alta resolución, el citoplasma endotelial (verde) y el núcleo (azul) de una célula individual pueden ser reconocidos. Barra de escala = 50 μm. (C) un animal eNOStag-GFP se inyecta i.v. con Doxil-en combinación con TNF, e imágenes fueron tomadas 24 horas más tarde. Aquí, la extravasación de Doxil-lo hizo fuera de los vasos dentro del tumor el intersticio es obvio (CI). Una evaluación más detallada de células individuales (CII) muestra que el portador de la púrpura puede encontrarse en el citoplasma (flecha), mientras que la doxorrubicina liberada (rojo) se observa en el núcleo celular (flecha). Barra de escala = 50 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Como tumor y desarrollo vasos del tumor, así como efectos terapéuticos del tumor, son procesos altamente dinámicos, intravital evaluación es una herramienta elegante para hacer una correcta evaluación de estos procesos de una manera dependiente del tiempo y espacial. Con la creciente disponibilidad de marcadores de células vivas, la creación de animales transgénicos y la promoción de modalidades de imagen, proyección de imagen de intravital se está convirtiendo en cada vez más popular. Aunque la histología se utiliza todavía de forma rutinaria, y una multitud de marcadores puede utilizarse para identificar las células y estructuras, tejido seccionado tiene desventajas al investigar procesos dinámicos. Disección del tejido es necesaria, proporcionar sólo información estática; fijación afecta la calidad del tejido; y cortar interacciones celulares. Además, la investigación de procesos dinámicos, disección del tejido en momentos diferentes y a menudo presumidos, requiere una gran cantidad de animales. Con la proyección de imagen intravital, las dimensiones espaciales XYZ y la dimensión extra de tiempo pueden ser evaluados en el mismo animal, posibilitando la colocación apropiada de los diferentes actores en el espacio y tiempo. Por lo tanto, no le falten puntos de tiempo óptimo, y se reduce significativamente el número de animales por experimento. En segundo lugar, la ventana de tiempo establecida con evaluación intravital puede ser extrapolada para optimizar la extracción de tejido. En tercer lugar, el escenario deseado de crecimiento de vasos puede identificar intravitally y manchado como un tejido de montaje en conjunto.
El diseño intravital mencionado en este manuscrito utiliza una combinación de animales transgénicos que expresan una etiqueta fluorescente en células endoteliales, la dorsal de pliegues modelo de cámara y microscopio confocal multifotón dedicado.
Las células endoteliales pasan por una serie de etapas21,22 durante la angiogénesis, y estas etapas pueden a menudo verse simultáneamente en un tumor. Utilizando la línea de ratón eNOSTag-GFP, células endoteliales individuales pueden ser seguidas, y puede rastrearse incluso filopodia dinámica. Por lo tanto es un buen modelo para estudiar el desarrollo de vasos intravitally. Dependiendo de las etiquetas intrínsecas ya presente, agentes fluorescentes inyectables pueden utilizarse para evaluar formación de lumen, flujo de sangre, extravasación y separación de la sangre. El ratón es imagen continua de hasta 5 horas. La evaluación a largo plazo de un animal es factible cuando se toman varias precauciones con respecto a la anestesia del animal, que ha sido descrito previamente23. Como esta investigación se centra en el cáncer, se implantaron tumores tejido o células. Sin embargo, también se experimentó con los metatarsos y los pulmones embrionarios. Sin embargo, la tasa de crecimiento de tejido bajo estudio está limitando, como después de un par de semanas, la piel comienza a crecer, que puede ser un problema con crecimiento lento de tumores o tejidos.
Durante la fase de validación, el dorsal que cámara ventana pliegues cutáneos se modificó considerablemente en comparación con el modelo clásico4. Los marcos están construidos con material sintético apto para el autoclave y son ligeros y pequeños, con un área grande de la ventana. El gancho del anillo de retención (figura 1Bg, punta de flecha blanca) se utiliza sólo para facilitar la extracción del anillo. Anillos de retención sin ganchos pueden utilizarse cuando éstos interfieren con la proyección de imagen. La piel no se estire demasiado, aflojamiento no ocurre en este modelo, y sólo rara vez se observan infecciones. Estas modificaciones reducen molestias animales y refinan el procedimiento animal significativamente. Además, las piezas de metal se pueden quitar fácilmente cuando proyección de imagen del tumor usando MRI24.
Cualquier microscopio puede adoptarse a intravitally imagen dorsal cámaras de pliegues cutáneos. El principal requisito es el espacio disponible entre la platina del microscopio y del objetivo. Un aspecto importante que afecta la proyección de imagen es movimiento. Para evitar artefactos de movimiento, puede usarse una plataforma que encaja en la mesa del microscopio (después de la eliminación de todas) y es compatible con el ratón. No es necesario sujetar el ratón cuando está bajo anestesia, y es mejor dejar que la respiración de ratón libremente. Sin embargo, la ventana se fija con pernos a la plataforma, dando una óptima fijación del campo de visión (es decir, el tumor es visible a través de la cámara de la ventana). La plataforma se calienta con una almohadilla de calefacción electrónica, utilizada para la calefacción del animal. Esta plataforma fue hecha interna y específicos pueden obtenerse a petición. Un objetivo de alta resolución es una necesidad cuando se evalúan los procesos intracelulares y permite discriminar entre el citoplasma y el núcleo. El uso de una lente cónica con una buena resolución óptica (NA alta) pero una relativamente larga distancia de trabajo (preferiblemente de 2 mm o más) se recomienda. La limitación en la proyección de imagen es la profundidad de penetración y la intensidad fluorescente de las etiquetas. Además, deben evitarse fotoblanqueo, fototoxicidad y saturación durante proyección de imagen.
Aquí, se utilizan un confocal multifotón integrado y un microscopio confocal. El multifotón es vertical, mientras que el confocal es un microscopio invertido. La ventaja de un microscopio vertical es el fácil uso de las lentes de inmersión en agua. Estas lentes tienen una NA alta y una larga distancia de trabajo, incluso a un aumento de alta (por ejemplo, 20 o 40 X). Específicamente, se recomienda para obtener una lente de inmersión en agua 20 X NA 1.0, que se comercializa por varias empresas. Ten en cuenta que, cuando se utilizan lentes de inmersión, el objetivo y el líquido de inmersión necesitan calentarse a 37 ° C. Para las mejores imágenes, se recomienda utilizar configuración confocal óptima (es decir, agujero de alfiler en 1 unidad de airy, laser de potencia tan bajo como sea posible, no demasiado alto (sobre todo si la ganancia introduce ruido), velocidad máxima y no con un promedio de análisis de la línea). Sobre exposición, la saturación y la diferencia de intensidades entre imágenes de comprometen la calidad de los datos. Se recomienda para evitar la saturación y la sobreexposición. Esto puede eludirse mediante la adquisición de imágenes en niveles de ganancia diferentes. Cambio de la ganancia es la forma más fácil de cambiar el brillo de la imagen. Si es necesario, puede ajustar la potencia del láser. Para estandarizar la calidad de imagen, se pueden utilizar diapositivas con una intensidad de fluorescencia fijo. Se debe tener en mente que incluso cuando el microscopio óptimo, calidad de imagen depende en gran medida de la calidad de la cámara de la ventana y el tejido
Al analizar simultáneamente varios marcadores fluorescentes, repintado, en el cual un fluoróforo es detectado en el canal de otra, debe evitarse. Evitar el repintado usando una combinación de fluoróforos con mínima superposición espectros y secuencial la exploración entre marcos. Las imágenes presentadas aquí fueron analizadas utilizando análisis secuenciales 3 (pista 1: GFP, DID o fluor647 con el laser de 488 y 633; pista 2: rodamina, Doxil o mTomato con el laser de 543; y 3: Hoechst con el láser de 405).
Aquí se muestra la posibilidad de evaluar varias etapas del desarrollo del buque tumor, punta de la célula dinámica, formación de lumen, extravasación y daño vascular. Utilizando la línea de eNOStag-GFP, áreas del tumor con un lecho vascular destruido fácilmente detectan restos celulares granulados todavía expresando GFP. Ningún agente inyectable fue detectado en estas áreas, lo que indica la falta de flujo. Esto significa que el había administrado a agentes quimioterapéuticos o bien no llegará a estas áreas. Sin embargo, la destrucción del buque también puede ser un resultado terapéutico. La evaluación del tumor, para verificar la destrucción de la nave de pretratamiento, es un requisito previo para la evaluación terapéutica precisa y puede realizarse fácilmente utilizando este diseño experimental.
Hay una plétora de posibilidades que se puede utilizar la microscopía intravital y discusión detallada está fuera del alcance de esta publicación. Para dar una visión breve, posibles aplicaciones incluyen estudios sobre la acumulación de quimioterápicos en tejido tumoral, el desarrollo de los vasos (por ejemplo, el número de buques, ramas e intersecciones) y flujo sanguíneo, las interacciones célula-célula, de la célula objetivo y procesamiento intracelular, así como los ejemplos mencionados anteriormente y se muestra a continuación. Como análisis se basan en la fluorescencia, ser conscientes de las fluctuaciones de intensidad debido a la calidad de la ventana o tejido. También, como el tejido del tumor es relativamente gruesa, fluorescencia por arriba o por debajo del plano de visión tiene un impacto en la señal en la imagen. Es mejor combinar el análisis cuantitativo de imagen con medidas objetivas. Por ejemplo, si está interesado en concentraciones de la droga, el tejido del tumor desde la ventana después de microscopia intravital y determine la droga contenida con HPLC para comparar con las imágenes confocales.
La evaluación de la respuesta del tumor puede realizarse bien con este modelo, pero con algunas precauciones. Uno debe darse cuenta de que los tumores crecen también hacia adentro, en la piel. Mediciones 3D se pueden hacer si la penetración es bastante profunda como para cubrir todo el tumor. En tal caso, deben utilizarse tintes far-red. La cámara de la ventana como describe aquí trata tumores en un entorno de piel, y es importante señalar que la ventana mantiene una temperatura ligeramente más baja que la temperatura del cuerpo normal del ratón. Por lo tanto, es mejor estudiar tumores en la derecha micro ambientación para confirmar estudios intravital con el dorsal cámara ventana pliegues cutáneos. Importante, el dorsal de pliegues de la cámara ofrece una visión de la cinética de los procesos y mecanismos, proporcionando una base instrumental para la mejora de la terapia. Además, puede obtenerse información adicional en la biodistribución y farmacocinética. Clásicamente, estos estudios de biodistribución se realizan por tratar a los animales con tumores y tumores/órganos para medir la absorción de la droga de disección. Usando este modelo intravital, la ubicación de intratumoral de un fármaco (es decir, intravascular, intratumoral, intracelular o nuclear) puede proporcionar5,25,26. No sólo es la ubicación de la droga revelada, pero también la ventana-de-oportunidad para la absorción más óptima.
Utilizando el diseño experimental descrito en este artículo, puede evaluarse una amplia gama de parámetros en un entorno temporal y espacial. En concreto, aquí mostramos que eso microscopia intravital proporciona penetraciones importantes en la dinámica del desarrollo del buque de tumor y la respuesta terapéutica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer a Rien van Haperen y Rini de Crom para su desarrollo y la donación de la línea eNOSTag-GFP, Joost A.P. Rens para su asistencia técnica con el trabajo animal y los animales guardianes por su ayuda. Las instalaciones de microscopía utilizadas son parte del centro de la proyección de imagen óptica de Erasmus, y nos gustaría agradecer al personal de la OCI para su servicio. Este estudio fue apoyado por beca 2000 DDHK-2224 de la sociedad holandesa de cáncer "Trustfonds Vereniging" Erasmus University Rotterdam y "Stichting Erasmus Heelkundig Kankeronderzoek", y agradecemos a los miembros de los comités para su donación.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma | D1145 | Supplemented with 10% FCS |
| Trypsin-versene (EDTA) | Lonza | BE17-161E | Make a 0.1% solution in PBS, sterile |
| PBS | |||
| Window frames | Costum made | ||
| Filler glass 10 mm, 0.55 mm | Abrisia technologies | ||
| Cover glass 12mm, #1 thickness | Thermo Scientific/VWR | 631-0713 | |
| Hear removal gel (veet) | for sensitive skin | ||
| Eye ointment | |||
| Buprenorfine hydrochloride | use 0.05 mg/kg | ||
| Anesthesia unit | O2/Isoflurane inhalation unit with an chamber and tubeing+cone | ||
| insulin syringe 0.5ml x 12.7mm 29g, green | BD | 324824 | |
| Needles 23G 1 1/4" | Braun | 4657640 | |
| Needles 25G 5/8" | Braun | 4657853 | |
| Sutures silkan 0.7 | Braun | 1134019 | |
| Nuts | Jeveka | 934 A2 1 | |
| Bolts | Jeveka | 84 A2 1 10 | |
| 0.9% NaCl | |||
| Microscope + software | The space between table and objective need to be wide enough to hold the animal | ||
| Heated temperature controlled platform | Costum made | ||
| Window holder | Costum made | ||
| tetramethylrhodamine 2,000,000 MW dextran | Invitrogen | D7139 | 100 µg/mouse |
| Alexa-fluor 647 10,000 MW dextran | Invitrogen | D22914 | 100 µg/mouse |
| Hoechst 33342 | Invitrogen | H1399 | 25 µg/mouse |
| Pegulated nanoparticles | ref 5 | ||
| LEICA TCS SP5 Multiphoton Microscope | Leica | ||
| LAS AF Software | Leica |
Referencias
- Massoud, T. F., Gambhir, S. S. Molecular imaging in living subjects: seeing fundamental biological processes in a new light. Genes Dev. 17, 545-580 (2003).
- Ellenbroek, S. I., van Rheenen, J. Imaging hallmarks of cancer in living mice. Nat Rev Cancer. 14, 406-418 (2014).
- Brown, E., Munn, L. L., Fukumura, D., Jain, R. K. In vivo imaging of tumors. Cold Spring Harb Protoc. 2010 (7), (2010).
- Palmer, G. M., et al. In vivo optical molecular imaging and analysis in mice using dorsal window chamber models applied to hypoxia, vasculature and fluorescent reporters. Nat. Protocols. 6, 1355-1366 (2011).
- Seynhaeve, A. L., et al. Tumor necrosis factor alpha mediates homogeneous distribution of liposomes in murine melanoma that contributes to a better tumor response. Cancer Res. 67, 9455-9462 (2007).
- Schiffelers, R. M., et al. Ligand-targeted liposomes directed against pathological vasculature. J Liposome Res. 12, 129-135 (2002).
- Straetemans, T., et al. T-cell receptor gene therapy in human melanoma-bearing immune-deficient mice: human but not mouse T cells recapitulate outcome of clinical studies. Hum Gene Ther. 23, 187-201 (2012).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147, 983-991 (2011).
- van Haperen, R., et al. Functional expression of endothelial nitric oxide synthase fused to green fluorescent protein in transgenic mice. Am J Pathol. 163, 1677-1686 (2003).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Manzoor, A. A., et al. Overcoming limitations in nanoparticle drug delivery: triggered, intravascular release to improve drug penetration into tumors. Cancer Res. 72, 5566-5575 (2012).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5, 1518-1534 (2010).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. J Vis Exp. , e50546 (2013).
- Hobbs, S. K., et al. Regulation of transport pathways in tumor vessels: role of tumor type and microenvironment. Proc Natl Acad Sci U S A. 95, 4607-4612 (1998).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat Rev Cancer. 6, 583-592 (2006).
- Koning, G. A., Eggermont, A. M., Lindner, L. H., Hagen, t. e. n., L, T. Hyperthermia and thermosensitive liposomes for improved delivery of chemotherapeutic drugs to solid tumors. Pharm Res. 27, 1750-1754 (2010).
- Seynhaeve, A. L., Eggermont, A. M., ten Hagen, T. L. TNF and manipulation of the tumor cell-stromal interface: "ways to make chemotherapy effective". Front Biosci. 13, 3034-3045 (2008).
- Brouckaert, P., et al. Tumor necrosis factor-alpha augmented tumor response in B16BL6 melanoma-bearing mice treated with stealth liposomal doxorubicin (Doxil) correlates with altered Doxil pharmacokinetics. Int J Cancer. 109, 442-448 (2004).
- Hoving, S., Seynhaeve, A. L., van Tiel, S. T., Eggermont, A. M., ten Hagen, L. T. Addition of low-dose tumor necrosis factor-alpha to systemic treatment with STEALTH liposomal doxorubicin (Doxil) improved anti-tumor activity in osteosarcoma-bearing rats. Anticancer Drugs. 16, 667-674 (2005).
- Gabizon, A., et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res. 54, 987-992 (1994).
- Bergers, G., Benjamin, L. E. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 3, 401-410 (2003).
- Eilken, H. M., Adams, R. H. Dynamics of endothelial cell behavior in sprouting angiogenesis. Curr Opin Cell Biol. 22, 617-625 (2010).
- Nakasone, E. S., Askautrud, H. A., Egeblad, M. Live imaging of drug responses in the tumor microenvironment in mouse models of breast cancer. J Vis Exp. , e50088 (2013).
- van Vliet, M., et al. MR angiography of tumor-related vasculature: from the clinic to the micro-environment. Radiographics. 25, S85-S97 (2005).
- Dicheva, B. M., et al. Cationic thermosensitive liposomes: a novel dual targeted heat-triggered drug delivery approach for endothelial and tumor cells. Nano Lett. 13, 2324-2331 (2013).
- Li, L., et al. Improved intratumoral nanoparticle extravasation and penetration by mild hyperthermia. J Control Release. 167, 130-137 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados