Method Article
Hautement sensible et rapide avec détection par fluorescence avec un analyseur FRET Portable
Dans cet article
Résumé
Ce protocole décrit la quantification rapide et très sensible de Förster transfert d'énergie par résonance (FRET) des données de capteur en utilisant un analyseur portable FRET-mesure. Le dispositif a été utilisé pour détecter le maltose dans une plage de température critique qui maximise la sensibilité de détection, ce qui permet une évaluation pratique et efficace de la teneur en sucre.
Résumé
De récentes améliorations dans Förster transfert d'énergie par résonance (FRET) capteurs ont permis leur utilisation pour détecter diverses petites molécules, y compris des ions et des acides aminés. Cependant, l'inné faible intensité du signal des capteurs FRET est un défi majeur qui empêche leur application dans divers domaines et rend l'utilisation de coûteux, haut de gamme Fluorimètres nécessaire. Auparavant, nous avons construit une haute performance FRET analyseur rentable qui peut spécifiquement mesurer le rapport de deux bandes de longueur d'onde d'émission (530 et 480 nm) pour obtenir une sensibilité de détection élevée. Plus récemment, on a découvert que les capteurs FRET avec des protéines de liaison périplasmique bactérienne détectent les ligands ayant une sensibilité maximale dans la plage de température critique de 50 - 55 ° C. Ce rapport décrit un protocole d'évaluation de la teneur en sucre dans des échantillons de boissons disponibles dans le commerce en utilisant notre FRET analyseur portable avec un capteur de FRET spécifique à la température. Nos résultats ont montré que le préchauffage supplémentaireProcédé de la sonde FRET augmente sensiblement le rapport signal FRET pour permettre une mesure plus précise de la teneur en sucre. Le FRET analyseur et le capteur sur mesure ont été appliquées avec succès pour quantifier la teneur en sucre dans trois types de boissons commerciales. Nous prévoyons que la poursuite de la réduction de la taille et amélioration de la performance de l'équipement facilitera l'utilisation d'analyseurs portatifs dans des environnements où l'équipement haut de gamme ne sont pas disponibles.
Introduction
Förster transfert d'énergie par résonance (FRET) a été largement utilisée comme un capteur biométrique pour détecter de petites molécules telles que des sucres, des ions calcium et des acides aminés 1-4. biocapteurs FRET contiennent des protéines fluorescentes, des protéines fluorescentes cyan (PFC) et des protéines fluorescentes jaunes (YFPs), qui sont fusionnés aux deux extrémités des protéines périplasmiques de liaison (PLP). Les sucres se lient aux PLP situées au milieu de la sonde FRET, ce qui provoque des modifications structurelles au capteur qui modifie ensuite l'orientation et la distance de transition dipolaire des deux protéines fluorescentes à chaque extrémité de la PLP. Cette modification permet une analyse quantitative de la teneur en sucre en mesurant le rapport des longueurs d'onde d'émission de l'EYFP (530 nm) et ECFP (480 nm). En raison de la haute sensibilité, la spécificité, la capacité de surveillance en temps réel, et le temps de biocapteurs FRET de réponse rapide, ces capteurs sont largement utilisés dans les applications environnementales, industrielles et médicales 5. En outre, ratiommesure étrique utilisant biocapteurs FRET a des avantages pratiques importants, car il peut être utilisé pour mesurer des composants dans des échantillons biologiques complexes où la concentration de la sonde ne peut pas être facilement contrôlé et la fluorescence de fond est toujours présent.
En dépit de ces avantages des capteurs à base de FRET pour la visualisation quantitative, de petits changements structurels avec domaine incomplète mouvement de transfert des protéines fluorescentes produisent intrinsèquement faible intensité du signal. Ce signal faible limite l'application des capteurs à base de FRET pour in vitro ou in vivo de l' analyse 6. Par conséquent, la plupart FRET biocapteurs nécessitent l'utilisation d'un matériel coûteux et hautement sensible. Précédemment, nous avons développé un analyseur de FRET peu coûteux et facile à transporter avec des capacités similaires à celles des analyseurs de fluorescence existants 7. Dans ce dispositif, la diode émettrice de lumière ultraviolette bande de 405 nm bon marché (LED) a été utilisé comme source de lumière pour provoquer une excitation de thsignal de fluorescence e, le remplacement d'une lampe ou laser coûteux. Le système de détection de l'analyseur se concentre efficacement le signal de fluorescence de dissipation sur deux photodétecteurs avec une photodiode au silicium. Dans une étude plus récente, nous avons montré que l' optimisation de la température de détection à 50 - 55 ° C pourrait amplifier considérablement le signal de FRET ratiométrique 8. Cette amélioration de signal spécifique à la température, ainsi que le FRET analyseur-mesure, permet l'utilisation de capteurs FRET dans des applications diagnostiques plus générales avec une sensibilité rapide et élevé.
Dans ce protocole, nous avons démontré l'applicabilité générale du dispositif d'analyse de FRET sous des conditions de températures optimales de FRET par la quantification de la teneur en sucre des boissons disponibles dans le commerce. Ce protocole fournit les détails du fonctionnement du dispositif de FRET, ainsi qu'une brève description du capteur et la préparation des échantillons. Nous prévoyons que ce rapport favorisera l'application potentielle du portableanalyseur dans des environnements de laboratoire à petite échelle et de fournir une base pour le développement d'un dispositif peu coûteux sur le site de diagnostic avec des biocapteurs basés sur FRET.
Protocole
1. Préparation de biocapteur
- Construire le plasmide pET21a (+) - CFP-MBP-YFP-His6 en suivant le protocole précédemment établi 2.
- Inoculer 5 ml de bouillon Luria (LB) avec une seule colonie d'une souche Escherichia coli DE3 et incuber à 37 ° C pendant 16 heures avec agitation.
- Le transfert de 1 ml de la culture O / N dans un ballon de 500 ml contenant 100 ml de LB et on incube à 37 ° C dans un incubateur agité jusqu'à ce que la densité optique à 600 nm (DO 600) atteint 0,5 (environ 3 heures).
- Récolter les cellules dans un tube conique de 50 ml par centrifugation à 1000 xg pendant 20 min à 4 ° C.
- Reprendre le culot rapidement dans chaque tube avec de l' eau 50 ml glacée distillée (DW) et centrifuger à 1000 g pendant 20 min à 4 ° C.
- Remettre en suspension le culot dans 50 ul de DW glacé avec 10% (v / v) de glycerol en faisant tourbillonner doucement jusqu'à ce que la solution (cellules électrocompétentes) atteint une DO600 100.
- Placer le mélange de cellules électrocompétentes (50 ul des cellules à une DO 600 de 100) et 10 ng du plasmide pET21a (+) - CFP-MBP-YFP-His6 dans une cuvette d' électroporation de la glace dans un dispositif d'électroporation et l' électroporation le mélange (18 kV / cm, 25 pF).
- Rapidement ajouter 1 ml de milieu SOC à la cuvette et remettre les cellules en douceur, suivie d'une récupération à 37 ° C pendant 1 heure avec agitation douce dans un 15 ml de tube à fond rond.
- Étaler les cellules sur une plaque LB contenant 100 ug / ml d'ampicilline et on incube à 37 ° C pendant 12 heures.
- Isoler une colonie unique à l'aide d'une boucle et d'inoculer la colonie dans 10 ml de LB contenant 100 ug / ml d'ampicilline à 37 ° C dans un agitateur pendant 12 heures.
- Ajouter 5 ml de la culture de semences à 500 ml de LB contenant 100 ug / ml d'ampicilline et incuber la culture dans un incubateur à agitation 37 ° C.
- Ajouter 0,5 mM isopropylique β-d-thiogalactoside (IPTG) lorsque les OD 600 atteint0,5 et incuber la culture dans un incubateur à agitation 37 ° C pendant 24 heures.
- Centrifuger les cellules à 4500 × g pendant 20 min (4 ° C) et retirez délicatement le surnageant.
- Remettre en suspension le culot dans 5 ml de tampon de liaison (20 mM de Tris-HCl, pH 8,0, 1 mM de PMSF, 0,5 mM d'EDTA et 1 mM de DTT).
- Soniquer les cellules sur la glace avec six salves de 10 s à 200-300 W, après chaque rafale avec 10 secondes de refroidissement.
- Centrifuger le lysat à 10.000 × g pendant 30 min à 4 ° C pour sédimenter les débris cellulaires. Transférer le surnageant (protéine soluble) dans un nouveau tube de collecte.
- Pour réaliser la purification par affinité des protéines de détection de FRET, la charge 4 ml du lysat cellulaire autorisé sur une colonne d'affinité Ni-NTA (volume de 5 ml) et d' effectuer un essai de chromatographie en utilisant une chromatographie liquide rapide des protéines (FPLC) 18.
- Laver la colonne une fois avec cinq volumes de colonne de tampon de lavage I (tampon phosphate 50 mM, chlorure de sodium 300 mM, imidazole 10 mM, pH 7,0).
- Répétez l'étape de lavage avec cinq volumes de colonne de tampon de lavage II (50 mM de tampon phosphate, chlorure 300 mM de sodium, 20 mM d'imidazole, pH 7,0).
- Éluer la protéine de capteur avec cinq volumes de colonne de tampon d'élution (50 mM de tampon phosphate, chlorure de sodium 300 mM, imidazole 500 mM, pH 7,0).
- Pour concentrer et dessaler l'échantillon élué, remplissez le concentrateur (taille de membrane de 10.000 MW) avec un maximum de 20 ml d'échantillon et centrifuger pendant 10 min à 3000 x g. Recharge concentrateur avec une solution saline à 0,8% tamponnée au phosphate (PBS). Répéter cette étape à deux reprises, d'abord remplir le concentrateur avec 20 ml d'échantillon, puis le remplissage avec du PBS.
- Récupérer la protéine de capteur concentré et de salé et de le stocker à -80 ° C.
2. Mesure de la teneur de sucre en utilisant l'analyseur FRET
NOTE: Les détails de la construction de l' analyseur FRET ont été décrits dans nos travaux précédents 7.
- Préparer une solution de détection de 0,8% de PBS contenant 0,2iM des protéines du capteur.
- Allumez l'analyseur de FRET. Appuyez sur le bouton "UP" pendant 2 secondes pour calibrer la température optimale. Réglez la température à 53 ° C en utilisant les touches "UP" et "DOWN" et appuyez sur la touche "SET".
- Pour l'étalonnage, appuyez sur la touche "UP" et "DOWN" en même temps pendant 2 secondes. Vérifiez que le panneau LED affiche "CALIB" et appuyez sur la touche "SET".
- Placer un 12,5 × 12,5 × 45 mm (longueur x largeur x hauteur) de la cuve de parallélépipède rectangulaire (cuvette) contenant du tampon PBS seulement dans un support de cuvette de l'analyseur et appuyez sur la touche "SET".
- Remplacer la cuvette avec un contenant uniquement la solution de détection (voir 2.1) sans sucre (maltose / saccharose) et appuyez sur le bouton "SET" pour calibrer la ligne de base.
- Remplacer la cuvette avec un contenant la solution de détection de sucre 10 mM et appuyez sur le "SET"bouton.
- Pour déterminer la teneur en sucre d'un échantillon de boisson, mettre 1 ml d'échantillon de boisson dans un microtube de 1,5 ml et on centrifuge à 16 000 x g pendant 1 min.
REMARQUE: la mesure de la fluorescence en fonction du capteur de FRET a l'avantage de ne pas nécessiter de pré-traitement particulier de l'échantillon étant donné que seul 1% (v / v) de l'échantillon est inclus dans le volume total. Cependant, nous recommandons de retirer tout matériel qui peut affecter la mesure de fluorescence (par exemple, des cellules, des particules insolubles, lipides, graisses, ou tout autre matériel avec autofluorescence). En outre, si un acide fort, base forte, agent de nettoyage (détergent), ou un agent émulsifiant (émulsifiant) est présent à une concentration élevée et peut affecter les propriétés du capteur biologique FRET, il doit être retiré à l'aide d'un solvant organique ou d'un neutraliseur. Par exemple, lorsque la matière grasse laitière et d'émulsifiants sont éliminés des snacks surgelés, les échantillons sont centrifugés dans un tube de microcentrifugeuse à 16 000 x g pendant 30 min et le liquide between les sédiments du fond et de la couche supérieure de la matière grasse laitière est extrait. Une quantité égale d'hexane est ensuite ajoutée, suivie par une centrifugation à 15 000 xg pendant 30 min pour éliminer les lipides. - Retirer le surnageant avec une seringue de 1 ml et filtrer à travers un filtre à seringue (taille des pores 0,2 um).
- Placer 0,1 ml d'échantillon filtré de boisson dans un microtube de 1,5 ml contenant 0,9 ml de PBS et vortexer doucement.
NOTE: Il est essentiel de diluer l'échantillon de boisson correctement. Dans ce cas, 1000 fois la dilution a été effectuée de telle sorte que la concentration en sucre tomberait dans la plage dynamique du dispositif. Nous recommandons d'estimer la concentration en sucre cible à l'avance en se référant à la teneur en sucre dans l'étiquette de la boisson. - Ajouter 5 ul de l'échantillon de boisson diluée (1%, v / v) dans une cuvette contenant 0,495 ml de la solution de détection.
- Placer la cuvette dans un support de cuvette de l'analyseur de FRET et préchauffer la solution d'échantillon à 53 ° C.
- Appuyez sur le bouton "SET" pour mesurer la teneur en sucre.
Remarque Il est possible d'évaluer la mesure de FRET en utilisant un lecteur de plaque de multilabel ou un spectrophotomètre à fluorescence équipé d'un dispositif Peltier pour le contrôle de la température en lisant le rapport à 488/535 nm 7,8. Pour la détection de saccharose, suivez les étapes de 01/01 à 02/12 avec un capteur CSY-LH 2.
Résultats
Pour effectuer une analyse quantitative de la teneur en sucre en utilisant l'analyseur FRET, il est nécessaire de construire une courbe ajustée estimation de la concentration en sucre cible à partir du rapport FRET observé. Soit r définir le rapport entre l'intensité d'émission de CFP à 480 nm et l'intensité d'émission de la YFP générée à 530 nm (éq. 1).

La courbe dose-réponse du FRET biocapteur (CMJ-BII à 53 ° C) peut être généré en observant le taux de FRET, r, à différentes concentrations de sucre. La courbe peut alors être exprimé sous la forme d'une courbe sigmoïde en forme de S comme suit:

où R max et R min représentent le rapport du signal avec des concentrations de sucre et de 0 saturé (1 000 pm), respectivement en page; x 0 représente la concentration du sucre à 50% de réponse; et p représente la pente de la réponse, qui est proche de 1 ou -1. Dans la présente étude, r max, r min, x 0, et p sont 4.256, 2.672, 71,779 et 1, respectivement. La gamme de concentrations allant de 1 uM à 1 000 um a été utilisée dans le modèle de montage.
En utilisant les équations 1 et 2, la teneur en sucre des boissons disponibles a été quantifiée avec vente dans le commerce de l'analyseur de FRET. Deux capteurs de FRET maltose ont été examinés pour tester le signal, r, en fonction de différentes températures de 2,8. Le premier capteur de FRET, CMY-0, est un capteur à base de FRET de base constitué par la PCP, la protéine de liaison au maltose (MBP) et la YFP, avec no les peptides de liaison. Le second capteur, CMY-BII, possède un segment de liaison Ser-Arg entre la MBP et les deux protéines fluorescentes 2. Comme le montre la figure 1A, on n'a pas observé CMY-0 à une température de mesure inférieures à 50 ° C, car il n'y a pas de différence de signal entre 0 et 1 mM de concentration maltose. Les différences entre les deux capteurs de signal FRET ont été optimisés compris entre 50 et 55 ° C (figure 1) 8. Afin de quantifier la teneur en sucre des trois types de boissons disponibles dans le commerce, une courbe dose-réponse du capteur CMY-BII à 53- ° C a été générée (figure 2A) et la teneur en maltose de ces trois échantillons ont été identifiés par convertir le rapport de la concentration FRET en maltose.
Comme l'échantillon A est constitué de céréales comme le riz et l'orge, qui sont des sources importantes de maltose, devrait l'échantillon pour contenir le contenu maltose relativement élevée (moyenne 11,892 g / 235 ml) ( Figure 2A). En revanche, l'échantillon C est une boisson de sport qui avait le maltose plus bas (0,29 g / 250 ml) parmi les trois boissons. Ces résultats suggèrent que l'analyseur de FRET peut être utilisé à des températures optimales afin de maximiser la quantification de la teneur en sucre, ce qui élimine la nécessité d'un dispositif de détection de FRET haut de gamme coûteux.
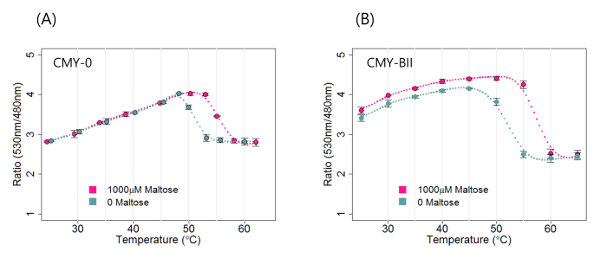
Figure 1. FRET Signal Différence entre 0 et 1 mM maltose en utilisant l'analyseur FRET à différentes températures. (A) Le capteur CMY-0 n'a montré aucune différence de signal à différentes concentrations de maltose à des températures inférieures à 50 ° C. (B) Le CMY-BII le capteur est capable de distinguer la différence de signal de FRET entre 0 et 1 mM maltose dans une large plage de températures. Dans les deux cas, la différence de signal considérablement augmentée dans une plage de température spécifique (50 - 55 ° C). L'ebarres de rror représentent l' écart - type. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
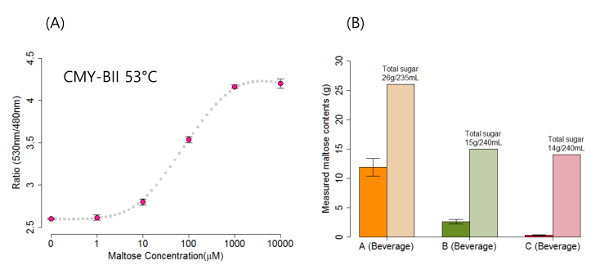
Figure 2. maltose de Quantification contenu dans trois disponibles dans le commerce (A) Une courbe dose-réponse boissons. Pour CMY-BII. (B) contenu maltose de trois échantillons de boissons a été quantifiée. Notez que le «sucre total» indique la quantité de tous les sucres (y compris le maltose) rapporté par le fabricant de boissons sur l'étiquette des boissons. La barre d'erreur indique l'écart - type. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Discussion
Ce protocole permet une quantification rapide et efficace de la teneur en sucre dans les échantillons de boisson, au moyen d' un sur-mesure de FRET analyseur 7 à une température optimale pour les capteurs FRET. L'analyseur a été conçu avec un récemment mis au point, peu coûteux 405 nm bande ultra-violet LED comme source lumineuse et deux photodétecteurs avec une photodiode au silicium. Ce dispositif est plus rentable que les autres fluorimétres comparables. Le dispositif a montré une sensibilité de détection élevée, en particulier lorsque l'on mesure le rapport entre deux bandes de longueur d'onde d'émission (530 nm et 480 nm) dans une plage de température optimale pour les capteurs FRET. Sa sensibilité et de l' intensité dans la détection de différents sucres étaient supérieurs à ceux d'un dispositif de fluorescence à 7 spectrophotomètre.
L'objectif principal de ce protocole est de soutenir la large applicabilité des capteurs à base de FRET avec le FRET analyseur-mesure. Alors que l'analyseur mesure indirectement la teneur en sucre par l'intermédiaire de capteurs FRET, it est clair que le dispositif incorpore un certain nombre des avantages des capteurs FRET, y compris largement extensible spécificité génétiquement de ligand, la conception modulaire, les signaux de concentration indépendant capteur, et un ciblage précis de petites molécules intracellulaires. Les capteurs FRET sont effectivement utilisés pour détecter une large gamme de petites molécules, y compris des ions hème 9, 10 et autres. En outre, plus de 20 types de constructions FRET peuvent être facilement trouvés et commandés par le dépositaire à but non lucratif Addgene 11.
En dépit de la large applicabilité de l'analyseur de FRET, il existe deux principaux problèmes avec le fonctionnement du dispositif. D'abord parce que le fonctionnement du dispositif est relativement simple, l'échantillon est pré-traitement de l'étape critique qui affecte la qualité de la détection, sauf en cas de dysfonctionnement de l'appareil. Dans ce protocole, une étape (dilution de l'échantillon) a été suffisante pour traiter les échantillons liquides qui étaient manifestement transparents et ne contenait aucun parti insolublecules. Cependant, d'autres échantillons peuvent nécessiter un traitement supplémentaire pour éliminer les matières insolubles, tels que des composants cellulaires ou des lipides. Toutes les particules autofluorescents qui peuvent affecter le signal de FRET devraient également être supprimés, comme indiqué ci-après l'étape 2.7. Deuxièmement, le contrôle de la qualité et de la connectivité interface avec les systèmes d'information hospitaliers doivent être abordées, comme avec tous les types de tests de point de soins (POCT) outils 12. Comme la qualité de l'analyseur de FRET du signal dépend largement de la qualité du capteur de FRET et sur les étapes de prétraitement, des contrôles réguliers de contrôle de la qualité sont nécessaires pour assurer que les mesures restent dans la plage de signal standard pour une analyse régulière des données de contrôle de la qualité. La période de stabilité et de stockage capteur de FRET, qui sont tous deux essentiels pour d'autres applications fiables, devrait être étudiée lors de contrôles de qualité. Créer des lignes directrices et le développement logiciel approprié peut également répondre à la limitation de la connectivité. Les versions actuelles de laanalyseur FRET sont équipés d'une connectivité RS232 pour le contrôle de la ligne de commande à distance, mais la communication sans fil peut être une caractéristique de la prochaine version de l'analyseur, ce qui aura une interface améliorée pour les systèmes d'information hospitaliers.
Cependant, les capteurs FRET ont été conçus pour la spécificité de substrat, une approche qui permet normalement plus large spécificité 2. Par conséquent, le signal de FRET peut rencontrer interférence involontaire d'autres ingrédients, y compris d'autres types de sucres dans les boissons commerciales. D'autres recherches devraient explorer comment les capteurs FRET répondre aux divers mélanges de sucre à quantifier avec précision la quantité de sucre. Collaboration avec des entreprises qui produisent les boissons permettra de confirmer la teneur en sucre pour calibrer de l'analyseur de FRET.
Il est prévu que le dispositif de FRET portatif proposé par différents capteurs FRET sera utilisé dans des applications ADBD. POCT est utilisé pour évaluer la grossesse, le sangles niveaux de glucose, des protéines de biomarqueurs, les bactéries infectieuses et les virus infectieux. méthodes POCT ont des délais d'exécution rapides et présentent généralement des taux d'erreur faibles en raison du petit nombre d'étapes de traitement. Ce sont des avantages importants de POCT sur l'approche centrale de tests de laboratoire. appareils POCT portatives, telles que le dispositif décrit ici, ont attiré une attention croissante en raison de leurs applications potentielles dans l'évaluation de la surveillance alimentaire et de sucre dans le sang. En particulier, le contrôle glycémique des échantillons de sang chez les patients atteints de diabète nécessite une méthode de POCT rapide, précise et rentable 13. Après l'équipe de recherche Ames a développé la première bandelette de test de glycémie en 1965 ( en utilisant une bande qui contient la glucose oxydase), plusieurs technologies ont été proposées à des fins de surveillance de la glycémie 12. L'analyseur de FRET est également disponible pour détecter le glucose dans les échantillons sanguins avec prétraitement approprié de sang et protei périplasmiques de glucose-liaisonn (MglB) 14 FRET à base de protéine.
, des méthodes simples et rapides pour l'évaluation de la qualité des aliments sont nécessaires. La consommation de boissons contenant du sucre est associée à une variété de maladies et syndromes, tels que le corps augmentation de l' indice de masse dans l' enfance 15, l' obésité pédiatrique 16, et le risque d'accident vasculaire cérébral 17. La compréhension de cette connexion nécessite une mesure précise des composants de sucre dans les boissons. Par conséquent, les concentrations de glucose et de fructose de boissons sont d'intérêt pour les scientifiques concernés par la santé humaine. Ce protocole démontre la performance très sensible de l'analyseur de FRET avec contrôle de la température optimale. Le dispositif peut être utilisé avec différents capteurs FRET pour détecter divers petits molecules- y compris le glucose et le fructose 14,15. Notre dispositif portatif et rechargeable, qui a une durée de vie de la batterie de 10 - 20 h, en fonction du protocole de chauffage, est applicable pour POCT. Son protocole simple mak opérationneles le dispositif est facile à utiliser et élimine la nécessité d'une formation du personnel compliqué. Avec des améliorations techniques, y compris la réduction de la taille de l'équipement, la minimisation des étapes de prétraitement, et l'identification des exigences pratiques pour une utilisation sur le terrain, ce dispositif favorisera le développement de la recherche à base de FRET dans des environnements de laboratoire à petite échelle.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Cette recherche a été soutenue par des subventions du Centre de biologie synthétique intelligente du projet Frontier mondial (2011-0031944) et le Programme Initiative KRIBB recherche.
matériels
| Name | Company | Catalog Number | Comments |
| LB | BD | #244620 | |
| isopropyl β-D-thiogalactoside (IPTG) | Sigma | I6758 | |
| Ampicillin | Sigma | A9518 | |
| Tri-HCl | Bioneer | C-9006-1 | |
| PMSF | Sigma | 78830 | |
| EDTA | Bioneer | C-9007 | |
| DTT | Sigma | D0632 | |
| NaCl | Junsei | 19015-0350 | |
| phosphate-buffered saline (PBS) | Gibco | 70011-044 | 0.8% NaCl, 0.02% KCl, 0.0144% Na2HPO4, 0.024% KH2OP4, pH 7.4 |
| SOC | 2% tryptone, 0.5% Yeast extract, 10 mM NaCl, 2.5 mM KCl, 10 mM MGCl2, 20 mM Glucose | ||
| Resource Q | Amersham Biosciences | 17-1177-01 | 6 × 30 mm anion-exchange chromatography column |
| HisTrap HP1 | Amersham Biosciences | 29-0510-21 | |
| Quartz cuvette | Sigma | Z802875 | |
| AKÄKTAFPLC | Amersham Biosciences | 18-1900-26 | a fast protein liquid chromatography (FPLC) |
| Cary Eclipse | VarianInc | a fluorescence spectrophotometer | |
| VICTOR | PerkinElmer | 2030-0050 | a multilabel plate reader |
| E. coli JM109 (DE3) | Promega | Electrocompetent cells | |
| A (Beverage) | Korea Yakult Co. (Korea) | Birak | Fermented drinks |
| B (Beverage) | Lotte Foods (Korea) | Epro | Soft drink |
| C (Beverage) | Lotte Foods (Korea) | Getoray | Sports drink |
Références
- Deuschle, K., Okumoto, S., Fehr, M., Looger, L. L., Kozhukh, L., Frommer, W. B. Construction and optimization of a family of genetically encoded metabolite sensors by semirational protein engineering. Protein Sci. 14 (9), 2304-2314 (2005).
- Ha, J. S., Song, J. J., Lee, Y. M., Kim, S. J., Sohn, J. H., Shin, C. S., Lee, S. G. Design and application of highly responsive fluorescence resonance energy transfer biosensors for detection of sugar in living Saccharomyces cerevisiae cells. Appl. Environ. Microbiol. 73 (22), 7408-7414 (2007).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proc. Natl. Acad. Sci. U.S.A. 101 (29), 10554-10559 (2004).
- Okumoto, S., Looger, L. L., Micheva, K. D., Reimer, R. J., Smith, S. J., Frommer, W. B. Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors. Proc. Natl. Acad. Sci. U.S.A. 102 (24), 8740-8745 (2005).
- Merzlyakov, M., Li, E., Casas, R., Hristova, K. Spectral Förster resonance energy transfer detection of protein interactions in surface-supported bilayers. Langmuir. 22 (16), 6986-6992 (2006).
- Zhang, J., Campbell, R. E., Ting, A. Y., Tsien, R. Y. Creating new fluorescent probes for cell biology. Nat. Rev. Mol. Cell Biol. 3 (12), 906-918 (2002).
- Kim, H., Kim, H. S., Ha, J. S., Lee, S. G. A portable FRET analyzer for rapid detection of sugar content. Analyst. 140 (10), 3384-3389 (2015).
- Gam, J., Ha, J. -S., Kim, H., Lee, D. -H., Lee, J., Lee, S. -G. Ratiometric analyses at critical temperatures can magnify the signal intensity of FRET-based sugar sensors with periplasmic binding proteins. Biosens. Bioelectron. 72, 37-43 (2015).
- Hessels, A. M., Merkx, M. Genetically-encoded FRET-based sensors for monitoring Zn2+ in living cells. Metallomics. 7 (2), 258-266 (2015).
- Song, Y., Yang, M., Wegner, S. V., Zhao, J., Zhu, R., Wu, Y., He, C., Chen, P. R. A genetically encoded FRET sensor for intracellular heme. ACS Chem. Biol. 10 (7), 1610-1615 (2015).
- Addgene. Fluorescent Protein Guide: Biosensors. , Available from: https://www.addgene.org/fluorescent-proteins/biosensors/ (2015).
- Rajendran, R., Rayman, G. Point-of-care blood glucose testing for diabetes care in hospitalized patients: an evidence-based review. J. Diabetes Sci. Technol. 8 (6), 1081-1090 (2014).
- American Diabetes Association. Standards of medical care in diabetes-2013. , Available from: http://care.diabetesjournals.org/site/misc/2016-Standards-of-Care.pdf (2015).
- Vyas, N. K., Vyas, M. N., Quiocho, F. A. Sugar and signal-transducer binding sites of the Escherichia coli galactose chemoreceptor protein. Science. 242, 1290-1295 (1988).
- Leermakers, E. T. M., Felix, J. F., Erler, N. S., Ċerimagić, A., Wijtzes, A. I., Hofman, A., Raat, H., Moll, H. A., Rivadeneira, F., Jaddoe, V. W., Franco, O. H., Kiefte-de Jong, J. C. Sugar-containing beverage intake in toddlers and body composition up to age 6 years: The Generation R Study. Eur. J. Clin. Nutr. 69 (3), 314-321 (2015).
- Shilts, M., Styne, D., Drake, C., Aden, C., Townsend, M. Fast food, fat and sugar sweetened beverage items are related to children's dietary energy density. FASEB J. 29 (1), 731-736 (2015).
- Larsson, S. C., Åkesson, A., Wolk, A. Sweetened beverage consumption is associated with increased risk of stroke in women and men. J Nutr. 144 (6), 856-860 (2014).
- Melkko, S., Neri, D. Calmodulin as an affinity purification tag. E. coli Gene Expression Protocols. Vaillancourt, P. E. , Methods in Molecular Biology; 205. Humana Press. Totowa, NJ. 69-77 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon