Method Article
Visualisation des miniSOG protéines marquées de réparation d'ADN en combinaison avec Electron imagerie spectroscopique (ESI)
Dans cet article
Résumé
Electron spectroscopic imaging can image and distinguish nucleic acid from protein at nanometer resolution. It can be combined with the miniSOG system, which is able to specifically label tagged proteins in transmission electron microscopy samples. We illustrate the use of these technologies using double-strand break repair foci as an example.
Résumé
Les limites de résolution optique et le défi de l'identification des populations de protéines spécifiques dans microscopie électronique en transmission ont été des obstacles en biologie cellulaire. Plusieurs phénomènes peuvent pas être expliqués par une analyse in vitro dans des systèmes simplifiés et ont besoin d'une information structurelle supplémentaire in situ, en particulier dans la plage comprise entre 1 nm et 0,1 pm, de manière à être entièrement compris. Ici, l'imagerie spectroscopique électronique, une technique de microscopie électronique en transmission qui permet la cartographie simultanée de la distribution des protéines et des acides nucléiques, et une étiquette d'expression, miniSOG, sont combinés pour étudier la structure et l'organisation de l'ADN double brin réparation des cassures foyers.
Introduction
Malgré les avancées significatives dans la microscopie optique au cours des dernières années 1, biologistes cellulaires souffrent encore d'une lacune dans la résolution. Cela limite la compréhension des relations structure-fonction dans les processus cellulaires fondamentaux qui impliquent l'interaction coordonnée entre les complexes macromoléculaires (par exemple, dans le remodelage de la chromatine, la réparation d'ADN, la transcription d'ARN et la replication d'ADN). Bien que des microscopes électroniques à transmission (MET) s fournir la résolution requise, il a été difficile de définir ces processus structurellement en raison de l'incapacité à marquer les protéines spécifiques tout en étant capable de déterminer la composition biochimique des structures visualisées. En l'absence de membranes internes pour aider à différencier les structures nucléaires, le noyau a été particulièrement difficile. Electron imagerie spectroscopique (ESI) permet de résoudre certaines de ces limitations en permettant la détection simultanée et la différenciation de l'ADN, de l'ARN, et protein-base structures nucléaires 2-5.
Electron imagerie spectroscopique:
Afin de cartographier la distribution des éléments à haute sensibilité et une résolution dans le microscope électronique, on peut utiliser un spectromètre d'imagerie qui sélectionne les électrons qui ont été inélastique par des interactions avec les électrons de coque intérieure d'un élément dans l'échantillon 6. En raison des quantités spécifiques d'énergie éléments sont perdues à la suite de l'ionisation d'atomes dans l'échantillon, ces électrons peuvent être séparées et visualisées en utilisant un spectromètre qui est attaché à la microscopie électronique. Ainsi, l'analyse du spectre des électrons qui ont interagi avec l'échantillon révèle des informations qualitatives et quantitatives sur la composition élémentaire de l'échantillon 7. Les électrons qui ne perdent pas d'énergie lors du passage à travers l'échantillon se trouvent dans le "pic sans perte» de la perte d'énergie d'électronsspectre. L'abondance de ces électrons est lié à la masse, la densité et l'épaisseur de l'éprouvette et est constitué d'électrons qui passent à travers l'échantillon sans entrer en collision avec l'échantillon ou la perte d'énergie lors du passage à travers l'échantillon. Cette information peut être utile pour la quantification absolue des nombres d'atomes d'un élément spécifique présent dans l'échantillon 8.
Depuis échantillons biologiques sont essentiellement des éléments légers qui dévient mal les électrons dans le faisceau incident de TEM, les méthodes de coloration utilisant sels de métaux lourds doivent être appliquées afin de générer contraste dans l'échantillon. Le manque de spécificité de la plupart de ces agents de contraste et de l'incapacité de visualiser plus d'une tache où la spécificité est possible a limité la valeur de la microscopie électronique conventionnelle dans l'étude du noyau. ESI possède des avantages significatifs sur TEM classique, en particulier pour l'étude des structures du noyau de la cellule.Il est possible d'exploiter la nature riche en phosphore de l'ADN et de complexes macromoléculaires contenant de l'ARN à distinguer des complexes de nucléoprotéine de complexes de protéines et de résoudre les différents complexes de nucléoprotéine en fonction de leur densité d'acides nucléiques. Le matériau biologique restant peut être imagée sur la base de l'abondance de l'azote. Cartographie seulement ces deux éléments et l'analyse de leur distribution et l'abondance relative au sein de différentes structures anatomiques nous fournit beaucoup d'informations sur le noyau. Par exemple, il est facile d'identifier la chromatine et les ribosomes dans la carte représentant l'abondance de phosphore. L'espace de interchromatiniens, des complexes de pore nucléaire, corps nucléaires et, d'autre part, peuvent être facilement détectés dans l'image de mappage d'azote.
Système générateur d'oxygène singulet Mini (miniSOG)
Bien ESI représente une technique puissante pour étudier la structure de la chromatine in situ car il prendres avantage des rapports caractéristiques entre dans la composition élémentaire de l'azote et du phosphore, la composition élémentaire ne peut normalement pas être utilisé pour établir une discrimination entre les différentes populations de complexes protéiques. Les anticorps marqués avec de petites particules d'or dans la plage du nanomètre ont été largement utilisés pour cartographier l'emplacement des molécules individuelles. Depuis la particule d'or est généralement fixé à un anticorps secondaire, il apparaîtra dans une circonférence d'environ 20 nm autour de l'épitope détecté par l'anticorps primaire. Dans les échantillons de post-enrobage, les anticorps peuvent uniquement détecter les epitopes qui sont exposés à la surface des sections. Bien qu'il soit possible de prouver la présence d'un antigène et le relier à une certaine structure anatomique de la cellule, l'information qui est obtenue est incomplète, car la plupart des epitopes sont obscurcies par de la résine. Techniques, qui utilisent des protocoles similaires à ceux utilisés pour la microscopie par fluorescence pré-enrobage, pour permettre l'accès à travers les antigènestoute la profondeur de l'échantillon, mais les étapes de perméabilisation qui sont nécessaires pour permettre à l'anticorps de pénétrer dans la cellule nécessite généralement l'enlèvement de membranes lipidiques et éliminer les composants qui ne peuvent être résolus par des aldéhydes. De plus, le fixateur d'aldéhyde préféré pour la préservation du ultrastructure, le glutaraldéhyde, des epitopes communément détruit et, par conséquent, le paraformaldéhyde est généralement nécessaire. Ceci est moins efficace pour la reticulation protéine-protéine. Un autre inconvénient des anticorps qui sont marqués avec une nanoparticule d'or est que l'or est un matériau dense aux électrons qui crée un très fort contraste qui peuvent masquer des détails de structure intéressants de l'échantillon, qui présente contraste plus faible.
L'émergence de la protéine fluorescente verte (GFP) comme une étiquette de protéine exprimée a transformé l'utilisation de la microscopie à fluorescence pour répondre aux questions en biologie cellulaire. Tagging une protéine avec un petit domaine fluorescente permet la cartographie de sa distribution in vivo sans la nécessité de procédures de perméabilisation qui peuvent altérer la structure. Pour traduire le principe de l'utilisation de mots-clés élégant de protéines pour cartographier les distributions de protéines dans une cellule pour la microscopie électronique, a besoin d'un système qui est capable de produire un signal à proximité de la structure d'intérêt et générer contraste dans le TEM. Diaminobenzidine polymérisé est un colorant qui est souvent utilisé en histologie pour détecter la liaison d'anticorps. Cette tache est habituellement déposé en utilisant la peroxydase de raifort (HRP) conjuguée à un anticorps secondaire. Bien que la réaction produit un résultat fiable, la HRP est catalytiquement actif non dans le cytosol des cellules 9. Les produits de réaction de HRP peut aussi diffuser hors du site de génération de sorte que leur résolution est pire que la méthode de Nanogold 10. Afin de contourner ces problèmes, le système / ReAsH flash a été développée 11. Il se compose de protéines de fusion recombinantes qui possèdent un motif tétracystéine. Ce motif permet de liaisonbiarsenic un fluorophore. Quand il est excité, le flash est lié ou ReAsH capable de générer de l'oxygène singulet hautement réactif et donc photoconvert diaminobenzidine (DAB) dans un polymère qui précipite immédiatement sur le site des protéines marquées. Le polymère de DAB peut être coloré avec du tétroxyde d'osmium, qui est électrons dense et donc peut être utilisé pour cartographier la distribution de la protéine de fusion recombinante dans le TEM.
En 2011, Shu et al. 10 ont présenté le système miniSOG, qui se compose d'un petit 106 amino tag acides de fusion dérivé d'un flavoprotéine d'Arabidopsis qui est fluorescente et capable de créer de nombreux radicaux oxygène singulet lorsqu'il est excité à 448 lumière bleue nm. Ces radicaux singulet d'oxygène peuvent être utilisés pour oxyder photo-diaminobenzidine pour former des polymères sur la surface et près de la protéine marquée, ce qui est considérablement plus étroite que les anticorps marqués 11 immunologique. Bien que le système FLASH / ReAsH nécessite portant le fluorole chrome et le diaminobenzidine dans les cellules avant de faire la photoconversion, le système ne nécessite que miniSOG diaminobenzidine et de la lumière et en plus est environ deux fois plus efficace à la polymérisation diaminobenzidine. Ici, miniSOG est utilisé en combinaison avec ESI afin de cartographier l'ultrastructure de réparation de l'ADN foyers.
Réparation de l'ADN foyers (DRF)
ADN non réparé des cassures double brin constituent une grave menace à la cellule, car ils peuvent conduire à des translocations et la perte de l'information génétique. À son tour, cela peut conduire à la sénescence, le cancer et la mort cellulaire. Beaucoup de protéines qui sont impliquées dans l'ADN réparation des cassures double brin accumulent dans les foyers que assembler autour d'un double brin d'ADN briser 12-14. Bien que leur fonction ne soit pas connu, ils représentent le site dans le noyau qui contient le double rupture de brin d'ADN et est le site de l'ADN double brin réparation des cassures.
Réparation de l'ADN foci (DRF) ont été caractérisés par microscopie à fluorescence et ils servir de biomarqueurs pour dommages à l'ADN 12,15. Ils sont énormes par rapport à la taille de la cassure double brin et ont été considérés comme relativement homogène jusqu'à ce que des études récentes de microscopie de super-résolution ont révélé des preuves de sous-cloisonnement des molécules au sein de chaque concentrent 16. Afin de comprendre comment ces sites sont organisées, il est nécessaire de visualiser toutes les structures biologiques sous-jacents rapport à l'autre. Cela ne peut être obtenu par microscopie à fluorescence, mais est possible grâce à la microscopie électronique 17,18. Ici, on décrit un procédé qui combine électronique imagerie spectroscopique avec la méthode miniSOG pour illustrer le potentiel de cette approche combinée pour explorer l'ultrastructure de double brin de réparation des cassures de l'ADN.
Protocole
1. Génération de miniSOG lignées cellulaires
- Cultiver U2OS (de l'ostéosarcome humain) des cellules dans une boîte de 35 mm contenant 2 ml de bas glucose milieu d'Eagle modifié par Dulbecco (DMEM), qui est complété avec 10% de sérum bovin fœtal (FBS) à 37 ° C dans un incubateur humidifié avec 5% de CO 2 atmosphère.
- Transfecter les cellules quand elles sont confluentes à 80% par lipofection avec la qualité de transfection purifié (A269 / rapport 280 de 1,8 à 2,0) des constructions plasmidiques contenant des séquences pour miniSOG et mCherry étiquetés protéines de réparation selon le protocole du fabricant du réactif de transfection 19. Les plasmides d'expression miniSOG peuvent être commandés à partir du Tsien-Lab: http://www.tsienlab.ucsd.edu/Samples.htm
- Trier les cellules exprimant la protéine recombinante avec la balise miniSOG et mCherry par fluorescence tri cellulaire activé deux jours après la transfection. Recueillir des cellulesavec l'intensité de fluorescence intermédiaire afin d'éviter que les cellules sont 20 surexpriment.
- Culture des cellules positives sur une boîte de 10 cm dans 10 ml de milieu DMEM qui est complété avec 10% de FBS et 0,6 ug / ml de l'agent de sélection G418 (généticine).
- Après colonies visibles ont émergé sur les plaques, écran de colonies positives mCherry aide d'un microscope inversé à fluorescence et de dessiner des cercles autour d'eux (sur le fond de la plaque) avec un marqueur permanent. Utilisez un objectif à faible grossissement de l'air (par exemple, 10x) et ramasser clones en utilisant une technique stérile en grattant soigneusement les colonies hors et lentement les aspirant dans une pipette de 1000 pi stérile.
- Développez les colonies sélectionnées et de geler les parties de bas en utilisant le milieu de croissance décrit dans l'étape 1.1 complété avec 10% diméthylsulfoxyde. Testez les cellules pour la formation DRF en les cultivant sur stériles 18 x 18 mm 2 lamelles et en les exposant à2 Gy de rayonnement. Les cellules irradiées exprimant de façon stable un miniSOG mCherry étiquetés protéines de réparation doit montrer le motif caractéristique typique focal CDB quand visualisée avec un microscope à fluorescence en utilisant un filtre-set pour l'imagerie mCherry.
2. Culture cellulaire
- U2OS cellules de culture exprimant de manière stable le miniSOG et mCherry protéines marquées de réparation dans les conditions décrites dans l'étape 1.1. Cultiver les cellules à 80% de confluence dans une boîte à fond de verre de 35 mm de diamètre contenant 2 ml de DMEM. Assurez-vous que la colle qui attache la lamelle à la matière plastique et le plastique utilisé est résistant aux solutions aqueuses et alcoolisées et résistant à la résine utilisée!
- Avant de procéder à l'expérience, définir un petit espace d'environ 1 mm 2 qui contient des cellules exprimant les protéines ectopiques par grattage avec un stylo à diamant stérile en utilisant un microscope à fluorescence pour déterminer la région d'intérêt. Vous pouvez également utiliser un plat de fond de verre tchapeau contient une lamelle couvre-objet avec un système de grille pré-gravé intégré dans la lamelle.
NOTE: Si vous utilisez de haute qualité combinant microscopie corrélative ESI et la fluorescence images microscopiques 21, assurez-vous que l'épaisseur de la lamelle est compatible avec les objectifs d'immersion d'huile. Il devrait avoir l'épaisseur n ° 1.5 (0,16 à 0,18 mm). Choisissez une zone à proximité du centre du plat de la région à être examinée dans le TEM afin d'éviter les problèmes de polymérisation de la résine qui peut se produire à proximité des bords (voir point 04.10 à 04.13).
Dommages induction 3. d'ADN
- Irradier les cellules avec des rayons gamma, en utilisant un médicament radiomimétique ou provoquer des dommages par irradiation micro laser sur un microscope confocal (par exemple, comme décrit dans 18,22 ou 23).
- Dans cet exemple, les cellules à irradier 2 et 6 Gy de rayonnement gamma dans une source de césium-137 ou le rayonnement laser à l'aide du sol microirradiate 405 nmIdentifiant du laser à l'état d'un microscope confocal après la sensibilisation des cellules pendant 20 minutes avec 0,5 ug / ml de Hoechst.
Préparation de l'échantillon 4.
- Fixer les cellules avec 1 ml de paraformaldéhyde 4% prudence dans tampon cacodylate de sodium 0,1 M ou en tampon phosphate 0,1 M pH 7,4 pendant 30 min à température ambiante dans l'obscurité.
ATTENTION: Paraformaldéhyde et cacodylate de sodium sont toxiques! Porter des gants et d'en disposer adéquatement les substances toxiques. - Laver les cellules deux fois avec 4 ml de tampon cacodylate de sodium 0,1 M pH 7,4 ou du tampon phosphate pH 7,4.
- Traiter les cellules fixées avec 2 ml de glycine 50 mM, 5 mM aminotriazole et 10 mM de cyanure de potassium ATTENTION en sodium 0,1 M tampon cacodylate ou 0,1 M de tampon phosphate (pH 7,4) (vérifier le pH!) Pendant 30 minutes afin de bloquer n'a pas réagi groupes aldéhyde et de supprimer les espèces réactives de l'oxygène générés par des groupes hème, ce qui peut augmenter l'arrière-plan.
ATTENTION: le cyanure de potassium est extrêmement toxique! WGants de l'oreille, travailler sous une hotte et évacuer adéquatement les substances toxiques. La réaction est très sensible au pH, il est important que le pH contrôlée et précise. - Notez la zone qui a été sélectionné à l'étape 2.2 en 2D ou en 3D sur un microscope inversé à fluorescence, si microscopie corrélative est souhaitée.
- Préparer un / ml de solution de chlorhydrate de diaminobenzidine ATTENTION 1 mg en plaçant un comprimé de chlorhydrate de diaminobenzidine 10 mg dans un tube de 2 ml à centrifuger. Ajouter 980 pi de H 2 O distillée et 20 ul d'acide chlorhydrique concentré (11,65 m) et mélanger jusqu'à ce que la solution est brun clair et translucide. Diluer cette solution dans 0,1 M de phosphate ou un tampon cacodylate de sodium 0,1 M à une concentration finale de 1 mg / ml alors que l'ajustement du pH avec de l'hydroxyde de sodium à un pH compris entre 7,0 et 7,6 (pH 7,4 est recommandée).
ATTENTION: Diaminobenzidine est toxique! Porter des gants et d'en disposer adéquatement les substances toxiques. - Pour la photo-oxydation, replace le tampon avec 2 ml d'une solution de chlorhydrate ml 1 mg / diaminobenzidine dans 0,1 M de tampon cacodylate de sodium ou un tampon phosphate. Protéger cette solution de la lumière et laisser refroidir sur de la glace à 4 ° C afin d'augmenter la solubilité de l'oxygène. Saturer la solution avec de l'oxygène par barbotage d'oxygène à travers la solution (en utilisant un tuyau flexible qui est inséré dans la solution et reliée à une bouteille d'oxygène). Vérifier le pH et ajustez si nécessaire.
NOTE: Il est essentiel que la réaction de photo-oxydation que le pH est compris entre pH 7,0 et pH 7,6. - Monter le plat avec les cellules fixées avec précaution sur un microscope inversé à fluorescence équipé d'un objectif 40x à immersion d'huile et le déplacer vers la zone d'intérêt. Exciter le tag miniSOG avec la lumière bleue en utilisant des cubes de filtre pour la GFP ou PCP. MiniSOG a un maximum d'excitation à 448 nm avec un épaulement à 473 nm 10.
- Continuer avec l'illumination même après le vert miniSOG fluorescence has complètement disparu et que le produit de photo-oxydation brune de la diaminobenzidine polymérisé émerge dans le canal de lumière transmise. Lorsque le produit d'oxydation est visible dans la plupart des cellules, désactiver l'éclairage de fluorescence pour arrêter la photo-oxydation.
REMARQUE: Photo-oxydation peut prendre plusieurs minutes en fonction de l'objectif, des longueurs d'onde de transmission de filtre et l'efficacité, et la source d'éclairage. - Postfix les cellules avec 1 ml de glutaraldéhyde à 2% dans du cacodylate de sodium 0,1 M pH 7,4 tampon phosphate ou un tampon pH 7,4 pendant 30 min.
- Fixer les membranes des cellules avec 0,1% -0,5% de tétroxyde d'osmium pendant 20 minutes dans du tampon cacodylate de sodium 0,1 M pH 7,4 ou dans du tampon phosphate 0,1 M pH 7,4.
NOTE: Il est recommandé d'utiliser la concentration la plus basse possible de tétroxyde d'osmium nécessaire pour stabiliser les membranes. Étant donné que les précipités DAB polymérisés ont une densité élevée de l'azote, qui peut être détectée directement par ESI, une forteosmium coloration est pas nécessaire d'identifier la protéine miniSOG-marqués et pourrait être préjudiciable à l'ESI. Tétroxyde d'osmium est très toxique! Travailler dans une hotte et d'en disposer de façon adéquate les déchets toxiques. - Déshydrater, les cellules à travers une série d'éthanol à l'aide de 30%, 50%, 70%, 90%, 98% à 100% des étapes de l'éthanol (5 min chacun). Par la suite, incuber les cellules dans un mélange 1: 1 d'éthanol à 100% et de résine acrylique (LR Blanc) et mettre le plat sur un shaker pendant 4 heures pour faciliter l'infiltration dans les cellules avant incubation des cellules pendant au moins un autre 4 heures dans 100 résine acrylique% (LR Blanc).
- Afin de polymériser la résine, couper le couvercle 2 ml d'un tube de microcentrifugation marquée avec une lame de rasoir et la couche jante avec accélérateur de résine acrylique. Assurez-vous que l'accélérateur ne couvre que la jante et ne coule pas dans le tube. Par la suite, remplissez soigneusement le tube environ les deux tiers avec de la résine LR Blanc aide d'une pipette Pasteur. Veillez à ce que la résine ne soit pas en contact l'esprith l'accélérateur sur la jante!
- Retirer la résine qui a infiltré les cellules dans le plat et placer le plat à l'envers sur le tube vertical microcentrifuge permanente afin que la largeur du tube remplit presque entièrement la fenêtre de la boîte d'observation de verre recouverte.
- Attendre 1 à 2 minutes pour l'accélérateur pour sceller le tube et la lamelle couvre-objet, puis inverser le tube de sorte que la résine dans le tube couvre maintenant les cellules.
- Placer le plat avec le tube dans un four à 60 ° C et le guérir pendant 12 heures.
- Lorsque le bloc est guéri, retirez le plat avec le tube à centrifuger de résine rempli joint du four et séparer le tube de microcentrifugation de l'antenne. Faciliter la séparation par les cycles de gel-dégel dans l'azote liquide et de l'eau chaude.
- Jeter le plat à fond de verre et soigneusement ouvrir le tube à centrifuger avec une lame de rasoir afin d'éliminer le bloc.
- Marquez le bloc avec un marqueur permanent.
- Utiliser une lame de rasoir à trim le bloc de sorte que rien d'autre que la région de 1 mm 2 qui contient la zone préalablement marqué avec le stylet de diamant ou de tungstène (ou la zone contient des cellules d'intérêt) demeure.
- Monter le bloc dans un ultramicrotome, couper le bloc avec un couteau de rognage et couper des sections ultra-minces d'environ 50 nm à l'aide d'un couteau de diamant.
- Ramassez les sections sur une transmission élevée de 300 grilles de maille. Ces grilles ont de très petits barreaux de grille et portent donc moins de cellules dans la zone d'intérêt.
- Enduire les sections sur les grilles avec environ 0,2-0,4 nm du carbone à l'aide d'une coucheuse de carbone pour aider à stabiliser les sous le faisceau d'électrons du TEM.
5. Electron Microscopy
- Charger les grilles dans un TEM qui est équipé d'un filtre d'énergie. Après mise au point du microscope et le filtre d'énergie selon les instructions du fabricant, inspecter les cellules sur les articles dans le mode de grossissement faible (transmission normale) et comparerleur fluorescence données le cas échéant (obtenu à l'étape 4.4).
- Une fois un noyau avec des caractéristiques intéressantes (dommages à l'ADN de la piste ou de réparation de l'ADN foyers) est trouvé, passez en mode de filtrage d'énergie et d'enregistrer une carte d'épaisseur.
Remarque: Cette procédure comprend l'enregistrement d'un-zéro perte et une image non filtrée. Épaisseurs allant jusqu'à 0,3 libre parcours moyen (30% des électrons du faisceau incident se diffusée par l'échantillon) sont suffisamment minces pour générer de bonnes cartes élémentaires. - Rapport de la fiche de carte de l'azote et du phosphore des éléments en utilisant le logiciel qui commande le filtre d'énergie du microscope utilisé. Enregistrez la carte de phosphore après pointe images à 175 eV perte d'énergie avec une largeur de fente de 20 eV et pré-gardistes images à 120 eV perte d'énergie, également avec une largeur de fente de 20 eV. Pour les cartes d'azote, d'enregistrer des images après de pointe à 447 eV avec une largeur de fente de 35 eV et pré-garde des images à 358 eV, également avec une largeur de fente de 35 eV.
NOTE: Comme le contenu des éléments imagés (phosphOrus et d'azote) est relativement faible (env. 1%), choisissez "Rapport d'image" (carte élémentaire qualitative) sur la «méthode 3 de fenêtre" (quantifier carte élémentaire) dans le but de générer des images avec un meilleur rapport signal sur bruit.
6. Traitement de l'image
- Ouvrez les cartes de rapport élémentaires dans un logiciel de traitement d'image qui peut gérer le format de fichier des images acquises (par exemple, Microscopie numérique). Copiez la carte de l'azote dans le canal rouge et le plan de phosphore dans le canal vert d'une image RVB, puis superposer et aligner les cartes.
- Exporter l'image composite comme un format de fichier d'image étiqueté (TIFF) fichier. Ouvrez l'image dans un logiciel de traitement d'image qui peut utiliser des couches (par exemple, Photoshop).
- Ajustez la plage dynamique de chaque canal en rééchelonnant le minimum et maximum dans l'image à un ensemble de données de 8 bits (0 à 255).
- Soustraire la teneur en phosphore à partir de la carte d'azote (en utilisant leFenêtre "Layers") afin de générer une carte qualitative qui montre la répartition des protéines.
- Convertir les cartes de l'acide nucléique (phosphore) et la protéine (azote) créé à l'étape précédente en «couleurs indexées" et de créer une table de consultation jaune dans l'espace de couleur CMYK pour voir la carte montrant la répartition de l'acide nucléique et une table cyan de recherche montrer la carte non-nucléoprotéine. Les couleurs sont choisies pour produire un contraste maximal entre les deux cartes élémentaires.
- Créer une nouvelle image et d'importer les cartes montrant les distributions de phosphore et de protéines que les différentes couches. Utilisez le mode de la transparence "de l'écran" afin de voir les deux couches superposées les unes aux autres.
- Ouvrez l'image sans perte acquise dans l'étape 5.2. Cette image représente une image de la zone enregistrée qui ressemble à une image TEM classique, mais ne contient que les électrons qui ont traversé l'échantillon sans entrer en collision avec le spécimen. Exportcette image comme une image TIFF.
- Ouvrez l'image exportée de zéro perte dans un éditeur de photo et copiez-le dans la couche supérieure de l'image montrant la carte élémentaire. Alignez l'image en utilisant le mode de la transparence "de l'écran".
- Facultativement, le seuil de l'image sans perte de segmenter le signal qui provient de la miniSOG. Ajouter l'image résultante comme une couche séparée comme décrit ci-dessus.
Résultats
ESI
En comparant les images du noyau ESI (figure 1) avec les images de TEM classiques (par exemple, la figure 1.7) révèle une augmentation spectaculaire des structures anatomiques qui peuvent être facilement distingués. Les crêtes de la chromatine apparaissent en jaune et il est assez facile d'identifier les chromocentres dans les cellules de souris. Nucléoles peut être facilement distinguée de la chromatine par leur structure et autour de couleur différente, étant donné que les ribosomes pré-assemblés contiennent déjà de grandes quantités de protéine, qui est riche en azote, en plus de l'ARN, qui est riche en phosphore. La chromatine périphérique réside en une couche mince sur la frontière du noyau et les pores nucléaires peut être considéré comme des structures riches en azote qui interrompent la chromatine périphérique. Souvent, la lame peut être considérée comme une couche très mince bleu à l'extérieur de la chromatine périphérique. Dans le cytoplasme, de nombreuses petites particules riches en phosphore peutêtre vu. Ceux-ci peuvent être identifiés comme des ribosomes fonction de leur taille, l'abondance et l'emplacement extérieur du noyau. L'espace de interchromatiniens peut être considérée comme la région riche en protéines située entre la chromatine. Celui-ci contient les corps nucléaires et des zones riches en petits signaux jaunes, telles que des particules de ribonucléoprotéine et amas de granules de ribonucléoprotéines (figure 2). Ces derniers sont appelés grappes interchromatiniens granulaires et sont typiquement enrichie en protéines nécessaires pour l'épissage de pré-ARNm. Figure 1B, C et D illustrent l'apparition d'autres structures connues comme chromosomes mitotiques, les mitochondries, les centrosomes et les centromères. Sur la figure 2, les étapes utilisées pour produire des images composites de couleur de l'une des cartes de rapport élémentaire premières sont résumées. Fusion de la carte de phosphore (vert) et la carte d'azote (rouge) dans l'espace de couleur RVB (rangée supérieure) permet une meilleure évaluation des quantités de ces éléments dans l'échantillon. However, en soustrayant le signal de phosphore à épuiser la contribution des structures contenant des acides nucléiques à partir de la carte d'azote pour obtenir la carte de protéines (cyan) et fusionnant avec la carte de phosphore (jaune) en CMJN espace de couleur fournit une représentation visuelle plus distincte de la nucléoprotéine et non nucléoprotéine (rangée du bas). Cela permet aux données d'être interprétées plus facilement par des personnes non familiarisées avec la technologie.
Laser cellules exprimant microirradiated MDC1, 53BP1 et Rad52
En raison de la taille définie par l'utilisateur, la forme et l'emplacement des dommages laser pistes, la région de dépôt DAB dans les cellules laser microirradiated sont très faciles à trouver dans le TEM lors de l'utilisation du système miniSOG. Les photos prises en mode de transmission de faible grossissement (c.-à-TEM fond clair conventionnel) révèlent les dommages caractéristiques pistes et peuvent être comparées aux données qui a été enregistrée avec un microscope à fluorescence avant l'enrobage.Ceci est particulièrement utile si microscopie corrélative est destiné, car il permet l'identification et la relocalisation des noyaux simples facile. (Figure 2-4).
Le premier exemple (Figure 3) montre une lignée de cellules exprimant de manière stable MDC1 U2OS miniSOG-mCherry. Dans une expérience de microirradiation laser, le recrutement du MDC1 contenant les balises miniSOG et mChrerry était très semblable aux versions GFP étiqueté de cette protéine (données non présentées). Fixant les cellules 1 h après l'endommagement de l'ADN induction et la préparation de l'échantillon pour la MET, les dommages MDC1 pistes ont été facilement identifiés dans les ultra-fines sections en mode TEM normale que des rayures foncées sur les noyaux, ce qui correspond très bien aux données de fluorescence ( Figure 3-5). Lorsque l'on regarde la répartition de la protéine, une nette augmentation de signal de l'azote peut être observée sur les sites de laser endommagé. Il doit être souligné ici que cela est principalement causée par le DiAmi polymérisé nobenzidine, qui est riche en azote et amplifie le signal de la protéine marquée miniSOG de réparation, plutôt que par la seule accumulation de protéines de réparation de la piste de dommages. En comparant la structure de la chromatine dans le reste du noyau avec la structure dans les dommages pistes montre une nette différence. La chromatine endommagé (qui est représenté à l'intérieur les lignes en pointillés sur la figure 3) apparaît plus décondensée en contraste avec la chromatine non irradiées, ce qui se produit dans des nervures épaisses dans le nucléoplasme. Dans les dommages pistes, corps nucléaires (200-300 nm) (mis en évidence par des flèches dans la figure 3 II2, IIb, IIc et IIIa) qui sont riches en protéines MDC1-miniSOG mais libre à partir d'acide nucléique peuvent également être observés. Il serait très difficile de définir ces corps nucléaires que les structures gratuitement chromatine sans cette technique. Il suggère également un niveau supplémentaire de complexité aux sites de dommages qui ne sont pas prédites par la biochimie connu de MDC1.
MÉNAGEMENT "> En regardant les dommages pistes de 53BP1 (Figure 4) qui ont été créés en utilisant les mêmes conditions que les dégâts décrit précédemment dans les cellules MDC1 transfectées, des résultats très similaires peuvent être observées. Le signal qui a été produit par la photo-oxydation de l'miniSOG était bondé et rempli l'espace entre les plis de la chromatine. corps nucléaires très sale pourraient également être observés (mis en évidence par une flèche dans la figure 4 D, E, F).A partir d'expériences avec des constructions Rad52-GFP, il est connu que Rad52 se former de petites 24 microcompartements lumineuses le long d'une piste dommages induits par laser. En raison de la limite de résolution des microscopes optiques conventionnels, il a été difficile de savoir comment grand ces structures sont vraiment et comment ils se rapportent à l'ADN endommagé. En regardant l'image de TEM de noyaux de U2OS irradiées par laser exprimant constitutivement Rad52-miniSOG-mCherry, la taille de ces organismes ont été mesurés pour être en moyenne (150-250 nm). c'estencore plus surprenant de regarder ces foyers avec ESI. Contrairement aux exemples précédents, les foyers Rad52-miniSOG-mCherry semblent être organisée très différemment le long de la piste de dommages et semblent être les structures du corps comme nucléaires compacts qui sont constitués de protéines et avoir aucun acides nucléiques détectables dans leur intérieur. Basé sur la recherche à la relation / protéine acide nucléique dans les zones endommagées obtenus avec notre approche combinée miniSOG et ESI, nous suggérons que la réparation de l'ADN peut avoir lieu à la surface des foyers plutôt que dans l'intérieur.
L'image du bas de la figure 5 montre des résultats similaires à la figure 3-III. La chromatine dans la zone endommagée semble être plus décondensée par rapport à la chromatine dans les zones non irradiées (voir zone délimitée par des tirets rouges).
Gamma cellules irradiées
Bien laser micro-irradiation est un outil pratique pour quicklprotéines tests y contenant un marqueur fluorescent pour le recrutement aux sites de lésions de l'ADN, il crée de grandes quantités de dommages complexe (cassures double brin, ruptures de brins simples, dégâts de base, et les dimères de cyclopyrimidine) 25. Afin d'étudier les compartiments qui se forment autour ADN cassures double brin plus directement, nous avons examiné DRFs qui se forment autour CDB individuels en exposant les cellules à une irradiation gamma.
U2OS cellules qui expriment de façon stable 53BP1-miniSOG-mCherry ont été exposés à 2 Gy d'irradiation gamma et fixées une demi-heure après l'irradiation. Le motif caractéristique des grands foyers répartis dans le nucléoplasme pu être observée (Figure 6IA). Après la photo-oxydation de diaminobenzidine, taches sombres émergents dans les positions où les signaux de mCherry fluorescentes ont été situés dans des micrographies de fluorescence peuvent être vu dans les photographies au microscope électronique (Figure 6iB et c). Ces taches peuvent être corrélées à des images TEMqui ont été prises à faible grossissement (Figure 6Id et e). Les images ESI de ces foyers, qui semblaient être environ 1-1,5 m de diamètre, ont montré une structure intéressante. Brins minces de chromatine semblaient être entrecoupées de protéine 53BP1 d'environ deux fois l'épaisseur.
Dans d'autres expériences, les cellules ont été exposées à une plus grande quantité de rayonnement et fixés à des points de temps plus tard (après 3 h et 6 h, respectivement) afin de générer de plus grands foyers et faciliter les localiser dans les sections ultra-minces (figure 7). Parce que nous sommes en mesure de cartographier séparément nucléoprotéine et de protéines, ESI révèle que la structure des foyers apparaissent à réorganiser au fil du temps. La quantité relative de protéine 53BP1 dans le foyer semble augmenter alors que la chromatine prend une position plus périphérique.
Depuis 53BP1 foyers apparaissent également dans les cellules que "foyers cryptique" dans les cellules de G1 sur les sites de sous-répliquée non irradiésADN d 26,27, ces foyers ont également été imagée. Ces foyers cryptiques semblent abriter des quantités élevées de protéine par rapport au rayonnement foyers induite et montrent une structure régulière intéressant de la chromatine.
Ainsi, la visualisation de foyers constituants réparation de l'ADN en utilisant la méthode miniSOG permet d'identifier les régions de lésions de l'ADN et pour cartographier la distribution de la protéine de réparation marqué par rapport à la chromatine.

Figure 1. Vue d'ensemble des structures qui peuvent être observés dans une image ESI S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
(A) de l'image d'un ESI fibroblastes embryonnaires de souris. Crêtes de la chromatine (de jaune) sont entourés par nucléoplasme (cyan) en remplissant le interchromatiniens space. Le noyau est entouré par hétérochromatine périphérique et chromocentres (en bas à gauche) qui sont interrompu par complexes des pores nucléaires (cyan). Le nucléoles peut être clairement séparé par leur couleur. Cela est dû au fait que la quantité de protéine par rapport à l'acide nucléique est plus élevé dans la structure nucléolaire qu'elle ne l'est dans la chromatine. En dehors du noyau, les mitochondries et les ribosomes (riches en acide nucléique) peuvent être facilement identifiés.
(B) l'image d'un noyau et les centrosomes (voir les flèches), qui peut être considérée comme des particules riches en protéines creuses dans le coin supérieur gauche de l'image.
Section (C) de la Croix à travers une plaque équatoriale. Les chromosomes métaphasiques hautement condensés ont aligné à un disque qui va du coin supérieur gauche vers le coin inférieur gauche. Des concentrations élevées d'azote peuvent être consultées à la surface de certains chromosomes. Ces zones sont les kinétochores (voir les flèches).
D: Pièces de mitochondries (voir les flèches supérieures) dans le cytoplasme entouré par les ribosomes (petites taches jaunes - voir flèches inférieures). La membrane interne de la mitochondrie avec son invaginations typiques (crêtes) est visible.

Figure 2. Création d'un multi-couleur image ESI
(Rangée supérieure) Les deux premiers de photos dans la ligne indiquent le rapport cartes de phosphore et d'azote. La dernière image dans la rangée supérieure montre ces cartes élémentaires superposées dans l'espace de couleur RVB. Structures jaunes représentent nucléoprotéines, reflétant la présence de phosphore et de l'azote.
(Rangée inférieure) La première image montre la carte de phosphore, qui révèle principalement la distribution de l'acide nucléique dans l'échantillon. L'image du milieu montre la distribution de l'acide nucléique appauvri / stru négative mages. Il a été calculée en soustrayant de la carte de phosphore à partir de la carte d'azote. L'image en bas à droite montre une fusion de la carte d'acide nucléique et la carte de protéine dans l'espace de couleur soustractif. Ce composite de couleur devrait être utilisée pour aider à l'identification des structures individuelles et de les classer comme nucléoprotéine ou non nucléoprotéine. Les informations quantitatives sur le phosphore et l'azote abondance devraient être recueillies visuellement du phosphore et de l'azote nette nette cartes en niveaux de gris ou de composites générées par l'utilisation des couleurs additives, comme dans la rangée du haut.

Figure 3. Laser micro irradiation des cellules exprimant de façon stable MDC1 U2OS-miniSOG-mCherry. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
(II) La zone, mis en évidence par un carré vert dans Ic a été agrandie et affichée en mode de transmission normal (IIa) et ESI (IIb). IIc montre une superposition de l'image ESI avec le signal de la voie de dommages. Le signal de dommages piste a été obtenu par seuillage l'image supérieure.
(III) Des exemples de la structure de micro laserchromatine -irradiated chromatine et hors de la zone endommagée par laser.
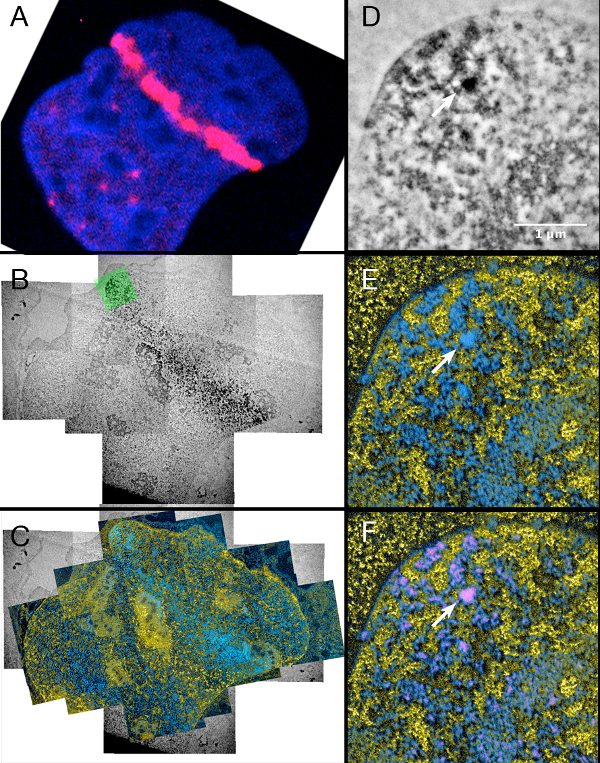
Figure 4. Laser micro irradiation des cellules exprimant de façon stable 53BP1-miniSOG-mCherry. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Colonne de gauche: (A) de fluorescence, (B) conventionnel TEM et (C) l'image ESI des mêmes micro laser noyau irradiés.
Colonne de droite: (D) conventionnel TEM, (E) et ESI (F) superposition de l'image ESI avec le signal miniSOG qui a été segmenté par seuillage (D) (voir l'étape 6.10)

Figure lignée cellulaire 5. U2OS exprimant de façon stable Rad52-miniSOG-mCherry et endommagé par laser micro-irradiation. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
(A) en superposition d'une image de fluorescence avec une image de TEM à faible grossissement montrant un laser microirradiated U2OS noyau avec une piste de dommages en bas à gauche.
(B) image de microscopie confocale de fluorescence représentant d'un micro laser irradié noyau Hoechst teinté (bleu) exprimant Rad52-miniSOG-mCherry montrant le motif caractéristique de petits foyers le long de la piste dégâts (feu rouge).
(C) conventionnel TEM, (D) ESI, (E) carte de phosphore, (F) ESI et le signal segmenté de (C) Fort grossissement du noyau indiqué dans le coin supérieur gauche.
L'image (G) ESI d'un autre noyau U2OS exprimant de façon stable Rad52-miniSOG-mCherry montrant une piste dommages induite par laser dans le contexte de l'ensemble du noyau.

Figure 6. cellules exprimant de façon stable 53BP1 U2OS-miniSOG-mCherry irradiées avec 2 Gy et fixés après 30 minutes. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
(I) a) image de fluorescence montrant les foyers de 53BP1 irradiation gamma-induite. b) Transmis image lumineuse après photopolymérisation. c) Overlay de la fluorescence avec l'image la lumière transmise. d) l'image faible grossissement de TEM (la bande noire est une barre de grille de TEM). e) Superposition de l'image fluorescente avec l'image faible grossissement de TEM.
Mise au point (II) de dommages marqué d'un astérisque dans l'image enregistrée dans la lumière transmise TEM normal et en mode ESI. a) sans perte, b) ESI, c) phosphore, d) la protéine E) Overlay ESI et le signal segmenté de l'image sans perte.
Mise au point (III) de dommages marqué d'une croix dans l'image de fluorescence enregistrée dans TEM normal et en mode ESI. a) sans perte, b) ESI, c) phosphore, d) la protéine E) Overlay ESI et le signal segmenté de l'image sans perte.
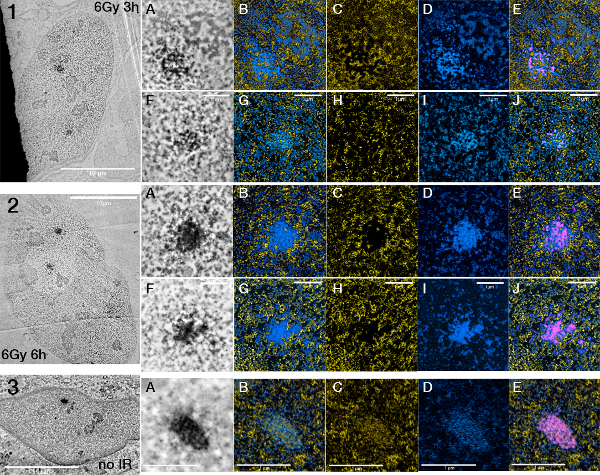
Figure 7. Changements dans la structure des foyers entre foyers après différents temps d'irradiation. < / strong> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Cellules U2OS 53BP1 miniSOG mCherry exposés à 6 Gy d'irradiation gamma fixe après 3h (1A-E, FJ) et 6h (2A-E, FJ) respectivement. La figure 3 montre un noyau U2OS 53BP1 miniSOG mCherry irradiés montrant un accent cryptique (AE). ESI images sont présentées dans l'ordre ESI (d'acide nucléique et de la protéine), l'acide nucléique (seul), la protéine (seul), ESI (acides nucléiques et protéines) + signal de miniSOG segmentés.

Figure 8. foyers réparation de l'ADN sont encore visibles dans le mode de transmission classique quand après fixation avec le tétroxyde d'osmium est omis. arge.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Section ultramince (50 nm) d'un noyau de U2OS montrant deux foyers de 53BP1 à partir d'un échantillon qui n'a pas été traité avec du tétroxyde d'osmium. (A) en mode TEM classique, il est possible de voir les sites colorées par le polymère DAB même sans augmenter le contraste avec le lourde tache de métal. (B) Le contraste des foyers peut encore être améliorée en prenant des images sans perte (filtrage de distance tous les électrons que l'origine des événements de diffusion au pluriel).
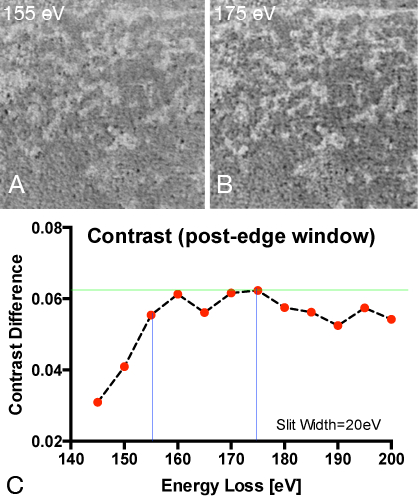
Figure 9. Détermination des paramètres de la fenêtre optimale de l'énergie pour le phosphore de cartographie
(A) la carte de rapport élémentaire enregistrée pour le phosphore avec Postes bord à 155 eV et pré-bord à 120 eV.
contenu "> (B) Ratio élémentaire carte enregistrée pour le phosphore avec Postes bord à 175 eV et pré-bord à 120 eV.(C) Calcul de cartes de rapport de phosphore à partir d'une fenêtre de pré-bord constant à 120 eV perte d'énergie et une fenêtre post-bord variables allant de 140-200eV perte d'énergie afin de déterminer la combinaison qui convient le mieux à la différence. La différence d'intensité de la plus brillants et les dimmestpixel dans une ligne de balayage couvrant plus de la même phosphore pauvres riches et de phosphore région montre plus hautes valeurs de contraste (dynamique) quand une image post-bord de 175 eV perte d'énergie a été choisi.
Discussion
ESI peut servir comme un excellent outil pour examiner les différents états de la chromatine et ribonucléoprotéines dans le noyau, car il est capable de cartographier précisément les zones qui sont riches en phosphore. Il augmente profondément la quantité de détails qui peut être obtenue par un microscope électronique et ne dépend pas de méthodes non spécifiques contrastées. Un inconvénient de ESI est qu'il nécessite des sections plus minces que TEM conventionnelle à la même tension d'accélération. Ceci peut être surmonté en travaillant avec des coupes en série ou en utilisant des procédés tomographiques 28.
Bien que beaucoup d'informations peuvent être obtenues en examinant les distributions de phosphore et de l'azote, il est intéressant de pouvoir cartographier également la distribution de certaines protéines. Avec le procédé présenté dans le présent document, il a été démontré que ESI pourrait être combiné avec des procédés qui sont basés sur la polymérisation spécifique de site de la diaminobenzidine. Bien que cette méthode ne pas ajouter un full nouvelle couleur à ESI, il est clairement utile pour cartographier la distribution d'une protéine. Cela vaut en particulier pour les protéines qui interagissent avec la chromatine. Si une étude a besoin de visualiser plus d'une population de protéines, les méthodes de repérage à l'aide immunogold peuvent encore être utilisés lorsqu'il est appliqué comme coloration pré-enrobage, avant la photo-oxydation 9. Par rapport à des lignées cellulaires stables, transfections transitoires ont l'inconvénient que les niveaux d'expression peuvent varier considérablement entre les cellules et donc faire du mal à trouver de multiples cellules exprimant des quantités similaires de la protéine marquée. Par conséquent, la création de lignées cellulaires stables est recommandée. Cependant, il est possible de juger de la quantité relative d'expression de la protéine en utilisant l'imagerie de fluorescence et sélectionner des cellules présentant une expression intermédiaire suivants transfection transitoire.
Bien que la fusion tag miniSOG est lui-même fluorescent, son rendement quantique est bien pire que la GFP (0,37 contre 0,6) 10. Pour le purpOSE de microscopie corrélative, l'ajout d'une étiquette de protéine fluorescente supplémentaires comme mCherry permet l'imagerie dans les cellules vivantes sans la production d'oxygène singulet qui se produit avec miniSOG excitation. Le niveau des protéines composées miniSOG-expression, la quantité d'oxygène dans le tampon contenant du DAB, et le pH peut également affecter la vitesse de photo-oxydation. Parfois, il peut être assez difficile à réaliser homogène photo-oxydation dans la région d'intérêt en raison de la dépendance à la lumière de la réaction de photo-oxydation. Prolongée photo-oxydation peut conduire à une coloration non spécifique et le dépôt de trop de métaux lourds dans l'échantillon, ce qui peut compliquer la détection de signaux spécifiques de l'élément par ESI. Le procédé de photo-oxydation est assez de temps de sorte que généralement seule une très petite région contenant quelques cellules sur la lamelle couvre-objet sont normalement souillé.
Nous avons montré la combinaison de miniSOG protéines marquées avec ESI utilisant une monocouche d'un adhérent huhomme lignée cellulaire de cancer. En principe, la méthode peut également être appliquée à tout autre échantillon (levures, de bactéries, de tissus, d'embryons) dans la mesure où il est possible d'exprimer la protéine miniSOG-marqué à des taux raisonnables et aussi longtemps translucidité et la diffusion de l'oxygène et DAB est suffisamment élevée pour permettre la photo-oxydation et la coloration appropriée ainsi homogène. Pour les cellules en suspension, il serait avantageux de fixer l'emplacement de cellules sur une lamelle couvre-objet en utilisant un adhésif tel que le poly-L-lysine. Pour des échantillons plus épais, les objectifs avec une ouverture numérique inférieure vont atteindre un éclairage plus homogène, mais prendre plus de temps à la photo-oxyder.
Nous avons présenté l'utilisation de la fusion miniSOG-protéines marquées au plus près du protocole original publié par Shu et al 10 que possible -. Y compris l'utilisation de tétroxyde d'osmium. Il ne pouvait être observé que, outre le dépôt préférentiellement sur DAB-polymères et des membranes, le tétroxyde d'osmium et montre une certaine réactivitédépôt sur la majeure partie de la matière biologique dans l'échantillon (10 figure 3). Tétroxyde d'osmium a un avantage élémentaire à 45 eV. Ce signal et ses plasmons peuvent être superposées sur le spectre de perte d'énergie d'électrons à l'épaisseur de l'échantillon augmente et les électrons célibataires subir de multiples événements de perte d'énergie lors du passage dans l'échantillon. Cela peut limiter la qualité des cartes élémentaires de phosphore si élevés OsO 4 concentrations sont utilisés dans la préparation des échantillons. Les concentrations que nous avons utilisées ici, qui sont significativement plus faible que ce qui a été utilisé précédemment 10, ont permis à la génération de bonnes cartes de phosphore de qualité. Dans une expérience utilisant miniSOG protéines marquées que des exigences plus élevées OsO 4 concentrations, la meilleure concentration qui permet encore bon phosphore création de la carte devra être déterminée de manière empirique.
Nous avons trouvé que le polymère qui se forme à la DAB foyers de réparation d'ADN est sufficiently dense pour être vu en mode TEM conventionnelle (ou en mode sans perte, même avec un meilleur contraste) même lorsque post-fixation avec le tétroxyde d'osmium est omis (voir figure 8). La segmentation des signaux qui ont été enregistrées de cette façon est aussi robuste que celle utilisant les échantillons ont été traités avec de l'osmium. En fonction de la protéine nucléaire qui doit être visualisé, la taille des structures qu'il forme et la nécessité pour visualiser les systèmes membranaires, l'utilisation de tétroxyde d'osmium peut ne pas être nécessaire et son omission va supprimer le potentiel de masquer la signature élémentaire de phosphore.
Comparé à d'autres publications à l'aide ESI 18,29,30 nous avons utilisé des réglages différents pour les pré et post-gardistes images afin de générer des cartes de rapport élémentaire avec le moins de bruit. Nous avons déterminé empiriquement les paramètres présentés dans le manuscrit (voir figure 9). Les réglages choisis sur les bords devraient conduire à corriger elecartes mentales à moins que les fenêtres de collecte se chevauchent avec d'autres éléments qui sont présents dans l'échantillon. Dans notre cas, le soufre pourrait être un tel élément. Depuis la concentration de soufre (qui se produit dans les acides aminés méthionine et cystéine) est très faible et contribue à la carte calculée seulement dans une quantité négligeable, nous croyons que le meilleur rapport S / N que nous avons obtenu en utilisant les paramètres utilisés ici l'emportent sur les inconvénients qui pourraient découler de traces de soufre dans l'échantillon.
Nous avons révélé l'ultrastructure de DRFs à des résolutions nanométriques en utilisant les protéines de réparation d'ADN MDC1, 53BP1 et RAD52 combinées avec des techniques de ESI et TEM. L'organisation de la chromatine et individuelle ORD protéines de réparation de localisation a été résolu en utilisant cette approche. Leur localisation dans des domaines riches en lésions de l'ADN suivantes laser irradiation micro-ADN et la tendance des protéines de réparation pour remplir l'espace entre les nervures de la chromatine a été montré. Dans le cas de Rad52, qui plays un rôle dans la recombinaison homologue, la formation de structures sphériques nucléaires corps en forme le long du rail de laser endommagé a pu être observée, ce qui est à l'opposé des deux autres protéines testées. Lorsque le dommage est appliquée par irradiation gamma, 53BP1 formé foyers autour de la chromatine endommagé. La composition et la position relative de la chromatine et de protéines dans les foyers semble changer au fil du temps. La relation entre ces protéines et la chromatine endommagé ainsi que des changements dans l'organisation de la chromatine et la composition des organes nucléaires peuvent tous être facilement obtenu en utilisant la technique ESI considérant que la microscopie en fond clair classique utilisant de l'uranium et conduire comme des agents contrastés ne peut pas évaluer directement ces propriétés. Ainsi, cette technique présente un potentiel élevé pour l'étude des relations structure-fonction, en particulier pour les processus qui agissent sur l'ADN.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank Dr. Roger Tsien for providing us with the miniSOG constructs. Dr. Xuejun Sun for help with the TEM. Lisa Lem, and Peter Shipple from the Cross Cancer Institute for supplying oxygen. Hilmar Strickfaden holds a postdoctoral fellowship by the Alberta Cancer foundation and was supported by the Bayrische Forschungsallianz. This work was supported by grants from the Canadian Institutes of Health Research and Alberta Cancer Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| 35 mm glass bottom dishes | MatTek | P35G-1.5-14-C | |
| Gridded 35 mm glass bottom dishes | MatTek | P35G-2-14-CGRD | not made for immersion objectives |
| LR White: acryl resin | emsdiasum | 14381 | |
| LR White accelerator | emsdiasum | 14385 | |
| 3,3′-Diaminobenzidine tetrahydrochloride 10 mg tablets | Sigma | D5905 | |
| Slim Bar Grids 300 Mesh | SPI | 1161123 | |
| Tungsten-Point Lab Pen | emsdiasum | 41148 | |
| Osmium Tetroxide | emsdiasum | 19100 | |
| Carbon Coater 208 carbon | Cressington | ||
| Ultra microtome Leica EM UC6 | Leica | ||
| Photoshop CS5 | Adobe | might even work with older versions | |
| Digital Micrograph V.2.30 | Gatan | might even work with older versions | |
| Hoechst 33342 | Sigma | H-1399 | |
| Effectene | Quiagen | ||
| MiniSOG-Constructs | Tsien-Lab | tsienlab@yahoo.com | |
| MDC1 miniSOG mCherry | |||
| 53BP1 miniSOG mCherry | |||
| Rad52 miniSOG mCherry | |||
| cesium 137 radiation source "MARK 1" | (J.L. Shepherd & Associated) | ||
| ImageJ/FiJi | open source | http://fiji.sc/Fiji | |
| 2 ml Eppendorf tubes | Fisherbrand | 05-408-146 | |
| Diamond Knife ultra 35° | Diatome | ||
| Trimming Knife ultratrim | Diatome | ||
| Sodium cacodylate trihydrate | emsdiasum | 12300 | Caution Toxic! |
| Glutaraldehyde EM Grade 8% | emsdiasum | 16020 | Caution Toxic! |
| Sodium phosphate dibasic | emsdiasum | 21180 | |
| Sodium phosphate monobasic | emsdiasum | 21190 | |
| Paraformaldehyde | emsdiasum | 19202 | |
| Osmium tetroxide 4% solution | emsdiasum | 19150 | |
| Inverted Fluorescence Micoscope Axiovert 200M | Zeiss | ||
| Hydrochloric Acid | Fisherbrand | A142-212 | |
| Sodium Hydroxide Solution 10M | Fluka | 72068 | |
| Oxygen | Medigas | ||
| 3-Amino-1,2,4-triazole | Sigma | A8056 | |
| Potassium cyanide | Sigma | 207810 | Caution Toxic! |
| Ethanol | emsdiasum | 15058 | Caution Toxic! |
| Razor blade Single Edge Carbon Steel | emsdiasum | 71960 | Caution Sharp! |
| DMEM | Sigma | D 5546 | |
| FBS | Life Technologies | 16000-044 | |
| G418 | Life Technologies | 11811-023 | |
| DMSO | Sigma | D2650 | |
| Transmission Electron Microscope 200 kV | JEOL | 2100 | |
| GIF Tridiem 863 Energy filter | Gatan |
Références
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190, 165-175 (2010).
- Bazett-Jones, D. P., Hendzel, M. J., Kruhlak, M. J. Stoichiometric analysis of protein- and nucleic acid-based structures in the cell nucleus. Micron (Oxford, England: 1993). 30, 151-157 (1999).
- Michael J Hendzel, F. M. B., Bazett-Jones, D. P. Direct Visualization of a Protein Nuclear Architecture. Molecular biology of the cell. 10, 2051(1999).
- Ottensmeyer, F. P., Andrew, J. W. High-resolution microanalysis of biological specimens by electron energy loss spectroscopy and by electron spectroscopic imaging. Journal of ultrastructure research. 72, 336-348 (1980).
- Leapman, R. D., Ornberg, R. L. Quantitative electron energy loss spectroscopy in biology. Ultramicroscopy. 24, 251-268 (1988).
- Simon, G. T. Electron spectroscopic imaging. Ultrastructural pathology. 11, 705-710 (1987).
- Egerton, R. Electron Energy-Loss Spectroscopy in the Electron Microscope. , Springer. (2011).
- Aronova, M. A., Kim, Y. C., Zhang, G., Leapman, R. D. Quantification and thickness correction of EFTEM phosphorus maps. Ultramicroscopy. 107, 232-244 (2007).
- Hopkins, C., Gibson, A., Stinchcombe, J., Futter, C. Chimeric molecules employing horseradish peroxidase as reporter enzyme for protein localization in the electron microscope. Methods in enzymology. 327, 35-45 (2000).
- Shu, X., et al. A Genetically Encoded Tag for Correlated Light and Electron Microscopy of Intact Cells, Tissues, and Organisms. PLoS biology. 9, e1001041(2011).
- Gaietta, G., et al. Multicolor and electron microscopic imaging of connexin trafficking. Science (New York, NY). 296, 503-507 (2002).
- Fernandez-Capetillo, O., Celeste, A., Nussenzweig, A. Focusing on foci: H2AX and the recruitment of DNA-damage response factors. Cell cycle (Georgetown, Tex). 2, 426-427 (2003).
- Haaf, T., Golub, E. I., Reddy, G., Radding, C. M., Ward, D. C. Nuclear foci of mammalian Rad51 recombination protein in somatic cells after DNA damage and its localization in synaptonemal complexes. Proceedings of the National Academy of Sciences of the United States of America. 92, 2298-2302 (1995).
- Maser, R. S., Monsen, K. J., Nelms, B. E., Petrini, J. H. hMre11 and hRad50 nuclear foci are induced during the normal cellular response to DNA double-strand breaks. Molecular and Cellular Biology. 17, 6087-6096 (1997).
- Bekker-Jensen, S., Mailand, N. Assembly and function of DNA double-strand break repair foci in mammalian cells. DNA repair. 9, 1219-1228 (2010).
- Chapman, J. R., Sossick, A. J., Boulton, S. J., Jackson, S. P. BRCA1-associated exclusion of 53BP1 from DNA damage sites underlies temporal control of DNA repair. Journal of cell science. 125, 3529-3534 (2012).
- Dellaire, G., Kepkay, R., Bazett-Jones, D. P. High resolution imaging of changes in the structure and spatial organization of chromatin, gamma-H2A.X and the MRN complex within etoposide-induced DNA repair foci. Cell cycle (Georgetown, Tex). 8, 3750-3769 (2009).
- Kruhlak, M. J., et al. Changes in chromatin structure and mobility in living cells at sites of DNA double-strand breaks. The Journal of Cell Biology. 172, 823-834 (2006).
- Goodson, H. V., Dzurisin, J. S., Wadsworth, P. Generation of stable cell lines expressing GFP-tubulin and photoactivatable-GFP-tubulin and characterization of clones. Cold Spring Harbor protocols. 2010, (2010).
- Zeyda, M., Borth, N., Kunert, R., Katinger, H. Optimization of sorting conditions for the selection of stable, high-producing mammalian cell lines. Biotechnology progress. 15, 953-957 (1999).
- Dellaire, G., Nisman, R., Bazett-Jones, D. P. Correlative light and electron spectroscopic imaging of chromatin in situ. Methods in enzymology. , 375-456 (2004).
- Campbell, S., Ismail, I. H., Young, L. C., Poirier, G. G., Hendzel, M. J. Polycomb repressive complex 2 contributes to DNA double-strand break repair. Cell cycle. 12, 2675-2683 (2013).
- Mortusewicz, O., et al. Recruitment of RNA polymerase II cofactor PC4 to DNA damage sites. J Cell Biol. 183, 769-776 (2008).
- Bekker-Jensen, S., et al. Spatial organization of the mammalian genome surveillance machinery in response to DNA strand breaks. The Journal of Cell Biology. 173, 195-206 (2006).
- Ferrando-May, E., et al. Highlighting the DNA damage response with ultrashort laser pulses in the near infrared and kinetic modeling. Frontiers in genetics. 4, 135(2013).
- Lukas, C., et al. 53BP1 nuclear bodies form around DNA lesions generated by mitotic transmission of chromosomes under replication stress. Nature. 13, 243-253 (2011).
- Harrigan, J. A., et al. Replication stress induces 53BP1-containing OPT domains in G1 cells. The Journal of Cell Biology. 193, 97-108 (2011).
- Aronova, M. A., et al. Reprint of 'Three-dimensional elemental mapping of phosphorus by quantitative electron spectroscopic tomography (QuEST). J. Struct. Biol. 161, 322-335 (2007).
- Fussner, E., et al. Constitutive heterochromatin reorganization during somatic cell reprogramming. The EMBO journal. 30, 1778-1789 (2011).
- Kepkay, R., Attwood, K. M., Ziv, Y., Shiloh, Y., Dellaire, G. KAP1 depletion increases PML nuclear body number in concert with ultrastructural changes in chromatin. Cell cycle. 10, Georgetown, Tex. 308-322 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon