Method Article
Suppression des éléments traces par Cupric nanoparticules d'oxyde de Uranium
Dans cet article
Résumé
Production bleed water (PBW) was treated with cupric oxide nanoparticles (CuO-NPs) and cellular toxicity was assessed in cultured human cells. The goal of this protocol was to integrate the native environmental sample into a cell culture format assessing the changes in toxicity due to CuO-NP treatment.
Résumé
Dans la récupération in situ (ISR) est la principale méthode d'extraction de l'uranium aux États-Unis. Pendant ISR, l'uranium est lessivé à partir d'un gisement de minerai et extrait par échange d'ions. La purge de l'eau résultant production (pep) contient des impuretés telles que l'arsenic et d'autres métaux lourds. Des échantillons de PBW à partir d'une installation d'uranium ISR actifs ont été traités avec des nanoparticules d'oxyde de cuivre (CuO-IP). Traitement CuO-NP de PBW réduite contaminants prioritaires, y compris l'arsenic, le sélénium, l'uranium, et le vanadium. Essai non traitée et traitée CuO-NP PBW a été utilisé comme le composant liquide du milieu de croissance des cellules et les variations de viabilité ont été déterminées par le MTT (3- (4,5-diméthylthiazol-2-yl) -2,5-diphényltétrazolium de) dans le rein embryonnaire humain (HEK 293) et le carcinome hépatocellulaire humain (Hep G2) des cellules. Traitement CuO-NP a été associée à l'amélioration de HEK et HEP viabilité cellulaire. Les limites de ce procédé comprennent la dilution de PBW par des composants de milieu de croissance et pendant osmolréglage de nalité ainsi que l'ajustement du pH nécessaire. Ce procédé est limité dans son contexte plus large du fait des effets de dilution et des changements dans le pH de la PBW qui est traditionnellement cependant légèrement acide; cette méthode pourrait avoir une utilisation plus large évaluation de traitement CuO-NP dans les eaux plus neutres.
Introduction
Environ 20% de l'alimentation électrique des États-Unis est fournie par l'énergie nucléaire et, basé en partie sur des incitatifs nationaux pour accroître l'indépendance énergétique, la capacité nucléaire des États-Unis devrait augmenter de 1. Est également prévu la croissance mondiale de l'énergie nucléaire à poursuivre, avec beaucoup de la croissance survenant à l'extérieur des États-Unis 2. Dès 2013, 83% de l'uranium a été importé des États-Unis, mais 952 544 tonnes de réserves existent dans les Etats-Unis 3,4. En 2013 il ya eu 7 nouvelles applications de l'installation et des applications 14 redémarrage / dilatation entre le Wyoming, Nouveau-Mexique, et le Nebraska 5. Aux États-Unis, l'uranium est principalement extrait par récupération in situ (ISR) dans les processus 6. ISR provoque moins de perturbations des sols et évite de créer des tas de résidus qui peuvent libérer des contaminants environnementaux 7. ISR utilise des solutions oxydantes à base d'eau pour lixivier l'uranium à partir du gisement souterrain, après quoi l'uranium est extrait de la solution de lixiviation à traversun procédé d'échange d'ions 8. Pour maintenir un solde négatif de l'eau dans le corps de minerai, une partie du lixiviat, appelé production saigner l'eau (PBW), est saigné off. Une partie de la PBW est décontaminé par osmose inverse (OI) et ré-introduit dans le processus de l'exploitation minière, mais PBW pourrait également avoir des usages industriels ou agricoles bénéfiques, si des contaminants toxiques peuvent être réduits à des niveaux acceptables déterminées par les organismes de réglementation de l'État pour la surface et 9 souterraines. Actuellement, la plupart des installations d'uranium ISR utilisent RO pour éliminer les contaminants de PBW. Cependant, le traitement RO est consommatrice d'énergie et la saumure produit des déchets toxiques, ce qui nécessite l'élimination réglementée.
Beaucoup de méthodes de décontamination de l'eau existent, y compris des adsorbants, des membranes, et l'échange d'ions. Parmi ceux-ci, l'adsorption est le plus couramment utilisé, et les développements récents dans la synthèse de nanoparticules a renforcé les capacités de l'eau en fonction de la décontamination adsorbant-processus 10. Oxi Cupricde nanoparticules (CuO-IP) avait auparavant pas été largement étudiés sur l'uranium ISR PBW, mais dans des études récentes de l'élimination des contaminants des eaux souterraines, CuO-IP ont été trouvés à avoir des propriétés uniques, y compris ne pas nécessiter d'étapes de traitement de l'eau (pré ou post par exemple, ajuster le pH ou potentiel redox) et qui fonctionne bien dans des compositions différentes de l'eau (par exemple, dans différents pH, des concentrations de sel, ou ions concurrents) 11. En outre, CuO-IP sont facilement régénérés par lessivage avec de l'hydroxyde de sodium (NaOH), après quoi le CuO-IP régénéré peut être réutilisé. Détails de CuO-NP capacités de filtrage de métaux traces dans les eaux naturelles ont déjà été publiés 11-14.
Bien utile pour le traitement de l'eau, des nanoparticules d'oxyde de métal peuvent être toxiques pour les organismes vivants, mais la mesure de la toxicité dépend, en partie, sur les caractéristiques des nanoparticules et des constituants 10,15,16. Par conséquent, il est important d'étudier simultdéménagements et de nanoparticules toxicités contaminants aneous avant applications sur le terrain. L'étude actuelle a déterminé la capacité de CuO-IP pour éliminer les contaminants prioritaires PBW (y compris l'arsenic, le sélénium, le vanadium et uranium), et d'évaluer l'effet du traitement CuO-NP sur PBW cytotoxicité.
PBW été recueillies à partir d'une installation d'uranium ISR actif et utilisé pour déterminer l'efficacité du traitement CuO-NP dans l'élimination des contaminants de priorité. PBW cytotoxicité avant et après traitement CuO-NP a également été évaluée. PBW est une géologique complexe mélange (industrielle / de l'environnement) et les deux de l'Institut national de la santé environnementale et de la Science (NIEHS) et l'Agence pour les Substances Toxiques & Disease Registry (de ASTDR) sont mettant l'accent sur l'étude de la toxicité des mélanges pertinents pour l'environnement, y compris les mélanges telles qu'elles existent dans la nature ou les paramètres industriels, ainsi que dans la promotion de tests in vitro pour donner la priorité à des produits chimiques autres tests in vivo17-19. Les études de l'exposition, de mélange à faible dose chroniques sont difficiles parce que l'exposition chronique à un mélange à faible dose pas produire des effets évidents, du moins pas dans le court laps de temps de la plupart des études de laboratoire. De même, la plupart des études in vitro de mélanges chimiques exposer les cellules à un mélange de laboratoire faites défini de deux ou plusieurs métaux 20,21. Ces études fournissent des informations de base, mais des mélanges simplifiées ne reproduisent pas les interactions antagonistes et synergiques complexes qui peuvent survenir dans un échantillon environnemental natale, où la gamme complète des composants du mélange sont présents.
Les objectifs de cette étude étaient d'examiner les processus d'élimination de contaminants de rechange pour PBW et d'évaluer l'effet de (CuO-NP) de traitement sur PBW cytotoxicité en utilisant des cellules humaines en culture. Les résultats pourraient profiter à l'industrie de l'uranium à travers le développement de méthodes plus efficaces ou respectueux de l'environnement pour l'élimination des contaminants. Cette étude fournitla première preuve que la réduction des contaminants prioritaires dans PBW par CuO-IP réduit la cytotoxicité des cellules de mammifères 22.
Protocole
Tous les échantillons ont été prélevés dans le bâtiment de traitement de liquide de l'uranium d'une installation d'ISR de l'uranium dans le Wyoming.
1. Production de purge de l'eau (PBW)
- Recueillir deux types d'échantillons d'eau provenant d'une installation d'uranium ISR: PBW et l'osmose (RO) de l'eau inverser. Recueillir PBW partir d'un robinet de suivi après le processus d'échange d'ions, mais avant osmose inverse décontamination. Prélever des échantillons RO après la PBW est décontaminé par un traitement par osmose inverse.
REMARQUE: agent de lixiviation est transporté dans des canalisations des champs de puits multiples à la construction de traitement de liquide de l'uranium, où elle est recueillie dans une colonne et préparé pour l'échange d'ions. Environ 1-3% de l'agent de lixiviation après l'échange d'ions est retiré du circuit et appelée eau de purge de production (pep). PBW est réutilisée dans les procédés d'extraction et de décontaminer / déminéralisée avec filtration RO. - Prélever des échantillons d'eau en polyéthylène haute densité (PEHD) bouteilles avec zéro espace de tête selonles procédures d'exploitation normalisées pour la collecte et l'analyse du Département Wyoming of Environmental Quality (WYDEQ) 23 échantillon.
- Mesurer la température et du pH sur place et transporter les échantillons sur la glace pour les garder au frais.
- PBW de magasin à 4 ° C. Conserver la solution PBW frais jusqu'à ce que après que les médias essentielle (EMEM-10x) minimum du concentré d'Eagle est ajouté lors de la préparation des médias comme indiqué dans le protocole suivant.
NOTE: PBW est une solution oxydée qui va précipiter si on les laisse geler ou réchauffé à température ambiante. Après dilution, la solution est suffisamment dilué PBW qu'il ne précipite pas lorsqu'il est chauffé à 37 ° C avant l'application sur les cellules et pendant l'incubation.
2. Préparation de nanoparticules de CuO (CuO-PN)
- Moissonneuse une solution éthanolique pur contenant 250 ml de 0,2 M de CuCl 2 • 2H 2 O, 250 ml d'hydroxyde de sodium 0,4 M (NaOH), et 5 g de polyethylene glycol (PEG) dans un ballon à fond rond avec six mm boules de verre borosilicate.
- Placer la solution dans un four à micro-ondes modifié et lui permettre de réagir sous reflux à la pression de l'air ambiant pendant 10 min à 20% de puissance (intervalles de 6 secondes à 24 secondes éteint).
- Refroidir la solution à la température ambiante (20 ° C), puis décanté dans 50 ml tubes coniques, en laissant les billes de verre.
- Centrifugeuse la solution dans les 50 ml tubes coniques à 1000 g pendant 30 min, décanté, puis laver le CuO-IP avec une séquence de 300 ml d'eau chaude (60-65 ° C), 100 ml d'éthanol et 100 ml d'acétone.
- Sécher le CuO-IP à la température ambiante (20 ° C) dans les 50 ml tubes coniques.
- Grattez la CuO-IP de leurs tubes dans un mortier. Couvrir le CuO-IP avec une feuille d'étain et de chauffer le CuO-IP à 110 ° C dans un four pour retirer le liquide restant. Combinez CuO-IP dans un lot et peser le CuO-IP.
NOTE: La préparation de CuO-IP et le traitement CuO-NP de PBW ont été menées dans l'eau Quallité Laboratoire de science des écosystèmes et de la gestion, Université du Wyoming. CuO-NP synthèse suit la procédure de Martinson et Reddy (2009) 11.
3. Traitement des PBW avec CuO-IP
- Ajouter 50 mg (1 mg / ml) de CuO-NP à un tube conique de 50 ml puis 50 ml d'PBW. Scellez le tube et on fait réagir pendant 30 min sur un banc haut agitateur orbital à 250 rpm.
- Échantillons Tubes à centrifuger à 250 g pendant 30 min puis filtrer le surnageant à l'aide d'un filtre à seringue de 0,45 um. Modifier la vitesse de la centrifugeuse et le temps peut dépendre de la nanoparticule d'assurer la CuO-IP devient compact dans le tube de centrifugation.
4. Analyse élémentaire
- Préparer non traitée (témoin) et des échantillons PBW CuO-NP-traités pour l'analyse élémentaire comme suit.
- Acidifier aliquotes (40 ml) de CuO-NP-traitées et non traitées PBW avec de l'acide nitrique de qualité trace métallique à un pH de 2,0. Analyser aliquotes PBW acidifiés pour les cations par coupl inductifed plasma spectroscopie de masse (ICP-MS) comme décrit dans Reddy et Roth (2012) 13.
- Préparer des aliquots non acidifiés (20 ml) de CuO-NP-traitées et non traitées PBW et analyser les aliquotes non acidifiés pour anions par chromatographie ionique (IC) tel que décrit dans Reddy et Roth (2012) 13.
NOTE: Des aliquotes ont été analysées par le Département des services analytiques Wyoming Agriculture, Laramie WY 82070. Une description de la procédure IC et ICP-MS peut être trouvée dans Reddy et Roth, (2012) 13.
5. Préparation de culture cellulaire supports Utilisation PBW
- Utilisez la commande à deux (EMEM-1x et RO + médias) et huit solutions médias de test PBW (quatre concentrations de chaque PBW non traitée et les médias CuO-NP-traitée) dans les études de viabilité. Tour d'Horizon des solutions sont les suivantes:
- Pour le contrôle EMEM-1x, acheter des supports essentiel minimum (EMEM-1x) de Eagle avec L-glutamine et de bicarbonate de sodium déjà ajoutées. Ajouter sérum fœtal bovin (FBS) Et des antibiotiques par les instructions du fabricant.
REMARQUE: EMEM-1x est acheté dilué à la concentration appropriée pour la croissance cellulaire et contenant de la L-glutamine et du bicarbonate de sodium. EMEM-1x nécessite l'ajout de sérum fœtal bovin (FBS) et un mélange d'antibiotiques de pénicilline et de la streptomycine (50 UI / ml de pénicilline et 50 pg / ml de streptomycine). EMEM-1x est utilisé comme un support de commande, car il est le milieu de croissance recommandée par le fabricant pour les deux types de cellules utilisées dans cette étude. Concentré EMEM-10x est dilué avec de l'eau RO de l'installation ou non traitée ou CuO-NP-traitée PBW pour produire les solutions d'essai. Concentré EMEM-10x lors de l'achat ne contient pas de L-glutamine ou du bicarbonate de sodium si ceux-ci sont ajoutés en plus du sérum bovin fœtal (FBS) et un mélange d'antibiotiques de pénicilline et de streptomycine. - Pour la solution de contrôle RO RO utiliser l'eau recueillis dans l'installation d'ISR. Utilisez le même protocole que les milieux d'essai PBW seul substitut 100% RO water de l'installation d'ISR à la place de PBW. Pour diluer l'eau non traitée et l'utilisation de la solution CuO-NP-traitée RO ou ultrapure du laboratoire.
- Diluer PBW non traité en quatre concentrations d'essai avant le mélange avec les composants de milieux de culture cellulaire. Préparer les quatre concentrations différentes de solutions non traitées PBW en mélangeant traitée PBW avec RO (du laboratoire) dans les combinaisons suivantes: 100% (PBW pur + pas d'eau de RO), 75% (187,5 ml de PBW + 62,5 ml eau RO), 50% (125 ml de PBW + 125 ml d'eau RO) ou 25% (62,5 ml de PBW + 187,5 ml d'eau RO).
- Diluer CuO-NP-PBW traitée en quatre concentrations d'essai avant le mélange avec les composants de milieux de culture cellulaire. Préparer les quatre concentrations différentes de solutions PBW CuO-NP-traités en mélangeant PBW (pré-traités avec 1 mg / ml CuO-NP pendant 30 minutes) avec RO (du laboratoire) dans les combinaisons suivantes: 100% (pur CuO- PBW NP-traitée + pas d'eau de RO), 75% (187,5 ml de CuO-NP-traitée PBW + 62,5 ml d'eau RO), 50% (125ml de CuO-NP-traitée PBW + 125 ml d'eau RO) ou 25% (62,5 ml de PBW CuO-NP-traitée + 187,5 ml d'eau RO).
- Pour le contrôle EMEM-1x, acheter des supports essentiel minimum (EMEM-1x) de Eagle avec L-glutamine et de bicarbonate de sodium déjà ajoutées. Ajouter sérum fœtal bovin (FBS) Et des antibiotiques par les instructions du fabricant.
- Préparez 250 ml de RO + médias, PBW non traitée + médias et PBW + concentration des médias CuO-NP-traitée par addition de 25 ml de concentré EMEM-10x à 190 ml de la RO 100% et 100%, 75%, 50% ou 25% des concentrations PBW préfabriqués non traitées ou CuO-NP-traités créés à l'étape 6.1.3 et 6.1.4.
- Ajuster le pH de chaque solution à 7,4 avec du NaOH ou du HCl.
- Supplément chaque concentration de non traitée et CuO-NP-traitée PBW ainsi que RO + support avec les composants standards suivants: 25 ml (10%) de sérum bovin fœtal (FBS), 2,5 ml de L-glutamine, 0,55 g de NaHCO 3 et 1,25 ml Pen / Strep (50 UI / ml de pénicilline et 50 pg / ml de streptomycine).
- Réglez l'osmolalité de chaque concentration de PBW non traitée + médias, CuO-NP-traitée PBW + médias et RO + médias à 290-310 mOsm / kg par addition d'eau RO et la mesure en utilisant un osmomètre.
- Filtre à chaque solution en utilisantune unité de 0,22 um à vide de filtre, et conserver à 4 ° C.
NOTE: En raison de légères variations dans la quantité d'eau RO utilisé pour ajuster l'osmolalité, varier la concentration des médias finales dans une fourchette de 5%, avec PBW non traitée + concentrations des médias à 56%, 44%, 29% et 16,5% et CuO-NP Les concentrations de PBW + médias traitée à 53%, 45%, 30% et 17%.
6. viabilité cellulaire
NOTE: Étant donné que les reins et le foie sont des organes cibles de la toxicité des métaux lourds, emploient des cellules en culture de rein embryonnaire humain (HEK293) (HEK) et le carcinome hépatocellulaire humain (HepG2) cellules (HEP) de méthodes d'essai 24-26.
- Préparer une culture de cellules HEK et HEP 2-3 jours avant l'ensemencement des plaques à 96 puits utilisés dans l'expérience par les instructions du fabricant.
- Mesurer la viabilité des cellules en utilisant le [, 5-diméthylthiazol-2-yl-4] -2, le bromure de 5-diphényltétrazolium (MTT) 3- essai.
REMARQUE: Le protocole de dosage de MTT a été modifié à partir de Meerloo et al. (2011) 27.- Obtenir MTT sous forme de poudre. Ajouter un tampon phosphate salin (PBS) pour constituer une concentration stock de 50 mg / ml. Agiter la solution pendant 2 heures puis filtrer avec un filtre à seringue de 0,45 um et aliquote dans des tubes sécuritaires 1,5 ml de congélation. Protéger les tubes de la lumière et conserver à 4 ° C.
- Éliminer les cellules HEK et HEP de leurs boîtes de culture à l'aide de trypsine, centrifuger à 1000 g pendant 5 min et décanter la trypsine. Ajouter 5 ml de PBS et les cellules mélanger pour obtenir une solution d'une seule cellule. Ensuite, 20 ul d'appliquer la solution à une seule cellule à un hémocytomètre pour obtenir un nombre de cellules par millilitre de solution. Centrifuger les cellules à nouveau à 1000 g pendant 5 min et décanter la PBS utilisée pour rincer les cellules. Ajouter la quantité appropriée de EMEM-1x pour ajuster la concentration de cellules à 500 cellules / 100 pi (100 pl / puits).
- Remplir les puits périphériques de la plaque avec 200 ul de PBS pour contrôler l'évaporation.
- cellule de semencess à une densité de 500 cellules / puits en ajoutant 100 ul dans chaque puits, sauf les puits périphériques (qui ne sont pas étalées avec des cellules).
REMARQUE: la densité de semis pour les cellules HEK et HEP est basée sur des courbes de croissance expérimentales qui permettent le pic de croissance de se produire autour de 4-5 jours. Préparer des courbes de croissance pour toutes les lignées cellulaires pour estimer la densité de semis. - Incuber les cellules pour 24 heures à 37 ° C leur permettant de récupérer (formulaire adhérences serrées à la plaque) avant d'effectuer des lectures de base de MTT de la densité cellulaire.
- Effectuer des lectures de MTT base de la densité cellulaire en enlevant le support d'ensemencement à partir de la première colonne (à l'exclusion du périmètre) et en ajoutant 100 ul de MTT (5 mg / ml dans du milieu) dans les puits pendant 1 h.
- Après une heure, enlever le MTT et ajouter 100 ul de diméthylsulfoxyde (DMSO) pour dissoudre le MTT-formazan produit par les cellules viables (20 min).
- Lire la densité optique (DO) de la première colonne à une longueur d'onde d'absorption de 570 nm pour obtenir une basela lecture de la ligne.
- Utilisez des lectures de base pour assurer que toutes les plaques ont été ensemencées correctement et que les cellules sont en croissance constante entre les plaques. Retirez le DMSO de la colonne étant testés avant incubation pendant 24 heures suivantes.
REMARQUE: si DMSO est laissé pendant une nuit à la plaque elle tire l'humidité de la colonne adjacente, ce qui provoque une réduction du volume de support.
- Utilisez des lectures de base pour assurer que toutes les plaques ont été ensemencées correctement et que les cellules sont en croissance constante entre les plaques. Retirez le DMSO de la colonne étant testés avant incubation pendant 24 heures suivantes.
- Réchauffez les solutions de test (par exemple, l'EMEM-1x, RO, PBW non traitée et de solutions PBW médias CuO-NP-traités) à 37 ° C dans un bain d'eau.
- Retirez le support d'ensemencement du reste de la plaque (non compris le périmètre ou la première colonne qui a été utilisé pour la lecture de base) et remplacé par 100 pi de EMEM-1x, + médias, PBW non traitée + médias concentrations RO ou CuO-NP PBW -Traité + la concentration des médias (une solution par plaque). Incuber les cellules dans leurs concentrations des solutions d'essai ou de contrôle pour un total de sept jours (jours 2-8).
NOTE: Il 10 plaques totales: 1 GEMM-1x, 1 RO + médias, une de chaque concentration PBW + des médias non traité (56%, 44%, 29% et 16,5%) et une plaque de chaque concentration PBW + médias CuO-NP-traités (53%, 45% , 30% et 17%) par expérience par ligne cellulaire. - Chaque jour qui suit la ligne de base de lecture de MTT, retirez les solutions de contrôle et de test (figurant dans la note sous 6.11) de la colonne suivante de leur plaque respective (par exemple Jour 2 test et de contrôle des médias sont retirés de la ligne 3, les puits BG; Jour 3: rangée 4, puits BG etc.) et répéter le protocole de MTT comme décrit dans les étapes 06.07 à 06.09 ci-dessus.
- Répéter le protocole chaque jour pendant sept jours. La moyenne des résultats de DO pour chaque ligne (6 puits) et rapporté contre le temps pour générer une courbe de croissance de sept jours.
- Pour évaluer l'effet de chélation du cuivre sur la viabilité des cellules dans PBW CuO-NP-traitées + supports suivent le même mode opératoire que ci-dessus, sauf ajouter 100 uM de D-pénicillamine de contrôler et de solutions d'essai avant l'addition des solutions à leurs plaques respectives. Effectuer anale de donnéesana- utilisant un logiciel graphique scientifique.
7. Modélisation géochimique
- Télécharger la version de Visual MINTEQ 3.0 / 3.1 un logiciel gratuit à partir du site Web suivant http://www2.lwr.kth.se/English/Oursoftware/vminteq/ .
Remarque: Visual MINTEQ est un modèle d'équilibre chimique freeware pour le calcul de la spéciation des métaux, des équilibres de solubilité, etc. sorption pour les eaux naturelles. En outre, il est utilisé pour prédire la spéciation d'ions, des activités d'ions, d'ions complexes et des indices de saturation qui est comparée à la concentration d'éléments avant et après traitement (résultats de spectroscopie de masse) pour examiner les mécanismes possibles de l'enlèvement de l'élément 28. - Ouvrir le programme et les données d'entrée de spectroscopie de masse provenant de l'étape 4, y compris le pH, l'alcalinité et la concentration des différents éléments dans le programme.
NOTE: Étant donné que les eaux souterraines est oxydé au cours urani in situum processus d'extraction, utilisez espèces oxydées de l'arsenic, le vanadium, et de l'uranium pour l'entrée.
8. Concentration inhibitrice 50 (CI50)
- Calculer l'IC 50 pour les PBW + médias concentrations non traités et CuO-NP-traitées d'abord par la moyenne de la viabilité (moyennes de DO) au jour 5 de trois séries distinctes.
- Soustraire jour, cinq moyennes de viabilité des médias PBW + concentrations non traités et CuO-NP-traités provenant de cinq jours des moyennes de viabilité de EMEM-1x pour calculer les différences de viabilité. Puis diviser les différences de viabilité de la viabilité moyenne sur 5 jours dans EMEM, et multiplier par 100 pour obtenir une inhibition pour cent.
- Soustraire le pour cent d'inhibition de 100 (EMEM-1x viabilité) pour obtenir la viabilité pour cent pour chaque PBW + concentration des médias non traitée et CuO-NP-traitée.
- Entrée dans le logiciel graphique scientifique par la mise en EMEM-1x à une concentration de l'un et un pour cent viabilité de 100; transformer toutes les concentrations en journaléchelle (X = Log (X)) et effectuer régression non linéaire avec moins l'analyse de forme carrée.
9. Analyse des données
- Comparer les concentrations d'éléments en non traité et CuO-NP-traité avec un PBW, jumelé, T-test de Student bilatéral.
- Calculer les aires sous la courbe (AUC) en utilisant les données de la courbe de croissance recueillies sur sept jours et d'analyser la variance avec analyses de mesures répétées de la variance (Anova), suivie par la poste hoc comparaison de Tukey entre tous les groupes (n = 3).
- Calculer la IC 50 en utilisant des données de cinq jours de la courbe de croissance pour les deux PBW non traitée et CuO-NP-traitée + solutions médias (décrites ci-dessus). Les valeurs de P <0,05 sont considérées comme significatives.
NOTE: Aux fins de l'analyse statistique, les valeurs de la spectroscopie de masse de la moitié de la limite de détection a été affecté à ions niveaux de concentration en dessous de cette limite 29.
Résultats
Concentrations de composants PBW et pH non traitée et dans CuO-NP-traitée PBW sont présentés au tableau 1. Martinson et Reddy (2009), ont indiqué que le point de charge nulle du CuO-NP est estimée à 9,4 ± 0,4. Étant donné que le pH de 7.2 à 7.4 PBW était, dans ces conditions, un don de l'eau à protons CuO-IP, ce qui provoque la surface des nanoparticules à charger positivement permettant l'adsorption d'espèces chargées négativement. Traitement CuO-NP supprimé contaminants prioritaires de PBW, y compris l'arsenic, le sélénium, le vanadium et l'uranium (tableau 1). La concentration d'arsenic moyenne a été réduite de 87% [0,0175-0,002 mg / L (bilatéral test t apparié, p <0,0001)]. Traitement CuO-NP également sélénium réduit de manière significative (30%), de l'uranium (78%), de vanadium (92%) et de phosphate (85%) (p <0,05).
résultats de la modélisation de spéciation, rapporté dans le Tableau 2, appuyer les résultats d'analyse: 99% de latal arsenic dissous dans PBW est présent sous forme HAsO 4 2- et H 2 AsO 4 - et 94% de sélénium total dissous dans PBW est présent sous forme SeO 4 2-. Ces espèces sont chargées négativement, donc capable d'adsorber à CuO-IP. la modélisation de spéciation prédit que 99% des espèces de vanadium dans PBW sont chargés négativement, promouvoir également l'adsorption sur CuO-IP. Cependant, la modélisation de spéciation prédit que 35,5% de l'uranium espèces sont chargées négativement, ce qui limiterait l'adsorption sur CuO-IP. Analyse des indices de saturation prédit qu'aucune espèce de l'arsenic, du sélénium, uranium ou de minéraux contenant du vanadium étaient proches de la saturation (ie, la précipitation minérale) niveaux, adsorption soutien à CuO-IP, contre la précipitation.
Pour évaluer si les concentrations attendues de contaminants prioritaires dans les médias sont fabriqués à partir de non traitée et CuO-NP-traitée PBW, des échantillons de médias de contrôle non dilué (EMEM-1X), 56%PBW + supports non traités et l'PBW CuO-NP-traité 53% + les médias ont été analysés par ICP-MS. Médias de contrôle non dilué (EMEM-1x) est un produit commercial fourni avec L-glutamine et de bicarbonate de sodium (pré-ajouté). Les concentrations de cuivre et de sélénium dans le contrôle EMEM-1x étaient légèrement élevés que prévu, car ils sont essentiels pour la croissance cellulaire, mais l'arsenic, l'uranium et le vanadium ont été négligeables, indiqué dans le tableau 3. Des études préliminaires ont montré que, de l'arsenic, les concentrations de sélénium et de vanadium ont été réduits par traitement CuO-NP et que la diminution a été représentée dans les concentrations dans le PBW CuO-NP-traitées + médias. La concentration mesurée de l'uranium dans le PBW CuO-NP-traitée + médias a été diminué par rapport à PBW non traitée, et cette baisse a été plus prononcée que prévu par la modélisation visuelle MINTEC v.3. Les niveaux de cuivre ont augmenté dans les médias CuO-NP-traitée comme prévu.
Pour déterminer la capacité de traitement CuO-NP à améliorer la cytotoxicité de mammifère sur PBWdes cellules, la viabilité a été évaluée dans des cellules exposées à des solutions de PBW + support avant et après le traitement CuO-NP. Les deux cellules HEK (figure 1A) et HEP (figure 1B) ont été exposées à différentes concentrations de PBW non traitées ou traitées + médias pour jusqu'à sept jours. Dans les cellules cultivées dans PBW non traitée + médias, la viabilité a été altérée de manière dépendante de la concentration, alors que le traitement CuO-NP amélioré la viabilité cellulaire dans les deux lignées cellulaires. La CUA intégrée dans la figure 1C montre que les cellules HEK cultivés dans PBW CuO-NP-traitées + médias étaient plus viable par rapport à PBW non traitée + médias dans les trois plus fortes concentrations (29%, 44% et 56%). Cellules HEP ont montré la viabilité légèrement différente: seuls les deux plus fortes concentrations de PBW non traitée + médias (44% et 56%) ont montré une altération viabilité par rapport à PBW CuO-NP-traitée + media (figure 1D). Les concentrations plus diluées de PBW sont moins toxiques pour les cellules HEP, et la viabilité des cellules moins affectés par le traitement. Lela viabilité des deux cellules HEK et HEP cultivées dans 16,5% PBW non traité + support n'a pas été significativement différente de celle des cellules cultivées dans 53% de CuO PBW-NP-traitées + support (p <0,05). Ainsi, le traitement CuO-NP est apparu pour améliorer la cytotoxicité de PBW, avec la viabilité près des niveaux de contrôle. Comme indiqué plus haut, le traitement de CuO-NP PBW est associée à une augmentation des concentrations de cuivre. L'augmentation a été, sur la base des résultats antérieurs par Reddy et Roth (2012), dans lequel ils ont utilisé CuO-IP pour éliminer l'arsenic des eaux souterraines. L'augmentation de cuivre dépend de la chimie de l'eau de la PBW spécifique, mais est resté inférieur EPA MCL de 1,3 mg / L. Cependant, il est important d'exclure que l'augmentation des concentrations de cuivre a contribué à l'amélioration de la viabilité (à savoir, en plus ou à la place de, la diminution de contaminants prioritaires). En conséquence, le chélateur de cuivre Dpénicillamine a été ajouté à commande EMEM-1x, RO + contrôle des médias, des solutions de PBW + médias non traités et CuO-NP-traités, et ecourbe de l'évolution de la viabilité en MTT ont été générées, comme décrit ci-dessus. chélation du cuivre n'a pas significative affecter la viabilité des cellules soit HEK ou HEP incubés dans RO + contrôle des médias, PBW non traitée et CuO-NP-traitée + médias (résultats non montrés).
La concentration inhibitrice demi-maximale (CI50) a été calculée à partir de cinq jours de croissance des cellules HEK et cellules HEP cultivées dans des milieux PBW non traité + (tableau 4A) et PBW CuO-NP-traitées + médias (tableau 4B). Pour les cellules HEK cultivés dans PBW non traitée + médias, la valeur IC 50 était de 1,264 (log% PBW). Ainsi, les médias PBW + non traités devraient être diluée à 18,38% pour arriver à une diminution de 50% de la viabilité. Pour les cellules HEK cultivés dans PBW CuO-NP-traitée + médias, la valeur IC 50 était 2.744 (log% PBW). Ce résultat suggère que, théoriquement, la cytotoxicité de la solution a été réduit dans la mesure où traités auraient besoin PBW + médias à être concentré par 500% (log% PBW = 2,744) pour produire un semblable de 50%pli de la viabilité. Pour les cellules HEP cultivés dans PBW non traitée + médias, l'IC 50 était de 1,243 (log% PBW). Cela exigerait une dilution de la PBW + médias à 17,5% afin de produire une diminution de 50% de la viabilité. En revanche, pour les cellules HEP cultivés dans PBW CuO-NP-traitée + médias, l'IC 50 était 5.327 (log% PBW). Cette valeur probable était si grand, parce que la viabilité des cellules dans PBW CuO-NP-traitée + médias n'a pas été significativement différent de cellules cultivées dans du EMEM-1x (contrôle). Imagerie en champ clair, illustré à la figure 2, à la fois de la croissance cellulaire HEK et HEP sur cinq jours. Le nombre de cellules et de l'attachement dans les médias PBW + CuO-NP-traitées (figure 2E, F) ont été améliorées par rapport à PBW non traitée + media (figure 2C, D).
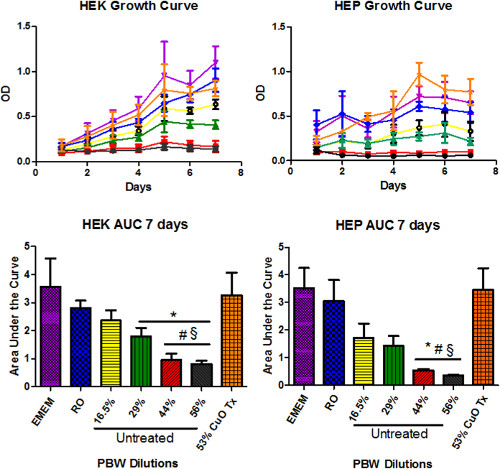
Figure 1: courbes de croissance. Les courbes de croissance ont été utilisés pour évaluer la viabilité et groissance des cultures pendant le traitement. courbes de croissance pour HEK (A) et HEP (b) des cellules cultivées dans quatre dilutions de PBW + médias par rapport à 53% PBW CuO-NP-traitée + médias (panneaux supérieurs). Contrôle EMEM-1x (EMEM)  , RO
, RO  , 53% de CuO-NP-traité
, 53% de CuO-NP-traité  , 16,5% non traitée PBW
, 16,5% non traitée PBW  , 29% non traitée PBW
, 29% non traitée PBW  , 44% non traitée PBW
, 44% non traitée PBW  , 56% non traitée PBW
, 56% non traitée PBW  . Surface sous l'analyse courbe (AUC) du HEK (C) et HEP (D) les données de courbe de croissance de 7 jours (panneaux inférieurs). * P <0,05 par rapport au témoin EMEM, #p <0,05 par rapport au témoin RO, §p <0,05, comparativement à 53% CuO NP-traités PBW-médias. (Rapport en utilisant une analyse de variance à deux queue avecPost hoc de l'analyse de Tukey, n = 3.)
. Surface sous l'analyse courbe (AUC) du HEK (C) et HEP (D) les données de courbe de croissance de 7 jours (panneaux inférieurs). * P <0,05 par rapport au témoin EMEM, #p <0,05 par rapport au témoin RO, §p <0,05, comparativement à 53% CuO NP-traités PBW-médias. (Rapport en utilisant une analyse de variance à deux queue avecPost hoc de l'analyse de Tukey, n = 3.)

Figure 2:. La morphologie cellulaire avant et après traitement CuO-NP microscopie en champ lumineux (20X) de HEK (colonne de gauche) et HEP (colonne de droite) des cellules au jour 5, cultivé dans: contrôle EMEM-1x (EMEM) (A, B ), 56% PBW non traitée + médias (C, D) et 53% PBW CuO-NP-traitée + médias (E, F) a été utilisé pour examiner la morphologie des cellules. Des cellules HEK et HEP cultivés dans le contrôle EMEM-1x (EMEM) (A, B) montrent une croissance saine, près de confluence. Des cellules HEK et HEP cultivés dans PBW non traitée + médias ont réduit le nombre et semblent détachés (C, D). Des cellules HEK et HEP cultivés dans PBW CuO-NP-traitée + médias montrent une meilleure fixation et les cellules saines, plus confluentes (E , F).
| Élément (mg / L) | Moyenne, Saint-Dev. & Importance | ||
| Avant le traitement | Après Traitement | ||
| Arsenic | 0,018 ± 0,001 | 0,002 ± 0.0 | *** |
| Sélénium | 1,8 ± 0,07 | 1,3 ± 0,05 | ** |
| Cuivre | 0,0015 ± 0,001 | 0,93 ± 0,43 | * |
| Calcium | 102 ± 82 | 106 ± 15 | |
| Strontium | 3,3 ± 1,1 | 1,5 ± 0,4 | * |
| Magnésium | 44 ± 2,1 | 47 ± 1,7 | |
| Sodium | 610 ±; 0.0 | 627 ± 27 | |
| Uranium | 0,98 ± 0,03 | 0,21 ± 0,03 | *** |
| Baryum | 0,037 ± 0,02 | 0,019 ± 0,01 | |
| Potassium | 12 ± 0,0 | 12 ± 0,8 | |
| Silicium | 12 ± 0,7 | 12 ± 0,5 | |
| Vanadium | 1,3 ± 0,07 | 0,1 ± 0,02 | *** |
| Phosphate | 0,35 ± 0,07 | 0,05 ± 0.0 | *** |
| Sulfate | 805 ± 21 | 807 ± 15 | |
| Conductivité | 3125 ± 143 | 3190 ± 62 | |
| pH | 7,31 ± 0,09 | 7,36 ± 0,05 | |
Tableau 1:. Analyse de cations et d'anions, avant et après traitement CuO-NP Moyenne élément concentrations avant et après traitement avec CuO-NP. Importance entre la concentration de NP-CuO-traitées et non traitées sont désignés comme PBW * = p <0,05, ** = p <0,01 et *** = p <0,001. Une cellule vide indique aucune différence significative. Les concentrations de chlorure ont varié entre 46,5 ± 0,707 et 55,25 ± 8.180. Aluminium, le bore, le molybdène et les concentrations étaient faibles et ne présentaient aucun changement significatif en raison de traitement CuO-NP. Concentrations de manganèse étaient pas conformes.
| Composants | % De la concentration totale | Espèce |
| Arsenic | 58,7 | HAsO 4 2- |
| 41.2 | H 2 AsO 4 - | |
| Uranium | 64,1 | Ca 2 UO 2 (CO 3) 3 (aq) |
| 32,2 | Cauo 2 (CO 3) 3 2- | |
| 0,03 | UO 2 (CO 3) 2 2- | |
| 3.5 | UO 2 (CO 3) 3 4- | |
| 0,09 | Ca 2 UO 2 (CO 3) 3 (aq) | |
| 0,02 | Cauo 2 (CO 3) 3 2- | |
| Sélénium | 94,3 | SeO 4 2- |
| 5.6 | Caseo 4 (aq) | |
| Vanadium | 2.1 | HVO 4 2- |
| 95,7 | H 2 VO 4- | |
| 2.1 | H 2 V 2 O 7 2- | |
| 0,01 | HV 2 O 7 3- | |
| 0,01 | V 4 O 12 4- |
Tableau 2: Espèces modélisation à l'aide de Visual MINTEQ ver. 3.0 du logiciel. Ver de Visual MINTEQ. 3.0 du logiciel (KTH Royal Institute of Technology, Valhallavägen, Suède) a été utilisée pour calculer la spéciation des métaux des composants de PBW énumérés dans le tableau 1. (Aq) = aqueuse par opposition à la forme solide de cette espèce.
| Contrôle EMEM | Non traitée | ||
| PBW | PBW + médias | ||
| Arsenic | 0,003 ± 0.0 | 0,017 ± 0.0 | 0,010 ± 0,001 |
| Cuivre | 0,01 ± 0.0 | 0,0015 ± 0,001 | 0,018 ± 0.0 |
| Selinium | 0,013 ± 0,002 | 1,75 ± 0,07 | 1,15 ± 0,06 |
| Uranium | 0,00015 ± 0.0 | 0,975 ± 0,03 | 0,71 ± 0,01 |
| Vanadium | 0,0015 ± 0.0 | 1,25 ± 0,07 | 0,785 ± 0,007 |
| CuO NP-traitée | |||
| PBW | PBW + médias | ||
| Arsenic | 0,0022 ± 0,001 | 0,0015 ± 0.0 | |
| Cuivre | 0,926 ± 0,4 | 0,81 ± 0.0 | |
| Selinium | 1,25 ± 0,05 | 0,855 ± 0.0.02 | |
| Uranium | 0,208 ± 0,03 | 0,45 ± 0,01 | |
| Vanadium | 0,102 ± 0,02 | 0,0795 ± 0,01 | |
Tableau 3:. Les concentrations de contaminants dans les milieux de concentration des contaminants prioritaires (mg / L) dans le contrôle EMEM-1x (EMEM), non traitée PBW, CuO-NP-traitée PBW, PBW non traitée + médias et PBW CuO-NP-traitée + médias PBW après l'ajout de composants de médias (n = 3) ont été évalués pour assurer des changements dans la concentration des contaminants dus au traitement ont été représentés dans les médias PBW + non traités et CuO-NP-traitée + médias appliquées à CELls.
| Un non traitée PBW + Médias | ||
| Les concentrations de PBW non traitée (log X) | % Viabilité (cellules HEK) | Viabilité% (cellules HEP) |
| EMEM | 100 | 100 |
| 16,5% (1.217) | 51,4 | 50,8 |
| 29% (1.462) | 39 | 33,3 |
| 44% (1,643) | 19,3 | 14,7 |
| 56% (1,748) | 14,5 | 9.4 |
| IC 50 Log [PBW] | 1.264 | 1.243 |
| B CuO-NP-traitée PBW + Médias | ||
| Les concentrations de CuO-NP-traité PBW (log X) | % Viabilité (cellules HEK) | Viabilité% (cellules HEP) |
| EMEM | 100 | 100 |
| 17% (1.230) | 86,7 | 119,8 |
| 30% (1.477) | 75,8 | 86,7 |
| 45% (1,653) | 81 | 92,4 |
| 53% (1.724) | 70,3 | 97,5 |
| IC 50 Log [PBW] | 2.744 | 5.327 |
Tableau 4: Calcul du circuit intégré 50. Le circuit intégré 50 représente la concentration de PBW non traité + CuO médias ou PBW-NP-traitées + support qui est nécessaire pour une inhibition de 50% de viabilité. La viabilité pour cent à 5 jours pour les cellules HEK et HEP exposées à des dilutions de presse non traité PBW + (A) ou CuO-NP-traitée PBW + supports (B) ont été utilisés pour calculer la concentration inhibitrice demi-maximale (CI50).
Discussion
Des études antérieures ont rapporté que CuO-IP retiré l'arsenic des eaux souterraines 11,13,30,31. Cette étude confirme ces résultats antérieurs et rapporte que CuO-IP éliminer les contaminants supplémentaires de PBW également. Cette étude confirme également que les rapports précédents CuO-IP sont efficaces pour éliminer l'arsenic, en dépit de la présence d'autres contaminants et les ions concurrents potentiels 11. la modélisation de spéciation prédit que 97% des espèces de vanadium dans PBW sont chargées négativement, ce qui permet d'adsorption sur CuO-IP, et le traitement par lots retiré 92% de vanadium.
Cette étude est la première à étudier les effets de l'élimination des contaminants spécifiques de PBW utilisant CuO-NP, et ensuite évaluer les changements dans la cytotoxicité associés à l'enlèvement. Les résultats de l'enquête démontrent que les changements dans la cytotoxicité de mélanges complexes en utilisant une approche in vitro peut être possible, mais ces méthodes ne sont pas sans limites. PBW ne pouvait pas être utilisé full force sur les cellules, en raison de survivre, les cellules cultivées exige un milieu de croissance spécifique définie et l'osmolalité. PBW + médias pourraient également ne pas être utilisés sur les cellules sans ajustement du pH. Le pH de la PBW était 7,31 et 7,36 avant traitement après cependant; l'addition de composantes de média de croissance réduit le pH à environ 6,8, en fonction de la dilution. l'ajustement du pH est une étape normale dans la préparation des milieux de culture cellulaire cependant; ajuster le pH des PBW + médias peut avoir modifié les interactions moléculaires des espèces d'éléments avec des composants de médias. Non traité et CuO-NP-traité ont été combinés avec PBW médias concentré de croissance EMEM-10X dans diverses proportions pour obtenir des solutions d'essai (+ PBW médias). L'analyse ICP-MS a été effectuée sur des supports de test pour vérifier que les concentrations de métaux significativement touchés par CuO-NP-traitement (arsenic, le cuivre, le sélénium, l'uranium, le vanadium) étaient à des concentrations attendues après dilution par des composants des médias et de l'ajustement de l'osmolalité. La diminutionen arsenic, le sélénium et le vanadium après CuO-NP-traitement se reflète dans les différences de concentration entre PBW non traitée + médias et de la PBW CuO-NP-traitée + médias. Les concentrations d'uranium sont plus élevés dans le PBW CuO-NP-traitée + médias que prévu. Les données d'ICP-MS (Tableau 1) indiquent que plus d'uranium a été éliminé au cours du traitement de PBW CuO-NP que prédit par modélisation. la modélisation de spéciation (tableau 2) prédit que à pH 7,3, seulement 35,5% des espèces d'uranium sont chargées négativement. Le modèle prédit que les principales espèces de l'uranium, du carbonate de calcium d'uranyle (UO 2 Ca 2 (CO 3) 3), est neutre.
Le retrait observé 78% de l'uranium était probablement dû à une combinaison de l'adsorption et la précipitation de l'uranium (comme un carbonate minéral uranyle de calcium). Sur la base de la modélisation géochimique, le pourcentage d'uranium éliminés par adsorption est inférieure à permettre calculée pour une concentration plus élevée dans le CuO-NPPBW -Traité + médias. Le mécanisme d'élimination de l'uranium par CuO-NP-traitement est difficile et nécessite une enquête plus approfondie. A été prévu une augmentation de la concentration de calcium, le potassium et le magnésium quand PBW a été ajouté à EMEM-10x cependant; CuO-NP-traitement n'a pas produit de changement significatif de ces éléments, donc pas de différence a été observée dans vs non traitées PBW CuO-NP-traitées + médias. La technique de combiner le réel de l'environnement avec des composants de médias a réussi à représenter les changements observés dans les concentrations d'éléments dus au traitement; Toutefois, la nature oxydée de l'PBW limitée comment les PBW + médias pourraient être apportées. Dans une tentative pour augmenter la concentration maximale des éléments de support de test, poudre milieux de culture cellulaire a été mélangé avec non traitée et CuO-NP-traitée PBW faire PBW + médias. Les médias en poudre ont souvent entraîné des précipitations de sels de calcium et il a augmenté l'osmolalité de la PBW + média qui exige une plus grande dilution avec de l'eau RO, produisant concentrations proches de ceux obtenus avec liquides 10x médias. Ces questions sont les plus susceptibles PBW spécifique en raison de son état oxydatif et peuvent ne pas être un problème avec d'autres mélanges moins sensibles.
Le test MTT a été choisi pour évaluer la cytotoxicité, car il est un dosage à haut débit standard reconnu qui évalue la santé globale des cellules en mesurant l'activité mitochondriale. Ce procédé présente des avantages et des inconvénients. Le format de 96 puits est utile pour obtenir plusieurs points de données cependant; la majorité des cellules à 5 jours étaient malsain regarder, et non plus arrondi fixé à la plaque. Les photos dans la figure 2 ont été prises avant le milieu a été retiré avec un aspirateur; aspiration hors les médias, puis en ajoutant la solution de MTT peut-être supprimé cellules seules ou détaché cellules mal adhérentes, contribuant à le plateau globale du signal de MTT après la deuxième journée vu non traité PBW. L'hypothèse est que les cellules flottantes sont morts ou mourants et oeuls les cellules attachées sont évalués en utilisant cette méthode. Il est également important de tenir compte des limites de l'analyse au MTT en ce qui concerne les études utilisant des nanoparticules.
Des études antérieures ont rapporté que, lorsqu'il est directement appliqué à des cellules en culture, les nanoparticules peuvent avoir une toxicité inhérente, au-delà de leurs propriétés chimiques de base, en fonction de leurs caractéristiques physiques uniques tels que la taille et la forme 32,33. Dans cette étude, nous ne l'appliquons CuO-IP directement sur les cellules. Au lieu de cela, les cellules ont été exposées à PBW qui avait été précédemment traité avec CuO-IP, centrifugé pour éliminer la majorité de la CuO-IP, puis filtrée deux fois pour éliminer plus CuO-IP avant la PBW a été utilisé pour préparer PBW + médias. Les résultats ont montré une augmentation de sclérose en plaques en cuivre après le traitement. Cela peut être des ions de cuivre qui ont été dissoutes à partir de nanoparticules au cours du traitement ou CuO-IP qui peuvent avoir traversé les étapes centrifugation / filtration de rester dans le PBW traitée used pour rendre le PBW + médias. CuO-IP varient en taille de 12 à 18 nm avec un BET mesurée superficie de 85 ± 1 m 2 / g, mais 11 sont connus pour agréger et basées sur l'augmentation minimale de concentrations de cuivre dans le PBW traités, la plupart du cuivre indépendamment de la source est éliminé après centrifugation et filtration. La confirmation visuelle de l'amélioration de la santé des cellules et la confluence soutenir les résultats du dosage de MTT de l'amélioration de la viabilité dus au traitement CuO-NP de l'PBW (Figure 2). Les études futures utilisant d'autres méthodes peuvent évaluer (ou caractériser) effets confondants similaires causés par CuO-IP.
Cellules de rein embryonnaire humain (HEK 293) et Human carcinome hépatocellulaire (HEP G2) ont été choisies pour les tests de toxicité. Ce sont des lignées de cellules standard qui sont cliniquement pertinente à la toxicité de l'organe de métal lourd 24,25,34-40. A faible densité d'ensemencement a été utilisé pour les dosages MTT. Les cellules ont été ensemencées à 500 cellules / puits, a permis de récupérerpendant 24 h, puis exposé au milieu d'essai. La densité de semis faible était nécessaire pour atteindre une courbe de croissance avec une phase de journal autour du jour 5, avant de devenir plus-confluentes et fixe le jour 6 ou 7. Chakraborty et al. (2010) a rapporté que dans une étude de la toxicité du cadmium sur les reins culture cellules du tubule proximal (PTC), confluence et l'état de la prolifération (prolifération vs repos) affecté la réponse à l'exposition au cadmium: cellules sous-confluentes prolifération ont montré que plus de la cytotoxicité des cellules confluentes (repos). Cellules HEP et HEK exposés à PBW à une des concentrations plus élevées (plus de confluence) similaires à celles utilisées pour d'autres test (résultats non montrés) ne pas montrer les changements dans la morphologie robustes vu avec le test MTT. Une enquête plus poussée dans les changements de cytotoxicité utilisant des lignées cellulaires non adhérentes ou protocoles qui récoltent et rassemblent toutes les cellules (par exemple, la cytométrie en flux) est nécessaire.
Une autre limitation de la méthode de MTT en nous des étudesing nanoparticules est que certains types de nanoparticules peuvent interférer avec la nutrition cellulaire. des milieux de culture de cellules contiennent typiquement des sources de protéines ajoutées, telles que le sérum bovin fœtal (FBS), pour compléter la croissance cellulaire. Des études ont montré que l'oxyde métallique nanoparticulaire peut épuiser composants importants de la croissance dans de FBS, en raison de l'augmentation de la capacité d'absorption des nanoparticules. des nanoparticules d'oxyde métallique ont été montrés pour créer un lien vers FBS par une interaction avec 41 le calcium. Selon le pH de la solution, les nanoparticules métalliques peuvent porter une charge positive ou négative. des études de cytotoxicité ont montré que les nanoparticules métalliques ajoutés à la culture cellulaire médias adsorber cations, y compris Ca 2+, puis retirez FBS / albumine sérique par la liaison du complexe NP-Ca 2+ à la sites sur les protéines dans le FBS fixation du calcium. Cela diminue la concentration de Ca 2+ et FBS dans les médias, essentiellement affamer les cellules et l'augmentation de la cytotoxicité attribué au nanoparticles 41. En outre, pré-exposition des nanoparticules à FBS / Ca 2+ revêtu les nanoparticules, en diminuant leur effet cytotoxique. Cependant, nous ne sommes pas exposer directement les médias à CuO-IP. De plus, aucune diminution significative de la concentration de Ca2 + ont été observées dans PBW après traitement avec CuO-IP, indiquant l'absence d'absorption significative de Ca2 + sur la CuO-NP eux amorçage de se lier avec le FBS. Cependant, la concentration de calcium dans le PBW est suffisamment élevée pour que la diminution induite nanoparticules peut ne pas avoir été apparent. Il est encore peu probable que le CuO-IP utilisée dans cette étude sont d'absorber de grandes quantités de calcium pendant le traitement, car il n'y avait pas de diminution de la capacité d'absorption de l'arsenic de la CuO-IP dans PBW, qui contient des niveaux élevés de calcium par rapport à des études antérieures avec eaux souterraines avec un calcium inférieure concentrations 13.
Les données démontrent que CuO-IP éliminer l'arsenic, le sélénium et le vanadium uranium, ce qui est associé à l'amélioration de la viabilité des cellules HEK et HEP dans le test MTT. Le mécanisme (s) par laquelle on améliore la viabilité n'a pas encore été déterminée, mais peut être dû à l'élimination des contaminants prioritaires par CuO-NP, parmi d'autres mécanismes. L'étude actuelle démontre également que les méthodes de culture cellulaire standard peuvent être utilisés pour évaluer l'efficacité d'une méthode de traitement de l'eau nanoparticule ISR, permettant potentiellement à un éventail d'études mécanistes être terminée, avant de passer dans les études in vivo sur les animaux plus coûteuses et chronophages . En outre, CuO-IP peut se révéler plus polyvalent pour des procédés d'extraction et pour le traitement de mélanges de métaux que les adsorbants classiques tels que les oxydes d'aluminium, de fer, de titane et de manganèse, étant donné que CuO-IP ne nécessitent pas l'ajustement du pH ou de l'oxydation de l'eau pour l'élimination de l'arsenic, et CuO-IP éliminer à la fois l'arsénite et l'arséniate en présence du phosphate de compétition anions, silicate et sulfate. Aussi, CuO-IP peut être régénéré et re-Utilisé, en réduisant les coûts de réactifs et la quantité de sous-produits de déchets passées de traitement dans le besoin de l'élimination 12.
Les limites potentielles du protocole de MTT comprennent la faible densité cellulaire au moment de l'exposition, le détachement des cellules et de la perte du signal, la famine cellulaire et une éventuelle exposition directe des cellules à CuO-NP modification MTT réactivité. La densité cellulaire et les questions de détachement pourraient être abordées en utilisant un test de remplacement tels que la cytométrie de flux, ce qui permet de plus grandes densités de semis ainsi que la collecte de toutes les cellules (à savoir, à la fois flottant et ci-joint). Des questions cellule de famine pourraient être évalués en mesurant les concentrations de facteurs de croissance dans les médias périodiquement pendant le traitement. Les travaux futurs se concentrer sur l'application de l'actuel protocole de différents tests de cytotoxicité qui traiteront si possible l'exposition modifié l'activité de dosage CuO-NP, les mesures de la famine cellulaire pendant le traitement et tester aussi la capacité de CuO-IP pour enlever contaminationnts et affectent la cytotoxicité des autres types de mélanges complexes, tels que les déchets des sites Superfund et étangs d'élimination des déchets. Ces études abordent également si les méthodes étaient robustes dans divers milieux.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We thank Dr. Roger Hopper and the Wyoming Department of Agriculture, Analytical Services Lab for the mass spectroscopy analysis of our samples. We would like to express our gratitude to the University of Wyoming, School of Pharmacy for allowing us to video this protocol in their laboratories. We would also like to thank the Theodore O. and Dorothy S. King Endowed Professorship Agreement for their graduate assistantship (SC), the University of Wyoming for the Graduate Assistantship support (JRS), and the Science Posse (NSF GK-12 Project # 084129) for the teaching fellowship (JRS). We would also like to thank Uranium One for allowing us to obtain samples and assisting us with questions. This work was supported by the School of Energy Resources, University of Wyoming.
matériels
| Name | Company | Catalog Number | Comments |
| CuCl2 | Sigma | 203149 | |
| Borosilicate glass balls | VWR | 26396-639 | 6 mm |
| Nitric Acid | Fisher | A509-P500 | Trace metal grade |
| 0.45 μm syringe filter | Fisher | SLHA 033S S | |
| 10x EMEM | Fisher | BW12-684F | |
| Fetal Bovine Serum | ATCC | 30-2020 | |
| L-glutamine | Fisher | BP379-100 | |
| NaHCO3 | Sigma | S5761 | |
| Penicillin/Streptomycin | ATCC | 30-2300 | |
| 0.22 μm vacuum filter unit | Fisher | 09-740-28C | |
| HEK293 | ATCC | CRL-1573 | |
| HEPG2 | ATCC | HB-8065 | |
| Trypsin | Sigma | SV3003101 | |
| MTT | Sigma | M2128 | |
| D-penicillamine | Fisher | ICN15180680 | |
| 96-well plates | Fisher | 07-200-92 | |
| DMSO | Fisher | D12814 | |
| Spectra Max 190 | Molecular Devices | ||
| Visual MINTEQ version 3.0 | KTH Royal Institute of Technology | ||
| ICP-MS | Agilent | Details of instruments, models and detection limits were published in Reddy et al., 2013. | |
| IC DIONEX DX 500 | Dionex | Details of instruments, models and detection limits were published in Reddy et al., 2013. | |
| VWR Incubator | VWR |
Références
- What is the status of the U.S. nuclear industry? Washington (DC): U.S. Energy Information Administration (US). , Available from: http://www.eia.gov/energy_in_brief/article/nuclear_industry.cfm (2014).
- International Energy Outlook. Washington (DC): U.S. Energy Information Administration (US). , Available from: http://www.eia.gov/forecasts/archive/ieo11/pdf/0484%282011%29.pdf (2011).
- Uranium Marketing Annual Report. Washington (DC): U.S. Energy Information Administration (US). , Available from: http://www.eia.gov/uranium/marketing/ (2014).
- Domestic Uranium Production Report. Washington (DC): U.S. Energy Information Administration (US). , Available from: http://www.eia.gov/uranium/production/annual/ (2014).
- Uranium Recovery. Washington (DC): U.S. United States Nuclear Regulatory Commission (US). , Available from: http://www.nrc.gov/materials/uranium-recovery/license-apps/ur-projects-list-public.pdf (2014).
- U.S. Uranium Reserves Estimates. Washington (DC): U.S. Energy Information Administration (US). , Available from: http://www.eia.doe.gov/cneaf/nuclear/page/reserves/ures.html (2010).
- The Future of Uranium Production in Wyoming: A Public Forum on In-Situ Recovery. Washington (DC): Meridian Institute. , Available from: http://www.uwyo.edu/ser/_files/docs/conferences/2010/uraniumforum/ser_uranium_forum_final_report.pdf (2010).
- Generic Environmental Impact Statement for In-Situ Leach Uranium Milling Facilities Washington (DC): U.S. Nuclear Regulatory commission (US). , Available from: http://www.nrc.gov/reading-rm/doc-collections/nuregs/staff/sr1910/v1/ (2012).
- Wyoming surface water quality standards. Cheyenne (WY): State of Wyoming Department of Environmental Quality (US). , Available from: http://soswy.state.wy.us/Rules/RULES/6547.pdf (2011).
- Qu, X., Alvarez, P., Li, Q. Applications of nanotechnology in water and wastewater treatment. Water Research. 47 (12), 3931-3946 (2013).
- Martinson, C., Reddy, K. Adsorption of arsenic(III) and arsenic(V) by cupric oxide nanoparticles. Journal of Colloid and Interface Science. 336 (2), 401-411 (2009).
- Reddy, K., McDonald, K., King, H. A novel arsenic removal process for water using cupric oxide nanoparticles. Journal of Colloid and Interface Science. 397, 96-102 (2013).
- Reddy, K., Roth, T. Arsenic Removal from Natural Groundwater Using Cupric Oxide. Ground Water. 51 (1), 83-91 (2012).
- Zhang, G., Ren, Z., Zhang, X., Chen, J. Nanostructured iron(III)-copper(II) binary oxide: a novel adsorbent for enhanced arsenic removal from aqueous solutions. Water Research. 47 (12), 4022-4031 (2013).
- Ali, I. New generation adsorbents for water treatment. Chemical Reviews. 112 (10), 5073-5091 (2012).
- Zhang, Q. CuO nanostructures: Synthesis, characterization, growth mechanisms, fundamental properties, and applications. Progress in Materials Science. 60, 208-337 (2014).
- Schmidt, C. TOX 21: new dimensions of toxicity testing. Environmental health perspectives. 117 (8), 348-353 (2009).
- Firestone, M., Kavlock, R., Zenick, H., Kramer, M. The U.S. Environmental Protection Agency Strategic Plan for Evaluating the Toxicity of Chemicals. Journal of Toxicology and Environmental Health, Part B. 13 (2-4), 139-162 (2010).
- Guidance Manual for the Assessment of Joint Toxic Action of Chemical Mixtures [Internet]. Atlanta (GA); Agency for Toxic Substance and Disease Registry (US). , Available from: http://www.atsdr.cdc.gov/interactionprofiles/IP-ga/ipga.pdf (2014).
- Bae, D., Gennings, C., Carter, W., Yang, R., Campain, J. Toxicological interactions among arsenic, cadmium, chromium, and lead in human keratinocytes. Toxicological Sciences: An Official Journal of the Society of Toxicology. 63 (1), 132-142 (2001).
- Whittaker, M. Exposure to Pb, Cd, and As mixtures potentiates the production of oxidative stress precursors: 30-day, 90-day, and 180-day drinking water studies in rats. Toxicology and Applied Pharmacology. 254 (2), 154-166 (2011).
- Schilz, J. Investigating the ability of cupric oxide nanoparticles to adsorb metal contaminants from uranium in-situ recovery (ISR) production bleed water and assessing the associated changes in cytotoxicity. , University of Wyoming. Laramie, WY. Available from: ProQuest UMI, Ann Arbor, MI (2014).
- Manual of Standard Operating Procedures for Sample Collection and Analysis. Cheyenne (WY): Wyoming Department of Environmental Quality (US). , Available from: http://deq.state.wy.us/wqd/watershed/downloads/qa/4-1089.pdf (2011).
- Florea, A., Splettstoesser, F., Büsselberg, D. Arsenic trioxide (As2O3) induced calcium signals and cytotoxicity in two human cell lines SY-5Y neuroblastoma and 293 embryonic kidney (HEK). Toxicology and Applied Pharmacology. 220 (3), 292-301 (2007).
- Mao, W. Cadmium induces apoptosis in human embryonic kidney (HEK) 293 cells by caspase-dependent and -independent pathways acting on mitochondria. Toxicology in Vitro. 21 (3), 343-354 (2007).
- Tchounwou, P., Yedjou, C., Patlolla, A., Sutton, D. Heavy Metal Toxicity and the Environment. Molecular, Clinical and Environmental Toxicology. 101, 133-164 (2012).
- Meerloo, J., Kaspers, G., Cloos, J. Cell Sensitivity Assays: The MTT Assay. Cancer Cell Culture. 731, 237-245 (2011).
- Gustafsson, J. Visual MINTEQ. , Royal Institute of Technology. Stockholm, Sweden. (2010).
- Hallab, N., Caicedo, M., McAllister, K., Skipor, A., Amstutz, H., Jacobs, J. Asymptomatic prospective and retrospective cohorts with metal-on-metal hip arthroplasty indicate acquired lymphocyte reactivity varies with metal ion levels on a group basis. Journal of Orthopaedic Research. 31 (2), 173-182 (2013).
- Goswami, A., Raul, P., Purkait, M. Arsenic adsorption using copper (II) oxide nanoparticles. Chemical Engineering Research and Design. 90 (9), 1387-1396 (2011).
- Pillewan, P., Mukherjee, S., Roychowdhury, T., Das, S., Bansiwal, A., Rayalu, S. Removal of As(III) and As(V) from water by copper oxide incorporated mesoporous alumina. Journal of Hazardous Materials. 186 (1), 367-375 (2011).
- Kroll, A. Cytotoxicity screening of 23 engineered nanomaterials using a test matrix of ten cell lines and three different assays. Particle and fibre toxicology. 8 (9), 1-19 (2011).
- Fahmy, B., Cormier, S. Copper oxide nanoparticles induce oxidative stress and cytotoxicity in airway epithelial cells. Toxicology in vitro: an international journal published in association with BIBRA. 23 (7), 1365-1371 (2009).
- Radike, M. Distribution and accumulation of a mixture of arsenic, cadmium, chromium, nickel and vanadium in mouse small intestin, kidney, pancreas, and femur following oral administration in water or feed. Journal of Toxicology and Environmental Health, Part A. 65 (23), 2029-2052 (2002).
- Barbier, O., Jacquillet, G., Tauc, M., Cougnon, M., Poujeol, P. Effect of heavy metals on, and handling by, the kidney. Nephron. Physiology. 99 (4), 105-110 (2005).
- Zheng, X., Watts, G., Vaught, S., Gandolfi, A. Low-level arsenite induced gene expression in HEK293 cells. Toxicology. 187 (1), 39-48 (2003).
- Li, Z., Piao, F., Liu, S., Wang, Y., Qu, S. Subchronic exposure to arsenic trioxide-induced oxidative DNA damage in kidney tissue of mice. Experimental and Toxicologic Pathology. 62 (5), 543-547 (2010).
- Farombi, E., Akintunde, J., Nzute, N., Adedara, I., Arojojoye, O. Municipal landfill leachate induces hepatotoxicity and oxidative stress in rats. Toxicology and Industrial Health. 28 (6), 532-541 (2011).
- Das, N. Arsenic exposure through drinking water increases the risk of liver and cardiovascular diseases in the population of West Bengal. India. BMC public health. 12 (1), 639-648 (2012).
- Valko, M., Morris, H., Cronin, M. Metals, toxicity and oxidative stress. Current Medicinal Chemistry. 12 (10), 1161-1208 (2005).
- Horie, M. Protein Adsorption of Ultrafine Metal Oxide and Its Influence on Cytotoxicity toward Cultured Cells. Chemical Research in Toxicology. 22 (3), 543-553 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon