Method Article
L'étude des interactions de
Dans cet article
Résumé
Nous présentons les méthodes pour étudier l'effet du PSM et d'autres toxines sécrétées par Staphylococcus aureus Sur les neutrophiles en utilisant la cytométrie en flux et la microscopie de fluorescence.
Résumé
Nous présentons les méthodes pour étudier l'effet de modulins solubles phénol (PSM) et d'autres toxines produites et sécrétées par Staphylococcus aureus sur les neutrophiles. Pour étudier les effets des MPS sur les neutrophiles nous isolons neutrophiles frais en utilisant un gradient de densité centrifugation. Ces neutrophiles sont chargées avec un colorant fluorescent qui lors de la mobilisation du calcium. L'activation des neutrophiles par les MSP lance une augmentation rapide et transitoire de la concentration de calcium intracellulaire libre. Dans une expérience de cytométrie en flux cette mobilisation rapide peut être mesurée en surveillant la fluorescence d'un colorant pré-chargé qui réagit à l'augmentation de la concentration de Ca 2 + libre. En utilisant cette méthode, nous pouvons déterminer la concentration de PSM nécessaire d'activer le neutrophiles, et de mesurer les effets des inhibiteurs spécifiques et générales de l'activation des neutrophiles.
Pour étudier l'expression des MPS dans l'espace intracellulaire, we ont construit fusions rapporteurs du promoteur de l'opéron PSMα à la GFP. Lorsque ces souches rapporteuses de S. aureus sont phagocytés par les neutrophiles, l'induction de l'expression peut être observée en utilisant la microscopie à fluorescence.
Introduction
Neutrophiles (PMN) sont des phagocytes professionnels qui jouent un rôle clé dans la réponse immunitaire innée contre le Staphylococcus aureus 1. La bataille constante entre l'hôte et microbe a conduit à une course aux armements des deux. Récemment, la communauté-associés souches (CA) de résistant à la méticilline S. aureus (MRSA) ont vu le jour qui semble être très efficace dans la neutralisation des neutrophiles meurtre 2,3. Modulin (PSM), la production soluble phénol excessif de CA-MRSA a été associée avec une plus grande virulence 4,5. Neutrophiles humains peuvent reconnaître ces PSM via FPR2 qui conduisent à l'activation de cette protéine-G récepteur couplé à 6. Un des premiers événements est la mobilisation des réserves intracellulaires de calcium (Ca 2 +). Ca 2 + agit comme un messager secondaire pour une variété de fonctions effectrices des PMN dont la dégranulation et la phagocytose 7. Par conséquent Ca 2 + est un indicateur très sensible de lala capacité fonctionnelle du PSM pour activer PMN. Pour étudier les effets de PSM sur les neutrophiles, les neutrophiles frais sont isolées et chargées avec un colorant fluorescent qui lors de la mobilisation du calcium. Dans une expérience de cytométrie en flux cette mobilisation rapide peut être mesurée. En utilisant cette méthode, il est possible d'étudier les effets directs des composants toxiques et d'autres sur les neutrophiles, et de déterminer la concentration minimale à laquelle ceux-ci sont actifs. Pour nous, c'est un outil très utile pour étudier l'effet de nombreuses protéines produites par S. aureus impliquée dans l'évasion immunitaire, comme FPR2 protéine inhibitrice (FlipR) 8, FlipR-like 7 et Chemotaxis protéine inhibitrice de Staphylococcus aureus (CHIPS) 9. Toutes ces protéines ont été montré pour empêcher la mobilisation du calcium dans les neutrophiles en se liant au récepteur reconnaissant l'agoniste.
Récemment, notre groupe a indiqué que les MSP sont fonctionnellement inhibés par les lipoprotéines du sérum 10 </ Sup>. Ces lipoprotéines sont abondamment présents dans le sang et les tissus humains, ce qui indique que les MSP exercent leur fonction principalement dans le milieu intracellulaire. La disponibilité du test de mobilisation du calcium permis de mesurer précisément l'effet des lipoprotéines du sérum sur l'activation des neutrophiles par les PSM, indiquée par l'inhibition considérable par de très faibles concentrations de sérum.
Depuis les PSM sont fonctionnellement inhibée par le sérum, nous avons émis l'hypothèse qu'il existe une fonction importante pour PSM que les toxines intracellulaires. Nous avons donc cherché à déterminer le rôle de PSM après phagocytose. Pour étudier l'expression des MPS dans l'espace intercellulaire, nous avons construit des fusions rapporteurs du promoteur de l'opéron psmα à la GFP. Lorsque ces souches rapporteuses de S. aureus ont été phagocytés par les neutrophiles, l'induction de l'expression était observable en utilisant la microscopie à fluorescence 10. Évidemment, cette technique permet l'étude de l'expression d'un grand nombre de gènes de S. aureus ou d'autres agents pathogènes après phagocytose. Étant donné que pour S. aureus survivre dans la niche intercellulaire est très important pour surmonter le système immunitaire inné 11 10 12, étudier le rôle des gènes activés dans ce créneau est très pertinente pour la compréhension de sa virulence.
Protocole
1. Isolation des PMN du sang humain par centrifugation par densité
- Dessinez 5 9 tubes ml de sang veineux hépariné.
- Préparer double couche gradients Ficoll (4 gradients de 5 tubes de sang), comme suit: verser 12 ml d'une solution de ficoll de densité 1,119 g / ml dans un tube de 50 ml et la couche soigneusement 10 ml d'une solution de ficoll de densité 1,077 g / ml sur le dessus.
- Diluer le sang avec un volume égal de PBS.
- La couche de sang dilué avec soin sur la couche double gradient Ficoll; 20-25 ml par gradient.
- Centrifuger 20 min à 396 x g dans un rotor à godets oscillants, 22 ° C sans freinage.
- Préparer RPMI froid contenant 0,05% de l'albumine sérique humaine (RPMI-HSA). Préparez aussi 9 ml stérile déminéralisée H 2 O. Pré-cool à la fois le RPMI et H 2 O sur la glace.
- Aspirer la couche de Ficoll supérieure contenant le plasma (de couleur jaune) et des PBMC, et la seconde couche de Ficoll (couleur blanche) avec l'utilisation d'une pompe à vide (mettre une pointe de pipette stérile surla pipette).
- Recueillir les PMN en tubes de 50 ml à l'aide d'une petite pipette en plastique (1 Tube pour les fractions de PMN tous les 2 gradients), et les placer sur la glace.
- Ajouter froid RPMI-HSA pour un volume total de 50 ml et centrifuger pendant 10 min à 249 xg à 4 ° C.
- Enlever le surnageant à l'aide d'une pompe à vide et le culot vortex doucement (érythrocytes et PMN).
- Ajouter 9 ml stérile déminéralisée H 2 O et lancer le chronomètre. Arrêter le choc osmotique hyper après 30 secondes exactement, en ajoutant 1 ml 10 fois concentré PBS. Note: le 30 sec sont très critiques.
- Ajouter froid RPMI-HSA pour un volume total de 50 ml et centrifuger pendant 10 min à 249 xg à 4 ° C.
- Enlever le surnageant à l'aide d'une pompe à vide et de recueillir le PMN culot dans 1 tube avec un volume défini (2.1 ml) de milieu RPMI-HSA.
- Déterminer la quantité de cellules et ajuster la concentration de 1.10 7 cellules / ml. Selon le donateur, le rendement du PMN isolés sont betweFR 5 x 10 6 et 3 x 10 7 PMN de chaque tube 9 ml de sang
2. Débit Assay Cytometric pour l'évaluation de la mobilisation de calcium dans PMN humains
- Les cellules de charge (5 x 10 6 cellules / ml) avec 2uM Fluo-3-AM dans RPMI-HSA et incuber pendant 20 min à température ambiante bascule lentement, en utilisant par exemple une plate-forme à bascule shaker, à l'abri de la lumière.
- En attendant préparer une dilution en série (par exemple 3 fois) du stimulus à 10x la concentration finale. PSMα3 est utilisé dans ce protocole, mais tout stimulus de GPCR qui agit sur les neutrophiles est approprié.
- Préparer inhibiteur concentré 10x du récepteur dans RPMI-HSA. Lorsque l'inhibiteur agit sur la stimulation (par exemple HDL sur PSMα3) pré-incuber 25 stimulus ul avec un volume égal d'inhibiteur pendant 10 min à température ambiante.
- Laver les cellules en ajoutant 10 ml de RPMI-HSA et centrifugeuse pour 249 g à température ambiante. Remettre les cellules à 5 x10 6 cellules / ml.
- Juste avant l'expérience, diluer les cellules à 2x10 6 cellules / ml dans du RPMI-HSA et ajouter 200 pi de cellules par tube FACS. PMN dilué sont très fragiles. Les garder trop longtemps à cette concentration va conduire à l'activation automatique; la même chose pour secouer vigoureusement ou pipetage.
- Attachez le tube à la cytométrie en flux, attendre 3 secondes et lancer l'acquisition. Après une période de temps fixe (par exemple 8 sec), enlever le tube et ajouter rapidement 50 stimulus ul de l'échantillon. Immédiatement ré-attacher le tube sur le porte-échantillon et de continuer l'acquisition.
- Commencez par le bas et à la fin avec la plus forte concentration de stimulus. Laver l'aiguille de cytomètre de flux régulièrement après chaque course avec RPMI-HSA.
- Analyser des données avec le logiciel d'analyse de cytométrie en flux. Comparer le signal de fluorescence moyenne avant l'ajout du stimulus pour que, après plus de stimulus et d'utiliser les contrôles positifs et négatifs appropriés pour calculer l'acrésistance à la vation mesurée pour chaque dilution.
En variante lorsque l'inhibiteur agit sur les récepteurs de pré-incuber les cellules avec l'inhibiteur.
3. Analyse par microscopie de fluorescence de la GFP bactéries expression après phagocytose par les PMN
- Croître S. souches de Staphylococcus contenant une construction reporter d'intérêt pendant la nuit dans un bouillon (avec des antibiotiques lorsque cela est nécessaire pour maintenir le plasmide rapporteur). Dans ce cas, la souche de MW2 contenant une construction rapporteur GFP PSMα 10 est utilisé, cultivées dans un tube en matière plastique de 50 ml avec 5 ml de milieu de culture LB.
- Pour supprimer tous GFP de l'expression O / N, diluer les cultures à OD 660 0,01 croître et à OD 660 0.1. Redilute ce 1h30 de culture, et de surveiller la croissance jusqu'à ce que la culture atteint une DO660 de 0,1. Recueillir les bactéries par centrifugation et les laver une fois dans DPBS. Reprendre en 1h10 du volume initial pour obtenir une DO 660 de 1,0 ou roughly 5.10 8 ufc / ml.
- Mélanger les bactéries (1.10 7 / ml) avec PMN fraîchement isolés (1.10 6 / ml) dans du RPMI-HSA (10:1) dans un microtube de 1,5 ml et ajouter le sérum humain mis en commun à une concentration finale de 10%. Secouez sur une plate-forme agitation pendant 10 min à 37 ° C pour stimuler la phagocytose. Diluer les PMN chargées de bactéries à 5.10 5 PN / ml et pipette 250 ul dans un puits d'une lamelle bien chambré 8.
- Image PMN avec des bactéries sur un microscope. Un microscope inversé équipé d'un objectif NA 40X/0.85 fonctionne bien et ne doit être enfermé dans une chambre à environnement sombre pour maintenir l'environnement de manière stable à 37 ° C. Acquérir les images pour un certain nombre de positions prédéfinies à l'aide de la caméra toutes les 5-10 min à la fois dans le champ lumineux et le canal GFP de suivre la production de GFP dans le temps.
Résultats
Débit test de cytométrie pour l'évaluation de la mobilisation du calcium dans les PMN humains
Incuber des neutrophiles avec une série de concentrations de PSMα3 synthétiques résultant en une activation rapide, tel que mesuré par le flux de calcium, qui est représenté par une augmentation du signal dans FL-1. La pré-incubation de synthèse PSMα3 avec 0,01%, 0,1% ou 1% de sérum humain inhibé de manière significative la capacité de susciter des flux de calcium (Figure 1).
Analyse de l'expression de la GFP dans des bactéries après la phagocytose par les PMN utilisant la microscopie à fluorescence
Bactéries phagocytées contenant un journaliste PSMα-GFP construire 10 start à fluorescence verte entre 1 et 2 heures après la phagocytose, indiquant expression à partir du promoteur PSMα. Les bactéries en dehors des neutrophiles ne fluorescence, ou montrent une fluorescence seulement après que les bactéries extracellulaires ont formé microcolonies denses (figure 2). Cesdonnées indiquent que l'expression de PSMα est rapidement activé lorsque les bactéries sont phagocytés par les PMN.
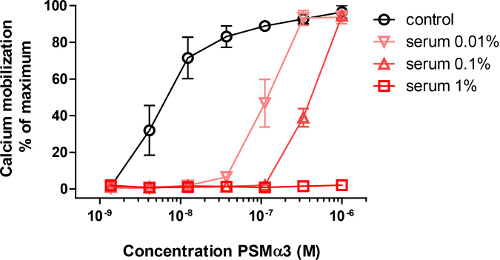
Figure 1. L'activation des neutrophiles par PSMα3. D'activation des neutrophiles par une gamme de concentration de PSMα3, telle que mesurée par la mobilisation du calcium. Lorsque de très faibles quantités de sérum sont ajoutés l'activation des neutrophiles est inhibée, et à 1% de sérum guère activation est visible à ces PSMα3 concentrations (Adapté de la référence 10).

Figure 2. L'induction de l'expression de PSMα après phagocytose.Les neutrophiles ont été autorisés à phagocyter S. aureus contenant une construction rapporteur du promoteur du PSMα fusionnée à la GFP. Environ 1 heure après le début de la phagocytose des bactéries intracellulaires commencent à fluorescence verte, expression indiquant le PSM α opéron, alors que les bactéries en dehors des neutrophiles (#) n'induisent pas l'expression de α de PSM dans ce délai (Adapté de la référence 10).

Figure 3. modèle schématique des expériences réalisées. neutrophiles ont été isolées et incubées avec des MSP pour mesurer l'effet de l'activation de ces petites hélices amphipathiques dans un essai de mobilisation du calcium. Lorsque le sérum a été ajouté, les PSM ont été neutralisés et non plus les neutrophiles activés. Pour étudier l'EXPRE intracellulairession des MPS, une souche contenant une fusion du promoteur de PSMα-GFP a été mélangé avec du sérum et les neutrophiles pour permettre la phagocytose. Expression de la GFP a été suivie en utilisant time-lapse microscopie à fluorescence. Cliquez ici pour agrandir la figure .
Discussion
Dans les procédés décrits ici quelques étapes sont très critiques. Nous allons mettre en évidence ces ici.
Pour l'isolement des neutrophiles par centrifugation en gradient de densité, il est important de ne pas perturber les couches pendant ou après les étapes de centrifugation. Lors de l'aspiration des neutrophiles à l'aide d'une pipette en plastique, assurez-vous de ne pas presser le ballon alors que dans la couche de cellules, comme éjecter un liquide va perturber les couches. En outre, inspecter visuellement le culot de neutrophiles après le choc osmotique et l'étape de centrifugation. Si la pastille est toujours rouge la lyse des érythrocytes n'était pas assez efficace, et doit être répété une fois de plus. Si cela se produit régulièrement, augmenter le temps d'incubation avec déminéralisée H 2 O par jusqu'à cinq secondes pour obtenir une lyse des érythrocytes plus complète.
Pour la méthode de mobilisation du calcium, il est important d'avoir des neutrophiles qui sont isolés frais. Généralement, les cellules qui ont été stockés dans le réfrigérateur pouro longtemps ne répond pas aussi bien. Ils pourraient soit avoir activé provoquant déjà une diminution de l'effet du stimulus supplémentaire, ou sont morts et ne répondent pas du tout. Forte agrégation des neutrophiles est un signe qu'ils ne sont pas plus frais et doivent être jetés.
Dans la configuration de microscopie plusieurs choses sont importantes. Pour être en mesure d'observer une augmentation de la GFP dans les bactéries, il est nécessaire que la protéine GFP très stable est retiré de la bactérie par plusieurs étapes de dilution et de la croissance dans des conditions où le gène d'intérêt est exprimé à un niveau très bas, voire pas du tous. Dans notre cas, comme l'opéron psmα est exprimé à de fortes densités cellulaires 13, deux étapes répétées de dilution avant que les cellules atteignent la phase semi-log sont suffisants. Aussi pour ces expériences, il est préférable que les neutrophiles sont fraîches, surtout depuis que vous pourriez vouloir les suivre pendant plusieurs heures dans le microscope. Ajout de l'iodure de propidium (PI) à la RPMITampon HSA permettra la visualisation de la rupture de la membrane des neutrophiles par l'expression des MPS. Quand PI est ajouté, assurez-vous que les filtres appropriés sont disponibles dans le microscope de sorte que le rouge fluorescence PI n'interfère pas avec le vert fluorescence de la GFP. Surtout lorsque vous utilisez des filtres passe-longues pour GFP, la PI va certainement intervenir. Une autre option intéressante est d'utiliser plusieurs reporters fluorescents dans les bactéries, comme une intégration chromosomique du PCP couplé avec un journaliste GFP, ce qui permettrait un suivi de toutes les bactéries en utilisant la microscopie confocale, où il est difficile de voir les bactéries non étiquetés. Toujours en grande microscopie à fluorescence sur le terrain à l'aide de plusieurs étiquettes présente des avantages évidents. Un inconvénient de l'utilisation des reporters fluorescents stables comme nous l'avons fait, c'est leur stabilité. Le chiffre d'affaires très lente de la protéine GFP permet de contrôler seulement de l'interrupteur du journaliste, l'interrupteur d'arrêt ne peut pas être visualisées facilement. Pour celui-ci aurait besoin d'utiliser l'IETses constructions GFP instables, ou d'utiliser un système d'expression de luminescence alimenté par exemple par l'opéron lux 14.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
RN a été partiellement financée par une bourse Marie subventions Re-Curie d'intégration européens (ERG) du septième programme-cadre de la Communauté européenne, le numéro de projet 268324.
matériels
| Name | Company | Catalog Number | Comments |
| Fluo-3, AM | Molecular Probes / Life Technologies | F-1241 | |
| Ficoll-Paque | GE Healthcare | 17-5442-03 | density 1.077 g/ml |
| Histopaque | Sigma | 11191 | density 1.119 g/ml |
| RPMI 1640 | Gibco, Life Technologies | 52400-025 | contains 25 mM HEPES and L-glutamine |
| Leica TCS SP5 microscope | Leica Microsystems, The Netherlands | TCS SP5 | objective: HCX PL APO 40x/0.85 |
| FACSCalibur | BD Biosciences | FACSCalibur | Very important that the tube can be removed and replaced during the measurement process |
Références
- Rigby, K. M., DeLeo, F. R. Neutrophils in innate host defense against Staphylococcus aureus infections. Semin. Immunopathol. 34, 237-259 (2012).
- Voyich, J. M., et al. Insights into Mechanisms Used by Staphylococcus aureus to Avoid Destruction by Human Neutrophils. The Journal of Immunology. 175, 3907-3919 (2005).
- Kobayashi, S. D., et al. Rapid neutrophil destruction following phagocytosis of Staphylococcus aureus. J. Innate Immun. 2, 560-575 (2010).
- DeLeo, F. R., Otto, M., Kreiswirth, B. N., Chambers, H. F. Community-associated meticillin-resistant Staphylococcus aureus. The Lancet. 375, 1557(2010).
- David, M. Z., Daum, R. S. Community-Associated Methicillin-Resistant Staphylococcus aureus: Epidemiology and Clinical Consequences of an Emerging Epidemic. Clinical Microbiology Reviews. 23, 616-687 (2010).
- Kretschmer, D., et al. Human Formyl Peptide Receptor 2 Senses Highly Pathogenic Staphylococcus aureus. Cell Host & Microbe. 7, 463(2010).
- Prat, C., et al. A homolog of formyl peptide receptor-like 1 (FPRL1) inhibitor from Staphylococcus aureus (FPRL1 inhibitory protein) that inhibits FPRL1 and FPR. J. Immunol. 183, 6569-6578 (2009).
- Prat, C., Bestebroer, J., de Haas, C. J. C., van Strijp, J. A. G., van Kessel, K. P. M. A New Staphylococcal Anti-Inflammatory Protein That Antagonizes the Formyl Peptide Receptor-Like 1. The Journal of Immunology. 177, 8017-8026 (2006).
- de Haas, C. J., et al. Chemotaxis inhibitory protein of Staphylococcus aureus, a bacterial antiinflammatory agent. The Journal of Experimental Medicine. 199, 687-695 (2004).
- Surewaard, B. G. J., et al. Inactivation of Staphylococcal Phenol Soluble Modulins by Serum Lipoprotein Particles. PLoS Pathog. 8, e1002606(2012).
- Kubica, M., et al. A Potential New Pathway for Staphylococcus aureus Dissemination: The Silent Survival of S. aureus Phagocytosed by Human Monocyte-Derived Macrophages. PLoS ONE. 3, e1409(2008).
- Surewaard, B. G. J., et al. Staphylococcal alpha-phenol soluble modulins contribute to neutrophil lysis after phagocytosis. Cellular Microbiology. , In Press (2013).
- Queck, S. Y., et al. RNAIII-Independent Target Gene Control by the agr Quorum-Sensing System: Insight into the Evolution of Virulence Regulation in Staphylococcus aureus. Molecular Cell. 32, 150(2008).
- Baban, C. K., et al. Bioluminescent Bacterial Imaging In Vivo. J. Vis. Exp. (69), e4318(2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon