Method Article
El estudio de las interacciones de
En este artículo
Resumen
Se presentan métodos para estudiar el efecto de las MEP y otras toxinas secretadas por Staphylococcus aureus En los neutrófilos usando citometría de flujo y microscopía de fluorescencia.
Resumen
Se presentan métodos para estudiar el efecto de modulinas solubles en fenol (PSM) y otras toxinas producidas y secretadas por Staphylococcus aureus en los neutrófilos. Para estudiar los efectos de los PSM en los neutrófilos que aislamos neutrófilos frescos utilizando centrifugación en gradiente de densidad. Estos neutrófilos se cargan con un medio de contraste que emite fluorescencia en la movilización del calcio. La activación de los neutrófilos por las MEP inicia un aumento rápido y transitorio en la concentración de calcio libre intracelular. En un experimento de citometría de flujo de esta rápida movilización se puede medir mediante el control de la fluorescencia de un colorante pre-cargado que reacciona con el aumento de la concentración de Ca2 + libre. Con este método se puede determinar la concentración PSM necesario activar los neutrófilos, y medir los efectos de los inhibidores específicos y generales de la activación de los neutrófilos.
Para investigar la expresión de los PSM en el espacio intracelular, we han construido fusiones reportero del promotor del operón PSMα a GFP. Cuando estos reportero cepas de S. aureus son fagocitadas por los neutrófilos, la inducción de la expresión se puede observar mediante microscopía de fluorescencia.
Introducción
Los neutrófilos (PMNs) son fagocitos profesionales que juegan un papel clave en la respuesta inmune innata contra Staphylococcus aureus 1. La batalla constante entre el huésped y microbio ha llevado a una carrera de armamentos de ambos. Recientemente, cepas relacionadas con la comunidad (CA) de la meticilina resistente S. aureus (MRSA) se han comprobado que parece ser muy eficiente en la elusión de los neutrófilos muerte 2,3. Modulina (MEP) soluble en fenol producción excesiva de CA-MRSA se ha asociado con una mayor virulencia 4,5. Los neutrófilos humanos pueden reconocer estos MEP a través de FPR2 que conducen a la activación de esta proteína G-receptor acoplado a 6. Uno de los acontecimientos más tempranos es la movilización de las reservas intracelulares de calcio (Ca2 +). Ca 2 + actúa como un segundo mensajero para una variedad de funciones efectoras de los PMN incluyendo la desgranulación y la fagocitosis 7. Por lo tanto Ca 2 + es un indicador muy sensible de lacapacidad funcional de las MEP para activar PMNs. Para estudiar los efectos de las MEP sobre los neutrófilos, los neutrófilos frescas se aíslan y se cargan con un medio de contraste que emite fluorescencia en la movilización del calcio. En un experimento de citometría de flujo de esta rápida movilización se puede medir. El uso de este método, es posible estudiar los efectos directos de los componentes tóxicos y otro sobre los neutrófilos, y determinar la concentración más baja a la que éstos están activos. Para nosotros, es una herramienta muy útil para estudiar el efecto de muchas proteínas producidas por S. aureus implicado en la evasión inmune, como FPR2 proteína inhibidora (FLIPR) 8, FLIPR-like 7 y quimiotaxis proteína inhibidora de Staphylococcus aureus (CHIPS) 9. Todas estas proteínas se ha demostrado que inhiben la movilización de calcio en los neutrófilos por la unión al receptor que reconoce el agonista.
Recientemente, nuestro grupo ha descrito que las MEP son funcionalmente inhibidos por las lipoproteínas séricas de 10 </ Sup>. Estas lipoproteínas son abundantemente presente dentro de la sangre y el tejido humano, lo que indica que las MEP ejercen su función principalmente en el medio ambiente intracelular. La disponibilidad del ensayo de movilización de calcio nos permitió medir precisamente el efecto de las lipoproteínas séricas en la activación de neutrófilos por los MEP, indicado por la considerable inhibición por concentraciones muy bajas de suero.
Dado que los MEP están funcionalmente inhibidos por el suero, la hipótesis de que hay una función importante para las MEP como las toxinas intracelulares. Por lo tanto, trató de determinar el papel de las MEP después de la fagocitosis. Para investigar la expresión de los PSM en el espacio intercelular, hemos construido fusiones reportero del promotor del operón psmα a GFP. Cuando estos reportero cepas de S. aureus fueron fagocitadas por los neutrófilos, la inducción de la expresión se observa mediante microscopía de fluorescencia 10. Obviamente, esta technique permite el estudio de la expresión de un gran número de genes en S. aureus u otros patógenos después de la fagocitosis. Dado que para S. aureus sobrevivir en el nicho intercelular es muy importante para superar el sistema inmune innato 11 10 12, el estudio del papel de los genes activados en este nicho es altamente relevante para la comprensión de su virulencia.
Protocolo
1. Aislamiento de PMN de sangre humana mediante centrifugación de densidad
- Dibuja 5 9 tubos ml de sangre venosa heparinizada.
- Preparar de doble capa de gradientes de Ficoll (4 gradientes para 5 tubos de sangre) de la siguiente manera: Verter 12 ml de una densidad de 1,119 g / ml de solución de Ficoll en un tubo de 50 ml y cuidadosamente capa de 10 ml de una densidad de 1,077 g / ml de solución de Ficoll en la parte superior.
- Diluir la sangre con un volumen igual de PBS.
- Capa de la sangre diluida con cuidado en el gradiente de Ficoll de doble capa; 20-25 ml por gradiente.
- Centrifugar 20 minutos a 396 xg en un rotor de cubeta oscilante, 22 ° C sin frenado.
- Preparar RPMI frío que contiene 0,05% albúmina de suero humano (RPMI-HSA). También hay que preparar 9 ml estéril desionizada H 2 O. Pre-cool tanto el RPMI y H 2 O en el hielo.
- Aspirar la capa de Ficoll superior que contiene el plasma (de color amarillo) y PBMC, y la segunda capa de Ficoll (color blanco) con el uso de una bomba de vacío (poner una punta de pipeta estéril enla pipeta).
- Recoge los PMNs en tubos de 50 ml con una pequeña pipeta de plástico (1 tubo para las fracciones PMN de cada 2 gradientes), y colocarlos en hielo.
- Añadir frío RPMI-HSA para un volumen total de 50 ml y centrifugar durante 10 min a 249 xga 4 ° C.
- Retirar el sobrenadante con el uso de una bomba de vacío y agitar suavemente el sedimento (eritrocitos y PMN).
- Añadir 9 ml estéril desionizada H 2 O e iniciar el temporizador. Detener el choque osmótico hiper después de 30 segundos exactamente, mediante la adición de 1 ml de PBS concentrada 10 veces. Nota: El 30 sec son muy críticos.
- Añadir frío RPMI-HSA para un volumen total de 50 ml y centrifugar durante 10 min a 249 xga 4 ° C.
- Retirar el sobrenadante con el uso de una bomba de vacío y se recoge el precipitado en 1 PMN tubo con un volumen definido (1-2 ml) de RPMI-HSA.
- Determinar la cantidad de células y ajustar la concentración a 1,10 7 células / ml. Dependiendo del donante, el rendimiento de PMNs aislados serán los que betwees 5 x 10 6 y 3 x 10 7 PMNs de cada tubo de 9 ml de sangre
2. Ensayo de citometría de flujo para la evaluación de la movilización de calcio en los PMN humanos
- Las celdas de carga (5 x 10 6 células / ml) con 2 mM Fluo-3 AM en RPMI-HSA y se incuba durante 20 minutos a temperatura ambiente balanceo lentamente, utilizando por ejemplo, un agitador de plataforma oscilante, protegido de la luz.
- Mientras tanto preparar una dilución en serie (por ejemplo, 3 veces) del estímulo a 10x la concentración final. PSMα3 se utiliza en este protocolo, sin embargo cualquier estímulo GPCR que actúa sobre los neutrófilos es adecuado.
- Preparar inhibidor de concentrado 10x del receptor en RPMI-HSA. Cuando el inhibidor actúa sobre el estímulo (por ejemplo HDL en PSMα3) pre-incubar 25 l estímulo con un volumen igual de inhibidor durante 10 minutos a temperatura ambiente.
- Lavar las células mediante la adición de 10 ml de medio RPMI-HSA y centrifugar durante 249 x g a temperatura ambiente. Resuspender las células a 5 x10 6 células / ml.
- Justo antes del experimento, diluir las células a 2x10 6 células / ml en medio RPMI-HSA y añadir 200 células l por tubo de FACS. PMNs diluidas son muy frágiles. Mantenerlos demasiado tiempo a esta concentración dará lugar a la activación automática, y lo mismo ocurre con agitación vigorosa o pipeta.
- Conecte el tubo a la citometría de flujo, espere 3 segundos y comenzar la adquisición. Después de un período de tiempo fijo (por ejemplo, 8 segundos), quitar el tubo y añadir rápidamente 50 l de estímulo a la muestra. Inmediatamente vuelva a colocar el tubo en el soporte de la muestra y continuar con la adquisición.
- Comience con el extremo más bajo y con la mayor concentración de estímulo. Lave la aguja citómetro de flujo regular después de cada carrera con RPMI-HSA.
- Analizar los datos con el software de análisis de citometría de flujo. Comparar la señal de fluorescencia promedio antes de la adición del estímulo para que después de la adición del estímulo y el uso de los controles positivos y negativos apropiados para calcular la corriente alternafuerza tivación para cada dilución medido.
Alternativamente, cuando el inhibidor actúa sobre los receptores de pre-incubar las células con el inhibidor.
3. Análisis de microscopía de fluorescencia de las bacterias Expresión de GFP después de la fagocitosis por los PMN
- Crecer S. Aureus cepas que contienen un constructo indicador de interés durante la noche en caldo (con antibióticos cuando sea necesario para mantener el plásmido reportero). En este caso cepa MW2 contiene un PSMα constructo indicador de GFP se utiliza 10, crecido en un tubo de plástico de 50 ml con 5 ml de medio de cultivo LB.
- Para eliminar todas las buenas prácticas agrarias de la expresión O / N, diluir las culturas para OD 660 0.01 y crecer a OD 660 de 0,1. Redilute la 01:30 la cultura y controlar el crecimiento hasta que el cultivo alcanza un 660 OD de 0,1. Recoge las bacterias por centrifugación y se lava una vez en DPBS. Resuspender en 1:10 del volumen original para obtener un OD 660 de 1,0 o roughly 5,10 8 UFC / ml.
- Mezclar las bacterias (1.10 7 / ml) con PMN recién aislados (1.10 6 / ml) en medio RPMI-HSA (relación 10:01) en un microtubo de 1,5 ml y añadir suero humano agrupado a una concentración final de 10%. Agitar en una plataforma de agitación durante 10 min a 37 ° C para estimular la fagocitosis. Diluir los PMNs cargados de bacterias a 5.10 5 PMN / ml y pipeta de 250 l en un pozo de un 8 bien calibrada cubreobjetos.
- Imagen de los PMN con bacterias en el microscopio. Un microscopio invertido equipado con un objetivo NA 40X/0.85 funciona bien y debe ser encerrado en una cámara de ambiente oscuro para mantener el medio ambiente de manera estable a 37 ° C. Adquirir imágenes para un número de posiciones predeterminadas utilizando la cámara cada 5-10 minutos, tanto en el campo brillante y el canal de GFP para seguir la producción de GFP en el tiempo.
Resultados
Ensayo de citometría de flujo para la evaluación de la movilización de calcio en los PMN humanos
La incubación de los neutrófilos con una serie de concentración de PSMα3 sintéticos resultantes en la activación rápida tal como se mide por el flujo de calcio, que se muestra por un aumento en la señal en FL-1. Pre-incubación de PSMα3 sintético con 0,01%, 0,1% o 1% de suero humano inhibió significativamente la capacidad para obtener los flujos de calcio (Figura 1).
Análisis de la expresión de GFP en las bacterias después de la fagocitosis por los PMN utilizando microscopía de fluorescencia
Bacterias fagocitadas que contienen un reportero PSMα-GFP construir 10 inicio de fluorescencia verde entre 1 y 2 horas después de la fagocitosis, lo que indica la expresión del promotor PSMα. Las bacterias fuera de los neutrófilos no emiten fluorescencia, o muestran fluorescencia sólo después de las bacterias extracelulares se han formado microcolonias densos (Figura 2). Estoslos datos indican que la expresión de PSMα se conmuta rápidamente en cuando las bacterias son fagocitadas por los PMN.
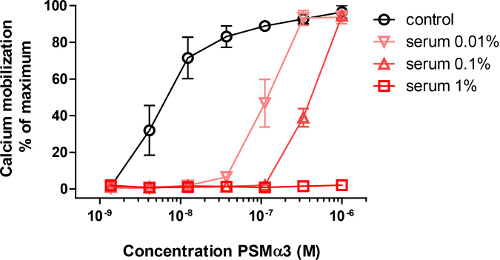
Figura 1. La activación de neutrófilos por PSMα3. Activación de los neutrófilos por un intervalo de concentración de PSMα3, medida por la movilización de calcio. Cuando se añaden cantidades muy bajas de suero se inhibe la activación de neutrófilos, y en el 1% de suero de casi cualquier activación es visible en estos PSMα3 concentraciones (Adaptado de referencia 10).

Figura 2. La inducción de la expresión de PSMα después de la fagocitosis.Los neutrófilos se permitió que fagocitan S. aureus que contiene un constructo indicador del promotor de PSMα fusionado a GFP. Aproximadamente 1 hora después del inicio de la fagocitosis de las bacterias intracelulares comienzan a fluorescencia verde, lo que indica la expresión del operón psm α, mientras que las bacterias fuera de los neutrófilos (#) no inducen la expresión α psm en este período de tiempo (Adaptado de la referencia 10).

Figura 3. Modelo esquemático de los experimentos llevados a cabo. Los neutrófilos se aislaron y se incubaron con las MEP para medir el efecto de activación de estas pequeñas hélices anfipáticas en un ensayo de movilización de calcio. Cuando se añadió el suero, los PSM se neutralizaron y ya no activan los neutrófilos. Para estudiar la expre intracelularsi ó n de las MEP, una cepa que contiene una fusión de la PSMα-promotor a GFP se mezcló con suero y neutrófilos para permitir la fagocitosis. GFP expresión fue seguido utilizando time-lapse microscopía de fluorescencia. Haz clic aquí para ver más grande la figura .
Discusión
En los métodos descritos aquí algunos pasos son muy críticos. Vamos a destacar estas aquí.
Para el aislamiento de neutrófilos por centrifugación en gradiente de densidad es importante no perturbar las capas durante o después de las etapas de centrifugación. Al aspirar los neutrófilos utilizando una pipeta de plástico, asegúrese de no apretar el globo, mientras que en la capa de células, como inyectar líquido perturbará las capas. Además, inspeccione visualmente el sedimento de neutrófilos después del choque osmótico y la centrifugación. Si el sedimento es rojo todavía la lisis de los eritrocitos no era lo suficientemente eficaz, y se debe repetir una vez más. Si esto sucede con regularidad, aumentar el tiempo de incubación con H2O desionizada hasta en cinco segundos para obtener una lisis de los eritrocitos más completa.
Para el método de la movilización del calcio es importante tener los neutrófilos que están aislados frescos. Generalmente, las células que se han almacenado en la nevera ao largo no responderá también. O bien podrían haber activado ya que causa una disminución en el efecto del estímulo añadido, o han muerto y no responder en absoluto. Fuerte agregación de neutrófilos es una señal de que no son frescos ya y deben desecharse.
En la configuración de la microscopía varias cosas que son importantes. Para ser capaz de observar un aumento de GFP dentro de la bacteria, es necesario que la proteína GFP altamente estable se elimina de las bacterias por varias etapas de dilución y el crecimiento bajo condiciones en las que el gen de interés se expresa a un nivel muy bajo o no en todo. En nuestro caso, como el operón psmα se expresa a altas densidades de células 13, dos pasos de dilución repetidas antes de que las células alcanzan la fase logarítmica media son suficientes. También para estos experimentos, lo mejor es que los neutrófilos son frescos, sobre todo porque es posible que desee seguir durante varias horas en el microscopio. Adición de yoduro de propidio (PI) para el medio RPMITampón-HSA permitir la visualización de la ruptura de la membrana de neutrófilos por la expresión de los MEP. Cuando se añade PI, asegurarse de que los filtros adecuados están disponibles en el microscopio por lo que el rojo fluorescencia de PI no interfiere con la fluorescencia de GFP verde. Especialmente cuando se utilizan filtros de paso largo para GFP, la IP definitivamente interferir. Otra opción interesante es el uso de múltiples reporteros fluorescentes en las bacterias, tales como la integración cromosómica de PPC junto con un indicador de GFP, lo que permitiría la monitorización de todas las bacterias utilizando microscopía confocal, donde es difícil ver las bacterias no marcadas. También en el amplio campo de microscopía de fluorescencia utilizando varias etiquetas tiene claras ventajas. Un inconveniente de la utilización de los reporteros fluorescentes estables como hemos hecho es su estabilidad. El volumen de negocios muy lenta de la proteína GFP sólo permite el seguimiento del interruptor ON del reportero, el interruptor no se puede visualizar fácilmente. Para esto tendría que usar eitsus construcciones GFP inestables, o utilizar un sistema de expresión de luminiscencia accionado por ejemplo, el operón lux 14.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
RN fue parcialmente financiado por una Marie Curie Becas Re-integración europeas (ERG) del Séptimo Programa Marco de la Comunidad Europea, el número de proyecto 268324.
Materiales
| Name | Company | Catalog Number | Comments |
| Fluo-3, AM | Molecular Probes / Life Technologies | F-1241 | |
| Ficoll-Paque | GE Healthcare | 17-5442-03 | density 1.077 g/ml |
| Histopaque | Sigma | 11191 | density 1.119 g/ml |
| RPMI 1640 | Gibco, Life Technologies | 52400-025 | contains 25 mM HEPES and L-glutamine |
| Leica TCS SP5 microscope | Leica Microsystems, The Netherlands | TCS SP5 | objective: HCX PL APO 40x/0.85 |
| FACSCalibur | BD Biosciences | FACSCalibur | Very important that the tube can be removed and replaced during the measurement process |
Referencias
- Rigby, K. M., DeLeo, F. R. Neutrophils in innate host defense against Staphylococcus aureus infections. Semin. Immunopathol. 34, 237-259 (2012).
- Voyich, J. M., et al. Insights into Mechanisms Used by Staphylococcus aureus to Avoid Destruction by Human Neutrophils. The Journal of Immunology. 175, 3907-3919 (2005).
- Kobayashi, S. D., et al. Rapid neutrophil destruction following phagocytosis of Staphylococcus aureus. J. Innate Immun. 2, 560-575 (2010).
- DeLeo, F. R., Otto, M., Kreiswirth, B. N., Chambers, H. F. Community-associated meticillin-resistant Staphylococcus aureus. The Lancet. 375, 1557(2010).
- David, M. Z., Daum, R. S. Community-Associated Methicillin-Resistant Staphylococcus aureus: Epidemiology and Clinical Consequences of an Emerging Epidemic. Clinical Microbiology Reviews. 23, 616-687 (2010).
- Kretschmer, D., et al. Human Formyl Peptide Receptor 2 Senses Highly Pathogenic Staphylococcus aureus. Cell Host & Microbe. 7, 463(2010).
- Prat, C., et al. A homolog of formyl peptide receptor-like 1 (FPRL1) inhibitor from Staphylococcus aureus (FPRL1 inhibitory protein) that inhibits FPRL1 and FPR. J. Immunol. 183, 6569-6578 (2009).
- Prat, C., Bestebroer, J., de Haas, C. J. C., van Strijp, J. A. G., van Kessel, K. P. M. A New Staphylococcal Anti-Inflammatory Protein That Antagonizes the Formyl Peptide Receptor-Like 1. The Journal of Immunology. 177, 8017-8026 (2006).
- de Haas, C. J., et al. Chemotaxis inhibitory protein of Staphylococcus aureus, a bacterial antiinflammatory agent. The Journal of Experimental Medicine. 199, 687-695 (2004).
- Surewaard, B. G. J., et al. Inactivation of Staphylococcal Phenol Soluble Modulins by Serum Lipoprotein Particles. PLoS Pathog. 8, e1002606(2012).
- Kubica, M., et al. A Potential New Pathway for Staphylococcus aureus Dissemination: The Silent Survival of S. aureus Phagocytosed by Human Monocyte-Derived Macrophages. PLoS ONE. 3, e1409(2008).
- Surewaard, B. G. J., et al. Staphylococcal alpha-phenol soluble modulins contribute to neutrophil lysis after phagocytosis. Cellular Microbiology. , In Press (2013).
- Queck, S. Y., et al. RNAIII-Independent Target Gene Control by the agr Quorum-Sensing System: Insight into the Evolution of Virulence Regulation in Staphylococcus aureus. Molecular Cell. 32, 150(2008).
- Baban, C. K., et al. Bioluminescent Bacterial Imaging In Vivo. J. Vis. Exp. (69), e4318(2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados