Method Article
Radioactif In situ D'hybridation pour détecter divers profils d'expression génique dans les tissus
Dans cet article
Résumé
Ce protocole est utilisé avec succès pour détecter quantitativement les niveaux et les schémas spatiaux de l'expression des ARNm de multiples types de tissus à travers les espèces de vertébrés. La méthode peut détecter des transcrits de faible abondance et permet de traiter des centaines de diapositives simultanément. Nous présentons ce protocole en utilisant le profil d'expression de la formation du cerveau embryonnaire aviaire comme un exemple.
Résumé
Connaissant le calendrier, le niveau, la localisation cellulaire, et le type de cellules qu'un gène est exprimé dans contribue à notre compréhension de la fonction du gène. Chacune de ces fonctionnalités peut être accompli avec l'hybridation in situ d'ARNm dans les cellules. Nous présentons ici une méthode radioactive dans l'hybridation in situ modifié à partir de Clayton et al. (1988) 1 qui a été travaillé avec succès dans notre laboratoire depuis de nombreuses années, en particulier pour les adultes cerveaux vertébrés 2-5. Les longues complémentaires ARN (ARNc) sondes à la séquence cible permet la détection de transcrits de faible abondance 6,7. Incorporation de nucléotides radioactifs dans les sondes d'ARNc permet en outre la sensibilité de détection de transcrits de faible abondance et des analyses quantitatives, soit sensible à la lumière par un film radiographique ou recouverte d'une émulsion sur le tissu. Ces méthodes de détection de fournir un enregistrement de longue durée de l'expression du gène cible. Par rapport à la sonde non radioactive méthods, comme DIG-étiquetage, la méthode d'hybridation sonde radioactive ne nécessite pas d'amplification des mesures multiples en utilisant HRP-anticorps et / ou TSA kit pour détecter des transcrits de faible abondance. Par conséquent, cette méthode fournit une relation linéaire entre l'intensité du signal et des quantités d'ARNm ciblés pour l'analyse quantitative. Il permet de traiter simultanément les diapositives 100-200. Il fonctionne bien pour les différents stades de développement d'embryons. La plupart des études de développement de l'expression des gènes utiliser des embryons entiers et non-radioactifs approches 8,9, en partie parce que les tissus embryonnaires est plus fragile que le tissu adulte, avec moins de cohésion entre les cellules, ce qui rend difficile de voir les frontières entre les populations de cellules avec des coupes de tissus. En revanche, notre approche radioactifs, en raison de la plus grande plage de sensibilité, est en mesure d'obtenir un contraste plus élevé dans la résolution de l'expression génique entre les régions des tissus, ce qui rend plus facile à voir les limites entre les populations. En utilisant cette méthode, les chercheurs pourraient révéler lasignification possible d'un gène nouvellement identifié, et en outre prédire la fonction du gène d'intérêt.
Protocole
1. Préparation des tissus
- Récolter des tissus frais. Pour les embryons aviaires, ouvrir avec précaution les œufs et nettoyer l'embryon dans un plat avec 1xPBS, deux fois. Pour les cerveaux adultes, enlever rapidement le cerveau et laver délicatement avec 1 x PBS.
- Intégrer les embryons ou le cerveau des adultes dans un moule intégré complet de l'OCT Tissue Tek, orienter le tissu selon les besoins pour la découpe, et congeler rapidement le bloc en le plaçant dans un mélange d'éthanol et de la glace sèche, en faisant attention de ne pas obtenir le mélange à l'intérieur du bloc .
- Trancher l'échantillon congelé dans un cryostat en 10-12 um sections épaisses. Pour tissu cérébral et embryonnaires, la meilleure tempérée de coupe est dans la gamme de -18 ° C à -20 ° C.
- Monter les coupes congelées sur des lames de verre Super Plus.
- Conserver les sections dans une boîte à lames à -80 ° C.
2. Génération de ribosondes radioactifs (Utilisez les procédures de radioprotection de votre établissement)
- Générer un DN purifié linéaireUn gabarit de ton ADNc d'intérêt soit par enzyme de restriction de résumé d'un fragment cloné entourée par des sites promotrice d'ARN polymérase à partir d'un ADN plasmidique ou par PCR de l'insert fixé à des sites de liaison promotrice d'ARN polymérase. Il est également possible de générer des fragments de PCR avec les promoteurs d'ARN polymérase dans le cadre de la 3 'et 5' des amorces de PCR. Gels purifiez vos restreintes ou PCR des fragments générés avec le kit de purification sur gel Geneclean.
- Pour un tube de 0,5 ml Eppendorf, ajouter 0,5 à 1 ug de matrice d'ADN purifié linéaire, tampon de transcription, la TNT, RNasin, solution AGC mélange de nucléotides, et RNase eau pour amener le volume à la quantité désirée. Ensuite, ajoutez S 35-UTP et l'ARN polymerase appropriée pour faire soit des ribosondes antisens ou sens.
- Incuber le mélange pendant 1 heure dans un bain à 37 ° C. Ajouter une autre partie aliquote de l'ARN polymérase et incuber pendant une autre de 1 h.
- Ajouter la solution d'acétate de sodium 3M (0,1 fois du volume total) et 100% (2,5 fo EtOHld du volume total) dans le tube Eppendorf pour précipiter l'ARN synthétisé ribosonde.
- Incuber dans la glace sèche ou -80 ° C pendant 15 min ou plus de 3 heures pour aider les précipitations.
- Culot d'ARN par centrifugation à 4 ° C et 15.000 tpm dans une centrifugeuse de table Eppendorf pendant 30 min.
- Retirer le surnageant et laver le culot avec de l'EtOH 70%, tapoter avec le doigt pour mélanger le culot bien.
- Culot d'ARN à nouveau par centrifugation à 4 ° C et 15000 tours par minute pendant 30 min.
- Eliminer le surnageant complètement par un pipetage, puis ajouter 40 ul solution d'hybridation. Mélangez bien par pipetage et de sortie.
- Mettre 1 ul de la solution dans 3 ml de sécurité-Solve solution dans le flacon à scintillation, bien mélanger, et de mesurer les chefs d'accusation dans le compteur à scintillation.
- Placez le Eppendorf avec la ribosonde à -20 ° C pour une utilisation dans une semaine.
3. Traitement des tissus
- Dans une hotte, préparer une nouvelle PBS tamponnée paraformaldehy 4%Solution de d'environ 3-5 ° C supérieure à la température ambiante. Placer les lames de -80 ° C de stockage dans un rack en métal sur la glace sèche, procéder à l'espace de travail sous le capot, puis placez le support dans la solution de paraformaldéhyde à 4%, et incuber pendant 5 min à température ambiante.
- Laver 3 fois en 1 x PBS environ 15 plonge chacun (environ 1 seconde par immersion).
- Dans la hotte, assurez-tampon acétylation et agiter vigoureusement pendant 10 secondes. Verser immédiatement dans un bac contenant le support de diapositives et incuber pendant 10 min, afin de réduire la liaison de fond de la ribosonde.
- Rincer 3 fois en 2 x SSPE pendant 15 trempettes.
- Déshydrater dans 70%, 95% et 100% de série EtOH pendant 2 min à chaque étape (ne pas être dans la hotte).
- Sécher les lames sous le capot pendant au moins 10-15 minutes.
4. Hybridation
- Calculer la quantité de ribosonde (0,5-1x10 6 cpm par diapositive) et une solution d'hybridation (100 pi par diapositive) nécessaire pour toutes les diapositives. Prewarm le mélange ribosonde-hybridation à 65 ° C pendant 5 min pour dénaturer la ribosonde.
- Pipeter 100 pi de ribosonde-hybridation en solution dans une ligne à travers la diapositive, et d'utiliser une lamelle de verre pour le répartir uniformément sur le tissu et la lamelle. Lieu glisse horizontalement, face verticale dans un rack en métal et placez le porte lentement debout dans le bain d'huile à 65 ° C pendant un minimum de 4 heures et un maximum de 16 heures. L'huile crée un joint étanche à l'air autour des lamelles.
- Retirer les grilles métalliques du bain d'huile et essuyez l'excédent d'huile autour de la galerie avec du papier absorbant.
- Laver l'huile à partir des diapositives couverts et support en métal dans des plateaux en verre ou en métal contenant le chloroforme, deux fois. Le 2 ème chloroforme de lavage peut être utilisé comme le premier pour la prochaine expérience.
- Transférer la crémaillère avec toboggans couverts dans un bac avec de 0,1% β-mercaptoéthanol solution + 2 x SSPE et monter et descendre pendant quelques trempettes de desserrer quelques lamelles et retirez l'excès dissoudre l'hybridation des solutionstion.
- Transférer la crémaillère avec toboggans couverts dans une solution fraîche de 0,1% β-mercaptoéthanol + 2 x SSPE, puis retirez les lamelles avec une pince RNase libres en solution pour éviter de rayer les coupes de tissus. Transférer les lames à découvert dans crémaillère frais dans un plateau pour lames porte-support horizontal, dans une solution de 0,1% β-mercaptoéthanol dans 2 x SSPE.
- Incuber le rack avec des diapositives dans le frais de 0,1% β-mercaptoéthanol + 2 x SSPE solution à température ambiante pendant 1 heure pour éliminer l'excès de sonde d'ARN non lié. Rejeter cette et les solutions de lavage aqueuses précédentes, ainsi que les lamelles, en tant que déchets radioactifs.
- Transférer la crémaillère avec des diapositives à une solution préchauffée 2x SSPE à 65 ° C, ajouter β-mercaptoéthanol à une finale de concentration de 0,1%, et incuber à 65 ° C pendant 1 heure. Jeter les déchets radioactifs.
- Transfert et incuber le rack avec des toboggans à deux reprises en préchauffé SPPE 0,1 x à 65 ° C pendant 30 min à chaque fois. La quantité de radioactivité éliminécette étape est très petit et n'est plus considéré comme excessif des déchets radioactifs après cette étape.
- Déshydrater le rack et lames dans 70%, 95% et EtOH 100% pour 2 min chacun.
- Sécher les lames dans la hotte pendant au moins 30 min.
5. Visualisation des signaux radioactifs
- Placez les diapositives secs dans une cassette de film et dans une pièce sombre, placez le film x-ray (Kodak BioMax MR film) au cours des diapositives, et de fermer la cassette. Assurez-vous que les lames sont en face du côté émulsion du film x-ray. Exposer les diapositives pour ~ 1-7 jours en fonction de l'abondance prévue des transcriptions.
- Développer le film x-ray dans le révélateur et le fixateur norme. Le signal d'hybridation apparaît comme noir (exposée grains d'argent dans l'émulsion) sur le film (Fig. 1).
- (Facultatif) Pour déterminer la résolution du signal cellulaire et voir sur le tissu, les diapositives doivent être plongées dans une émulsion photographique et contre-.Si vous allez éventuellement recolorer au crésyl violet, puis delipidize sections par incubation dans du xylène pendant 5 min à température ambiante à deux reprises, réhydrater 1 min de chaque dans 100%, 100%, 95%, 95%, 70%, et 50% EtOH puis dans de l'eau désionisée. Si vous n'allez pas à la tache avec un colorant qui ne nécessite pas délipidation, puis délipidation n'est pas nécessaire. Bien sécher les diapositives sous une hotte pendant au moins 2-3 heures.
- Dans la chambre noire en utilisant une lumière sûre, évider assez Kodak NTB émulsion pour couvrir la moitié de la longueur de la lame (c.-à-tissu) dans un récipient en verre trempé, et puis fondre dans un bain d'eau à 42 ° C pendant 20-30 min. Puis le diluer avec de l'eau distillée pour un rapport de 1:1. Le niveau de l'émulsion doit maintenant couvrir toutes les sections sur une diapositive lorsque la lame est trempée dans l'. Si vous avez un grand nombre de diapositives, vous devrez peut-être préparer des émulsions supplémentaire.
- Tremper les lames dans l'émulsion diluée dans le 42 ° C et bain d'eau à sec diapositives de croisement dans un récipient fermé étanche la lumière overnight dans la chambre noire, ou dans un four à 37 ° C pendant 2-3 heures, avec les feux éteints.
- Transférer les lames dans les fentes supports dans des boîtes noires contenant des dessiccateurs, en faisant attention pour les diapositives de ne pas toucher les uns les autres et donc créer des artefacts. Sceller les bords des boîtes avec du ruban électrique noir lentement pour éviter les étincelles de lumière statique induits puis envelopper les boîtes en aluminium. Rangez les boîtes à 4 ° C à partir de plusieurs jours à plusieurs semaines (signal de 1 jour sur x-ray film est semblable à 5 jours sous émulsion).
- Réchauffez les boîtes de lames à la température ambiante pendant 1 heure.
- Dans la chambre noire, enlever la grille avec des diapositives (ou placer les lames dans un châssis métallique si vous utilisez des boîtes avec des fentes de diapositives) dans les boîtes et de les développer dans le Kodak D-19 développeur à 16 ° C pendant 3,5 min.
- Laver les lames développés dans l'eau du robinet à température ambiante pendant 1 min.
- Incuber les lames à deux reprises dans du fixateur à 19 ° C pendant 6 min de chaque. Les lumières peuvent être mis en marche lors de l'incubation de fixateur seconde.
- Laver les lames à l'eau courante à température ambiante pendant au moins 30 min et gratter l'émulsion de la face arrière de la lame tout en «humide» avec une lame de rasoir pour éviter de rayer le verre.
- Taches sur les tissus au crésyl violet 0,3% dans l'eau du robinet pendant 5 min.
- Laver supplémentaire solution violet de crésyl dans l'eau fraîche du robinet pendant ~ 15 trempettes.
- Déshydrater les lames pour ~ 15 plonge dans chaque solution d'alcool: 50%, 70%, 95%, 95%, 100% et 100% EtOH.
- Incuber les lames dans du xylène pendant 5 min à température ambiante à deux reprises.
- Lamelle avec un milieu de Permount sur la lame et sécher la lame recouverte dans la hotte du jour au lendemain (> 16 h), il faudra plusieurs jours avant que la colle est suffisamment robuste pour nettoyer les diapositives plus loin.
6. Générer des images couleur fond noir
- Si nécessaire, en outre propre émulsion en excès à l'arrière des lames (non coversliped côté sans tissu) en le mouillage avec de l'eau et de raclage avec une lame de rasoir.
- Rincer les lames avec une solution EtOH 80% et essuyez 1-2 fois doucement pour se débarrasser des débris et la poussière.
- Prenez des photos sous fond noir ou fond clair illumination. Étapes 6.2 et 6.3 peut être répétée 2-3 fois afin d'obtenir de bonnes images sans quelques particules de poussière, qui sont facilement visibles dans les fond noir sous une loupe binoculaire.
7. Les résultats représentatifs
La ya deux façons principales de l'affichage dans les résultats d'hybridation in situ sur des coupes de tissus hybridées avec des sondes radioactives S 35: 1) x-ray du film qui a été placé sur les diapositives ou les 2) émulsion qui a été enduite sur les diapositives. Une troisième approche est l'utilisation d'un écran placé au-dessus phosphorimager les diapositives, mais nous n'avons pas été satisfaits de la résolution de cette approche. X-ray des films de fournir un résultat rapide et analyses de l'état général de l'hybridation. Le film x-ray de données révèle également une large résolution anatomique et peut être utilisé pour analys quantitativesest de 10. Exemples d'images de films x-ray de la fin des têtes d'embryons aviaires hybridées avec des sondes antisens pour FOXP1 et CoupTF2 l'expression des gènes se trouvent dans les figures 1A et B. Les deux gènes sont très abondants dans les subdivisions spécifiques du cerveau. Un résultat de bonne qualité du film x-ray devrait être un dièse (non floue) et ont un rapport signal-à-bruit de fond. Un image floue peut être en raison du contact inégale entre un film de rayons X et la lame de verre avec le tissu hybridée.
Pour lames d'émulsion de croisement, l'émulsion contient des sels d'argent sensibles lumière enduite sur le tissu, par opposition à être sur la matière plastique du film à rayons X. Pendant le développement, les 35-S sels d'argent exposés sont convertis en grains d'argent métallique, de façon similaire dans le film à rayons X. Toutefois, les dépôts d'argent sont directement visibles sur les cellules représentant l'expression des gènes qui peuvent être observés et mesurés qualitativement sous un microscope. Les grains d'argent métalliques bloquer la lumière directe par le biaiset apparaissent comme des points noirs sous vue en fond clair. Le contre violet de crésyl apparaît de couleur pourpre (figure 3A, 3C, et Fig. 4). Dans fond noir, les grains d'argent réfléchir la lumière provenant du côté et apparaissent comme des points blancs (figure 1C, 1D, 3B, 3D). Dans cette situation, le violet de crésyl tache apparaît de couleur rouge. En clair, le signal d'hybridation est plus facile à voir à fort grossissement avec une résolution cellulaire, alors que dans fond noir, en plus, le signal d'hybridation peuvent être consultés sous faible grossissement sur l'ensemble du tissu. Le point de vue sur fond noir est l'approche que nous utilisent couramment pour montrer le modèle gène globale expression. Cependant, par rapport au résultat rapide obtenu à partir de films radiographiques, les diapositives d'émulsion de croisement prend plus de temps (une à plusieurs semaines) et est plus sensible à l'obtention d'arrière-plan.
Il existe quatre sources communes de solides antécédents: 1) Contexte partout dans le film x-ray est généralement faire pourdes problèmes avec le révélateur ou de fixateur, ou un film partiellement exposé; 2) Informations générales sur les lames de verre est généralement dû à des problèmes avec la préparation des lames de verre ou de lavage, comme silination abusif des diapositives à partir de la source commerciale ou d'auto-préparés; 3) Emulsion l'exposition et le contexte de développement, et 4) d'information sur la section due à un manque d'étapes de lavage soigneux post-hybridation, trop faible d'une température d'hybridation, la mauvaise qualité de la solution d'hybridation, la contamination du paraformaldéhyde en laver la vaisselle causant des sondes de façon permanente réticuler à la dégradation des tissus ribosonde, conduisant à de petites molécules d'étiquetage du tissu non-spécifiquement, DTT ou inactif β-mercaptoéthanol dans de réticulation résultant de S-35 ARN sondes dans di-sulfure liaisons à du tissu, et d'attente trop long pour l'acétylation. Il est essentiel d'avoir les diapositives de la solution acétylation en quelques secondes de mélange de l'anhydride acétique et de la triéthanolamine. Si plusieurs minutes withou passert d'ajouter la solution à des diapositives, puis des groupes acétyle ne sera pas éliminée de manière efficace et ensuite lier à l'ARN non-spécifique. D'autres facteurs comprennent l'hybridation de plus de 20 heures, ce qui peut générer trop forte d'un signal, et des gouttelettes d'huile en excès sur les diapositives, qui séquestrent une solution d'hybridation sur les diapositives pendant la lessive, traduit par des taches radioactives sur le tissu et glisse de donner des signaux de fond sombre. Si vous travaillez avec de nombreuses diapositives (plus de 100 tranches), ajouter un 3 e chloroforme laver ou changer les lavages au chloroforme, pour empêcher les particules d'huile en excès de rester sur les diapositives. Le traitement des tissus Careless, c.-à-pas de gel assez rapidement (dans les 5-10 minutes après dissection) ou de la décongélation et la recongélation augmente également de fond dû à l'ARNm de dégradation. Veillez à ne pas confondre fond pour une exposition plus.
Pour le fond d'émulsion sur les lames de croisement est possible parce qu'il est très sensible à la lumière et nécessite une exposition à long dans l'obscurité. Com problèmes de fond communs comprennent trop élevée de la température pour le révélateur et le fixateur. Lorsque la température est supérieure à 19 ° C, à proximité ou plus chaud que la température ambiante, plus de fond d'argent à grains est obtenue. L'exposition à de faibles niveaux de lumière qui s'infiltre dans une chambre noire fera fond émulsion. Non lavage fixateur suffisamment longtemps (au moins 30 min dans de l'eau courante), laisse le fixateur qui réagit ensuite avec le violet de crésyl pour générer un précipité brun à travers l'émulsion. Toutefois, si les lames sont lavées dans de l'eau plus de 90 min après la fixation avant la coloration violet de crésyl, cela peut provoquer l'émulsion de devenir lâches et les sections pour colorer mal. S'il n'y a pas assez de temps pour colorer les lames dans une fenêtre de 30-90 min après la fixation et le lavage, après le lavage 30 min, sécher les lames du jour au lendemain et de procéder à la coloration violet de crésyl le lendemain. En règle générale, la plupart des ARNm ont spécifiques profils d'expression génique, alors que le signal de fond est plus uniforme.
e_content "> tissus plié pourrait induire en erreur pour les résultats d'expression génique sur film radiographique, conduisant à une région plus sombre du signal. Pour déterminer si le tissu est plié, d'examiner non-sections colorées en fond noir ou violet de crésyl sections colorées en fond clair. crésyl Une contre violette fournit une meilleure façon d'examiner l'état des tissus.Pour une meilleure interprétation de la spécificité de la sonde, sondes de détection de contrôle doit être appliqué sur plusieurs sections adjacentes. La plupart des sondes de détection ne montrent pas un signal, mais certains le font, et quand ils le font, nous constatons qu'il est souvent différente de celle du signal antisens. Nous croyons que cela pourrait être lié à antisens de synthèse ou un autre gène sur le brin antisens du génome. Nous présentons un exemple Pax6 sens et antisens sondes (Fig. 2A et B). Le brin antisens révèle l'étiquetage le long de la zone ventriculaire du cerveau antérieur, le cervelet et les yeux comme prévu (Fig. 2A), mais le sens révèle laBeling dans la couche pigmentaire de la rétine (fig. 2B).
Pour les tailles de sonde, nous utilisons des sondes d'ADNc n'importe où dans la gamme des 300-5000 bps. Sondes à moins de 300 points de base de travail, mais les signaux sont généralement plus faibles. Nous n'avons pas essayé les sondes plus grandes de 5000 bps. Il est préférable d'utiliser des sondes sur le tissu de la même espèce, si possible. Si non, nous contre-s'hybrider sondes sur des sections d'autres espèces et à diminuer l'hybridation et de lavage des températures 3-5 ° C par incréments basés sur une identité de séquence, si elle est connue. S'il n'est pas connu, puis nous effectuons une hybridation essais et erreurs et se laver les températures. Si la température est abaissée trop, la sonde d'ADNc peut contre-s'hybrider avec des ARNm d'autres séquences similaires entre les espèces ou dans les mêmes espèces 11. Dans la pratique, nous constatons que des ADNc qui sont ~ 95% identique ou supérieure à la cible ARNm dans le tissu, l'hybridation strictes et la température de lavage (65 ° C) les conditions qui fonctionne bien. Pour les séquences qui sont dans le ranges de ~ 85 à 94% identiques, l'hybridation et la température de lavage peut être nécessaire de réduire de l'ordre de ~ 50 à 60 ° C.
La raison pour utiliser un support en métal dans la plupart des étapes est l'utilisation de lavages au chloroforme et le xylène. Les deux composés organiques fondent de nombreux types de plastiques. Verre et certains types de plastiques sont résistants à ces matières organiques. Mais le verre est plus facile à briser, et certains plastiques que dans un premier temps sont résistantes va fondre sur de longues périodes d'exposition à des matières organiques.

Figure 1. Autoradiographie des images d'hybridation in situ à partir de x-ray films et diapositives émulsion de croisement. (AB) X-ray du film des images de coupes sagittales tête entière de l'oiseau chanteur diamant mandarin à jour embryonnaire 10, hybridé avec ribosondes antisens (A) FOXP1 ou (B) CoupTF2, prises avec un éclairage en fond clair sous une loupe binoculaire. Noir, grains exposés dans le film montrant l'ARNm expresseionique. Échelle = 500 um. (CD) Emulsion plongé images diapositives de coupes sagittales tête entière de le diamant mandarin au poste trappe de jour 6, hybridées avec ribosondes antisens à (C) FOXP1 et (D) CoupTF2, prises avec un éclairage sur fond noir sous un microscope à dissection. Blanc, exposée grains d'argent dans l'émulsion ci-dessus montrant l'expression des ARNm des tissus. Rouge, violet de crésyl tache. Échelle = 200 um. Pour tous les image, le bec est rostrale vers la gauche. Les images du film x-ray ont été exposés pendant un jour, diapositives croisement pendant 3 jours. La sonde est FOXP1 178 pb à 1544 à 1711 pb la partie de l'ARNm; CoupTF2 est 545 pb à la partie 1-545 pb de l'ARNm. Comme on le voit, au sein de l'ARNm du cerveau antérieur FOXP1 est enrichi en mesopallium (M), le striatum (St) et le thalamus dorsal (DT), alors que CoupTF2 est enrichi en nidopallium (N), arcopallium (A), et le thalamus plus ventral . Il existe une cohérence dans l'expression entre les différents types d'exposition (et l'âge). Avec les lames trempées, cependant, un étiquetage de plus haute résolution est vu, unelimites des tissus et des subdivisions d sont directement identifiés. Ceux-ci et toutes les autres images figurant dans le document sont tirées de sections en utilisant le standard de 65 ° C d'hybridation forte stringence.
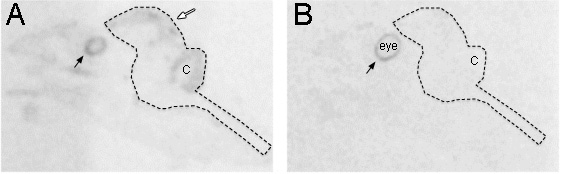
Figure 2. Comparaison des antisens et l'étiquetage sens qui montre différents modèles. (A) Le brin antisens de Pax6 a été exprimé dans le cerveau, en particulier la zone ventriculaire (flèche blanche). Montré est autoradiographie sur des films radiographiques de sagittales tranches entières prises de tête diamant mandarin à jour embryonnaire 12. (B) de l'article adjacent hybridé avec le brin sens de Pax6 révèle pas d'expression de fond à travers la tête d'embryons, mais l'expression apparente dans la couche de pigment de la rétine (flèches noires) que le brin antisens. La ligne en pointillés indique le contour de l'ensemble du cerveau. C: Cervelet.

rong> Figure 3. Dans signaux in situ de l'expression des gènes dans les diapositives prises à partir d'émulsion de croisement diamant mandarin cerveau au cours de derniers stades embryonnaires sous vues en fond clair et fond noir. (A) sur l'image à fond clair d'expression D1B à jour embryonnaire 10 à une exposition normale à l'émulsion. L'étiquette (noir) est à peine visible à ce grossissement. Probe est de 625 points de base à la partie 1-625 pb de l'ARNm. (B) et un grossissement de section identique comme dans (A), mais passe à l'affichage sur fond noir montrant l'étiquette (blanc) dans le striatum (St) et le thalamus (TH). (C) l'image de fond clair Slit3 expression à 12 jours embryonnaires à partir d'une exposition sur l'émulsion. Label (noir) peut facilement être vu. Probe est de 779 points de base à la partie 1243-2021 de l'ARNm. (B) section identique et le grossissement que dans (A) sont passés à fond noir vue étiquette indiquant (blanc) dans la moelle épinière (SC) qui correspond à l'image en fond clair. Rostrale est orienté vers la gauche. Cb: Cervelet.
/ 3764/3764fig4.jpg "alt =" Figure 4 "/>
Figure 4. Résolution des grains d'argent au niveau cellulaire. Montré est FOXP1 étiquette ARNm dans le cerveau antérieur diamant mandarin avec des grains d'argent (taches noires) au-dessus des cellules (violet de crésyl) dans différentes régions du cerveau et de tout âge par rapport à des images de plus faible puissance de la figure 1A et 1C. (A) l'expression forte abondance sur des cellules individuelles (flèches noires) chez l'adulte mesopallium diamant mandarin. (B) l'expression Faible abondance sur des cellules individuelles (têtes de flèches noires) dans le nidopallium adjacente de la même section. (C) l'expression d'ARNm de haut FOXP1 sur les cellules (flèches noires) dans le 12 e jour mesopallium embryonnaire. (D) l'expression Faible abondance sur les cellules (flèches noires) dans le nidopallium adjacente de la même section. Exemple cellules sont entourées par une ligne jaune. Les cellules embryonnaires (C et D) sont plus petits et plus serrés par rapport aux cellules adultes (A et B). Le car il ya peu d'espace entre les cellules et l'émulsion, le domaine de la exposée sigrains lver du S 35 sonde sont légèrement grande que la zone des corps cellulaires. Échelle = 10 um.
Discussion
Radioactifs hybridation in situ de l'expression des ARNm est largement utilisé à des fins multiples, y compris pour l'étude de l'organisation des tissus régionaux, types de cellules, et l'activité fonctionnelle du cerveau 2-5,10,12-14. L'utilisation ultérieure est sur les gènes dont l'expression d'ARNm dans le cerveau dépend de l'activité neuronale accrue, souvent appelés dépendants de l'activité des gènes ou gènes précoces immédiats. Avec ces utilisations, notre méthode a été appliquée à travers de multiples espèces, y compris chez les oiseaux, les mammifères (par exemple l'homme), les poissons et les amphibiens; dans de nombreux tissus, y compris le cerveau, la peau et le muscle, et les âges, y compris les nouveau-nés multiples ou les nouveau-nés, les jeunes , les adultes, et ici dans les sections d'embryons entiers 2,3,5,15-17. Les caractéristiques particulières de notre protocole comprennent: (1) Elle produit un équilibre entre la spécificité anatomique et la spécificité quantitative. Afin de quantifier l'expression des gènes sur le film x-ray, nous prenons des photos numériques des images (ex:. Fig 1A et 1B), utiliser le Photoshop fonction histogramme (Adobe) pour mesurer la densité de pixels dans les régions d'intérêt et soustraire le bruit de fond sur le film extérieur du tissu mais encore sur la lame de verre 2,4. Pour quantifier l'expression au niveau cellulaire, nous prenons des images de grains d'argent sur les cellules à fort grossissement (40-100X; Fig 4). Nous utilisons ensuite le seuil et les fonctions de mesure de J image par Wayne Rasband au NIH pour compter le nombre de grains d'argent dans l'image, il faut soustraire le nombre d'arrière-plan dans un domaine similaire, sans cellules sur la lame de verre, il faut diviser par le nombre de cellules, pour obtenir un valeurs d'expression par la cellule. 4,18 (2), il peut être débit relativement élevé, permettant le traitement de 100-200 lames simultanément, en raison de la lamelle d'étanchéité étanche créée par le bain d'huile minérale. Standard des méthodes d'hybridation in situ prendre plus de temps pour sceller les diapositives avec du parafilm, vernis à ongles, et d'autres moyens, où les diapositives prennent beaucoup d'espace; (3) Il est trèssensibles pour les transcriptions de faible abondance en raison de sulfate de dextran et la solution de Denhardt dans le tampon d'hybridation 2,13; (4) L'approche d'imagerie fond noir donne des images à contraste élevé en raison de prendre des photos sous un éclairage sur fond noir sur un microscope à dissection 4,5. En outre, il permet la détection sensible de petits changements dans l'expression des gènes, comme dans l'expression des gènes dépendant de l'activité pour identifier les régions cérébrales activées lors de la perception spécifiques et la production de comportements spécifiques 19. Les limitations relatives à la non-radioactifs protocoles sont que celui-ci sont plus claires dans la résolution cellulaire et l'emplacement de l'ARNm dans la cellule, et en travaillant avec l'émulsion est très sensible à la manipulation et la lumière. Il est possible de combiner notre méthode avec d'autres méthodes, telles que la non-radioactifs hybridation in situ pour étiqueter l'expression des ARNm de plus d'un gène dans le tissu même 10,17,20. Il peut être combiné avec immunocytochimied'étiqueter les deux ARN et expression de la protéine sur le même échantillon, afin de co-localiser l'ARNm avec certains types de cellules 10. Les modifications du protocole nécessaires à ces expériences de double marquage sont décrites dans les références citées.
En résumé, notre approche facilite la compréhension du calendrier et de localisation cellulaire de l'expression des gènes dans le but de comprendre l'organisation la région, l'activité des tissus fonctionnels, et la fonction des gènes.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Les auteurs tiennent à remercier tous les membres Jarvis laboratoire qui ont amélioré le protocole au fil des ans.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| L'anhydride acétique | VWR | MK242002 | |
| Chloroforme | VWR | BDH1109 | |
| Acétate de violet de crésyl | Sigma | C5042 | |
| Cryostat | Thermo Scientific | Microm HM550 | |
| Formamide déionisé | Sigma | F9037 | |
| TNT | Promega | P1171 | 100 mM |
| EDTA | Sigma | ED | |
| Intégration moule | VWR | 15160-215 | |
| Fisher marque SuperFrost Plus diapositive | Fisher Scientific | 22-034-979 | |
| Formaldéhyde | VWR | BDH0506-4LP | |
| Le formamide | Sigma | F7508 | |
| Geneclean kit | Q-Bio gène | 1001-200 | |
| Kodak BioMax MR du film | Sigma | Z350370 | |
| Kodak NTB Emulsion | Carestream Health | 8895666 | |
| Kodak Professional développeur D19 | Kodak | 1462593 | |
| Kodak professionnel Fixer | Kodak | 1971746 | |
| β-mercaptoéthanol | Calbiochem | 444203 | |
| Huile minérale | VWR | IC15169491 | |
| NaOH | VWR | SX0600-1 | |
| Paraformaldéhyde | Sigma | 76240 | |
| Un Poly | Invitrogen | POLYA.GF | |
| rATP | Promega | P1132 | 10 mM |
| rCTP | Promega | P1142 | 10 mM |
| rGTP | Promega | P1152 | 10 mM |
| RNasin | Promega | N2111 | 40Units/μl |
| S 35 UTP | PerkinElmer | NEG039C001MC | |
| Sécurité-Solve solution | Sécurité Résolvez recherche Products International | 111177 | |
| Acétate de sodium | Sigma | S7899 | 3M |
| Phosphate de sodium dibasique | Sigma | S3264 | |
| Phosphate monosodique | Sigma | S3139 | |
| SP6ARN polymérase | Promega | P1085 | |
| Coloration grille métallique | Sciences Electron Microscopy | 70312-54 | |
| T7 RNA polymérase | Promega | P2075 | |
| Tissue-Tek octobre | Sakura | 4583 | |
| Un tampon de transcription 5x | Promega | P1181 | |
| Triéthanolamine | VWR | IC15216391 | |
| Tris-HCl (1 M, pH 8,0) | VWR | 101449-446 | |
| ARNt | Roche | 10109509001 |
Solutions:
- Réactifs pour la fabrication de ribosondes: 1,5 matrice d'ADN ul (0,2-0,3 pg / pl), 2 pl de tampon de transcription 5x optimisé, 1 pl de la TNT 100mm (livré avec la polymérase de Promega, mélangebien à la température ambiante), 0,3 pi de RNasin (40 unités / pl), 1,5 pi de solution AGC mélange ribonucléotide, 3,5 l de S 35 UTP, et 1 polymérase ARN ul. Apportez jusqu'à 10 pi avec une eau sans nucléase.
- Solution AGC mélange ribonucléotide: mélanger des quantités égales de 10 mM ATP, GTP et CTP ensemble.
- Solution d'acétate de sodium pour EtOH la précipitation pour éliminer gratuitement S 35 UTP: 40 pl de RNase et DNase eau libre, 5 ul d'acétate de sodium 3M, et 125 ul d'EtOH à 100%.
- Tampon d'hybridation (10ml stock): 5 ml de formamide désionisée 100%, 600 pi de NaCl 5M, 1M Tris-HCl (pH = 8,0), 240 ul d'EDTA 0,5 M (pH = 8,0), 100 pi de solution de 100x Denhart, 100 pi de 1 million de TNT, 250 pi de 20mg/ml ARNt, 125 pi de 20 mg / ml de poly A, et 1 g de sodium de sulfate de dextrane. Ajouter de l'eau traitée au DEPC à porter le volume total à 10 ml. Agiter vigoureusement et incuber à 55 ° C jusqu'à ce que tout le sulfate de sodium dextran est dissoute. Stockez le tampon d'hybridation dans-20 ° C, ce qui est bon pour environ 6 mois.
- 4% solution tamponnée paraformaldéhyde: ajouter 40 g de paraformaldéhyde en ml d'eau distillée 760 dans un ballon désigné pour paraformaldéhyde, la chaleur à 50 ° C sur une plaque chaude, tout en agitant. Ajouter 320 ul de NaOH 10N pour aider à dissoudre le paraformaldéhyde. Après la dissolution (~ 10 min), ajouter 100 ml de PBS 10X, et porter le volume avec de l'eau distillée jusqu'à 1 litre. Remuer et chauffer la solution jusqu'à ce que le paraformaldéhyde est dissous. Le pH doit être de 7,4.
- L'acétylation de tampon: 13,6 ml de triéthanolamine plus 2,52 ml d'anhydride acétique dans 1 litre d'eau distillée.
- 20x PESS solution: 3M NaCl, 200 mM NaH 2 PO 4-H 2 O, et 200 mM d'EDTA dans l'eau distillée. Ajuster la solution à pH 7,4 avec NaOH 10N.
- 10x tampon PBS: 80 g de NaCl, 2,0 g de KCl, 14,4 g de Na 2 HPO 4, et 2,4 g de KH 2 PO 4 dans l'eau distillée. Ajuster la solution à pH 7,0 et porter le volume total à 1 Liter.
- Deuxième solution de lavage: 0,1% β-mercaptoéthanol et 50% de formamide dans 2x SSPE
- Crésyl solution d'acétate de violet: 3% d'acétate de crésyl violet dans l'eau du robinet (eau distillée empêche la coloration bonne), dissous une nuit sous agitation dans un flacon à la température ambiante. Filtrez avec aspiration par le vide à travers un papier filtre Whatman 1mm et Büchner.
Références
- Clayton, D. F., Huecas, M. E., Sinclair-Thompson, E. Y., Nastiuk, K. L., Nottebohm, F. Probes for rare mRNAs reveal distributed cell subsets in canary brain. Neuron. 1, 249-261 (1988).
- Wada, K., Sakaguchi, H., Jarvis, E. D., Hagiwara, M. Differential expression of glutamate receptors in avian neural pathways for learned vocalization. J. Comp. Neurol. 476, 44-64 (2004).
- Haesler, S. FoxP2 expression in avian vocal learners and non-learners. J. Neurosci. 24, 3164-3175 (2004).
- Jarvis, E. D., Nottebohm, F. Motor-driven gene expression. Proc. Natl. Acad. Sci. U.S.A. 94, 4097-4102 (1997).
- Holzenberger, M. Selective expression of insulin-like growth factor II in the songbird brain. J. Neurosci. 17, 6974-6987 (1997).
- Mahmood, R., Mason, I. In-situ hybridization of radioactive riboprobes to RNA in tissue sections. Methods Mol. Biol. 461, 675-686 (2008).
- Wilkinson, D. G., Nieto, M. A. Detection of messenger RNA by in situ hybridization to tissue sections and whole mounts. Methods Enzymol. 225, 361-373 (1993).
- Acloque, H., Wilkinson, D. G., Nieto, M. A. In situ hybridization analysis of chick embryos in whole-mount and tissue sections. Methods Cell Biol. 87, 169-185 (2008).
- Moorman, A. F., Houweling, A. C., de Boer, P. A., Christoffels, V. M. Sensitive nonradioactive detection of mRNA in tissue sections: novel application of the whole-mount in situ hybridization protocol. J. Histochem. Cytochem. 49, 1-8 (2001).
- Horita, H., Wada, K., Rivas, M. V., Hara, E., Jarvis, E. D. The dusp1 immediate early gene is regulated by natural stimuli predominantly in sensory input neurons. J. Comp. Neurol. 518, 2873-2901 (2010).
- Braissant, O., Wahli, W. A simplified in situ hybridization protocol using non-radioactively labelled probes to detect abundant and rare mRNAs on tissue sections. Biochemica. 1, 10-16 (1998).
- Kubikova, L., Wada, K., Jarvis, E. D. Dopamine receptors in a songbird brain. J. Comp. Neurol. 518, 741-769 (2010).
- Wada, K. A molecular neuroethological approach for identifying and characterizing a cascade of behaviorally regulated genes. Proc. Natl. Acad. Sci. U.S.A. 103, 15212-15217 (2006).
- Jarvis, E. D. Avian brains and a new understanding of vertebrate brain evolution. Nat. Rev. Neurosci. 6, 151-159 (2005).
- Hoke, K. L., Ryan, M. J., Wilczynski, W. Social cues shift functional connectivity in the hypothalamus. Proc. Natl. Acad. Sci. U.S.A. 102, 10712-10717 (2005).
- Burmeister, S. S., Jarvis, E. D., Fernald, R. D. Rapid behavioral and genomic responses to social opportunity. PLoS. Biol. 3, e363(2005).
- Jarvis, E. D., Schwabl, H., Ribeiro, S., Mello, C. V. Brain gene regulation by territorial singing behavior in freely ranging songbirds. Neuroreport. 8, 2073-2077 (1997).
- Jarvis, E. D., Scharff, C., Grossman, M. R., Ramos, J. A., Nottebohm, F. For whom the bird sings: context-dependent gene expression. Neuron. 21, 775-788 (1998).
- Feenders, G. Molecular mapping of movement-associated areas in the avian brain: a motor theory for vocal learning origin. PLoS One. 3, e1768(2008).
- Chen, C. C., Fernald, R. D. Distributions of two gonadotropin-releasing hormone receptor types in a cichlid fish suggest functional specialization. J. Comp. Neurol. 495, 314-323 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon