Method Article
Étiquetage cellules souches avec Ferumoxytol, une nanoparticule approuvé par la FDA d'oxyde de fer
Dans cet article
Résumé
Nous décrivons une technique d'étiquetage et de suivi avec des cellules souches approuvé par la FDA, le fer superparamagnétiques d'oxyde (SPIO), ferumoxytol (Feraheme). Cette technique d'imagerie cellulaire qui utilise par résonance magnétique (IRM) pour la visualisation, est facilement accessible pour surveillance à long terme et le diagnostic de succès ou non engraftments cellules souches chez les patients.
Résumé
Thérapies basées sur les cellules souches offrent un potentiel important pour le domaine de la médecine régénérative. Cependant, il reste beaucoup à comprendre sur la cinétique in vivo des cellules transplantées. Une méthode non-invasive pour surveiller de façon répétitive des cellules souches transplantées in vivo permettrait aux enquêteurs de contrôler directement les greffes de cellules souches et de déterminer les résultats greffe réussie ou non.
Une large gamme de cellules souches continue à être étudiée pour des applications innombrables. Ce protocole se concentre sur trois différentes populations de cellules souches: embryonnaires de rein humain 293 (HEK293) les cellules, cellules souches mésenchymateuses humaines (hMSC) et souches pluripotentes induites (iPS). Cellules HEK 293 sont issus de cellules rénales embryonnaires humaines mises en culture par l'adénovirus 5 ADN cisaillé. Ces cellules sont largement utilisés dans la recherche parce qu'ils sont faciles à cultiver, se développent rapidement et sont facilement transfectées. hMSCs sont trouvées dans la moelle adulte. Ces cellules can être reproduits comme des cellules indifférenciées, tout en maintenant multipotence ou le potentiel de se différencier en un nombre limité de destins cellulaires. hMSCs peuvent se différencier pour des lignées de tissus mésenchymateux, y compris les ostéoblastes, les adipocytes, chondrocytes, tendons, muscles, et du stroma médullaire. Les cellules iPS sont des cellules adultes reprogrammées génétiquement qui ont été modifiées pour exprimer des gènes et des facteurs semblables à définir les propriétés des cellules souches embryonnaires. Ces cellules sont pluripotentes sens qu'ils ont la capacité de se différencier en tous les lignages cellulaires 1. Les deux hMSCs et les cellules iPS ont démontré la capacité de régénération des tissus in vivo.
Par résonance magnétique (IRM) en collaboration avec l'utilisation de l'oxyde de fer superparamagnétiques (SPIO) étiquettes cellulaire des nanoparticules se sont avérées efficaces dans le suivi in vivo des cellules souches en raison de la résolution anatomique microscopiques proximité, une plus longue demi-vie sanguine qui permet d'imagerie longitudinale et la haute SENSIBILITÉy pour la détection de cellules fournies par l'IRM du SPIO nanoparticules 2-4. En outre, l'IRM avec l'utilisation de SPIOs est cliniquement traduisible. SPIOs sont composées d'un noyau d'oxyde de fer avec une couche de surface de dextrane, carboxydextran ou de l'amidon qui sert à contenir le noyau de fer à partir de composants bioréactifs plasma. Ces agents créent locales inhomogénéités de champ magnétique qui conduisent à une diminution du signal sur les images IRM pondérées en T2 5. Malheureusement, SPIOs ne sont plus fabriqués. La deuxième génération, ultrapetites SPIOs (USPIO), cependant, offrir une alternative viable. Ferumoxytol (FerahemeTM) est l'un USPIO composé d'un noyau de magnétite non stœchiométrique entouré d'une couche carboxymethylether sorbitol polyglucose. Le colloïdale, taille des particules de 17-30 nm ferumoxytol est telle que déterminée par diffraction de la lumière. Le poids moléculaire est de 750 kDa, et la relaxivité champ constant à 2T IRM est 58,609 mm-1 sec-1 de force 4. Ferumoxytol a été récemment approuvé par la FDA unes un supplément de fer pour le traitement de la carence en fer chez les patients atteints d'insuffisance rénale 6. Notre groupe a appliqué cet agent dans un "hors étiquette" usage pour les applications de marquage cellulaire. Notre technique démontre l'étiquetage efficace des cellules souches avec ferumoxytol qui mène à d'importants effets de signal IRM de cellules marquées sur les images IRM. Cette technique peut être appliquée pour les non-invasif de surveillance de thérapies par cellules souches dans les paramètres pré-cliniques et cliniques.
Protocole
1. Jour 1
Cellules de la plaque 1)
- HMSC plaque dans une fiole T75 à un confluence de 80% au moins 18-24 heures avant l'étiquetage. Se reporter au Tableau 1 pour les instructions pour les navires de remplacement.
2. Jour 2
2) Préparer une solution d'étiquetage. Cette préparation d'étiquettes un (1) flacon T75 à 80% de confluence avec une concentration de 400 pg Fe / ml. Se reporter au Tableau 1 pour les instructions pour les navires de remplacement.
- Créer une solution (solution 1) en mélangeant 1 ml de milieu sans sérum et 93,1 l de ferumoxytol (stock: 30 mg / ml) dans un tube de 15 ml conique.
- Créer une deuxième solution (solution 2) en mélangeant 1 ml de milieu sans sérum et 7 ul de sulfate de protamine (stock: 10 mg / ml) dans un second tube de 15 ml conique.
- Permettre à chaque solution de se reposer pendant 5 minutes.
- Ajouter les solutions 1 et 2 ensemble. Mélanger doucement la solution nouvel étiquetage. Laisser la solution reposer pendant 5 minutes afin de permettre USPIO pro-complexes de sulfate tamine à se former.
- Ajouter 5 ml de milieu sans sérum à l'mixtes de 2 ml de SPIO / solution de sulfate de protamine pour un volume final de 7 ml.
3) Préparer les cellules pour l'étiquetage
- Aspirer les médias à partir des cellules.
- Lavez délicatement les cellules une fois avec 2-3 ml de pré-chauffé Mg / Ca-libres D-PBS ou un milieu sans sérum pour rincer résiduelle protéines sériques et des médias ou d'autres éléments qui pourraient nuire à l'absorption agent de contraste et l'efficacité d'étiquetage. Aspirer le liquide de rinçage.
Cellules label 4)
- Ajouter le complète de 7 ml de solution d'étiquetage pour les cellules.
- Placez les cellules dans un incubateur (37 ° C / 5% CO 2) et permettre aux cellules à incuber dans la solution d'étiquetage pour les 4 heures.
- Ajouter 700 ul de FCS à la solution d'étiquetage des cellules pour obtenir une concentration finale de sérum de 10%. Le sérum est ajouté à rétablir l'environnement enrichi sur lequel les cellules sont habitués, et pour aider à minimizing mort cellulaire qui pourrait résulter d'un changement brusque d'une exposition de 24 heures à un environnement sans sérum.
- Autoriser les cellules à incuber avec la solution d'étiquetage pour 20 heures supplémentaires.
3. Jour 3
5) Préparer les cellules marquées
- Aspirer la solution d'étiquetage à partir des cellules.
- Rincer délicatement les cellules avec 2-3 ml de pré-chauffé Mg / Ca-libres D-PBS. Aspirer le PBS. Il est important d'utiliser Mg / Ca PBS sans que le Mg et Ca va nuire à l'efficacité de la trypsine dans l'étape suivante.
- Ajouter 2 ml de pré-chauffé trypsine à 0,05% pour les cellules et incliner le flacon avant et en arrière afin d'assurer toute la surface du flacon est recouverte d'une fine couche de trypsine. Placez les cellules dans un incubateur (37 ° C / 5% CO 2) et permettre aux cellules de se reposer pendant 5-7 minutes ou jusqu'à ce que les cellules commencent à se détacher de la plaque. Il peut être nécessaire pour confirmer le détachement sous un microscope. Tapoter légèrement les côtés du flacon si nécessaire à FAciliter la surface des cellules du détachement.
- Ajouter 4 ml de pré-chauffé média complète dans le ballon pour neutraliser la trypsine. Rincer délicatement le flacon par pipetage la trypsine / media / solution cellulaire de haut en bas plusieurs fois. Recueillir l'ensemble de la solution dans un tube de 15 ml conique. Centrifuger la solution de cellules à 400 FCR pendant 5 minutes.
- Aspirer délicatement le surnageant sans déranger le culot cellulaire. Resuspendre les cellules dans 5 ml de milieu (sérum contenant ou dépourvu de sérum). Centrifuger la solution de cellules à 400 FCR pendant 5 minutes.
- Répéter le lavage de cellules décrite à l'étape 5.5. Au total, les cellules seront rincés trois fois pour éliminer les résidus, sans agent de contraste dans les médias et sur la surface des cellules.
- Compter les cellules à ce stade pour atteindre le nombre de cellules les plus précises, comme les cellules seront perdues lors du lavage précédent. Effectuez un test de viabilité des cellules. Les cellules sont maintenant prêtes pour une analyse ultérieure et ou de l'application expérimentale. IRM peut être réalisée avec T1-w et T2-w paramètres, parce que bien ferumoxytol est un agent de contraste T2-w, ferumoxytol présente également des effets T1. Représentant T2-w paramètres IRM qui peut être utilisé pour l'image ferumoxytol cellules marquées comprennent: des séquences FSE ou SE_Multislice avec un TR de 2000 à 2500 ms et un TE de 60-80 ms. Pour acquérir une image T1-w, diminuer la valeur de TE sur un FSE ou séquence SE_Multislice ou utiliser une séquence GRE avec une haute et basse TR TE. La figure 4 montre un potentiel d'application pour l'imagerie in vivo de cellules souches étiquetées.
4. Les résultats représentatifs:
Les cellules marquées montrent un effet de contraste significatif assombrissement ou négatif sur les images IRM pondérées en T2 et un effet de contraste éclaircissant ou positif sur les images IRM pondérées en T1 (figure 2). Longitudinales IRM et des tests de viabilité effectuée cinq jours après l'étiquetage n'a démontré aucun signal significatif MR et aucun impact significatif sur la viabilité par rapport aux contrôles non marqué (données non présentées).
jove_content "> cellules souches marquées peuvent ensuite être différenciées en divers types cellulaires ou injecté par voie intraveineuse pour une étude in vivo.
Figure 1. Schéma ligne de temps pour l'étiquetage des cellules souches avec les nanoparticule d'oxyde de fer, ferumoxytol.

Figure 2. Images IRM de coupes sagittale tubes eppendorf thrrough avec des cellules en un culot cellulaire. A) Unlabeled contrôles. B) Les cellules marquées montrant un T2 significative ou effet négatif sur les agents de contraste en T2 FSE ou SE_Multislice imagerie et un effet de contraste T1 ou positifs agent sur la séquence pondérée en T1 GRE.

Figure 3. Sagittale sections de tubes Eppendorf avec des cellules en cellules PELpermet. Aussi peu que 10 000 ferumoxytol cellules marquées peuvent être détectés par l'intermédiaire T2-w IRM.
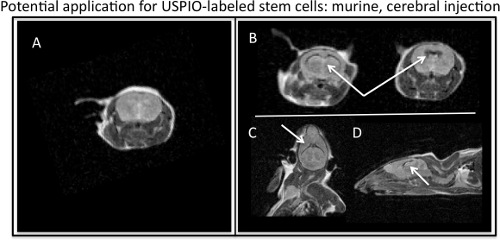
Figure 4. Visualisation des MR ferumoxytol marqué les cellules souches injectées dans murin ventricules cérébraux. A) axiale, l'image du MR Barin murin sans injection de USPIO marqué les cellules souches. B) Axial, C) coronale, et D) les images IRM sagittale montrant le T2, effet de contraste négatif de USPIO marqué les cellules souches (flèches blanches) injecté dans le cerveau murin.
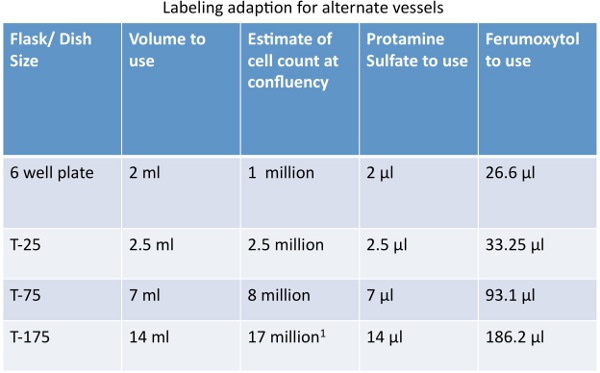
Tableau adaptations Quantité 1. Pour le marquage des cellules dans d'autres bateaux.
Discussion
Améliorer l'efficacité des cellules souches engraftments est crucial pour l'avancement de la médecine régénérative. Une technique de visualisation non invasive des cellules souches in vivo améliore de façon significative notre capacité à comprendre les mécanismes qui conduisent à des résultats transplantés avec succès. Étiquetage magnétique pour visualiser MR, telles que la procédure, nous avons démontré, permet de suivre in vivo des cellules souches avec l'IRM. Les cellules souches marquées magnétiquement ont déjà été transplantées dans les tissus cibles et ont été visualisées à l'IRM semaines avec 7. À long terme d'étiquetage et d'imagerie longitudinale est possible en raison de la surcharge lysosomale des nanoparticules d'oxyde de fer dans les cellules 8. Défis, cependant, ne correspondent à la surveillance à long terme de cellules marquées de fer. Un défi associé à l'imagerie longitudinales de fer cellules marquées est que, comme saines, les cellules viables prolifèrent l'agent de contraste est distribué à daughter cellules. Distribution de l'agent de contraste à des cellules filles est inégale et les résultats dans un effet de dilution marquée de l'agent de contraste au cours du temps. Un deuxième défi associé à la surveillance à long terme du fer des cellules marquées est la différence entre l'origine étiqueté, les cellules viables par les phagocytes résidents, telles que les macrophages, qui peuvent avoir phagocyté publié agent de contraste d'origine étiqueté, les cellules mortes 4. Notre groupe a identifié des différences dans la cinétique de signal à long terme de la viabilité et l'apoptose de cellules souches, qui avait été étiqueté avec des nanoparticules d'oxyde de fer autres que ferumoxytol 9-11. Des études futures sont nécessaires pour déterminer si ces principes s'appliquent également aux greffes de cellules ferumoxytol-étiquetés.
Alors que dans cette étude l'étiquetage ferumoxytol effets potentiels pourraient exposer sur la capacité de différenciation des cellules souches n'ont pas été examinés, les études précédentes ont démontré un effet dose-dépendant sur SPIO différencapacité de négociation et des doses SPIO qui ne compromettent pas le potentiel de différenciation, ce qui suggère une dose ferumoxtyol qui ne réduisent pas la capacité de différenciation des cellules souches peuvent également être déterminés 12, 13.
SPIOs Grande (diamètre hydrodynamique> 50 nm) ont été appliquées auparavant aux fins de suivi des cellules après marquage des cellules souches par des techniques diverses, y compris l'étiquetage simple incubation et la transfection avec des agents de l'électroporation ou transfection telles que protamine, lipofectine et poly-L-lysine (PLL) 3 , 13-16., mais pas toujours nécessaire pour le marquage des cellules avec des SPIOs, les méthodes de transfection de cellules pour l'étiquetage se sont révélés bénéfiques pour faciliter l'étiquetage et l'augmentation de l'efficacité d'étiquetage 15. SPIOs qui ont été utilisés pour le marquage cellulaire, cependant, ne sont plus produites pour des raisons commerciales. Ultrapetites SPIO (USPIO, diamètre hydrodynamique <50 nm) comme ferumoxytol, d'autre part sont encore en cours de productionmais nécessitent l'aide d'un agent de transfection efficaces pour atteindre l'absorption cellulaire 8. Sulfate de protamine est un agent de transfection cliniquement applicables qui forme des complexes avec USPIO pour faciliter l'absorption phagocytaire de l'agent de contraste de 17 cellules souches. La combinaison de la FDA a approuvé le sulfate de protamine avec le USPIO approuvé par la FDA, ferumoxytol, offre la possibilité de l'application clinique des techniques de cellules souches de suivi par l'utilisation hors AMM de cet agent. Fait à noter, ferumoxytol a démontré un excellent profil de sécurité dans les essais cliniques 18. La visualisation directe des cellules transplantées par une technique telle que celle démontrée permettrait une meilleure compréhension des facteurs qui favorisent ou nuisent succès des transplantations de cellules souches et les aider à identifier les techniques les plus prometteuses pour des applications cliniques. Avec l'utilisation de marqueurs de cellules cliniquement applicable et de l'équipement d'imagerie, cette technique d'imagerie est en principe, facilement accessibleaux patients qui subissent une greffe de cellules souches.
Déclarations de divulgation
Tous les contributeurs de cette étude offrent aucune divulgation.
Remerciements
Ce travail a été soutenu par une subvention du National Institute of Arthritis and musculo-squelettiques et les maladies cutanées: 3R01AR054458-02S2.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| D-MEM glycémie élevée | Sigma | D5648 | Ou moyen autre base pour la ligne de cellules souches souhaitées pour être utilisé |
| D-PBS (Ca + +, Mg + + gratuit) | GIBCO | 14190-144 | |
| Trypsine-EDTA 0,05% | Invitrogen | 25300-120 | |
| Sérum fœtal bovin (FBS) | Hyclone | SH30071.03 | |
Ferumoxytol (Feraheme) | AMAG | 59338-0775-01 | |
| Sulfate de protamine | APP Pharm. | 22930 |
Références
- Narsinh, K. H., Plews, J., Wu, J. C. Comparison of human induced pluripotent and embryonic stem cells: fraternal or identical twins?. Mol Ther. 19, 635-638 (2011).
- Bulte, J. W. In vivo MRI cell tracking: clinical studies. AJR. Am. J. Roentgenol. 193, 314-325 (2009).
- Henning, T. D., Boddington, S., Daldrup-Link, H. E. Labeling hESCs and hMSCs with Iron Oxide Nanoparticles for Non-Invasive in vivo Tracking with MR Imaging. J. Vis. Exp. (13), e685-e685 (2008).
- Tallheden, T., Nannmark, U., Lorentzon, M. In vivo MR imaging of magnetically labeled human embryonic stem cells. Life. Sci. 79, 999-1006 (2006).
- Jung, C. W., Jacobs, P. Physical and chemical properties of superparamagnetic iron oxide MR contrast agents: ferumoxides, ferumoxtran, ferumoxsil. Magn. Reson. Imaging. 13, 661-674 (1995).
- Coyne, D. W. Ferumoxytol for treatment of iron deficiency anemia in patients with chronic kidney disease. Expert. Opin. Pharmacother. 10, 2563-2568 (2009).
- Li, Z., Suzuki, Y., Huang, M. Comparison of reporter gene and iron particle labeling for tracking fate of human embryonic stem cells and differentiated endothelial cells in living subjects. Stem Cells. 26, 864-873 (2008).
- Metz, S., Bonaterra, G., Rudelius, M. Capacity of human monocytes to phagocytose approved iron oxide MR contrast agents in vitro. Eur. Radiol. 14, 1851-1858 (2004).
- Nedopil, A., Klenk, C., Kim, C. MR signal characteristics of viable and apoptotic human mesenchymal stem cells in matrix-associated stem cell implants for treatment of osteoarthritis. Invest. Radiol. 45, 634-640 (2010).
- Kraitchman, D. L., Heldman, A. W., Atalar, E. In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation. 107, 2290-2293 (2003).
- Stuckey, D. J., Carr, C. A., Martin-Rendon, E. Iron particles for noninvasive monitoring of bone marrow stromal cell engraftment into, and isolation of viable engrafted donor cells from, the heart. Stem Cells. 24, 1968-1975 (2006).
- Henning, T. D., Sutton, E. J., Kim, A. The influence of ferucarbotran on the chondrogenesis of human mesenchymal stem cells. Contrast. Media. Mol. Imaging. 4, 165-173 (2009).
- Arbab, A. S., Yocum, G. T., Kalish, H. Efficient magnetic cell labeling with protamine sulfate complexed to ferumoxides for cellular MRI. Blood. 104, 1217-1223 (2004).
- Nedopil, A. J., Mandrussow, L. G., Daldrup-Link, H. E. Implantation of Ferumoxides Labeled Human Mesenchymal Stem Cells in Cartilage Defects. J. Vis. Exp. (38), e1793-e1793 (2010).
- Arbab, A. S., Yocum, G. T., Wilson, L. B. Comparison of transfection agents in forming complexes with ferumoxides, cell labeling efficiency, and cellular viability. Mol Imaging. 3, 24-32 (2004).
- Babic, M., Horak, D., Trchova, M. Poly(L-lysine)-modified iron oxide nanoparticles for stem cell labeling. Bioconjug Chem. 19, 740-750 (2008).
- Golovko, D. M., T, H. e. n. n. i. n. g., Bauer, J. S. Accelerated stem cell labeling with ferucarbotran and protamine. Eur. Radiol. 20, 640-648 (2010).
- Lu, M., Cohen, M. H., Rieves, D. FDA report: Ferumoxytol for intravenous iron therapy in adult patients with chronic kidney disease. Am. J. Hematol. 85, 315-319 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon