Method Article
وسم الخلايا الجذعية مع Ferumoxytol ، وهو أوكسيد الحديد وافقت عليها الهيئة الجسيمات النانوية
In This Article
Summary
وصفنا تقنية لوضع العلامات وتعقب الخلايا الجذعية مع ادارة الاغذية والعقاقير التي وافق عليها ، superparamagnetic أكسيد الحديد (سبيو) ، ferumoxytol (Feraheme). هذه التقنية التي تستخدم الخلوية التصوير بالرنين المغناطيسي (MR) التصوير عن التصور ، ويمكن الوصول بسهولة للرصد طويل الأجل وتشخيص ناجحة أو فاشلة engraftments الخلايا الجذعية في مرضى.
Abstract
Stem cell based therapies offer significant potential for the field of regenerative medicine. However, much remains to be understood regarding the in vivo kinetics of transplanted cells. A non-invasive method to repetitively monitor transplanted stem cells in vivo would allow investigators to directly monitor stem cell transplants and identify successful or unsuccessful engraftment outcomes.
A wide range of stem cells continues to be investigated for countless applications. This protocol focuses on 3 different stem cell populations: human embryonic kidney 293 (HEK293) cells, human mesenchymal stem cells (hMSC) and induced pluripotent stem (iPS) cells. HEK 293 cells are derived from human embryonic kidney cells grown in culture with sheared adenovirus 5 DNA. These cells are widely used in research because they are easily cultured, grow quickly and are easily transfected. hMSCs are found in adult marrow. These cells can be replicated as undifferentiated cells while maintaining multipotency or the potential to differentiate into a limited number of cell fates. hMSCs can differentiate to lineages of mesenchymal tissues, including osteoblasts, adipocytes, chondrocytes, tendon, muscle, and marrow stroma. iPS cells are genetically reprogrammed adult cells that have been modified to express genes and factors similar to defining properties of embryonic stem cells. These cells are pluripotent meaning they have the capacity to differentiate into all cell lineages 1. Both hMSCs and iPS cells have demonstrated tissue regenerative capacity in-vivo.
Magnetic resonance (MR) imaging together with the use of superparamagnetic iron oxide (SPIO) nanoparticle cell labels have proven effective for in vivo tracking of stem cells due to the near microscopic anatomical resolution, a longer blood half-life that permits longitudinal imaging and the high sensitivity for cell detection provided by MR imaging of SPIO nanoparticles 2-4. In addition, MR imaging with the use of SPIOs is clinically translatable. SPIOs are composed of an iron oxide core with a dextran, carboxydextran or starch surface coat that serves to contain the bioreactive iron core from plasma components. These agents create local magnetic field inhomogeneities that lead to a decreased signal on T2-weighted MR images 5. Unfortunately, SPIOs are no longer being manufactured. Second generation, ultrasmall SPIOs (USPIO), however, offer a viable alternative. Ferumoxytol (FerahemeTM) is one USPIO composed of a non-stoichiometric magnetite core surrounded by a polyglucose sorbitol carboxymethylether coat. The colloidal, particle size of ferumoxytol is 17-30 nm as determined by light scattering. The molecular weight is 750 kDa, and the relaxivity constant at 2T MRI field is 58.609 mM-1 sec-1 strength4. Ferumoxytol was recently FDA-approved as an iron supplement for treatment of iron deficiency in patients with renal failure 6. Our group has applied this agent in an “off label” use for cell labeling applications. Our technique demonstrates efficient labeling of stem cells with ferumoxytol that leads to significant MR signal effects of labeled cells on MR images. This technique may be applied for non-invasive monitoring of stem cell therapies in pre-clinical and clinical settings.
Protocol
1. اليوم 1
خلايا بلايت 1)
- hMSC وحة في قارورة T75 في confluency من 80 ٪ على الأقل 18-24 ساعة قبل وضع العلامات. الرجوع إلى الجدول رقم 1 للتعليم للسفن بديلة.
2. اليوم 2
2) إعداد حل التوسيم. وهذا إعداد تسمية واحدة (1) في دورق T75 confluency 80 ٪ مع تركيز 400 ميكروغرام الحديد / مل. الرجوع إلى الجدول رقم 1 للتعليم للسفن بديلة.
- ايجاد حل (الحل 1) عن طريق خلط 1 مل من مصل خالية من وسائل الإعلام و93.1 ميكرولتر من ferumoxytol (المخزون : 30 ملغ / مل) في أنبوب مخروطية 15 مل.
- إنشاء الحل الثاني (محلول 2) عن طريق خلط 1 مل من مصل خالية من وسائل الإعلام و 7 ميكرولتر من سلفات بروتامين (المخزون : 10 ملغ / مل) في أنبوب 15 مل المخروطية.
- السماح لكل حل لراحة لمدة 5 دقائق.
- إضافة حلول 1 و 2 معا. المزيج بلطف الحل العلامات الجديدة. يسمح الحل لراحة لمدة 5 دقائق للسماح للمحترفين USPIOالمجمعات سلفات لtamine النموذج.
- إضافة 5 مل من مصل خالية من وسائل الإعلام إلى 2 مل المختلطة سبيو / بروتامين حل سلفات عن الحجم النهائي من 7 مل.
3) إعداد الخلايا لوصفها
- نضح في وسائل الاعلام من الخلايا.
- يغسل مرة واحدة مع الخلايا بلطف 2-3 مل من قبل تحسنت مغ / كا خالية D - PBS أو وسائل الإعلام خالية من المصل لشطف بعيدا بروتينات مصل المتبقية وسائل الإعلام أو غيرها من المكونات التي يمكن أن تؤثر على النقيض عامل امتصاص والكفاءة التوسيم. نضح من السائل الشطف.
الخلايا تسمية 4)
- إضافة الكامل 7 مل من حل لوضع العلامات الخلايا.
- خلايا المكان الى حاضنة (37 ° / C 5 ٪ CO 2) وتسمح للخلايا لاحتضان في حل وضع العلامات لمدة 4 ساعات.
- إضافة 700 ميكرولتر من السفح إلى حل توسيم الخلايا لتحقيق تركيز المصل نهائي قدره 10 ٪. يضاف المصل إلى إعادة تهيئة البيئة المخصب الذي اعتادوا الخلايا ، والمساعدة في ميلnimizing موت الخلايا التي يمكن أن تنجم عن تحول مفاجئ إلى 24 ساعة من التعرض لبيئة خالية من المصل.
- السماح للخلايا لاحتضان مع الحل التوسيم لمدة 20 ساعة إضافية.
3. اليوم 3
5) إعداد الخلايا المسمى
- نضح الحل وسم من الخلايا.
- شطف الخلايا برفق مع 2-3 مل من قبل تحسنت مغ / كا خالية D PBS. نضح بها في برنامج تلفزيوني. من المهم استخدام مغ / كا خالية من برنامج تلفزيوني مثل المغنيسيوم والكالسيوم وسوف يضعف من كفاءة التربسين في الخطوة التالية.
- تتناول إضافة 2 مل من قبل التربسين تحسنت 0.05 ٪ إلى الخلايا والميل القارورة ذهابا وإيابا لضمان كامل سطح القارورة بطبقة رقيقة من التربسين. مكان الخلايا في حاضنة (37 ° / C 5 ٪ CO 2) وتسمح للخلايا للراحة لمدة 5-7 دقائق أو حتى الخلايا تبدأ في فصل من لوحة. قد يكون من الضروري لتأكيد انفصال تحت المجهر. اضغط برفق على جانبي القارورة اذا لزم الامر لكرة القدمcilitate سطح الخلية المفرزة.
- إضافة 4 مل من قبل وسائل الإعلام تحسنت الكامل إلى القارورة لتحييد التربسين. الشطف بلطف بواسطة قارورة pipetting والتربسين / وسائل الإعلام / حل الخلية صعودا وهبوطا عدة مرات. جمع الحل بأكمله في أنبوب مخروطية 15 مل. الحل الطرد المركزي في 400 خلية التعاون الإقليمي لمدة 5 دقائق.
- نضح بعناية وطاف دون الإخلال بيليه الخلية. Resuspend الخلايا في 5 مل من وسائل الإعلام (التي تحتوي على مصل أو مصل الحرة). الحل الطرد المركزي في 400 خلية التعاون الإقليمي لمدة 5 دقائق.
- تكرار غسل الخلية هو موضح في الخطوة 5.5. في المجموع ، سيتم تشطف الخلايا ثلاث مرات لإزالة المتبقية ، عامل تباين في وسائل الاعلام الحرة والموجودة على سطح الخلايا.
- عدد الخلايا في هذه المرحلة لبلوغ عدد الخلايا الأكثر دقة ، كما سيتم فقدان الخلايا أثناء الغسيل السابقة. إجراء اختبار جدوى من الخلايا. الخلايا هي الآن جاهزة للتحليل أو تطبيق اللاحقة والتجريبية. لا يمكن أن يؤديها MR التصوير مع T1 - W و T2 - W المعلمات ، لأنه على الرغم ferumoxytol هو عامل تباين T2 - W ، ferumoxytol المعروضات أيضا آثار T1. ممثل T2 - W المعلمات التصوير بالرنين المغناطيسي التي يمكن استخدامها للخلايا المسمى ferumoxytol صورة ما يلي : FSE أو SE_Multislice متواليات مع TR من 2000-2500 مللي والشركة المصرية للاتصالات (أ) من 60-80 مللي. للحصول على صورة T1 - W ، وانخفاض قيمة الشركة المصرية للاتصالات على FSE أو تسلسل SE_Multislice أو استخدام تسلسل GRE مع TR TE العالية والمنخفضة. الشكل 4 يوضح المحتملة في تطبيق الجسم الحي المسمى لوقف التصوير الخلية.
4. ممثل النتائج :
الخلايا المسمى إثبات تأثير كبير على النقيض سواد أو سلبية على صور الرنين المغناطيسي T2 المرجحة وتأثير إيجابي أو العكس اشراق على صور الرنين المغناطيسي T1 المرجحة (الشكل 2). يقوم السيد طولية التصوير واختبارات الجدوى 5 أيام الوسم آخر أظهرت عدم وجود إشارة MR كبيرة وليس لها تأثير كبير على قابلية مقارنة مع الضوابط غير المسماة (لا تظهر البيانات).
jove_content "> يمكن بعد ذلك الخلايا الجذعية إعتبر أن تكون متباينة في مختلف أنواع الخلايا أو الحقن في الوريد من أجل التحقيق في الجسم الحي.
الشكل 1. تخطيطي زمني لوضع العلامات الخلايا الجذعية مع جسيمات متناهية الصغر أكسيد الحديد ، ferumoxytol.

الشكل 2. صور الرنين المغناطيسي لسهمي أنابيب عبر المقاطع إيبندورف thrrough مع الخلايا في خلية بيليه. أ) غير إعتبر الضوابط. ب) خلايا إعتبر يدل على T2 كبيرة أو تأثير سلبي على النقيض من وكيل T2 المرجحة FSE SE_Multislice أو التصوير وكيل النقيض من T1 او ايجابيا تأثير على تسلسل GRE T1 المرجحة.

الشكل 3. مقاطع عرضية من سهمي أنابيب إيبندورف مع الخلايا في خلية PELيتيح. ويمكن الكشف عن أقل قدر 10000 ferumoxytol الخلايا المسماة عبر التصوير بالرنين المغناطيسي T2 - W.
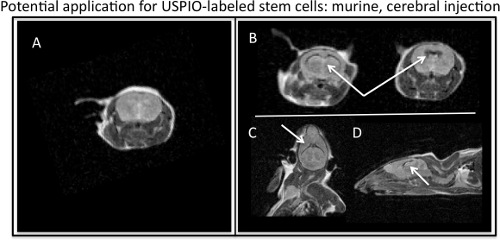
الشكل 4. MR تصور ferumoxytol المسمى الخلايا الجذعية حقن الفئران البطينات الدماغية. أ) صورة MR المحورية ، من barin الفئران بدون حقن USPIO المسمى الخلايا الجذعية. B) المحورية ، C) الاكليلية و D) الصور المسيئة للالسهمي MR T2 ، تأثير سلبي على النقيض من USPIO المسمى الخلايا الجذعية (السهام البيضاء) حقن الفئران في الدماغ.
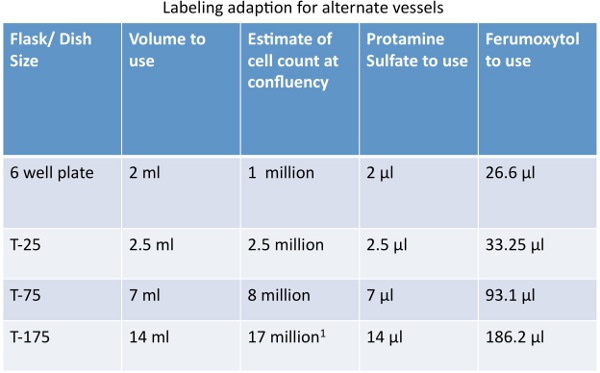
adaptions الجدول الكمية 1. لوصفها الخلايا في الاوعية بديل.
Discussion
تحسين فعالية engraftments الخلايا الجذعية هو أمر حاسم لتطوير الطب التجديدي. وهناك تقنية التصور غير الغازية للخلايا الجذعية في الجسم الحي يعزز بشكل كبير من قدرتنا على فهم الآليات التي تؤدي إلى نتائج engraftment ناجحة. وسم المغناطيسي لرؤية MR ، مثل إجراء أننا أظهرنا ، ويسمح في الجسم الحي تتبع الخلايا الجذعية مع التصوير بالرنين المغناطيسي. الخلايا الجذعية المسمى مغناطيسيا سبق زرعها في الأنسجة المستهدفة ، وقد يصل إلى تصور أسابيع مع التصوير بالرنين المغناطيسي 7. على المدى الطويل وضع العلامات والتصوير الطولي هو ممكن نظرا لتخزين الليزوزومية من جزيئات أكسيد الحديد داخل الخلايا 8. التحديات ، ومع ذلك ، لا تتوافق مع مراقبة على المدى الطويل من الحديد الخلايا المسمى. أحد التحديات المرتبطة التصوير الطولي للحديد هو أن الخلايا المسمى الأصحاء ، تتكاثر خلايا قابلة للحياة وتوزع وكيل النقيض من daughteخلايا ص. توزيع وكيل النقيض من الخلايا الوليدة والنتائج غير متساوية في تخفيف تأثير ملحوظ للعامل تباين مع مرور الوقت. والتحدي الثاني يرتبط مع مراقبة على المدى الطويل من الحديد الخلايا المسمى هو التفريق بين الخلايا ، وصفت أصلا قابلة للحياة من البالعات المقيمين ، مثل الخلايا البلعمية الكبيرة ، التي قد يكون عامل تباين phagocytosed صدر من الخلايا ، وصفت ميتة أصلا 4. وقد حددت المجموعة خلافاتنا في إشارة حركية على المدى الطويل قادرة على البقاء وأفكارك زرع الخلايا الجذعية ، التي تم المسمى مع جزيئات أكسيد الحديد بخلاف ferumoxytol 9-11. ثمة حاجة إلى دراسات مستقبلية لتحديد ما إذا كانت هذه المبادئ تنطبق أيضا على زرع الخلايا ferumoxytol المسمى.
بينما في هذه الدراسة ferumoxytol الآثار المحتملة يمكن أن تعرض العلامات على قدرة تمايز الخلايا الجذعية لم يدرس ، وقد أثبتت الدراسات السابقة تأثير الجرعة التي تعتمد على سبيو differenويمكن أيضا القدرة tiation وجرعات سبيو التي لا تضعف إمكانية التمايز ، مما يوحي ، جرعة ferumoxtyol لا ينتقص من قدرة تمايز الخلايا الجذعية تحدد 12 و 13.
وقد طبقت SPIOs كبيرة (قطرها الهيدروديناميكية> 50 نانومتر) سابقا لأغراض تتبع الخلية التالية وسم الخلايا الجذعية عبر تقنيات مختلفة بما في ذلك وضع العلامات حضانة بسيطة وترنسفكأيشن مع وكلاء أو electroporation ترنسفكأيشن مثل بروتامين ، وبولي lipofectin - L - يسين (PLL) 3 ، 13-16. ، على الرغم من أن ليس من الضروري دائما لوسم الخلية مع SPIOs ، وأساليب ترنسفكأيشن لوسم الخلية أثبتت مفيدة لتسهيل وضع العلامات وزيادة كفاءة استخدام العلامات 15. SPIOs التي كانت تستخدم لوضع العلامات الخلية ، ومع ذلك ، لم يعد يجري إنتاجها لأسباب تجارية. Ultrasmall سبيو (USPIO ، وقطره الهيدروديناميكية <50 نانومتر) مثل ferumoxytol ، لا تزال من ناحية أخرى يتم إنتاجهاولكنها تحتاج إلى مساعدة من وكيل ترنسفكأيشن لتحقيق كفاءة امتصاص الخلوية 8. سلفات بروتامين هو عامل ترنسفكأيشن ينطبق سريريا أن أشكال المجمعات مع USPIOs لتسهيل امتصاص أكلة الوكيل على النقيض من الخلايا الجذعية 17. الجمع بين وافقت عليها الهيئة سلفات بروتامين مع USPIO وافقت عليها الهيئة ، ferumoxytol ، ويوفر القدرة على الترجمة السريرية لتقنيات تعقب الخلايا الجذعية عن طريق خارج التسمية استخدام هذا العامل. من الملاحظة ، وقد أثبتت ferumoxytol ملف تعريف السلامة الممتاز 18 في التجارب السريرية. ورؤية مباشرة للخلايا المزروعة عبر تقنية مثل واحد تظاهر تسمح لفهم أفضل للعوامل التي تعزز أو تعوق نجاح عملية زرع الخلايا الجذعية وتساعد على تحديد التقنيات الواعدة بالنسبة إلى التطبيقات السريرية. مع استخدام علامات الخلية المطبقة سريريا ومعدات التصوير ، وهذه تقنية التصوير من حيث المبدأ ، يمكن الوصول إليها بسهولةللمرضى الذين خضعوا لعمليات زرع الخلايا الجذعية.
Disclosures
جميع المساهمين في هذه الدراسة لا تقدم الافصاحات.
Acknowledgements
وأيد هذا العمل من خلال منحة من المعهد الوطني لالتهاب المفاصل والعضلات والعظام والأمراض الجلدية : 3R01AR054458 - 02S2.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | تعليق (اختياري) |
| D - MEM الجلوكوز السامية | سيغما | D5648 | أو متوسطة قاعدة أخرى لوقف خط الخلية المطلوب ليتم استخدامها |
| D - PBS (كا + + ، المغنيسيوم + + الحرة) | GIBCO | 14190-144 | |
| التربسين - EDTA 0.05 ٪ | Invitrogen | 25300-120 | |
| الجنين مصل البقر (FBS) | Hyclone | SH30071.03 | |
Ferumoxytol (Feraheme) | AMAG | 59338-0775-01 | |
| سلفات بروتامين | APP فارم. | 22930 |
References
- Narsinh, K. H., Plews, J., Wu, J. C. Comparison of human induced pluripotent and embryonic stem cells: fraternal or identical twins?. Mol Ther. 19, 635-638 (2011).
- Bulte, J. W. In vivo MRI cell tracking: clinical studies. AJR. Am. J. Roentgenol. 193, 314-325 (2009).
- Henning, T. D., Boddington, S., Daldrup-Link, H. E. Labeling hESCs and hMSCs with Iron Oxide Nanoparticles for Non-Invasive in vivo Tracking with MR Imaging. J. Vis. Exp. (13), e685-e685 (2008).
- Tallheden, T., Nannmark, U., Lorentzon, M. In vivo MR imaging of magnetically labeled human embryonic stem cells. Life. Sci. 79, 999-1006 (2006).
- Jung, C. W., Jacobs, P. Physical and chemical properties of superparamagnetic iron oxide MR contrast agents: ferumoxides, ferumoxtran, ferumoxsil. Magn. Reson. Imaging. 13, 661-674 (1995).
- Coyne, D. W. Ferumoxytol for treatment of iron deficiency anemia in patients with chronic kidney disease. Expert. Opin. Pharmacother. 10, 2563-2568 (2009).
- Li, Z., Suzuki, Y., Huang, M. Comparison of reporter gene and iron particle labeling for tracking fate of human embryonic stem cells and differentiated endothelial cells in living subjects. Stem Cells. 26, 864-873 (2008).
- Metz, S., Bonaterra, G., Rudelius, M. Capacity of human monocytes to phagocytose approved iron oxide MR contrast agents in vitro. Eur. Radiol. 14, 1851-1858 (2004).
- Nedopil, A., Klenk, C., Kim, C. MR signal characteristics of viable and apoptotic human mesenchymal stem cells in matrix-associated stem cell implants for treatment of osteoarthritis. Invest. Radiol. 45, 634-640 (2010).
- Kraitchman, D. L., Heldman, A. W., Atalar, E. In vivo magnetic resonance imaging of mesenchymal stem cells in myocardial infarction. Circulation. 107, 2290-2293 (2003).
- Stuckey, D. J., Carr, C. A., Martin-Rendon, E. Iron particles for noninvasive monitoring of bone marrow stromal cell engraftment into, and isolation of viable engrafted donor cells from, the heart. Stem Cells. 24, 1968-1975 (2006).
- Henning, T. D., Sutton, E. J., Kim, A. The influence of ferucarbotran on the chondrogenesis of human mesenchymal stem cells. Contrast. Media. Mol. Imaging. 4, 165-173 (2009).
- Arbab, A. S., Yocum, G. T., Kalish, H. Efficient magnetic cell labeling with protamine sulfate complexed to ferumoxides for cellular MRI. Blood. 104, 1217-1223 (2004).
- Nedopil, A. J., Mandrussow, L. G., Daldrup-Link, H. E. Implantation of Ferumoxides Labeled Human Mesenchymal Stem Cells in Cartilage Defects. J. Vis. Exp. (38), e1793-e1793 (2010).
- Arbab, A. S., Yocum, G. T., Wilson, L. B. Comparison of transfection agents in forming complexes with ferumoxides, cell labeling efficiency, and cellular viability. Mol Imaging. 3, 24-32 (2004).
- Babic, M., Horak, D., Trchova, M. Poly(L-lysine)-modified iron oxide nanoparticles for stem cell labeling. Bioconjug Chem. 19, 740-750 (2008).
- Golovko, D. M., T, H. e. n. n. i. n. g., Bauer, J. S. Accelerated stem cell labeling with ferucarbotran and protamine. Eur. Radiol. 20, 640-648 (2010).
- Lu, M., Cohen, M. H., Rieves, D. FDA report: Ferumoxytol for intravenous iron therapy in adult patients with chronic kidney disease. Am. J. Hematol. 85, 315-319 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved