Method Article
Les analyses de croissance pour évaluer la toxicité de polyglutamine dans la levure
Dans cet article
Résumé
Ce manuscrit décrit trois protocoles complémentaires pour évaluer la toxicité de polyglutamine (polyQ)-extension protéines dans la levure Saccharomyces cerevisiae. Ces protocoles peuvent être facilement modifié pour contrôler la toxicité d'autres protéines mal repliées dans la levure.
Résumé
Mauvais repliement des protéines est associée à de nombreuses maladies humaines, en particulier les maladies neurodégénératives, telles que la maladie d'Alzheimer, la maladie de Parkinson, la maladie de Huntington 1. La maladie de Huntington (HD) est provoquée par l'expansion de polyglutamine anormale d'un (polyQ) dans la région la protéine huntingtine. La protéine huntingtine polyQ-expansé atteint une conformation aberrante (c'est à dire qu'il misfolds) et entraîne une toxicité cellulaire 2. Au moins huit autres maladies neurodégénératives sont causées par des polyQ-extensions, y compris le spinocérébelleuse Ataxies et la maladie de Kennedy 3.
La levure organisme modèle a facilité des informations importantes sur la base cellulaire et moléculaire de la polyQ-toxicité, y compris l'impact des facteurs intra-et inter-moléculaire de polyQ-toxicité, et l'identification des mécanismes cellulaires qui sont déficients dans les cellules exprimant l'expansion polyQ- protéines 3-8. Importantment, de nombreux aspects de polyQ-toxicité qui ont été trouvés dans la levure ont été reproduites dans d'autres systèmes expérimentaux et dans une certaine mesure dans des échantillons provenant de patients HD, démontrant ainsi l'importance du modèle de la levure pour la découverte des mécanismes de base qui sous-tendent polyQ-toxicité.
Une manière directe et relativement simple de déterminer la toxicité polyQ-dans la levure est de mesurer les défauts de croissance de cellules de levure exprimant polyQ-expansion protéines. Ce manuscrit décrit trois approches expérimentales complémentaires pour déterminer la toxicité polyQ-dans la levure par la mesure de la croissance des cellules de levure exprimant polyQ-expansion protéines. Les deux premières approches expérimentales de surveiller la croissance des levures sur les assiettes, la troisième approche surveille la croissance des cultures de levures liquides en utilisant l'instrument BioscreenC.
En outre, ce manuscrit décrit les difficultés expérimentales qui peuvent survenir lors de la manipulation des modèles polyQ levure et décrit les stratégies qui vous aideront à éviter ou àminimiser ces difficultés. Les protocoles décrits ici peuvent être utilisées pour identifier et à caractériser les voies génétiques et des petites molécules qui modulent polyQ-toxicité. En outre, les tests décrits peuvent servir de modèles pour des analyses précises de la toxicité causée par d'autres maladies associées à des protéines mal repliées dans les modèles de levure.
Protocole
1. Expression des toxiques polyQ-expansion protéines chez la levure
Une analyse systématique a mis en place la séquence d'acides précise aminés d'une protéine polyQ-expansion qui est nécessaire pour produire une toxicité chez la levure 7. Ce toxique polyQ-dilatation protéine contient un groupe amino-terminal de FLAG-tag suivie par 17 acides aminés de la séquence originale de la protéine huntingtine, une région polyQ, et une fusion carboxy-terminale à une protéine fluorescente (GFP ou l'autre ou PCP, voir figure 1a). L'expression de protéines avec des expansions polyQ de 46 glutamines ou plus (par exemple 72 et 103 glutamines) produit une toxicité chez la levure lorsqu'il est exprimé sous le contrôle de l'inductible et solide par rapport promoteur GAL1 7, 9.
Comme décrit précédemment, la toxicité polyQ dans la levure n'est qu'apparente dans les cellules qui transportent l'Rnq1p protéine dans sa conformation prion, [RNQ +], par exemple, la souche de levure W303 9. Le r protéine toxique polyQ-expansionecapitulates aspects centraux de la polyQ-biologie dans la levure, telles que polyQ dépendant de la longueur de toxicité (voir ci-dessous) et d'agrégation (Figure 1 b). Notamment, toxiques polyQ-expansion protéines ne tuent pas les cellules de levure immédiatement; ils sont plutôt nuire ou d'arrêter le cycle cellulaire et devision cellule, ce qui ralentit ou inhiber la croissance de colonies de levures sur des plaques ou des cultures liquides (nos données non publiées).
2. Problèmes potentiels avec cellules de levure exprimant toxiques polyQ-expansion protéines
Les cellules de levure exprimant les protéines toxiques d'expansion polyQ contraire ne peut pas montrer tout défaut une croissance de 9. La nature génétique de ces suppresseurs de polyQ-toxicité ne semble pas être fondée sur de simples mutations mendéliennes et ne peut donc se produire avec une fréquence relativement élevée (nos résultats non publiés). Nous pensons que ces suppresseurs spontanés sont causées par le durcissement des prions non identifiés qui fonctionnent de façon similaire à [RNQ +] pour déterminer toxicity.Thes polyQe suppresseurs spontanés de toxicité polyQ peut mettre en péril la réussite de toute expérience qui vise à caractériser la toxicité polyQ ou pour identifier et caractériser des modificateurs de la toxicité polyQ.
Afin d'éviter l'apparition fréquente de ces suppresseurs spontanés, suivez les mesures de précaution décrites ci-dessous, qui se sont avérées très efficaces:
- Utiliser des cellules de levure fraîche pour des expériences de toxicité. Ne pas stocker la levure pendant de longues périodes de temps. Foire de récupérer des colonies de levures fraîches en provenance de stocks congelés.
- Surveiller fréquemment l'expression et l'agrégation des toxiques polyQ-expansion protéines par microscopie à fluorescence.
- Gardez les cellules de levure dans les médias qui répriment l'expression de la toxicité toxique polyQ en tout temps (c.-à-dans des milieux sélectifs contenant du glucose comme seule source de carbone) avant de commencer toute mesures de toxicité.
- Utilisez au moins trois transformants indépendants pour chaque expérience polyQ-toxicité.
3. Les analyses de croissance
- Pour chaque condition expérimentale, ensemencer une colonie de chaque de trois transformants indépendants de cellules de levure hébergeant le toxique polyQ-expansion protéines dans 3 ml de levure médias sélectifs avec du glucose comme seule source de carbone.
- Incuber ces cultures la nuit à 30 ° C. Dans ces conditions, les cellules ne sont pas l'expression de la protéine de polyQ-expansion parce que le glucose dans le milieu réprime leur expression. Ne laissez pas envahir ces cultures; garder la DO 600 (absorbance de la lumière de longueur d'onde de 600 nm) des cultures de la nuit en dessous de 1.
- Nous utilisons régulièrement trois dosages différents pour surveiller les défauts de croissance de cellules de levure exprimant la toxicité polyQ-expansion protéines:
3.1 Croissance sur des plaques
- Diluer les cultures de levure nuit (cultivé avec 220 secousses tpm) pour une DO 600 de 0,0005 (soit une dilution 1:1000 d'une DO600 = 0,5) la culture dans sélective moidia 7 contenant du glucose.
- Répartir uniformément 50 pi (résultant dans le CA. 700 colonies par plaque) de chaque culture diluée sur une plaque (10 cm de diamètre) avec un milieu sélectif contenant du glucose comme seule source de carbone et une plaque avec un milieu sélectif contenant du galactose comme seule source de carbone.
- Incuber les boîtes pendant trois à quatre jours à 30 ° C. Après l'incubation, de prendre des photos de chaque plaque et compter le nombre de colonies sur le glucose et le nombre de colonies sur les plaques de galactose. Dans des conditions idéales, il devrait y avoir aucun ou seulement très peu de colonies sur la plaque de galactose lors de l'utilisation des cellules de levure exprimant une très toxique polyQ-expansion protéines (103 octodecies, figure 2a).
3.2 dosages Spotting
Ce test est plus quantitative que le dosage de placage décrite ci-dessus et peut donc révéler même des différences subtiles dans la toxicité polyQ avec la même expérience sur la même plaque.
- Diluer le overnuit cultures cultivées dans un milieu avec du glucose pour une DO 600 de 0,1.
- Introduire à la pipette 200 ul de ces cultures stériles dilués dans des plaques 96 puits et de préparer cinq dilutions quintuplé en série dans l'eau stérile à l'aide d'une pipette multi-canaux.
- L'utilisation d'un Frogger, (aussi appelé un observateur, avec 8 x 6 broches pour le transfert de cellules en suspension) transférer les suspensions cellulaires sur des plaques contenant des milieux sélectifs avec du glucose comme seule source de carbone et des plaques contenant des milieux sélectifs avec du galactose comme seule source de carbone.
- Laisser les plaques sécher avant de les incuber à 30 ° C pendant trois à quatre jours.
- Après l'incubation, de prendre des photos de chaque plaque (Figure 2b).
3,3. Surveillance de la toxicité polyQ dans la levure par la croissance des cultures en milieu liquide
Ce protocole est le plus quantitative (DO600 numéros) des trois essais décrits ici et peut même détecter des différences très subtiles de la toxicité des polyQ. Le précitée ocCurrence de suppresseurs spontanés, cependant, peut potentiellement produire des résultats trompeurs. Je recommande donc cet essai combinant avec au moins un des deux essais de placage décrits ci-dessus. Nous proposons d'utiliser l'instrument BioscreenC pour ces expériences. Le BioscreenC est un instrument qui mesure automatiquement la densité optique des cultures de levures dans 100 des plaques tout en incubés à des températures définies avec l'agitation défini. D'autres méthodes pour cultiver des cellules de levure et de mesurer leur densité optique peuvent également s'appliquer.
- Laver les cellules de levure à partir de supports minimaux contenant du glucose comme seule source de carbone trois fois dans 3 ml d'eau stérile.
- Diluer les cultures de la nuit cultivées dans un milieu avec du galactose à une DO 600 de 0,1.
- Remplir chaque puits de la plaque 100-bien BioscreenC avec 300 pl des cultures de levures.
- Ouvrez le programme Expérience facile Bioscreen. Déterminer le nombre d'échantillons que vous souhaitez surveiller (y compris les ébauches et les moyennes seulementcontrôles), régler la température à 30 ° C, régler la longueur des expériences pour 3 jours, de définir les intervalles de mesure à 15 minutes, régler le filtre à 600 nm / Brown, et définir le mode d'agitation pour 15 secondes avant chaque mesure à force moyenne.
- L'instrument BioscreenC et le logiciel ci-joint sera de produire des feuilles de calcul Excel chaque point de données prises pendant l'expérience.
- Préparer les courbes de croissance avec Excel pour chaque échantillon et comparer la croissance des différents échantillons (figure 2c). Une description détaillée de l'analyse des données produites par les expériences BioscreenC a été fourni avant le 10.
4. Les résultats représentatifs
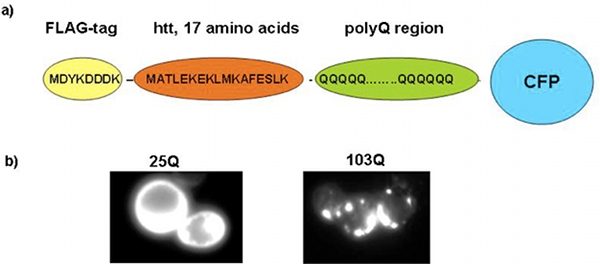
Figure 1. Le modèle de la levure polyQ. a) Représentation schématique de la toxicité polyQ-expansion protéines. b) La microscopie à fluorescence montrant des cellules de levure exprimant un court, non-toxique polyQcellules de protéines d'expansion (25Q, panneau de gauche) et de levure exprimant un long, toxique polyQ-expansion protéines (103 octodecies, panneau de droite).

Figure 2. Les résultats représentatifs de tests de croissance de cellules de levure exprimant polyQ-expansion protéines. a) test de placage. Environ 700 cellules de levure ont été étalés sur des plaques et incubées pendant trois jours à 30 ° C. Le panneau supérieur présente une plaque contenant milieu glucose, soit l'expression de la toxicité polyQ-dilatation protéine (103 octodecies) n'est pas induite. Le panneau inférieur présente une plaque de support de levure contenant du galactose, à savoir l'expression de la toxicité polyQ-dilatation protéine est induite. Notez que dans l'expérience décrite ici, pas de suppresseur spontanée a eu lieu. B) Repérer dosage. Cinq série de cinq dilutions de cellules de levure héberger soit un non-protéine toxique polyQ (25Q) ou une substance toxique polyQ-expansion protein (103 octodecies) ont été repérés sur des plaques de glucose qui répriment l'expression des protéines (panneau de gauche) ou sur des plaques de galactose qui induisent leur expression. Les plaques ont ensuite été incubées pendant trois jours à 30 ° C. c) expérience BioscreenC. La croissance des cultures de cellules de levure exprimant soit un non-protéine toxique polyQ (25Q) ou une substance toxique polyQ-expansion protéines (103 octodecies) ont été suivis par le instrument BioscreenC. Les conditions expérimentales et l'analyse des expériences BioscreenC sont décrits dans le texte principal.
Discussion
Ce manuscrit présente trois approches expérimentales complémentaires pour mesurer la toxicité polyQ-dans la levure organisme modèle fondé sur une croissance réduite des cellules de levure exprimant toxiques polyQ-expansion protéines. Travail dans la levure a offert un aperçu de profondes dans les mécanismes de base cellulaires et moléculaires de repliement des protéines et de sa toxicité qui a suivi, y compris le mauvais repliement et la toxicité des polyQ-expansion protéines 9,11,12. Des expériences basées sur les protocoles présentés ici ont déjà permis d'identifier et de caractériser les exhausteurs génétiques ou des suppresseurs de toxicité polyQ, les modificateurs de petites molécules de toxicité polyQ, et les mécanismes cellulaires qui sous-tendent la toxicité polyQ 5-8,13,14.
Les protocoles présentés peuvent être facilement adaptés pour explorer d'autres modificateurs de toxicité polyQ tels que différentes conditions de croissance ou des mutations génétiques qui réduisent ou exacerbent la toxicité polyQ. En outre, le protocole présenté expérimentalepeut facilement être ajustée pour tester la toxicité d'autres toxiques protéines mal repliées dans la levure.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Le travail dans le laboratoire Duennwald est pris en charge par des subventions de la Fédération américaine pour recherche sur le vieillissement (AFAR), la Fondation des maladies héréditaires (HDF) et la Fondation William Wood.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'instrument | Entreprise | Numéro de catalogue | |
| Frogger (6x8 broches) | V & P scientifique, San Diego | VP 407 AH | |
| BioscreenC | Growthcurves États-Unis | 5101370 | |
| 100 puits ont en nid d'abeille | Growthcurves États-Unis | 9602550 |
Références
- Soto, C., Estrada, L. D. Protein misfolding and neurodegeneration. Arch. Neurol. 65, 184-189 (2008).
- Ross, C. A., Tabrizi, S. J. Huntington's disease: from molecular pathogenesis to clinical treatment. Lancet Neurol. 10, 83-98 (2011).
- Zoghbi, H. Y., Orr, H. T. Glutamine repeats and neurodegeneration. Annu. Rev. Neurosci. 23, 217-247 (2000).
- Meriin, A. B. Endocytosis machinery is involved in aggregation of proteins with expanded polyglutamine domains. FASEB J. 21, 1915-1925 (2007).
- Giorgini, F., Guidetti, P., Nguyen, Q., Bennett, C. S., Muchowski, P. J. A genomic screen in yeast implicates kynurenine 3-monooxygenase as a therapeutic target for Huntington disease. Nat. Genet. 37, 526-5231 (2005).
- Duennwald, M. L., Lindquist, S. Impaired ERAD and ER stress are early and specific events in polyglutamine toxicity. Genes Dev. 22, 3308-3319 (2008).
- Duennwald, M. L., Jagadish, S., Muchowski, P. J., Lindquist, S. Flanking sequences profoundly alter polyglutamine toxicity in yeast. Proc. Natl. Acad. Sci. U.S.A. 103, 11045-1150 (2006).
- Duennwald, M. L., Jagadish, S., Giorgini, F., Muchowski, P. J., Lindquist, S. A network of protein interactions determines polyglutamine toxicity. Proc. Natl. Acad. Sci. U.S.A. 103, 11051-116 (2006).
- Meriin, A. B. Huntington toxicity in yeast model depends on polyglutamine aggregation mediated by a prion-like protein Rnq1. J. Cell. Biol. 157, 997-1004 (2002).
- Murakami, C., Kaeberlein, M. Quantifying Yeast Chronological Life Span by Outgrowth of Aged Cells. J. Vis. Exp. (27), e1156-e1156 (2009).
- Gitler, A. D. Beer and bread to brains and beyond: can yeast cells teach us about neurodegenerative disease. Neurosignals. 16, 52-62 (2008).
- Giorgini, F., Muchowski, P. J. Screening for genetic modifiers of amyloid toxicity in yeast. Methods Enzymol. 412, 201-222 (2006).
- Ehrnhoefer, D. E. Green tea (-)-epigallocatechin-gallate modulates early events in huntingtin misfolding and reduces toxicity in Huntington's disease models. Hum. Mol. Genet. 15, 2743-2751 (2006).
- Cashikar, A. G., Duennwald, M., Lindquist, S. L. A chaperone pathway in protein disaggregation. Hsp26 alters the nature of protein aggregates to facilitate reactivation by Hsp104. J. Biol. Chem. 280, 23869-2375 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon