Method Article
Physiologiques, caractérisation morphologique et neurochimiques des neurones modulée par le Mouvement
Dans cet article
Résumé
Une technique est décrite pour quantifier la réponse physiologique au in vivo des neurones de mammifères pendant le mouvement et de corréler la physiologie du neurone avec une morphologie neuronale, le phénotype neurochimique et microcircuits synaptique.
Résumé
Le rôle des neurones individuels et leur fonction dans les circuits neuronaux est fondamentale pour comprendre les mécanismes neuronaux de fonctions sensorielles et motrices. La plupart des enquêtes sur des mécanismes sensori compter ni sur l'examen des neurones tout en un animal est de 1,2 statiques ou enregistrer l'activité neuronale extracellulaire lors d'un déplacement. 3,4 Bien que ces études ont fourni le contexte fondamental de la fonction sensorimotrice, soit ils n'évaluent pas l'information fonctionnelle qui se produit pendant un mouvement ou qui sont limités dans leur capacité à caractériser complètement le phénotype anatomie, la physiologie et neurochimique du neurone. Une technique est montré ici, qui permet une caractérisation complète de neurones individuels pendant une vivo dans le mouvement. Cette technique peut être utilisée non seulement pour étudier les neurones afférents primaires, mais aussi pour caractériser les motoneurones et les interneurones sensori-motrices. Initialement, la réponse d'un seul neurone est enregistrée en utilisant des méthodes électrophysiologiques au cours des différents mouvements de la mandibule suivie par la détermination du champ réceptif pour le neurone. Un traceur neuronal intracellulaire est alors injecté dans le neurone et le cerveau sont traitées de telle sorte que le neurone peut être visualisée en microscopie optique, électronique ou confocale (Fig. 1). La morphologie détaillée des neurones est alors caractérisé reconstitué de manière que la morphologie neuronale peut être corrélé avec la réponse physiologique du neurone (fig. 2,3). Dans cette communication, les principaux détails importants et des conseils pour la mise en œuvre réussie de cette technique sont fournis. De précieuses informations complémentaires peuvent être déterminées pour le neurone à l'étude, en combinant cette méthode avec d'autres techniques. Rétrograde étiquetage neuronales peuvent être utilisées pour déterminer les neurones avec lesquels les synapses des neurones marqués; permettant ainsi la détermination détaillée des circuits neuronaux. Immunocytochimie peut être combinée avec cette méthode pour examiner les neurotransmetteurs dans le neurone marqué et pour déterminer les phénotypes chimiques des neurones avec lesquels les synapses des neurones marqués. Le neurone marqué peut également être traitées pour la microscopie électronique pour déterminer les caractéristiques ultrastructurales et microcircuits du neurone étiquetés. Globalement, cette technique est une méthode puissante pour bien caractériser les neurones au cours du mouvement in vivo permettant ainsi des renseignements importants sur le rôle des neurones dans la fonction sensori-motrices.
Protocole
1. Préparation des animaux
- Anesthetize rat avec du pentobarbital de sodium (50mg/kg IP) et les placer sur un coussin chauffant. Rasez la peau recouvrant le crâne avec une tondeuse postérieure animal. Vérifiez l'animal pour s'assurer que le niveau chirurgical du niveau de l'anesthésie a été obtenue par des tests de l'absence d'un réflexe de retrait et de la vocalisation lorsque les doigts sont pincés ainsi que l'absence d'un réflexe palpébral. Vérifier le niveau d'anesthésie toutes les 15 minutes et maintenir un niveau chirurgicale de anesthetisa par des injections de pentobarbital de sodium 15mg/kg toutes les 45 minutes.
- Utiliser une technique aseptique et faire une incision dans la région inguinale juste distale au pli formé par l'abdomen et la cuisse intérieure et insérer une canule (1 mm de diamètre, Clay Adams) dans la veine fémorale et l'artère fémorale. Faire une incision médiane dans la région sous-mandibulaire, les muscles sous-hyoïdiens reflètent. Faire une petite incision dans la trachée et insérer une canule (2 mm de diamètre) pour permettre la ventilation. Tye une suture autour de l'trachael cannual pour le fixer en place.Monitor la pression artérielle systémique systolique et diastolique par la canule artérielle. En plus de surveiller le retrait et réflexe palpébral maintenant surveiller la pression artérielle pour évaluer le niveau de l'anesthésie. Administrer une anesthésie supplémentaires si nécessaire par la canule veineuse.
- Placez le rat dans un cadre stéréotaxique et d'effectuer une craniotomie pour exposer le cervelet. Fixer la canule trachéale à un ventilateur de rongeurs. Aérer l'animal avec un volume de 2 cm 3 à un taux de 100/min avec de l'air humidifié. Une pression expiratoire positive de 1 cm H 2 O devraient être maintenus pour éviter l'effondrement du poumon. Toutes les 15 minutes hyperinflate les poumons pour éviter une atélectasie. Puis couvrir la surface du cerveau avec de l'huile minérale chauffée (30 ° C). Soyez prudent pour éviter les grands sinus veineux situé directement sous la jonction entre les os pariétal et interpariétales.
- Appliquez de la colle cyanoacrylate à une tige couplé à un vibrateur électromagnétique et attacher la tige dans le diastème de la mâchoire. Déplacer les signaux de commande en utilisant la mandibule vers le vibreur soit d'une sortie A / D de l'ordinateur ou d'un générateur de signal.
- Placez une électrode siliver-chlorure d'argent mise à la terre sous la peau adjacente à la craniotomie.
2. Préparation de l'électrode
- Fabriquer des microélectrodes en verre de quartz ou aluminosilicate aide d'un extracteur de microélectrodes horizontale.
- Remplissez la microélectrode avec biotinamide 5-10% dissous dans 0,25 M de KCl et 0,5 M de tampon Tris-HCl (pH 7,6) ou tetramethlyrhodamine 2% dans une solution saline (pH 6). Vérifiez l'impédance d'électrode avec un testeur de l'électrode. Pour enregistrer à partir des axones de grand diamètre fabriquer des électrodes avec une impédance de 60 Ω-80M, pour les petites et les axones des interneurones fabriquer des électrodes avec une impédance de 80-150MΩ.
- Placez la microélectrode dans le stade de la tête de l'électromètre. Visualisez l'électrode à travers un petit télescope (20X avec un réticule de joint) qui est fixé en position derrière la tête de l'animal. En utilisant le télescope est importante car elle permet d'être électrodes positionnées stéréotaxique avec une grande précision.
3. D'enregistrement électrophysiologiques et coloration intracellulaire
- Faites une petite ouverture dans la pie-mère et surcompenser les commentaires de capacitance de sorte que lorsque l'électrode touche le cerveau un signal de retour est produite. Ceci permet une localisation précise de la surface du cerveau.
- Produire répétées déplacement mandibulaire et faire progresser l'électrode dans le cerveau avec un moteur pas à pas.
- Reconnaître impalements neuronale par une chute brutale du potentiel de DC et identifier intrasomatic impalements neuronale par l'activité synaptique en cours. La vibration de l'électrode avec la surcompensation de la capacité ou de taraudage produisent rarement une pénétration cellulaire de succès. En raison de la haute impédance des électrodes, des réponses neuronales sont rarement observés avant la pénétration.
- Une fois que vous empaler un neurone et la pénétration est considérée comme stable, caractériser la réponse des neurones utilisant la rampe, les détenir et mouvement de la mâchoire sinusoïdale. 5 Carte du champ récepteur des neurones en sondant la peau autour de la tête et intra cavité buccale avec une sonde non-conducteur comme un bâton de bois. Si cela est pertinent à l'étude, d'examiner la réponse du neurone à d'autres stimuli fonctionnellement pertinents tels que la contraction musculaire et des stimuli nocifs. Primaire 6 afférente nociceptive récepteurs neuronaux réagir à des stimuli nociceptifs. Anesthesetics général tels que le sodium pentobarbital ne pas bloquer la conduction axonale dans les neurones afférents primaires mais plutôt baisser la transmission synaptique. Ainsi conduction axonale dans l'axone des neurones afférents primaires est préservée.
- Injecter courant continu (CC, 1-4NA) pour une durée d'injection totale de 15 70nA minutes. Surveiller la pénétration électrode pendant l'injection de courant et cesser si le potentiel de membrane devient plus positif que -30 mV.
4. Le traitement des tissus
- Euthanasier l'animal par une surdose de pentobarbital (140mg/kg IV) et perfuser avec un vasculaires rinçage (NaCl 0,9% à 38 ° C contenant 500 unités d'héparine et de 2% 1ml xylocaïne suivi par du paraformaldéhyde à 4% en tampon phosphate 0,1 M (pH 7,4) .
- Enlever le cerveau et la section, il à 50-100 microns en utilisant un vibratome soit dans le frontal, sagittal ou horizontal. Secions sont collectés flottement libre dans 25 ° C PBS.
- Processus du cerveau pour la DAB par incubation dans du sérum de chèvre normal de 1-2% et 1% de Triton X-100 dans PBS 0,01 M suivie d'une incubation de l'avidine biotine (1:50 Elite Vectastain). Réagir à l'aide des sections de nickel-DAB avec H 2 O 2. Pour traiter pour le Texas Red, incuber dans des sections complexe avidine-biotine (1:50) dans le PBS pendant une nuit à 4 ° C puis incuber à 4% au Texas Red DCS avidine dans PBST à 4 ° C pendant la nuit. Contre-sections avec une lampe fluorescente Nissl tache (NeuroTrace) 20min à 23 ° C.
- Si neurone a été injecté avec de la rhodamine, de visualiser les neurones injectés directement avec un microscope à fluorescence (Ex 545nm).
5. Combinant méthode avec marquage rétrograde, immunocytochimie, imagerie confocale, analyse quantitative colocalisation
Le succès de combiner cette technique avec d'autres méthodes dépend largement de marquage intracellulaire bon.
- La méthode visualisés ici peut facilement être combiné avec l'étiquetage neuronaux rétrogrades. 7-10 Pour ce faire, anesthésier l'animal et en utilisant une technique aseptique, injecter un traceur neuronal comme la peroxydase de raifort (20% peroxydase de raifort. Sigma VI, Sigma) et 1% de germe de blé aggultinated peroxydase de raifort (Sigma) dans les régions cibles périphériques tels que le muscle masséter. Ce traceur neuronal sera repris dans les axones périphériques et transportés via le transport axonal de la soma du motoneurone. Pour le muscle masséter, 15μl de traceur est injecté dans le muscle en utilisant une solution stérile 10 microseringue microlitre. Les animaux sont ensuite placés sur un coussin chauffant et surveillés jusqu'à ce récupéré de l'anesthésie et ensuite placés dans leurs cages pour la récupération. Après 24h, anesthésier les animaux et physiologiquement caractériser les neurones et intracellulairement les tacher. Puis perfuser l'animal tel que décrit ci-dessus et des coupes de tissus processus pour la présence de HRP utilisant tétraméthylbenzidine (TMB) comme chromogène et le tungstate de sodium comme stabilisateur et intensifiée avec le cobalt. Placer dans des sections de sodium à 1% tungstate dissous dans 0,1 M PBS (pH 6,5) et TMB 0,0007% dissous dans l'éthanol absolu et de l'acétone à 15 ° C pendant 20 min. Puis des coupes de tissus réagissent en ajoutant 1,0 ml de 0,3% H 2 O 2 par 100 ml de solution d'incubation pendant 60 min. Rincez le tissu dans 0,1 M de PBS (pH 6,5) et les placer dans diaminobenzidine 0,05% (pH 7,4), le cobalt 0,02% et 0,01% de H 2 O 2 dans 0,1 M PBS (pH 7,4) pendant 10 min. à 37 ° C. Traiter les tissus pour la visualisation des neurones injectés avec biotinamide tel que décrit et visualiser les relations entre les neurones sensoriels étiquetés et une variété de motoneurones.
- La technique montrée ici peut également facilement être combiné avec immnocytochemistry. 6 À titre d'exemple, immunocytochimique processus du cerveau pour la synaptophysine pour localiser avec précision des synapses dans les neurones marqués (Fig. 3). Pour ce faire, incuber des coupes de cerveau de souris anti-synaptophysine anticorps (1:10.000) pour 2 jours à 4 ° C et ensuite incuber dans FITC anti-souris (1:400) pour 1h à 23 ° C.
- Neurones marqués avec des marqueurs fluorescents ou transformés pour l'imagerie de fluorescence sont idéales pour l'imagerie confocale. La figure 3 est un exemple d'une section optique obtenue avec la microscopie confocale à travers un bouton axone. (Fig. 3). Générer des animations de neurones marqués par l'acquisition de plusieurs sections optiques à travers le neurone marqué (fig. 4).
- Neurones marqués par cette méthode peut être utilisée pour l'analyse quantitative colocalisation. Pour ce faire, utiliser une macro logiciels disponibles publiquement en conjonction avec les NIH image (qui se trouve au http://phy.ucsf.edu/ ° idl / colocalization.htm). Localiser synaptophysine dans les terminaisons axonales simple en combinant marquage intracellulaire avec immunocytochimie synaptophysine 6.
6. Les résultats représentatifs:
Un aperçu des résultats représentatifs qui peuvent être obtenus en utilisant cette méthode sont illustrés dans la Figure 1. Ce tronc cérébral seul neurone a été enregistrée au cours électrophysiologiquement mouvement de la mandibule et, comme on peut clairement être vu, la réponse de ce neurone (figure 1 en bas à gauche, la lumière bleue) a été modulée durant le mouvement. Ce neurone a été injecté avec biotinamide après caractérisation électrophysiologique et ensuite traitées pour être visualisées. Le neurone reconstruite (Figure 1 milieu, vert) peut être réelTed à un repère anatomique, dans ce cas, le noyau moteur du trijumeau désigné (cadre rouge). Basé sur la réponse neuronale pendant le mouvement et la reconstruction de ce neurone peut être identifié comme un neurone fuseau musculaire secondaires afférentes. La figure 2 illustre un exemple représentatif de la réponse physiologique d'un neurone lors d'un déplacement mâchoire. La réponse du neurone est représenté comme fréquence de tir instantané. Notez que la réponse neuronale imite étroitement déplacement mandibulaire indiquant que ce neurone particulier fournit la rétroaction sensorielle liée à la position mandibulaire. La figure 3 est une image à fort grossissement d'un axone intracellulaire teinté combiné avec coloration pour la synaptophysine et une Nissl tache. Notez la colocalisation de la synaptophysine (jaune) au sein de l'axone bouton. Figure 4 est une animation d'un seul neurone physiologiquement caractérisé et intracellulaire étiquetés.

Figure 1. Aperçu de la méthode. En haut à gauche: déplacement mandibulaire. Moyen d'enregistrement intracellulaire (vert) à partir seul neurone (jaune). La morphologie de ce neurone a été reconstruite après l'enregistrement intracellulaire et de l'injection. Contour rouge indique l'emplacement du noyau moteur du trijumeau. En bas à gauche: la réponse physiologique de ce neurone lors de mouvement de la mâchoire.
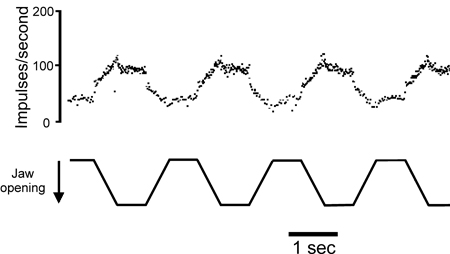
Figure 2. Représentant réponse physiologique d'un neurone sensoriel seul muscle in vivo enregistrées pendant le mouvement de la mandibule. Notez la similitude de la réponse neuronale avec déplacement mâchoire.

Figure 3. Terminal arborisation axonale avec boutons synaptiques (gonflements rouge) d'un neurone intracellulaire teinté sensorielles qui ont répondu au cours du muscle sondage. Après le traitement pour la synaptophysine immunocytochimiques montre la localisation de la synaptophysine dans le bouton axonal (jaune). Le vert est une Nissl colorant fluorescent.
Figure 4. Animation du fuseau musculaire neurone axone afférents primaires dont l'état physiologique de réponse a été enregistrée in vivo au cours des mouvements mandibulaires, l'axone a ensuite été teinté intracellulaire et traitées pour la visualisation.
Télécharger une vidéo haute résolution de la figure 4 ici
Télécharger une vidéo à résolution moyenne de la figure 4 ici
Discussion
La méthode illustrée ici est une technique puissante qui fournit des informations importantes sur la fonction des neurones individuels et la manière dont la réponse des neurones individuels contribue à des circuits neuronaux. 9 Cette connaissance est fondamentale pour comprendre la fonction sensori-motrices. La plus grande force de cette technique est qu'elle permet la détermination d'un grand nombre de paramètres sur un neurone dont la physiologie, la morphologie et de la morphologie synaptique et la distribution. Lorsqu'il est combiné avec d'autres techniques telles que les informations marquage rétrograde des neurones supplémentaires telles que les circuits neuronaux peut être caractérisée 7,8. Un autre avantage de cette méthode est qu'elle peut être apprise par étapes. Par exemple, l'enregistrement intracellulaire peut être réalisée initialement, suivie d'une coloration intracellulaire avec immunocytochimie ou rétrograde étiquetage neuronale ajouté après la maîtrise de la méthode initiale. Peut-être la plus grande limitation de cette technique est que seul un petit nombre de neurones peuvent être étiquetées dans une quelconque expérience d'un. Généralement deux à trois neurones d'un type particulier physiologiques sont initialement étiquetés. Une fois la relation potentielle entre la physiologie et la morphologie est formulé, des expérimentations supplémentaires sont utilisés pour vérifier attentivement cette relation dans des expériences dans lesquelles seul un seul neurone est étiqueté.
L'étape la plus cruciale pour le succès de cette méthode est de maintenir la stabilité électrophysiologique d'enregistrement intracellulaire. La stabilité d'enregistrement varient grandement en fonction de la localisation dans le cerveau des neurones à l'étude, mais un certain nombre de manipulations peuvent être utilisés pour augmenter la stabilité d'enregistrement. Un pneumothorax peut être effectuée et l'animal artificiellement ventilé pour réduire les pulsations respiratoires. La stabilité peut être encore augmenté par l'application d'une pression expiratoire positive d'environ 1 cm H 2 O. Lorsque la région d'intérêt dans le cerveau est atteint, la stabilité peut être améliorée par l'hyperventilation de l'animal en diminuant le volume respiratoire et augmente le rythme respiratoire. Certaines études électrophysiologiques ont appliqué agar chaud sur le cerveau et la canule de la vessie; ces procédures n'ont pas été efficaces pour augmenter la stabilité d'enregistrement des neurones dans le tronc cérébral. Il est important de souligner que les temps d'injection n'ont pas besoin d'être long. De bons résultats peuvent être obtenus avec des temps d'injection d'environ 5 minutes. En raison de la taille de petit pourboire des microélectrodes, la rupture de l'électrode dans le cerveau ne produisent généralement pas une grande libération du traceur. Par conséquent, l'électrode peut être remplacé et les neurones avec succès enregistrés et colorées au sein de plusieurs centaines de microns de l'emplacement de la rupture de l'électrode. Si l'électrode est bouché ou la solution d'enregistrement ne remplit pas l'extrémité de l'électrode de manière adéquate, le bruit sera grandement accrue et l'électrode doit être remplacée. Test d'impédance de l'électrode avant l'insertion dans le cerveau réduit considérablement étendues d'électrode improductifs et un gain de temps. Si vous tentez d'enregistrer à partir d'une petite région du positionnement stéréotaxique du cerveau est primordiale. J'utilise un télescope suspendu à la table d'enregistrement afin de maintenir un zéro fixe stéréotaxique. Le télescope est très utile parce que l'électrode peut être placée dans le porte-électrode attachée à la table d'enregistrement et puis affichés sous grossissement. Cela permet le placement très précis des microélectrodes et de remise à zéro des électrodes de remplacement.
Un certain nombre d'études récentes ont utilisé juxtacellulaire étiquetage neuronale. 11,12 Avec cette méthode, une électrode est placée à proximité d'un neurone en fonction des caractéristiques de l'enregistrement des neurones et un traceur neuronal est éjecté. Un problème évident potentiel de cette méthode est d'étiquetage fallacieux puisque traceur peut être incorporé dans les dendrites et les axones des neurones d'autres dans le voisinage de l'électrode. En outre, les relations d'entrée-sortie du neurone ne peut pas être déterminé parce que les potentiels d'action extracellulaires enregistrées peuvent être produites non seulement par l'entrée synaptique au neurone, mais par des propriétés intrinsèques du neurone. Avec la méthode décrite ici, les neurones ne sont étiquetés alors que la microélectrode est réellement dans le neurone et donc il n'ya aucune ambiguïté quant à l'attribution de l'activité neuronale au neurone tachés. Ceci est particulièrement important lorsque l'étiquetage des axones parce que le mouvement de la microélectrode par un résultat de quelques microns dans l'étiquetage fallacieux. De plus, les événements, y compris sous le seuil du potentiel synaptique peut être enregistré à partir du neurone empalé.
Des études futures pourraient combiner cette méthode avec des mouvements évoqués. Par exemple la stimulation corticale peut évoquer les mouvements de mastication et de la stabilité d'enregistrement dans le tronc cérébral doit permettre l'enregistrement intracellulaire et la coloration des neurones au cours de ces mouvements évoqués. Comme cette technique peut être fait avec une intervention chirurgicale minime, il peut également être possFIL à utiliser cette méthode pour injecter des substances qui modifient l'expression des gènes in vivo.
Déclarations de divulgation
Remerciements
Je remercie Anthony Taylor pour la formation initiale dans l'enregistrement intracellulaire in vivo et A Maxwell Brown et David de l'aide pour le développement initial de la technique de coloration intracellulaire. Je remercie M. Argent de l'aide pour la macro collocalization. Beaucoup de chercheurs avec lesquels j'ai collaboré aperçu fourni dans le développement de cette technique dont R. Donga, M. Moritani, P. Luo, R. Ambalavanar. Cette technique a été développée avec un soutien considérable de subventions des NIH DE10132, DE15386 et RR017971.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de réactif ou de l'équipement | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| vibrateur électromagnétique | Ling Dynamic Systems | V101 | |
| générateur de signaux | Systèmes Commentaires | PFG605 | capable de produire le signal de sortie trapézoïdale |
| électrode de verre | Sutter Instruments | AF100-68-10 | avec des filaments |
| Extracteur d'électrode | Sutter Instruments | Modèle P-2000 ou P-80 | |
| biotinamide | Vector Laboratories | SP-1120 | conservés à 4 ° C |
| Texas Red avidine DCS | Vector Laboratories | A-2016 | |
| tetramethlyrhodamine | Molecular Probes | D-3308 | 3000 poids moléculaire, la lysine fixable |
| de souris anti-synaptophysine d'anticorps | Chemicon | MAB5258 | |
| colorant fluorescent Nissl | Neurotrace, Molecular Probes | N-21480 | |
| Testeur d'électrode | Winston Electronics | BL-1000-B | pour mesurer l'impédance d'électrode |
| électromètre | Axon Instruments | Axoprobe 1A, 2B Axoclamp |
Références
- Cuellar, C. A., Tapia, J. A., Juarez, V., Quevedo, J., Linares, P., Marinez, L., Manjarrez, E. Propagation of sinusoidal electrical waves along the spinal cord during a fictive motor task. J. Neurosci. 29, 798-810 (2010).
- Frigon, A., Gossard, J. Evidence for specialized rhythm-generating mechanisms in the adult mammalian spinal cord. J. Neurosci. 30, 7061-7071 (2010).
- Wang, W., Chan, S. S., Heldman, D. A., Moran, D. W. Motor cortical representation of hand translation and rotation during reaching. J. Neurosci. 30, 958-962 (2010).
- Ma, C., He, J. A method for investigating cortical control of stand and squat in conscious behavioral monkeys. J. Neurosci. Meth. 192, 1-6 (2010).
- Dessem, D., Donga, R., Luo, P. Primary- and secondary-like jaw-muscle spindle afferents have characteristic topographic distributions. J. Neurophysiol. 77, 2925-2944 (1997).
- Dessem, D., Moritaini, A., Ambalavanar, R. Nociceptive craniofacial muscle primary afferent neurons synapse in both the rostral and caudal brain stem. J. Neurophysiol. 98, 214-223 (2007).
- Luo, P., Dessem, D. Inputs from identified jaw-muscle spindle afferents to trigeminothalamic neurons in the rat: a double-labeling study using retrograde HRP and intracellular. J. Comp. Neurol. 353, 50-66 (1995).
- Dessem, D., Luo, P. Jaw-muscle spindle afferent feedback to the cervical spinal cord in the rat. J. Comp. Neurol. 128, 451-459 (1999).
- Luo, P., Wong, R., Dessem, D. Projection of jaw-muscle spindle afferents to the caudal brainstem in rats demonstrated using intracellular biotinamide. J. Comp. Neurol. 358, 63-78 (1995).
- Luo, P., Dessem, D. Ultrastructural anatomy of physiologically identified jaw-muscle spindle afferent terminations onto retrogradely labeled jaw-elevator motoneurons in the rat. J. Comp. Neurol. 406, 384-401 (1999).
- Hassani, O. K., Henny, P., Lee, M. G., Jones, B. E. GABAergic neurons intermingled with orexin and MCH neurons in the lateral hypothalamus discharge maximally during sleep. Eur. J. Neurosci. 32, 448-457 (2010).
- Inokawa, H., Yamada, H., Matsumoto, N., Muranishi, M., Kimura, M. Juxtacellular labeling of tonically active neurons and phasically active neurons in the rat striatum. Neuroscience. 168, 395-404 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon