Tomografía fotoacústica para obtener imágenes de sangre y lípidos de la Aorta Infrarrenal
Visión general
Fuente: Gurneet S. Sangha y Craig J. Goergen, Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
La tomografía fotoacústica (PAT) es una modalidad emergente de imágenes biomédicas que utiliza ondas acústicas generadas por luz para obtener información compositiva del tejido. PAT se puede utilizar para tomar imágenes de componentes de sangre y lípidos, lo que es útil para una amplia variedad de aplicaciones, incluyendo imágenes cardiovasculares y tumorales. Las técnicas de imagen utilizadas actualmente tienen limitaciones inherentes que restringen su uso con investigadores y médicos. Por ejemplo, los largos tiempos de adquisición, los altos costos, el uso de contrastes nocivos y la mínima y alta invasividad son factores que limitan el uso de diversas modalidades en el laboratorio y la clínica. Actualmente, las únicas técnicas de imagen comparables a PAT son las técnicas ópticas emergentes. Pero estos también tienen desventajas, como la limitada profundidad de penetración y la necesidad de agentes de contraste exógenos. PAT proporciona información significativa de manera rápida, no invasiva y sin etiquetas. Cuando se combina con ultrasonido, PAT se puede utilizar para obtener información estructural, hemodinámica y compositiva de tejido, complementando así las técnicas de imagen utilizadas actualmente. Las ventajas de PAT ilustran sus capacidades para tener un impacto tanto en el entorno preclínico como clínico.
Principios
PAT es una modalidad híbrida que utiliza ondas acústicas inducidas por la luz para obtener información compositiva del tejido. La propagación acústica se atribuye a la expansión termoelástica. Esto ocurre cuando los enlaces químicos específicos en un tejido absorben la luz, y el aumento de la temperatura ambiente hace que el tejido se expanda. Para elaborar, los enlaces químicos específicos absorben la luz, haciendo que la molécula vibre y convierta parte de esta energía vibratoria en calor. Esta producción de calor provoca la expansión del tejido local, lo que induce las propagaciones acústicas que pueden ser detectadas por un transductor de ultrasonido. Para inducir el efecto fotoacústico, deben cumplirse las condiciones de confinamiento térmico y de tensión para minimizar la disipación de calor y permitir que la presión inducida por la termoelástica se acumule dentro del tejido. La onda de presión fotoacústica resultante se puede caracterizar por la ecuación (1), que establece que la onda acústica inducida por la luz (Po) se rige por el parámetro Grueneisen dependiente de la temperatura (o), el coeficiente de absorción(a)y la fluidez óptica local (F).
Po áaF Ecuación 1
Como resultado, cada aumento de la temperatura mK produce característicamente una onda de presión Pascal 800 que se puede detectar mediante un transductor de ultrasonido. Esta absorción selectiva de unión de la luz permite a los usuarios apuntar a varios componentes biológicos mediante el ajuste de la longitud de onda de la luz, como el uso de 1100 nm de luz para apuntar a la sangre y 1210 nm de luz para apuntar a los lípidos. Además, dado que la luz se utiliza para inducir la propagación de ondas acústicas, esta técnica se puede utilizar normalmente para crear imágenes de estructuras más profundas que otras técnicas ópticas sin necesidad de agentes de contraste o procedimientos invasivos. Este método específico que utiliza luz de longitud de onda larga en la segunda luz de ventana de infrarrojo cercano para inducir ondas acústicas proporciona numerosas ventajas al usuario, lo que permite que la PAT vibratoria (o VPAT) se utilice potencialmente para una amplia gama de aplicaciones biomédicas.
Procedimiento
El siguiente procedimiento describe los métodos necesarios para configurar vpAT para la toma de imágenes sanguíneas y lipídicas de la aorta infrarrenal en ratones con apolipoproteína-E deficiente (apoE-/-).
1. Acoplamiento de ultrasonido láser
- Obtenga un láser de oscilador paramétrico óptico pulsado Nd:YAG y un sistema de ultrasonido. Adquiera un generador de pulsos, 1 cable BNC y un conector D conectado a dos cables BNC.
- Con la configuración del conector D, conecte el cable BNC 'Fire' al puerto A del generador de impulsos y 'Q-switch' al puerto B del generador de pulsos. Por último, conecte un cable BNC desde el puerto C para "activar" en la parte posterior del sistema de ultrasonido.
- Alinee el cable de fibra óptica con el láser y conecte los extremos de fibra a los lados del transductor de ultrasonido de 40 MHz.
- Ajuste el retardo de los puertos A, B y C a los valores enumerados aquí (puerto A: 0.00000000, puerto B: 0.00021440, puerto C: 0.00000910). Ajuste los puertos A y B a la señal invertida y al puerto C en la señal normal.
2. Preparación de animales y adquisición de imágenes
- Anestetizar un ratón apoE-/- usando 3% de isoflurano en una cámara de inducción de anestesia. Una vez que el animal es anestesiado mover el ratón a un cono nasal para entregar 1-2% de isoflurano.
- Aplique lubricante para los ojos en los ojos de los animales para evitar la desecación corneal. Pegue las patas del ratón a los electrodos integrados en la etapa calentada para monitorear la respiración y la frecuencia cardíaca del animal. Por último, inserte la sonda rectal para controlar la temperatura corporal.
- Aplicar crema depilatoria para eliminar el vello del abdomen del animal. Limpie después de 30 s con una almohadilla de gasa.
- Coloque el transductor de ultrasonido en el abdomen del animal y localice la aorta infrarrenal. La vena renal izquierda y la trifurcación aórtica en la arteria de la cola son dos puntos de referencia que ayudarán al usuario a localizar esta zona.
- Ejecute el láser para emitir 1100 nm de luz para apuntar a la sangre seguida de 1210 nm de luz para el lípido objetivo. Utilice gafas de seguridad láser adecuadas cuando el láser esté en uso.
Resultados
Aquí, se utilizaron métodos VPAT para realizar imágenes específicas de lípidos y sangre in vivo. Al acoplar un sistema láser y de ultrasonido, se entregó luz al tejido y se detectaron las ondas acústicas resultantes. Las imágenes por ultrasonido nos permitieron obtener información estructural de la aorta infrarrenal (Figura 1a) que se puede utilizar para interpretar mejor la información de composición VPAT. Específicamente, se utilizó una luz de 1100 nm para tomar imágenes de sangre dentro de la aorta(Figura 1b),y se utilizó una luz de 1210 nm para crear imágenes de acumulación de grasa subcutánea y periaortica(Figura 1c). A partir de las imágenes de ultrasonido y VPAT, se puede ver que la grasa subcutánea sigue la geometría de la piel, la grasa periaortica sigue el contorno de la aorta, y la señal de sangre se origina dentro de la aorta. Estos resultados confirman que, de hecho, VPAT se puede utilizar para crear imágenes de la acumulación de sangre y lípidos in vivo.
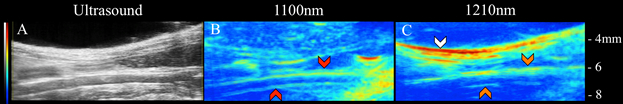
Figura 1:Imágenes de ApoE -/- ultrasonido (izquierda), VPAT de sangre (medio) y VPAT lipídico (derecha) de ApoE-/-. La grasa subcutánea (flechas blancas), la grasa periaortica (flechas naranjas) y la sangre (flechas rojas) es claramente visible.
Aplicación y resumen
VPAT es un método rápido, no invasivo y libre de etiquetas para la imagen de la acumulación de sangre y lípidos in vivo. Al suministrar luz láser pulsada al tejido, se indujeron las propagaciones acústicas para obtener densidad relativa y localizar componentes biológicos. Cuando se combina con imágenes por ultrasonido, se puede resolver la información compositiva, así como estructural y hemodinámica del tejido. Una limitación actual de esta técnica es su profundidad de penetración, que es aproximadamente 3 mm para imágenes basadas en lípidos. Si bien esto es mejor que las técnicas ópticas actuales, las mejoras en las técnicas de entrega de luz mejorarían la profundidad de penetración. Una manera de mejorar esto es mediante el desarrollo de un transductor fotoacústico que maximiza la entrega de luz a la región de interés mientras redirige la luz reflejada de nuevo al tejido. Si bien VPAT es una técnica de imagen que todavía está en su infancia, ha recibido un gran interés en los últimos años, por lo que es probable que esta técnica se utilice en más laboratorios y clínicas en el futuro.
El protocolo descrito se puede utilizar para una amplia variedad de aplicaciones tanto en el espacio preclínico como clínico. Tres posibles aplicaciones de VPAT incluyen la utilización de la técnica para 1) estudiar la progresión de la enfermedad basada en lípidos, 2) evaluar terapias prometedoras, y 3) mejorar el diagnóstico de enfermedades basadas en lípidos. La capacidad de rastrear información estructural, hemodinámica y compositiva hace de VPAT una tecnología atractiva para estudiar cómo se acumulan los lípidos vasculares en los modelos de animales pequeños(Figura 1). Además, dado que el VPAT es un método no invasivo se puede aplicar para evaluar los efectos de las terapias en estudios longitudinales. Esto podría reducir específicamente el costo de la investigación al disminuir el número de animales necesarios para la validación de la terapia. Por último, la capacidad de VPAT para proporcionar información compositiva hace que sea una técnica atractiva para la imagen de diferentes tipos de placas en pacientes que sufren de enfermedades relacionadas con el aterosclerótero como la carótida y la enfermedad arterial periférica. Uno de los desafíos actuales en la medicina cardiovascular es predecir qué placas son propensas a la ruptura, y por lo tanto tienen potencial para inducir infarto de miocardio y accidentes cerebrovasculares isquémicos. Por lo tanto, VPAT también puede desempeñar un papel importante en la caracterización de placas vulnerables frente a estables, debido a su capacidad para diferenciar los componentes biológicos. En conjunto, VPAT tiene potencial para tener un impacto significativo tanto en la investigación como en la práctica clínica de la medicina.
Lista de materiales
| Nombre | Empresa | Número de catálogo | Comentarios |
| Equipo VPAT | |||
| Sistema de ultrasonido | VisualSonics | Vevo2100 | |
| Nd:YAG OPO Láser | Continuo | Surelite EX | |
| Generador de pulsos de zafiro | Compositores cuánticos | 9200 | Se requieren 4 puertos |
| BNC Cables | Thor Labs | 2249-C-120 | Diámetro exterior 0,2'', la longitud del cable BNC depende de la preferencia del usuario. |
| Conector B conectado a dos cables BNC | L-com | CTL4CAD-1.5 | Continuum también proporciona este conector |
| Gafas ópticas | LaserShields | #37 0914 UV400 | Cualquier gafas con OD 7+ será suficiente. |
Saltar a...
Vídeos de esta colección:

Now Playing
Tomografía fotoacústica para obtener imágenes de sangre y lípidos de la Aorta Infrarrenal
Biomedical Engineering
5.9K Vistas

Obtención de imágenes de muestras biológicas con microscopía óptica y confocal
Biomedical Engineering
36.2K Vistas

Imágenes con MEB de muestras biológicas
Biomedical Engineering
24.0K Vistas

Biodistribución de nanotransportadores de fármacos: Aplicaciones del MEB
Biomedical Engineering
9.5K Vistas

Imágenes por ultrasonido de alta frecuencia de la aorta abdominal
Biomedical Engineering
14.8K Vistas

Mapeo cuantitativo de la deformación de un aneurisma de la aorta abdominal
Biomedical Engineering
4.6K Vistas

Resonancia Magnética Cardíaca
Biomedical Engineering
15.0K Vistas

Simulaciones de dinámica de fluidos computacionales del flujo sanguíneo en un aneurisma cerebral
Biomedical Engineering
11.9K Vistas

Imágenes de fluorescencia infrarroja de aneurismas aórticos abdominales
Biomedical Engineering
8.4K Vistas

Técnicas no invasivas para medir la presión arterial
Biomedical Engineering
12.1K Vistas

Adquisición y análisis de una señal de ECG (electrocardiografía)
Biomedical Engineering
106.7K Vistas

Resistencia a la tracción de biomateriales reabsorbibles
Biomedical Engineering
7.7K Vistas

Imágenes por micro-CT de la médula espinal de un ratón
Biomedical Engineering
8.3K Vistas

Visualización de la degeneración articular de rodilla posterior a una lesión no invasiva del LCA en ratas
Biomedical Engineering
8.3K Vistas

Imágenes combinadas de SPECT y TC para visualizar la funcionalidad cardíaca
Biomedical Engineering
11.2K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados