Estructura del ferroceno
Visión general
Fuente: Tamara M. Powers, Departamento de química, Texas A & M University
En 1951, Kealy y Pauson informaron a la naturaleza de la síntesis de una nueva ferroceno compuesto organometálicos. 1 en su informe original, Pauson sugirió una estructura de ferroceno en que la plancha es solo en condiciones de servidumbre (enlaces sigma) al átomo de un carbono de cada ligando de cyclopentadiene (figura 1, la estructura). 1 , 2 , 3 este informe inicial condujo a interés extenso en la estructura del ferroceno, y muchos científicos participaron en la elucidación de la estructura de esta nueva molécula interesante. Wilkinson y Woodward eran rápidos para sugerir una alternativa formulization donde el hierro se "encuentra" entre dos ligandos de cyclopentadiene, con Unión igual a todos los átomos de carbono 10 (figura 1, la estructura II). 4 aquí, vamos a sintetizar ferroceno y decidir, en base a datos experimentales (IR y 1H RMN), que de estas estructuras se observaron. Además, estudiaremos la electroquímica de ferroceno recogiendo un voltagrama cíclico. En el curso de este experimento, introducimos la regla 18-electron y discutir el electrón de Valencia contando para los complejos de metales de transición.
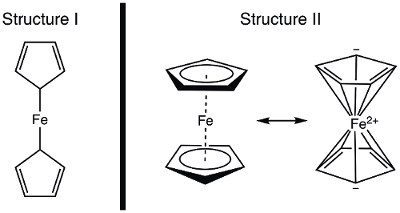
Figura 1. Dos estructuras propuestas de ferroceno.
Principios
Regla de 18 electrones y electrones de Valencia totales contando:
Al dibujar las estructuras de puntos de Lewis, es importante recordar la regla del octeto, que dice que los átomos de los elementos del grupo principal tienen 8 electrones en su cáscara de la Valencia. Sin embargo, la regla del octeto no tiene para los metales de transición, que tienen nueve orbitarios de la Valencia (un s, tres py cinco d orbitarios) y así puede acomodar hasta 18 electrones. Por lo tanto, una regla de 18 electrones se aplica para los complejos de metales de transición. Como la regla del octeto, hay excepciones a la regla de 18 electrones, pero en general, complejos de metales de transición con 18 electrones de Valencia son considerados compuestos altamente estables.
Hay dos métodos que pueden utilizarse para determinar el número de electrones totales de Valencia de un metal de transición complejo: el modelo iónico (cargado) y el modelo covalente (neutro). 5 correcta aplicación de cualquiera de los métodos pueden dar lugar a la misma cuenta total del electrón. Ambos modelos utilizan tres clasificaciones de ligando llamadas X, L y Z-tipos. Cada tipo de ligando aporta un número diferente de electrones para el recuento total de electrones y depende del método utilizado. Ligandos de tipo X son grupos aniónicos tales como haluros, hidróxido y alcóxidos. Ligandos de tipo L son a donantes del par solitario como aminas y fosfinas. Finalmente, los ligandos tipo Z son aceptores de pares de electrones. por lo tanto, ligandos de tipo Z son neutros ácidos de Lewis, como BR3. Consideramos la molécula Co (NH3)3Cl3 para demostrar los dos métodos (figura 2).

Figura 2. Electron cuenta ejemplo, Co (NH3)3Cl3.
Modelo iónico:
En primer lugar, considerar el número de electrones por el átomo central. Co está en el grupo 9 de la tabla periódica y así tiene 9 electrones de Valencia. En el modelo iónico, debe considerarse el estado de oxidación del metal. Puesto que el estado de oxidación del Co de Co (NH3)3Cl3 es + 3, el número total de electrones de Valencia aportados por el metal en el modelo iónico es 6 e− (tabla 1). En el modelo iónico, ambos ligandos de tipo X y L donan 2 e− para el recuento total de electrones mientras que los ligandos tipo Z no contribuyen cualquier electrones. Para el ejemplo Co (NH3)3Cl3, hay dos tipos de ligando presente. Cl es un ligando de tipo X y el NH3 es un ligando de L-type. Usando el modelo iónico, el recuento total de electrones es 18 e− (tabla 1).
Tabla 1. e− recuento de Co (NH3)3Cl3 utilizando los modelos iónicos y covalentes
| Átomo central ligando | Tipo de ligando | e − contribución
(modelo iónico) |
e − contribución
(modelo covalente) |
| Co | n / a | 6 e− | 9 e− |
| 3 NH3 | L | 3 x ( e2−) | 3 x ( e2−) |
| 3 Cl | X | 3 x ( e2−) | 3 x (1 e−) |
| Carga del ión | n / a * | − (0) | |
| Total e− Conde | 18 e− | 18 e− | |
* La carga del ion del metal que contienen no está incluida en la cuenta total del electrón usando el modelo iónico. La carga se contabiliza en el estado de oxidación del metal (electrones por el átomo central).
Modelo covalente:
Para el modelo covalente, la contribución de e− del átomo central es igual al número total de Valencia e− para el átomo neutro (en este caso 9 e−). Ligandos de tipo X donan 1 e−ligandos tipo L donan 2 e−y ligandos tipo Z donan 0 e−. Finalmente, si la molécula es iónica, la carga de los iones que contiene el centro de metal debe restarse del metal y los electrones del ligando. Usando el modelo covalente, la cantidad total de electrones Co (NH3)3Cl3 es también 18 e− (tabla 1).
Electron cuenta de ferroceno y Ferrocenium catión:
Usando el modelo covalente, Fe tiene 8 e−. Si se considera la vinculación de ferroceno, que en la estructura, los ligandos de cyclopentadiene (Cp) son los donantes de tipo X y, por tanto, cada uno contribuye 1 electrón (tabla 2). Así, tendríamos 10 electrones de Valencia. Sin embargo, en la estructura II, cada anillo Cp dona 5 electrones (ligando de L2X-type), donde tenemos dos dobles enlaces (cada uno son 2 electrones, los donantes de tipo L) y un donante de tipo X (el radical). Esto da un total de 18 electrones (tabla 2).
Tabla 2.Electrón para ferroceno (Fc) y catión ferrocenium (Fc+) mediante el modelo covalente
| Ligand / central átomo | La estructura I | Estructura II | ||||
| Tipo de ligando | FC | FC+ | Tipo de ligando | FC | FC+ | |
| Fe | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| CP | X | 2 x (1 e−) | 2 x (1 e−) | L2X | 2 x (5 e−) | 2 x (5 e−) |
| Carga del ión | − (0) | − (+ 1) | Carga del ión | − (0) | − (+ 1) | |
| Recuento total de electrones | 10 e− | 9 e− | Recuento total de electrones | 18 e− | 17 e− | |
Ferroceno sufre fácilmente una 1 e− oxidación para producir el catión ferrocenium (ecuación 1).
 (1)
(1)
Consideremos el electrón resultante contar para el catión ferrocenium de estructuras I y II. En una oxidación e− 1, ferroceno se convierte en iones. Por lo tanto, la carga (+ 1) del catión ferrocenium debe restarse de los electrones de Valencia (tabla 2). El gravamen resulta en cuentas de electrónica total de 9 e− y 17 e− estructura I y II de la estructura, respectivamente.
Qué estructura del ferroceno es correcta?:
Si estructura es correcta, con sólo 10 electrones de Valencia, ferroceno sería altamente reactivo en la Fe. Oxidación para producir el catión ferrocenium sería bastante difícil en este caso, desde la estructura del ferroceno es deficiente de electrones. Por otro lado, II estructura del ferroceno obedece la regla de 18 electrones y por lo tanto es consistente con el ferroceno es un compuesto estable. En este caso, oxidación de ferroceno a catión ferrocenium produciría una especie de 17 e− . Basado en el recuento de electrones, uno puede predecir que eso ferroceno exhibe estructura II; vamos a pensar en cómo demostrar la estructura correcta espectroscópico.
Antes de que publicaron datos estructurales, la estructura del ferroceno fue deducida de sus propiedades espectroscópicas y magnéticas, así como su reactividad. Consideremos los espectros de IR que se predicen para las dos estructuras. Estructura muestra dos protones químicamente inequivalent así debe dar lugar a más de un modo estiramiento C-H en el espectro IR. En cambio, II estructura muestra un solo tipo de enlace C-H y por lo tanto debe mostrar un solo tramo C-H. Espectroscopia RMN habían disponible en la década de 1950, esto también daría una pista: dos resonancias en el espectro de 1H para I y una resonancia de la estructura II se puede predecir la estructura. En este experimento, se sintetizan ferroceno y utilizar datos espectroscópicos para proporcionar evidencia de su estructura.
Procedimiento
1. grietas el dímero de Cyclopentadiene (figura 3)
Cyclopentadiene sufre una reacción de Diels-Alder con sí mismo a dar diciclopentadieno. Esta reacción es reversible, por lo que grietas se logran usando principio de La Châtelier para conducir la reacción reversa destilando el monómero de cyclopentadiene (b.p. 42 ° C) lejos del dímero de diciclopentadieno (b.p. 170 ° C). La reacción de dimerización es lenta cuando la cyclopentadiene se mantiene frío, pero debe estar recién preparada para sintetizar con éxito el ferroceno.
- A un matraz de fondo redondo de 25 mL, agregar una barra de agitación y 10 mL de diciclopentadieno dimer.
PRECAUCIÓN: Tenga cuidado de utilizar sólo diciclopentadieno y cyclopentadiene en una campana de humos ya que son dos sustancias químicas de olor. - Conectar el matraz de fondo redondo para un aparato de destilación fraccionada (ver módulo "Destilación fraccionada" en la serie de fundamentos de química orgánica ) y coloque en baño de aceite en una placa de agitación. Asegúrese que los frascos que recoge en un baño de hielo. Sujete el aparato en su lugar.
- Coloque la placa caliente a 160 ° C y agitar suavemente la solución.
- Destilación fraccionada ~ 5 mL de monómero Cp de dímero (39-42 ° C).

Figura 3. Craqueo de diciclopentadieno.
2. síntesis de ferroceno (figura 4)
- A un matraz Schlenk de 100 mL, agregar una barra de agitación y 15 g de KOH de molido fino.
PRECAUCIÓN: KOH es muy corrosivo e higroscópico. El KOH se debe en una campana bien ventilada y usarse inmediatamente después de la preparación. - Añadir 30 mL de 1,2-dimethoxyethane al matraz mientras revuelve.
- Conectar el matraz al nitrógeno y coloque una membrana de goma sobre el cuello del matraz.
- Removiendo bajo nitrógeno, añadir 2,75 mL de cyclopentadiene mediante jeringa. Ello a agitar durante al menos 10 minutos antes de la adición de hierro.
- Mientras revuelve la reacción, añada una barra de agitación, 3,25 g de tierra FECLAS2·4H DMSO2O y 12,5 mL a un matraz de Schlenk separado de 50 mL. Colocar un tabique en el cuello y revolver bajo nitrógeno hasta que se haya disuelto todo el hierro.
- Cánula de transferencia de la solución de hierro a la solución de cyclopentadienyl bajo nitrógeno gota a gota en el transcurso de 30 minutos. Para un procedimiento más detallado, por favor, revise el video de "Síntesis de un Ti(III) metaloceno usando Schlenk Line técnica" en esta serie de Química inorgánica .
- Una vez terminada la adición, agitar durante una 30 minutos adicionales.
- Mientras tanto, en un vaso de fresco 45 mL de HCl M 6 añadiendo hielo picado (50 g) directamente a la solución.
- Una vez completada la reacción, vierta la mezcla sobre la mezcla y revuelva durante unos minutos. Forman cristales naranja.
- Recoger los cristales en un embudo de Büchner (provisto de papel de filtro) y lavar el precipitado con agua.
- Permitir que los sólidos a secar al aire.
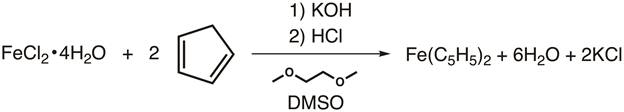
Figura 4. Síntesis de ferroceno.
3. purificación de ferroceno. Purifique el producto por sublimación (para un procedimiento más detallado, por favor ver el video de "Purificación de ferroceno por sublimación").
4. Caracterización de ferroceno
- Preparar y recoger un espectro de 1H NMR de ferroceno.
- Recoge un espectro de IR de ferroceno.
- Recoger un voltagrama cíclico de ferroceno (ver el video de "Voltametría cíclica" de la serie de Fundamentos de química analítica ).
Resultados
Caracterización de ferroceno:
1 H RMN (cloroformo -d, 300 MHz, δ, ppm): 4.15 (s).
Espectro 1H NMR de ferroceno muestra claramente una resonancia única, coherente con la estructura II.
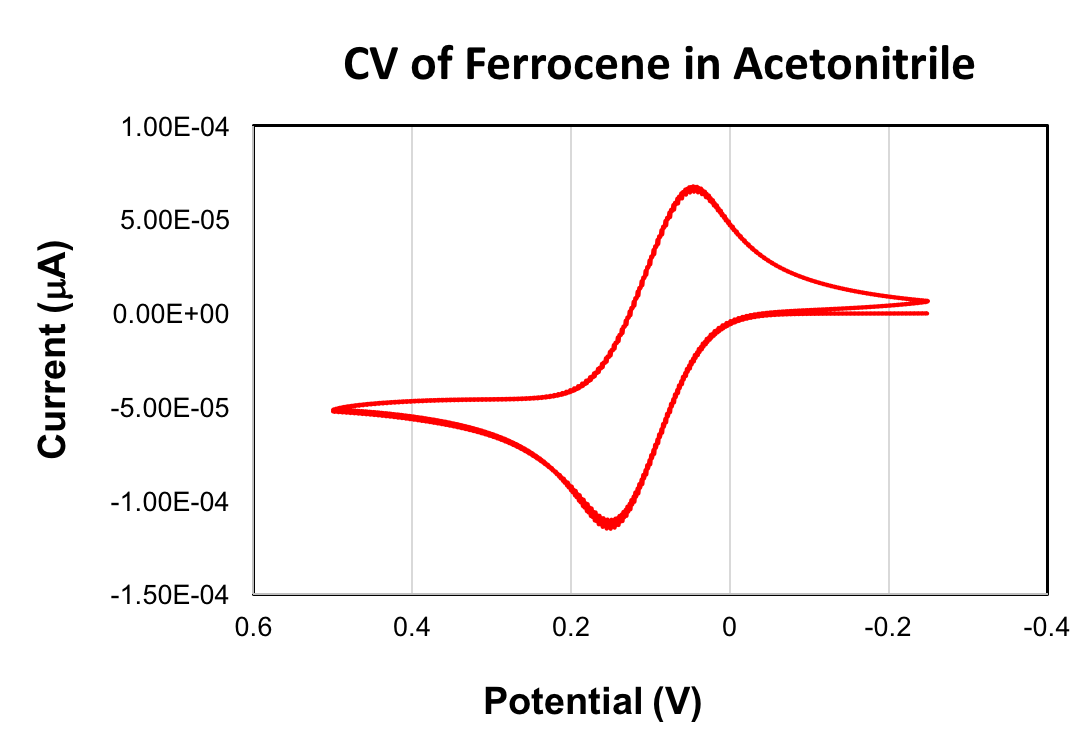
Un CV de ferroceno se expone a continuación. El valor de1/2 de Eobtenido para la oxidación de ferroceno fue + 90 mV (acetonitrilo, exploración velocidad de 100 mV/s, 0.1 M (Bu4N) PF6, electrodo de trabajo de carbón vidrioso). La pareja ferroceno/ferrocenium redox es utilizada como referencia en voltametría cíclica. Cuando se utiliza como referencia, el valor de1/2 Ede ferroceno se establece igual a 0 V.
Aplicación y resumen
En este video hablamos de ferroceno y el papel que desempeñan en el desarrollo de la química organometálica. Ferroceno fue sintetizado y caracterizado por la espectroscopia de 1H NMR e IR. Ambos espectros son consistentes con el 18 e− estructura II, donde el hierro se "encuentra" entre dos ligandos de cyclopentadiene, con Unión igual a todos los átomos de carbono 10 (figura 1, la estructura II). Oxidación de ferroceno a catión ferrocenium observó electroquímicamente.
En 1973, tras la caracterización estructural de ferroceno, Wilkinson fue uno de los dos químicos, el Premio Nobel en química "por [su] trabajo pionero... en la química de organometálicos, denominado complejos de sandwich". 6 su obra grandemente influenciado y amplió el campo emergente de la química organometálica. Mientras que el primer compuesto organometálicos fue preparado en 1849, fue sólo en la década de 1950 que se hicieron avances significativos para entender cómo los metales se pueden enlazar a átomos de carbono. Hoy, el campo de la química organometálica o la química de los compuestos que forman enlaces metal-carbon, es fundamental para muchas aplicaciones. Esto incluye: energía, células solares teñir-sensibilizadas, catálisis, polimerización, descubrimiento de fármacos y síntesis, bioinorganic sistemas y orgánicos diodos emisores de luz (OLEDs). 7
Ferroceno en sí mismo también juega un papel activo en el campo de la química organometálica. Ferroceno participa fácilmente en sustitución aromática electrófila; de hecho, es 100.000 veces más reactiva que benceno en estas reacciones. Ferroceno ha encontrado uso extenso como un componente estructural de los ligandos bidentados en catálisis Organometálica. Por ejemplo, 1, 1'-bis (difenilfosfino) ferroceno (dppf) es un ligando quelante utilizado en la catálisis homogénea. La dppf ligandos quelatos 1st, 2ndy 3rd fila transición metales como Ni, Pd y PT. [dicloruro de ferrocene]palladium(II) de 1,1'-Bis(diphenylphosphino) es un ejemplo de un catalizador de paladio Cruz-acoplamiento C-c y Formación del enlace C-heteroatom (figura 5). 8 en el video "MO teoría del Metal de la transición complejos", se sintetizan dos complejos metálicos con dppf.
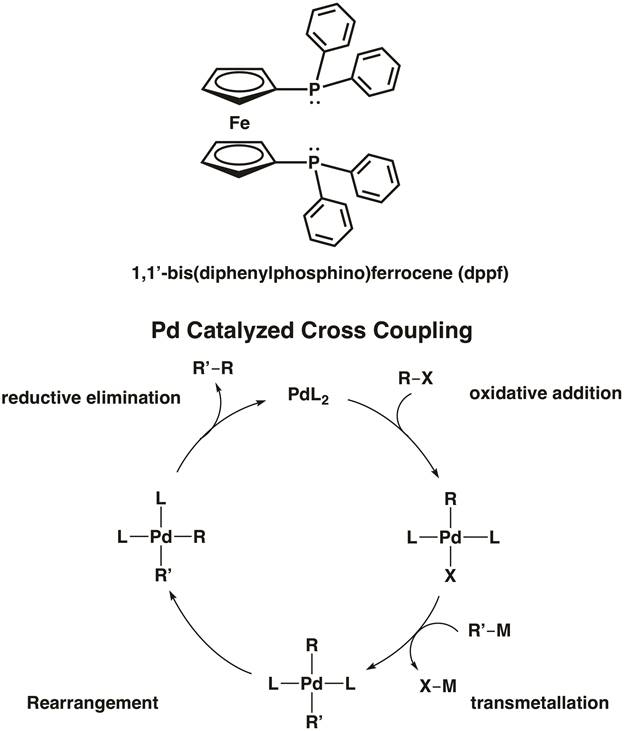
Figura 5. [Dicloruro de ferrocene]palladium(II) de 1,1'-Bis(diphenylphosphino) es un catalizador de la Cruz-acoplamiento C-C y C X enlace formación.
Referencias
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Estructura del ferroceno
Inorganic Chemistry
79.4K Vistas

Síntesis de un metaloceno Ti(III) utilizando la técnica de línea de Schlenk
Inorganic Chemistry
31.6K Vistas

Guantera y sensores de impureza
Inorganic Chemistry
18.6K Vistas

Purificación de ferroceno por sublimación
Inorganic Chemistry
54.5K Vistas

El método de Evans
Inorganic Chemistry
68.4K Vistas

Difracción de rayos X de monocristal y de polvos
Inorganic Chemistry
104.4K Vistas

Espectroscopía de resonancia paramagnética electrónica (EPR)
Inorganic Chemistry
25.4K Vistas

Espectroscopía de Mössbauer
Inorganic Chemistry
22.0K Vistas

Interacción ácido-base de Lewis en Ph3P-BH3
Inorganic Chemistry
38.8K Vistas

Aplicación de la teoría de grupos a la espectroscopía infrarroja
Inorganic Chemistry
45.2K Vistas

Teoría del orbital molecular (MO)
Inorganic Chemistry
35.3K Vistas

Enlance cuadruple de metal a metal en complejos de tipo rueda de paletas
Inorganic Chemistry
15.3K Vistas

Celdas solares teñidas con colorante
Inorganic Chemistry
15.8K Vistas

Síntesis de un complejo de cobalto (II) que transporta oxígeno
Inorganic Chemistry
51.6K Vistas

Iniciación fotoquímica de reacciones de polimerización por radicales libres
Inorganic Chemistry
16.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados