Method Article
Aplicación de la ablación por microondas en la esplenectomía parcial laparoscópica
En este artículo
Resumen
El uso de la esplenectomía parcial laparoscópica se ha limitado debido al alto riesgo de sangrado durante la cirugía. Por ello, introducimos un método laparoscópico combinado con la ablación por microondas para solucionar el problema del sangrado intraoperatorio.
Resumen
El hemangioma esplénico es la clasificación patológica más común de los tumores esplénicos, y su indicación quirúrgica y tratamiento han sido controvertidos. Antes, la esplenectomía abierta generalmente se usaba para tratar el hemangioma esplénico. Tras el rápido desarrollo de las técnicas laparoscópicas, los requisitos de las personas para el tratamiento mínimamente invasivo han aumentado gradualmente y la esplenectomía laparoscópica se ha convertido gradualmente en el principal método de tratamiento. Sin embargo, a través del estudio más profundo de la función del bazo, se descubrió que la esplenectomía parcial puede reducir la incidencia de trombocitemia postoperatoria y disminuir los efectos secundarios sobre la función fisiológica del cuerpo, por lo que surgió la esplenectomía parcial laparoscópica. Sin embargo, debido a la estructura anatómica especial, la incidencia de hemorragia durante la esplenectomía parcial es mayor. Por lo tanto, durante la operación, extirpamos parte de los vasos sanguíneos esplénicos, combinado con ablación por microondas, lo que resolvió perfectamente el problema del sangrado intraoperatorio. La esplenectomía parcial laparoscópica combinada con la ablación por microondas no solo cumple con los requisitos del tratamiento mínimamente invasivo, sino que también reduce el riesgo de sangrado intraoperatorio, lo que amerita aplicación y promoción clínica.
Introducción
Las lesiones esplénicas benignas generalmente no requieren intervención quirúrgica y el seguimiento regular es el pilar principal. La cirugía está indicada cuando alcanzan más de 40 mm de diámetro o causan síntomas clínicos1. Para las lesiones de masa esplénica benigna, la esplenectomía total es el pilar de la cirugía, y la esplenectomía total laparoscópica (LTS) se ha considerado durante mucho tiempo un procedimiento quirúrgico estándar. Las ventajas de esta técnica frente a la cirugía abierta son indiscutibles2. Sin embargo, la esplenectomía total puede llevar a complicaciones como disminución de la inmunidad, trombosis venosa e infección después de una esplenectomía abrumadora 3,4,5, lo que afecta seriamente el pronóstico de los pacientes. Con el estudio en profundidad de la función y la anatomía del bazo, la esplenectomía parcial laparoscópica (SPL), que conserva parte de la función del bazo, ha sido ampliamente utilizada en la práctica clínica 6,7, pero aún no existe consenso sobre si la SPL es superior a la LTS para los tumores esplénicos benignos. Debido a la fragilidad del tejido del bazo, que dificulta mucho la sutura, el LPS tiene un mayor riesgo de sangrado que el LTS8. Por lo tanto, cómo reducir el sangrado intraoperatorio es un tema clave en la implementación de LPS.
La ablación por microondas (AMEU) puede utilizarse para controlar una hemorragia potencialmente mortal al elevar rápidamente la temperatura local del tejido diana por encima de los 60 °C. Se ha utilizado como medio de hemostasia en una variedad de biopsias con aguja de tumores sólidos y hepatectomía laparoscópica 9,10,11,12,13. En la actualidad, el LPS asistido por MVA todavía se reporta raramente.
En este estudio, realizamos LPS bloqueando el flujo sanguíneo en el área donde se encuentra el tumor y luego usamos MVA para coagular el tejido del bazo en el plano de la línea isquémica, y finalmente completamos con éxito la operación. Este abordaje preserva parte de la función esplénica y reduce la pérdida de sangre intraoperatoria, lo que disminuye la tasa de complicaciones postoperatorias después de la esplenectomía.
PRESENTACIÓN DEL CASO:La paciente, una mujer de 48 años, se quejaba de dolor en el cuadrante superior izquierdo desde hacía más de 7 años, tenía antecedentes de hipertensión y negaba antecedentes de cirugía abdominal. La tomografía computarizada (TC) y la gammagrafía con contraste de la parte superior del abdomen en el hospital externo mostraron que había un nódulo de densidad ligeramente baja en el bazo, y era más probable que se considerara un hemangioma.
Diagnóstico, evaluación y planificación:
Después del ingreso, se completaron la ecografía y la resonancia magnética de la parte superior del abdomen para diagnosticar preliminarmente el hemangioma esplénico. Considerando que el diámetro tumoral del paciente era mayor de 5 cm y se acompañaba de dolor abdominal, se planificó una esplenectomía parcial
Protocolo
Este protocolo cumple con las normas y requisitos del Comité de Ética Médica del Primer Hospital Afiliado de la Universidad de Jinan, y se ha obtenido el consentimiento informado del paciente.
1. Examen preoperatorio
- Determinar la ubicación y el tamaño del tumor y los vasos sanguíneos (ramas arteriovenosas esplénicas) que irrigan el tumor de acuerdo con la TC o RMN preoperatoria, y luego planificar el rango de resección y el plano de ablación por microondas. En este caso, solo se realizó una resonancia magnética antes de la operación (Figura 1), y se determinó que el tumor estaba localizado en el polo inferior del bazo e irrigado por la rama del polo inferior de la arteria esplénica.
- Utilizar los siguientes criterios de inclusión: Edad 18-75 años; El examen imagenológico preoperatorio muestra una ocupación benigna del bazo, y el diámetro de la masa de ocupación del bazo es de ≥ 5 cm, o se combina con síntomas clínicos como dolor abdominal e hinchazón; El tumor está confinado al polo superior o inferior del bazo y no compromete los vasos arteriovenosos esplénicos.
- Utilice los siguientes criterios de exclusión: Antecedentes de enfermedades relacionadas con el sistema sanguíneo; Lesiones del bazo causadas por otras causas (como hipertensión portal, enfermedad pancreática, paludismo, rotura esplénica, neoplasia maligna esplénica, etc.).
2. Anestesia y preparación preoperatoria
- Utilice la intubación endotraqueal para la anestesia general. Al mismo tiempo, realizar la venopunción yugular interna para colocar un catéter intravenoso de 7 Fr con guía ecográfica y puncionar la arteria radial con una aguja arterial permanente de 21 G para la detección de la presión arterial.
- Lleva una sonda gástrica de 16Fr y una sonda urinaria de 16Fr. Administrar antibióticos (Latoxef 1 g) 30 minutos antes de la cirugía para prevenir infecciones.
- Deje que el paciente se acueste inclinado hacia la derecha con la cabeza por encima de los pies y las extremidades inferiores separadas 50°-60°. Ajustar la posición en el tiempo según la situación intraoperatoria.
3. Procedimiento quirúrgico
- Posición del operador: El primer cirujano se coloca en el lado derecho del paciente, mientras que el segundo se ubica en el lado opuesto, y el operador de cámara se coloca entre las piernas (Figura 2).
- Disposición del orificio del trócar: Establezca y mantenga una presión del neumoperitoneo de 12 mmHg. Establecer un orificio de observación de 10 mm en el margen umbilical inferior utilizando el método de 5 orificios e implantar en él un laparoscopio de 30°. Establecer un orificio quirúrgico primario de 12 mm a nivel de la línea pararectal del ombligo derecho, y orificios auxiliares de operación de 5 mm en la línea media clavicular derecha por debajo del margen costal, la línea axilar anterior izquierda por debajo del margen costal y la línea pararectal umbilicus izquierda. Ajuste la posición del trócar o aumente su número si es necesario, durante la operación.
NOTA: En el caso del método de cuatro orificios, el orificio de observación todavía se encuentra en el borde inferior del ombligo. Establezca dos orificios de operación primarios de 10 mm en el punto medio de la línea que conecta la apófisis xifoides con el ombligo y el nivel del ombligo de la línea axilar anterior izquierda, respectivamente. Coloque cinco orificios de operación auxiliar de 5 mm a nivel del ombligo de la línea clavicular media izquierda. - Procedimientos quirúrgicos
- Abra el ligamento gastrocólico izquierdo con un bisturí ultrasónico y separe el ligamento gastrosplénico para revelar el portal esplénico (Figura 3A). Preste atención a la ligadura de las arterias gástricas cortas mientras disecciona el ligamento gastrosplénico.
- Aísle la rama polar inferior del pedículo del bazo y luego látela con pinzas Hem-o-Lok (Figura 3B-C). Diseccionar la arteria esplénica para encontrar las ramas de los vasos sanguíneos que irrigan el tumor, si es necesario.
- Revelar el hemangioma esplénico (Figura 3D). Separe los ligamentos esplenocólicos (en la parte inferior externa del bazo, Figura 3E) y los ligamentos esplenorenales (detrás del bazo, Figura 3F) para que el área objetivo quede completamente libre.
- Identificar la línea isquémica entre el tejido normal del bazo y la fracción que carece de riego sanguíneo (Figura 3G).
- Insertar la aguja de ablación percutánea por microondas y coagular el tejido del bazo mediante ablación por microondas a lo largo de la línea isquémica por fases y gradualmente, con una potencia de 60-80 W. Ajustar el tiempo según la posición y profundidad específicas de la inyección (Figura 3H-I). El tiempo por ablación es de unos 3 min. Asegúrese de que la punta de la aguja no penetre en el parénquima del bazo y que el área de ablación esté en el mismo plano.
- Divida el esplénico a lo largo de la zona de coagulación (Figura 3J). Verifique si hay sangrado en la sección esplénica y observe el suministro de sangre del bazo residual (Figura 3K).
- Coloque el tubo de drenaje de la fosa esplénica (Figura 3L) y retire los especímenes tumorales esplénicos de la incisión umbilical extendida. Use suturas en capas para suturar la incisión quirúrgica y la cirugía habrá terminado.
4. Procedimientos postquirúrgicos
- Realice la tinción de H&E y la tinción inmunohistoquímica (IHQ) en muestras de masa esplénica para confirmar el diagnóstico.
- Vuelva a examinar la muestra de sangre el 1º,3º y 7º día después de la cirugía, seguido de un control de sangre semanal. Use aspirina si se encuentran plaquetas persistentemente elevadas. Continúe tomando antibióticos durante 3 días después de la cirugía para prevenir infecciones. Los pacientes generalmente son hospitalizados durante 1-2 semanas después de la cirugía, y el nuevo examen se realiza mediante TC abdominal 1 mes después de la cirugía.
Resultados
El polo inferior del esplénico, incluido el tumor, se resecó en aproximadamente 3 h con 100 mL de hemorragia. El paciente se recuperó sin complicaciones como fuga pancreática, fuga intestinal, derrame esplénico y trombosis de la vena porta.
Se utilizó la tinción de IHQ H&E y CD34 para determinar la patología postoperatoria como hemangioma esplénico con infarto focal (Figura 4A-C).
Después del alta, el paciente regresó al hospital para un reexamen semanal del hemograma, y el pico de plaquetas fue de 7,24 x10 11 células/L a las 2 semanas después de la cirugía. Se inició el uso de aspirina oral para prevenir la trombosis venosa y luego el recuento de plaquetas disminuyó gradualmente (Tabla 1). La aspirina se suspendió 1 mes después de la operación, cuando el nivel de plaquetas volvió a la normalidad. La tomografía computarizada (TC) abdominal 1 mes después de la cirugía indicó una buena circulación sanguínea esplénica residual (Figura 4D-4F). La resonancia magnética no se volvió a examinar después de la cirugía debido a problemas financieros.

Figura 1: Imagen de resonancia magnética. (A-D) Se encontró una masa con un rico suministro de sangre en el polo subesplénico, que se consideró un tumor de origen vascular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Colocación del trócar. Adopte el método de cinco orificios y use la posición de perforación específica que se muestra en la figura. Haga clic aquí para ver una versión más grande de esta figura.
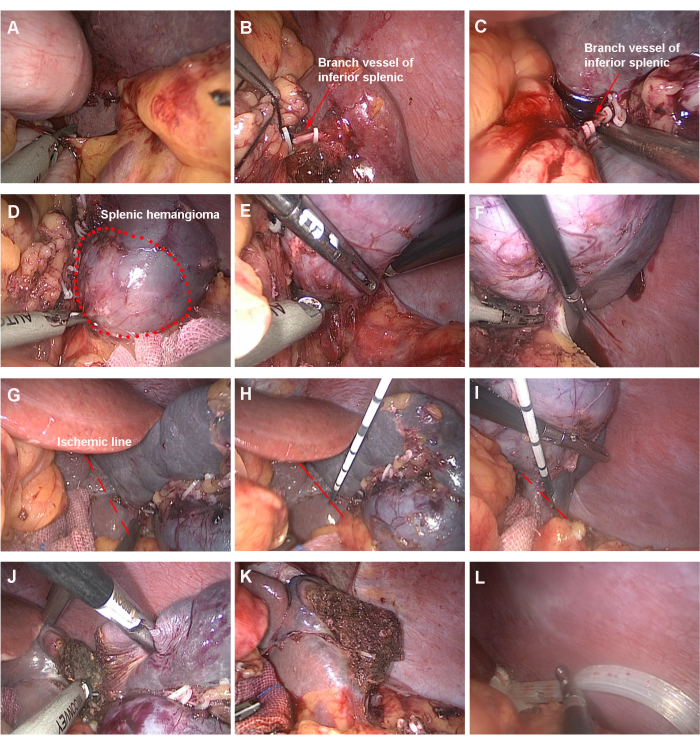
Figura 3: Pasos de la cirugía. (A) Abrir los ligamentos gastrocólicos y gastrosplénicos izquierdos. (B, C) Disociar y ligar los vasos polares inferiores del bazo. (D) Revelar el hemangioma del polo inferior del bazo. (E) Separar los ligamentos esplenocólicos. (F) Separar los ligamentos entre el bazo y el riñón. (G) Observar la línea isquémica. (H, I) Iniciar la ablación. (J) Cortar el bazo. (K) Examinar la sección transversal del esplénico y evaluar el suministro de sangre del esplénico residual. (L) Tubo de drenaje de indoor. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Muestra patológica. (A) Imagen de la apariencia del tumor, barras de escala = 1 cm. (B) Imagen de tinción de H&E, barras de escala = 10 μm. (C) Imagen de tinción IHQ CD34, barras de escala = 10 μm. (D-F) Imágenes de TC después de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
| Preoperatorio | 1 día postoperatorio | 3 días después de la operación | 7 días después de la operación | 2 semanas después de la operación | 3 semanas después de la operación | 1 mes postoperatorio | |
| Recuento de plaquetas (PLT) | 2,61 x 1011 células/L | 2,74 x 1011 células/L | 3,51 x 1011 células/L | 5,02 x 1011 células/L | 7,24 x 1011 células/L | 6,13 x 1011 células/L | 3,35 x 1011 células/L |
Tabla 1: Recuento de plaquetas del paciente.
Discusión
La selección de los casos apropiados es el primer paso en el desarrollo exitoso de LPS. Con base en la experiencia personal y los reportes bibliográficos, resumimos las siguientes indicaciones14,15: (1) El tumor se localiza en el polo superior o inferior del bazo y lejos del hilio esplénico. (2) No hay adherencia grave entre el tumor y los tejidos circundantes. (3) El volumen retenido del bazo debe ser al menos el 25% del volumen original. (4) Sin disfunción de la coagulación.
Debido al abundante flujo sanguíneo al bazo, es necesario tratar un gran número de vasos pediculares esplénicos y vasos internos parenquimatoso durante la resección, lo que requiere una amplia experiencia en cirugía laparoscópica. El riesgo de LPS es muy alto, lo que limita la popularidad de esta técnica. El LPS convencional suele implicar la exposición del hilio esplénico, seguida de la ligadura de los vasos arteriovenosos del polo superior o inferior donde se localiza el tumor esplénico y el corte del tejido esplénico a lo largo de la línea isquémica16,17. El control de la hemorragia cuando se corta el bazo se ha convertido en un problema clave en el desarrollo del LPS. Un estudio ha encontrado que la disección esplénica a lo largo del plano 1 cm dentro de la línea isquémica puede reducir eficazmente el sangrado intraoperatorio18. La oclusión temporal del tronco esplénico se ha considerado una técnica segura, factible y repetible en LPS19. Wang et al. realizaron una esplenectomía parenquimatosa sin sangre utilizando un dispositivo de radiofrecuencia bipolar laparoscópica20. La ablación por radiofrecuencia se considera una técnica segura, sencilla y eficaz para reducir el sangrado intraoperatorio en la esplenectomía parcial21,22. En la esplenectomía parcial, la ablación térmica para ayudar a la hemostasia puede minimizar la pérdida de sangre durante la cirugía23. Aunque hay muchas formas de controlar el sangrado intraoperatorio, la efectividad de estos métodos debe verificarse más a fondo en la práctica clínica.
Por lo tanto, recomendamos un método especial de hemostasia, que consiste en aplicar AMEU a LPS. En comparación con la ablación por radiofrecuencia, la AMEU tiene un mayor efecto térmico y se utiliza a menudo en el tratamiento de tumores sólidos. La aplicación de la ablación por microondas para ayudar a la hepatectomía laparoscópica ha sido ampliamente reportada, pero la aplicación de la AMEU para ayudar a la LPS todavía se menciona raramente.
Con la AMEU, se puede evitar el bloqueo previo de los vasos pediculares esplénicos intraoperatorios, lo que reduce la lesión por isquemia-reperfusión en el bazo residual. Intraoperatoriamente, se utiliza la ablación penetrante multipunto en el mismo plano para formar una zona de coagulación entre el tejido normal del bazo y la parte isquémica. El sangrado es prácticamente nulo cuando se corta el bazo.
Por supuesto, hay ciertos inconvenientes en esta tecnología. Se ha reportado en la literatura que se utiliza un uso excesivo de energía para detener el sangrado, lo que puede resultar en grandes áreas de márgenes de tejido parenquimatoso necrótico24. El uso inadecuado de las agujas de ablación puede provocar daños térmicos en los tejidos y órganos circundantes. Por lo tanto, el cirujano debe haber acumulado una amplia experiencia en las técnicas de AMEU para poder realizar este procedimiento con éxito.
Cuando se utiliza la ablación por microondas como complemento de la LPS, se deben tener en cuenta los siguientes puntos: En primer lugar, planificar preliminarmente la ruta de ablación en función de la TC o la RM antes de la cirugía; en segundo lugar, controle la profundidad de inyección de acuerdo con el tamaño y el grosor del bazo y calcule el tiempo de cada ablación para lograr una ablación precisa; En tercer lugar, esté atento cuando use la aguja de ablación para penetrar en el bazo y preste atención a la posición de la punta de la aguja para evitar daños a los tejidos circundantes durante la operación; Finalmente, la ablación de la trayectoria de la aguja se realiza mientras se extrae la aguja de ablación para evitar el sangrado de la aguja.
En conclusión, la LPS asistida por AMEU es segura y factible, pero aún se necesita una revisión adicional de los criterios de inclusión de los pacientes y una mejora de las técnicas de ablación para reducir las complicaciones postoperatorias y mejorar los resultados de los pacientes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| 10-mm trocar | Xiamen Surgaid Medical Device Co., LTD | NGCS 100-1-10 | Sterile, ethylene oxide sterilized, disposable |
| 12-mm trocar | Xiamen Surgaid Medical Device Co., LTD | NGCS 100-1-12 | Sterile, ethylene oxide sterilized, disposable |
| 5-mm trocar | Xiamen Surgaid Medical Device Co., LTD | NGCS 100-1-5 | Sterile, ethylene oxide sterilized, disposable |
| Hem-o-lok | America Teleflex Medical Technology Co., LTD | 544240 | Sterile, ethylene oxide sterilized, disposable |
| Pneumoperitoneum needle | Xiamen Surgaid Medical Device Co., LTD | NGCS 100-1 | Sterile, ethylene oxide sterilized, disposable |
| Suction and irrigation tube | Tonglu Hengfeng Medical Device Co., LTD | HF6518.035 | Sterile,dry heat sterilized, reusable |
| Ultrasounic-harmonic scalpel | Chongqing Maikewei Medical Technology Co., LTD | QUHS36S | Sterile, ethylene oxide sterilized, disposable |
| Water-cooled microwave ablation probe(single use) | Nanjing Viking Jiuzhou Medical Device R&D Center | MTC-3CA-II19 | Sterile, ethylene oxide sterilized, disposable |
Referencias
- Reyes-Jaimes, L., Camacho-Aguilera, J. F. Spontaneous splenic rupture. Case report and literature review. Rev Med Inst Mex Seguro Soc. 61 (4), 523-531 (2023).
- Nyilas, Á, et al. Laparoscopic splenectomy in our practice at the University of Szeged Department of Surgery. Magy Seb. 75 (2), 200-207 (2022).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Theilacker, C., et al. Overwhelming postsplenectomy infection: A prospective multicenter cohort study. Clin Infect Dis. 62 (7), 871-878 (2016).
- Nardo-Marino, A., Brousse, V. Splenectomy in sickle cell disease: do benefits outweigh risks. Haematologica. 108 (4), 954-955 (2023).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Di Buono, G., et al. Laparoscopic near-total splenectomy. Report of a case. Int J Surg Case Rep. 77s (Suppl), S44-S47 (2020).
- Liao, K. X., et al. Laparoscopic partial splenectomy in the treatment of splenic ectopic pregnancy. Hepatobiliary Surg Nutr. 13 (3), 569-572 (2024).
- Langford, J., Schammel, C. M. G., Bolton, W., Devane, A. M. Microwave ablation to cauterize a bleed after CT-guided lung biopsy. J Vasc Interv Radiol. 33 (11), 1456-1457 (2022).
- Guo, J., Tian, G., Zhao, Q., Jiang, T. Fast hemostasis: a win-win strategy for ultrasound and microwave ablation. Onco Targets Ther. 11, 1395-1402 (2018).
- Rao, Z., et al. Precoagulation with microwave ablation for hepatic parenchymal transection during liver partial resection. Int J Hyperthermia. 36 (1), 146-150 (2019).
- Abdelraouf, A., et al. Initial experience of surgical microwave tissue precoagulation in liver resection for hepatocellular carcinoma in cirrhotic liver. J Egypt Soc Parasitol. 44 (2), 343-350 (2014).
- Sasaki, K., Matsuda, M., Hashimoto, M., Watanabe, G. Liver resection for hepatocellular carcinoma using a microwave tissue coagulator: Experience of 1118 cases. World J Gastroenterol. 21 (36), 10400-10408 (2015).
- Bader-Meunier, B., et al. Long-term evaluation of the beneficial effect of subtotal splenectomy for management of hereditary spherocytosis. Blood. 97 (2), 399-403 (2001).
- de Buys Roessingh, A. S., de Lagausie, P., Rohrlich, P., Berrebi, D., Aigrain, Y. Follow-up of partial splenectomy in children with hereditary spherocytosis. J Pediatr Surg. 37 (10), 1459-1463 (2002).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Di Mauro, D., Fasano, A., Gelsomino, M., Manzelli, A. Laparoscopic partial splenectomy using the harmonic scalpel for parenchymal transection: two case reports and review of the literature. Acta Biomed. 92 (S1), e2021137(2021).
- de la Villeon, B., et al. Laparoscopic partial splenectomy: a technical tip. Surg Endosc. 29 (1), 94-99 (2015).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Wang, W. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Karadayi, K., Turan, M., Sen, M. A new technique for partial splenectomy with radiofrequency technology. Surg Laparosc Endosc Percutan Tech. 21 (5), 358-361 (2011).
- Itamoto, T., Fukuda, S., Tashiro, H., Ohdan, H., Asahara, T. Radiofrequency-assisted partial splenectomy with a new and simple device. Am J Surg. 192 (2), 252-254 (2006).
- Duan, Y. Q., Liang, P. Thermal ablation for partial splenectomy hemostasis, spleen trauma, splenic metastasis and hypersplenism. Hepatogastroenterology. 60 (123), 501-506 (2013).
- Zacharoulis, D., Katsogridakis, E., Hatzitheofilou, C. A case of splenic abscess after radiofrequency ablation. World J Gastroenterol. 12 (26), 4256-4258 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados