Method Article
Evaluación de la transcitosis intestinal de aislados de bacteriemia neonatal por Escherichia coli
En este artículo
Resumen
Escherichia coli causa sepsis en neonatos que ingieren la bacteria alrededor del momento del nacimiento. El proceso involucrado en la capacidad de E. coli para viajar desde el tracto entérico al torrente sanguíneo es poco conocido. Este modelo in vitro evalúa la capacidad de las cepas de E. coli para viajar a través de las células epiteliales intestinales.
Resumen
Los recién nacidos ingieren cepas maternas de E. coli que colonizan su tracto intestinal alrededor del momento del parto. Las cepas de E. coli con la capacidad de translocarse a través del intestino invaden el torrente sanguíneo del recién nacido, causando bacteriemia potencialmente mortal. La metodología presentada aquí utiliza células epiteliales intestinales polarizadas cultivadas en insertos semipermeables para evaluar la transcitosis de aislados de bacteriemia neonatal por E. coli in vitro. Este método utiliza la línea celular intestinal T84 establecida que tiene la capacidad de crecer para confluir y formar uniones estrechas y desmosomas. Después de alcanzar la confluencia, las monocapas T84 maduras desarrollan resistencia transepitelial (TEER), que se puede cuantificar utilizando un voltímetro. Los valores de TEER están inversamente correlacionados con la permeabilidad paracelular de los componentes extracelulares, incluidas las bacterias, a través de la monocapa intestinal. El paso transcelular de bacterias (transcitosis), por otro lado, no necesariamente altera las mediciones TEER. En este modelo, el paso bacteriano a través de la monocapa intestinal se cuantifica hasta 6 h después de la infección, y se realizan mediciones repetidas de TEER para controlar la permeabilidad paracelular. Además, este método facilita el uso de técnicas como la inmunotinción para estudiar los cambios estructurales en las uniones estrechas y otras proteínas de adhesión de célula a célula durante la transcitosis bacteriana a través del epitelio polarizado. El uso de este modelo contribuye a la caracterización de los mecanismos por los cuales E. coli neonatal se transcita a través del epitelio intestinal para producir bacteriemia.
Introducción
Escherichia coli es la causa más común de sepsis de inicio temprano en recién nacidos 1,2,3. La tasa de mortalidad de la bacteriemia neonatal por E. coli puede alcanzar el 40%, y la meningitis es una posible complicación asociada a discapacidades graves del desarrollo neurológico2. La ingestión de cepas maternas de E. coli por el recién nacido puede producir bacteriemia neonatal; Este proceso ha sido replicado en modelos animales 2,4. Una vez ingeridas, las bacterias patógenas viajan desde la luz intestinal neonatal a través de la barrera intestinal y entran en el torrente sanguíneo, causando septicemia. Las cepas neonatales invasivas de E. coli que producen bacteriemia varían en su capacidad para invadir las células epitelialesintestinales 1,5. Sin embargo, su capacidad para transcitar el epitelio intestinal después de la invasión no ha sido completamente caracterizada.
Este modelo de transcitosis intestinal es un método in vitro útil para emular el paso bacteriano a través del epitelio intestinal. El objetivo general de los métodos presentados en este manuscrito es comparar la capacidad de los aislados neonatales de E. coli para transcitar el epitelio intestinal. El modelo descrito aquí utiliza células T84, que son células de adenocarcinoma intestinal humano inmortalizadas 6,7. Las células T84 se cultivan para confluir en una membrana semipermeable con dos compartimentos separados. La justificación para utilizar esta técnica es que, como sucede in vivo, estas células intestinales se polarizan y desarrollan uniones estrechas maduras 6,8. El lado en contacto con la membrana se convierte en el lado basal. El lado opuesto de las células se convierte en el lado apical, parecido a la luz intestinal donde los patógenos ingeridos se adhieren e invaden. La membrana transwell es permeable a las bacterias, pero las células intestinales polarizadas forman uniones estrechas, que perjudican el movimiento paracelular bacteriano9. Por lo tanto, este método proporciona la ventaja de un entorno in vitro controlado que utiliza una línea celular humana para estudiar el proceso de transcitosis bacteriana, incluida la ruta transcelular. Mientras que existen otros métodos para investigar la transcitosis de bacterias a través del epitelio intestinal, el método transwell presentado aquí proporciona una mayor facilidad y accesibilidad. Se dispone de técnicas alternativas, como las que utilizan muestras ex vivo instaladas en sistemas de cámaras Ussing. Sin embargo, utilizan muestras de tejido que pueden no ser fácilmente accesibles, particularmente si la investigación tiene la intención de estudiar la fisiología humana10. Los organoides intestinales representan otro ejemplo de una alternativa in vitro para estudiar las interacciones huésped-bacteria11. Mientras que las monocapas organoides también pueden ser utilizadas en el sistema transwell para estudiar la transcitosis bacteriana, requieren el aislamiento y crecimiento de células madre y el uso de factores de crecimiento específicos para inducir la diferenciación12. Por lo tanto, su uso requiere más tiempo y se asocia con mayores costos en comparación con el método transwell descrito en este manuscrito.
La evaluación del paso bacteriano a través del epitelio intestinal utilizando este sistema de transwell in vitro se ha realizado con éxito para varios patógenos. Estos estudios han demostrado la utilidad del sistema transwell utilizando células T84 para caracterizar la transcitosis de bacterias a través del epitelio intestinal polarizado13,14,15. Sin embargo, la aplicación de este método transwell para comparar la capacidad de transcitosis de cepas neonatales de E. coli productoras de bacteriemia no se ha descrito en detalle. Este manuscrito proporciona a otros investigadores un protocolo estándar de transwell que es confiable y fácil de usar y no requiere recursos demasiado caros.
Para comparar la capacidad de las cepas neonatales invasivas de E. coli para transcitar el epitelio intestinal, el lado apical de la monocapa epitelial intestinal puede infectarse con un número conocido de células bacterianas. Después de la incubación, se puede recolectar el medio en el lado basal del epitelio y cuantificar las bacterias para determinar la cantidad de transcitosis bacteriana a lo largo del tiempo. En este manuscrito, los métodos presentados se utilizan para estudiar la capacidad de transcitosis de cepas clínicas neonatales de E. coli recuperadas de recién nacidos hospitalizados con bacteriemia. Los criterios de inclusión para la selección de estos aislados clínicos neonatales para estudios de transcitosis han sido publicados previamente 1,2,16. Cuando este método se realiza utilizando diferentes cepas de E. coli, se pueden comparar sus capacidades de transcitosis. A través de este proceso, el modelo de transcitosis intestinal proporciona datos valiosos para caracterizar los factores de virulencia de E. coli que contribuyen al proceso de múltiples pasos que culmina en el desarrollo de bacteriemia neonatal.
Protocolo
NOTA: Realice todas las manipulaciones de las células, bacterias, placas y reactivos T84 en un gabinete de seguridad de nivel de bioseguridad 2 (BSL-2) para evitar la contaminación. Use áreas e incubadoras separadas para todo el trabajo que involucre células T84 estériles, células T84 infectadas y E. coli. Los aislados clínicos de E. coli probados con los métodos aquí descritos fueron obtenidos siguiendo las directrices del Comité de Revisión Institucional de nuestra institución 1,16.
1. Preparación de insertos de transcitosis con células T84 (aproximadamente 1-2 semanas antes del experimento)
- Grow American Type Culture Collection (ATCC) células T84 en medio de cultivo de tejidos (MTC + antibióticos) que consiste en el medio Águila modificada de Dulbecco: mezcla de nutrientes F-12 de Ham (1: 1, concentración final: 50% cada uno), suero bovino fetal al 5% y mezcla antibiótica dual de penicilina / estreptomicina al 1% (100 U / ml). Incubar las células a 37 °C con 5% deCO2.
NOTA: Se utiliza una variación de esta formulación de medio sin penicilina/estreptomicina (MTC sin antibióticos) para los pasos posteriores (sección 2 y posteriores) del procedimiento. Asegúrese de que se utiliza la formulación correcta para cada paso. - Trabajando dentro de un gabinete de bioseguridad (BSC), siembre las células T84 en insertos de transwell de cultivo celular de membrana de tereftalato de polietileno con poros de 3 μm hechos para placas de 24 pocillos. Incluya réplicas de transwell para cada condición experimental deseada más controles no infectados para monitorear la posible contaminación.
- En una placa de 24 pocillos diseñada para contener insertos de transwell, llene el número deseado de pocillos colectores con 1 ml de MTC + antibióticos.
- En cada pocillo, coloque un inserto transwell.
- Sembrar estos insertos con 1 x 105 células T84 suspendidas en 500 μL de MTC + antibióticos. Cuantificar el número de células utilizando un hemocitómetro con tinción de azul de tripano o un contador celular automatizado17.
- Incubar las placas transwell que contienen insertos con semillas en las mismas condiciones en que se cultivaron las células.
- Verifique con microscopía óptica que las monocapas hayan comenzado a confluente después de sembrar el inserto, aproximadamente 48 h después de la siembra.
- Cada 2 días después de la siembra, mida y registre la resistencia eléctrica transepitelial (TEER) utilizando un medidor epitelial volt/ohm (EVOM) para evaluar la madurez de la monocapa. Una vez que los insertos alcanzan un TEER de al menos 1.000 Ωcm2, se consideran listos para el ensayo18.
NOTA: Los insertos suelen tardar de 7 a 10 días en alcanzar este TEER después de la siembra. Las células T84 mostrarán una confluencia del 100% bajo microscopía óptica una vez que se alcance esta resistencia.- Guarde la sonda EVOM con los electrodos sumergidos en 0,15 M KCl cuando no esté en uso.
- Antes de medir el TEER, descontamine la sonda del electrodo sumergiéndola en 5 ml de etanol al 70% en un tubo cónico de 50 ml durante 10-15 min. Retire la sonda, sacuda el exceso de etanol y deje que se seque al aire dentro del BSC durante 10 minutos. Retener el tubo de etanol.
- Pruebe el EVOM y la sonda colocando la sonda seca descontaminada en un pocillo estéril que contenga 1 ml de MTC + antibióticos con un inserto estéril en el interior que contenga 500 μL de MTC + antibióticos. Asegúrese de que la lectura de EVOM sea de <200 Ω. Registre este valor en blanco para utilizarlo en los cálculos de resistencia posteriores descritos en el paso 1.3.6.
- Retire la sonda del tubo de MTC + antibióticos. Conserve este tubo para el almacenamiento de la sonda durante todo el experimento.
- Baje suavemente la sonda en el primer inserto con el electrodo largo en el pozo colector y el electrodo corto dentro del inserto. Permita que el electrodo largo toque el fondo del pocillo colector, pero no empuje hacia abajo, ya que esto puede interrumpir la monocapa epitelial.
- Repita este proceso para medir y registrar la resistencia en ohmios (Ω) para cada inserto. Cuando termine, descontamine la sonda en el etanol sumergiéndola durante otros 10-15 minutos. Luego, mueva la sonda descontaminada de nuevo a la solución KCl para su almacenamiento. Restar la resistencia en blanco obtenida en el paso 1.3.3 de cada valor obtenido de cada inserto que contenga celdas T84. Multiplique la resistencia resultante (Ω) para cada inserto por el área de la parte inferior de cada inserto (cm 2) para obtener la medida TEER final (Ω·cm2).
- Una vez que el TEER alcanza al menos 1.000 Ω · cm2, la monocapa epitelial está madura y lista para los ensayos de infección.
- A medida que el TEER madura, proporcione a las células un medio fresco cada 1-2 días.
- En una nueva placa de 24 pocillos, agregue 1 ml de MTC + antibióticos a un pocillo por cada inserto sembrado que se esté preparando.
- Usando fórceps estériles, transfiera cuidadosamente los insertos a los pozos recién reabastecidos.
- Reemplace el soporte en las inserciones.
- Retire los medios viejos de los insertos inclinando la placa y utilizando un aspirador de vacío interno para extraer suavemente el medio con una punta de pipeta a lo largo del costado del inserto. El aspirador permite la regulación de la succión de bajo nivel para evitar la interrupción de las células. No permita que la punta de la pipeta toque la parte inferior del inserto, ya que esto interrumpirá la monocapa epitelial en desarrollo.
- Agregue 500 μL de MTC + antibióticos a los insertos. Visualice la monocapa con microscopía óptica para verificar que permanezca intacta.
- Cada 1-2 días, mida el TEER en cada inserto como se describe anteriormente en los pasos 1.3.2-1.3.6.
2. Preparación de las células T84 1 día antes del experimento usando MTC sin antibióticos
- Mida y registre el TEER el día antes del experimento.
- Reemplace la MTC de la misma manera que durante la preparación y el mantenimiento de la celda anterior. Sin embargo, la MTC sin antibióticos se usa en su lugar en preparación para la infección (1 ml en el pocillo de la placa y 500 μL en el inserto).
3. Cultivos de E. coli (iniciados 1 día antes del experimento)
PRECAUCIÓN: Use precauciones de nivel de bioseguridad 2 (BSL-2) cuando trabaje con cepas clínicas patógenas de E. coli.
- Tome un tubo cónico marcado de 15 ml con 5 ml de caldo de lisogenia estéril (LB) y use un asa estéril para inocular el caldo con una colonia de una cepa bacteriana (E. coli). Repita este proceso, creando un tubo de cultivo nocturno para cada cepa a probar.
- Incubar el cultivo nocturno, con las tapas de los tubos aflojadas, en un agitador de incubadora (250 rpm, 37 °C).
4. Preparación del inóculo de E. coli , células epiteliales y materiales (en la mañana del experimento)
NOTA: Use MTC sin antibióticos calentados hasta 37 °C a partir de este momento.
- Añadir 250 μL de cada cultivo de LB durante la noche a 25 ml de MTC sin antibióticos en un tubo cónico de 50 ml (uno por cepa individual). Mantenga las tapas de los tubos aflojadas. Coloque estos nuevos tubos de cultivo en el agitador con la misma configuración (250 rpm, 37 °C) durante exactamente 2 h. Realice los subpasos restantes mientras espera.
- Mida el TEER en cada inserto, como se describe en los pasos 1.3.2-1.3.6. Regístrelos como TEER en el momento (t) = 0 h.
- Mover los insertos a pocillos de una placa nueva y cambiar el medio utilizando la técnica descrita en el paso 1.4.3. Sin embargo, esta vez, llene los nuevos pocillos colectores con 500 μL de MTC sin antibióticos, y llene los insertos con 400 μL de MTC sin antibióticos. Mantenga los insertos dentro de la incubadora de cultivo de tejidos hasta el momento de la infección.
- Coloque un número suficiente de placas cuadradas de agar LB para calentar a temperatura ambiente (RT) para su posterior recubrimiento y cuantificación bacteriana.
5. Inoculación de las células (inicio del experimento)
- Después de exactamente 2 h, retire los cultivos bacterianos matutinos del agitador y centrifugarlos durante 10 min (1,900 x g, 4 °C).
NOTA: Para todos los pasos siguientes, mantenga todas las suspensiones bacterianas en hielo para minimizar el crecimiento. - Resuspender el pellet de bacterias en TCM sin antibióticos. Use un espectrofotómetro para ajustar la densidad óptica (OD) a 0.7-0.9, y diluya aún más con TCM sin antibióticos a una concentración de 1 x 106 unidades formadoras de colonias (UFC) / ml (aproximadamente 1:100 dilución). Use esta suspensión bacteriana para infectar cada inserto con 1 x 105 UFC por volumen de 100 μL.
- Etiquetar la placa transwell e infectar cada inserto con 100 μL del inóculo ajustado por OD (total de 1 x 105 UFC por inserto). El ensayo ya ha comenzado. Anote la hora y regístrela como t = 0 h.
- Colocar en placa la suspensión bacteriana del inóculo para cuantificar la UFC/ml utilizando el método de dilución de la vía, colocando alícuotas de 10 μL en placas cuadradas de agar LB19.
6. Cuantificación de la transcitosis
- Cada 30 minutos después de la inoculación, llene los nuevos pocillos con 500 μL de MTC sin antibióticos. Transfiera los insertos a estos nuevos pocillos utilizando un conjunto diferente de pinzas estériles para cada cepa bacteriana diferente.
- Recoja los medios del pozo recolector usado para cada inserto en tubos etiquetados separados. Coloque estos tubos sobre hielo. Devuelva las placas transwell a la incubadora entre puntos de tiempo.
- Para cada inserto, combine los medios recolectados de t = 0.5 h, t = 1 h, t = 1.5 h y t = 2 h, y vórtice brevemente. Coloque los medios recolectados en placas de agar LB utilizando el método de dilución de pista para cuantificar la cantidad de bacterias transcitadas en las primeras 2 h del experimento.
NOTA: Recuperar las bacterias cada 30 minutos y mantenerlas en hielo asegura que el crecimiento bacteriano en los pozos colectores se minimice y las mediciones se realicen en bacterias predominantemente transcitadas. - Coloque las placas de agar LB de dilución de vía etiquetadas en la incubadora bacteriana a 37 °C sinCO2 suplementario y devuelva la placa de pocillo T84 a la incubadora de cultivo de tejidos.
- En t = 4 h, repita el paso 6.3 combinando los medios recolectados de t = 2.5 h, t = 3 h, t = 3.5 h y t = 4 h.
- En t = 6 h, repita el paso 6.3 combinando los medios recolectados de t = 4.5 h, t = 5 h, t = 5.5 h y t = 6 h. Además, a t = 6 h, placa el medio de los pocillos de control.
7. Fin del experimento
- Mida y registre el TEER al final del experimento, t = 6 h. Utilice el procedimiento descrito en los pasos 1.3.2-1.3.6.
- Descontamine la sonda sumergiéndola en etanol al 70% durante 10-15 min. Deseche los insertos o guárdelos/procese para aplicaciones adicionales, si lo desea. Permita que las placas de agar LB se incuben durante la noche y desinfecte y/o deseche de forma segura todos los demás materiales utilizados.
- Después de la incubación durante la noche, cuente las colonias bacterianas manualmente en las placas LB de dilución de la pista para determinar la cantidad de inóculo y la cantidad de transcitosis de E. coli. Asegúrese de que las placas de control no muestren ningún crecimiento bacteriano.
Resultados
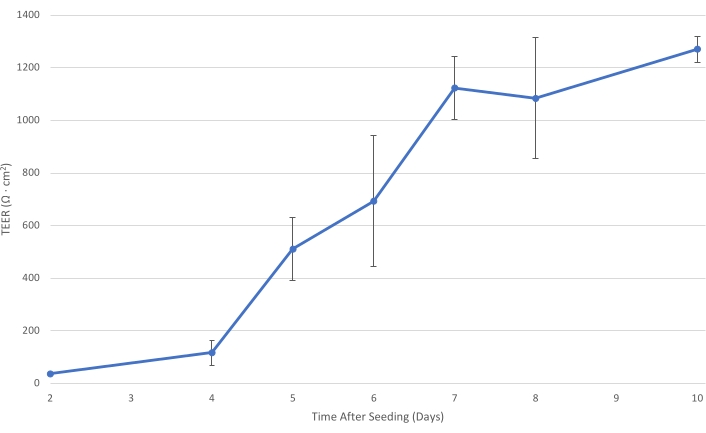
Figura 1: T84 TEER a lo largo del tiempo. A medida que la capa de celda T84 madura en el inserto, la resistencia eléctrica de la monocapa aumenta. A un TEER de al menos 1.000 Ω·cm2, la capa celular está suficientemente desarrollada para disminuir el transporte bacteriano paracelular y permitir la medición del tránsito bacteriano principalmente transcelular. Las barras de error indican la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.
Durante la proliferación de las células T84 estériles descritas en la sección 1, los TEER a través de las monocapas T84 aumentan continuamente con el tiempo, superando los 1.000 Ω·cm2 aproximadamente después de 7 días desde la siembra (ver Figura 1). Aunque la polarización de las células epiteliales y la maduración del TEER son más robustas con las células T84 que con otras células intestinales, como Caco-2, aún puede ser necesaria cierta solución de problemas6. El TEER de un inserto no debe disminuir drásticamente entre mediciones. Tal disminución en el TEER podría indicar una interrupción mecánica de la monocapa epitelial. Uno debe asegurarse de que durante el cambio de medio, la punta del aspirador nunca toque la parte inferior del inserto de cultivo celular. Si se sospecha este tipo de daño, se puede visualizar mediante microscopía óptica como una ausencia de células epiteliales cerca de la ubicación de la aspiración. Además de los daños causados por la manipulación, una disminución en el TEER podría indicar contaminación.

Figura 2: Transcitosis de aislados neonatales de E. coli a lo largo del tiempo. Después de infectar los insertos T84, los aislados clínicos neonatales de E. coli que llegan con éxito al pocillo colector se cuantifican utilizando el método de dilución de pista. Se pueden comparar diferentes cepas de E. coli en términos de su capacidad para transcitar el epitelio intestinal. Se incluyó como comparador la E. coli DH5 alfa no patógena. Los gráficos muestran las UFC medias y los errores estándar en cada punto de tiempo. Las comparaciones de los valores medios de transcitosis se realizaron con pruebas t de una cola, que demostraron diferencias significativas entre los aislados neonatales de E. coli # 1 versus # 2 a las 2 h (* p < 0.05), 4 h (** p < 0.04) y 6 h (***p < 0.04) después de la infección. En contraste, la cepa no patógena de E. coli DH5 alfa sufrió una transcitosis mínima, como se muestra en la tercera gráfica. Haga clic aquí para ver una versión más grande de esta figura.
La transcitosis cuantificada se puede representar como se muestra en la Figura 2. En este ejemplo, los experimentos se realizaron utilizando tres insertos, cada uno infectado con dos aislados de E. coli invasivos neonatales diferentes. Una cepa no patógena, DH5 alfa, también se probó para la comparación. También se incluyeron dos insertos de control estériles (no se muestra ninguna gráfica ya que no se aislaron bacterias). Los datos de este procedimiento son útiles para describir la capacidad de una sola cepa de E. coli para transcitar el epitelio intestinal. Los datos también pueden permitir una comparación de las capacidades de transcitosis de diferentes cepas (consulte la sección de discusión para otras aplicaciones).

Figura 3: TEER inmediatamente antes de la infección y 6 h después de la infección. El TEER de los insertos generalmente aumenta después de la infección con cepas productoras de bacteriemia neonatalpor E. coli 2. Los insertos infectados muestran un mayor aumento en TEER que los insertos de control no infectados. El TEER fue significativamente mayor en monocapas T84 después de 6 h de infección con E. coli neonatal cepa #1 (*p < 0.01) y E. coli cepa #2 (**p < 0.03), según lo calculado por las pruebas t. El TEER en las monocapas T84 de control no infectadas también aumentó, pero la diferencia entre los valores previos y posteriores a la infección no fue estadísticamente significativa. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 3 muestra los resultados típicos de TEER antes y después de la infección con dos aislados clínicos neonatales de E. coli con diferentes capacidades para transcitar las células epiteliales intestinales. La velocidad y la cantidad de transcitosis varían entre las cepas, como se muestra en la Figura 2, pero el TEER aumenta significativamente después de la infección con ambas cepas patógenas.
Los resultados pueden ser alterados en presencia de contaminación en este experimento. Las cepas neonatales de E. coli utilizadas no causaron suficiente daño a la monocapa epitelial para producir una disminución en TEER, sin embargo, las bacterias pudieron transcitoizar. Es plausible que un organismo contaminante, si está presente, podría causar daño a las células intestinales y una posterior disminución del TEER. Los insertos de control estériles sirven para ayudar a identificar dicha posible contaminación. El medio de cultivo de tejidos utilizado en este procedimiento contiene el indicador de pH rojo fenol. En general, el medio aparece de color rosa claro cuando es estéril o está infectado con un pequeño inóculo. Con un crecimiento o contaminación significativos, el medio puede volverse turbio, amarillo o maloliente. Antes de la infección, los medios en todos los insertos T84 normalmente aparecen de color rosa claro.
Después de la incubación durante la noche, el lugar final para verificar la contaminación es en las placas de agar LB. Las placas de control no deben mostrar ningún crecimiento. Las placas hechas de los pocillos colectores de insertos infectados por E. coli deben contener colonias homogéneas, redondas y amarillas de E. coli. Para minimizar el riesgo de contaminación, todo el trabajo debe realizarse en gabinetes de bioseguridad. Se deben usar gabinetes e incubadoras separados para el cultivo de tejidos estériles, el cultivo de tejidos infectados con E. coli y la manipulación bacteriana. Los espacios de trabajo deben mantenerse limpios y se debe usar una técnica estéril en todo momento.
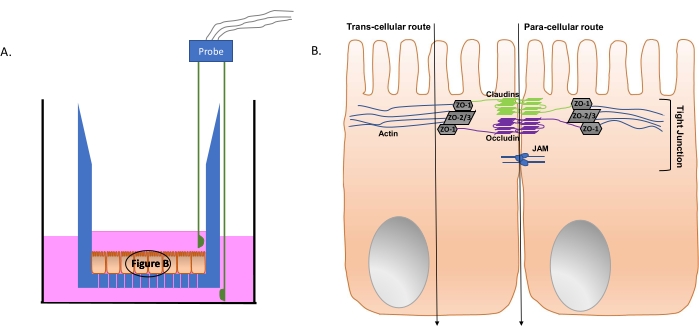
Figura 4: Representación esquemática del sistema transwell y estructuras celulares intestinales relevantes. (A) Vista de sección del inserto de transpozo (azul); Las líneas verticales en la parte inferior del inserto indican los poros permeables. Las células epiteliales intestinales polarizadas forman una monocapa en la parte inferior del inserto. El medio de cultivo de tejidos se muestra en rosa, con una sonda EVOM de dos clavijas sumergida en él. Los cables de la sonda en el lado opuesto están enganchados al aparato EVOM (no se muestra). (B) Diagrama simplificado de los componentes de unión estrecha de las células epiteliales intestinales. Las flechas verticales representan posibles rutas de paso bacteriano desde el lado apical al basolateral de la monocapa epitelial intestinal polarizada. Abreviaturas: ZO = zonas occludens proteins; JAM = moléculas de adhesión de unión. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Crecimiento apical de E. coli neonatal aislado a lo largo del tiempo. Las mediciones de E. coli en sobrenadantes que recubren células T84 dentro de insertos de transpozo se pueden realizar como un punto final adicional opcional. La figura demuestra que el crecimiento apical de ambas cepas patógenas de E. coli que se analizaron para detectar transcitosis no fue significativamente diferente con el tiempo. Las barras de error indican desviaciones estándar. Haga clic aquí para descargar este archivo.
Discusión
Este método se deriva de técnicas utilizadas en gastroenterología y enfermedades infecciosas20. Se han utilizado modelos in vitro de la barrera epitelial intestinal para dilucidar los mecanismos por los cuales el contenido luminal interactúa con este componente relevante de la inmunidad innata 6,8. Las interacciones huésped-patógeno de E. coli neonatal invasiva también se han caracterizado por separado a través de análisis genéticos, estudios de resistencia a los antimicrobianos y técnicas inmunológicas 1,5,16,21. Sin embargo, se sabe poco sobre los mecanismos moleculares que sustentan la capacidad de los aislados neonatales de E. coli para ingresar al torrente sanguíneo a través del intestino3.
La técnica de transcitosis aquí demostrada permite una caracterización más detallada de las cepas invasivas neonatales de E. coli que producen septicemia después de la adquisición enteral. La bacteriemia neonatal es un proceso de varios pasos, y la transcitosis es uno de los pasos relevantes. En comparación con los modelos de invasión, este método de transcitosis ofrece información adicional sobre los mecanismos implicados en la patogénesis de la bacteriemia. En algunos casos, la E. coli patógena invade el intestino delgado sin llegar al torrente sanguíneo, limitando la infección a causar la enfermedad localizada22. Por lo tanto, la capacidad de las bacterias para simplemente invadir el epitelio intestinal puede no reflejar su capacidad para atravesar completamente la barrera epitelial. Este modelo puede ser utilizado para estudiar el proceso de paso bacteriano a través del epitelio intestinal a través de las rutas transcelulares o paracelulares, particularmente si se incorporan técnicas adicionales como la microscopía electrónica20. En comparación con los modelos animales in vivo , este modelo in vitro es más eficiente y permite un mejor control de varias variables potenciales. Además, contribuye al bienestar animal al proporcionar una alternativa a la experimentación in vivo .
A pesar de estas ventajas, este experimento todavía tiene sus limitaciones. Por un lado, este ensayo no tiene en cuenta las diferencias en el crecimiento bacteriano en el lado apical del epitelio durante la incubación. Tales diferencias de crecimiento pueden afectar la cantidad de transcitosis para cada cepa. Los usuarios pueden optar por medir el crecimiento apical para una caracterización más completa de los resultados obtenidos con este modelo. Un ejemplo del crecimiento apical de los dos aislados de E. coli utilizados para los experimentos de transcitosis en los métodos presentados en este manuscrito se muestra en la Figura Suplementaria 1. Además, aunque este modelo recrea razonablemente la monocapa epitelial intestinal, no representa completamente todos los componentes de la barrera intestinal que protege el torrente sanguíneo de los patógenos ingeridos. Sin embargo, algunas propiedades del epitelio intestinal se pueden estudiar con este modelo. Por ejemplo, las células T84 secretan cloruro y producen mucina23. La invasión por E. coli productora de diarrea se asocia con un aumento de la secreción de cloruro en las células T84 y una disminución significativa de la ETE más allá de las 6 h posteriores ala infección 24. Es posible que la invasión por cepas de E. coli productoras de bacteriemia también aumente la secreción de cloruro en este modelo y que pueda ocurrir una disminución en TEER después de 6 h de la infección. Este modelo se puede adaptar para estudios sobre la relación entre el transporte de iones y la invasión bacteriana si así lo desean otros investigadores. La mucina es una barrera física que protege el epitelio contra los patógenos. La infección con otras cepas de E. coli disminuye la expresión de mucina por las células T8425. El papel de la mucina en la patogénesis de la transcitosis neonatal de E. coli a través del epitelio intestinal también se puede estudiar con este modelo. Otro uso de este modelo podría ser estudiar los efectos citotóxicos de las ciclomodulinas bacterianas y su posible papel en el proceso de transcitosis de cepas neonatales de E. coli. Por ejemplo, el factor necrotizante citotóxico-1 (CNF-1), que es producido por algunas cepas patógenas de E. coli, se dirige a las Rho GTPasas, que son cruciales para regular la función de unión estrecha y la apoptosis de las células eucariotas infectadas26. Este modelo transwell puede ser adaptado para comprender mejor los mecanismos por los cuales estas citotoxinas afectan el epitelio intestinal27. Al utilizar este modelo para estudiar la interacción de las cepas neonatales de E. coli con el epitelio intestinal, es importante considerar que las células T84 utilizadas para modelar el epitelio intestinal provienen de una metástasis pulmonar de adenocarcinoma de colon en un adulto6. Mientras que los estudios en células T84 han reproducido efectos específicos sobre la permeabilidad intestinal que se han traducido en efectos similares en células intestinales humanas recién nacidas y animales neonatales28,29, el epitelio intestinal fetal y neonatal puede comportarse de manera diferente en presencia de E. coli invasiva.
Es posible que se requiera alguna solución de problemas para optimizar este modelo y la calidad de los datos que proporciona. El uso de insertos de control estériles se discute en detalle en la sección de resultados representativos. Otras cepas no invasivas de E. coli también se pueden incluir como controles de transcicltosis negativos/mínimos. Además, se puede utilizar una línea celular diferente, como Caco-2, para evaluar la capacidad de las cepas neonatales de E. coli para transcitar el epitelio intestinal polarizado. Se ha encontrado que la invasión y la transcitosis de E. coli son mayores para las células T84 en comparación con las células Caco-230. Por lo tanto, estas diferencias deben considerarse cuando este modelo se utiliza para evaluar la transcitosis bacteriana con estas y otras células epiteliales que polarizan y forman uniones estrechas. Tomar medidas TEER de cada inserto de transpozo individual requiere varios segundos, y cuando se prueban múltiples deformaciones, se debe tener en cuenta el tiempo adicional del operador. Se siguen desarrollando métodos más eficientes de vigilancia del TEER en los sistemas de transwell. Estos dispositivos más nuevos permiten monitorear el TEER simultáneamente en múltiples insertos de transwell y en tiempo real31. Los investigadores que consideren estas opciones tendrían que decidir si el tiempo ahorrado podría compensar el aumento del precio de estos dispositivos más nuevos en comparación con las mediciones de un solo electrodo descritas en este documento.
A pesar de algunos posibles desafíos, este ensayo permite a los investigadores estudiar mecanismos específicos involucrados en la patogénesis de la bacteriemia por E. coli más allá de la cantidad de transcitosis. Cuando se combina con técnicas de microbiología molecular, este proceso puede ser utilizado para identificar los efectos de genes individuales sobre la capacidad de E. coli para transcitar el epitelio intestinal, como se ha intentado en modelos animales32. Este modelo también puede ser modificado por el cocultivo de células inmunes o la adición de citoquinas, factores de crecimiento e intervenciones farmacéuticas para simular respuestas inmunes y farmacodinámicas más complejas33.
Divulgaciones
Ninguno.
Agradecimientos
Este trabajo fue apoyado por una beca estudiantil Sarah Morrison emitida por la Escuela de Medicina de la Universidad de Missouri-Kansas City a A.I.
Materiales
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
Referencias
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032 (2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593 (2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018 (2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330 (2021).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314 (2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60 (2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321 (2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119 (2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344 (2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2 (2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352 (2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994 (2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208 (2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282 (2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698 (2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados