Method Article
Beurteilung der intestinalen Transzytose von neonatalen Escherichia coli Bacteremia-Isolaten
In diesem Artikel
Zusammenfassung
Escherichia coli verursacht Sepsis bei Neugeborenen, die die Bakterien um den Zeitpunkt der Geburt aufnehmen. Der Prozess, der an der Fähigkeit von E. coli beteiligt ist, vom Darmtrakt in den Blutkreislauf zu gelangen, ist kaum verstanden. Dieses In-vitro-Modell bewertet die Fähigkeit von E. coli-Stämmen, durch die Darmepithelzellen zu wandern.
Zusammenfassung
Neugeborene nehmen mütterliche E. coli-Stämme auf, die ihren Darmtrakt um den Zeitpunkt der Geburt besiedeln. E. coli-Stämme mit der Fähigkeit, über den Darm zu translozieren, dringen in den Blutkreislauf des Neugeborenen ein und verursachen lebensbedrohliche Bakteriämie. Die hier vorgestellte Methodik verwendet polarisierte intestinale Epithelzellen, die auf semipermeablen Einsätzen gezüchtet wurden, um die Transzytose von neonatalen E. coli-Bakteriämie-Isolaten in vitro zu beurteilen. Diese Methode nutzt die etablierte T84-Darmzelllinie, die die Fähigkeit hat, zu Konfluenz zu wachsen und enge Verbindungen und Desmosomen zu bilden. Nach Erreichen der Konfluenz entwickeln reife T84-Monoschichten einen transepithelialen Widerstand (TEER), der mit einem Voltmeter quantifiziert werden kann. Die TEER-Werte korrelieren umgekehrt mit der parazellulären Permeabilität extrazellulärer Komponenten, einschließlich Bakterien, über die intestinale Monoschicht. Die transzelluläre Passage von Bakterien (Transzytose) hingegen verändert die TEER-Messungen nicht notwendigerweise. In diesem Modell wird die bakterielle Passage durch die intestinale Monoschicht bis zu 6 h nach der Infektion quantifiziert, und wiederholte Messungen von TEER werden durchgeführt, um die parazelluläre Permeabilität zu überwachen. Darüber hinaus erleichtert diese Methode den Einsatz von Techniken wie der Immunfärbung, um die strukturellen Veränderungen in Tight Junctions und anderen Zell-zu-Zell-Adhäsionsproteinen während der bakteriellen Transzytose über das polarisierte Epithel zu untersuchen. Die Verwendung dieses Modells trägt zur Charakterisierung der Mechanismen bei, durch die neonatale E. coli durch das Darmepithel transzytieren, um Bakteriämie zu erzeugen.
Einleitung
Escherichia coli ist die häufigste Ursache für eine früh einsetzende Sepsis bei Neugeborenen 1,2,3. Die Sterblichkeitsrate der neonatalen E. coli-Bakteriämie kann 40% erreichen, und Meningitis ist eine mögliche Komplikation, die mit schweren neurologischen Entwicklungsstörungen einhergeht2. Die Aufnahme von mütterlichen E. coli-Stämmen durch das Neugeborene kann zu neonataler Bakteriämie führen; Dieser Prozess wurde in Tiermodellenrepliziert 2,4. Einmal eingenommen, wandern pathogene Bakterien aus dem neonatalen Darmlumen über die Darmbarriere und gelangen in den Blutkreislauf, was zu einer Sepsis führt. Neonatale invasive E. coli-Stämme, die Bakteriämien produzieren, unterscheiden sich in ihrer Fähigkeit, in Darmepithelzellen einzudringen 1,5. Ihre Fähigkeit, das Darmepithel nach der Invasion zu transzytieren, ist jedoch nicht vollständig charakterisiert.
Dieses intestinale Transzytosemodell ist eine nützliche In-vitro-Methode, um die bakterielle Passage durch das Darmepithel zu emulieren. Das übergeordnete Ziel der in diesem Manuskript vorgestellten Methoden ist es, die Fähigkeit von neonatalen E. coli-Isolaten zu vergleichen, das Darmepithel zu transzytieren. Das hier beschriebene Modell verwendet T84-Zellen, die immortalisierte humane intestinale Adenokarzinomzellen 6,7 sind. T84-Zellen werden auf einer semipermeablen Membran mit zwei getrennten Kompartimenten zum Zusammenfluss gezüchtet. Der Grund für die Anwendung dieser Technik ist, dass diese Darmzellen, wie in vivo geschehen, polarisieren und reife Tight Junctions entwickeln 6,8. Die Seite, die mit der Membran in Kontakt kommt, wird zur basalen Seite. Die gegenüberliegende Seite der Zellen wird zur apikalen Seite und ähnelt dem Darmlumen, wo aufgenommene Krankheitserreger haften und eindringen. Die Transwell-Membran ist durchlässig für Bakterien, aber die polarisierten Darmzellen bilden enge Verbindungen, die die bakterielle parazelluläre Bewegung beeinträchtigen9. Somit bietet diese Methode den Vorteil einer kontrollierten In-vitro-Umgebung, in der eine menschliche Zelllinie verwendet wird, um den Prozess der bakteriellen Transzytose, einschließlich des transzellulären Weges, zu untersuchen. Während es andere Methoden gibt, um die Transzytose von Bakterien über das Darmepithel zu untersuchen, bietet die hier vorgestellte Transwell-Methode eine größere Leichtigkeit und Zugänglichkeit. Es stehen alternative Techniken zur Verfügung, z. B. unter Verwendung von Ex-vivo-Proben, die in Ussing-Kammersystemen eingerichtet wurden. Sie verwenden jedoch Gewebeproben, die möglicherweise nicht leicht zugänglich sind, insbesondere wenn die Forschung beabsichtigt, die menschliche Physiologie zu untersuchen10. Intestinale Organoide stellen ein weiteres Beispiel für eine In-vitro-Alternative zur Untersuchung von Wirt-Bakterien-Interaktionen dar11. Während organoide Monoschichten auch im Transwell-System verwendet werden können, um bakterielle Transzytose zu untersuchen, erfordern sie die Isolierung und das Wachstum von Stammzellen und die Verwendung spezifischer Wachstumsfaktoren, um die Differenzierung zu induzieren12. Daher ist ihre Verwendung zeitaufwendiger und mit höheren Kosten verbunden als die in diesem Manuskript beschriebene Transwell-Methode.
Die Beurteilung der bakteriellen Passage durch das Darmepithel mit diesem In-vitro-Transwell-System wurde erfolgreich für verschiedene Krankheitserreger durchgeführt. Diese Studien haben den Nutzen des Transwell-Systems unter Verwendung von T84-Zellen gezeigt, um die Transzytose von Bakterien über das polarisierte Darmepithel zu charakterisieren13,14,15. Die Anwendung dieser Transwell-Methode zum Vergleich der Transzytosefähigkeit von Bakteriämie erzeugenden neonatalen E. coli-Stämmen wurde jedoch nicht detailliert beschrieben. Dieses Manuskript bietet anderen Forschern ein Standard-Transwell-Protokoll, das zuverlässig und einfach zu bedienen ist und keine zu teuren Ressourcen erfordert.
Um die Fähigkeit neonataler invasiver E. coli-Stämme zur Transzytose des Darmepithels zu vergleichen, kann die apikale Seite der intestinalen Epithelmonoschicht mit einer bekannten Anzahl von Bakterienzellen infiziert werden. Nach der Inkubation kann das Medium auf der basalen Seite des Epithels gesammelt und die Bakterien quantifiziert werden, um die Menge der bakteriellen Transzytose im Laufe der Zeit zu bestimmen. In diesem Manuskript werden die vorgestellten Methoden verwendet, um die Transzytosefähigkeit von klinischen E. coli-Stämmen von Neugeborenen zu untersuchen, die von Neugeborenen mit Bakteriämie hospitalisiert wurden. Die Einschlusskriterien für die Auswahl dieser neonatalen klinischen Isolate für Transzytosestudien wurden bereits veröffentlicht 1,2,16. Wenn diese Methode mit verschiedenen E. coli-Stämmen durchgeführt wird, können ihre Transzytosefähigkeiten verglichen werden. Durch diesen Prozess liefert das intestinale Transzytosemodell wertvolle Daten zur Charakterisierung der Virulenzfaktoren von E. coli, die zu dem mehrstufigen Prozess beitragen, der in der Entwicklung einer neonatalen Bakteriämie gipfelt.
Protokoll
HINWEIS: Führen Sie alle Manipulationen der T84-Zellen, Bakterien, Platten und Reagenzien in einer Sicherheitswerkbank der Biosicherheitsstufe 2 (BSL-2) durch, um eine Kontamination zu vermeiden. Verwenden Sie separate Bereiche und Inkubatoren für alle Arbeiten mit sterilen T84-Zellen, infizierten T84-Zellen und E. coli. Die klinischen E. coli-Isolate, die mit den hier beschriebenen Methoden getestet wurden, wurden nach den Richtlinien des Institutional Review Board an unserer Institution 1,16 gewonnen.
1. Herstellung von Transzytose-Inserts mit T84-Zellen (ca. 1-2 Wochen vor dem Experiment)
- Züchten Sie American Type Culture Collection (ATCC) T84-Zellen in Gewebekulturmedium (TCM + Antibiotika), bestehend aus Dulbeccos modifiziertem Adlermedium: Hams F-12-Nährstoffmischung (1:1, Endkonzentration: jeweils 50%), 5% fötalem Rinderserum und 1% (100 U/ml) Penicillin / Streptomycin-Dual-Antibiotika-Mischung. Die Zellen bei 37 °C mit 5%CO2 inkubieren.
HINWEIS: Eine Variation dieser Mediumformulierung ohne Penicillin/Streptomycin (TCM ohne Antibiotika) wird für die späteren Schritte (Abschnitt 2 und weiter) des Verfahrens verwendet. Stellen Sie sicher, dass für jeden Schritt die richtige Formulierung verwendet wird. - In einer Biosicherheitswerkbank (BSC) werden die T84-Zellen in Polyethylenterephthalat-Membran-Zellkultur-Transwell-Einsätze mit 3 μm-Poren für 24-Well-Platten ausgesät. Fügen Sie Transwell-Insert-Replikate für jede gewünschte Versuchsbedingung sowie nicht infizierte Kontrollen hinzu, um mögliche Kontaminationen zu überwachen.
- Füllen Sie in einer 24-Well-Platte zur Aufnahme von Transwell-Einsätzen die gewünschte Anzahl von Sammelmulden mit 1 ml TCM + Antibiotika.
- Legen Sie in jede Vertiefung einen Transwell-Einsatz.
- Säen Sie diese Einsätze mit 1 x 105 T84-Zellen, die in 500 μL TCM + Antibiotika suspendiert sind. Quantifizieren Sie die Anzahl der Zellen mit einem Hämozytometer mit Trypanblaufärbung oder einem automatisierten Zellzähler17.
- Inkubieren Sie die Transwell-Platten mit den gesäten Einsätzen unter den gleichen Bedingungen, unter denen die Zellen gezüchtet wurden.
- Mit Lichtmikroskopie wird überprüft, ob die Monoschichten nach der Aussaat des Einsatzes, etwa 48 Stunden nach der Aussaat, zu konfluieren begonnen haben.
- Messen und notieren Sie alle 2 Tage nach der Aussaat den transepithelialen elektrischen Widerstand (TEER) mit einem epithelialen Volt/Ohm-Messgerät (EVOM), um den Reifegrad der Monoschicht zu beurteilen. Sobald die Einsätze einen TEER von mindestens 1.000 Ω·cm2 erreichen, gelten sie als bereit für den Assay18.
HINWEIS: Die Einsätze benötigen in der Regel 7-10 Tage, um diesen TEER nach der Aussaat zu erreichen. Die T84-Zellen zeigen unter Lichtmikroskopie eine 100%ige Konfluenz, sobald dieser Widerstand erreicht ist.- Lagern Sie die EVOM Sonde mit den Elektroden in 0,15 M KCl getaucht, wenn sie nicht verwendet wird.
- Vor der Messung des TEER dekontaminieren Sie die Elektrodensonde, indem Sie sie 10-15 Minuten lang in ein konisches 50-ml-Röhrchen mit 70 % Ethanol eintauchen. Entfernen Sie die Sonde, schütteln Sie das überschüssige Ethanol ab und lassen Sie es 10 Minuten lang im BSC an der Luft trocknen. Behalten Sie die Röhre mit Ethanol bei.
- Testen Sie das EVOM und die Sonde, indem Sie die trockene dekontaminierte Sonde in eine sterile Vertiefung mit 1 ml TCM + Antibiotika mit einem sterilen Einsatz im Inneren mit 500 μl TCM + Antibiotika legen. Stellen Sie sicher, dass der VOM Messwert <200 Ω beträgt. Notieren Sie diesen leeren Wert, um ihn in den späteren Widerstandsberechnungen zu verwenden, die in Schritt 1.3.6 beschrieben werden.
- Entfernen Sie die Sonde aus dem Röhrchen TCM + Antibiotika. Bewahren Sie dieses Röhrchen für die Aufbewahrung der Sonde während des gesamten Experiments auf.
- Senken Sie die Sonde vorsichtig in den ersten Einsatz mit der langen Elektrode in der Auffangmulde und der kurzen Elektrode im Inneren des Einsatzes. Lassen Sie die lange Elektrode den Boden der Sammelmulde berühren, aber drücken Sie nicht nach unten, da dies die epitheliale Monoschicht stören kann.
- Wiederholen Sie diesen Vorgang, um den Widerstand in Ohm (Ω) für jeden Einsatz zu messen und aufzuzeichnen. Wenn Sie fertig sind, dekontaminieren Sie die Sonde im Ethanol, indem Sie sie für weitere 10-15 Minuten eintauchen. Bringen Sie dann die dekontaminierte Sonde zur Lagerung zurück in die KCl-Lösung. Der in Schritt 1.3.3 ermittelte Blindwiderstand wird von jedem Wert abgezogen, der von jedem Einsatz mit T84-Zellen erhalten wird. Multiplizieren Sie den resultierenden Widerstand (Ω) für jeden Einsatz mit der Fläche der Unterseite jedes Einsatzes (cm 2), um die endgültige TEER-Messung (Ω·cm2) zu erhalten.
- Sobald das TEER mindestens 1.000 Ω·cm2 erreicht, ist die epitheliale Monoschicht ausgereift und bereit für Infektionstests.
- Wenn das TEER reift, versorgen Sie die Zellen alle 1-2 Tage mit frischem Medium.
- In einer neuen 24-Well-Platte 1 ml TCM + Antibiotika zu einer Vertiefung für jede vorbereitete Saateinlage hinzufügen.
- Mit sterilen Pinzetten die Einsätze vorsichtig in die neu aufgefüllten Brunnen geben.
- Ersetzen Sie die Medien in den Einsätzen.
- Entfernen Sie das alte Medium aus den Einsätzen, indem Sie die Platte kippen und mit einem hauseigenen Vakuumsauger das Medium mit einer Pipettenspitze an der Seite des Einsatzes vorsichtig entfernen. Der Absauger ermöglicht die Regulierung der schwachen Saugleistung, um die Störung der Zellen zu verhindern. Lassen Sie die Pipettenspitze nicht die Unterseite des Einsatzes berühren, da dies die sich entwickelnde epitheliale Monoschicht stört.
- Fügen Sie 500 μL TCM + Antibiotika zu den Einsätzen hinzu. Visualisieren Sie die Monoschicht mit Lichtmikroskopie, um zu überprüfen, ob sie intakt bleibt.
- Messen Sie alle 1-2 Tage den TEER an jedem Einsatz, wie oben in den Schritten 1.3.2-1.3.6 beschrieben.
2. Vorbereitung der T84-Zellen 1 Tag vor dem Experiment mit TCM ohne Antibiotika
- Messen und notieren Sie den TEER am Tag vor dem Experiment.
- Ersetzen Sie die TCM auf die gleiche Weise wie bei der vorherigen Zellvorbereitung und -erhaltung. Zur Vorbereitung auf die Infektion wird jedoch TCM ohne Antibiotika eingesetzt (1 ml in der Plattenmulde und 500 μl im Einsatz).
3. E. coli-Kulturen (begonnen 1 Tag vor dem Experiment)
VORSICHT: Verwenden Sie Vorsichtsmaßnahmen der Biosicherheitsstufe 2 (BSL-2), wenn Sie mit pathogenen klinischen E. coli-Stämmen arbeiten.
- Nehmen Sie ein markiertes konisches 15-ml-Röhrchen mit 5 ml steriler Lysogenie-Bouillon (LB) und verwenden Sie eine sterile Schleife, um die Brühe mit einer Kolonie eines Bakterienstamms (E. coli) zu impfen. Wiederholen Sie diesen Vorgang und erstellen Sie ein Übernacht-Kulturröhrchen für jede zu testende Sorte.
- Die Übernachtkultur bei gelösten Deckeln der Röhrchen in einem Inkubatorschüttler (250 U/min, 37 °C) inkubieren.
4. Vorbereitung des E. coli-Inokulums, der Epithelzellen und -materialien (am Morgen des Experiments)
HINWEIS: Verwenden Sie ab diesem Zeitpunkt TCM ohne auf 37 °C erwärmte Antibiotika.
- Fügen Sie 250 μL aus jeder LB-Kultur über Nacht zu 25 ml TCM ohne Antibiotika in einem konischen 50-ml-Röhrchen hinzu (eines pro einzelnen Stamm). Halten Sie die Kappen der Röhrchen gelockert. Legen Sie diese neuen Kulturröhrchen mit den gleichen Einstellungen (250 U/min, 37 °C) für genau 2 h in den Shaker. Führen Sie die verbleibenden Teilschritte aus, während Sie warten.
- Messen Sie den TEER an jedem Einsatz, wie in den Schritten 1.3.2 bis 1.3.6 beschrieben. Notieren Sie diese als TEERs zum Zeitpunkt (t) = 0 h.
- Bewegen Sie die Einsätze in Vertiefungen in einer neuen Platte und wechseln Sie das Medium mit der in Schritt 1.4.3 beschriebenen Technik. Füllen Sie dieses Mal die neuen Auffangbrunnen mit 500 μL TCM ohne Antibiotika und füllen Sie die Einsätze mit 400 μL TCM ohne Antibiotika. Bewahren Sie die Einsätze bis zum Zeitpunkt der Infektion im Gewebekulturinkubator auf.
- Legen Sie eine ausreichende Anzahl von quadratischen LB-Agarplatten vor, um sich für eine spätere Beschichtung und bakterielle Quantifizierung auf Raumtemperatur (RT) zu erwärmen.
5. Impfung der Zellen (Beginn des Experiments)
- Nach genau 2 h die morgendlichen Bakterienkulturen aus dem Shaker nehmen und 10 min (1.900 x g, 4 °C) zentrifugieren.
HINWEIS: Halten Sie für alle folgenden Schritte alle Bakteriensuspensionen auf Eis, um das Wachstum zu minimieren. - Resuspendieren Sie das Bakterienpellet in TCM ohne Antibiotika. Verwenden Sie ein Spektralphotometer, um die optische Dichte (OD) auf 0,7-0,9 einzustellen, und verdünnen Sie sie weiter mit TCM ohne Antibiotika auf eine Konzentration von 1 x 106 koloniebildenden Einheiten (KBE)/ml (ca. 1:100 Verdünnung). Verwenden Sie diese Bakteriensuspension, um jeden Einsatz mit 1 x 105 KBE pro 100 μL Volumen zu infizieren.
- Beschriften Sie die Transwell-Platte und infizieren Sie jeden Einsatz mit 100 μL des OD-adjustierten Inokulums (insgesamt 1 x 105 KBE pro Einsatz). Der Test hat nun begonnen. Notieren Sie sich die Uhrzeit und notieren Sie sie als t = 0 h.
- Zur Quantifizierung der KBE/ml unter Verwendung der Spurverdünnungsmethode wird die Inokulumbakteriensuspension plattiert, wobei 10 μL-Aliquots auf quadratische LB-Agarplattenplattiert werden 19.
6. Quantifizierung der Transzytose
- Füllen Sie alle 30 Minuten nach der Impfung neue Vertiefungen mit 500 μL TCM ohne Antibiotika. Übertragen Sie die Einsätze in diese neuen Vertiefungen mit einer anderen sterilen Pinzette für jeden Bakterienstamm.
- Sammeln Sie das Medium aus der gebrauchten Auffangmulde für jeden Einsatz in separat beschrifteten Röhrchen. Legen Sie diese Röhrchen auf Eis. Geben Sie die Transwell-Platten zwischen den Zeitpunkten in den Inkubator zurück.
- Kombinieren Sie für jede Einlage die gesammelten Medien aus t = 0,5 h, t = 1 h, t = 1,5 h und t = 2 h und Wirbel kurz. Die gesammelten Medien werden auf LB-Agarplatten unter Verwendung der Track-Verdünnungsmethode beschichtet, um die Menge der in den ersten 2 h des Experiments transzytosierten Bakterien zu quantifizieren.
HINWEIS: Wenn die Bakterien alle 30 Minuten entnommen und auf Eis gehalten werden, wird sichergestellt, dass das Bakterienwachstum in den Auffangbrunnen minimiert wird und Messungen an überwiegend transzytosierten Bakterien durchgeführt werden. - Legen Sie die markierten LB-Agarplatten zur Spurverdünnung in den Bakterieninkubator bei 37 °C ohne zusätzlichesCO2 und bringen Sie die T84-Transwell-Platte in den Gewebekulturinkubator zurück.
- Bei t = 4 h wiederholen Sie Schritt 6.3, indem Sie die gesammelten Medien aus t = 2,5 h, t = 3 h, t = 3,5 h und t = 4 h kombinieren.
- Bei t = 6 h wiederholen Sie Schritt 6.3, indem Sie die gesammelten Medien aus t = 4,5 h, t = 5 h, t = 5,5 h und t = 6 h kombinieren. Zusätzlich werden bei t = 6 h die Medien aus den Kontrolltöpfen plattiert.
7. Ende des Experiments
- Messung und Aufzeichnung des TEER am Ende des Experiments, t = 6 h. Verwenden Sie das in den Schritten 1.3.2-1.3.6 beschriebene Verfahren.
- Dekontamination der Sonde, indem Sie sie für 10-15 min in 70% Ethanol tauchen. Entsorgen Sie die Einsätze oder speichern Sie sie für weitere Anwendungen, falls gewünscht. Lassen Sie die LB-Agarplatten über Nacht inkubieren und desinfizieren und/oder entsorgen Sie alle anderen verwendeten Materialien.
- Nach der Inkubation über Nacht werden die Bakterienkolonien manuell auf den LB-Platten der Spurverdünnung gezählt, um die Inokulummenge und die Menge an E. coli-Transzytose zu bestimmen. Stellen Sie sicher, dass die Kontrollplatten kein Bakterienwachstum aufweisen.
Ergebnisse
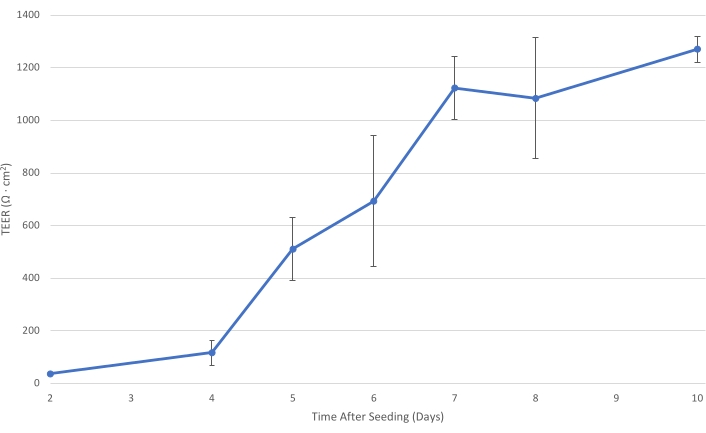
Abbildung 1: T84 TEER im Zeitverlauf. Wenn die T84-Zellschicht auf dem Einsatz reift, steigt der elektrische Widerstand der Monoschicht. Bei einem TEER von mindestens 1.000 Ω·cm2 ist die Zellschicht ausreichend entwickelt, um den parazellulären Bakterientransport zu verringern und die Messung des primär transzellulären Bakterientransits zu ermöglichen. Die Fehlerbalken zeigen die Standardabweichung an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Während der Proliferation der in Abschnitt 1 beschriebenen sterilen T84-Zellen steigen die TEERs über die T84-Monoschichten im Laufe der Zeit kontinuierlich an und überschreiten etwa 7 Tage nach der Aussaat 1.000 Ω·cm2 (siehe Abbildung 1). Obwohl die epitheliale Zellpolarisation und die Reifung des TEER mit T84-Zellen robuster sind als mit anderen Darmzellen, wie z.B. Caco-2, kann es sein, dass noch einige Fehlersuche erforderlich ist6. Der TEER eines Einsatzes sollte zwischen den Messungen nicht dramatisch abnehmen. Ein solcher Rückgang des TEER könnte auf einen mechanischen Aufbruch der epithelialen Monoschicht hindeuten. Es sollte darauf geachtet werden, dass während des Mediumwechsels die Spitze des Absauggeräts niemals den Boden des Zellkultureinsatzes berührt. Wenn diese Art von Schädigung vermutet wird, kann sie durch Lichtmikroskopie als Abwesenheit von Epithelzellen in der Nähe des Ortes der Aspiration sichtbar gemacht werden. Neben Schäden durch die Handhabung kann eine Abnahme des TEER auf eine Kontamination hindeuten.

Abbildung 2: Transzytose von neonatalen E. coli-Isolaten im Zeitverlauf. Nach der Infektion der T84-Einsätze werden klinische E. coli-Isolate für Neugeborene, die erfolgreich die Sammelbohrung erreichen, mit der Track-Verdünnungsmethode quantifiziert. Verschiedene E. coli-Stämme können hinsichtlich ihrer Fähigkeit zur Transzytose des Darmepithels verglichen werden. Das nicht-pathogene E. coli DH5 alpha wurde als Vergleichsgröße einbezogen. Die Diagramme zeigen die mittleren KBE- und Standardfehler zu jedem Zeitpunkt. Die Vergleiche der mittleren Transzytosewerte wurden mit einseitigen t-Tests durchgeführt, die signifikante Unterschiede zwischen den neonatalen E. coli-Isolaten #1 und #2 bei 2 h (*p < 0,05), 4 h (**p < 0,04) und 6 h (***p < 0,04) nach der Infektion zeigten. Im Gegensatz dazu erfuhr der nichtpathogene E. coli-Stamm DH5 alpha eine minimale Transzytose, wie in der dritten Grafik gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die quantifizierte Transzytose kann wie in Abbildung 2 dargestellt dargestellt werden. In diesem Beispiel wurden die Experimente mit drei Einsätzen durchgeführt, die jeweils mit zwei verschiedenen neonatalen invasiven E. coli-Isolaten infiziert waren . Ein nicht-pathogener Stamm, DH5 alpha, wurde ebenfalls zum Vergleich getestet. Zwei sterile Kontrolleinsätze wurden ebenfalls eingeschlossen (kein Diagramm ist dargestellt, da keine Bakterien isoliert wurden). Die Daten aus diesem Verfahren sind nützlich, um die Fähigkeit eines einzelnen E. coli-Stammes zu beschreiben, das Darmepithel zu transzytieren . Die Daten können auch einen Vergleich der Transzytosefähigkeiten verschiedener Stämme ermöglichen (siehe den Diskussionsabschnitt für weitere Anwendungen).

Abbildung 3: TEER unmittelbar vor der Infektion und 6 h nach der Infektion. Der TEER der Einsätze steigt typischerweise nach einer Infektion mit neonatalen E. coli-Bakteriämie-produzierenden Stämmenan 2. Die infizierten Beilagen zeigen einen stärkeren Anstieg der TEER als die nicht infizierten Kontrollbeilagen. Der TEER war in T84-Monoschichten nach 6 Stunden Infektion mit neonatalem E. coli-Stamm #1 (*p < 0,01) und E. coli-Stamm #2 (**p < 0,03) signifikant größer, wie durch t-Tests berechnet. Die TEER in den nicht infizierten T84-Monoschichten der Kontrolle nahm ebenfalls zu, aber die Differenz zwischen den Werten vor und nach der Infektion war statistisch nicht signifikant. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 3 zeigt typische TEER-Ergebnisse vor und nach der Infektion mit zwei neonatalen klinischen E . coli-Isolaten mit unterschiedlichen Fähigkeiten, intestinale Epithelzellen zu transzytieren. Die Rate und das Ausmaß der Transzytose variieren zwischen den Stämmen, wie in Abbildung 2 gezeigt, aber die TEER steigt nach einer Infektion mit beiden pathogenen Stämmen signifikant an.
Die Ergebnisse können in Gegenwart einer Kontamination in diesem Experiment verändert werden. Die verwendeten neonatalen E . coli-Stämme verursachten keine ausreichende Schädigung der epithelialen Monoschicht, um eine Abnahme des TEER zu bewirken, aber die Bakterien konnten transzytieren. Es ist plausibel, dass ein kontaminierender Organismus, falls vorhanden, eine Schädigung der Darmzellen und eine anschließende Abnahme des TEER verursachen könnte. Die sterilen Kontrolleinsätze dienen dazu, solche möglichen Kontaminationen zu erkennen. Das in diesem Verfahren verwendete Gewebekulturmedium enthält den phenolroten pH-Indikator. Im Allgemeinen erscheint das Medium ein klares Rosa, wenn es steril oder mit einem kleinen Inokulum infiziert ist. Bei starkem Wachstum oder Verunreinigung kann das Medium trüb, gelb oder übelriechend werden. Vor der Infektion erscheinen die Medien in allen T84-Einsätzen normalerweise klar rosa.
Nach der Inkubation über Nacht befindet sich der letzte Ort, an dem auf Kontamination geprüft werden kann, auf den LB-Agarplatten. Die Kontrollplatten sollten kein Wachstum zeigen. Die Platten aus den Sammeltöpfen von E. coli-infizierten Einsätzen sollten homogene, runde, gelbe E. coli-Kolonien enthalten. Um das Risiko einer Kontamination zu minimieren, sollten alle Arbeiten in Biosicherheitswerkbänken durchgeführt werden. Separate Schränke und Inkubatoren sollten für die sterile Gewebekultur, die Kultivierung von E. coli-infiziertem Gewebe und die bakterielle Manipulation verwendet werden. Die Arbeitsbereiche sollten sauber gehalten werden, und es sollte durchgehend eine sterile Technik verwendet werden.
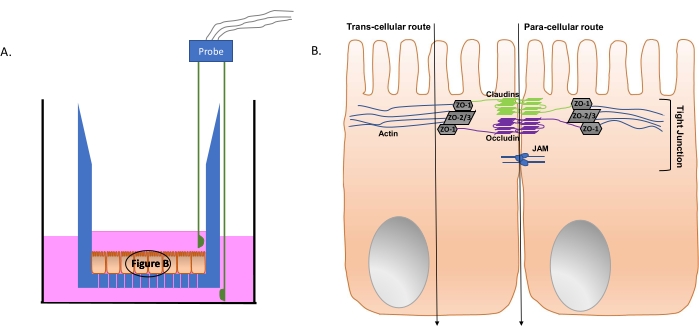
Abbildung 4: Schematische Darstellung des Transwell-Systems und relevanter Darmzellstrukturen. (A) Schnittansicht des Transwell-Einsatzes (blau); Die vertikalen Linien am unteren Rand des Einsatzes zeigen die durchlässigen Poren an. Die polarisierten intestinalen Epithelzellen bilden eine Monoschicht an der Unterseite des Einsatzes. Das Gewebekulturmedium ist rosa dargestellt, in das eine zweizackige EDAM-Sonde eingetaucht ist. Die Sondendrähte auf der gegenüberliegenden Seite sind mit der EDAM-Apparatur (nicht abgebildet) verbunden. (B) Vereinfachtes Diagramm der Tight-Junction-Komponenten von intestinalen Epithelzellen. Die vertikalen Pfeile stellen mögliche Wege der bakteriellen Passage von der apikalen zur basolateralen Seite der polarisierten intestinalen Epithelmonoschicht dar. Abkürzungen: ZO = zona occludens proteins; JAM = junctionale Adhäsionsmoleküle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Apikales Wachstum von neonatalen E . coli-Isolaten über die Zeit. Messungen von E. coli in Überständen, die T84-Zellen in Transwell-Inserts überlagern, können als optionaler, zusätzlicher Endpunkt durchgeführt werden. Die Abbildung zeigt, dass sich das apikale Wachstum beider pathogener E. coli-Stämme , die auf Transzytose getestet wurden, im Laufe der Zeit nicht signifikant unterschied. Die Fehlerbalken zeigen Standardabweichungen an. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Diese Methode leitet sich von Techniken ab, die in der Gastroenterologie und bei Infektionskrankheitenverwendet werden 20. In-vitro-Modelle der intestinalen Epithelbarriere wurden verwendet, um die Mechanismen aufzuklären, durch die die luminalen Gehalte mit dieser relevanten Komponente der angeborenen Immunität interagieren 6,8. Die Wirt-Pathogen-Interaktionen von invasiven neonatalen E. coli wurden auch separat durch genetische Analysen, Studien zur Antibiotikaresistenz und immunologische Techniken charakterisiert 1,5,16,21. Es ist jedoch wenig über die molekularen Mechanismen bekannt, die der Fähigkeit von E. coli-Neugeborenenisolaten zugrunde liegen, durch den Darm in den Blutkreislauf zu gelangen3.
Die hier gezeigte Transzytose-Technik ermöglicht eine detailliertere Charakterisierung der neonatalen E. coli-Stämme, die nach enteralem Erwerb eine Sepsis hervorrufen. Die neonatale Bakteriämie ist ein mehrstufiger Prozess, und die Transzytose ist einer der relevanten Schritte. Im Vergleich zu Invasionsmodellen bietet diese Transzytose-Methode zusätzliche Informationen über die Mechanismen, die an der Pathogenese der Bakteriämie beteiligt sind. In einigen Fällen dringen pathogene E. coli in den Dünndarm ein, ohne den Blutkreislauf zu erreichen, wodurch die Infektion auf die Verursachung einer lokalisierten Erkrankung beschränktwird 22. Daher spiegelt die Fähigkeit der Bakterien, einfach in das Darmepithel einzudringen, möglicherweise nicht ihre Fähigkeit wider, die Epithelbarriere vollständig zu passieren. Dieses Modell kann verwendet werden, um den Prozess der bakteriellen Passage durch das Darmepithel durch die transzellulären oder parazellulären Wege zu untersuchen, insbesondere wenn zusätzliche Techniken wie Elektronenmikroskopie integriert werden20. Im Vergleich zu In-vivo-Tiermodellen ist dieses In-vitro-Modell effizienter und ermöglicht eine bessere Kontrolle mehrerer potenzieller Variablen. Darüber hinaus trägt es zum Tierschutz bei, indem es eine Alternative zu In-vivo-Experimenten bietet.
Trotz dieser Vorteile hat dieses Experiment immer noch seine Grenzen. Zum einen berücksichtigt dieser Assay keine Unterschiede im Bakterienwachstum auf der apikalen Seite des Epithels während der Inkubation. Solche Wachstumsunterschiede können die Menge der Transzytose für jeden Stamm beeinflussen. Benutzer können sich dafür entscheiden, apikales Wachstum zu messen, um eine umfassendere Charakterisierung der mit diesem Modell erzielten Ergebnisse zu erhalten. Ein Beispiel für das apikale Wachstum der beiden E. coli-Isolate, die für die Transzytose-Experimente in den in diesem Manuskript vorgestellten Methoden verwendet wurden, ist in der ergänzenden Abbildung 1 dargestellt. Obwohl dieses Modell die intestinale Epithelmonoschicht sinnvoll nachbildet, repräsentiert es nicht vollständig alle Komponenten der Darmbarriere, die den Blutkreislauf vor aufgenommenen Krankheitserregern schützt. Dennoch können einige Eigenschaften des Darmepithels mit diesem Modell untersucht werden. Zum Beispiel sezernieren T84-Zellen Chlorid und produzieren Mucin23. Die Invasion durch Durchfall erzeugende E. coli ist mit einer erhöhten Chloridsekretion in T84-Zellen und einer signifikanten Abnahme der TEER über 6 h nach der Infektion hinaus assoziiert24. Es ist möglich, dass die Invasion durch bakteriämieproduzierende E. coli-Stämme in diesem Modell auch die Chloridsekretion erhöht und dass nach 6 h Infektion eine Abnahme des TEER auftreten kann. Dieses Modell kann für Studien über den Zusammenhang zwischen Ionentransport und bakterieller Invasion angepasst werden, wenn dies von anderen Forschern gewünscht wird. Mucin ist eine physikalische Barriere, die das Epithel vor Krankheitserregern schützt. Eine Infektion mit anderen E. coli-Stämmen verringert die Mucinexpression durch T84-Zellen25. Die Rolle von Mucin in der Pathogenese der neonatalen E. coli-Transzytose über das Darmepithel kann ebenfalls mit diesem Modell untersucht werden. Eine weitere Anwendung dieses Modells könnte darin bestehen, die zytotoxischen Wirkungen von bakteriellen Cyclomodulinen und ihre mögliche Rolle im Prozess der Transzytose von neonatalen E. coli-Stämmen zu untersuchen. Zum Beispiel zielt der zytotoxische nekrotisierende Faktor-1 (CNF-1), der von einigen pathogenen E. coli-Stämmen produziert wird, auf Rho-GTPasen ab, die für die Regulierung der Tight-Junction-Funktion und Apoptose infizierter eukaryotischer Zellen entscheidend sind26. Dieses Transwell-Modell kann angepasst werden, um die Mechanismen besser zu verstehen, durch die diese Zytotoxine das Darmepithelbeeinflussen 27. Bei der Verwendung dieses Modells zur Untersuchung der Interaktion von neonatalen E. coli-Stämmen mit dem Darmepithel ist es wichtig zu berücksichtigen, dass die T84-Zellen, die zur Modellierung des Darmepithels verwendet werden, aus einer Lungenmetastase des Kolonadenokarzinoms bei einem Erwachsenen stammen6. Während Studien an T84-Zellen spezifische Wirkungen auf die intestinale Permeabilität reproduziert haben, die sich in menschlichen neugeborenen und neonatalen tierischen Darmzellen niedergeschlagen haben28,29, können sich das fetale und neonatale Darmepithel in Gegenwart von invasiven E. coli unterschiedlich verhalten.
Möglicherweise sind einige Fehlerbehebungen erforderlich, um dieses Modell und die Qualität der bereitgestellten Daten zu optimieren. Der Einsatz steriler Kontrolleinsätze wird im repräsentativen Ergebnisteil ausführlich besprochen. Andere nichtinvasive E . coli-Stämme können ebenfalls als negative/minimale Transzyktose-Kontrollen einbezogen werden. Darüber hinaus kann eine andere Zelllinie, wie Caco-2, verwendet werden, um die Fähigkeit der neonatalen E. coli-Stämme zu beurteilen, polarisiertes Darmepithel zu transzytieren . Es wurde festgestellt, dass die Invasion und Transzytose von E. coli für T84-Zellen größer ist als für Caco-2-Zellen30. Daher müssen diese Unterschiede berücksichtigt werden, wenn dieses Modell verwendet wird, um die bakterielle Transzytose mit diesen und anderen Epithelzellen zu bewerten, die polarisieren und enge Verbindungen bilden. Die Durchführung von TEER-Messungen an jedem einzelnen Transwell-Einsatz dauert mehrere Sekunden, und wenn mehrere Stämme getestet werden, muss die zusätzliche Bedienerzeit berücksichtigt werden. Effizientere Methoden zur Überwachung des TEER in Transwell-Systemen werden weiter entwickelt. Diese neueren Geräte ermöglichen die gleichzeitige Überwachung des TEER in mehreren Transwell-Einsätzen und in Echtzeit31. Forscher, die diese Optionen in Betracht ziehen, müssten entscheiden, ob die Zeitersparnis den gestiegenen Preis dieser neueren Geräte im Vergleich zu den hier beschriebenen Einzelelektrodenmessungen möglicherweise ausgleichen könnte.
Trotz einiger möglicher Herausforderungen ermöglicht dieser Assay den Forschern, spezifische Mechanismen zu untersuchen, die an der Pathogenese der E. coli-Bakteriämie beteiligt sind, die über die Transzytose hinausgehen . In Kombination mit molekularmikrobiologischen Techniken kann dieser Prozess verwendet werden, um die Auswirkungen einzelner Gene auf die Fähigkeit von E. coli , das Darmepithel zu transzytieren, zu bestimmen, wie es in Tiermodellen versucht wurde32. Dieses Modell kann auch durch Kokulturierung von Immunzellen oder die Zugabe von Zytokinen, Wachstumsfaktoren und pharmazeutischen Interventionen modifiziert werden, um komplexere Immun- und pharmakodynamische Reaktionen zu simulieren33.
Offenlegungen
Nichts.
Danksagungen
Diese Arbeit wurde durch ein Sarah Morrison Studentenstipendium unterstützt, das von der University of Missouri-Kansas City School of Medicine an A.I.
Materialien
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
Referenzen
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032 (2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593 (2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018 (2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330 (2021).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314 (2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60 (2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321 (2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119 (2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344 (2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2 (2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352 (2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994 (2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208 (2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282 (2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698 (2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten