Method Article
Generación de un modelo reproducible de activación inmune materna a mediados de la gestación utilizando Poly(I: C) para estudiar la susceptibilidad y la resiliencia en la descendencia
En este artículo
Resumen
La infección materna es un factor de riesgo para los trastornos del desarrollo neurológico. Los modelos de ratón de activación inmune materna (MIA) pueden dilucidar el impacto de la infección en el desarrollo y la función del cerebro. Aquí, se proporcionan pautas generales y un procedimiento para producir crías confiablemente resistentes y susceptibles expuestas a MIA.
Resumen
La activación inmune materna (MIA) durante el embarazo está constantemente relacionada con un mayor riesgo de trastornos del desarrollo neurológico y neuropsiquiátricos en la descendencia. Los modelos animales de MIA se utilizan para probar la causalidad, investigar mecanismos y desarrollar diagnósticos y tratamientos para estos trastornos. A pesar de su uso generalizado, muchos modelos MIA sufren de una falta de reproducibilidad y casi todos ignoran dos aspectos importantes de este factor de riesgo: (i) muchos descendientes son resistentes a MIA, y (ii) los descendientes susceptibles pueden exhibir distintas combinaciones de fenotipos. Para aumentar la reproducibilidad y modelar tanto la susceptibilidad como la resistencia a la MIA, la inmunorreactividad basal (BIR) de ratones hembra antes del embarazo se utiliza para predecir qué embarazos darán lugar a una descendencia resistente o descendencia con anomalías moleculares y de comportamiento definidas después de la exposición a la MIA. Aquí, se proporciona un método detallado para inducir MIA a través de la inyección intraperitoneal (i.p.) del poli (I: C) imitador viral de ARN bicatenario (dsRNA) a los 12,5 días de gestación. Este método induce una respuesta inflamatoria aguda en la madre, lo que resulta en perturbaciones en el desarrollo del cerebro en ratones que se asignan a dominios impactados de manera similar en los trastornos psiquiátricos y del neurodesarrollo humano (NDD).
Introducción
La evidencia epidemiológica vincula la infección materna con un mayor riesgo de NDD psiquiátrica, incluida la esquizofrenia (SZ) y el trastorno del espectro autista (TEA)1,2,3,4,5,6,7. El modelo de ratón MIA fue desarrollado para probar la causalidad y el papel mecanicista de MIA en la etiología de estos trastornos, así como para identificar biomarcadores moleculares y desarrollar herramientas diagnósticas y terapéuticas 4,6. A pesar de la utilidad de este modelo y su creciente popularidad, existe una variabilidad considerable en los protocolos de inducción de MIA dentro del campo, lo que dificulta la comparación de los resultados entre los estudios y la replicación de los hallazgos 8,9. Además, la mayoría de las iteraciones del modelo no investigan dos aspectos traslacionales importantes de la MIA: (i) muchos descendientes son resistentes a la MIA, y (ii) los descendientes susceptibles pueden exhibir distintas combinaciones de fenotipos8.
Para generar un modelo de MIA reproducible, los investigadores deben informar al menos una medida cuantitativa de la magnitud de MIA inducida en presas. Para inducir MIA durante la gestación, nuestro laboratorio realiza inyecciones intraperitoneales (i.p.) del poliinositítico imitador viral de ARN bicatenario: ácido policitidílico [poli(I:C)]. Poly(I:C) induce una cascada inmune similar a los virus de la influenza, ya que es reconocido por el receptor tipo toll 3 (TLR3)10. Como resultado, poli(I:C) activa la respuesta de fase aguda que resulta en una rápida elevación de citoquinas proinflamatorias 8,11,12. Estudios previos han demostrado que la elevación de citoquinas proinflamatorias, incluyendo la interleucina-6 (IL-6), es necesaria para producir anomalías conductuales y neuropatología en la descendencia como resultado de MIA11,12,13. Por lo tanto, el nivel de IL-6 en el suero materno recolectado durante su pico a las 2,5 h después de la inyección de poli(I: C) es una medida cuantitativa convincente de MIA que se puede utilizar para comparar los resultados entre laboratorios dentro del campo.
Con el fin de generar un modelo MIA que aborde los elementos traslacionalmente esenciales de resiliencia y susceptibilidad con un solo protocolo de inducción 8,14, los investigadores pueden combinar enfoques típicos de inducción con la caracterización de la inmunorreactividad basal (BIR) de la madre antes del embarazo8. Recientemente, se descubrió que los ratones hembra vírgenes C57BL / 6 muestran una amplia gama de respuestas IL-6 a una exposición a dosis bajas a poli(I: C) antes del embarazo8. Es sólo un subconjunto de estas hembras que llegan a producir descendencia susceptible, y sólo a ciertas magnitudes de activación inmune según lo dictado por la combinación de BIR y poli(I:C) dosis8. MIA induce fenotipos en un patrón de U invertida; La descendencia muestra las mayores aberraciones conductuales y moleculares cuando las madres son moderadamente inmunorreactivas, y la magnitud de la inflamación materna alcanza, pero no supera, un rango crítico8. Aquí, se proporciona un método detallado de cómo crear de manera confiable descendientes resistentes y susceptibles con fenotipos conductuales divergentes como resultado de la inyección gestacional media de poli (I: C).
Protocolo
Todos los protocolos se realizan bajo la aprobación del Comité Institucional de Cuidado y Uso de Animales de la Universidad de California-Davis (IACUC).
1. Preparación de animales
- Al adquirir animales, mantenga los siguientes parámetros consistentes para garantizar la máxima reproducibilidad.
- Ubicación del proveedor y del proveedor: como se informó anteriormente, los ratones salvajes tipo C57BL / 6J exhiben diferentes respuestas a la misma dosis de poli (I: C) dependiendo del proveedor8. Elija un proveedor y una cepa de ratón que muestren una respuesta consistente. Para los experimentos aquí, los ratones C57BL / 6 obtenidos de Charles River exhibieron cambios consistentes en el comportamiento después de la exposición a MIA gestacional media, mientras que los comprados a Taconic muestran una respuesta de mayor magnitud, con algunas diferencias entre los grupos de tratamiento en comparación con los ratones Charles River8.
- Cepa: Los ratones C57BL / 6J son los más utilizados, pero los ratones BTBR y otras cepasmuestran respuestas diferenciales a la MIA 9 gestacional media. Tenga en cuenta estas respuestas diferenciales, ya que mejoran la reproducibilidad del método y pueden ser una variable potencial para contribuir a los resultados diferenciales en la descendencia.
- Para garantizar una variabilidad mínima, use solo hembras vírgenes para los estudios de MIA8 y anote claramente los detalles en los métodos.
- Edad en el momento del embarque y período de aclimatación: los ratones enviados antes de las 7 semanas muestran sistemas endocrinos desregulados15. Dejar que los animales se aclimaten durante un mínimo de 48 h16,17. Ordene que los ratones se envíen a las 7 semanas (± 2 días) e inyecte BIR a las 8 semanas (± 2 días).
- Edad en el momento del apareamiento: el sistema inmunológico de los animales es dinámico a lo largo de su vida. Tenga cuidado de minimizar la variabilidad manteniendo la edad de apareamiento/inyección lo más consistente posible18,19,20. Aparearse ratones hembra a las 9 semanas (± 2 días). No use machos mayores de 6 meses de edad para aparearse.
2. Prueba y preparación de lotes de poli(I:C)
- Prepare poli(I:C) de alto peso molecular como se describe a continuación.
- Tubos de microcentrífuga de autoclave de 1,5 mL para almacenamiento. El poli(I:C) resuspendido se puede almacenar a -20 °C, pero los deshielos por congelación repetidos pueden afectar la potencia. Caliente el baño maría a 70 °C.
- Usando la técnica estéril, agregue 10 ml de solución salina fisiológica estéril (NaCl 0.9%) al poli(I: C) liofilizado usando una jeringa. Calentar al baño maría a 70 °C durante 15 min para permitir el recocido completo. Retirar y dejar enfriar a temperatura ambiente.
- En una campana estéril, agregue 40 ml adicionales de solución salina fisiológica al frasco e invierta varias veces para mezclar. Retire la parte superior del frasco de poli(I:C) o utilice una jeringa para alícuota en tubos de microcentrífuga de 1,5 ml. Conservar a -20 °C.
- Prepare poli(I:C) de peso molecular mixto como se describe a continuación.
- Tubos de microcentrífuga de autoclave de 1,5 mL para almacenamiento. El poli(I:C) resuspendido se puede almacenar a -20 °C, pero los deshielos por congelación repetidos pueden afectar la potencia. Ajuste el baño maría a 50 °C.
- Usando la técnica estéril, agregue 10 ml de NaCl estéril al 0,9% al poli liofilizado (I: C) y asegure la tapa. Calentar al baño maría a 50 °C durante 25 min para permitir el recocido completo. Retirar y dejar enfriar a temperatura ambiente.
- Utilizando la técnica estéril, alícuota en tubos de microcentrífuga de 1,5 ml y almacenar a -20 °C.
- Administrar poli(I:C) a través de inyecciones intraperitoneales (i.p.) como se describe a continuación.
- Pese el ratón para determinar la dosificación exacta. Utilizando una aguja de insulina de 0,5 cc, extraiga poli (I: C) resuspendido. Limpie el ratón y voltee para que el abdomen quede expuesto.
- Con la otra mano, inserte la aguja a una profundidad de aproximadamente 0,5 cm entre los dos pezones anteriores en un ángulo de aproximadamente 45°.
- Elaborar para determinar que no entre sangre ni orina en la jeringa antes de inyectarla. Si ocurre alguna de las dos, vuelva a colocar la aguja e inténtelo de nuevo. Inyecte lentamente. Si el poli(I:C) burbujea, la inyección probablemente fue subcutánea. Una colocación exitosa de la inyección dará como resultado que no se dibuje nada una vez que se inserte la aguja, y no se gotee una vez que se retire.
- Pruebe la potencia del lote de poli (I: C) MMW como se describe a continuación8.
- Obtenga la forma deseada de poli (I: C). Algunos fabricantes permitirán a los investigadores colocar una retención en un lote completo o parcial mientras se prueba la potencia para que se puedan obtener múltiples botellas más tarde simultáneamente. Por lo general, estos pueden almacenarse liofilizados a -20 ° C durante varios años si se evita la congelación-descongelación.
- Obtener o criar 30 madres preñadas para su análisis. En E12.5, realizar inyecciones i.p. de 20, 30 y 40 mg/kg en un mínimo de 10 ratones por dosis.
- A las 2,5 h después de la inyección, recoger la sangre a través de la hemorragia de la cola. Tenga en cuenta que la sangre periférica y la sangre del tronco pueden diferir en los niveles de citoquinas, así que mantenga el método de recolección consistente dentro de un estudio.
- Permita que la sangre se coagule durante la noche a temperatura ambiente. Después de 12-24 h, centrifugar las muestras de sangre a 3.768 x g a 4 °C durante 8 min. Recoger el suero y almacenar a -80 °C hasta su análisis.
- Aísle el suero y mida los niveles de IL-6 a través de ELISA o Luminex. Mantenga las herramientas de medición consistentes ya que existe una variabilidad significativa en la concentración total medida con diferentes modalidades y fabricantes. Determinar la magnitud de la respuesta a IL-6 necesaria para inducir fenotipos utilizando una cohorte piloto.
3. Prueba de inmunorreactividad basal (BIR)
NOTA: La figura 1 muestra el esquema de los pasos. Use un poli (I: C) de peso molecular diferente para la prueba BIR en comparación con la gestacional para reducir la probabilidad de respuestas inmunes adaptativas al compuesto.
- Ordene que los ratones hembra vírgenes se envíen a las 7 semanas de edad. A su llegada, agrupe y albergue de cuatro a cinco ratones en una jaula y mantenga el grupo alojado hasta que se aparee. Use muesca en la oreja o cualquier otro sistema de identificación.
- Inyecte a las hembras por vía intraperitoneal 5 mg/kg de poli(I:C) 1 semana después de la llegada. A las 2,5 h después de la inyección, cuando la IL-6 circulante es más alta6, recoger la sangre entera de los animales inyectados a través del corte de cola.
- Permita que la sangre se coagule durante la noche a temperatura ambiente. Después de 12-24 h, centrifugar las muestras de sangre a 3.768 x g a 4 °C durante 8 min.
- Recoger un mínimo de 32 μL de suero de cada muestra. Congelar a -80 °C hasta que esté listo para detectar citoquinas. Para medir los niveles de IL-6 de manera más consistente, utilice un ensayo múltiplex como Luminex. Mantenga las herramientas de medición consistentes ya que existe una variabilidad significativa en la concentración total medida con diferentes modalidades y fabricantes.
- Para el protocolo de ensayo de Luminex, consulte Bruce et al.21.
- Usando niveles relativos de IL-6, divida a los animales en grupos BIR bajo (cuartil inferior), medio (dos cuartiles medios) y alto (cuartil más alto).
4. Método de sangrado de cola para la recolección de sangre
NOTA: Para evitar el uso de sedantes potencialmente inmunomoduladores, use el método de extracción de sangre para el sangrado de la cola.
- Para configurarlo, coloque un soporte de soldadura y una copa de sujeción en una superficie en el lado de la mano no dominante. En una placa de Petri de 35 mm, agregue 1-2 ml de aceite comestible de grado alimenticio. Retire la tapa del tapón de sangre rápido y colóquela cerca de la configuración.
- Coloque algunas capas de toalla de papel en el soporte de soldadura y el primer tubo capilar en un clip, colóquelo cerca de donde se sostendrá la punta de la cola del ratón y manténgalo paralelo a la superficie de la mesa. Tenga una hoja de afeitar a mano.
- Para recolectar la sangre, realice los siguientes pasos.
- En el momento requerido, retire el mouse de la jaula y colóquelo debajo de la copa con la cola saliendo de la muesca en la base. Con una cuchilla de afeitar nueva, recorte el extremo (1-2 mm) de la cola y recoja la primera gota de sangre en el tubo capilar enganchado al soporte de soldadura.
- Sumerja los dedos de la mano dominante en el aceite comestible y úselo para apretar desde la base de la cola hasta la punta, guiando la punta de la cola hacia el tubo capilar para recoger las gotas de sangre resultantes. Continúe hasta que se hayan recogido ~200 μL de sangre.
- Coloque una pequeña tapa en el extremo cónico del tubo capilar antes de la tapa superior. Si primero se coloca la tapa superior, la muestra se expulsará del extremo cónico del tubo. Coloque el tubo en la cubierta exterior protectora.
- Dejar coagular durante la noche a temperatura ambiente. Enfriar una microcentrífuga a 4 °C y reducir la sangre como se indica en el paso 3.3.
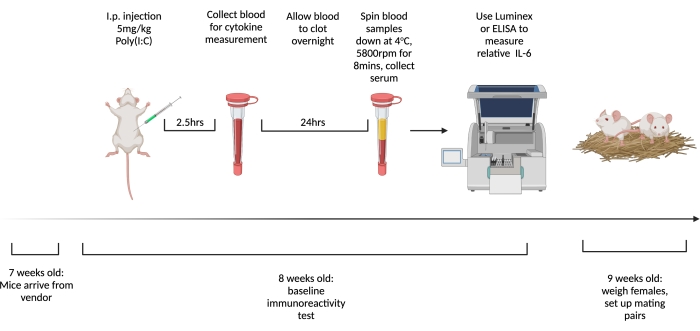
Figura 1. La línea de tiempo para probar la inmunorreactividad y el apareamiento de referencia de las hembras vírgenes. Ordene a los ratones que lleguen a las 7 semanas de edad y permita aclimatarse a las instalaciones durante 1 semana. Inyectar a los animales con 5 mg/kg de poli(I:C) y 2,5 h más tarde extraer sangre. Deje que la sangre se coagule durante la noche, luego centrifugar a 3,768 x g, 4 ° C durante 8 min. Recolectar suero y evaluar los niveles relativos de IL-6 a través de ELISA o Multiplex. A las 9 semanas de edad, establezca parejas de apareamiento. Creado con BioRender.com Haga clic aquí para ver una versión más grande de esta figura.
5. Método basado en el peso para el apareamiento y la inyección gestacional de E12.5
NOTA: La figura 2 muestra el esquema de los pasos. Se pueden usar dos métodos para configurar pares de apareamiento y determinar el punto de tiempo E12.5. El primero, el apareamiento cronometrado, se describe en otra parte22. Los cálculos basados en el peso también se pueden utilizar para evaluar un embarazo E12.523. El beneficio de este enfoque es que permite el bloqueo temporal de la edad de la madre en el apareamiento, disminuyendo la variabilidad en la respuesta inmune. Este procedimiento se utiliza aquí.
- Coloque a los machos en jaulas limpias y permítales aclimatarse durante un mínimo de 2 h. Esto disminuye la probabilidad de agresión femenina ya que los machos ya formarán un olor dominante en la jaula.
- Establezca parejas reproductoras de macho único y hembra soltera agregando la hembra a la jaula del macho. Antes de colocarla en la jaula, pésela y registre el peso. Agregue un pequeño puñado de semillas de girasol a cada jaula para aumentar la eficiencia del apareamiento.
- Para determinar el rango de aumento de peso, realice los siguientes pasos.
- Obtenga un grupo de prueba de hembras y establezca parejas de apareamiento, registrando el peso en el momento del apareamiento.
- Cuando las hembras comiencen a aparecer visiblemente embarazadas, péselas y divídalas en subconjuntos de 8.5 g, 9.5 g, 10.5 g y 11.5 g de peso ganado. Los fetos en E12.5 acaban de comenzar a desarrollar dígitos distintos en sus patas. Utilice la morfología fetal para determinar el aumento de peso promedio para alcanzar E12.5.
- A los 12 días después del apareamiento, pesar a las hembras y determinar el aumento de peso. En una instalación de prueba, las hembras ganan constantemente 9.5-10.5 g desde el momento del apareamiento hasta E12.5. Inyectar vía i.p. la dosis de poli(I:C) solubilizado determinada en el paso 2.3.2 cuando el aumento de peso de la hembra cae dentro del rango predeterminado.
- Observe la respuesta a MIA en presas utilizando los siguientes parámetros.
- Comportamiento de enfermedad: Recopile puntajes subjetivos en una escala de 1 a 3 para determinar qué tan activas se vuelven las presas en respuesta a ser manipuladas, donde 1 es poco o ningún movimiento en respuesta a ser manejado y 3 es una respuesta normal a la captura y restricción. Los animales con mayores respuestas inmunes mostrarán menos resistencia a la manipulación8.
- Respuesta febril: Usando un termómetro IR, recoja las temperaturas previas a la inyección y 2,5 h después de la inyección. Los animales con respuestas inmunes de mayor magnitud a menudo muestran hipotermia en respuesta a una mayor actividad inmune8.
- Cambio de peso: Pesar los animales a las 24 h después de la inyección. Los animales con respuestas inmunes de mayor magnitud generalmente pierden más peso8.
- Mida los niveles gestacionales de IL-6 de la siguiente manera8.
- A las 2,5 h después de la inyección, recolectar sangre con el método preferido. Permita que la sangre se coagule durante la noche a temperatura ambiente. Después de 12-24 h, centrifugar las muestras de sangre a 3.768 x g a 4 °C durante 8 min.
- Recoger el suero y almacenar a -80 °C hasta su análisis. Aísle el suero y mida los niveles de IL-6 a través de ELISA o Luminex. Mantenga las herramientas de medición consistentes ya que existe una variabilidad significativa en la concentración total medida con diferentes modalidades y fabricantes.
- Aloje individualmente la presa después de la inyección con el enriquecimiento adecuado, como anidamientos y dispositivos de enriquecimiento. Mantener todo el enriquecimiento consistente ya que las alteraciones en el enriquecimiento pueden tener impactos significativos en el comportamiento de los roedores 24,25,26,27,28,29.
- El tiempo de gestación para ratones C57 oscila entre 18,5 y 20,5 días. Realice controles de camada para determinar si los animales nacieron dentro de este rango para asegurarse de que la inyección se realizó en el momento correcto. Cuando verifique si hay camadas, moleste la jaula lo menos posible. El estrés inmediatamente después de que nace la camada puede aumentar el riesgo de canibalización.
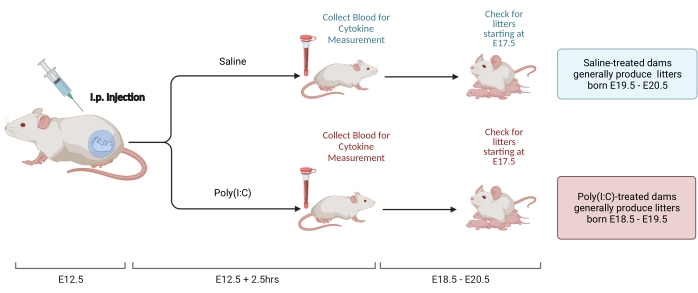
Figura 2. Inducción MIA. La inducción de MIA requiere una evaluación del embarazo, inyección i.p. de poli(I: C) y controles de camada para garantizar el momento correcto de la inflamación materna. Después de evaluar el día gestacional, ya sea a través del apareamiento cronometrado o el método de aumento de peso, administre una inyección i.p. de poli (I: C) en E12.5. Recoger una muestra de sangre a las 2,5 h después de la inyección para confirmar la activación inmune y determinar el nivel de activación de IL-6. Las camadas nacerán aproximadamente E18.5-E20.5. Creado con BioRender.com Haga clic aquí para ver una versión más grande de esta figura.
6. Investigación de alteraciones en el comportamiento en MIA adulta y crías control (opcional)
- A partir de P60 y antes de realizar pruebas de comportamiento, aclimatar a los animales al contacto humano con un manejo suave durante 1 minuto al día durante 3 días consecutivos. Asegúrese de que los días de cambio de jaula no ocurran el mismo día en que se realizan las pruebas de comportamiento.
- Siempre permita que los ratones se aclimaten a la sala de pruebas durante 30-60 minutos antes de comenzar las pruebas de comportamiento. Use habitaciones con poca luz (15-20 lux) para minimizar la ansiedad.
- Para el aseo repetitivo, coloque a los ratones solos en jaulas limpias y sin ropa de cama con tapas. Usando una cámara, grabe a los ratones en estas jaulas durante 20 minutos. Los primeros 10 minutos funcionan como un período de aclimatación, los últimos 10 minutos son el período de prueba.
- Usando videos guardados y un cronómetro, anote el tiempo de aseo acumulado para cada mouse durante el período de prueba de 10 minutos. Otros comportamientos que se pueden calificar a partir de estos videos incluyen la crianza (pararse sobre las patas traseras), congelarse y saltar8.
- Utilice otras pruebas comunes para el modelo MIA, como la inhibición de prepulso (PPI) 14,30,31,32, campo abierto 12,33,34, enfoque social de 3 cámaras13,35,36, reconocimiento de objetos novedosos 37, laberinto en y 30, laberinto elevado más33 y condicionamiento de contexto / miedo indicado 38.
- Inmunotransferencia postnatal8 (opcional)
- En P0, decapitar rápidamente y diseccionar el tejido cerebral fetal en HBSS, congelar en nitrógeno líquido y almacenar a -80 ° C.
- Interrumpir muestras utilizando un sonicador de sonda con una amplitud del 20% durante 5 s en 2x tampón Laemmli, luego desnaturalizar a 85 °C durante 5 min. Centrífuga lisado a 16.000 x g durante 10 min a temperatura ambiente. Recoger sobrenadante y almacenar a -80 °C.
- Mida el contenido total de proteína utilizando un kit comercial de ensayo de proteínas BCA, siguiendo las instrucciones del fabricante, y use albúmina sérica bovina como estándar de calibración.
- Añadir ditiothreitol como agente reductor a las muestras como una concentración final de 100 mM. Calentar a 85 °C durante 2 min antes de cargarlo en un gel.
- Ejecutar 5 μg/carril de proteína en condiciones reductoras en geles TGS al 7,5% y transferir electroforéticamente a las membranas de PVDF. Bloquear las membranas con tampón de bloqueo e incubar con los anticuerpos elegidos.
- Lavar tres veces con TBS + 0,05% Tween 20 e incubar las membranas durante 45 min con anticuerpos secundarios marcados con fluorescencia.
- Lavar cuatro veces más en TBS/Tween 20 y resultados de imagen. Estandarizar los resultados usando β-tubulina, detectada usando anti-β-tubulina.
Resultados
No todos los animales expuestos a 30 mg/kg de poli(I:C) en E12.5 producen descendencia con anomalías de comportamiento consistentes 8,31. Aunque tanto 30 mg/kg como 40 mg/kg de poli(I:C) producen de manera confiable comportamientos de enfermedad en las presas, incluyendo disminución de los niveles de actividad, respuestas hipotérmicas y pérdida de peso, y también causan elevaciones significativas en IL-6, solo un subconjunto de camadas expuestas a MIA desarrollará anomalías de comportamiento en dominios similares a los observados en psiquiátricos humanos y NDD (Figura 3A-C)8 . Una dosis más baja de 20 mg/kg de poli(I:C) también induce comportamiento de enfermedad y pérdida de peso, pero en contraste con dosis más altas no produce consistentemente respuestas de IL-6 lo suficientemente altas en magnitud como para inducir aberraciones de comportamiento en la descendencia a pesar de que las respuestas de IL-6 están muy por encima de las de las madres inyectadas con solución salina (Figura 3D)8.
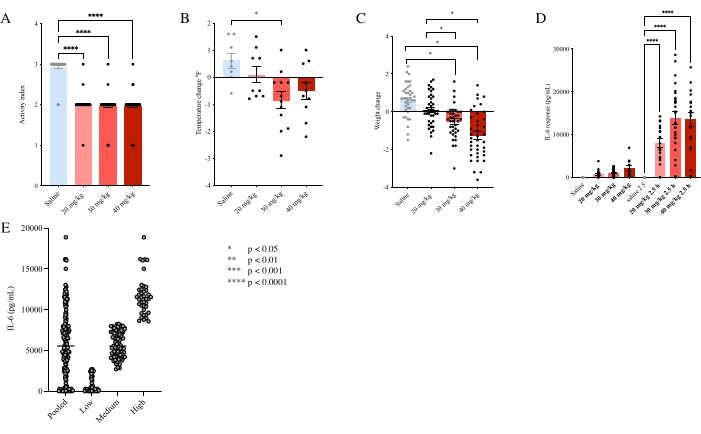
Figura 3. Diferentes dosis de poli(I:C) conducen a efectos diferenciales en las presas. (A) Las presas expuestas a 20 mg/kg, 30 mg/kg o 40 mg/kg de poli(I:C) experimentaron una disminución de la actividad en una escala subjetiva (ANOVA unidireccional; P < 0,0001). (B) Las presas expuestas sólo a 30 mg/kg de poli(I:C) mostraron una temperatura significativamente alterada en forma de respuesta hipotérmica (ANOVA unidireccional; F3,35 = 4,289, p < 0,05). (C) Tanto 30 mg/kg de poli(I:C) como 40 mg/kg de poli(I:C) indujeron una pérdida de peso significativa (ANOVA unidireccional; F7,187 = 26.93, P < 0.0001) y (D) mostraron niveles elevados de IL-6 por encima del umbral requerido para inducir alteraciones conductuales (ANOVA unidireccional; F3,35 = 25,54, p < 0,0001). (E) La inmunorreactividad basal en hembras isogénicas C57BL/6J es muy variable, y la categorización de las hembras BIR en grupos bajos, medios y altos permite a los investigadores predecir qué crías tienen más probabilidades de ser susceptibles al impacto de MIA. Las barras representan la media ± SEM. Esta figura ha sido modificada de Estes et al.8. Haga clic aquí para ver una versión más grande de esta figura.
Inesperadamente, los ratones hembra vírgenes C57BL/6 exhiben inmunorreactividad basal (BIR) bastante variable a una dosis baja de poli(I:C) (5 mg/kg de poli(I:C)) antes del embarazo a pesar de que son isogénicos, y esta variabilidad no está asociada con el peso (Figura 3E, Figura complementaria 1)8. Las madres inyectadas con 5 mg/kg de poli(I:C) antes del embarazo cuyas respuestas IL-6 están en el 50% medio (madres BIR medias) producen descendencia masculina adulta con alteraciones en los niveles de STAT3, MEF2 y proteína tirosina hidroxilasa en el tejido estriado P0 (Figura 4C-E)8. Las crías masculinas de madres BIR medianas expuestas a 30 mg/kg de poli(I:C) también presentan disminución de la densidad de sinapsis y elevada del complejo mayor de histocompatibilidad I (MHCI) en cultivo neuronal disociado (Figura 4A,B)8. Las madres inyectadas con 5 mg/kg de poli(I:C) antes del embarazo cuyas respuestas IL-6 están en el 50% medio (madres BIR medias) producen de manera confiable crías masculinas adultas con comportamientos repetitivos elevados y comportamiento exploratorio disminuido cuando se exponen a 30 mg/kg de poli(I:C) en E12.5 (Figura 5A-F)8.
Por el contrario, los ratones del grupo de BIR alto (con niveles de IL-6 en el 25% superior cuando se exponen a 5 mg / kg de poli (I: C) antes del embarazo) producen descendencia de manera confiable sin cambios de comportamiento repetitivos después de MIA. Sin embargo, las crías masculinas de estas presas BIR altas exhiben un comportamiento exploratorio elevado después de MIA (Figura 5D)8. Juntos, estos resultados indican que la MIA puede causar resultados diferenciales en la descendencia, dependiendo del BIR8 de la madre.

Figura 4. Una dosis intermedia de poli(I:C) y BIR conduce a los mejores resultados en los modelos MIA. (A) Las neuronas corticales de la descendencia expuesta a la activación inmune materna a mediados de la gestación mostraron un aumento significativo de la presentación de MHCI solo cuando las madres recibieron 30 mg / kg de poli (I: C) (ANOVA unidireccional; F3,19 = 5,156, p < 0,01). (B) En contraste, todas las dosis (20 mg/kg, 30 mg/kg y 40 mg/kg) resultaron en una disminución significativa de la densidad de sinapsis en el cultivo neuronal disociado (ANOVA unidireccional; F3,43 = 11,01, p < 0,0001). (C-E) Los Western blots estriatales P0 muestran niveles elevados de STAT3, MEF2A y TH, solo en animales cuyas madres tenían BIRs medianos y estuvieron expuestas a 30 mg/kg de poli(I:C) (ANOVA unidireccional; MEF2A: F3,24 = 3,968, p < 0,05; STAT3: F3,24 = 6,401, P < 0,01; TH: F3,24 = 3,668, p < 0,05). Las barras representan la media ± SEM. Esta figura ha sido modificada de Estes et al.8. Haga clic aquí para ver una versión más grande de esta figura.
Los animales susceptibles en los grupos BIR medio 30 mg/kg y BIR alto 30 mg/kg no solo pueden compararse con los controles, sino también con los animales resistentes. La inyección de presas BIR medianas con una dosis aún mayor de 40 mg/kg de poli(I:C) produce descendencia sin alteraciones significativas en el comportamiento identificadas mediante los ensayos empleados hasta la fecha (Figura 5A-F)8. Esto sugiere una relación en U invertida entre la activación inmune y la susceptibilidad a MIA.

Figura 5. Las crías masculinas de madres expuestas a una dosis intermedia de poli(I:C) exhiben las mayores alteraciones en el comportamiento. (A-F) Crías masculinas de presas expuestas a 30 mg/kg de poli(I:C) (ANOVA anidado unidireccional; F3,27 = 8,775; Baja: P = 0,0427; Media: P = 0,0062; Alto: (P = 0,9568) pero no 20 mg/kg o 40 mg/kg de poli(I:C) muestran alteraciones en el aseo repetitivo y el comportamiento de crianza exploratoria. Además, los animales en el grupo de tratamiento poli (I: C) de 30 mg / kg muestran formas dispares de susceptibilidad, y los descendientes masculinos de madres BIR medianas muestran un aumento del comportamiento repetitivo y una disminución de la exploración, mientras que los descendientes masculinos de madres con BIR alto no muestran alteración en el comportamiento repetitivo, pero han aumentado el comportamiento exploratorio (A, D ; ANOVA unidireccional anidado; F3,15 = 9,407, Bajo: P = 0,4910; Medio: P < 0,001; Alto: P = 0,0117). Las crías expuestas a 20 mg/kg de poli(I:C) no parecieron alcanzar el umbral de activación inmune requerido para alterar el desarrollo neuronal ya que no mostraron alteraciones en los comportamientos probados, mientras que las crías expuestas a 40 mg/kg de poli(I:C) también fueron en su mayoría resistentes a sus efectos (B,C,E,F). Las barras representan la media ± SEM. Esta figura ha sido modificada de Estes et al.8. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1. La inmunorreactividad basal no se correlaciona con el peso animal. Los ratones hembra vírgenes exhiben una amplia gama de respuestas de IL-6 a 5 mg / kg de poli (I: C) inyectado antes del embarazo de manera independiente del peso, R2 = 0.0086, P = 0.9. Haga clic aquí para descargar este archivo.
Discusión
La infección materna altera el curso del desarrollo cerebral en humanos y en roedores y primates no humanos 4,5,7. Aquí, se describe un procedimiento para inducir MIA en ratones en un punto de tiempo gestacional medio usando poli (I: C). Este método incorpora la evaluación del BIR antes del embarazo, lo que aumenta la reproducibilidad y ofrece la oportunidad de investigar mecánicamente los mecanismos que conducen a la resiliencia y susceptibilidad de la descendencia a MIA8. Después de MIA, las madres del grupo BIR medio (con niveles de IL-6 en el 50% medio) generan de manera confiable descendencia adulta con alteraciones en los comportamientos repetitivos, alteraciones en los niveles de MHCI en las neuronas de la descendencia recién nacida según lo determinado por inmunocitoquímica y niveles elevados de tirosina hidroxilasa estriatal, MEF2 y proteína STAT3 de la descendencia recién nacida según lo determinado por Western blot8.
El uso de MIA como modelo ambiental confiere una mayor relevancia traslacional ya que cumple con los criterios para un modelo de enfermedad: constructo, cara y validez predictiva7. Sin embargo, como con cualquier modelo ambiental, se debe tener mucho cuidado para minimizar las variables externas. Muchos factores como el vendedor, el lote de poli(I:C), el momento de la inyección, la edad de las presas e incluso el sistema de jaula pueden alterar el impacto de MIA en la descendencia 8,9,39. Como se informó anteriormente, la potencia de poli(I:C) es inconsistente entre fabricantes, lotes e incluso botellas dentro de un lote debido a la alta variabilidad en las concentraciones de dsRNA y pesos moleculares 8,40. Debido a que esta variabilidad puede aumentar la heterogeneidad en la respuesta inmune materna, es fundamental que los laboratorios determinen la dosis efectiva para cada lote para mantener la máxima reproducibilidad en fenotipos observables. Por ejemplo, se ha observado que los ratones Charles River expuestos a MIA producen BIR consistente y fenotipos dependientes de la dosis en la descendencia, y los ratones de Taconic también pueden verse afectados de manera similar con algunas diferencias entre los grupos de tratamiento8. Además, es vital que los investigadores estandarizen las prácticas de cría y mantengan registros detallados para aumentar la reproducibilidad del modelo. La publicación escrita por Kentner et al. describió los muchos detalles que deben incluirse en los informes experimentales y también puede funcionar como una lista de verificación para los investigadores a medida que finalizan sus protocolos9.
El BIR se evalúa utilizando los niveles séricos relativos de interleucina-6 (IL-6) de ratones hembra vírgenes. La división de esos ratones en tres grupos (bajo, medio y alto) revela modelos reproducibles, resistentes y susceptibles8. Debido a que BIR es una cuestión de concentración relativa de IL-6, no es crucial probar rigurosamente la potencia poli (I: C) de alto peso molecular como es necesario con el poli (I: C) de peso molecular mixto utilizado para inducir la activación inmune materna durante la gestación. BIR es una medida relativamente nueva que puede no reducir todos los resultados variables.
Las respuestas inmunes de las madres durante su primera exposición a dosis gestacionales de poli(I:C) pueden diferir de su respuesta durante embarazos y exposiciones posteriores. Con este fin, el uso de hembras vírgenes reduce el potencial de variabilidad que podrían presentar las alteraciones en la respuesta inmune resultantes de embarazos múltiples. El método basado en el peso para estimar el punto de tiempo del embarazo es necesario porque los ratones a menudo no quedan embarazadas dentro de las primeras 24 horas de apareamiento.
Es importante tener en cuenta que existen desafíos estadísticos con este modelo. Debido a que MIA se induce en las madres, la descendencia no puede ser aleatorizada en condiciones de tratamiento. Por lo tanto, cada camada debe considerarse un n de 1 9,41,42, y los individuos dentro de esa camada deben promediarse para crear cada punto de datos. Por lo tanto, el diseño estadístico más apropiado para estos datos utiliza análisis anidados8. Se necesita un mínimo de seis camadas por grupo (dosis BIR x) para detectar de forma fiable alteraciones en las medidas conductuales y moleculares. Se han observado ampliamente diferencias significativas de sexo en la literatura de MIA, por lo que los sexos nunca deben agruparse en los análisis 8,9,43,44.
BIR es una herramienta predictiva relativamente nueva, y aún no se ha definido en términos de impacto mecanicista. Se desconoce si el BIR está asociado con respuestas inmunes gestacionales específicas, sin embargo, la respuesta de IL-6 de los ratones antes del embarazo no es equivalente a su respuesta durante el embarazo8. Por lo tanto, BIR representa una medida predictiva correlativa, y se están realizando más investigaciones para determinar sus orígenes.
A pesar de la variabilidad inherente al modelo MIA, ningún otro modelo ambiental de trastornos neuropsiquiátricos y NDD hasta la fecha puede proporcionar el mismo nivel de relevancia traslacional. La preparación y las pruebas piloto exhaustivas son necesarias para producir consistencia en el modelo MIA, pero la solidez de los resultados fenotípicos compensa esta inversión inicial. En última instancia, los modelos animales MIA ofrecen un potencial sin precedentes para investigar un solo factor de riesgo que crea grupos divergentes y distintos de alteraciones conductuales y moleculares en la descendencia, similares a las observadas en poblaciones humanas.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos a la Dra. Myka Estes por su persistencia en abordar la variabilidad en el modelo MIA de ratón y a todos los colaboradores en Estes et al.8 por su trabajo que condujo al desarrollo del protocolo de métodos descrito aquí. La investigación reportada aquí fue apoyada por NIMH 2P50 MH106438-06 (A.K.M.) y NIMH T32MH112507 (K.P.).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl physiological endotoxin free saline | Sigma-Aldrich | 7647-14-5 | Control and vehicle for Poly(I:C) |
| 35mm petri dish | Thomas Scientific | 1219Z45 | Used to hold oil during tail bleed |
| 7.5% TGX gels | Bio-rad | 4561084 | Optional |
| Ancare Nestlets | Fisher Scientific | NC9365966 | Optional |
| anti-β-tubulin | Millipore | MAB3408 | Optional |
| Bio-Plex Pro Mouse Cytokine Standards Group I | Bio-rad | 171I50001 | |
| Bio-Plex Pro Reagent Kit with Flat Plate | Bio-rad | 171304070M | |
| Bovine Serum Albumin | ThermoFisher | 23209 | Optional |
| Centrifuge | Eppendorf | 5810R | Optional |
| Covidien Monoject 1/2 mL Insulin Syringe with 28G x 1/2 in. Needle | Spectrum | 552-58457-083 | |
| Dithiothreitol | Sigma-Aldrich | D9779-10G | Optional |
| Environmental enrichment | Bio-serv | K3327 and K3322 | Optional |
| Ethovision | Noldus | Ethovision | Optional |
| Fluorsecent-tagged seondary ntibodies | Li-cor | 925-32213 and 925-68072 | Optional |
| Food-grade edible oil (like olive, canola or grapeseed) | Various vendors | Use to lubricate tail during tail bleeds | |
| HBSS | ThermoFisher | 14060040 | Optional |
| High molecular weight polyinositic:polycytidilic acid | Invivogen | #tlrl-pic-5 | Used to establish females' BIR |
| Humane Mouse Restrainer | AIMS | 1000 | Used to restrain mouse during tail bleeds |
| Image Studio Software | Licor | 5.2 | Optional |
| Laemmli buffer | Bio-rad | 1610737EDU | Optional |
| Luminex200 | ThermoFisher | APX10031 | |
| Microvette CB300 300μl Serum capillary tube | Sarstedt | 16.440.100 | |
| Mixed molecular weight polyinositic:polycytidilic acid | Sigma-Aldrich | #P0913 | Gestational induction of MIA |
| monoclonal anti-MEF2A | AbCam | ab76063 | Optional |
| monoclonal anti-STAT3 | Cell signaling | 12640S | Optional |
| Observer | Noldus | Observer | Optional |
| Odyssey blocking buffer (TBS) | Li-cor | 927-50003 | Optional |
| Odyssey CLx imaging system | Li-cor | 9140 | Optional |
| Omnipure PBS | Millipore | 65054L | Optional |
| Pierce BCA Protein Assay Kit | ThermoFisher | 23227 | Optional |
| polyclonal anti_TH | Pel-Freez | P4101-150 | Optional |
| PVDF membrane | Bio-rad | 162-0177 | Optional |
| Qsonica Sonicator Q500 | Fisher Scientific | 15-338-282 | Optional |
| Quick blood stopper | Petco | 17140 | |
| Seal-Rite 1.5 ml microcentrifuge tube, natural non-sterile | USA Scientific | 1615-5500 | |
| Soldering stand | Amazon | B08Y12QC73 | Used to hold capillary tube during tail bleeds |
| Sunflower seeds | Bio-serv | S5137-1 | Use to increase breeding efficiency |
| The Bio-Plex Pro Mouse IL-6 set, | Bio-rad | 171G5007M | |
| Tris base | Fisher Scientific | BP152-1 | Optional |
| Tween 20 | Bio-rad | 23209 | Optional |
Referencias
- Adams, W., Kendell, R. E., Hare, E. H., Munk-Jørgensen, P. Epidemiological evidence that maternal influenza contributes to the aetiology of schizophrenia. An analysis of Scottish, English, and Danish data. The British Journal of Psychiatry: The Journal of Mental Science. 163 (4), 522-534 (1993).
- Brown, A. S., et al. Serologic evidence of prenatal influenza in the etiology of schizophrenia. Archives of General Psychiatry. 61 (8), 774-780 (2004).
- Brown, A. S., Derkits, E. J. Prenatal infection and schizophrenia: a review of epidemiologic and translational studies. The American Journal of Psychiatry. 167 (3), 261-280 (2010).
- Patterson, P. H. Immune involvement in schizophrenia and autism: etiology, pathology and animal models. Behavioural Brain Research. 204 (2), 313-321 (2009).
- Patterson, P. H. Maternal infection and immune involvement in autism. Trends in Molecular Medicine. 17 (7), 389-394 (2011).
- Estes, M. L., McAllister, A. K. Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews. Neuroscience. 16 (8), 469-486 (2015).
- Estes, M. L., McAllister, A. K. Maternal immune activation: Implications for neuropsychiatric disorders. Science. 353 (6301), 772-777 (2016).
- Estes, M. L., et al. Baseline immunoreactivity before pregnancy and poly(I:C) dose combine to dictate susceptibility and resilience of offspring to maternal immune activation. Brain, Behavior and Immunity. 88, 619-630 (2020).
- Kentner, A. C., et al. Maternal immune activation: reporting guidelines to improve the rigor, reproducibility, and transparency of the model. Neuropsychopharmacology. 44 (2), 245-258 (2019).
- Zhou, Y., et al. TLR3 activation efficiency by high or low molecular mass poly I:C. Innate Immunity. 19 (2), 184-192 (2013).
- Hsiao, E. Y., Patterson, P. H. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6. Brain, Behavior and Immunity. 25 (4), 604-615 (2011).
- Smith, S. E., Li, J., Garbett, K., Mirnics, K., Patterson, P. H. Maternal immune activation alters fetal brain development through interleukin-6. The Journal of Neuroscience. 27 (40), 10695-10702 (2007).
- Choi, G. B., et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science. 351 (6276), 933-939 (2016).
- Meyer, U. Neurodevelopmental resilience and susceptibility to maternal immune activation. Trends in Neurosciences. 42 (11), 793-806 (2019).
- Laroche, J., Gasbarro, L., Herman, J. P., Blaustein, J. D. Reduced behavioral response to gonadal hormones in mice shipped during the peripubertal/adolescent period. Endocrinology. 150 (5), 2351-2358 (2009).
- Aguila, H. N., Pakes, S. P., Lai, W. C., Lu, Y. S. The effect of transportation stress on splenic natural killer cell activity in C57BL/6J mice. Laboratory Animal Science. 38 (2), 148-151 (1988).
- Landi, M. S., Kreider, J. W., Lang, C. M., Bullock, L. P. Effects of shipping on the immune function in mice. American Journal of Veterinary Research. 43 (9), 1654-1657 (1982).
- Menees, K. B., et al. Sex- and age-dependent alterations of splenic immune cell profile and NK cell phenotypes and function in C57BL/6J mice. Immunity & Ageing. 18 (1), 3(2021).
- Shaw, A. C., Goldstein, D. R., Montgomery, R. R. Age-dependent dysregulation of innate immunity. Nature Reviews Immunology. 13 (12), 875-887 (2013).
- Starr, M. E., Saito, M., Evers, B. M., Saito, H. Age-associated increase in Cytokine production during systemic inflammation-II: the role of IL-1beta in age-dependent IL-6 upregulation in adipose tissue. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences. 70 (12), 1508-1515 (2015).
- Bruce, M., et al. Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. Journal of Neuroinflammation. 16 (1), 200(2019).
- Mader, S. L., Libal, N. L., Pritchett-Corning, K., Yang, R., Murphy, S. J. Refining timed pregnancies in two strains of genetically engineered mice. Lab Animal. 38 (9), 305-310 (2009).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. Journal of the American Association for Laboratory Animal Science. 54 (4), 368-371 (2015).
- Hutchinson, E., Avery, A., VandeWoude, S. Environmental enrichment for laboratory rodents. ILAR Journal. 46 (2), 148-161 (2005).
- Bayne, K. Environmental enrichment and mouse models: Current perspectives. Animal Models and Experimental Medicine. 1 (2), 82-90 (2018).
- Toth, L. A., Kregel, K., Leon, L., Musch, T. I. Environmental enrichment of laboratory rodents: the answer depends on the question. Comparative Medicine. 61 (4), 314-321 (2011).
- Sparling, J. E., Barbeau, K., Boileau, K., Konkle, A. T. M. Environmental enrichment and its influence on rodent offspring and maternal behaviours, a scoping style review of indices of depression and anxiety. Pharmacology Biochemistry and Behavior. 197, 172997(2020).
- Xiao, R., Ali, S., Caligiuri, M. A., Cao, L. Enhancing effects of environmental enrichment on the functions of natural killer cells in mice. Frontiers in Immunology. 12, 695859(2021).
- Girbovan, C., Plamondon, H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers. Behavioural Brain Research. 253, 178-190 (2013).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Mueller, F. S., et al. neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Molecular Psychiatry. 26 (2), 396-410 (2021).
- Nyffeler, M., Meyer, U., Yee, B. K., Feldon, J., Knuesel, I. Maternal immune activation during pregnancy increases limbic GABAA receptor immunoreactivity in the adult offspring: implications for schizophrenia. Neuroscience. 143 (1), 51-62 (2006).
- Babri, S., Doosti, M. H., Salari, A. A. Strain-dependent effects of prenatal maternal immune activation on anxiety- and depression-like behaviors in offspring. Brain, Behavior, and Immunity. 37, 164-176 (2014).
- Vigli, D., et al. Maternal immune activation in mice only partially recapitulates the autism spectrum disorders symptomatology. Neuroscience. 445, 109-119 (2020).
- Malkova, N. V., Yu, C. Z., Hsiao, E. Y., Moore, M. J., Patterson, P. H. Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism. Brain, Behavior, and Immunity. 26 (4), 607-616 (2012).
- Shin Yim, Y., et al. Reversing behavioural abnormalities in mice exposed to maternal inflammation. Nature. 549 (7673), 482-487 (2017).
- Ito, H. T., Smith, S. E., Hsiao, E., Patterson, P. H. Maternal immune activation alters nonspatial information processing in the hippocampus of the adult offspring. Brain, Behavior, and Immunity. 24 (6), 930-941 (2010).
- Zuckerman, L., Weiner, I. Maternal immune activation leads to behavioral and pharmacological changes in the adult offspring. Journal of Psychiatric Research. 39 (3), 311-323 (2005).
- Mueller, F. S., Polesel, M., Richetto, J., Meyer, U., Weber-Stadlbauer, U. Mouse models of maternal immune activation: Mind your caging system. Brain, Behavior, and Immunity. 73, 643-660 (2018).
- Careaga, M., Murai, T., Bauman, M. D. Maternal immune activation and autism spectrum disorder: from rodents to nonhuman and human primates. Biological Psychiatry. 81 (5), 391-401 (2017).
- Lazic, S. E., Essioux, L. Improving basic and translational science by accounting for litter-to-litter variation in animal models. BMC Neuroscience. 14, 37(2013).
- Spencer, S. J., Meyer, U. Perinatal programming by inflammation. Brain, Behavior, and Immunity. 63, 1-7 (2017).
- Mouihate, A., Kalakh, S. Maternal Interleukin-6 hampers hippocampal neurogenesis in adult rat offspring in a sex-dependent manner. Developmental Neuroscience. 43 (2), 106-115 (2021).
- Zhang, Z., van Praag, H. Maternal immune activation differentially impacts mature and adult-born hippocampal neurons in male mice. Brain, Behavior, and Immunity. 45, 60-70 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados