Method Article
Realización de espectroscopía en nanopartículas Plasmónicas con microscopía de contraste de interferencia diferencial de tipo Nomarski basado en la transmisión
En este artículo
Resumen
El objetivo de este protocolo es detallar un enfoque comprobado para la preparación de muestras de nanopartículas plasmónicas y para realizar espectroscopía de partícula única en ellas con microscopía de contraste de interferencia diferencial (DIC).
Resumen
La microscopía de contraste de interferencia diferencial (DIC) es una potente herramienta de imagen que se emplea con mayor frecuencia para objetos de microescala de imagen utilizando luz de rango visible. El propósito de este protocolo es detallar un método probado para preparar muestras de nanopartículas plasmónicas y realizar espectroscopía de partícula única en ellas con microscopía DIC. Varios pasos importantes deben seguirse cuidadosamente para realizar experimentos de espectroscopía repetible. Primero, los hitos pueden ser grabados en el sustrato de la muestra, que ayuda a localizar la superficie de la muestra y en el seguimiento de la región de interés durante los experimentos. A continuación, el sustrato debe limpiarse adecuadamente de escombros y contaminantes que de otro modo pueden obstaculizar u oscurecer el examen de la muestra. Una vez que una muestra se prepara correctamente, la trayectoria óptica del microscopio debe alinearse, utilizando Kohler Illumination. Con un microscopio DIC de estilo Nomarski estándar, la rotación de la muestra puede ser necesaria, especialmente cuando las nanopartículas plasmónicas exhiben propiedades ópticas dependientes de la orientación. Debido a que la microscopía DIC tiene dos campos de polarización ortogonal inherentes, el patrón de contraste DIC dependiente de la longitud de onda revela la orientación de las nanopartículas plasmónicas en forma de varilla. Finalmente, la adquisición de datos y los análisis de datos deben realizarse cuidadosamente. Es común representar datos de espectroscopía basada en DIC como un valor de contraste, pero también es posible presentarlo como datos de intensidad. En esta demostración de la DIC para la espectroscopía de una sola partícula, el foco se centra en las nanopartículas de oro esféricas y en forma de varilla.
Introducción
Desde la década de 1980, la microscopía de contraste de interferencia diferencial (DIC) se ha visto en gran medida como un importante método de imagen reservado para los objetos de microescala dentro de las ciencias biológicas. Sin embargo, durante su desarrollo en los años 1950 y 1960, fue concebido como una técnica para la ciencia de los materiales1. Con los recientes avances en las Ciencias materiales relacionados con las nanopartículas plasmónicas, se ha realizado un mayor interés en la caracterización de materiales con microscopía óptica.
Muchas técnicas ópticas están sin duda disponibles para la caracterización de nanomateriales (por ejemplo, campo oscuro, campo claro, luz polarizada, fluorescencia, etc.). El campo oscuro es muy popular en la investigación de nanopartículas, pero se basa únicamente en la colección de dispersión y proporciona información limitada sobre muestras complejas2. La fluorescencia puede ser útil, pero sólo con muestras que luminesce o que pueden ser debidamente teñidas. La microscopía DIC tiene varios rasgos que la convierten en una herramienta valiosa para el análisis de nanopartículas. Las ventajas más frecuentemente indicadas de la DIC en comparación con otros métodos y en lo que respecta a las nanopartículas plasmónicas son: no se requiere tinción de muestras, no hay efectos de Halo, profundidad de campo superficial y alta resolución lateral3. El DIC tiene fortalezas adicionales que son valiosas para la investigación de nanopartículas plasmónicas. En primer lugar, dos campos de polarización inherentes y ortogonales están presentes, y se pueden medir simultáneamente para fines de espectroscopía2. En segundo lugar, la señal depolarizada de las nanopartículas no se captura en la imagen final2, que puede ser una causa de grave preocupación en las mediciones de espectroscopía de campo oscuro.
El propósito de este artículo es proporcionar una metodología clara para la utilización de microscopía de Nomarski de luz transmitida para realizar espectroscopía en nanopartículas plasmónicas. Aunque la DIC es una técnica poderosa que se puede aplicar a materiales muy diversos, también es una técnica que requiere una gran habilidad y comprensión para operarla correctamente cuando se imaginan nanopartículas. La microscopía de la transmisión Nomarski con base en transmisiones tiene un camino ligero complejo1 que solo se revisará brevemente aquí. El tren óptico de DIC se visualiza en la figura 1. La luz se transmite a través del microscopio, primero se pasa a través de un polarizador y un prisma de Nomarski que divide el haz antes de ser centrado por el condensador en el plano de la muestra. Después de pasar por el objetivo, la luz se encuentra con un Haz que combina el prisma Nomarski y un analizador antes de salir al detector. Los dos polarizadores y prismas de Nomarski son críticos para la formación de la imagen de DIC y son responsables de producir los dos campos de polarización ortogonal1de Dic. Para el lector interesado en saber más sobre los principios de trabajo y la trayectoria óptica de los microscopios de Nomarski DIC, o las diferencias entre Nomarski DIC y otros estilos de DIC, por favor refiérase a otras cuentas bien escritas sobre estos temas1, 4 , 5 , 6 , 7.
Es igualmente importante entender la naturaleza básica de las nanopartículas plasmónicas antes de intentar realizar espectroscopía en ellas, ya sea con Nomarski DIC, campo oscuro, o cualquier otra técnica de microscopía. En el campo de los plasmónicos, las nanopartículas se definen como partículas con dimensiones en la escala de 10-100 nm8,9. Las nanopartículas pueden adoptar muchas formas (por ejemplo, esferas, varillas, estrellas, mancuernas, etc.), y la mayoría de sus propiedades importantes surgen de las interacciones con la luz en el rango infrarrojo ultravioleta-visible-cercano del espectro electromagnético. El término "plasmónico" no se restringe a las nanopartículas10; sin embargo, cuando se discuten las nanopartículas, se utiliza en referencia a la resonancia de Plasmon superficial localizada (LSPR). LSPR es un fenómeno en el que los electrones de conducción en una nanopartícula oscilan debido a una interacción Coulombic con la radiación electromagnética de una banda de frecuencias8muy específica y relativamente estrecha. A estas mismas frecuencias, las nanopartículas plasmónicas exhiben una mayor absorción y dispersión de la luz, haciéndolos observables con microscopía óptica. En muchos casos, se prefiere observar las nanopartículas mientras se colocan filtros de paso de banda antes del condensador2, para mejorar el contraste de imagen y para eliminar la luz que no induce el efecto LSPR. El uso de filtros también hace posible realizar experimentos de espectroscopía de partículas individuales.
El comportamiento óptico relacionado con LSPR depende en gran medida del tamaño y la forma de las nanopartículas, y se puede investigar con muchas técnicas de microscopía óptica. Sin embargo, con el fin de descifrar la información de orientación de las nanopartículas plasmónicas con una forma anisotrópico (es decir, no esférica), es necesario utilizar la polarización del campo de luz. Al rotar cuidadosamente el campo de polarización o el sustrato de la muestra en pequeños incrementos, es posible monitorear las propiedades espectroscópicas dependientes de la orientación de las nanopartículas individuales. La rotación y la polarización también pueden ayudar a determinar si una característica espectral se debe a una oscilación de orden dipolares o superior de los electrones superficiales de la nanopartícula. Sin embargo, en el caso de nanopartículas isotrópicas (es decir, esféricas), el perfil espectral permanece esencialmente sin cambios al rotar la muestra bajo luz polarizada.
Cuando se ve a través de un microscopio DIC (figura 2), las nanopartículas tienen un disco aireado con un aspecto blanco y negro fundido a la sombra contra un fondo gris. Las nanopartículas esféricas mantendrán esta apariencia bajo rotación y con el cambio de filtros de paso de banda; sin embargo, las partículas se desvanecerán gradualmente de la vista a medida que la longitud de onda central del filtro se separa más de la única longitud de onda LSPR de la esfera11. La aparición de nanorods puede cambiar drásticamente a medida que se giran2. Los nanorods tienen dos bandas LSPR con comportamiento dipolares, cuya ubicación se basa en las dimensiones físicas de los nanorods. Cuando el eje longitudinal de un nanorod está orientado paralelo a uno de los campos de polarización DIC, el disco aireado aparecerá todo blanco o negro Si se visualiza con un filtro de paso de banda asociado con esa longitud de onda LSPR. Después de rotar la muestra 90 °, tomará el color opuesto. Alternativamente, dado que el eje transversal de un nanorod es perpendicular al eje longitudinal, la varilla tomará el color opuesto al cambiar entre filtros que coincidan con las longitudes de onda LSPR para los dos ejes. En otras orientaciones y configuraciones de filtro, las nanorods aparecerán más como esferas, presentando una variedad de patrones de disco aireados de sombra. Para nanorods con un eje transversal < 25 nm, puede ser difícil detectar la señal en la longitud de onda de LSPR utilizando la microscopía DIC.
Para realizar la espectroscopía de una sola partícula, es importante utilizar los componentes ópticos correctos y alinearlos correctamente. Se debe utilizar un objetivo capaz de microscopía DIC. Para experimentos de partículas individuales, los objetivos de aceite de 80x o 100x son ideales. Los prismas de Nomarski DIC normalmente vienen en tres variedades: estándar, alto contraste y alta resolución. El tipo ideal depende altamente del propósito del experimento y del tamaño de las nanopartículas. Los prismas estándar están bien para muchos experimentos; pero cuando se trabaja con nanopartículas más pequeñas (< 50 nm), los prismas de alto contraste pueden ser beneficiosos, ya que el contraste de partículas disminuye a medida que las partículas disminuyen en el tamaño11. El ajuste del contraste DIC se consigue girando un polarizador o traduciendo uno de los prismas DIC, dependiendo de la marca del microscopio o del modelo6.
Después de configurar la iluminación de Kohler y los ajustes del polarizador, es fundamental no reajustar estos ajustes mientras se recopilan datos de espectroscopía. Además, se debe mantener una señal de fondo promedio constante en todo momento durante la recopilación de datos, incluso cuando se cambia entre los filtros y los ajustes de ángulo. El valor real de fondo ideal depende del rango dinámico de la cámara científica, pero en general, el fondo debe estar en el rango de 15% – 40% del nivel de detección máximo de la cámara. Esto reduce la probabilidad de saturar el sensor de la cámara al tiempo que permite un contraste de partículas óptimo. Para recopilar datos de espectroscopía, es necesario trabajar con una cámara científica que Capture imágenes en blanco y negro, en contraposición a una cámara a color.
La preparación de muestras es otro aspecto crítico de las nanopartículas plasmónicas por imágenes. Es imperativo que los operadores de la microscopía DIC tengan una comprensión de las propiedades ópticas de la muestra y del sustrato de la muestra. El cristal del microscopio "precaseados" no está suficientemente preparado para las nanopartículas de imagen, y debe volver a limpiarse correctamente antes de la deposición de la muestra para garantizar la observación sin obstrucciones de la muestra. Muchos protocolos de limpieza para las diapositivas de microscopio han sido documentados previamente12, pero no es un paso que se divulga normalmente en estudios experimentales.
Finalmente, los métodos de análisis de datos son el componente final de la espectroscopía de partículas individuales. Se deben medir las intensidades máximas y mínimas para cada nanopartícula, así como la media de fondo local. Las partículas de interés deben estar ubicadas en áreas sin residuos de fondo, defectos de sustrato o iluminación irregular. Un método para determinar el perfil espectral de una nanopartícula es calculando el contraste de las partículas en cada longitud de onda, utilizando la ecuación inferior a11,13,14,15:

Alternativamente, el espectro de una sola partícula se puede dividir en sus componentes individuales de señal máxima y mínima, que representan los dos campos de polarización de DIC, mostrando así los dos espectros dependientes direccionalmente que se recogen simultáneamente, a través de las dos ecuaciones:
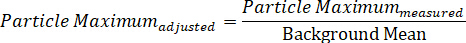

Protocolo
1. preparación de muestras con diapositivas de microscopía de vidrio estándar
- Prepare diapositivas de microscopio de vidrio para la deposición de muestras.
Nota: en algunas circunstancias, puede ser más apropiado almacenar el vidrio en agua ultrapura en lugar de etanol. Sin embargo, el almacenamiento en agua o aire hace que el vidrio hidrófobo con el tiempo.- Para obtener los mejores resultados, compre portaobjetos de vidrio o cuarzo y vidrio de cubierta.
- Usando una pluma de trazado, coloque una marca de rasguño corto y superficial en el centro de cada resguardo de cubierta de vidrio.
- Limpie todo el vidrio del microscopio, incluso si se adquiere "pre-limpiado", para eliminar fragmentos de vidrio, polvo, polvo, residuos orgánicos y cualquier otro contaminante que afecte la calidad de la imagen o la deposición de la muestra.
Nota: este método de limpieza a continuación funciona bien para los tipos de muestras descritas aquí y evita el uso de productos químicos agresivos. Los productos químicos harsher pueden grabar el vidrio y requieren más cuidado en el manejo y la eliminación.- Coloque el cristal del microscopio en los estantes de almacenamiento y luego en un vaso de precipitados, o en un frasco de tinción. No coloque el cristal del microscopio en la parte inferior de los vasos de precipitados y otros cristalería de laboratorio sin aglomerado, ya que cada pieza y superficie del vidrio del microscopio debe estar completamente expuesta a los agentes de limpieza.
- Vierta ~ 1 mL de detergente líquido (tabla de materiales) en el recipiente y tapa el recipiente con agua. Sonicar durante 30 min.
Nota: una vez que el proceso de limpieza comienza, sólo manipule el vidrio mientras lleva guantes, para evitar dejar residuos de huellas dactilares en el vidrio. - Vierta el contenido líquido del recipiente de limpieza en un fregadero. Enjuague el recipiente varias veces con agua ultrapura para eliminar toda la apariencia de detergente. Rellene el recipiente con agua ultrapura. Someter a ultrasonidos el recipiente con vidrio del microscopio por otro 30 min.
- Repita el paso anterior al menos una vez más. Realizar rondas adicionales de sonicación en agua hasta que sea obvio que todos los rastros del detergente han sido removidos.
- Vierta el contenido del recipiente de limpieza. Enjuagar el recipiente con agua ultrapura. Rellene el envase con etanol. Sonicar vidrio del microscopio durante 30 min.
- Vierta el contenido del recipiente de limpieza en un recipiente de desechos. Rellenar con etanol. Cubra el recipiente para evitar la pérdida de etanol a través de la evaporación. Almacene el cristal del microscopio en este recipiente hasta el momento del experimento. Las diapositivas permanecen limpias y utilizables siempre y cuando permanezcan sumergidas en etanol dentro de un recipiente cubierto.
-
Preparación de la solución de nanopartículas
- Con una micropipetas, extraiga una alícuota de 100 μL de una solución de nanopartículas de oro de 0,05 mg/mL de su contenedor de almacenamiento original y expulse la solución en un tubo de centrifugación de 1,5 mL.
- Centrifugar la muestra durante 10 min a 6.000 x g.
- Retire el sobrenadante con una micropila, con el fin de eliminar el exceso de surfactante.
- En el tubo de centrifugación, coloque 100 μL de agua ultrapura.
Nota: Si no se puede eliminar todo el sobrenadante en el primer intento, repita los pasos de centrifugación y resuspensión. - Torbellino brevemente la muestra para Resuspender el pellet. Sonicar inmediatamente después durante 20 minutos para resuspender completamente y romper agregados de nanopartículas.
Nota: Si la muestra no se utiliza inmediatamente, se debe Sonicar de nuevo durante 20 minutos antes de depositar la solución en el vidrio del microscopio.
-
Deposición de muestra
- Retire los resbalones de cubierta y los portaobjetos de sus recipientes de almacenamiento. Seque el vidrio con nitrógeno presurizado o argón.
- Utilizando una micropipetas, lanzar 6 μL de solución de nanopartículas del paso 1.2.5 en el resguardo de la tapa. Para extender la gota uniformemente, coloque cuidadosamente una segunda pieza más grande de vidrio del microscopio en la parte superior del resguardo de la cubierta, como un segundo resguardo de la cubierta o un portaobjetos de microscopio. Evite que las burbujas de aire se atrapen entre las dos piezas de vidrio.
- Gire el sustrato de la muestra y selle los bordes del resguardo de la cubierta con una estrecha línea de esmalte de uñas para evitar la evaporación de la solución mediana.
- Alternativamente, para la imagen de la muestra "seca", deje que la solución reposar durante 5 – 15 minutos en el resguardo de la tapa, antes de retirar la pieza de vidrio no deseada. Soplar suavemente el deslizamiento de la tapa seco con nitrógeno presurizado o argón.
- Si es posible, muestras de imagen inmediatamente después de la preparación. Si no es posible, almacene las muestras en un recipiente cubierto, como una placa de Petri, hasta que se hagan imágenes.
2. la imagen DIC
- Alinear objetivo y condensador.
- Después de colocar la muestra en el microscopio, encuentre el plano focal con la muestra en él. Primero Localice y céntrese en la marca de arañazos creada anteriormente. Luego afinar el enfoque hasta que las nanopartículas se ven en la vista.
- Para determinar la colocación precisa del condensador, utilice el método de iluminación Kohler. 5 la iluminación Kohler a alta magnificación (80x, 100x) se logra más fácilmente estableciendo primero la iluminación Kohler a una ampliación más baja, como 20x.
Nota: normalmente, no es necesario volver a ajustar la iluminación de Kohler durante la toma de imágenes de una sola muestra. Sin embargo, es una buena práctica verificar que Kohler Illumination esté correctamente configurado al cambiar a una nueva diapositiva de microscopio.
- Optimice la configuración de contraste.
- Seleccione una región de interés dentro de la muestra para la creación de imágenes. Centre la región en el campo de visión de la cámara y ajuste el enfoque según sea necesario.
- Si el microscopio tiene el diseño de Senarmont, comience con el polarizador establecido cerca de la máxima extinción de fondo y gire gradualmente el polarizador hacia la extinción de fondo decreciente. La intensidad del fondo aumentará gradualmente.
- Si el microscopio no tiene un diseño de Senarmont, comience con el tren óptico fijado a la máxima extinción de fondo. En este caso, ajustar gradualmente la posición del prisma objetivo hacia la extinción de fondo decreciente.
Nota: el ajuste ideal se logra cuando las nanopartículas alcanzan su mayor diferencia de intensidad (es decir, contraste) del valor de fondo local promediado. Para las nanopartículas plasmónicas, el contraste óptimo se logra normalmente con un fondo relativamente oscuro, por lo tanto en entornos cercanos a la extinción de fondo máxima.
- Seleccione una región de interés dentro de la muestra para la creación de imágenes. Centre la región en el campo de visión de la cámara y ajuste el enfoque según sea necesario.
- Imagen de la muestra.
- Apague la iluminación de la habitación para evitar que la iluminación perdida interactúe con el proceso.
- Mientras visualiza las nanopartículas con una cámara de imagen científica, determine el nivel de fondo óptimo. Utilizando un filtro de paso de banda de 10 Nm de ancho completo a medio máximo (FWHM) con su longitud de onda central colocalizada con la longitud de onda principal LSPR, ver la región de interés. Ajuste la intensidad de la lámpara o el tiempo de exposición hasta que el nivel de fondo esté en el rango de 15% – 40% del nivel de capacidad máximo de la cámara y ningún objeto dentro de la región de interés muestra intensidades de señal que excedan el 90% del nivel de intensidad máxima de la cámara.
Nota: el objetivo del paso 2.3.2 es evitar saturar el sensor al cambiar entre filtros. El nivel de fondo ideal variará entre las muestras y las cámaras. Una vez finalizado este paso, se puede ajustar el tiempo de exposición, pero no la intensidad de la lámpara. - Imagen de la muestra con una serie de filtros de paso de banda que cada uno tiene un FWHM de 10 nm y que como un todo permiten la toma de imágenes a través de todo el rango de longitud de onda de interés. Asegúrese de que la intensidad del fondo permanezca consistente de la imagen a la imagen (dentro del ~ 5% entre sí) ajustando el tiempo de exposición. Después de cambiar los filtros, vuelva a enfocar la muestra antes de capturar la imagen.
- Guarde las imágenes como archivos TIFF sin comprimir y/o en el formato de archivo nativo del software, con el fin de preservar toda la información.
- Gire la muestra.
- Después de recoger las imágenes de la muestra en su posición original, la muestra ahora se puede rotar e imágenes en orientaciones adicionales en la trayectoria de la luz. Realice la rotación a intervalos regulares (p. ej., 10 ° o 15 °) a través de un rango de 180 ° o 360 °.
Nota: la rotación requiere una etapa de muestra giratoria. - Como en las secciones 2.1-2.3, ajuste la configuración de la cámara para proporcionar un nivel de fondo consistente de imagen a imagen.
Nota: no se debe realizar ningún ajuste a la iluminación Kohler.
- Después de recoger las imágenes de la muestra en su posición original, la muestra ahora se puede rotar e imágenes en orientaciones adicionales en la trayectoria de la luz. Realice la rotación a intervalos regulares (p. ej., 10 ° o 15 °) a través de un rango de 180 ° o 360 °.
3. Análisis de datos utilizando ImageJ
Nota: los siguientes cálculos se pueden realizar en una variedad de paquetes de software, y a veces en el programa nativo utilizado para recoger las imágenes. ImageJ es un software de libre disposición de los institutos nacionales de la salud (NIH).
- Calcule el contraste o la intensidad de las partículas.
- Abra la imagen con ImageJ.
- Seleccione la herramienta rectángulo y dibuje un rectángulo alrededor de la región principal de interés.
- En la barra de herramientas, seleccione imageny, a continuación, zoomy, a continuación, selección. La ventana de imágenes se acercará al área seleccionada.
- En la barra de herramientas, seleccione imagen, luego ajustey, a continuación, brillo/contraste. Aparecerá una nueva ventana. Para permitir una mejor visualización de la región de muestra, ajuste los cuatro parámetros: mínimo, máximo, brillo y contraste. Estos ajustes no alteran los datos científicos, sino que simplemente permiten una mejor visibilidad de la región de muestreo.
Nota: los pasos 3.1.3 y 3.1.4 se pueden realizar varias veces y en orden inverso. - Usando la herramienta rectángulo de nuevo, dibuja un cuadro alrededor de la primera nanopartícula a medir. La caja debe ser ligeramente más grande que el disco aireado de la nanopartícula.
- En la barra de herramientas, seleccione analizary, a continuación, medir. Aparece una nueva ventana que notifica las intensidades mínima, máxima y media de los píxeles ubicados dentro del cuadro seleccionado.
- Arrastre el cuadro utilizado para medir la nanopartícula a un área inmediatamente adyacente a la partícula, donde el contraste de fondo es relativamente incluso y no hay partículas o contaminantes están presentes. Conserve el tamaño original de la caja.
- Utilice la herramienta medir para determinar la intensidad media del área de fondo.
- Mida las partículas restantes y un área de fondo adyacente para cada una.
- Repite el proceso para cada partícula en todas las imágenes de la serie.
- Exporte los datos a una hoja de cálculo para calcular el contraste o la intensidad de cada partícula, en todas las longitudes de onda y ángulos.
- Calcule el contraste de cada partícula, utilizando la siguiente ecuación13,14,15:

Nota: usando esta ecuación, el contraste de partículas siempre debe ser > 0. - Calcule el valor máximo ajustado del fondo de la partícula dividiendo la intensidad de partícula máxima medida por la media de fondo:
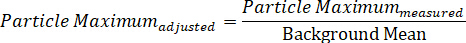
- Del mismo modo, calcule el valor mínimo ajustado en segundo plano dividiendo la intensidad mínima de partícula medida por el medio de fondo:

Nota: como se calculó, el máximo debe tener un valor mayor que uno, mientras que el mínimo será menor que uno. Es aceptable restar cada valor por "1", de modo que el fondo medio es esencialmente cero, el máximo se representa como un valor positivo, y el valor mínimo se asigna un valor negativo16. Este último enfoque permite al analista considerar por separado lo que está ocurriendo a lo largo de cada uno de los campos de polarización, lo cual es útil cuando se estudian partículas anisotrópicas. - Para graficar el perfil espectral en una posición de nanopartícula determinada, trace los datos con la longitud de onda a lo largo del eje x y el contraste o la intensidad a lo largo del eje y.
- Para graficar el perfil rotacional en una longitud de onda determinada, trace el ángulo de rotación a lo largo del eje x y el contraste o la intensidad a lo largo del eje y.
Resultados
Cuando se trabaja con muestras que son lo suficientemente grandes como para ser vistos a simple vista, no se requiere normalmente colocar puntos de referencia en el sustrato de vidrio. Sin embargo, cuando se trabaja con nanomateriales o cuando se requiere la rotación de la muestra, los puntos de referencia pueden proporcionar un método fácil para ubicar, distinguir y rastrear la orientación de la muestra. Aunque se pueden utilizar técnicas más sofisticadas para dejar puntos de referencia sobre sustratos de vidrio17, rayar el vidrio con una pluma de trazado es un método económico y sencillo que funciona en muchas situaciones. Es importante evitar examinar regiones de muestra que se encuentran inmediatamente adyacentes a estos puntos de referencia, ya que las marcas de arañazos crean un fondo complejo con el potencial de afectar a los datos (figura 3). Sin embargo, en las puntas de las marcas de arañazos, "telas de araña" a menudo se extienden hacia fuera desde el rasguño. Estas líneas son bastante valiosas como hitos, pero de nuevo, las nanopartículas deben evitarse si se superponen con estos defectos.
Con el fin de lograr una imagen óptima con la microscopía DIC, es de vital importancia determinar el plano focal adecuado. Los objetos que estén ligeramente fuera de foco aparecerán borrosos, tendrán bordes borrosos y tendrán un menor contraste. La figura 4 muestra nanopartículas de oro que están fuera de foco en diferentes grados. Las nanopartículas en la esquina inferior derecha están en foco, mientras que las nanopartículas se vuelven más alejadas de foco a medida que se acercan a la esquina superior izquierda de esta imagen. Debido a que la DIC tiene una profundidad de campo poco profunda, no es raro que algunas nanopartículas estén en foco mientras que otras están fuera de foco cuando se les toma imágenes en un sustrato de vidrio. Como resultado, es fundamental centrarse sistemáticamente en las mismas partículas exactas al realizar ajustes en el microscopio durante un experimento.
La figura 5 proporciona un ejemplo del efecto de ajustar la configuración del polarizador mientras se imaginan nanoesferas de oro. Cinco nanopartículas están en foco, mientras que una está ligeramente fuera de foco. Un filtro de paso de banda 540 nm con 10 Nm FWHM también estaba en la trayectoria óptica. En esta serie de imágenes, el brillo del fondo se ajustó con ImageJ después de la adquisición de la imagen con el fin de hacer las cinco partículas más evidentes en el fondo. Cuando el polarizador se fija a 0 ° en un microscopio de Senarmont diseñado con Nomarski DIC, es ortogonal al analizador (figura 5A). A 0 °, las partículas aparecen mayormente blancas, con una franja oscura que corre a través de su sección media. Esto es indicativo de polarización cruzada para muestras de nanoesferas. Cuando el polarizador se gira a diferentes ángulos (figura 5b-E), las partículas parecen estar lanzando sombras oscuras hacia el suroeste. Los componentes en blanco y negro de la señal surgen como resultado de los dos campos de polarización de DIC y proporcionan información sobre la orientación de las nanopartículas plasmónicas cuando se trabaja con filtros de paso de banda. A medida que el polarizador se gira hacia ángulos más altos, el patrón de sombra sigue siendo similar. Sin embargo, los valores de contraste de partículas cambian drásticamente. Esto se demuestra mejor midiendo los valores de contraste para las partículas individuales, utilizando la ecuación proporcionada anteriormente. La partícula resaltada con la caja negra tiene valores de contraste de 0,65 (polarizadores cruzados), 0,84 (desplazamiento polarizador de 5 °), 1,10 (10 °), 0,44 (20 °) y 0,23 (45 °). Por lo tanto, para esta muestra, el ajuste de imagen óptimo es con un desplazamiento polarizador de 10 °. Las nanopartículas plasmónicas a menudo requieren un ajuste polarizador en el rango de 5 ° – 15 °, y los incrementos más pequeños que estos normalmente deben utilizarse para identificar el ajuste ideal. Para obtener más información sobre las imágenes y el análisis de nanopartículas de oro esféricas, los lectores se refieren al trabajo previo de Sun et al.11.
Las nanopartículas de forma anisotrópica producen patrones de mayor complejidad que las nanoesferas. Se fotografiaron nanorods de oro (figura 6) en su longitud de onda longitudinal LSPR, 650 nm. En la imagen inicial (figura 6A), cinco nanorods brillantes y varias partículas de dimmer son evidentes. En lugar de tener un aspecto fundido a la sombra, tres de las varillas tienen predominantemente discos de color negro, mientras que dos son en su mayoría de color blanco. El polarizador se estableció en 10 ° a la izquierda de la configuración de polarización cruzada. En la Figura 6B, se utilizó la polarización cruzada; solo aparecen tres de las partículas, como discos completamente aireados y blancos. Los otros han desaparecido o parecen estar un poco fuera de foco. Con el polarizador fijado a 10 ° a la derecha de la polarización cruzada (Figura 6C), los patrones ahora se invierten de lo que se observó en la figura 6A. El polarizador fue girado a 45 ° derecho de polarización cruzada (figura 6D), el ajuste máximo, para demostrar que las partículas conservan sus colores en este ajuste, pero el contraste ha disminuido significativamente. En los paneles de figuras restantes, la colección de nanorods giró incrementalmente un total de 90 ° en el sentido de las agujas del reloj mientras que el polarizador se estableció en 10 ° a la derecha de la polarización cruzada. El patrón cambia gradualmente para cada nanorod, y después de una rotación completa de 90 °, las partículas han invertido sus colores desde el ajuste inicial. En Resumen, si uno de los ejes de un nanorod plasmónico está alineado con uno de los dos campos de polarización, y si el nanorod se imagina en la longitud de onda LSPR de ese eje, el nanorod parecerá ser mayormente blanco o mayormente negro, dependiendo de qué campo de polarización es aligne d con (figura 6A, C)2. Si la nanopartícula se gira una completa 90 ° (figura 6H), ahora se alineara con el campo de polarización opuesta y tomar en el color opuesto. Si en lugar de eso la nanopartícula fue girada sólo 45 ° (figura 6F), entonces estará en una posición donde la partícula exhibirá su mayor apariencia de reparto de sombras, mostrando una llamativa similitud con lo que se observa con las nanoesferas plasmónicas. Como resultado de este comportamiento óptico, las nanopartículas plasmónicas con una forma anisotrópica a menudo se ven planas en lugar de tener la apariencia tridimensional de las nanoesferas de fundición a la sombra. El resultado de esta diferencia en el comportamiento óptico es que se puede explotar con el fin de distinguir entre nanopartículas plasmónicas que son esféricas y anisotrópicas en forma, como se ha discutido previamente en múltiples estudios de investigación2, 3,6,7,11,13,16.
Finalmente, la figura 7 muestra datos representativos de espectroscopía de partículas individuales, como contraste de una nanoesfera de oro (Figura 7A)11, intensidad de un único nanorod de oro con su eje longitudinal orientado paralelo a una de la polarización campos (figura 7b)6, y el perfil de intensidad de un único nanorod dorado en su longitud de onda LSPR y durante la rotación de la etapa (Figura 7c)6. Cualquiera de los métodos de presentación revela el ancho y la ubicación del efecto LSPR. Para las nanopartículas plasmónicas con una forma anisotrópica, los datos de intensidad y rotación revelan la direccionalidad del efecto, y por lo tanto, la orientación de la partícula sobre el sustrato de la muestra, que ha sido probada previamente a través de estudios correlativos en tales partículas utilizando la microscopía electrónica dic y de transmisión2,16,18.

Figura 1: la trayectoria de la luz en la microscopía de la luz transmitida por Nomarski. Después de salir de la fuente de luz (S), la luz pasa a través de un polarizador (P), un prisma Nomarski (NP), el condensador (C), el plano focal (FP), el objetivo (O), un Haz que combina el prisma Nomarski (NP), el analizador (A) y finalmente el detector (D). Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2: ejemplos de nanopartículas plasmónicas imágenes en sus longitudes de onda LSPR con filtros de paso de banda de 10 nm, utilizando un microscopio Dic. Ambas imágenes se recogen a 100x. (A) nanoesferas de plata con un diámetro de 40 Nm A una imagen de 480 nm con un filtro de paso de banda con 10 Nm de FWHM. (B) las nanopartículas de oro en forma de varilla se han imágenes a 700 nm utilizando un filtro de paso de banda con 10 Nm FWHM. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3: imagen de un rasguño hecho en un resguardo de cubierta de cristal con una pluma de trazado. Cerca del final de la indentación real, una serie de líneas estrechas y superficiales de "araña" se ramifican desde el propio rasguño, resultando en un patrón que puede ser utilizado como un hito de imagen. Esta imagen fue recolectada usando una magnificación de 100x y luz blanca de banda ancha. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4: nanoesferas de oro con luz blanca de banda ancha a 100x. Las partículas en la parte inferior derecha están en foco, pero las partículas se alejan del plano focal hacia la esquina superior izquierda. El objeto en medio de la imagen es la suciedad. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 5: nanoesferas de oro imágenes bajo una serie de diferentes ajustes polarizadores a una longitud de onda de 540 nm y una ampliación de 100x. El brillo del fondo se ajustó después de la imagen con ImageJ para hacer las partículas más evidentes. Ajuste polarizador de (a) 0 ° (polarizador ortogonal a analizador), (B) 5 °, (C) 10 ° (el mejor contraste de esta serie de imágenes), (D) 20 °, y (e) 45 °. El contraste medido de la partícula en la caja negra es (A) 0,65, (B) 0,84, (C) 1,10, (D) 0,44, y (E) 0,23. Por favor, haga clic aquí para ver una versión más grande de esta figura.
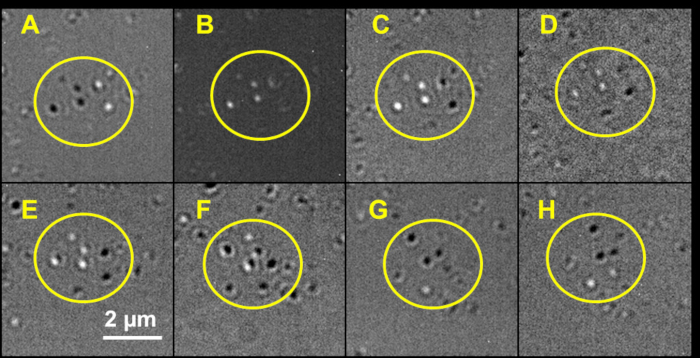
Figura 6: ejemplo de imágenes de nanopartículas plasmónicas anisotrópicas: nanorods de oro en su longitud de onda longitudinal LSPR de 650 nm y una ampliación de 100x. Las partículas de interés principal están encerradas en caja amarilla. Los ajustes del polarizador son: (A) izquierda 10 °, (B) 0 °, (C) derecha 10 °, (D) derecha 45 °. Con el polarizador fijado a la derecha 10 °, el escenario fue girado en sentido horario por (E) 20 °, (F) 45 °, (G) 70 °, y (H) 90 °. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 7: resultados representativos de datos de espectroscopía de partículas individuales. (A) espectroscopía de nanoesferas de oro mostrada en términos de contraste de Dic. Cada punto de datos representa un promedio de 20 nanoesferas para cada diámetro de partícula, y la captura de datos dependía de los filtros de paso de banda de 10Nm FWHM. (B) un único nanorod dorado mostrado como datos de intensidad dic, utilizando dos ajustes polarizadores diferentes (2 ° a cada lado de la polarización cruzada). (C) datos de intensidad dic para un solo nanorod dorado a la longitud de onda lspr de 680 nm, mientras que fue girado 180 ° y el polarizador se mantuvo a 2 ° de la posición de polarización cruzada. La Figura 7A está adaptada con permiso de Sun et al., química analítica. 81 (22), 9203-9208 (2009), y figura 7B, C de STENDER et al., química analítica. 84 (12), 5210-5215 (2012). Copyright sociedad americana de químicos. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Cuando se toma imágenes con microscopía DIC, es fundamental optimizar los componentes ópticos antes de recopilar datos. Incluso ajustes menores en el polarizador en medio de un experimento pueden resultar en impactos significativos en los datos finales6. Además, diferentes materiales requieren diferentes ajustes polarizadores. Aunque aquí se utilizaron grandes tamaños de paso para demostrar el efecto del ángulo de polarización, en un experimento real, es imprescindible optimizar el ajuste del polarizador dentro de 1 ° – 2 ° del ajuste de contraste óptimo. El ajuste polarizador también debe grabarse para referencia futura. También se recomienda trabajar siempre en el mismo lado del punto polarizador cruzado (0 °). El cambio de ida y vuelta no proporciona ninguna ventaja, pero puede conducir a la confusión, debido a una reversión en el patrón de sombra.
A continuación, en importancia, es fundamental monitorear la intensidad del fondo cuando se planea realizar la espectroscopía. Esto se logra mejor ajustando el tiempo de exposición de la cámara o agregando filtros de densidad neutra al camino de luz. Ajuste de aperturas o intensidades de la lámpara puede afectar a la iluminación Kohler y alterar los valores de contraste. El fondo debe ser relativamente incluso a través de la muestra, por lo que la selección de una región de fondo no altera el cálculo del contraste. Se deben evitar muestras de muestras que no estén adyacentes a un espacio de fondo limpio. Por otra parte, la intensidad del fondo no puede ser fijado inicialmente demasiado alto o demasiado bajo. Si la intensidad de fondo es demasiado alta, hay un mayor riesgo de que algunas señales superen el rango máximo de la cámara, lo que hace imposible calcular el contraste en esas regiones. Si la intensidad de fondo se establece demasiado baja, será extremadamente difícil lograr un buen contraste entre el componente oscuro de la señal de DIC y la señal de fondo. Entender el comportamiento típico o esperado de una muestra puede ayudar a seleccionar la intensidad de fondo adecuada.
También es esencial encontrar el plano focal adecuado. Una de las ventajas de Nomarski DIC es que tiene una profundidad de campo poco profunda. Sin embargo, esto hace que sea más difícil centrarse en muestras delgadas, como las nanopartículas. Con muestras más gruesas, el reto es encontrar el plano focal real de mayor interés. Muchos planos focales pueden ser interesantes y tener nanopartículas en ellos, por lo que es importante determinar tempranamente las nanopartículas de mayor interés.
En el caso de las nanopartículas, es importante que el microscopista reconozca que están visualizando un disco aireado o una "función de dispersión de puntos" del objeto2. En general, el disco aireado es útil para determinar si una nanopartícula plasmónica tiene una forma isotrópica o anisotrópica, pero la imagen de nanopartículas es, de hecho, mucho más compleja de lo que se discute aquí. Los agregados de nanopartículas complejos a veces pueden parecerse a las partículas isotrópicas, y como resultado, los métodos de microscopía electrónica son entonces necesarios para caracterizar los patrones de nanopartículas2,16,18, 19. para la imagen de nanopartículas plasmónicas con un microscopio dic, es crucial utilizar imágenes filtradas e imágenes de las partículas en una de sus longitudes de onda plasmónicas de alta absorción6. La toma de imágenes a una longitud de onda inadecuada o sin filtros puede resultar en la captura de patrones de proyección de sombras que son difíciles de descifrar.
Cuando se imaginan nanopartículas junto a objetos que son más grandes que el límite de difracción de la luz, es importante recordar que el objetivo del microscopio "ve" un plano focal relativamente plano. Un concepto erróneo común de DIC es que permite la visualización de un objeto en el relieve 3D real. Esto es causado por el patrón de sombra-fundido, que de hecho hace que muchos objetos parezcan ser tridimensionales. Sin embargo, para recopilar información vertical en varios planos focales, sería necesario elevar o bajar la etapa y recopilar una secuencia de imágenes. Esto puede ser muy difícil de realizar y de interpretar, especialmente para muestras más gruesas, como las células. Por lo tanto, el microscopista necesita una comprensión profunda de todos los materiales implicados en la realización de estos experimentos y debe registrar las posiciones de los planos focales individuales que se utilizaron.
Por último, el paso de análisis de datos es tan importante como la recopilación de datos. Al medir los valores de contraste o intensidad de la muestra, deben tenerse en cuenta varios factores. Normalmente, el analista está interesado principalmente en los valores mínimo y máximo para la partícula de interés. Cuando la relación de contraste a ruido para la muestra es lo suficientemente alta, y si el área de fondo está limpia y iluminada uniformemente, a continuación, una forma geométrica simple se puede dibujar alrededor de la región de muestra sin preocupación de la señal que se introduce por los contaminantes. Además, si el fondo está limpio y iluminado uniformemente, se puede realizar una medición de fondo en cualquier área inmediatamente adyacente a la muestra. Sin embargo, si hay contaminantes o si el fondo es desigual, entonces el analista debe hacer una revisión crítica de los alrededores de la muestra, y el analista necesita evaluar si es incluso posible hacer una medición de fondo razonable. También es fundamental medir la muestra y las áreas de fondo con la misma herramienta de tamaño y forma, con el fin de evitar la introducción de sesgo en el cálculo. En general, las áreas de medición de menor tamaño tienen una menor probabilidad de detectar valores atípicos (por ejemplo, contaminantes, píxeles defectuosos, etc.), pero las áreas de muestreo más grandes a menudo proporcionan una medición más fiable del valor medio del fondo.
Divulgaciones
El autor no tiene nada que revelar.
Agradecimientos
El Dr. Anthony S. STENDER desea reconocer el apoyo técnico a través de la Nanoscale y el Instituto de fenómenos cuánticos (NQPI) en la Universidad de Ohio. Este artículo fue posible gracias a la financiación inicial proporcionada al Dr. STENDER por la Universidad de Ohio.
Materiales
| Name | Company | Catalog Number | Comments |
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
Referencias
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That's Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. . Plasmonics: Fundamentals and Applications. , (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados