Method Article
Modelo de la rata de la Asociación de partición hepática y ligadura de la vena porta para procedimiento efectuado hepatectomía (ALPPS)
En este artículo
Resumen
Inducir la hipertrofia hepática rápida utilizando partición de hígado asociar y ligadura de la vena porta para una hepatectomía Staged (ALPPS) se ha propuesto para la resección de tumores del hígado resecables borderline. Este modelo puede aclarar los mecanismos implicados en la hipertrofia rápida y permite realizar pruebas de drogas que promueven o bloquean la aceleración de la regeneración.
Resumen
Datos clínicos recientes apoyan un enfoque quirúrgico agresivo para tumores primarios y metastásicos del hígado. Para algunas indicaciones, como las metástasis hepáticas colorrectales, la cantidad de tejido hepático queda después de resección hepática se ha convertido en el principal factor limitante de la extirpación de grandes o múltiples tumores en el hígado. Una cantidad mínima de tejido funcional es necesaria para evitar la complicación severa de la post-hepatectomía insuficiencia hepática, que tiene alta morbilidad y mortalidad. Inducir crecimiento hepático del remanente anticipado antes de la resección ha establecido más en Cirugía hepática, ya sea en forma de embolización de vena porta por radiólogos intervencionistas o en la forma de la ligadura de la vena porta varias semanas antes de la resección. Recientemente, fue demostrado que la regeneración hepática es más amplia y rápida, cuando la transección del parénquima se agrega a la ligadura de la vena porta en una primera etapa y luego, después de sólo una semana de esperar, la resección en una segunda etapa (asociar la partición de hígado y la ligadura de la vena porta para hepatectomy Staged = ALPPS). ALPPS ha convertido rápidamente en popular en todo el mundo, pero ha sido criticado por su mortalidad perioperatoria alta. El mecanismo de crecimiento acelerado y extensa inducido por este procedimiento no se ha entendido bien. Se han desarrollado modelos animales para explorar los mecanismos fisiológicos y moleculares de la regeneración hepática acelerada en ALPPS. Este protocolo presenta un modelo de rata que permite exploración mecanicista de regeneración acelerada.
Introducción
El tamaño del remanente hepático limita la resecabilidad de los tumores hepáticos. 1 en general, cuando menos de 25% hígado tejido queda atrás, el paciente está en mayor riesgo de muerte por insuficiencia hepática aguda debido a la falta de función metabólica para todo el organismo ("demasiado pequeño para el síndrome de tamaño"). 2 este post-hepatectomía insuficiencia hepática es la complicación más devastadora después de resección hepática. Por lo tanto, los médicos han tratado de inducir la regeneración hepática antes de la resección del hígado manipulando el flujo de la vena porta. 3 se encontró que, una vez que se ocluye la vena porta, la parte restante con vena porta flujo empieza a crecer a un ritmo lento y así puede aumentar hasta un 60% de tamaño. 4 5 de la ligadura quirúrgica o intervencionista de la vena porta obstrucción tanto clínicamente establecidos. 4 el aumento de volumen y la función del hígado es confiable, pero la tasa de crecimiento del hígado después de la obstrucción portal es sólo aproximadamente una quinta parte en comparación con el crecimiento del hígado remanente después de hepatectomy parcial. 6
El tiempo necesario para que el hígado crecer es semanas o meses aunque el hígado se puede regenerar a un ritmo mucho más rápido después de la resección. Así, el hígado es el único órgano que crece hacia la función normal después del retiro de una parte de ella. 7 un novedoso procedimiento de inducir la regeneración hepática a un ritmo similar como después de hepactectomy parcial fue desarrollada por un grupo de cirujanos que descubrió que agregando una sección transversal entre la oclusión e induce a la parte no-ocluida del hígado hígado hipertrofia en la misma tasa de crecimiento como después de la resección hepática, pero antes de la resección. 9 el procedimiento inicia hipertrofia rápida del 80% dentro de un remanente de la semana en el futuro hígado, que permite la resección de tumores extensos, principalmente no resecables, hígados dentro de una semana. El procedimiento se llama "asociado partición del hígado y vena porta ligadura de hepatectomía Staged = ALPPS" y llegó a ser rápidamente popular en todo el mundo. 10 informes múltiples apoyaron un aumento de la resecabilidad de los tumores hepáticos resecables fronterizo alcanzada por la nueva técnica,11 mientras que el complejo procedimiento quirúrgico también fue criticado por su tasa de complicación alta. 12 , 13
El desarrollo de un roedor y también modelos animales grandes de hipertrofia lenta y rápida se ha intentado desde la publicación de ALPPS en 2012 para permitir una mejor caracterización histológica y la comprensión de los mecanismos y para probar los efectos de drogas en la tasas de crecimiento diferentes de tejido del hígado en animales. El primer modelo animal desarrollado fue un modelo de rata. En este modelo, hipertrofia rápida después de la transección del parénquima entre el derecho y la parte izquierda del lóbulo mediano acelerada regeneración del lóbulo mediano derecho. 14 un modelo diferente fue introducido más adelante en el ratón. En este modelo fue resecado el lóbulo lateral izquierdo y ataron a las ramas de la vena porta a cada lóbulo del hígado excepto el lóbulo medio izquierdo. 15 mientras tanto, los modelos animales grandes de ALPPS en cerdos se han descrito así. 16
Para el estudio de mecanismos fisiológicos como cambios de flujo y presión en la vena porta, la perfusión y oxigenación del tejido del hígado, el modelo de la rata es superior al modelo de ALPPS en ratones. Otra ventaja de la rata en el modelo murino es que en el modelo de la rata no es necesidad de una resección del lóbulo lateral izquierdo,15 que podrían contaminar los efectos de la resección del hígado con los de ALPPS. En cambio el modelo de la rata no reduce el hígado masa celular. Un modelo de cerdo utiliza el lóbulo posterior derecho que el lóbulo creciente, pero el hígado de cerdo es muy lobulado. Por lo tanto, es difícil crear un plano de corte transversal en el puente de tejido ya delgado entre la parte posterior derecha y el lóbulo anterior derecho. En cambio, el lóbulo mediano en ratas constan de dos partes que se suministran por separado por una vena porta cada y un plano de transección del parénquima puede crearse fácilmente entre los dos mediante técnicas microquirúrgicas. La disponibilidad de tomografía (CT) de la computadora pequeña de animal o imán resonancia (MRI) permite la cuantificación muy exacta del crecimiento volumétrico entre solamente la ligadura de la vena porta y la ligadura de la vena porta y la transección del añadido, que es importante para la validación de cualquier modelo de hipertrofia hepática rápida.
El protocolo que presentamos describe la técnica quirúrgica y procedimientos utilizados para la validación volumétrica y caracterización fisiológica del modelo de hipertrofia lenta y rápida después de la ligadura de la vena porta y la ligadura de la vena porta con corte transversal, respectivamente, en ratas.
Protocolo
Todos los experimentos en este protocolo fueron aprobados por las autoridades veterinarias del cantón de Zúrich, Suiza (número 60/2014). Además, todas las medidas experimentales se realizaron en estricto cumplimiento con las directrices sobre experimentos con animales por la Academia Suiza de ciencias médicas (SAMS) y las directrices de la Federación de europeo laboratorio animales ciencia asociaciones (personal) .
1. cría de animales, sala de operaciones e instrumentos, anestesia
- Mantener las ratas masculinas de Wistar con un peso de 250-300 g en jaulas ventiladas en condiciones estándar libres de patógeno en un ciclo de luz/oscuridad de 12/12 h. Dar animales libre acceso a alimentos y agua a una temperatura de 22 ± 1 ° C.
- Inducir la anestesia en una caja, donde isoflurano se enjuaga con 5% de vol de 30 s (figura 1A), seguido de una concentración de isoflurano de 3% vol hasta que el animal está bajo anestesia profunda. Confirmar el nivel de anestesia por el reflejo del pellizco del dedo del pie.
- Proporcionar analgesia por vía subcutánea utilizando aplica buprenorfina (0.01 mg/kg) durante la intervención quirúrgica, seguida de 0.02 mg/kg cada 12 h en la fase postoperatoria de 48 h.
- Traslado del animal al lugar de trabajo, donde están expuesta a una mezcla de gas de 1.0-2.5 vol % isoflurano en oxígeno de la respiración espontáneamente (flujo: 600 mL/min).
- Cerrar los ojos del animal y usar una pomada para proteger los ojos. Inyectar solución salina 5 mL por vía subcutánea, la mitad a cada lado del abdomen, seguido por la atropina 0,1 mg.
- Realizar la cirugía utilizando un microscopio quirúrgico en una sala de microcirugía.
- Que el animal bajo anestesia volátil usando una máscara de ventilación, que consiste en una membrana de látex (figura 1B), a través del cual se empuja el hocico de la rata. Fijar los extremos con cinta adhesiva (figura 1B).
- Diseñar los instrumentos quirúrgicos de manera estéril en mesa: esponjas remojados en solución salina y clorhexidina (figura 2A), abdominales pared retractores (figura 2B) así como las suturas 3-0 para la retracción de la pared abdominal y xifoides, tijeras, Adson fórceps, fino consejos Micro-pinzas recto y curvo y corte lazos de seda 6-0 para el procedimiento de ligadura (figura 2).
- Utilice Micro-pinzas bipolar no se pegue para la transección del parénquima hepático. Cerca de la pared abdominal y la piel con suturas de seda 3-0 con agujas SH-1 y 5-0 Maxon (Figura 2D). Utilizar una pinza bipolar para la hemostasia.
2. Inicio de la cirugía
- Afeitar el abdomen del animal con un pequeño animal cortapelos de la xifoides a los genitales con un lateral de la zona de 2 cm de la línea media. Eliminar completamente el pelo.
- Desinfectar esta zona 3 veces con betadine empapado esponjas.
- Realizar una incisión de línea media con bisturí para la piel y luego usar tijeras quirúrgicas para abrir el abdomen.
- Repliegue de la derecha e izquierda de la pared abdominal y el xifoides con suturas de seda 3-0 (Figura 3A).
- Retraer el estómago, el colon y el intestino delgado desde el ligamento de hepatoduodenal de la rata con separadores de alambre pequeño hecho a sí mismo (figura 3B).
3. vena porta ligadura (PVL)
- Acceder a la vena porta y sus ramas lateral contracción del estómago y el intestino delgado (figura 3B).
- Disecar la vena porta sin rodeos el peritoneo con la Micro-pinzas y lentamente peeling intermedio.
-
Diseccionar las ramas de la vena porta hacia fuera (figura 3) en la siguiente secuencia: rama posterior (1) derecho, (2) rama media izquierda y lateral a la izquierda y rama (3) caudado.
- En primer lugar, retire el peritoneo con movimientos pequeños, no demasiado enérgicos para evitar desgarro las pequeñas ramas arteriales a los lóbulos hepáticos que se ejecutan directamente con la cobertura peritoneal.
- Una vez que la vena porta principal es denudada, rodear las ramas con empujar adelante lento y movimientos que se separa y luego tirar un pedazo de 1 cm de seda 6-0 lazo alrededor de la rama respectiva de la vena porta y lo ligan.
-
Ligar la rama del lóbulo derecho posterior. (Figura 3) La dificultad técnica de la rama derecha posterior consiste en el hecho de que la arteria del lóbulo posterior derecho se ejecuta a través de la rama derecha posterior de la vena porta.
- Tire la arteria cranially junto con el peritoneo para exponer la rama derecha de la vena porta con Micro-pinzas curvado.
- Ligar la rama del lóbulo posterior derecho con el corte de la corbata de seda 6-0. El lóbulo posterior derecho se vuelve visiblemente pálido una vez que la vena porta está ligada.
- No empujar contra la resistencia en el circuito para evitar el desgarro de la arteria o la vena porta. En caso de sangrado, aplique presión durante al menos un minuto con un hisopo de algodón estéril y luego reevaluar. Si el sangrado no se detiene, sacrificar el animal.
-
Ligar el lateral izquierdo (LLL) y lóbulo medio izquierdo (LML) ramas. Estas ramas tienen un tronco común. (Figura 3). La rama izquierda del lóbulo mediano nace de la vena porta dentro de la parenquimia de la LLL.
- Ligar la vena porta lleva a LLL y el amor de mi rama de vida mediante el corte de la corbata de seda 6-0.
- Evitar lesiones en las arterias conduciendo a LLL y amor mi vida, dentro de la capa peritoneal. Como el peritoneo se pela detrás con cuidado, permanecen intactos. La LLL y el amor que mi vida gire visiblemente pálido una vez que las ramas se unen.
-
Ligar la rama del lóbulo caudado (figura 3). La vena porta lleva a algo separados lóbulos caudados en ratas despega de la vena porta principal, distal y medialmente al despegue de la rama del lóbulo derecho de la vena porta principal (como no estrictamente inferiorly en seres humanos o animales más grandes).
- Que disecar y rodear levantando el peritoneo más conductos biliares y las arterias de la vena porta principal.
- Rodear la rama de la vena porta caudada con una curva Micro-pinzas viniendo lateralmente. Los dos lóbulos caudados vuelta visiblemente pálidos, una vez que la rama del lóbulo caudado es ligarse con la seda 6-0.
- Atar las tres ramas de la vena porta lleva a vena portal exclusivo de la perfusión del lóbulo mediano derecho (RML), que es visible por una línea de demarcación clara entre el lóbulo medio derecho e izquierdo.
4. vena porta ligadura con sección transversal (PVL + T)
- Realizar el corte transversal a lo largo de la línea de demarcación entre RML y amor mi vida después de la leucomalacia periventricular (figura 3D).
- Usar un fórceps bipolares de plata no se pegue con una punta muy fina neuroquirúrgica para precauterize el tejido del hígado creando una tira de cauterización de 1 mm a lo largo de la línea de demarcación.
- Utilice tijeras para cortar con cuidado el tejido precauterized. Es muy difícil evaluar correctamente la profundidad de la sección transversal. El objetivo es llegar tan cerca de la vena cava como sea posible, que se extiende intrahepatically en ratas. Lesiones de la vena cava se acompañan de hemorragia extensa, que puede generalmente ser impedido.
- En caso de lesiones se aplica una presión suave con un bastoncillo, pero si el sangrado no se detiene dentro de 3-4 min, sacrificar el animal. Intentos de reparación de la vena cava mediante suturas han sido generalmente fracasados. Las ratas son muy sensibles al aire embolia, que puede ocurrir en alguna ocasión y llevar a paro cardiaco.
5. intraoperatoria medición de la presión venosa Portal y el flujo de volumen
- Evaluar la presión venosa portal mediante canulación directa con una aguja de G30 conectada a un monitor de presión (Figura 4A).
- Uso la punta de prueba de flujo de volumen de 2 mm lateralmente a conectados al dispositivo de flujo para medición directa de caudal portal sobre 2 minutos (Figura 4B). Sólo registrar datos con calidad de medición estable tal como se indica en la pantalla de la máquina.
- Evaluar la presión y el flujo de la vena porta por separado después del grupo de los pasos que definen el procedimiento respectivo, es decir, la vinculación de tres ramas de la vena porta o el atar de las tres ramas de la vena porta y realizar la transección del parénquima entre el RML y el amor mi vida.
6. últimos pasos de la cirugía
- Asegúrese de que el intestino esté colocado correctamente en la cavidad abdominal antes de cerrar.
- Cerrar el peritoneo y la pared abdominal con suturas de seda 3-0 con agujas SH-1.
- Finalmente se sutura la piel con Maxon 5-0.
- Desinfectar la piel otra vez.
- Aplicar nuevamente solución salina 5 mL por vía subcutánea en el lateral de tejido subcutáneo en el abdomen.
7. hígado volumetría en ratas usando el pequeño Animal CT
- 24 h antes de la primera proyección de imagen de CT inyectar 200 μL del agente de contraste en la vena de la cola a través de un catéter intravenoso G26.
- Uso un micro CT para escanear las ratas. Coloque el animal en una caja de plexiglás para inducir anestesia general (lavar primero con 5% de vol por 30 s, seguido de una concentración de isoflurano de 2-3 vol % hasta que el animal esté bajo anestesia y mantener a lo largo de la exploración a través de un sistema de tubería). Para calidad de imagen óptima, sincronizar la exploración del CT con la respiración del animal.
- Exportación de la imagen digital y comunicaciones en los archivos de medicina (DICOM) y analizarlos utilizando el dominio público plataforma OsiriX 8.0 la proyección de imagen. Utilice la herramienta "Polígono cerrado" para dibujar las fronteras del lóbulo basadas en el radiodensitiy del contraste de nanopartículas en el hígado y la región del menú de interés (ROI) para calcular volúmenes de hígado parciales (ver figura 2A en Schadde et al. 17)
- En el modelo estándar, permite el hígado crecen durante 3 días y diariamente obtener TAC para evaluar aumento de volumen.
Resultados
La ligadura de la vena porta de dos diferentes procedimientos quirúrgicos (PVL) y leucomalacia periventricular con resultado de transección (PVL + T) en la cinética de crecimiento muy diferentes. PVL induce aumento de volumen moderado dentro de 3 días, mientras que en el PVL + T un lóbulo mediano derecho mucho más grande (RML) puede ser visto (figura 5). Esto puede ser verificado por volumetría diario. El volumen de la RML duplica aproximadamente dentro de 3 días en el PVL, mientras que triplica en el PVL + T.17
Mediciones del flujo en la vena porta revelan un flujo estable, a pesar del área de flujo reducido en el PLV y el PVL + T (ver Figura 3A en Schadde et al. 17). Esto sugiere que el flujo de volumen de sangre portal entero se dirige a través de aproximadamente 26% del parénquima hepático anterior, causando "portal hyperflow".
Medición de la presión dentro de la vena porta revela un aumento agudo de la presión media de la vena porta de 5 mmHg a 9 mmHg en la leucomalacia periventricular y leucomalacia periventricular + T (ver figura 3B en Schadde et al. 17). este es probablemente un resultado de hyperflow portal. Corte transversal solo no lleva a un aumento de la presión portal aguda, puesto que no se reduce el volumen de tejido del hígado. 17 repetidas mediciones muestran que el aumento de presión permanece estable por 24 h17
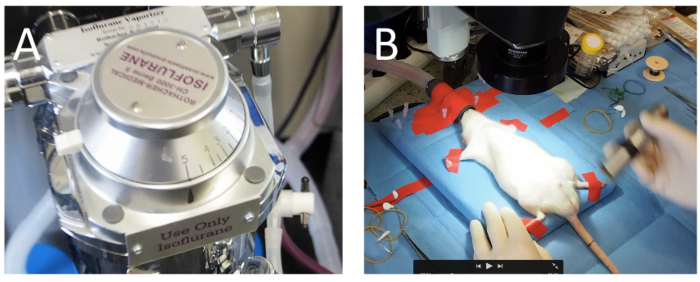
Figura 1 : Anestesia. (A) después del lavado una caja con isoflurano (5 vol %) para inducir la anestesia del animal, el isoflurano es vaporizado (600 mL oxígeno/min) para el mantenimiento de la anestesia general. (B) los animales están fijados sobre una superficie estéril de funcionamiento bajo un microscopio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Equipo estéril. (A) esponjas estéril húmedos para exposición y retracción. (B) alambre de mini-tractores conectados con bandas de goma. (C) fórceps bipolares, tijeras Potts; Micro-pinzas curvos, rectos microdissectors se utilizan para la disección de las ramas de la vena porta. (D) grandes tijeras, porta-agujas y agujas se utilizan para la apertura y cierre. Haga clic aquí para ver una versión más grande de esta figura.
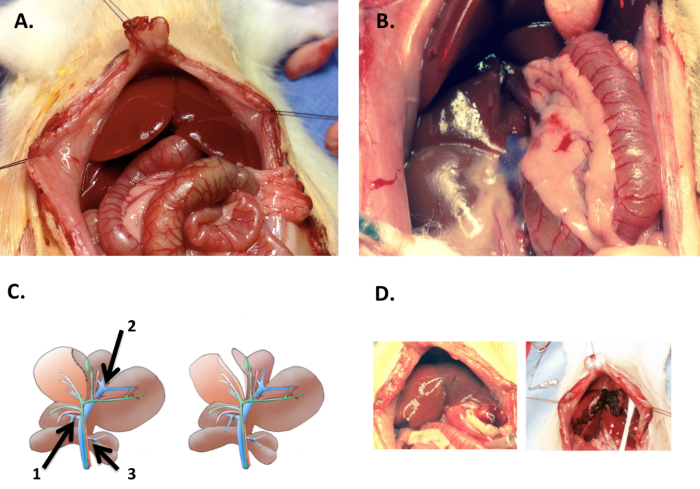
Figura 3 : Disección. (A) los lados del abdomen y el xifoides se repliegan con suturas de seda 3-0 después de laparotomía media. (B) por contracción del estómago, intestino pequeño y grande lateralmente al ligamento gastroduodenal en ratas y el hilio hepático puede estar expuesto. (C) en la ligadura de la vena porta (PVL), la rama de la vena porta a los lóbulos derecho (1), el lóbulo lateral izquierdo (2) y los lóbulos caudados (3) se unen con lazos de seda 6-0 (izquierda). En PVL con transección (PVL + T), además, la línea de demarcación isquémica entre lóbulo mediano derecho (RML) y lóbulo medio izquierdo (LML) es transversalmente (derecha). (D) la fotografía muestra la línea de demarcación clara entre el amor de mi vida y RML (izquierda). Esta línea es seguida por el corte transversal usando un bipolar microfórceps para PVL + T (derecha). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Medición intraoperatoria de la presión venosa Portal y caudal de aire. (A) durante el procedimiento, se inserta un transductor de presión de la aguja en la vena expuesta del portal. Sonda de flujo de volumen (B) los 2 mm se usa para medir los flujos de volumen en la vena porta principal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : Volumetría hepática. El hígado aumenta en tamaño después de PVL + T que después PVL solo. La figura muestra la volumetría diario en imagen digital y comunicaciones en medicina (DICOM) archivos obtenidos con un micro de rata tomógrafo y utilizando el dominio público de la plataforma. Mientras que la diferencia es evidente en las imágenes axiales, volumetría cuantitativa ya que se realiza en un anterior informe17, muestra una diferencia significativa en la cinética de crecimiento. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo presenta un modelo animal de ALPPS con su rápida hipertrofia inducida por PVL + T, que aproximadamente duplica el aumento del volumen dentro de 3 días en comparación con el PVL solo. 17 el media correcta del lóbulo hepático se usa como un lóbulo de modelo para el crecimiento del hígado porque el lóbulo hepático medio es una masa de parénquima contigua suministrada por dos separados las venas porta a su izquierda y a su derecha, como se muestra en la figura 1 en un recientemente trabajo publicado. 17 en comparación con otros informes, el modelo ofrece algunas ventajas. Anatómicamente, la elección del mejor medio lóbulo representa el hígado humano como una masa de parénquima contiguo que permite para corte transversal y de tal modo obliteración del flujo colateral. La ramificación de la vena porta al lóbulo medio izquierdo (LML) en el lóbulo lateral izquierdo (LLL) permite una ligadura combinada de amor mi vida y LLL.
Ha habido varias ratas y un modelo murino de ALPPS desarrollado y descrito. 18 muchos modelos de rata19,20 y el único ratón modelo15 descrito requiere una reducción de la masa hepática. Reducción de la masa puede desencadenar mayor hipertrofia independientemente. Esto está en contraste con nuestros similares modelos de rata y17 . 14 , 21 , 22 , 23 la ventaja de un modelo murino puede ser el uso de animales genéticamente modificados. Como alternativa a estos modelos animales pequeños, cerdo ha ha desarrollado un modelo,16 utilizando una técnica quirúrgica similar como en los seres humanos y lo que resulta en tasas de crecimiento similares. A pesar, que esto probablemente más asemeja el procedimiento quirúrgico humano, modelos animales pequeños todavía pueden ser muy importantes, ya que son más rápidos, son más fáciles de realizar, permite a mayor número de animales por grupo y son menos costosos.
Fisiológicamente, el modelo de rata permite el estudio del flujo sanguíneo, colateralización y oxigenación más fácilmente que un modelo de ratón. Este estudio es el primero en utilizar la misma metodología usada clínicamente en humanos para evaluar los cambios de volumen en el hígado, es decir, CT volumetría. A diferencia de algunos otros estudios, que incluyen un grupo control (p. ej. en un modelo porcino de ALPPS24) aún no asume la cinética de crecimiento de ALPPS, validamos la hipertrofia comparando PVL con PVL + T. Mientras que bajo PVL el RML duplica en plazo de 3 días, PVL + T aumenta significativamente la hipertrofia. Esta aceleración de la hipertrofia después de 3 días por el transection agregado refleja exactamente la condición humana, donde se ha informado un aumento del 46% del volumen en un gran meta análisis para PVE y un incremento de 86% en ALPPS después de 10 días en el primer gran informe de registro ALLPS de 202 pacientes. 25 el procedimiento de rata PVL + T y humanos ALPPS doble la cantidad de hipertrofia en sus respectivos marcos de tiempo para los tipos de dos procedimiento.
Pasos críticos en este protocolo incluyen la disección de las ramas de la vena porta en PVL y la transección del lóbulo mediano en PVL + T. Durante la disección de las ramas de la vena porta, es importante interrumpir la delgada capa de peritoneo que cubre el ligamento hepatoduodenal toda y no para empujar los instrumentos contra la resistencia. Una rotura accidental en la vena porta puede interrumpirse por presión mediante hisopos de algodón solas, pero puede ser irreparable y requieren el sacrificio del animal. En general, se debe enfatizar que animales sufren de una pérdida de sangre de más de un 10% estimado de volumen de la sangre del animal, deben ser excluidos del estudio, ya que esto puede alterar los resultados del estudio y causa innecesario sufrimiento de los animales.
Transección del lóbulo mediano puede lograrse mediante cauterización cuidadosa del tejido del hígado utilizando fórceps bipolar plata fina y suficiente solución salina gotea, seguido por corte simple del tejido cauterizar usando unas tijeras. La transección debería ser detenido antes de encontrarse con la vena cava, que funciona dentro del hígado en los roedores, para evitar la sangría masiva y embolia de aire en la vena cava. Entrada de aire en la circulación pulmonar conduce al paro cardíaco repentino en ratas.
Solución de problemas de este protocolo puede incluir todas las modificaciones que conducen a aumentar el estrés fisiológico de los animales, como hipotensión inducida por el oversedation, hipotermia, aumento de la pérdida de sangre y demasiado largo operativos veces. Este protocolo puede ser modificado también para otras especies de roedores como los ratones. Hemos realizado con éxito la técnica descrita en el presente Protocolo en ratones C57BL/6 (datos no mostrados).
Una limitación de este protocolo es el uso exclusivo del presente Protocolo para el estudio de los mecanismos de rápido versus lento hipertrofia; por lo tanto, la segunda etapa del procedimiento "ALPPS", la resección de tejido hepático deportalized todos excepto el hígado hipertrofiado, no se describe en este protocolo. Esta resección sin embargo fácilmente se logra siguiendo la norma técnica de la resección hepática en roedores, utilizando ligadura de sutura y retiro de los lóbulos hepáticos utilizando unas tijeras.
En general, este modelo actual permite experimentos elucidar el mecanismo de hipertrofia hepática rápida y pruebas de medicamentos y las intervenciones. Usando este modelo, fue demostrado recientemente que rápida hipertrofia de la RML también puede ser inducida por la ligadura de la vena porta junto con la hipoxia señalización utilizando inhibidores de la prolil-hidroxilasa, lo que sugiere que la hipoxia señalización mi juego un papel importante en la modulación de la cinética de crecimiento de hígado. Medicamentos como los inhibidores de la prolil-hidroxilasa pueden acelerar la regeneración hepática y deben estar probaron. 17 , 26 aplicaciones de futuro de este modelo pueden ser que se puede analizar el papel de agentes quimioterapéuticos convencionales y novedosos y su efecto sobre la aceleración de la regeneración del hígado puede ser aclarado aún más. El modelo también ofrece la oportunidad de estudiar la función hepática utilizando por ejemplo verde del indocyanine (ICG) o escintigrafía hepatobiliary iminodiacetic de ácido (HIDA) en ratas porque en última instancia, lentos y rápidos cambios volumétricos tendrá que ponerse en el contexto de regeneración hepática funcional ya que la función hepática es más importante que el volumen de hígado. 27 , 28 la evaluación de los pacientes con ICG29 y de30,de la escintigrafía HIDA31 ALPPS hasta ahora sólo ha sido probada en estudios de cohortes retrospectivos, pero todavía pueden ser herramientas muy importantes para responder a la pregunta cambios de volumen o función sean similares o disímiles en la regeneración hepática rápida.
En Resumen, presentamos un modelo bien caracterizado y estandarizado de regeneración hepática rápida y lenta, que permitirá futuros estudios en cirugía regenerativa del hígado.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores no tienen ninguna agradecimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| Isoflurane, 250 mL bottles | Attane, Piramal, Mumbai, India | LDNI 22098 | Standard vet. equipment |
| Tec-3 Isofluorane Vaporizer | Ohmeda, GE-Healthcare, Chicago, IL | not available anymore | Standard vet. equipment |
| Buprenorphine (Temgesic) | Indivior, Baar, Switzerland | 7680419310353 | GTIN-number |
| Vitamine A ointment | Bausch&Lomp, Zug, Switzerland | 7680223980247 | GTIN-number |
| Atropine sulfate 0.5 mg/mL | Sintetica SA, Mendrisio, Switzerland | 7680565330045 | GTIN-number |
| Microsurgery microscope | Olympus, Tokio, Japan | SZX10 | Standard vet. equipment |
| Betadine | Mundipharma, Basel, Switzerland | 7680342821377 | GTIN-number |
| Sponges | Carl Roth GmbH, Karlsruhe, Germany | NK83.1 | Mini-sponges |
| Abdominal Wall retractors | N/A | N/A | Self-made from paper clips and Q-Tips |
| 3-0 silk | Ethicon, Sommerville, NJ | K872H | Standard surgical |
| Scissors | World precision instruments (WPI), Sarasota, FL | 503371 | Standard microsurgical |
| Adson forceps | World precision instruments (WPI), Sarasota, FL | 501244-G | Standard microsurgical |
| Fine tips microforceps | World precision instruments (WPI), Sarasota, FL | 501976 | Tips need to be polished regularly |
| Curved fine tips microforceps | World precision instruments (WPI), Sarasota, FL | 504513 | Essential to go around the portal vein branches |
| 6-0 LOOK black braided silk | Surgical Specalities Corporation, Wyomissing, PA | SP114 | Spool, precut prior to the procedure |
| 2-0 silk sutures | Ethicon, Sommerville, NJ | K833 | Standard surgical |
| 5-0 maxon sutures | Covidien, Dublin, Ireland | 6608-21 | Standard surgical |
| Bipolar microforceps | Sutter, Freiburg, Germany | 780148SGS | Essential for parenchymal transection |
| Q-tips small | Carl Roth GmbH, Karlsruhe, Germany | EH11.1 | Standard surgical |
| Q-tips big | Carl Roth GmbH, Karlsruhe, Germany | XL54.1 | Standard surgical |
| G30 needle | Terumo, Tokyo, Japan | NN-3013R | Standard anesthesia equipment |
| 2 mm volume flow probe | Transonic Systems, Ithaca, NY | MA-2PS | Smallest available probe for HAT-311 flow meter |
| Transonic flow meter | Transonic Systems, Ithaca, NY | HAT-311 Transsonic flow QC meter | One of the first generation flow flow meters for surgery |
| ExiTron nano 12,000 | Miltenyi Biotech, Bergisch Gladbach, Germany | 130-095-698 | Nanomoloecular contrast medium that opacifies liver and spleen |
| G26 intravenous catheter | Becton Dickinson, Franklin Lakes, NJ | 391349 | Standard anesthesia equipment |
| Quantum FX MicroCT | Perkin Elmer, Waltham, MA | N/A | Standard small animal CT scanner at the institute of physiology, University of Zürich |
| OsiriX 8.0 | Pixmeo Sarl, Geneva, Switzerland | N/A | Public domain software : www.pixmeo.com |
Referencias
- She, W. H., Chok, K. Strategies to increase the resectability of hepatocellular carcinoma. World J Hepatol. 7 (18), 2147-2154 (2015).
- Vauthey, J. N., et al. Standardized measurement of the future liver remnant prior to extended liver resection: methodology and clinical associations. Surgery. 127 (5), 512-519 (2000).
- Kinoshita, H., et al. Preoperative portal vein embolization for hepatocellular carcinoma. World J Surg. 10 (5), 803-808 (1986).
- van Lienden, K. P., et al. Portal Vein Embolization Before Liver Resection: A Systematic Review. Cardiovasc Intervent Radiol. , (2012).
- Kianmanesh, R., et al. Right portal vein ligation: a new planned two-step all-surgical approach for complete resection of primary gastrointestinal tumors with multiple bilateral liver metastases. J Am Coll Surg. 197 (1), 164-170 (2003).
- Nadalin, S., et al. Volumetric and functional recovery of the liver after right hepatectomy for living donation. Liver Transpl. 10 (8), 1024-1029 (2004).
- Michalopoulos, G. K., DeFrances, M. C. Liver regeneration. Science. 276 (5309), 60-66 (1997).
- Fulop, A., et al. Alterations in hepatic lobar function in regenerating rat liver. J Surg Res. 197 (2), 307-317 (2015).
- Schnitzbauer, A. A., et al. Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings. Ann Surg. 255 (3), 405-414 (2012).
- de Santibanes, E., Clavien, P. A. Playing Play-Doh to prevent postoperative liver failure: the "ALPPS" approach. Ann Surg. 255 (3), 415-417 (2012).
- Schadde, E., et al. Monosegment ALPPS hepatectomy: extending resectability by rapid hypertrophy. Surgery. 157 (4), 676-689 (2015).
- Dokmak, S., Belghiti, J. Which limits to the "ALPPS" approach? Ann Surg. 256 (3), e6(2012).
- Aloia, T. A., Vauthey, J. N. Associating liver partition and portal vein ligation for staged hepatectomy (ALPPS): what is gained and what is lost? Ann Surg. 256 (3), e9(2012).
- Yao, L., et al. Establishment of a rat model of portal vein ligation combined with in situ splitting. PLoS One. 9 (8), e105511(2014).
- Schlegel, A., et al. ALPPS: from human to mice highlighting accelerated and novel mechanisms of liver regeneration. Ann Surg. 260 (5), 839-846 (2014).
- Croome, K. P., et al. Characterization of a porcine model for associating liver partition and portal vein ligation for a staged hepatectomy. HPB (Oxford). 17 (12), 1130-1136 (2015).
- Schadde, E., et al. Hypoxia of the growing liver accelerates regeneration. Surgery. 161 (3), 666-679 (2017).
- Moris, D., et al. Mechanistic insights of rapid liver regeneration after associating liver partition and portal vein ligation for stage hepatectomy. World J Gastroenterol. 22 (33), 7613-7624 (2016).
- Garcia-Perez, R., et al. Associated Liver Partition and Portal Vein Ligation (ALPPS) vs Selective Portal Vein Ligation (PVL) for Staged Hepatectomy in a Rat Model. Similar Regenerative Response? PLoS One. 10 (12), e0144096(2015).
- Shi, H., et al. A preliminary study of ALPPS procedure in a rat model. Sci Rep. 5, 17567(2015).
- Almau Trenard, H. M., et al. Development of an experimental model of portal vein ligation associated with parenchymal transection (ALPPS) in rats. Cir Esp. 92 (10), 676-681 (2014).
- Dhar, D. K., Mohammad, G. H., Vyas, S., Broering, D. C., Malago, M. A novel rat model of liver regeneration: possible role of cytokine induced neutrophil chemoattractant-1 in augmented liver regeneration. Ann Surg Innov Res. 9, 11(2015).
- Wei, W., et al. Establishment of a rat model: Associating liver partition with portal vein ligation for staged hepatectomy. Surgery. 159 (5), 1299-1307 (2016).
- Tschuor, C., et al. Salvage parenchymal liver transection for patients with insufficient volume increase after portal vein occlusion - an extension of the ALPPS approach. Eur J Surg Oncol. 39 (11), 1230-1235 (2013).
- Schadde, E., et al. Early survival and safety of ALPPS: first report of the International ALPPS Registry. Ann Surg. 260 (5), 829-836 (2014).
- Harnoss, J. M., et al. Prolyl Hydroxylase Inhibition Enhances Liver Regeneration Without Induction of Tumor Growth. Ann Surg. , (2016).
- Olthof, P. B., et al. Comparable liver function and volume increase after portal vein embolization in rabbits and humans. Surgery. 161 (3), 658-665 (2017).
- Olthof, P. B., van Gulik, T. M., Bennink, R. J. Optimal use of hepatobiliary scintigraphy before liver resection. HPB (Oxford). 18 (10), 870(2016).
- Lau, L., Christophi, C., Muralidharan, V. Intraoperative functional liver remnant assessment with indocyanine green clearance: another toehold for climbing the "ALPPS". Ann Surg. 261 (2), e43-e45 (2015).
- Cieslak, K. P., et al. Assessment of Liver Function Using (99m)Tc-Mebrofenin Hepatobiliary Scintigraphy in ALPPS (Associating Liver Partition and Portal Vein Ligation for Staged Hepatectomy). Case Rep Gastroenterol. 9 (3), 353-360 (2015).
- Truant, S., et al. Drop of Total Liver Function in the Interstages of the New Associating Liver Partition and Portal Vein Ligation for Staged Hepatectomy Technique: Analysis of the "Auxiliary Liver" by HIDA Scintigraphy. Ann Surg. 263 (3), e33-e34 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados